Разработка методов выделения рекомбинантного сосудистого эндотелиального фактора роста VEGF 165
ОГЛАВЛЕНИЕ
СПИСОК
СОКРАЩЕНИЙ
ВВЕДЕНИЕ
.
ЛИТЕРАТУРНЫЙ ОБЗОР
.1 Общие
сведения о васкулярных эндотелиальных факторах роста
.1.1 История
открытия
.1.2
Семейство васкулярных эндотелиальных факторов роста
.2 Сосудистый
эндотелиальный фактор роста - А
.3 Васкулярный
эндотелиальный фактор роста 165 (VEGF165)
.4
Биологическая роль VEGF 165
. ПРИМЕНЕНИЕ
ВАСКУЛЯРНОГО ЭНДОТЕЛИАЛЬНОГО ФАКТОРА РОСТА VEGF 165 В МЕДИЦИНЕ
.1
Терапевтический ангиогенез
.2 Анти VEGF терапия
. МЕТОДЫ
ПОЛУЧЕНИЯ РЕКОМБИНАТНОГО VEGF
165 ЧЕЛОВЕЧЕСКОГО
.1 Получение rhVEGF165 в эукариотической системе
экспрессии
.2 Получение rhVEGF165 в прокариотической системе
экспрессии
. МАТЕРИАЛЫ
. МЕТОДЫ
6. ЭЛЕКТРОФОРЕЗ БЕЛКОВ В ПААГ
РЕЗУЛЬТАТЫ И
ОБСУЖДЕНИЕ
ЗАКЛЮЧЕНИЕ
ВЫВОДЫ
СПИСОК
ЛИТЕРАТУРЫ
СПИСОК СОКРАЩЕНИЙ
VEGF -
сосудистый эндотелиальный фактор роста (Vascular endothelial growth factor)
VEGFR-1
- мембранный рецептор 1 сосудистого эндотелиального фактора роста (Vascular endothelial growth factor receptor)
VEGFR-2
- мембранный рецептор 2 сосудистого эндотелиального фактора роста (Vascular endothelial growth factor receptor)
CBD -
хитинсвязывающий домен
FGF-1,
-2 - фактор роста фибробластов (fibroblast growth factor)
FGFR -
рецептор фактора роста фибробластов
PDGF -
тромбоцитарный фактор роста (platelet derived
growth factor)
PDGFR
- рецептор тробмоцитарного фактора роста
HIF-1
- фактор, индуцируемый при гипоксии (hypoxic inducible factor)
Ang-1,-2
- ангиопоэтины
PAS -
семейство доменов (PER-ARNT-SIM)
Per -
белок кодируемый геном Drosophila melanogaster, отвечающий
за биоритмы организма (period circadian protein)
Arnt - аryl hidrocarbon receptor
nuclear translocator protein- single minded protein- семейство факторов транскрипции («спираль-петля-спираль») (basic
Helix-Loop-Helix)- опухолевый супрессор (von Hippel Lindau)- мембранный киназный рецептор (Tunica interna endothelial kinase-2)- митоген-активированная киназа (mitogen-activated
protein kinase)K- фосфатидилинозитол 3-киназа (phosphatidylinositol 3-kinase)-
белок сателлит фактора
роста (Growth factor
receptor-bound protein 2)- субстрат рецептора фактора
роста фибробластов (Fibroblast growth factor receptor substrate 2)
Ras - сигнальный белок, принадлежащий
семейству малых гуанозинтрифосфатаз
Raf -
сигнальный белок, серин/треонин-специфичная протеин-киназа- внутриклеточная
сигнальная киназа (extracellular-regulated kinase)
MEK -
митоген-активированная киназа киназа (Mitogen-activated protein kinase)-
семейство протоонкогенных тирозин киназKit - поверхностный цитокиновый
рецептор- межклеточный матрикс (extracellular matrix)
ATP -
аденозин-5`-трифосфат
БСА - бычий сывороточный альбумин
ДНК - дезоксирибонуклеиновая кислота
ИПТГ - изопропилтио-b-D-галактозид
ПААГ - полиакриламидный гель
ПЦР - полимеразная цепная реакция
Трис - трис(гидроксиметил)метиламин
ЭДТА - этилендиаминтетрауксусная кислота
DTT -
1,4-дитиотреитол
dNTP -
дезоксирибонуклеозид-5`-трифосфаты
SDS -
додецилсульфат натрия
TEMED
- N,N,N,N-тетраметилэтилендиамин
Amp -
ампициллин
ВВЕДЕНИЕ
Неоангиогенез - сложный многоступенчатый процесс, на каждом этапе
которого задействованы различные регуляторные пути. К факторам, способствующим
росту сосудов относятся ростовые факторы: кислый и основной факторы роста
фибробластов (aFGF и bFGF), сосудистый эндотелиальный фактор роста (VEGF), тромбоцитарный фактор роста (PDGF), белки клеточной адгезии, белки
матрикса, матриксные металлопротеиназы (MMP). Ангиогенная эффективность многих из них показана на
моделях ишемии миокарда и скелетных мышц животных, однако в клинических
исследованиях основная доля приходится на VEGF и фактор роста фибробластов
(FGF) (Парфенова и Ткачук, 2000). VEGF165 был первой идентифицированной изоформой семейства васкулярных
эндотелиальных факторов роста. VEGF165 является
основным сосудистым эндотелиальным фактором роста в человеческих тканях,
поэтому нашел свое применение в качестве мощного проангиогенного препарата при
моделировании процесса неоангиогенеза. Получение природного VEGF очень
дорогостоящая процедура, и поэтому представляет большой интерес получение VEGF генно-инженерными методами.
Применение в медицине препаратов, полученных генно-инженерным способом растёт,
так как получение биологически активных белков из природных источников
является, как правило, очень сложным и, как сказано выше, дорогостоящим
процессом. Так рекомбинантный интерферон существенно выигрывает в сравнении с
лейкоцитарным, вследствие низкой себестоимости и отсутствии контаминации
конечного продукта вирусами человека (Cantell, 1998). Поэтому экспрессия чужеродных генов
биотехнологическим способом представляет собой уникальную возможность для
продукции важных фармацевтических препаратов.
Целью дипломной работы являлось получение рекомбинантного васкулярного
эндотелиального фактора роста 165 человека, создание штамма продуцента,
разработка методики выделения и очистки. Для решения поставленной цели были
определенны следующие задачи:
. Получить высокоэффективный штамм-продуцент E.coli,
продуцирующий рекомбинантный сосудистый эндотелиальный фактор роста.
2. Подобрать условия культивирования штамма-продуцента сосудистого
эндотелиального фактора роста.
. Разработать схему выделения и очистки рекомбинатного сосудистого
эндотелиального фактора роста.
1. Литературный обзор
1.1 Общие сведения о Васкулярных эндотелиальных
факторах роста
.1.1 История открытия
В 1983 году Сенгером был открыт в клеточной линии карциномы фактор
сосудистой проницаемости эндотелиальных клеток, особенно, им оказалась богата
асцидная жидкость опухоли (Senger et al., 1983). Поэтому он получил название
сосудистый фактор проницаемости (VPF).
Другими исследователями был охарактеризован фактор ответственный за ангиогенез
получивший название VEGF. Впоследствии
было установлено, что VEGF и
VPF идентичны. VEGF является мультифункциональной молекулой, обладающей
разнообразным спектром биологической активности, зависящей от стадии развития и
физиологической функции органа, в котором он экспрессируется (Leung et al.,
1989).
.1.2 Семейство васкулярных эндотелиальных факторов роста(vascular
endothelial growth factor) - cосудистый
эндотелиальный фактор роста - семейство структурно близких между собой белков: VEGF-A, -B, -C, -D, -E и
плацентарного ростового фактора (placenta growth factor, PlGF) (Otrock et al., 2007). Эти
биологически активные белки влияют на развитие кровеносных сосудов и обладают
общей структурной архитектурой, несмотря на малую степень гомологии первичных
последовательностей. Они имеют общую структуру цистеинового узла (Shalini Iyer
and K.Ravi Acharya, 2011).
Представители семейства VEGF проявляют биологическую активность в виде
димеров: главным образом в виде гомодимеров и иногда в виде гетеродимеров
(Bonnie et al., 2009). Биологическая активность VEGF реализуется за счёт связывания с тремя
высокоаффинными тирозинкиназными рецепторами: рецептор сосудистого
эндотелиального фактора (VEGFR)-1,
2 и 3 (Rosana et al., 2008). Рецепторы VEGFR-1 и VEGFR-2 участвуют в росте кровеносных
сосудов, а VEGFR-3 в процессах гематопоэза и
лимфоангиогенеза. Кроме трех тирозиновых киназ (VEGFR-1,2,3) изоформы VEGF-А, VEGF-В
и PlGF обладают сродством к семафориновым
рецепторам (NRP, semaphoring receptor neuropilin) 1 и 2. VEGF-Е (вирусный VEGF) способен связываться с NRP-1,
хотя у него отсутствует гепарин-связывающий домен. Некоторые изоформы также
связывают гепарансульфат содержащие протеогликаны. Также известно, что разные VEGF и рецепторы VEGF формируют комплексы с интегринами и компонентами
внеклеточного матрикса (Ferrara
, 2010).
.2 Сосудистый эндотелиальный фактор роста - А
VEGF-А
является наиболее мощным и основным регулятором ангиогенеза и васкулогенеза. VEGF-А, высоко специфичный митоген для
сосудистых эндотелиальных клеток, способствующий высвобождению белков из
кровеносных сосудов, ассоциированных с опухолью. Делеции генов, кодирующих VEGF-А, приводят к серьезным дефектам и
неправильному развитию сердечно-сосудистой системы. Гипоксия является главным
активатором экспрессии VEGF-А
и, как полагают, управляет ангиогенезом во время развития органов. С другой
стороны, ограничение/уменьшение доставки VEGF-А к тканям приводит к задерживанию развития органов.
VEGF-А
существует в восьми изоморфных формах: VEGF121, VEGF145, VEGF148, VEGF165, VEGF183, VEGF189, VEGF206, образуемых в результате
альтернативного сплайсинга мРНК, которая состоит из 8-ми экзонов. Эти изоформы
отличаются в способности связывать гепарин- и гепаран-сульфат.
VEGF-А
экспрессируется in vivo в пространственно- временной связи с
физиологическим ангиогенезом, а также и с опухолевым. Экспрессия VEGF-А стимулирует образование
везикуло-вакуолярных органелл, которые служат каналом для переноса белков крови
в опухоли.
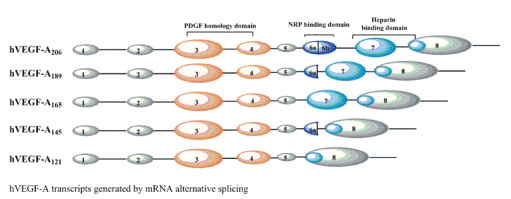
Рис. 1. Изоформы VEGF-А,
образующиеся в результате альтернативного сплайсинга мРНК VEGF-А.
Они формируют внесосудистый фибриновый гель, который стимулирует
эндотелиальные и опухолевые клетки к пролиферации и миграции, а также помогает
стромальным клеткам проникать в растущие опухоли. Взаимодействие лиганда с
рецептором запускает сигнальный каскад, который в конечном итоге стимулирует
рост эндотелиальных клеток сосуда, их выживание и пролиферацию (Bonnie et al., 2009).
При активации рецепторов VEGFR участвуют также «вспомогательные» белки
FRS2, которые так же, как и в случае FGFR рецептора, фосфорилированные по
тирозиновым и серин-треониновым остаткам, связывают адапторные белки Grb2 и
Shp2 (тирозин-фосфатазу) и запускают внутриклеточную сигнальную
последовательность PKC (протеин-киназа С), PI3K, Src и Crk (Matsumoto and Mugishima, 2006).
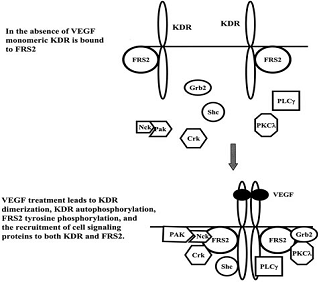
Рис. 2. Связывание VEGF с
рецептором VEGFR, запуск сигнальной
последовательности
.3 Васкулярный эндотелиальный фактор роста (VEGF165)
Изоформа VEGF165 была первым идентифицированным
членом семейства васкулярных эндотелиальных факторов роста. VEGF165 является основным сосудистым
эндотелиальным фактором роста в человеческих тканях. VEGF165 транскрибируется в виде 191 членного
полипептида, но затем сигнальные 25 первых аминокислотных остатка специфически
отщепляются протеиназой. Зрелый белок состоит из 165 аминокислотных остатка
первые 115 участвуют в образовании цистеинового узла и ответственны за связывание
с рецептором. С концевые 25 аминокислотных остатка не участвуют в рецепторном
взаимодействии, а несут сайты аффиности к гепарину (N. Ferrara, 2010).
Биологически активной формой данного белка является гомодимер, каждых
мономер имеет один сайт гликозилирования (Asn 75) с молекулярной массой 19165 Да, pI 7,429, образован семью β-складчатыми листами, и двумя α-спиралями, соединенных тремя
дисульфидными мостиками (Muller et al., 1997).
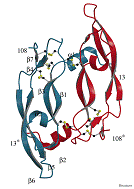
Рис. 3. Модель димера VEGF165 (Muller et al., 1997)
Необычная структура внутримолекулярных цистеиновых мостиков получила
название мотив «Цистеиновый узел» представленна на рис 4.
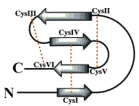
Рис. 4. схема фактора роста содержащего мотив «Цистеиновый узел» (Shalini
Iyer and K. Ravi Acharya 2011)
При расщеплении VEGF165
плазмином образуются два ранее описанных домена: амино-терминальный рецептор
связывающий домен (1-110 аминокислотных остатка) и С-концевой гепарин
связывающий домен (C. Wiesmann et al., 1997; R.G. Keck et al., 1997).
Понимание биологических свойств сосудистого эндотелиального фактора роста
и механизма рецептор опосредованного ангиогенеза открыли широкие возможности
терапевтического применения VEGF,
а также создание стратегий борьбы с онкологическими заболеваниями.
.4 Биологическая роль VEGF165
Васкулярный эндотелиальный фактор роста VEGF в особенности VEGF165 стимулирует ангигиогенез и
сосудистую проницаемость (Senger et al., 1983; Keck et al., 1989). За счёт лиганд-рецепторного взаимодействия
происходит гомо или гетеро димеризация рецепторов VEGFR1 (также известного как Flk-1)и VEGFR2
(также известного как Flk-1или
KDR), которая приводит к
автофосфорилированию некоторых тирозиновых аминокислотных остатков
цитоплазматического домена. Вдобавок VEGF рецепторы образуют гетеродимеры с семафориновыми рецепторами неофилина (NRP) 1 и 2. NRP рецепторы усиливают, но напрямую не участвуют в VEGF опосредованной сигнализации.
Основным рецептором VEGF является VEGFR2, димеризация которого активирует
целый ряд внутриклеточных каскадов таких как активация MAPK, фосфатидил-инозитол 3 киназы (Pl3-K), протеин киназы С (PKC), AKTи PLC путей ведущие к усилению
пролиферации, миграции, MMP
экспрессии, выживаемости и проницаемости эндотелиальных клеток. VEGFR1 выполняет вспомогательную функцию и
не участвует в запуски сигнальных каскадов из за низкого уровня
автофосфорилирования.
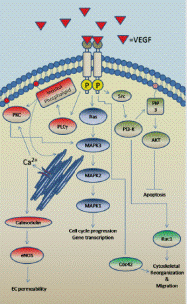
Рис. 5. Инициация VEGF
каскада внутриклеточных сигналов (Bonnie, 2009)
Биологическая важность VEGF была
продемонстрирована на модельных трансгенных мышах. Исследования показали, что
удаление одного из аллелей ген Vegf
или аллеля гена рецептора VEGFR-1
(Flt-1) или VEGFR-2 (KDR/Flk-1) приводит к эмбриональной
летальности в следствии серьёзных нарушений в развитии сосудов (Fongetal.,
1995; Shalabyetal., 1995; Carmelietetal., 1996; Ferraraetal., 1996). Тогда как
сверхэкспрессия VEGF приводит к
эмбриональной смертности от E12.5-14
в результате дезорганизации кровеносных сосудов, порока сердца и дефектов
каронарных сосудов (Miquerol et al., 2000).
Помимо действия на эндотелиальные клетки, VEGF оказывает влияние и на другие типы клеток в
зависимости от наличия VEGFR2
и VEGFR1 рецепторов. В почках гломерулогенез
и функционирование почечного гломерулярного фильтра находятся под строгим
(ген-зависимым) контролем VEGF (Ellen C. Breen, 2007). Последний также
участвует в регенерации мышечных клеток, ремоделировании миокарда и
эндохондральном костеобразовании, он действует как хемоаттрактант, мобилизующий
эндотелиальные клетки костного мозга (Street and Lenehan 2009). На сегодняшний
день, описано влияние VEGF
на моноциты (Barleon et al., 1996; Clauss et al., 1996), макрофаги (Duyndam et al., 2002), тучные клетки (Norrby, 2002), эозинофилы (Feistritzer et al., 2004), дендритные клетки (Dikov et al., 2005), мегакариоциты (Casella et al., 2003), лимфоциты (Farahani et al., 2005), альвиолярные эпителиальные клетки второго типа (Compernolle V et al 2002) и эпителий хрусталика (Shui YB et al., 2003), гомопоэтические стволовые клетки производные
косного мозга циркулирующие в кровотоке (Gerber et al., 2004; Grunewald et al., 2006;
Murayama et al., 2002; Iwaguro et al., 2002). VEGFспособствует: выживанию
гемопоэтических стволовых клеток, нервных клеток и лимфоцитов, дифференцировке мегакариоцитов
и дендритных клеток и участвует в мобилизации клеток предшественников костного
мозга. Результаты тромбоцитопении и нейтропении демонстрируют участие VEGFв регуляции уровня пролиферации
тромбоцитов и лейкоцитов. VEGF
также участвует в лимфоангиогенезе. Помимо его биологического действия на
эндотелиальные клетки и клетки иммунной системы появляются новые сведения о его
роли в росте и выживаемости нейронов. В статье (Schanzer et al., 2004) было показано, что VEGF действует на стволовые клетки нейронов in vitro и in vivo. В синоптических окончаниях и
глиальных клеток экспрессируется рецептор VEGF. Патологически низкий уровень экспрессии VEGF связан с дегенерацией мотонейрона
(Oosthuyse et al., 2001).
2. ПРИМЕНЕНИЕ ВАСКУЛЯРНОГО ЭНДОТЕЛИАЛЬНОГО ФАКТОРА РОСТА VEGF165 В МЕДИЦИНЕ
.1 Терапевтический ангиогенез
В регуляции ангиогенеза участвует большое количество ростовых факторов.
Ангиогенная эффективность многих из них показана на моделях ишемии миокарда и
скелетных мышц животных, однако в клинических исследованиях основная доля
приходится на VEGF и фактор роста фибробластов (FGF) (Парфенова и Ткачук,
2000).
Ангиогенез - сложный процесс, осуществляемый путем строго
скоординированной во времени и пространстве работы многих факторов. В
экспериментальных работах совместное использование VEGF и фактора стабилизации
сосудов ангиопоэтина-1, а также тромбоцитарного фактора роста (PDGF-BB) в
сочетании с FGF-2 индуцирует образование сосудистой сети, которая остается
стабильной даже через 1 год после прекращения действия этих факторов (ShyuK-G et al 2003; Cao R et al 2003). Еще одним подходом к более сбалансированной
стимуляции ангиогенеза может быть создание генетических конструкций на основе
гибрида геномной ДНК и кДНК форм гена VEGF, которые содержат экзоны и интроны в различно сплайсирующейся области,
что обеспечивает экспрессию нескольких изоформ VEGF, как это естественно происходит в тканях (Whitlock PR et al., 2004).
Возможность неоваскуляризации ишемизированных тканей с помощью VEGF и FGF
доказана в многочисленных экспериментальных работах с помощью гистологических,
ангиографических, радионуклидных методов на моделях ишемии миокарда и скелетных
мышц у грызунов (мыши, крысы, кролики), собак, свиней и овец (Парфенова и
Ткачук, 2000; Yla-Herttuala S et al., 2007; Rissanen and Yla-Herttuala, 2007). Эти факторы роста
использовали как в виде рекомбинантных белков, так и конструкций в плазмидном
или аденовирусном векторе.
.2 Анти VEGF терапия
В настоящее время анти-VEGF препараты применяются в качестве адъювантного
лечения при метастазах опухолей. Ингибиторы VEGF - это моноклональные антитела,
которые селективно связываются с VEGF, блокируя его действие. Они подавляют
неоангиогенез в опухолях, лишая их возможности дальнейшего роста (Кузьмин и
др., 2009).
Первым антиоангиогеным препаратом стал бевацизумад (Avastin). Бевацизумаб представляет собой
моноклональные антитела против VEGF; рекомбинантные IgG1-подобные антитела, с
молекулярной массой около 149 кДа, произведенный в системе экспрессии клеток
линии CHO, в питательной среде, содержащей антибиотик гентамицин. Препарат
рассчитан на внутривенное введение и выпускается в дозах 100мг и 400 мг в
одноразовых ампулах, с концентрацией в растворе 25мг/мл (Базин и Гарин, 2008).
Препарат связывается со всеми изоформами VEGF, препятствуя тем самым
взаимодействию лигандов с рецепторами VEGFR; т.е. блокирует инициацию
клеточного сигнала, ведущего к пролиферации эндотелиальных клеток. Бевацизумаб
не связывается с другими ангиогенными факторами, такими как факторы роста фибробластов,
тромбоцитарный фактор роста и др (Salvatore and Fock 2007).
Применение бевацизумада в сочетании с традиционной химиотерапии
продемонстрировало значительное снижение ангиогенеза и метастазирования
колоректального рака, рака молочной железы и лёгочной карциомы [60-63]. Более
того был создан препарат аналогичного с бевацизумадом действия получивший
название ранибизумад, который значительно снижает прогрессирование влажной
маскулярной дистрофии и повышает общую остроту зрения. Ранибизумад, является
фрагментом антитела, которое нейтрализует фактор роста эндотелия сосудов
(VEGF). Успехи в борьбе с онкологическими заболеваниями антиангиогенными
средствами способствовали созданию препаратов второго поколения. Такими
препаратами на сегодняшний деньявляютсяСорафениб, Сунитиниб и Вандетаниб,
которые ингибируют рецепторы VEGFи
другие тирозин киназные рецепторы. Сорафениб (Нексавар, Sorafenib/ Bayer) - одобрен управлением по санитарному надзору за
качеством пищевых продуктов и медикаментов (FDA, США) в декабре 2005 года для
клинического применения при метастатическом раке почки и первичном раке печени.
Сорафениб - 4-[4-[[4-хлоро-3-(трифторметил) фенил] карбомоиламино]
фенокси] - N-метил-пиридин-2-карбоксамид (Рис.6) - является ингибитором
тирозинкиназных рецепторов PDGFR, VEGFR-1,-2,-3, С-Kit рецептор, а также фермента Raf, на сигнальном пути
Ras-Raf-MEK-ERK (Lissandra et al., 2008).
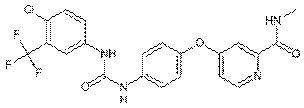
Рис. 6. Структурная формула сорафениба
Сунитиниб (Sunitinib, Sutent/ PfizerInc.) - одобрен управлением по
санитарному надзору за качеством пищевых продуктов и медикаментов (FDA, США) в
январе 2006 года для клинического применения при метастатическом раке почки и
устойчивой к иматинибу форме рака желудочно-кишечного тракта.
Сунитиниб - N-[2-(диэтиламино)этил]-5-[(Z)-(5-фторо-1,2-дигидро-2-окси-3Н-индол-3-илидин)метил]-2,4-диметил-1Н-пиррол-3-карбоксамид
(рис.7).
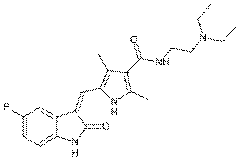
Рис. 7. Структурная формула сунитиниба
Сунитиниб является низмоколекулярным соединением, связывается с высокой
афинностью с тирозинкиназными рецепторами VEGF, PDGF и
C-Kit рецептором, ингибируя их аутофосфорилирование и
дальнейшую передачу внутриклеточного сигнала (Robert J. Motzer et al., 2006). Препарат выпускается в виде Сунитинибмалата для
перорального введения. Проявляет антиопухолевую активность при метастатическом
раке почки и применяется в качестве препарата терапии второй линии (J.G. Christensen 2007),
(Robert J. Motzer et al., 2006). Данные предклинических испытаний показали, что
антиопухолевый эффект может быть вызван не только с ингибированием ангиогенеза,
посредством связывания рецепторов VEGF и PDGF и блокирования сигнала тирозинкиназ,
но и антипролиферативным действием на определенные раковые клетки. При терапии
почечной карциномы препарат показал превосходство над стандартной терапией
интерфероном-α.
Полученные за последнее время данные об участии VEGF в развитии
диабетической ритинопатии позволили предложить анти-VEGF в качестве
консервативного лечения диабетической ритинопатии. В клинической практике
доступно несколько лекарственных препаратов, блокирующих биологическое действие
VEGF: пегаптаниб (селективный ингибитор VEGF165), ранибизумаб и
бевацизумаб (блокаторы всех изоформ VEGF) (Кузьмин и др., 2009).
Пегаптаниб («Макуген», Eyetech Pharmaceuticals⁄Pfizer) - это
связанный с полиэтиленгликолем нейтрализующий РНК-аптамерІ, обладающий
максимально высоким аффинитетомі к VEGF165.
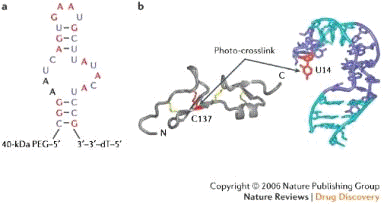
Рис. 8. Структура Пегаптаниба и сайты его связывания
Как было показано в эксперименте на грызунах, интравитреальное применение
пегаптаниба значительно подавляет лейкостаз, патологическую ретинальную
неоваскуляризацию и VEGF-опосредованную клеточную гиперфильтрацию (Ishida et al., 2004). FDA (Food and Drug Administration, США) одобрил применение
пегаптаниба в лечении отечной формы возрастной макулярной дегенерации (ВМД) в
декабре 2004 г.
3. МЕТОДЫ ПОЛУЧЕНИЯ РЕКОМБИНАТНОГО VEGF165 ЧЕЛОВЕКА
.1 Получение rhVEGF165 в эукариотической системе экспрессии
Как упоминалось ранее, нативная форма VEGF165 содержит сайт гликозилирования (Asn75) и является гомодимером за счёт
образования двух межцепочечных дисульфидных мостиков. Поэтому для получения
биологически активной формы рекомбинантного VEGF использовали в качестве продуцентов эукариотические
системы экспрессии. Такие как клеточные линии насекомых и ооциты китайских
хомячков. Lee Seong-Baek с
соавторами была описана методика получения rhVEGF165 в ооцитах китайских хомячков (Lee Seong-Baek et al., 2008). Авторами была достигнута
сверхпродукция целевого белка, составившая более 80 мг/л, и разработана
методика выделения, включающая последовательные стадии хроматографической
очистки. Выход белка после стадий очистки составил 48%.
Особенностью эукариотической экспрессии в отличии от прокариотической
является то, что продуцируемый белок экскретируется в питательную среду, и не
образует телец включения, таким образом, не требуется дальнейшая процедура
экстракции с последующей ренатурацией. Таким образом, количество стадий до
получения чистого белка сводится к минимуму. В приведённом обзоре (Lee Seong-Baek et al., 2008) стадия очистки была
реализована в два этапа. Первым этапом хроматографической очистки была
ионообменная хроматография на сорбенте HiTrap-SP (Amersham Biosciences). Фракции, содержащие rhVEGF165, были дочищены на колонке HiTrapHeparin HP (Amersham
Biosciences). В результате чистота белка
составила 96%.
Отличие рекомбинантного белка полученного из CHO, от клеток насекомых, заключалось в структуре
олигосахаридов и степени гликозилирования, которые наблюдались на SDS-PAGE электрофорезе.
В статье (Geum Young Lee et al., 2006) была представлена методика
получения rhVEGF165 в клетках насекомых. В них также как
и в клетках млекопитающих осуществляются эффективное гликозилирование,
димеризация за счёт образования межмолекулярных дисульфидных связей и секреция
целевого белка в культуральная среду. В качестве клеток продуцентов авторы
использовали клеточные линии Spodoptera frugiperda Sf21. Ген был получен из клеточной
линии карциомы яичников и клонирован в бакуловирусную систему экспрессии.
Экспрессия целевого белка составила 20 мг на литр среды. Полученный белок
очищали от компонентов культивационной среды трёхступенчатой хроматографией.
Первый шаг включал в себя аффинную хроматографию на гепарин сефарозе. Элюат,
содержащий целевой белок был сконцентрирован на центриконом 30 кДа и нанесён на
колонку заполненную катионообменой смолой Resource S (GE Healthcare). Элюцию осуществляли линейным
градиентом раствора NaCl. Далее элюат
был дочищен методом быстрой жидкостной хроматографии (FPLC) на обращено-фазовом сорбенте Resource RPC. На выходе было получено 3 мг с литра культуральной
среды. Таким образом, общий выход стадии очистки составил 15%.
.2 Получение rhVEGF165 в прокариотической системе
экспрессии
Биологическая активность VEGF165 не
зависит от гликозилирования Asn 75
(D. Peretz et al., 1992) поэтому, стало возможным, использование
прокариотической системы экспрессии для получения терапевтически активных форм.
Бактериальная система экспрессии легко масштабируема и даёт возможность
получить VEGF менее дорогостоящим способом в более
короткие сроки (F. Baneyx, 1999; Graumann and Premstaller, 2006; Swartz, 2001). В литературе были
описаны способы получения растворимых форм VEGF165 и VEGF121 виде гибридного белка (Arora, 1999;
Kim, 2007). Литературе имеются многочисленные публикации по получению VEGF165 в составе теле включений
(Scrofani et al., 2000; Morera et al., 2006).
В статье (Shelly A. Pizarro et al., 2010)
авторами описан способ получения рекомбинантного VEGF 165 в бактериальной системе экспрессии выход,
которого составил 9 г с литра биомассы, что на мой взгляд вызывает сомнение.
Представлена стратегия очистки, включающая три шага хроматографирования.
Ферментация биомассы осуществлялась в режиме «фед-бетч», за счёт чего
достигалась так называемая высокая клеточная плотность. Синтезированый белок
образовывал тельца включения, поэтому после дезинтеграции бактериальных клеток
было необходимо осуществить экстракцию белка из телец включения с последующим рефолдингом.
Хроматорафическая стадия включала последовательное использование хроматографии
смешанного режима на сорбенте Capto™ MMC, далее применяли катионообменную смолу
SP Sepharose HP и окончательную доочистку целевого
белка осуществляли на гидрофобном сорбенте PhenylSepharose™ 6 FastFlow. Общий
выход после стадий экстракции, ренатурации и хроматографии составил около
30%.Liang Lee с соавторами описали методику экспрессии и очистки
рекомбинантного VEGF 165 в
бактериальных клетках E. сoli Tuner (DE3) pLacI (Novagen, Madison,
WI) (I-Liang Lee et al., 2010). В качестве экспрессионного
вектора авторами была использована pET-1. Целевой белок экспрессировался в виде телец включения. Поэтому, также
как и в ранее описанной статье, перед авторами стояла задача солюбилизировать
тельца и осуществить ренатурацию экстрагированного белок. Экстракцию белка из
телец включения осуществляли буферным раствором содержащий 4 М мочевину.
Полученный экстракт телец включения содержал денатурированную мономерную форму rhVEGF165. Ренантурацию белка осуществляли
поэтапным разведением экстракта раствором 1 М L-аргенина содержащем небольшое количество окисленного
глутатиона. После чего ренатурационную смесь разделяли на катионообменом
сорбенте Mono S. Выход белка после описанной стадии составил 1 мг на литр
бактериальной культуры.
рекомбинантный васкулярный эндотелиальный рост
4. Материалы
· Реактивы
В работе использованы трис, акриламид, N,N’-метилен(бис)акриламид,
персульфат аммония (Sigma), ТЕМЕД,
уксусная кислота, этанол, SDS,
бромфеноловый синий, 2-меркаптоэтанол, агар (Difco), дрожжевой экстракт (Sigma), ИПТГ (Sigma), бакто-триптон (Difco).
Т4-ДНК-лигаза (Fermentas, #EL0014), Т4-полинуклеотидкиназа (Fermentas, #EK0031), Taq
ДНК-полимераза (Fermentas),
эндонуклеазы рестрикции Nco I, Xho I, Xba I, Bam HI, Bgl II, Hind III, Eco RI.
· Плазмидный вектор
pET32b(+)
(Novagen)
pTWIN1 (New England Biolabs)
· Бактериальные штаммы
E.coli ER2566 ( [F- lamda- fhuA2 [lon]
ompT lacZ:: T7 gene1 gal sulA11 D(mcrC- mrr)114::IS10 R(mcr-73::miniTn10--
TetS)2 R(zgb-210::Tn10) (TetS) endA1 [dcm]). coli Origami (DE3) ∆(ara-leu)7697
∆lacX74 ∆phoA PvuII phoR araD139 ahpC galE galK rpsL F'[lac+lacI
pro] (DE3) gor522::Tn10 trxB (KanR, StrR, TetR)4
В работе использовались настольные центрифуги Z 383K(Hermile) и Centrifuge 5430R (Eppendorf), (Heraeus); амплификатор (PTC-0200 DNA Engine Cycler) (Bio-Rad); сухой термостат DVE (Heraeus); качалку с термостатируемой камерой Certomat (ETH); источники постоянного тока: 2197 Power Supply (LKB), 2002 Power Supply (LKB), 2301
Macrodrive-l (LKB), 2301 Macrodrive-5 (LKB), Electrophoresis Power Supply
EPS500/400 (Pharmacia); ультразвуковой дезинтегратор (Branson) MSE, pH-метр PB-11 (Sartorius); Спектрофотометр SmartSpec Plus (Bio-Rad, США); ламинарный шкаф Gelaire (Flow Lab.); УФ-трансиллюминатор (Desaga); весы аналитические (Mettler PM460); автоматические микропипетки (Gilson, Eppendorf).
· Питательные среды
LB: 1%
бакто-триптон, 0,5% дрожжевой экстракт, 1% NaCl, pH 7.3
YT-бульон:
0,8 % бакто-триптон, 0,5 % дрожжевой экстракт, 0,5 % NaCl.
SOB:
2% бакто-триптон, 0,5% дрожжевой экстракт, 0,01 М NaCl, 0,01 М KCl, 0,01 М MgCl2, 0,01 М MgSO4, pH 7,5
· Буферные растворы
50´ТАЕ (50-кратный буфер для
электрофореза ДНК в агарозе):
Буферные системы для денатурирующего белкового электрофореза:
Буфер для приготовления образцов - 125 мМ трис-HCl, рН 6,8, 3% SDS, 20% глицерин, 3% 2-меркаптоэтанол,
0,05% бромфеноловый синий;
Стоковый раствор 40% акриламид/1,3% N,N'-метилен-бисакриламид
в воде.
LTB
(буфер для разделяющего геля) 375 мМ трис-HCl, рН 8,8, 0,1%SDS;
UTB
(буфер для концентрирующего геля) 125 мМ трис-HCl, рН 6,8, 0,1% SDS.
ЧБуфер для Taq-полимеразы: 67
мМ трис-HCl, 16,6 мМ (NH4)2SO4, 0,01 % TWEEN-20, 1,5 мМ MgCl2.
Ч Буфер для ДНК-лигазы фага Т4: 25 мМ трис-HCl, рН 7,8, 10 мМ MgCl2, 1 мМ ДТТ, 0,4 мМ рАТР.
ЧБуфер для полинуклеотидкиназы фага Т4: 50 мМ трис-HCl, рН 7,5, 10 мМ
MgCl2, 10 мМ ДТТ.
X Buffer Tango™ (Fermentas): 33 мМ трис-ацетат (pH 7,9
при 37°C), 10 мМ ацетат магния, 66 мМ ацетат
калия, 0,1мг/мл БСА.
ЧБуфер для эндонуклеаз рестрикции Green (Fermentas):10мМ ТрисHCl (pH 7,5 при 37°C), 10 мМ MgCl2, 50 мМ NaCl, 0,1 мг/мл БСА.
ЧБуфер для эндонуклеаз рестрикции Orange (Fermentas):10мМ ТрисHCl (pH 7,5 при 37°C), 10 мМ MgCl2, 100 мМ NaCl, 0,1 мг/мл БСА.
5. Методы
Создание штамма продуцента ER2566/pTTS-VEGF165
К 10 мкл раствора, содержащего 0,5 мкг плазмиды pET32b+
добавили 4 мкл 10Чбуфера Tango yellow (Fermentas), 4 мкл дистилированой воды и по 1 мкл
(10 е.а./мкл) эндонуклеаз рестрикции Eco RI и Hind III. Инкубировали реакционную смесь в течении 90 мин при
37о С. Реакционную смесь разделяли на 1% агарозном геле.
Экстрагировали ДНК из агарозного геля набором фирмы QIAGEN согласно протоколу
производителя. К 10 мкл экстракта, содержащего 0,5 мкг линеаризованного
фрагмента pET32b+ добавили 5 мкл раствора, содержащего 0,5 мкг
олигонуклеотидного дуплекса TRX_STOP, 2 мкл 5 мМ раствора АТФ, 2 мкл
10Чбуфера для полинуклеотидкиназы фага Т4 и 1 мкл (5 е.а./мкл) лигазы фага Т4 (Fermentas). Реакционную смесь инкубировали при
4о С в течении 15 часов.
Ген Trx-stop-start
амплифицировали с помощью полимеразной цепной реакции (ПЦР). В 50 мкл
реакционной смеси, содержалось 10 нг матрицы из ранее полученной лигазной смеси,
0,2 мкмоль каждого праймера (PR-1, PR-2), 5 мкл 10´ буфера для Taq-ДНК-полимеразы, SdNTP (каждый в концентрации 0,4 мМ), 2 ед. Taq-ДНК-полимеразы. Инкубацию проводили в
ДНК-амплификаторе по следующей программе:
) денатурация 40 сек. при 93°С, отжиг 40 сек. при 58°С, элонгация 30 сек.
при 72°С (5 циклов);
) денатурация 30 сек. при 93°С, отжиг 30 сек. при 60°С, элонгация 30 сек.
при 72°С (24 цикла).
Продукт ПЦР очищали при помощи набора для очистки ПЦР-продуктов MinElute
PCR Purification Kit (QIAGEN) согласно протоколу фирмы-производителя.
К 10 мкл раствора, содержащего 0,5 мкг плазмиды pTWIN1 (New England
Biolabs) добавили 4 мкл 10Чбуфера Orange, 4 мкл дистиллированной воды и по 1
мкл (10 е.а./мкл) эндонуклеаз рестриции XbaI и BamHI.
Инкубировали реакционную смесь в течении 90 мин при 37о С.
Реакционную смесь разделяли на 1% агарозном геле. Экстрагировали ДНК из
агарозного геля набором фирмы QIAGEN согласно протоколу производителя. К 10 мкл
очищенного экстракта, содержащего линеаризованный фрагмент pTWIN1 добавили 2 мкл 5 мМ раствора АТФ, 2
мкл 10Чбуфера для полинуклеотидкиназы фага Т4, 5 мкл раствора, содержащего 0,5
мкг олигонуклеотида TTS и 1 мкл (5
е.а./мкл) лигазы. Реакционную смесь инкубировали при 4оС в течение
15 часов. Лигазной смесью трансформировали компетентные клетки E. coli ER2566 и рассеивали их на твёрдой питательной среде. Из
выросших колоний выделяли плазмиду набором QIAGEN согласно протоколу
производителя. К 10 мкл раствора, содержащего 0,5 мкг плазмиды pTTS добавили 2 мкл 10Чбуфера Green (Fermentas), 6 мкл дистиллированной воды и по 1
мкл (10 е.а./мкл) эндонуклеаз рестрикции Xba I и Xho I. Инкубировали
реакционную смесь в течении 90 мин при 37оС. Реакционную смесь
разделяли на 1% агарозном геле. Экстрагировали ДНК из агарозного геля набором
фирмы QIAGEN согласно протоколу производителя. К 10 мкл экстракта, содержащего
0.5 мкг линеаризованной плазмиды pTTS
добавили 5 мкл раствора, содержащего 0,3 мкг ранее амплифицированного Trx-stop-start,
2 мкл 5 мМ раствора АТФ, 2 мкл 10Чбуфера для полинуклеотидкиназы фага Т4, 1 мкл
(5 е.а./мкл) лигазы. Реакционную смесь инкубировали при 4оС в
течение 15 часов. В результате была получена плазмида pTTS-Trx. К
10 мл раствора, содержащего 0,5 мкг плазмиды pTTS-Trx
добавили 2 мкл 10Чбуфера Green
(Fermentas), 6 мкл дистиллированной воды и по 1
мкл (10 е.а./мкл) эндонуклеаз рестрикции Sap I и Xho I. Инкубировали
реакционную смесь в течении 90 мин при 37о С. Реакционную смесь
разделяли на 1% агарозном геле. Экстрагировали ДНК из агарозного геля набором
фирмы QIAGEN согласно протоколу производителя. К 10 мкл экстракта, содержащего
0,5 мкг линеаризованной плазмиды pTTS Trx добавили 5 мкл
раствора, содержащего 0,3 мкг гена hVEGF165, 2 мкл 5 мМ раствора АТФ, 2 мкл 10Чбуфера для полинуклеотидкиназы
фага Т4, 1 мкл (5 е.а./мкл) лигазы. Реакционную смесь инкубировали при 4о
С в течении 15 часов. В результате была получена плазмида pTTS-VEGF165.
Культивирование штамма ER2566/pTTS-VEGF165
Плазмидой pTTS-VEGF165 трансформировали компетентные клетки
E. coli ER2566. 300 мл клеточной суспензии перенесли в питательную
среду LB объёмом 25 мл содержащую ампицилин
(100мкг/мл) инкубировали при 37оС на шейкере при 200об/мин в течении
16 часов. Ночную культуру объёмом 25 мл рассадили в питательную среду 2YT объёмом 250 мл, содержащую ампицилин
(100мкг/мл) и инкубировали при 37оС до оптической плотности
культуральной среды 0,8 ед. После чего добавляли ИПТГ до конечной концентрации
последнего 100 мкг/мл. Инкубировали в течении 4 часов при 37оС.
Выделение и очистка hVEGF165
Биомассу штамма ER2566/pTTS-VEGF165 (5г) ресуспендировали в 50 мл буфера
(50 мМ ТрисHCl, 5мМ ЭДТА, 0,2% PMSF, pH 9.0) и лизировали с помощью ультразвукового дезинтегратора
(15 с, амплитуда 40%) во льду в течении 30 минут. После дезинтеграции гомогенат
центрифугировали в течение 30 мин (15000g, +4oC).
Суммарное содержание белка в полученном супернатанте составило 473 мг.
Осветлённый лизат объёмом 50 мл разбавили дистиллированной водой до объёма 100
мл и нанесли со скоростью 1 мл/мин на колонку (20 мл) заполненную анионообменым
сорбентом Q XL уравновешенным буфером А (20 мМ ТрисHCl, 1 мМ ЭДТА, pH 9,0). Элюировали градиентом буфера Б (20 мМ ТрисHCl, 1 мМ ЭДТА, 1 М NaCl, pH
9,0) 0% до 70% со скоростью 1,5 мл/мин. Фракции анализировали методом ПААГ
электрофореза в денатурирующих условиях. Фракции, содержащие hVEGF 165, были объединены. Выход белка
составил 7 мг с литра культуры.
Создание штамма продуцента Origami(DE3) /pTrx-VEGF165
К 10 мкл раствора, содержащего 0,5 мкг гена hVEGF165 фланкированного сайтами Xho I и Nco I и 0,3 мкг
плазмиды pTVG добавили 4мкл 10Чбуфера Tango 4 мкл дистиллированной воды и по 1
мкл (10 е.а./мкл) эндонуклеаз рестриции Xho I и Nco I. Инкубировали
реакционную смесь в течении 90 мин при 37о С. Реакционную смесь
разделяли на 1% агарозном геле. Экстрагировали продукты ферментативного
расщепления из агарозного геля набором фирмы QIAGEN. К 15 мкл экстракта
добавили 2 мкл 5 мМ раствора АТФ, 2 мкл 10Чбуфера для полинуклеотидкиназы фага
Т4, 1 мкл (5 е.а./мкл) лигазы. Реакционную смесь инкубировали при 4оС
в течение 15 часов. В результате была получена плазмида pTrx-VEGF165.
Культивирование штамма Origami(DE3)/ pTrx-VEGF165
Плазмидой pTrx-VEGF165 трансформировали компетентные клетки
E. coli Origami (DE3).
300 мл клеточной суспензии перенесли в питательную среду LB объёмом 25 мл содержащую ампицилин
(100мкг/мл) и оставили инкубироваться при 37 оС на шейкере при 200
об/мин в течении 16 часов. Ночную культуру рассадили в питательную среду SOB объёмом 250 мл, содержащей ампицилин
(100 мкг/мл) и инкубировали при 30 оС до оптической плотности
культуральной среды 0,8. После чего добавляли ИПТГ до конечной концентрации
последнего 100 мкг/мл. Инкубировали в течении 16 часов при 30оС.
Выделение и очистка Trx-hVEGF165.
Биомассу E. coli Origami/pTrx-VEGF165 (1 г.) гомогенизировали в 15 мл
буфера (50 мМ (Трис)2SO4, 5мМ ЭДТА, 0,2% PMSF, pH 10.0) и лизировали с помощью ультразвукового дезинтегратора
(15 с, амплитуда 40%) во льду в течение 30 минут. После дезинтеграции лизат
центрифугировали в течение 30 мин (15000g, +4oC).
Суммарное содержание белка в полученном супернатанте составило 117 мг.
Концентрацию белка определяли методом Бредфорд по стандартному раствору БСА.
Супернатант объёмом 15 мл разбавили дистиллированной водой до 30 мл и нанесли
со скоростью 1 мл/мин на колонку HiTrap Heparin
Sepharose (5 мл) предварительно уравновешенную
буфером А (20 мМ (Трис)2SO4,
1 мМ ЭДТА, pH 8.5). Элюировали в течении 50 мин
градиентом буфера Б (20 мМ (Трис)2SO4, 1 мМ ЭДТА, 1 М NaCl, pH 8.5) 0% до 100% со скоростью 1,5
мл/мин. Фракции анализировали методом ПААГ электрофореза в денатурирующих
условиях. Фракции, содержащие ГБ, были объединены. Количество гибридного белка
составило 14.8 мг. Описанную операцию провели ещё раз. Объединённые фракции c двух разрушений содержащие 26,3 мг
гибридного белка в 54 мл концентрировали на приборе для ультрафильтрации Amicon (мембрана YM 30) в 4 раза. В результате получили 13 мл раствора с
концентрацией ГБ 1,63 мг/мл.
Сайтспецифическое расщепление гибридного белка TEV протеазой
К концентрату добавили экстракт тел включения TEV до соотношения фермент-субстрат 1:100 и дитиотриэтол
до 1мМ, инкубировали 15 часов при 37o С.
Создание штамма продуцента Origami
(DE3)/pCBD-VEGF165
Нуклеотидную последовательность кодирующую хитин-связывающий домен (CBD) амплифицировали с pTWIN1. Амплификацию проводили по ранее
описанной методике с парой праймеров (T7 прим - прямой, CBD1-обратный).
Очистка ПЦР-продукта осуществлялась с помощью набора MinElute PCR Purification
Kit (QIAGEN, #27106).
К раствору, содержащего 0,5 мкг плазмиды pET-32b(+)
добавили 4 мкл 10Чбуфера Tango,
4 мкл дистиллированной воды и по 1 мкл (10 е.а./мкл) эндонуклеаз рестриции Xba I и Bgl II. Инкубировали
реакционную смесь в течении 90 мин при 37о С. Реакционную смесь
разделяли на 1% агарозном геле. Экстрагировали ДНК из агарозного геля набором
фирмы Евроген согласно протоколу производителя. К 10 мкл экстракта, содержащего
0,5 мкг линеаризованного фрагмента плазмиды pET-32b(+)
добавили 5 мкл раствора, содержащего 1 мкг амплифицированного гена CBD, 2 мкл 5 мМ раствора АТФ, 2 мкл
10Чбуфера для полинуклеотидкиназы фага Т4, 1 мкл (5 е.а./мкл) лигазы.
Реакционную смесь инкубировали при 4 оС в течении 15 часов. Лигазной
смесью трансформировали компетентные клетки E. coli Origami. И из отобранного клона выделили
плазмиду pET-CBD.
К 10 мкл раствора, содержащего 0,2 мкг плазмиды pET-CBD и
0,5 мкг амплифицированного гена hVEGF165
фланкированного Xho I и Bgl II сайтами рестрикции добавили 4 мкл 10Чбуфера Tango, 4 мкл дистиллированной воды и по 1
мкл (10 е.а./мкл) эндонуклеаз рестриции Xho I и Bgl II. Инкубировали
реакционную смесь в течении 90 мин при 37о С. Реакционную смесь
разделяли на 1% агарозном геле. Экстрагировали ДНК из агарозного геля набором
фирмы Евроген согласно протоколу производителя. К 15 мкл экстракта, содержащего
0,2 мкг линеаризованного фрагмента плазмиды pET-CBD и
0.5 мкг амплифицированного гена hVEGF165 добавили
2 мкл 5 мМ раствора АТФ, 2 мкл 10Чбуфера для полинуклеотидкиназы фага Т4, 1 мкл
(5 е.а./мкл) лигазы. Реакционную смесь инкубировали при 4оС в
течении 15 часов. Лигазной смесью трансформировали компетентные клетки E. coli Origami. Из отобранных клонов выделяли плазмидную ДНК набором
фирмы QIAGEN. В результате получили экспрессионную плазмиду pCBD-VEGF 165, в качестве штамма носителя использовали E. coli Origami (DE3).
Культивирование штамма Origami
(DE3)/pCBD-VEGF165
Плазмидой pCBD-VEGF165 трансформировали компетентные
клетки E. coli Origami. 300 мл клеточной суспензии перенесли в питательную
среду LB объёмом 25 мл содержащую ампицилин
(100мкг/мл) и инкубировали при 37 оС на шейкере при 200об/мин в
течение 16 часов. Ночную культуру объёмом 25 мл рассадили в 250 мл питательной
среды SOB, содержащей ампицилин (100 мкг/мл) и
инкубировали при 37оС до оптической плотности культуральной среды
0,8 ед. После чего добавляли ИПТГ до конечной концентрации последнего
100мкг/мкл. Инкубировали в течение 16 часов при 30о С.
Выделение и очистка гибридного белка CBD-hVEGF165
Биомассу штамма E. coli Origami (DE3)/pCBD-VEGF165 (1 г.) гомогенизировали в 15 мл
буфера (50 мМ ТрисHCl, 5мМ ЭДТА, 2 М
мочевины, 0,2% PMSF, pH 10.0) и лизировали с помощью
ультразвукового дезинтегратора (15 с, амплитуда 40%) во льду в течении 30
минут. После дезинтеграции лизат центрифугировали в течение 30 мин (15000g, +4oC). Суммарное содержание белка в полученном супернатанте
составило 107 мг. Концентрацию белка определяли методом Бредфорд по
стандартному раствору БСА. Осветлённый лизат объёмом 15 мл разбавили раствором
2 М мочевины до 30 мл и нанесли со скоростью 1 мл/мин на колонку HiTrap Heparin Sepharose (5 мл) предварительно уравновешенную
буфером А (20 мМ Трис HCl, 1
мМ ЭДТА, 2 М мочевины, pH
8.5). Элюировали в течении 50 мин градиентом буфера Б (20 мМ ТрисHCl, 1 мМ ЭДТА, 1 М NaCl, pH 8.5) 0% до 100% со скоростью 1,5 мл/мин. Фракции
анализировали методом SDS-электрофорезом.
Фракции, содержащие ГБ, были объединены. Количество гибридного белка составило
19,31 мг.
Концентрирование ГБ метом ультрафильтрации
Объединённые фракции трёх с трёх разрушений объёмом 81 мл разбавили
буфером (20 мМ Трис HCl, 1 мМ ЭДТА, pH 8.5) в 3,5 раза до 300 мл
(концентрация белка 0,19 мг/мл) и концентрировали на приборе для
ультрафильтрации Amicon (мембрана YM 30) в 15 раз. В результате получили
20 мл раствора с концентрацией ГБ 2,2 мг/мл.
Сайтспецифическое расщепление гибридного белка TEV протеазой.
К концентрату добавили экстракт телец TEV до соотношения фермент-субстрат 1:100 и дитиотриэтол
до 1мМ, инкубировали 15 часов при 37oС. Реакционную смесь нанесли на колонку HiTrap Heparin Sepharose (5 мл) и хроматографироговали по
ранее описанной методике. Фракции, содержащие целевой белок были объединены и
сконцентрированы.
Высокоэффективная жидкостная хроматография на колонке Диасорб С18
Очистку осуществляли на колонке Диасорб-130 -С16Т 7 мкм, 16Ч250 мм в
градиенте концентрации 30%-50% ацетонитрила с 0,1% ТФУ при скорости потока 5
мл/мин в течение 35 мин. Фракции, содержащие чистотой более 98%, объединяли и
лиофилизировали. Итоговый белок - 11,5 мг.
6.
ЭЛЕКТРОФОРЕЗ БЕЛКОВ В ПААГ
Электрофорез белков в денатурирующих условиях проводили в
полиакриламидном геле (система Laemmli.).В
качестве маркеров молекулярных масс использовали набор “Kalibration kit":
молекулярный вес - 14.4, 20.1, 30.0, 43.0, 67.0, 94.0 кДа (Pharmacia).
Использовали двухступенчатый гель: верхний (концентрирующий) - 3,5% ПААГ
в буфере UTB, нижний (разделяющий) - 15% ПААГ в
буфере LTB с инициатором полимеризации
персульфата аммония (1/100 объема геля) катализатором полимеризации и TEMED (1/1000 объема). Размер и толщина
геля определялся размерами стёкл, толщиной спейсеров и составлял 9х12х0,05 см.
Электрофорез проводили в 1х трис-глициновом буфере с SDS при постоянном силе тока в 22 мА.
Электрофорез прекращали, когда фронт красителя бромфенолового синего не выходил
в буфер. Затем гель помещали на 15 минут в фиксирующий раствор (10% ТХУ, 10%
метанол), потом - на 15 минут в красящий раствор (0,2% Кумаси R-250, 10% уксусной кислоты, 10%
изопропанола) при 60єС. Краску геля отмывали кипячением в 5%-ом растворе
уксусной кислоты.
Определение концентрации белка методом Бредфорд
Реактив Бредфорд готовили следующим образом: кумасси бриллиантовый синий G-250 (100 мг) растворяли в 50 мл 95%
- ного EtOH. К полуяеному раствору добавили 100
мл 85%-ной фосфорной кислоты и водой довили объём смеси до 1л.
К анализируемому образцу, содержащему белок в диапазоне 0,5 -9 мг/мл
добавили 2,5 мл реагента-красителя и хорошо перемешали. Измеряли поглощение при
длине волны 595 нм относительно чистого реагента.
Концентрацию белка находили по градуировочному графику построенному по
БСА.
Результаты и обсуждение
В ходе выполнения курсовой работы на тему «Получение рекомбинантного
сосудистого эндотелиального фактора роста» нами был осуществлён
химико-ферментативный синтез из перекрывающихся олигонуклеотидов гена
человеческого VEGF165. Ген hVEGF165 был оптимизирован по встречаемости
кодонов для экспрессии в E. coli. Он был клонирован в экспрессионный
вектор pET-23d(+) и получен штамм продуцент E. coli ER2566/ pER-VEGF165. Однако,
продукция целевого белка hVEGF165 в
клетках E. coli ER2566 была незначительной.
В статье (Hyo Jin Ihm, et al., 2008) была предложена «стоп старт»
конструкция для бактериальной системы экспрессии косного морфогенного белка.
Авторы отмечали высокий уровень экспрессии BMP-2 за счёт сопряжённой транскрипции мРНК BMP-2 с тиоредоксином. На подобии
описанной в литературе конструкции было решено клонировать ген hVEGF165 под стоп кодон тиоредоксина.
Кодирующая последовательность тиоредокцина была взята из вектора pET32b+. В кодирующую последовательность тиоредоксина была встроена
по сайтам EcoR I и Hind III вставка TRX_STOP. Вставка содержала стоп кодон ТАА, старт кодон ATG и следующий за ним сайт рестрикции Sap I.

Рис. 9. Схема вставки TRX_STOP
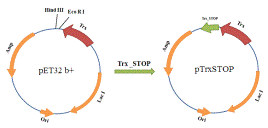
Рис. 10. Схема клонирования вставки Trx STOP в вектор pET32b+
Полученную последовательность тиоредоксин TRX_STOP
переклонировали по сайтам Nde I и Xho I в вектор pTTS,
производный вектора pTWIN1 (Рис. 11).
Вектор pTTS был получен из коммерчески
доступного вектора pTWIN1. Из вектора
pTWIN1 был удалён участок фланкированный
сайтами Xba I и Bam HI и по
образовавшимся липким концам была лигирована вставка, содержащая сайт
рестрикции Xho I (Рис. 12).

Рис. 11. Схема олигонуклеотидной вставки TTS
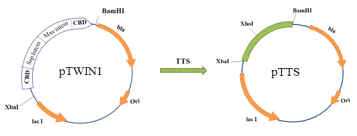
Рис. 12. Схема получения плазмиды pTTS
Амплифицированный ген TrxSTOP
был клонирован в вектор pTTS
по сайтам рестрикции Xba I и Xho I (Рис.13).
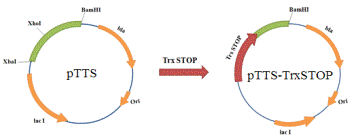
Рис. 13. Схема получения плазмиды pTTS-TrxSTOP
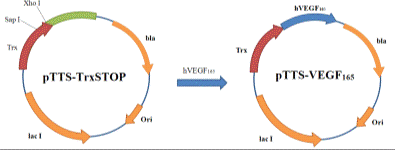
Из плазмиды pTTS-TrxSTOP был вырезан фрагмент фланкированный
сайтами Sap I и Xho I. По
образовавшимся липким концам лигировали амплифицированный ген hVEGF165. В итоге, была получен плазмидный
вектор pTTS-VEGF165 (Рис.14).
Лигазной смесью трансформировали компетентные клетки E. coli ER2566 и высеивали на твёрдую питательную среде LB Agar, содержащую 100 мкг/мл ампицилина. Полученные колонии
рекомбинантов анализировали на содержание и уровень экспрессии тиоредоксина и hVEGF165 методом ПААГ электрофореза в
денатурирующих условиях. На основании данных SDS ПААГ электрофореза были отобраны клоны №2,3 для
дальнейшей работы.

Рис. 15. Электрофореграмма (15% SDS-ПААГ) суммарных клеточных лизатов различных клонов E. coli ER2566/ pTTS- VEGF165. Где A-h VEGF165, B-тиоредоксин.
Из клонов №2, 3 выделили плазмидную ДНК (pTTS-hVEGF165).
Плазмидной ДНК клона № 2 (pTTS-hVEGF165) трансформировали клетки E. coli ER2655 и осуществили наработку биомассы ER2566/pTTS-hVEGF165.
Полученную биомассу лизировали с помощью ультразвукового дезинтегратора.
Осветлённый лизат после центрифугирования хроматографировали на анионообменной
смоле Q Sepharose (GE Healthcare). Фракции анализировали методом ПААГ
электрофореза в денатурирующих условиях на наличие целевого белка. Фракции,
содержащие 90% hVEGF165, были объединены. В объединенных
фракциях методом Бредфорд определяли концентрацию белка. В результате конечный
выход целевого белка составил 7 мг с литра культуры. Не смотря на низкий выход
целевого белка, продукция тиоредоксина была значительной, что отчётливо видно
на хроматограмме. (Рис.15).
Таблица 1
Содержание полипептидных продуктов на всех стадиях выделения и очистки
рекомбинантного белка hVEGF165 из
биомассы E. coli ER2566/ pTTS- VEGF165.
|
Этапы очистки
|
Общий белок (мг)
|
Содержание ГБ (%)
|
Содержание hVEGF165 (%)
|
|
Осветлённый клеточный лизат
|
473
|
|
10
|
|
Ионообменая хроматография на сорбенте Q XL
|
21
|
|
90
|
Получение гибридного белка Trx-hVEGF165
На основании результатов ранее описанного эксперимента по получению hVEGF165 с помощью «стоп старт» конструкции
было решено осуществить получение hVEGF165 в виде химерного белка. Так как уровень продукции тиоредоксина, несмотря
на низкий выход hVEGF165, был, достаточно, высокий.
В качестве экспрессионного вектора решили выбрать ранее полученный в
лаборатории вектор pTVG производный
вектора pET32 b(+). Вектор pTVG
содержит ген тиоредоксина, последовательность кодирующую сайт TEV протеазы и удобный полилинкер. Ген hVEGF165 был клонирован в плазмиду pTVG по сайтам Xho I и Nco I. В результате
получили плазмиду pTVG-VEGF165 (Рис. 16). В качестве штамма
носителя взяли E. coli Origami (DE3).
За счёт делеций гена глутатион редуктазы (gor522) и тиоредоксин редуктазы (trxB) биосинтез hVEGF165 в штамме Origami (DE3) идёт с образованием внутри и
межмолекуляных дисульфидных мостиков стабилизирующих молекулу белка и
способствующие правильному фолдированию молекулы.
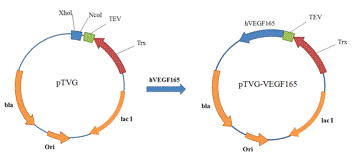
Рис. 16. Схема клонирования hVEGF165 в pTVG
Данной плазмидой трансформировали клетки Origami (DE3) и
осуществили наработку биомассы Origami
(DE3)/pTVG-hVEGF165. Полученную
биомассу дезинтегрировали с помощью ультразвукового дезинтегратора. Осветленный
лизат хроматографировали на колонке HiTrap Heparin
Sepharose. За счёт наличия на С конце молекулы
VEGF165 25 аминокислотных остатка, несущих
сайты аффиности к гепарину (N. Ferrara, 2010) было решено фракционировать белки
осветленного клеточного лизата на гепарин сефарозе.
Фракции анализировали методом ПААГ электрофореза в денатурирующих
условиях. Объединяли фракции, в которых содержание ГБ превышало 90%. Фракции,
содержащие ГБ концентрировали методом ультрафильтрации на мембране YM 30. К концентрату, содержащему
гибридный белок, была добавленная TEV протеаза в соотношении субстрат - фермент 100:1 соответственно.
Протеолитическое расщепление было не значительным, менее 40% (Рис. 17.).
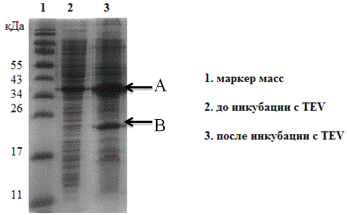
Рис. 17. Электрофореграмма (15% SDS-ПААГ). Результаты протеолитического
расщепления ГБ TEV протеазой. Где
A- гибридный белок (Trx-hVEGF165), B-тиоредоксин.
Вероятной причиной низкого уровня протеолитического расщепления были
неспецифические взаимодействия hVEGF165 с
тиоредоксином, экранировавшие сайт TEV.
Таблица 2
Содержание полипептидных продуктов на всех стадиях выделения и очистки
рекомбинантного белка hVEGF165 из
биомассы Origami (DE3)/pTVG-hVEGF165
|
Этапы очистки
|
Общий белок (мг)
|
Содержание ГБ (%)
|
Содержание hVEGF165 (%)
|
|
Осветлённый клеточный лизат
|
117
|
15
|
|
|
Аффинная хроматография на колонке HiTrap Heparin Sepharose
|
14.8
|
90
|
|
|
Расщепление ГБ TEV протеазой
|
14.8
|
|
34
|
Получение гибридного белка CBD-hVEGF165
Высокий уровень экспрессии гибридного белка Trx-hVEGF165
подтвердил правильность выбранного способа продукции целевого белка. Однако,
трудности возникшие на стадии сайт специфичного протеолитического расщепления TEV протеазой были, скорей всего,
вызваны специфической природой тиоредоксина, влияющего на фолдинг молекулы гибридного
белка. В результате снижалась доступность сайта TEV для TEV
протеазы. Поэтому мы решили использовать в качестве лидерного полипептида белок
с принципиально другой структурой, а также обладающего небольшой молекулярной
массой в сравнении с молекулой тиоредоксина. Таким образом, было решено создать
конструкцию, содержащую на N
конце хитинсвязывающий домен (CBD)
соединённый с hVEGF165 через сайт TEV.
CBD
фрагмент амплифицировали с pTWIN1
с помощью праймеров Т7-prim и
CBD2, содержащими сайты рестриктаз Xba I и Bgl II соответственно.
В качестве вектора была выбрана плазмида pET-32b(+).
Данный вектор содержит в полилинкерной последовательности сайты рестрикции Xba I и Bgl II (Рис. 19), по
которым и была произведена вставка амплифицированного фрагмента с учетом
корректной рамки считывания (Рис. 18).
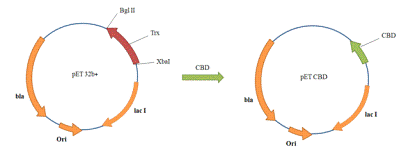
Рис. 18. Схема получения плазмиды pET-CBD

Рис. 19. Полилинкерная последовательность вектора pET-32b(+).
Полученной лигазной смесью трансформировали компетентные клетки Е.coli ER2566. Суспензию трансформированных клеток рассевали на чашки
с селективной средой. Клоны, полученные при высевании трансформированных клеток
на агаризованную среду пересевали в жидкую среду с добавлением ампициллина для
выращивания и отбора клонов.
Отбор клонов осуществляли по результатам данный полученных при
электрофорезе клеточных лизатов клонов в ПААГ. (Рис. 20).

Рис. 20. Электрофореграмма (15% SDS-ПААГ) суммарных клеточных лизатов
клонов E. coli ER2566/ pET-CBD
Из отобранных клонов выделили плазмидную ДНК для дальнейшей работы.
Получение экспрессионного вектора pCBD-VEGF165.
Ранее полученный ген человеческого VEGF165 был амплифицирован при помощи
полимеразной цепной реакции (ПЦР) с праймерами, содержащими сайты эндонуклеаз
рестрикции Bgl II и Xho I, в качестве
матрицы использовали плазмиду pTVG-VEGF165.
Амплифицированый ген hVEGF165 был
клонирован по сайтам Xho I и Bgl II в ранее созданную для этого генетическую конструкцию pET-CBD. В результате получили плазмиду pCBD-VEGF165 (Рис. 21).
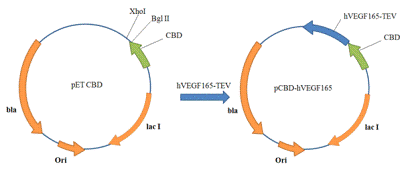
Рис. 21. Схема получения плазмиды pCBD-hVEGF165
Полученной лигазной смесью трансформировали компетентные клетки E. coli ER 2566, которые затем рассеивали на твёрдой питательной среде,
с целью отбора клонов. В результате было проверенно 9 клонов на наличие
экспрессии гибридного белка (Рис. 22).
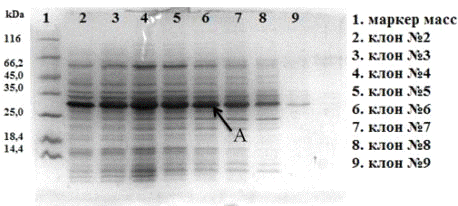
Рис. 22. Электрофореграмма (15% SDS-ПААГ) суммарных клеточных лизатов
клонов E. coli ER2566/pCBD-hVEGF165. Где А - гибридный белок CBD-hVEGF165
Для подтверждения строения вставки гена рекомбинантного белка, полученные
плазмиды были просеквенированы (в компании Евроген).
Из биомассы клона №4 была выделена плазмида pCBD-VEGF165 для
дальнейшей работы.
Получение штамма продуцента гибридного белка CBD-VEGF165
Выделенной плазмидой pCBD-VEGF165 трансформировали клетки E. coli Origami (DE3).
Полученный штамм продуцент проверяли на наличие продукции гибридного белка.
Элетрофорез проводили в восстанавливающих и в невосстанавливающих условиях с
целью обнаружения димера гибридного белка. Электрофореграмма в
невосстанавливающих условиях показала наличие димера химерного белка (Рис. 23).
Целевой белок после ультразвуковой дезинтеграции биомассы клетки E. coli Origami (DE3)/pCBD-VEGF165 в основном присутствовал в
растворённой фракции. Таким образом, нам удалось избежать образования телец
включения, характерных для гетерологической экспрессии многих белков в клетках E. coli.
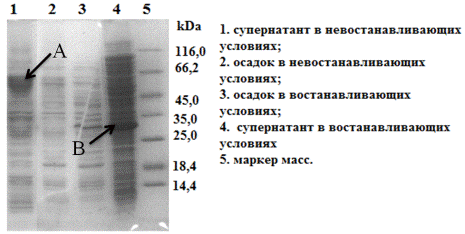
Рис. 23.Электрофореграмма (15% SDS-ПААГ) в восстанавливающих и невостанавливающих условиях. Где A- димер гибридного белка CBD-hVEGF165, B- мономер гибридного белка CBD-hVEGF165.
Подбор условий культивирования штамма E. coli Origami (DE3)/pCBD-VEGF165
В ходе дальнейшей работы был проведен подбор оптимальных условий
культивирования штамма-продуцента. Для этого в процессе культивирования клеток
после добавления ИПТГ каждый час отбирались пробы биомассы. Культивирование
проводили при 30о С.
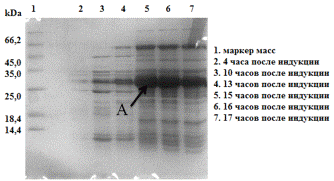
Рис. 24. Электрофореграмма (15% SDS-ПААГ) образцов биомассы E. coli Origami (DE3)/pCBD-hVEGF165после индукции ИПТГ. Где А -
гибридный белок CBD-VEGF165.
Из полученной электрофореграммы видно, что оптимальное время
культивирования клеточной культуры E. coli Origami (DE3)/pCBD-VEGF165 15-16 часов после добавления ИПТГ.
Выделение и очистка гибридного белка CBD-hVEGF165.
Полученный продуцент E.coli Origami (DE3)/pCBD-VEGF165 культивировали при 37 0С
до оптической плотности 0,6-0,7, затем добавляли ИПТГ и выращивали при 30 0С
в течение 16 часов.
Биомассу штамма-продуцента E.coli Origami (DE3)/pCBD-VEGF165 подвергали ультразвуковой
дезинтеграции в буфере, содержащем 2 М мочевину. Центрифугированием отделили
растворимую фракцию, содержащую гибридный белок, от нерастворимого осадка.
Используя сродство VEGF165 к гепарину, гибридный белок,
содержащийся в осветлённом лизате, очищали от белков E. coli на колонке HiTrap HP Heparin-Sepharose. Полученные фракции анализировали на наличие димера гибридного белка с
помощью SDS-ПААГ электрофореза в
невосстанавливающих условиях.

Рис. 25. Электрофореграмма (15% SDS-ПААГ) в невостанавливающих и восстанавливающих условиях фракций после
элюции с гепарин сефарозы. Где A -
димер гибридного белка CBD-hVEGF165. B - мономер гибридного белка CBD-hVEGF165.
По результатом электрофореза в невостанавливающих условиях были отобраны
фракции для дальнейшей работы.
Полученные фракции были объедены и сконцентрированы методом
ультрафильтрацией на мембране YM 30
с целью дальнейшего протеолитического расщепления гибридного белка TEV-протеазой.
Протеолитическое расщепление гибридного белка CBD-hVEGF165 TEV протеазой.
Концентрат нанесли на колонку, заполненную хитиновым сорбентом (New
England Biolabs). Колонку заполнили буферным раствором, содержащим TEV протеазу, инкубировали при 37оС
на 15 часов. Продукты протеолитического расщепления элюировали буферным
раствором А. Элюат и хитиновый сорбент анализировали методом SDS-электрофорезом.
Эффективность ферментативного гидролиза составила менее 50%. В качестве
альтернативного пути осуществления протеолитического расщепления ГБ было решено
отказаться от предварительной сорбции на хитиновый сорбент, а расщеплять,
непосредственно, в растворе. К полученному концентрату добавили экстракт тел
включения TEV в соотношении фермент-ГБ 1:100, а
также добавили 1М раствор дитиотриэтола до концентрации последнего в
реакционной среде 1 мм.
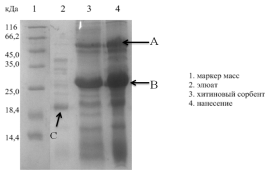
Рис 26. Электрофореграмма (15% SDS-ПААГ) результаты протеолитического расщепления TEV протеазой гибридного белка на колонке заполненной
хитиновым сорбентом. Где A-
димер гибридного белка CBD-hVEGF165, B - мономер гибридного белка CBD-hVEGF165, C - hVEGF 165.
Инкубировали в течение 15 часов при температуре 37оС и слабом
перемешивании. Гидролиз гибридного белка прошёл, практически, полностью (Рис.
27).
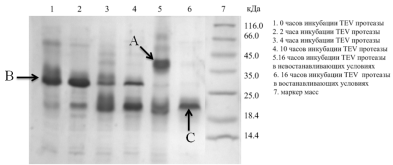
Рис. 27. Электрофореграмма (15% SDS-ПААГ). Кинетика протеолитического расщепления TEV протеазой гибридного белка в растворе. Где A - димер hVEGF165, B - мономер гибридного белка CBD-hVEGF165, C - мономер hVEGF165.
Далее смесь, содержащую продукты ферментативного гидролиза,
фракционировали, с помощью аффинной хроматографии на сорбенте гепарин сефароза
по ранее описанной методики. Фракции содержащие целевой белок очищали с помощью
ВЭЖХ на колонке Диасорб С18 (Рис. 28).
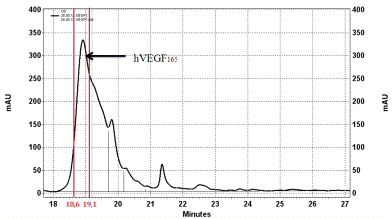
Рис. 28 Профиль ВЭЖХ хроматографии на колонке Диасорб С18 фракций,
содержащих hVEGF165
hVEGF165
чистотой 98% элюировался с колонки начиная 18,6 мин по 19,1 минуту. Полученный
элюат, содержащие чистый rhVEGF165 был
лиофилизирован. Итоговый выход целевого белка составил 22,4 мг с литра
культуры.
Таблица 3
Содержание полипептидных продуктов на всех стадиях выделения и очистки
рекомбинантного белка hVEGF165 из
биомассы E. coli Origami/pCBD-VEGF165.
|
Этапы очистки
|
Общий белок (мг)
|
Содержание ГБ (%)
|
Содержание hVEGF165 (%)
|
|
Осветлённый клеточный лизат
|
428
|
15
|
|
|
Аффинная хроматография на колонке HiTrap Heparin Sepharose
|
77,2
|
90
|
|
|
Концентрирование на мембране YM 30
|
56
|
90
|
|
|
Расщепление ГБ TEV протеазой
|
56
|
|
76
|
|
Аффинная хроматография на колонке HiTrap Heparin Sepharose
|
34
|
|
90
|
|
ОФ ВЭЖХ
|
22,4
|
|
97
|
ЗАКЛЮЧЕНИЕ
Нами было создано несколько генетических конструкций для бактериальной
системы экспресии человеческого васкулярного эндотелиального фактора роста hVEGF165 (pTrx-stop-hVEGF165, pTrx-hVEGF165, pCBD-hVEGF165). Отобрана наиболее эффективная из
них и подобран оптимально подходящий штамм E. coli. для
гетерологической экспрессии данного ростового фактора. Отработана методика и
схема выделения целевого белка.
ВЫВОДЫ
. Получен высокопродуктивный штамм продуцент hVEGF165 E. coli Origami (DE3)/pCBD-hVEGF165.
2. Определены оптимальные условия культивирования.
. Разработана схема выделения и очистки hVEGF165.
СПИСОК ЛИТЕРАТУРЫ
1. Базин И.,
Гарин А. Таргентные антиангиогенные препараты в терапии солидных опухолей. Врач 2008, 11: 52-55.
2. Кузьмин
А.Г., Липатов Д.В., Смирнова О.М., Шестакова М.В. Анти-VEGF препараты для лечения диабетической ретинопатии.
Офтальмохирургия. 2009, 3:
15-19.
. Парфенова
Е.В., Ткачук В.А. Перспективы генной терапии сердечно-сосудистых заболеваний.
Вопр. мед. хим. 2000, 46: 293-310.
4. Arora
N., Masood R., Zheng T., J. Cai, D.L. Smith, P.S. Gill. Vascular endothelial
growth factor chimeric toxin is highly active against endothelial cells. Cancer
Res. 1999, 59: 183-188.
. Baneyx
F., Recombinant protein expression in Escherichia coli, Curr. Opin. Biotechnol.
1999, 10: 411-421
. Barleon
B, Sozzani S, Zhou D, Weich H A, Mantovani A, Marme D. Migration of human
monocytesin response vascular endothelial growth factor (VEGF) is mediated via
the VEGF receptor flt-1. Blood. 1996, 87: 3336-3343.
. Bonnie
J. Nieves, Patricia A. D’Amore, and Brad A. Bryan. The function of vascular
endothelial growth factor International Union of Biochemistry and Molecular
Biology, Inc.Volume 2007 35, 332-337
8. Cantell,
K. The Story of Interferon, 1998.
. Cao
R, Brakenhielm E, Pawliuk R. Angiogenic synergism, vascular stability and
improvement of hind-limb ischemia by a combination of PDGF-BB and FGF. NatMed. 2003,
9: 604-13.
10. Casella
I, Feccia T, Chelucci C, Samoggia P, Castelli G, Guerriero R, Parolini I,
Petrucci E, Pelosi E, Morsilli O, Gabbianelli M, Testa U, Peschle C.
Autocrine-paracrine VEGF loops potentiate the maturation of megakaryocytic
precursors through Flt1 receptor. Blood. 2003, 101(4):1316-23.
11. Christensen
J.G. A preclinical review of sunitinib, a multitargeted receptor tyrosine
kinase inhibitor with anti-angiogenic and antitumour activities. Annals of
oncology. 2007, 18 1375-1381.
. Clauss
M., Weich H., Breier G., Knies U., Rockl W., Waltenberger J, Risau W. The
vascular endothelial growth factor receptor Flt-1 mediates biological
activities. Implications for a functional role of placenta growth factor in
monocyte activation and chemotaxis. J BiolChem. 1996; 271(30): 17629-17634.
. Compernolle
V., Brusselmans K., Acker T., Hoet P., Tjwa M., Beck H, Plaisance S, Dor Y,
Keshet E, Lupu F, Nemery B, Dewerchin M, Van Veldhoven P, Plate K., Moons L.,
Collen D., Carmeliet P. Loss of HIF-2alpha and inhibition of VEGF impair fetal
lung maturation, whereas treatment with VEGF prevents fatal respiratory
distress in premature mice. Nat Med. 2002, 8(7): 702-10.
. Dikov
M.M., Ohm J.E., Ray N, Tchekneva E.E., Burlison J., Moghanaki D., Nadaf S.
Carbone D.P. Differential roles of vascular endothelial growth factor receptors
1 and 2 in dendritic cell differentiation. J Immunol. 2005, 174(1): 215-22.
. Duyndam
MC, Hilhorst MC, Schluper HM, Verheul HM, van Diest PJ, Kraal G, Pinedo HM,
Boven E. Vascular endothelial growth factor-165 overexpression stimulates
angiogenesis and induces cyst formation and macrophage infiltration in human
ovarian cancer xenografts. Am J Pathol. 2002, 160 (2): 537-48.
. Ellen
C. Breen. VEGF in Biological Control. Journal of Cellular. Biochemistry. 2007,
102: 1358-1367.
. Farahani
M., Treweeke A.T., Toh C.H., Till K.J., Harris R.J., Cawley J.C., Zuzel M.,
Chen H. Autocrine VEGF mediates the antiapoptotic effect of CD154 on CLL cells.
Leukemia. 2005, 19(4): 524-30.
. Feistritzer
C, Kaneider N.C., Sturn D.H., Mosheimer B.A., Kahler C.M., Wiedermann C.J.
Expression and function of the vascular endothelial growth factor receptor
FLT-1 in human eosinophils. Am JRespir Cell MolBiol. 2004, 30(5): 729-35.
. Graumann
K., Premstaller A. Manufacturing of recombinant therapeutic proteins in
microbial systems. Biotechnol. J. 2006, 1: 164-186.
. Gerber
H.P., Malik A.K., Solar G.P., Sherman D., Liang X.H., Meng G., Hong K, Marsters
J.C., Ferrara N. VEGF regulates haematopoietic stem cell survival by an
internal autocrine loop mechanism. Nature. 2002, 417(6892): 954-958.
. Geum
Young Lee, Woon Won Jung, Chang Soo Kang, In Seok Bang. Expression and
characterization of human vascular endothelial growth factor (VEGF 165 ) in
insect cells Protein Expression and Purification. 2006, 46: 503-509.
. Grunewald
M, Avraham I, Dor Y, Bachar-Lustig E, Itin A, Yung S, Chimenti S, Landsman L,
Abramovitch R, Keshet E. VEGF-induced adult neovascularization: recruitment,
retention, and role of accessory cells. Cell. 2006, 124(1): 175-189.
24. Hyo
Jin Ihm, Seung-Ju Yang, Jae-Wan Huh, Soo Young Choi Sung-Woo Cho. Soluble
expression and purification of synthetic human bone morphogenetic protein-2 in
Escherichia coli, BMP Rep. 2008, 31;41(5): 404-7.
. I-Liang
Lee, Pei-Shan Li, Wei-Lin Yu, Hsin-Hsin Shen. Prokaryotic expression,
refolding, and purification of functional human vascular endothelial
growth factor isoform 165: Purification procedures and refolding
conditions revisited. Protein Expression and Purification. 2011, 76:
54-58.
26. Ishida
S., Usui T., Yamashiro K. VEGF165 as the pathophisiological isoform:
differential leukocyte and endothelial responses through VEGFR1 and VEGFR2.
Invest Ophthalmol. Vis. Sci. 2004, 45: 368-374.
. Iwaguro
H, Yamaguchi J, Kalka C, Murasawa S, Masuda H, Hayashi S, Silver M, Li T, Isner
JM, Asahara T. Endothelial progenitor cell vascular endothelial growth factor
gene transfer for vascular regeneration. Circulation. 2002, 105(6): 732-8.
. Keck,
P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, T., Feder, J., and Connolly,
D.T. Vascular permeability factor, an endothelial cell mitogen related to PDGF.
Science. 1989, 246: 1309-1312.
. Keck
R.G., Berleau L., Harris R., Keyt B.A. Disulfide structure of the heparin
binding domain in vascular endothelial growth factor: characterization of
posttranslational modifications in VEGF. Arch. Biochem. Biophys. 1997,
344: 103-113
. Kim
S., Mohamedali K.A., Cheung L.H., Rosenblum M.G. Overexpression of biologically
active VEG121 fusion proteins in Escherichia coli, J. Biotechnol. 2007, 128:
638-647
. Lee
Seong-Baek, Jeong Soo Park, Seunghee Lee, Junho Park. Overproduction of
Recombinant Human VEGF in Chinese Hamster Ovary Cell, J. Microbiol. Biotechnol.
2008, 18 (1): 183-187.
. Lissandra
Dal Lago, Veronique D’hondt, Ahmad Awada. Selected Combination Therapy with
Sorafenib: A Review of Clinical Data and Perspectives in Advanced Solid Tumors.
The Oncologist. 2008, 13: 845-858.
33. Matsumoto
Taro, Mugishima Hideo. Signal transduction via vascular endothelial growth
factor (VEGF) receptors and their roles in atherogenesis. J. of atherosclerosis
and thrombosis. 2006, 13 (3): 130-135.
34. Miquerol,
L., Langille, B.L., and Nagy, A. Embryonic development is disrupted by modest
increases in vascular endothelial growth factor gene expression. Development.
2000, 127: 3941-3946.
35. Morera
Y., Lamdan H., Bequet M., Ayala M., Rojas G., Muсoz Y.,. Gavilondo J.V.
Biologically active vascular endothelial growth factor as a bacterial
recombinant glutathione S-transferase fusion protein, Biotechnol. Appl.
Biochem. 2006, 44: 45-53.
. Muller
Y.A., Christinger H.W., Keyt B.A., de Vos A.M. The crystal structure of
vascular endothelial growth factor (VEGF) refined to 1.93 A resolution:
multiple copy flexibility and receptor binding. Structure. 1997, 15;5(10):
1325-38
. Murayama
T, Tepper O.M., Silver M, Ma H, Losordo D.W., Isner J.M., Asahara T., Kalka C.
Determination of bone marrow-derived endothelial progenitor cell significance
in angiogenic growth factor-induced neovascularization in vivo. Exp Hematol.
2002, 30(8): 967-72.
. Norrby
K. Mast cells and angiogenesis. Apmis. 2002, 110 (5): 355-71.
. Oosthuyse
B, Moons L, Storkebaum E, Beck H, Nuyens D, Brusselmans K, Van Dorpe J.,
Hellings P., Gorselink M., Heymans S, Theilmeier G, Dewerchin M, Laudenbach V.,
Vermylen P., Raat H., Acker T., Vleminckx V., Van Den Bosch L, Cashman N,
Fujisawa H, Drost M.R., Sciot R, Bruyninckx F., Hicklin D.J., Ince C., Gressens
P, Lupu F, Plate K.H., Robberecht W, Herbert J.M., Collen D, Carmeliet P.
Deletion of the hypoxia-response element in the vascular endothelial growth
factor promoter causes motor neuron degeneration. Nat Genet. 2001, 28(2):
131-8.
. Otrock,
Z.K., Makarem, J.A., and Shamseddine, A.I. Vascular endothelial growth factor
family of ligands and receptors: review. Blood Cells Mol. Dis. 2007, 38:
258-268.
. Peretz
D., Gitay-Goren H., Safran M., Kimmel N., Gospodarowicz D., Neufeld G.
Glycosylation of vascular endothelial growth factor is not required for its
mitogenic activity, Biochem. Biophys. Res. Commun. 1992, 182: 1340-1347.
. Rissanen
TT, Yla-Herttuala S. Current status of cardiovascular gene therapy. MolTher.
2007, 15: 1233-47.
. Robert
J. Motzer, M. Dror Michaelson, Bruce G. Redman, Gary R. Hudes, George Wilding,
Robert A. Figlin, Michelle S. Ginsberg, Sindy T. Kim, Charles M. Baum, Samuel
E. DePrimo, Jim Z. Li, Carlo L. Bello, Charles P. Theuer, Daniel J. George, and
Brian I. Activity of SU11248, a Multitargeted Inhibitor of Vascular Endothelial
Growth Factor Receptor and Platelet-Derived Growth Factor Receptor, in Patients
With Metastatic Renal Cell Carcinoma. The Journal of Clinical Oncology. 2006,
24 (1): 16-24.
. Rosana
D. Meyer, David B. Sacks, and Nader Rahimi. IQGAP1-Dependent Signaling Pathway
Regulates Endothelial Cell Proliferation and Angiogenesis. PLoS ONE. 2008,
3(12): e3848.
. Scrofani
S.D.B., Fabri L.J., Xu P., P. Maccarone, A.D. Nash. Purification and
refolding of vascular endothelial growth factor-B, Protein Sci. 2000, 9:
2018-2025.
. Salvatore
Grisatni, Fock Ziemssen. Bevacizumab: Off-label use on ophthalmology. Indian J
Opthtalmol. 2007, 55 (6): 417-420.
. Schanzer
A, Wachs FP, Wilhelm D, Acker T, Cooper-Kuhn C, Beck H, Winkler J, Aigner L,
Plate KH, Kuhn HG. Direct stimulation of adult neural stem cells in vitro and
neurogenesis in vivo by vascular endothelial growth factor. Brain Pathol. 2004,
14(3): 237-248.
. Senger,
D.R., Galli, S.J., Dvorak, A. M., Perruzzi, C.A., Harvey, V.S., and Dvorak,
H.F. Tumor cells secrete a vascular permeability factor that promotes
accumulation of ascites fluid. Science. 1983, 219: 983-985.
. Shalini
Iyer and K. Ravi Acharya. Tying the knot. The cystine signature and
molecular-recognition processes of the vascular endothelial growth factor
family of angiogenic cytokines. FEBS Journal. 2011, 278: 4304-4322.
. Shelly
A. Pizarro, Jane Gunson, Matthew J. Field, Rachel Dinges, Stefanie Khoo, Milind
Dalal, Michael Lee, Kimberly A. Kaleas, Kathryn Moiseff, Susan Garnick,
Dorothea E. Reilly, Michael W. Laird, Charles H. Schmelzer. High-yield
expression of human vascular endothelial growth factor VEGF 165 in Escherichia
coli and purification for therapeutic applications. Protein Expression
and Purification. 2010, 72: 184-193.
. Shui
YB, Wang X, Hu JS, Wang SP, Garcia CM, Potts JD, Sharma Y, Beebe DC.Vascular
endothelial growth factor expression and signaling in the lens. Invest Ophthal
mol VisSci. 2003, 44 (9): 3911-3919.
. ShyuK-G,
ChangH, IsnerJM. Synergistic effect of angiopoietin-1 and vascular endothelial
growth factor on neoangiogenesis in hypercholesterolemic rabbit model with
acute hind limb ischemia. Life Sciences. 2003, 73: 563-79.
. Street
John and Lenehan Brian. Vascular endothelial growth factor regulates osteoblast
survival -evidence for an autocrine feedback mechanism, J. of Orthopaedic
Surgery and Research. 2009, 4:19.
. Swartz
J.R. Advances in Escherichia coli production of therapeutic proteins. Curr.
Opin. Biotechnol. 2001, 12: 195-201.
. Wiesmann
C., Fuh G., Christinger H.W., Eigenbrot C., Wells J.A., de Vos A.M. Crystal
structure at 1.7 Е resolution of VEGF in complex with domain 2 of the Flt-1
receptor. Cell. 1997, 91: 695-704.
. Whitlock
PR, Hackett NR, Leopold P Letal. Adenovirus-mediated transfer of a minigene
expressing multiple isoforms of VEGF is more effective at inducing angiogenesis
than comparable vectors expressing individual VEGF cDNAs. MolTher. 2004, 9:
67-75.
. Yla-Herttuala
S, Rissanen TT, Vajanto I. Vascular endothelial growth factors: biology and
current status of clinical application in cardiovascular medicine. JMCC. 2007,
49: 1015-26.