Инфаркт миокарда
КУРСОВАЯ РАБОТА
На тему: «ИНФАРКТ
МИОКАРДА»
Специальность: Лечебное
дело
Чита - 2012г.
Организация кардиологической
помощи в России
Кардиологическая помощь
населению - система организации специализированной медицинской помощи лицам,
страдающим сердечно-сосудистыми болезнями. Создание и развитие кардиологической
помощи - приоритетное направление отечественного здравоохранения. Это связано с
высокой распространенностью сердечно-сосудистых заболеваний (ССЗ) [прежде всего
ишемической болезни сердца (ИБС) и гипертонической болезни], необходимостью
улучшения профилактики и лечения этой категории населения.
Концепция кардиологической
помощи вытекает из главной цели социальной политики Российской Федерации, а
именно: последовательного повышения уровня и качества жизни населения,
обеспечения всеобщей доступности основных видов социальных услуг, прежде всего
качественной медицинской помощи. Она включает комплексное планомерное развитие
взаимосвязанных структурных элементов: амбулаторно-поликлиническая помощь,
стационарная помощь (кардиологическая и кардиохирургическая), медицинская
реабилитация пациентов кардиологического профиля на основе системы управления
качеством и единой идеологии подходов к диагностике и лечению ССЗ.
Формирование системы
кардиологической помощи направлено на повышение уровня здоровья населения за
счет снижения предотвратимых потерь общества вследствие болезней
сердечно-сосудистой системы при условии обеспечения доступной
высококвалифицированной и высокотехнологичной кардиологической помощи, включая
профилактику ССЗ, раннее их выявление, адекватную диагностику, своевременное
лечение и реабилитацию, повышения эффективности деятельности всех этапов
кардиологической помощи на основе развития ресурсосберегающих медицинских и организационных
технологий.
На современном этапе ведущими
принципами кардиологической помощи служат этапность ведения больных с
сердечно-сосудистой патологией (первичная - специализированная -
высокотехнологическая кардиологическая помощь), преемственность в оказании
медицинской помощи, профилактическая направленность, индивидуальный подход к
больному, научная обоснованность применяемых в кардиологии методов диагностики
и лечения. Наряду с этим в национальную кардиологическую службу входят новые
принципы, а именно: ранняя диагностика ССЗ, основанная на концепции факторов
риска, применение высоких технологий, единая идеология лечебно-профилактических
мероприятий при интеграции кардиологической и кардиохирургической помощи.
Структура кардиологической
службы
Государственная система
организации медицинской помощи предусматривает оказание кардиологической помощи
на следующих уровнях (согласно Приказу Министерства здравоохранения и
социального развития Российской Федерации от 13.10.2005 № 633, табл. 1-1):
В учреждениях здравоохранения
федеральных органов исполнительной власти;
В учреждениях здравоохранения
субъектов Российской Федерации;
В учреждениях здравоохранения
городского округа;
В муниципальных учреждениях
здравоохранения.
Сложившаяся структура
кардиологической службы - сеть учреждений здравоохранения и их подразделений
(кардиологические институты, диспансеры, отделения, кабинеты), оказывающих
поэтапную медицинскую помощь больным с сердечно-сосудистой патологией
(действующий Приказ Минздрава СССР от 30.10.1978 № 1038 «О мерах по дальнейшему
развитию кардиологической помощи населению» вместе с положениями «О
кардиологическом диспансере», «О кардиологическом отделении стационара больницы
кардиологического диспансера», «О кардиологическом кабинете поликлиники»; Приказ
Минздрава РФ от 03.11.1999 № 395 «Об утверждении номенклатуры учреждений
здравоохранения», редакция от 28.02.2000) . На каждом этапе представлены
определенные технологии медицинской помощи.
Научно-методическим центром
стал Институт кардиологии им. А.Л. Мясникова РКНПК Росздрава. Координация,
контроль за деятельностью кардиологической службы и оказанием
организационно-методической помощи возложен на внештатных главных кардиологов
(Росздрава, федерального округа, области, края, города). Таким образом, систему
кардиологической помощи условно можно рассматривать с точки зрения уровня и
этапности ее оказания.
Первичным звеном выступает
участковая служба и скорая медицинская помощь. Этот этап кардиологической
медицинской помощи представлен в лечебно-профилактических учреждениях
муниципального района (поликлиника, районная больница, центральная районная
больница), городского округа (центр, медсанчасть, городская больница, станция
скорой медицинской помощи, больница скорой медицинской помощи). Оказание кардиологической
помощи обеспечивают терапевты, врачи общей практики (семейные врачи). К ним
обращаются впервые около 80% кардиологических пациентов. При условии владения
врачом знаниями в области сердечно-сосудистой патологии и оснащении поликлиник
необходимой аппаратурой (в первую очередь электрокардиографами) уже на первом
этапе решают проблемы ранней диагностики, лечения неосложненных форм основных
ССЗ, а также подготовки пациента к оказанию специализированной кардиологической
помощи, осуществляют дальнейший динамический контроль состояния пациентов.
Специализированную
кардиологическую помощь оказывают в учреждениях среднего звена, основу которого
составляют кардиологические диспансеры, кардиологические отделения в районных,
областных, городских больницах, кардиологические кабинеты поликлиник.
Кардиологические диспансеры и отделения могут быть организованы в учреждениях
здравоохранения субъектов Российской Федерации (областная, краевая,
республиканская, окружная больница, диспансер, специализированная больница, госпиталь,
центр). В составе кардиологических отделений обязательны блоки интенсивной
терапии для больных инфарктом миокарда (ИМ) и, с учетом перспективы развития
здравоохранения, организация высокотехнологичных кардиологических коек.
Скорую кардиологическую
специализированную помощь организуют в учреждениях здравоохранения субъектов
Российской Федерации - в областной, краевой, республиканской, окружной
больнице, в центрах медицины катастроф, перинатальном центре.
Оказание высокотехнологичной
(дорогостоящей) медицинской помощи осуществляют в федеральных
специализированных медицинских учреждениях, образующих высшее звено
высококвалифицированной кардиологической помощи: научно-исследовательских
институтах кардиологии и центрах высоких технологий. Они имеют развитое
материально-техническое оснащение, например установки для
электрофизиологических исследований, рентгеноангиографической диагностики,
оборудование для коронарной ангиопластики и стентирования, операций на сердец с
применением методики искусственного кровообращения и т.д.
Перевод больного с одного этапа
на другой осуществляют согласно определенным, строго алгоритмизированным
показаниям. Крайне важна преемственность между этапами лечения, оперативный
обмен информацией, соблюдение сроков госпитализации и реабилитации больных.
Кардиологическая помощь оказывается также негосударственными учреждениями
здравоохранения.
Неотложная кардиологическая
помощь
В организации медицинской
помощи исключительно важное место занимает неотложная кардиологическая помощь,
которая представляет комплекс экстренных мероприятий для диагностики, лечения и
профилактики острых нарушений систем организма при ССЗ. Состояния, при которых
возникает необходимость в неотложной кардиологической помощи, отличаются
широким разнообразием по своим механизмам, характеру и прогнозу: от приступа
тахиаритмии или гипертонического криза до внезапной смерти (в России примерно
250 тыс. человек ежегодно умирают внезапно от остановки сердца). Одновременно с
этим именно для острой сердечно-сосудистой патологии типична внезапность
развития, мгновенные, как отрицательные, так и положительные, реакции на
внешние факторы и оказываемую помощь, быстрая трансформация донного состояния в
другое, в том числе угрожающее жизни и требующее проведения сердечно-легочной
реанимации (СЛР). Потеря времени может быть непоправимой. В связи с этим
главными принципами организации неотложной кардиологической помощи на
догоспитальном этапе служит активное, раннее использование программ первой
доврачебной помощи, оказание неотложной помощи при первом контакте с пациентом
в достаточном объеме и в рамках соответствующего типу лечебного учреждения
стандарта, своевременная и непосредственная (без дополнительных промежуточных
этапов) передача больного врачам-специалистам. В то же время перспективы
организации экстренной помощи связаны с необходимостью подготовки основам
неотложной кардиологической помощи не только медицинских, но и парамедицинских
кадров, а также с обеспечением специальным оборудованием (в первую очередь,
дефибрилляторами) мест массового скопления людей.
Неотложную кардиологическую
помощь больному можно оказывать на догоспитальном и госпитальном (стационарном)
этапах. Переход с одного этапа на другой в случаях неэффективности мероприятий
осуществляют в сжатые сроки. На догоспитальном этапе проводят необходимые
мероприятия для купирования острого состояния и определяют тактику ведения
больных, проводят первичную сортировку пациентов по степени тяжести их
состояния. Условно этот этап оказания помощи подразделяют на пять уровней:
· I
- самопомощь, оказываемая больным, обученным специальным приемам купирования,
например пароксизма мерцательной аритмии или другого острого состояния в рамках
индивидуальной программы, подобранной лечащим врачом;
· II
- помощь, которую могут оказать врачи амбулаторно-поликлинических учреждений
нетерапевтического профиля (специаизированные диспансеры, консультации и др.);
· III
- помощь, доступная в амбулаторно-поликлинических учреждениях терапевтического
профиля, многопрофильных поликлиниках, офисе врача общей практики;
· IV
- помощь, доступная врачам (фельдшерам) линейных бригад скорой (неотложной)
помощи;
· V
- помощь, оказываемая врачами специализированных бригад скорой (неотложной)
помощи.
Госпитальный этап включает
мероприятия, направленные на уточнение диагноза и оказание квалифицированной
лечебной помощи. Он начинается сразу же при поступлении больного в приемное
отделение и продолжается в специализированном отделении до момента достижения
максимального терапевтического эффекта, определения прогноза заболевания.
Медицинскую помощь оказывают врачи, имеющие подготовку по неотложной
кардиологической помощи, при необходимости привлекают смежных специалистов.
Перевод пациента в кардиологическое или иное профильное отделение осуществляют
при стабилизации состояния больного для проведения дальнейших диагностических и
лечебных мероприятий. Движение пациентов по отделениям стационара должно быть
обосновано изменением диагностической концепции и плана лечения больного.
В отделениях неотложной
кардиологии больным с острой формой ИМ, поступающим в первые 12 часов от начала
болевого синдрома, проводят системную тромболитическую терапию, используют
баллонную контрпульсацию, современные методы лечения нарушений ритма сердца и
т.д. При анализе результатов работы данной формы организации стационарной
неотложной кардиологической помощи в Москве в конце 1990-х годов произошло
снижение летальности от болезней системы кровообращения и инфаркта миокарда
приблизительно на 20%, улучшились профильность поступления больных, качество
лечения и обследования пациентов, увеличилась пропускная способность блока
кардиореанимации.
Другое направление развития
экстренной помощи - разработка мобильных систем оказания высокотехнологичной
кардиологической помощи. Наиболее активно такие форма работы внедряют в
регионах с высокой остротой проблемы коронарных катастроф и большой
разбросанностью населенных пунктов (регионы Сибири - Томск, Новосибирск,
Тюмень, Кемерово, Красноярск, Новокузнецк, Барнаул). Модель организации
неотложной кардиологической помощи в крупном городе (Москва, Санкт-Петербург)
рассматривает его деление на несколько территорий с полной автономной
организацией помощи кардиологическим больным (машины скорой помощи,
прикрепленные к стационарам, кардиологические кабинеты и реабилитационные
центры).
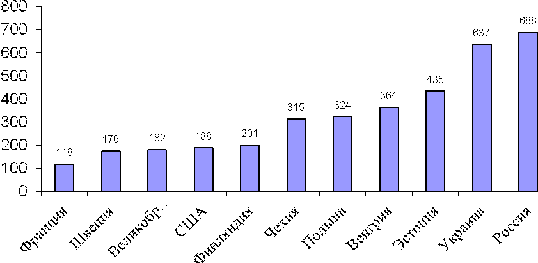
Рис.2-1 Смертность от ССЗ в разных странах (оба
пола, 2002г.)
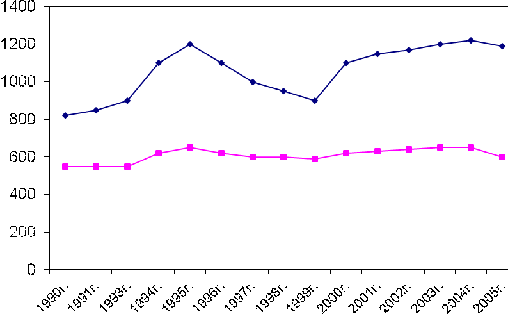
Рис.2-2 Динамика показателей смертности от ССЗ в
России
Этиология инфаркта Миокарда.
Характеристика внутрикоронарных изменений. Патогенез
Последнее двадцатилетие
характеризуется значительным прогрессом в лечении острого инфаркта миокарда
(ИМ). Летальность на протяжении первого месяца заболевания снизилась более чем
в два раза. Это было достигнуто путем эффективной профилактики и лечения
тяжелых аритмий, фибрилляции сердца, острой сердечной недостаточности, такие
результаты получены путем разработки и внедрения нового организационного
принципа - интенсивного наблюдения и лечения больных ИМ в специализированных
отделениях (отделениях интенсивной терапии - ОИТ). В них наряду с
круглосуточным клиническим наблюдением применяются методы инструментального и
лабораторного мониторинга за больными. Однако летальность от разрыва сердца и
кардиогенного шока сохраняется достаточно высокой. Определяющей причиной
указанных осложнений являются большие размеры инфаркта миокарда, обуславливающие
снижение прочности стенки и значительное уменьшение массы сокращающегося
миокарда. В связи с этим основной задачей стал поиск путей уменьшения размеров
некроза и профилактики его развития в первые часы ИМ. Естественно, что для
решения данной проблемы необходимы глубокие знания характера и динамики
процессов, происходящих в самом начале развития инфарктного процесса.
Причиной развития ИМ является
быстрое прекращение или критическое снижение (более чем на 80%) кровотока в
достаточно крупной коронарной артерии. Совершенствование методики
коронароангиографии с возможностью подробного динамического прижизненного
наблюдения изменений в коронарном русле позволило изучить патологический
механизм процесса коронарной окклюзии.
В основе этиологии ИМ, как это
было давно установлено, лежит стенозирующий атеросклероз коронарной артерии
(КА). Однако степень предшествующего инфаркту миокарда лужения КА (так
называемый "фиксированный стеноз") не является определяющим
механизмом развития острого процесса, хотя и влияет на тяжесть и исход
заболевания. Непосредственно производящими причинами признавались
функциональное несоответствие коронарного кровотока текущей потребности
миокарда, обтурация просвета КА увеличенной атеросклеротической бляшкой (АБ),
возможно, спазм коронарных артерий. Значение тромбоза коронарных артерий
признавалось не всеми исследователями, так как посмертно тромбы не всегда
обнаруживались, а антикоагулянты не давали полной реваскуляризации [Виноградов
А. В., 1971; Чазов Е. И., 1982; Руда М. Я. и Зыско А. П., 1980].
За последнее 10-летие динамика
внутрикоронарных изменений при ИМ изучена достаточно полно. Установлено, что
производящими причинами служат быстрые изменения в стенке коронарной артерии.
Основные их особенности представлены в табл.
Таблица
|
Характер
нарушений
|
Морфофункциональные
особенности
|
Нарушения
кровотока
|
|
Морфологические
|
Фиксированный
стеноз Разрушение бляшки, эндотелия, скопление и разрушение тромбоцитов,
эритроцитов, лейкоцитов
|
Спазмы
артерий, тромбоз Периферический блок.
|
|
Биохимические
|
Выход
серотонина, тромбоксана, лейкотриенов. Снижение уровня простациклина, ЭДФ
|
Полная
окклюзия сосуда
|
Изменения начинаются в
атеросклеротической бляшке. В силу различных причин - травмы, резкого повышения
скорости потока крови и давления, интоксикации и др. - нарушается ее
целостность. На поверхности АБ образуются трещины, изъязвления, кровоизлияния в
толщу стенки сосуда. Особенно важно, что нарушается эндотелиальный покров в
этой зоне. К области АБ прилипают тромбоциты, эритроциты, лейкоциты. Скопление
и распад клеток приводят к выделению ряда веществ, которые стимулируют
дальнейшее патологические изменения, приводящие к полной окклюзии КА.
Скопление тромбоцитов и их
распад приводят к выделению ряда продуктов, влияющих на просвет сосудов. К ним
относятся серотонин, тромбоксан (ГхАг). Особую роль играют выходящие из
измененных клеток эндотелия ионы кальция. Разрушенные эндотелиальные клетки
выделяют больше тромбогенных веществ и снижают или прекращают выброс
тромболитиков и вазодилататоров - простациклина, эндотелиального дилатирующего
фактора (ЭДФ) и др. Все это вызывает быстрое развитие тромбоза. Соотношение
содержания ТхА2 простациклина в пользу первого приводит к спастическим реакциям
сосуда. В этом же направлении действуют ионы Са++ и лейкотриены из прилипших
лейкоцитов. Таким образом, начинают действовать два основных патогенетических
фактора ИМ - тромбоз и спазм. Процесс окклюзии крупного сосуда осложняется
нарушением циркуляции в периферической сети, им обеспечиваемым. Эти изменения
вызываются микроэмболизациями из пораженного сосуда: детритом АБ, агрегатами из
тромбоцитов и других клеток крови. Вазоакгивные субстанции повышают тонус
мелких сосудов, и происходит набухание клеток их эндотелия. В результате
развивается периферический блок, то есть прекращение кровотока из пораженного
сосуда и по коллатералям. В итоге окончательно развивается первая фаза
формирования ИМ - быстрая окклюзия коронарной артерии, результатом чего
является острое некомпенсируемое кислородное голодание миокарда.
Морфология и динамика изменений
миокарда
Применение новых
инструментальных, лабораторных, морфо-функциональных методов (сканирование,
позитронная томо- графия, УЗИ, цитохимические исследования) в экспериментах и
клинике позволили достаточно полно представить течение процессов ишемического
повреждения миокарда и развития некроза в зоне кровоснабжения окклюзированного
сосуда. Общая характеристика представлена в табл.
Таблица Динамика изменений
миокарда в ходе развития его инфаркта
|
Типы
нарушений
|
Характеристика
сдвигов
|
Патологические
проявления
|
|
Метаболические
Морфологические
|
Высвобождение
ионов Н+ и Са++ и вазоактивных субстанций. Накопление перекислых соединений,
свободных радикалов, падение содержания АТФ. Набухание и отек миоцитов,
разрушение митохондрий и ядер. Скопление лейкоцитов. Некроз миоцитов.
|
Падение
сократимости и растяжимости миокарда. Повышение симпатической активности.
Асистолия зоны поражения
|
В условиях снижения или
прекращения доставки кислорода происходит нарушение процессов окисления. Из
миоцитов высвобождаются ионы Н*, К. Внутриклеточно нарастает концентрация Са**.
Появляются продукты неполного окисления, супероксидные и гидроксильные
свободные радикалы, немедленно нарушается сократимость и растяжимость миокарда.
Развивается набухание и отек клеток, разрушается их мембранная структура,
изменяются потоки ионов кальция. В результате резко падает продукция
макроэргов, в частности АТФ. Таксе состояние прогрессирует. Развивается некроз
миоцитов. Ему способствует протеолиз в результате миграции к очагу поражения
лейкоцитов.
Развитие некроза начинается с
центральной (по отношению к области нарушенного кровоснабжения) зоны и
распространяется позже на краевые области. Процесс этот не одномоментный.
Установлено, что на протяжении известного срока повреждение миокарда остается
полностью обратимым.
Изложенные выше данные привели
к современной концепции патогенеза инфарктного процесса. Принципиально новым
положением явилось то, что полная острая обструкция коронарного сосуда не ведет
к неизбежности развития ИМ. Эти понятия не синонимы. После полного прекращения
кровоснабжения миокард прекращает сократительную деятельность через 20-30 с, но
биологическая смерть наступает через 60-120 мин. То есть имеется период
обратимой ишемии. При реваскуляризации не позднее 1,5-2 часов ИМ может не
развиться вообще, сохраняется возможность полного восстановления морфологии
миокарда. В исследованиях был обнаружен и другой важный факт. Полный цикл
развития инфарктного процесса в зоне окклюзии завершается на протяжении 4-6
часов. То есть, если через 1-2 часа центральная область некротизирована
необратимо, краевая зона сохраняет возможность ресгитуции еще 2-4 часа.
Краевая зона обозначается как
"зона риска". Повреждение миокарда в этой зоне, кроме недостаточного
поступления кислорода, усиливается за счет поступления продуктов неполного
окисления и избытка ионов кальция из центральной зоны. Ишемически поврежденный
миокард определяют термином "потрясенный" (stunned)
миокард. Основная особенность заключается в понижении его сократимости и растяжимости.
Клинически при этом у части больных выявляется дисфункция левого желудочка
(ДЛЖ) в виде нарастания одышки, падения растяжимости в диастолу, тахикардии,
патологического изменения тонов, появления систолического шума, недостаточности
сердца. При ультразвуковом исследовании определяются участки дискинезии
миокарда, снижение фракции изгнания левого желудочка сердца.
Доплер-кардиографически находят падение растяжимости миокарда, что проявляется
снижением скорости трансмитрального потока крови в диастолу. Ранним признаком
потрясенного миокарда является склонность к аритмии. Его особенностью является
также состояние down
regulation - сниженной
регуляции. Оно характеризуется отсутствием усиления сократимости миокарда в
ответ на повышенную нагрузку, например, на инотропное воздействие. Это связано
с падением адренорецепции в зоне повреждения. Потрясенный миокард находится на
грани сохранения жизни миоцитов, то есть в нем велика угроза развития некроза.
Длительность ишемического повреждения миокарда значительно превышает период
нарушения кровоснабжения.
Изложенные выше данные
позволили обосновать новые положения о процессе развития ИМ:
. Основными причинами,
приводящими к острому ИМ, являются: разрушение атеросклеротической бляшки,
повреждение эндотелия, тромбоз и спазмы поврежденного сосуда.
. Между полной
окклюзией коронарного сосуда и развитием некроза миокарда есть период времени
(т.н. "временное окно") продолжительностью 1-2 часа, когда процесс
полностью обратим, а также отрезок времени, когда он частично обратим (от 2 до
6 часов).
В начале развития
внутрикоронарных изменений показана принципиальная возможность профилактики
развития ИМ или ограничения его размеров путем восстановления кровообращения.
При этом необходимо
осуществлять защиту миокарда от развития и прогрессирования ишемического
повреждения.
Клиническая картина
Основной симптом инфаркта
миокарда - внезапно возникающая резкая боль в области сердца или за грудиной,
которая может иррадиировать в левое плечо, левую лопатку. Боль продолжительная,
не купирующаяся нитроглицерином. Пациент возбужден, недооценивает тяжесть
своего состояния, иногда испытывает страх смерти. На лице у него выступает
холодный пот, отмечается бледность кожных покровов.
Важным признаком инфаркта
миокарда является острая сердечнососудистая недостаточность: резкая слабость,
учащение сердцебиения, понижение артериального давления, нитевидный пульс. При
аускультации выявляется глухость тонов сердца, аритмия.
Инфаркт миокарда, как правило,
сопровождается повышением температуры тела, она может быть высокой или
субфебрильной. Повышение температуры связано с поступлением в кровь продуктов
распада из очага некроза. У лиц старческого возраста температура тела может не
изменяться. В крови отмечаются лейкоцитоз, увеличение СОЭ.
Одним из важных клинических
симптомов инфаркта миокарда является шум трения перикарда, который
обнаруживается при аускультации. Шум трения отмечается при инфаркте миокарда
передней стенки левого желудочка сердца, при котором развивается реактивный
перикардит (этот признак не постоянен).
Окончательно установить диагноз
позволяет электрокардиографическое исследование. При наличии некроза в миокарде
появляется патологический зубец Q,
зубец Т становится отрицательным, сегмент ST
выше изолинии.
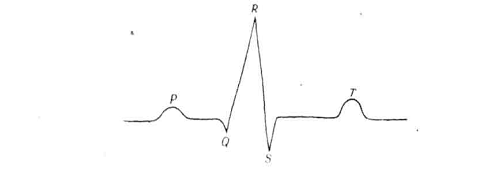
Схема электрокардиограммы в I стандартном
отведении
Схема нормальной ЭКГ. На
рисунке представлена схема типичной электрокардиограммы в I
стандартном отведении, по которой оценивается биоэлектрическая активность
сердца. На ней выделяют зубцы Р и R,
которые всегда направлены кверху, Q
и S, направленные
книзу, и зубец Т, положение которого может меняться. Выделяют также
определенные интервалы: PQ,
отражающий предсердно-желудочковую проводимость, комплекс QRS,
меняющийся при нарушении внутрижелудочковой проводимости, и интервал S-Т,
зависящий от частоты сердечного ритма.
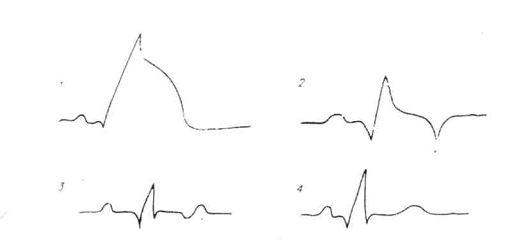
Динамика ЭКГ при инфаркте
миокарда (схема):
- острая фаза (первые часы); 2
- подострая фаза (первые дни); 3 - хроническая фаза (3-6 нед); 4 - фаза
оставшихся рубцовых изменений (несколько месяцев или лет)
При инфаркте миокарда изменения
на ЭКГ зависят от стадии заболевания. В первые дни отмечается изменение
сегмента RS - Т. В
результате зубец R начинает
быстро переходить в зубец Т, благодаря чему эта часть кривой приобретает
изогнутую форму. Указанные нарушения выявляются в отведениях, отражающих зону
расположения инфаркта миокарда. В противоположных отведениях отмечаются
дискордантные изменения, что проявляется выраженным смещением вниз сегмента S
- Т. Обычно через несколько дней появляется патологический зубец Q
или QS, после чего
сегмент S - Т постепенно
смещается к изоэлектрической линии и начинает формироваться сначала двухфазный
(+ -), а затем и отрицательный зубец Т. Максимальной глубины зубец Т достигает
на 3-4-й неделе развития инфаркта миокарда. Одновременно в противоположных
отведениях увеличивается высота положительных зубцов Т (дискордантные
изменения). Через 4-5 нед. начинается обратная динамика инфарктных изменений
ЭКГ. Наиболее долго остаются изменения зубца Q
или QS. Глубокий
зубец Q может выявляться в
течение нескольких месяцев и даже лет после перенесенного инфаркта миокарда.
В течение инфаркта миокарда
выделяются периоды: прединфарктный (нестабильная стенокардия), острейший,
острый, подострый (период рубцевания) и постинфарктный. Кроме того, инфаркт миокарда
может быть рецидивирующий, когда развивается новый участок некроза на фоне еще
протекающего (не зарубцевавшегося) первого. Повторный инфаркт миокарда
возникает после зарубцевавшегося первого. После первого инфаркта миокарда у
пациентов остается склонность к повторному, поэтому так важна профилактика
повторных инфарктов миокарда.
Описанный выше вариант течения
инфаркта миокарда является типичным (ангинозным), но он наблюдается не у всех
пациентов. Могут быть атипичные варианты: периферический и безболевой.
Периферический вариант включает
в себя: гортанно-глоточный (боль типа ангины), верхнепозвоночный (боль в
спине), нижнечелюстной (боль в нижней челюсти, в зубе).
Безболевые варианты: 1)
абдоминальный (локализация боли в эпигастральной области, возможна диарея); 2)
астматический - отек легких вследствие слабости левого желудочка (кашель с
отделением пенистой мокроты, удушье, обилие влажных хрипов в легких); 3)
коллаптоидный (шок без боли - резкая слабость); 4) аритмический; 5)
церебральный (резкая головная боль, возможна потеря сознания); 6)
малосимптомный; 7) отечный и др.
Прогноз острого периода
инфаркта миокарда и его значение для терапии
В ряде исследований [Чазов Е.
И., 1982; Nortis, 1987; Braunwald,
1981 были установлены основные признаки угрозы осложнений и летальности при
инфаркте миокарда. К ним относятся: длительность болевого приступа, размеры ИМ,
наличие и тяжесть аритмий, наличие и степень острых нарушений кровообращения,
наличие сопутствующей патологии (дыхательной недостаточности, сахарного диабета
и т.д.).
По тяжести острого периода ИМ
подразделяют на неосложненную и осложненную формы. Неосложненная форма
характеризуется продолжительностью болевого приступа до трех часов, наличием ИМ
без зубца Q на ЭКГ или
ограниченного ИМ с зубцом Q,
отсутствием тяжелых аритмий, выраженной недостаточности кровообращения и других
осложнений. Больные ИМ, имеющие осложнения, в свою очередь, подразделяются на 2
подгруппы - среднетяжелую и тяжелую. Наиболее прогностически угрожаема тяжелая
подгруппа. Ее основными критериями являются длительность болевого приступа
свыше 6-10 часов, плохая купируемость его медикаментами. Размеры ИМ обычно
большие с вовлечением более одной стенки, чаще наличие ИМ с зубцом Q
на ЭКГ или повторного инфаркта. У большинства лиц выявляются тяжелые формы
аритмий (3-4 степень по Lown);
недостаточность сердца выражается резким снижением его систолической функции
(фракция изгнания составляет менее 30%), наличием дискинезий на
эхокардиограмме. При этом развивается картина кардиогенного шока, отека легких
или их сочетание.
Остальных больных можно отнести
к промежуточной или среднетяжелой группе. Они и составляют большинство всех
больных ИМ (около 60%).
Диагностика инфаркта миокарда
ЭКГ
Если приведенные выше данные
позволяют усомниться в большой ценности ЭКГ для диагностики гипертрофии камер
сердца, то ее значение в распознавании инфаркта миокарда трудно переоценить.
Благодаря своей доступности, простоте, безопасности и высокой информативности
электрокардиограмма остается основным оружием врача при распознавании столь
серьезного и требующего неотложной врачебной помощи заболевания. ЭКГ необходимо
снять как можно быстрее во всех случаях, когда клиническая картина заболевания
вызывает малейшие подозрения на инфаркт миокарда. Все другие методы диагностики,
как инструментальные, так и лабораторные, носят главным образом,
вспомогательный по отношению к ЭКГ характер и применяются, прежде всего, в тех
случаях, когда электрокардиограмма не смогла четко ни подтвердить, ни
отвергнуть диагноз инфаркта миокарда. Что же может затруднить
электрокардиографическое распознавание некроза сердечной мышцы, и как
преодолеть возникающие при этом трудности?
Исходная деформация комплекса QRS.
Электрокардиографическое распознавание инфаркта миокарда затруднено, если у
больного имеются блокада ножек пучка Гиса, синдром WPW,
искусственный водитель ритма или рубцовые изменения после ранее перенесенных
инфарктов, Все эти состояния вызывают изменения формы желудочковых комплексов
на ЭКГ, которые затрудняют распознавание свежих очаговых изменений. Особенно
это относится к блокаде левой ножки пучка Гиса и некоторым вариантам синдромa
WPW, когда изменяется
направление начального вектора деполяризации желудочков. Усилиями врачей
нескольких поколений разрабатывались специальные диагностические признаки,
которые должны были позволить диагностировать инфаркт на фоне деформированных
комплексов QRS. Они
подробно описаны в специальных монографиях. Тем не менее, информативность ЭКГ в
таких ситуациях резко снижается. Падает и специфичность, и чувствительность
метода. Поэтому если блокада ножки пучка Гиса, синдром WPW
зарегистрированы на ЭКГ, снятой после затяжного ангинозного приступа, то
отсутствие каких-либо специальных электрокардиографических признаков,
считающихся характерными для острого инфаркта миокарда, отнюдь не дает врачу
права исключить этот диагноз. Необходимо сравнить ЭКГ с анамнестическими
пленками, проследить динамику ее изменений, а еще лучше прибегнуть к серийному
определению уровня КФК в крови. Более того, если блокада ножки пучка Гиса
впервые выявлена после приступа болей в груди, то этого уже само по себе
достаточно для диагностики инфаркта.
Если электрокардиографическая
диагностика инфаркта миокарда затруднена вследствие имеющегося у больного
синдрома WPW, то можно
провести пробу с аймалином. Внутривенное болюсное введение 50 мг этого
препарата часто позволяет на несколько минут полностью заблокировать проведение
импульса по пучку Кента. Снятая в этот момент ЭКГ позволит распознать инфаркт
миокарда.
Инфаркт в "немых"
зонах миокарда. При снятии ЭКГ в стандартных 12 отведениях в миокарде остаются
участки, поражение которых либо вообще не отражается на ЭКГ, либо отражается
только в виде косвенных реципрокных изменений. К таким "немым" для
обычной ЭКГ зонам относятся, прежде всего, задняя часть межжелудочковой
перегородки, 6азальные отделы задней и передне-боковой стенок левого желудочка,
правый желудочек. Для распознавания этих, локализаций инфаркта необходимо
снимать дополнительные отведения ЭКГ.
Для диагностики
задне-базального инфаркта наиболее ценными являются отведения V7,
V8 V9.
По нашим наблюдениям они информативнее, чем используемые иногда с той же целью
отведения по Небу. Признаками, указывающими на некроз высоких отделов задней
стенки, являются зубец Q
> 1/4 Rv7 и (или) Q
> 1/2 Rv8 в
сочетании с типичной динамикой ST
и Т (в отведении V9 и в норме
зубец Q может превышать по
размерам R1 поэтому
диагностической ценностью в этом отведении обладают только изменения ST
и Т).
Потенциалы правого желудочка
лучше всего отражаются в дополнительных отведениях V3R,
V4R,
Трудность, однако, заключается в том, что изменения в этих отведениях могут
быть обусловлены и некрозами передней части межжелудочковой перегородки,
Поэтому, как показал Н.А. Долгоплоск с соавторами, диагностировать инфаркт
правого желудочка можно лишь в тех случаях, когда «инфарктные» изменения
(патологический Q, подъем
сегмента ST,
отрицательный зубец Т) более выражены в V3R,
V4R,
чем в V1, V2.
Возбуждение задней части
межжелудочковой перегородки не имеет прямого отражения на ЭКГ. Обычно эта
локализация некроза фигурирует в диагнозе, если течение заднего инфаркта
миокарда осложнилось остро возникшей блокадой ножек пучка Гиса. Кроме того, как
показало сопоставление данных ЭКГ с результатами патологоанатомических исследований,
можно уверенно диагностировать распространение некроза на задний отдел
межжелудочковой перегородки и в тех случаях, когда имеются ЭКГ-признаки
инфаркта как задней стенки левого желудочка, так и правого желудочка. Лежащая
между этими отделами сердца задняя часть перегородки неминуемо вовлекается в
некроз.
Электрическая активность
высоких отделов передне-боковой стенки также плохо представлена на обычной
электрокардиограмме. При их изолированном поражении инфарктные изменения будут
выявляться либо только в отведении aVL,
либо ЭКГ вообще останется неизмененной, Лучше всего инфаркты миокарда такой
локализации отражаются в грудных отведениях, снятых на два межреберья выше
обычного уровня.
Когда же надо снимать
дополнительные отведения ЭКГ? Во-первых, в тех случаях, когда после затяжного
ангинозного приступа в обычных отведениях изменения отсутствуют. Чтобы не
пропустить инфаркт, необходимо такому больному снять и правые грудные
отведения, и V7, V8,
V9, и грудные
отведения на два межреберья выше. Во-вторых, нужда в дополнительных отведениях
возникает нередко и в тех случаях, когда стандартная ЭКГ подтверждает сам факт
наличия инфаркта миокарда, но требуется уточнить его истинные размеры. Прежде
всего это относится к пациентам с задне-диафрагмальным инфарктом миокарда.
Поражение этой стенки достаточно четко выявляется в отведениях II,
III, aVF.
Часто таким заключением и удовлетворяются. Диагноз поставлен, однако у этих
больных инфаркт нередко распространяется и на задне-базальную стенку, и на
правый желудочек. Это легко объяснить общим источником кровоснабжения: все
перечисленные участки миокарда кровоснабжаются из правой коронарной артерии.
Поэтому инфарктные изменения II,
III, aVF,
указывающие на окклюзию именно этого сосуда, всегда требуют уточнить, что
происходит а других зонах миокарда, получающих кровь из того же источника.
Проще всего это сделать, сняв отведения V7
,V8 ,V9,
V3R,
V4R.
Показанием к расположению
грудных электродов на два межреберья выше, чем обычно, являются изолированные
инфарктные изменения в отведении aVL.
Это позволит установить истинные размеры поражения высоких отделов
передне-боковой стенки левого желудочка.
Нередко в клинической практике
удобно прибегать к съемке грудных отведений, наоборот, на два межреберья ниже
стандартных точек. Об этом приеме стоит помнить, когда речь идет о диагностике
инфаркта миокарда у больного с выраженной эмфиземой легких. В этом случае
сердце смещается вместе с диафрагмой вниз, и стандартное расположение
электродов приводит к тому, что они оказываются выше необходимого уровня.
Сместив электроды вниз, мы получим просто нормальную запись грудных отведений
относительно новой позиции сердца.
Поздняя динамика ЭКГ.
Предположим, что у больного, доставленного в больницу после тяжелого
ангинозного приступа, изменений, характерных для инфаркта миокарда, на
стандартной ЭКГ не оказалось. Сняли указанные выше дополнительные отведения.
Электрокардиографических признаков инфаркта выявить все равно не удалось.
Однако можно совершить ошибку, если после этого сразу сделать вывод, что у
больного инфаркта миокарда нет. Возможно, что мы столкнулись с одной из самых
коварных ситуаций, возникающих при распознавании острого некроза сердечной
мышцы, - с так называемой поздней динамикой ЭКГ. По данным литературы, ЭКГ,
снятая сразу после болевого приступа, может оказаться нормальной примерно у 20%
больных с доказанным впоследствии инфарктом миокарда. В большинстве случаев
инфарктные изменения удается выявить в дальнейшем при контроле ЭКГ в динамике.
Причины отсроченного возникновения электрокардиографических изменений остаются
непонятными, но сам факт сомнений не вызывает, и из него следует чрезвычайно
важный практический вывод: если клиническая картина указывает на острый инфаркт
миокарда, а снятая сразу после приступа ЭКГ, включая дополнительные отведения,
осталась нормальной, то мы все равно не можем исключить этот диагноз. Если нет
возможности определить в крови уровень КФК, а еще лучше ее МВ-фракции, то
необходимо контролировать динамику ЭКГ хотя бы в течение 24 - 48 часов.
Передне-задний инфаркт
миокарда. Как уже говорилось выше, электрокардиографическая диагностика острого
инфаркта миокарда затруднена у больных, ранее перенесших некроз сердечной
мышцы. Рубцовые изменения после предыдущего инфаркта могут нивелировать
электрокардиографические признаки нового, особенно когда они располагаются на
противоположных стенках. Тем не менее, характерная динамика конечной части
желудочкового комплекса и, особенно, сравнение с анамнестическими
электрокардиограммами обычно позволяет поставить правильный диагноз. Однако,
если предшествующий инфаркт осложнился развитием хронической аневризмы сердца с
длительно сохраняющимся подъемом сегмента ST,
то разобраться в ситуации часто можно только с учетом клинических данных и
результатов определения КФК в крови. Помочь иногда может гот факт, что подъем
сегмента ST, связанный
с развитием хронической аневризмы сердца, наблюдается, как правило, только в
тех отведениях, где комплекс QRS
представлен зубцом OS
или, по крайней мере, очень глубоким патологическим Q
и маленьким R. Подъем же ST
в отведениях, где зубец R
сохраняет достаточную амплитуду, обычно указывает на свежие изменения.
У пациента, перенесшего
крупноочаговый инфаркт миокарда, резкая нормализация ЭКГ с исчезновением
патологического зубца Q,
отражавшего старые рубцовые изменения, особенно если подобное
"улучшение" произошло после ангинозного приступа, должна не радовать
лечащего врача, а наоборот - крайне насторожить его. Именно такая динамика ЭКГ
характерна для повторного инфаркта, возникшего на противоположной стенке левого
желудочка. Как известно, патологический зубец Q
со временем может уменьшаться в размерах, что связывают с компенсаторной
гипертрофией окружающих рубцовое поле миокардиальных волокон, на которые падает
повышенная нагрузка. Однако происходит это всегда очень медленно. Внезапное же
исчезновение зубца Q, да еще
после тяжелого болевого приступа, обычно можно объяснить только свежим некрозом
на противоположной стенке желудочка. Учитывая важную роль анамнестической ЭКГ в
постановке диагноза, мы всегда рекомендуем нашим больным, особенно перенесшим
инфаркт миокарда, иметь хотя бы одну электрокардиограмму при себе, а не сдавать
все в поликлинику, где они будут аккуратно подклеены в амбулаторную карту.
Гораздо сложнее поставить
диагноз в тех, к счастью редких, случаях, когда у пациента одновременно
возникает острый инфаркт и в передней, и в задней стенке левого желудочка.
Такой вариант наблюдается редко, поскольку передняя и задняя стенки левого
желудочка имеют разные источники кровоснабжения (соответственно левую и правую
коронарные артерии). Острый передне-задний инфаркт развивается обычно, когда
медленно растущая атероскеротическая бляшка практически полностью перекрывает
просвет одной из коронарных артерий, но вследствие того, что окклюзирование
происходило медленно и успели развиться мощные коллатерали, инфаркта не
происходит. Однако достаточно образоваться тромбу во второй артерии,
сохранявшей проходимость, как некроз охватит не только бассейн ее
непосредственного кровоснабжения, но и область, которую она снабжала кровью по
коллатералям. Такое действительно встречается нечасто, но создает большие
диагностические трудности. В этих случаях происходит взаимная нивелировка как
зубцов Q, так и изменений
конечной части желудочкового комплекса. В принципе, глядя на любую совершенно
нормальную ЭКГ, можно сказать, что у больного имеется симметричный
передне-задний инфаркт миокарда с полной взаимной нивелировкой, и чисто
электрокардиографическими методами такое заявление опровергнуть не удастся. По
нашим наблюдениям даже при чрезвычайно обширных передне-задних инфарктах
миокарда изменения ЭКГ нередко ограничивались только незначительной депрессией
сегмента ST в грудных
отведениях. Не поможет в этом случае и сравнение с анамнестическими пленками.
Ключом к диагнозу обычно служит клиническая картина. Гибель большой массы
миокарда, неизбежная при таком распространенном некрозе, закономерно ведет к
недостаточности кровообращения. Сочетание ангинозного приступа с развитием
кардиогенного шока или отека легких при нормальной или только незначительно
измененной ЭКГ сразу должно вызвать подозрение на развитие обширного
передне-заднего инфаркта миокарда. Подтвержден этот диагноз будет резким
повышением в крови уровня КФК или миоглобина, в спорных случаях целесообразно провести
эхокардиографическое исследование, а при необходимости - сцинтиграфию миокарда.
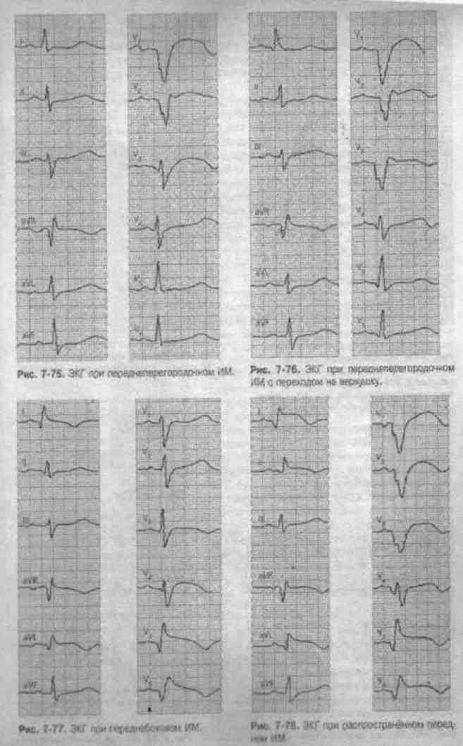
Рис.7.75. ЭКГ при Рис.
7-76. ЭКГ при
переднеперегородочном ИМ
переднеперегородочном ИМ
с переходом на верхушку

Рис.7-77. ЭКГ при Рис.7-78.
ЭКГ при
переднебоковом ИМ
распространенном переднем ИМ
Лабораторная диагностика
острого инфаркта миокарда
На фоне успешного развития
электрокардиографии лабораторные методы долго играли весьма скромную роль в
диагностике инфаркта миокарда. Давно известное врачам повышение в крови больных
с инфарктом количества лейкоцитов и увеличение СОЭ слишком неспецифичны, чтобы
на них строить диагностическое заключение. Интерес к возможности лабораторной
диагностики некроза сердечной мышцы увеличился после того, как в 50-х годах
было установлено, что крови больных с острым инфарктом миокарда закономерно
повышается уровень аспартатаминотрансферазы (ACT)
- фермента, содержащегося в кардиомиоцитах и попадающего в кровоток после их
гибели. Однако ACT,
к сожалению, также оказалась малоспецифичным маркером некроза именно миокарда.
Этот фермент содержится почти во всех тканях организма и, соответственно,
повышается при самых разных заболеваниях, в том числе и тех, которые требуют
дифференциальной диагностики с инфарктом миокарда, - тромбоэмболии легочной
артерии, расслаивающей аневризме аорты, заболеваниях поджелудочной железы,
печени и т.д. Единственным, пожалуй, исключением были ситуации, когда надо было
дифференцировать инфаркт миокарда с затяжным приступом стенокардии. Но здесь
возникали проблемы в связи с тем, что ACT
начинает повышаться в крови только через 8-2 часов после развития некроза. В
настоящее время ACT
уже редко используется для диагностики инфаркта миокарда. Стандартным методом
стало определение в крови больных с подозрением на некроз сердечной мышцы
гораздо более специфичной креатинфосфокиназы, а если пациент был доставлен в
стационар лишь через несколько дней после болевого приступа - лактатдегидрогеназы.
Еще более специфичным для инфаркта миокарда является повышение активности
особых разновидностей этих энзимов, обозначаемых как МВ-КФК и ЛДГ1. Для ранней
диагностики инфаркта миокарда с известными оговорками используется и
определение концентрации миоглобина в крови. Обсудим клиническое значение
каждого из этик маркеров гибели кардиомиоцитов подробнее.
Креатинфосфокиназа (КФК) -
фермент, содержащийся, главным образом, в миокарде, скелетных мышцах, головном
мозге и щитовидной железе. При развитии инфаркта миокарда повышение активности
КФК в крови отмечается обычно через 6 - 8 часов после начала болевого приступа
и достигает максимума в среднем к концу первых суток заболевания. На 2-3-й день
инфаркта активность КФК часто возвращается к норме, хотя при обширных инфарктах
может держаться и дольше. Описаны редкие случаи, главным образом у пожилых
больных, когда активность КФК остается повышенной в течение нескольких недель.
Столь необычный феномен
связывают с формированием иммунных комплексов КФК с иммуноглобулином G,
в которых фермент сохраняет свою активность.
Повышение активности КФК в
крови определяется практически у всех больных с острым инфарктом миокарда.
Случаи, когда она оставалась нормальной при доказанном впоследствии некрозе
сердечной мышцы, в большинстве своем обусловлены несвоевременным взятием крови
на анализ. Следует учитывать, что в большинстве случаев КФК существенно
повышается, как говорилось выше, только через 6-8 часов после ангинозного
приступа. Частота ложно-отрицательных ответов при однократном обследовании в
первые 8 часов заболевания может достигать 30%. Необходимо определять
активность КФК при поступлении больного в стационар и затем еще по крайней мере
2 - 3 раза с интервалом в 8 - 12 часов. В последующем анализ повторяют в случаях
повторения болей сразу и через 12 и 24 часа после каждого затяжного ангинозного
приступа, чтобы не пропустить рецидива инфаркта.
Отсутствие значимой
концентрации КФК в других внутренних органах, кроме сердца, резко повышает
специфичность этого анализа по сравнению с определением активности ACT.
Тем не менее, количество
ложно-положительных результатов, по данным литературы, может достигать 15%. Это
связано с тем, что, помимо острого инфаркта миокарда, существенное повышение
активности КФК в крови отмечается при травмах и заболеваниях скелетных мышц,
включая судороги и длительную иммобилизацию, инсультах, гипотиреозе,
некоронарогенных заболеваниях миокарда. Описано также повышение КФК в крови при
алкогольной интоксикации, сахарном диабете, хирургических операциях и в
некоторых случаях при тромбоэмболии легочной артерии. Чрезвычайно важно, что
после самых обычных внутримышечных инъекций, без которых до больниц добирается
редкий больной с инфарктом миокарда, активность КФК в крови может увеличиться в
2 - 3 раза.
В большинстве случаев ошибки
можно избежать, если учитывать два обстоятельства. Во-первых, при всех
вышеперечисленных состояниях содержание КФК в крови обычно повышается не более
чем в 2 - 3 раза, в то время как при остром инфаркте миокарда в большинстве
случаев отмечается увеличение в 10 - 20 раз и больше по сравнению с нормальным
уровнем. Если столь высокая концентрация КФК будет обусловлена, например,
поражением скелетных мышц, то последнее будет настолько массивным, что
распознать его клинически не составит труда. Во-вторых, никогда нельзя ставить
диагноз только по результатам лабораторного исследования, пусть даже и такого
чувствительного, как определение активности КФК. Об инфаркте миокарда можно
уверенно говорить только в тех случаях, когда повышение уровня КФК сочетается с
теми или иными клиническими и (или) электрокардиографическими признаками, также
указывающими на некроз сердечной мышцы.
В сомнительных случаях, когда,
к примеру, активность КФК повышена незначительно, при стертой клинической картине
заболевания и неизвестно когда возникшей блокаде ножки пучка Гиса на ЭКГ,
целесообразно прибегнуть к определению в крови изофермента КФК - MB-КФК.
В отличие от других разновидностей КФК (ВВ-фракции, содержащейся, главным
образом, а мозге, и ММ-фракции, выделяемой из скелетных мышц), МВ-КФК в
значительной концентрации присутствует практически только в миокарде. В
клинической практике считается поэтому, что повышение в крови активности МВ-КФК
указывает на поражение именно сердечной мышцы.
Тем не менее специфичность даже
этого анализа не является абсолютной. Описано повышение MB-КФК
после очень тяжелых физических нагрузок у профессиональных спортсменов, а также
после хирургических операций на тонком кишечнике, матке, предстательной железе,
диафрагме, в которых этот изофермент содержится в незначительных количествах.
На специфичность анализа влияет и методика определения - наиболее
чувствительным является радиоиммунный метод, в то время как широко используемый
метод электрофореза чаще дает ложно-положительные результаты. Естественно, что
активность МВ-КФК будет повышаться не только при инфаркте, но и при
некоронарогенных повреждениях сердечной мышцы - миокардитах, операциях на
сердце, электроимпульсной терапии. Таким образом, хотя повышенная активность
МВ-КФК и является достаточно специфичным лабораторным признаком острого
инфаркта миокарда, диагностическое заключение все равно должно строиться с
обязательным учетом клинической и электрокардиографической картины заболевания
и никогда не может быть основано только на результатах биохимического
исследования. Главным достоинством этого анализа является не то, что он
позволяет поставить диагноз острого инфаркта миокарда, не выходя из
лаборатории, а то, что все остальные причины повышения активности МВ-КФК в крови
можно достаточно просто исключить с помощью анамнеза и простейшего клинического
обследования.
Определение активности МВ-КФК в
крови следует проводить в те же сроки, что и для обшей КФК, и прежде всего в
тех случаях, когда у больного с подозрением на острый инфаркт миокарда имеются
признаки поражения скелетных мышц или головного мозга, которые сами по себе
могут вызвать появление КФК в крови, либо когда активность последней повышена
незначительно или даже остается нормальной, несмотря на клинические и (или) ЭКГ-признаки
инфаркта миокарда. Последнее обстоятельство особенно важно, так как имеются
данные, что у больных с острым инфарктом миокарда повышенная активность МВ-КФК
может определяться даже при нормальной общей активности КФК,
В большинстве клиник мира определение
КФК и МВ-КФК стало стандартным обследованием даже для тех пациентов, у которых
диагноз инфаркта миокарда не вызывает сомнения по данным клиники и ЭКГ. Это
объясняется тем, что степень повышения их активности в крови коррелирует с
размерами инфаркта миокарда и позволяет оценить опасность тяжелых нарушений
гемодинамики и прогноз в целом, что очень важно для правильной тактики ведения
больного. Следует только иметь в виду, что размеры инфаркта коррелируют не с
максимальным значением активности КФК и МВ-КФК в крови, а с их общим
количеством, попавшим в кровоток. Рассчитать этот показатель можно по
специальным формулам, исходя из результатов серии анализов. Более того, если
больному проводилась тромболитическая терапия, то динамика изменения активности
КФК в крови может быть использована как один из лучших показателей успешности
или неэффективности предпринятой попытки восстановить проходимость коронарной
артерии. Реперфузия приводит к вымыванию клеточного детрита из зоны инфаркта,
что обуславливает резкий и значительный подъем активности КФК в крови в первые
часы после процедуры с последующим быстрым снижением до нормального уровня.
Лактатдегидрогеназа (ЛДГ).
Содержание КФК и МВ-КФК в крови возвращается к норме часто уже на 2 - 3 день
острого инфаркта миокарда. Поэтому, если пациент поступал в клинику позже этого
срока, то для уточнения диагноза прибегают обычно к определению активности
другого фермента - лактатдегидрогеназы. Активность ЛДГ в крови повышается
значительно позже, чем КФК, - только через 24 - 48 часов после развития
некроза, достигает максимальных значений обычно на 3 - 6 день заболевания и
возвращается к норме через 1 - 2 недели. Однако определение общей активности
ЛДГ оказалось хотя и чувствительным, но малоспецифичным признаком гибели кардиомиоцитов.
Она повышается в крови при гемолизе, мегалобластической анемии, лейкозах,
злокачественных новообразованиях, заболеваниях печени и почек, недостаточности
кровообращения (в связи с застойной гепатомегалией), тромбоэмболии легочной
артерии, поражениях скелетных мышц. Чрезвычайно ценным, также как в случае с
КФК, оказалось то обстоятельство, что специфичность анализа можно значительно
повысить, если раздельно определять активность различных изоферментов ЛДГ.
Таких изоферментов известно пять.
Сердце содержит главным образом
ЛДГ1, в то время как другие внутренние органы и скелетные мышцы - остальные
четыре фракции (ЛДГ2 -ЛДГ5) Определение ЛДГ 1 и особенно отношения активности
ЛДГ1 и ЛДГ2 (повышение этого отношения до величины: более 1 является важным диагностическим
признаком) повышает специфичность и чувствительность исследования для
распознавания инфаркта миокарда более чем до 90%. Тем не менее, следует
учитывать, что ЛДГ1, как и MB-КФК,
будет повышаться при любых поражениях миокарда, в том числе и некоронарогенных.
Кроме того, активность этого изофермента в плазме повышается при гемолизе,
которого необходимо избежать при взятии крови на анализ, Особенностью ЛДП
является также то, что ее активность повышается в крови раньше, чем общая
активность ЛДГ - иногда уже через 8 - 24 часа после приступа.
Таким образом, пациентам,
поступившим в клинику с подозрением на инфаркт миокарда давностью более суток,
при нормальном уровне КФК и МВ-КФК в крови для уточнения диагноза показано
определение активности ЛДГ, а еще лучше ее изоферментов.
В последние годы для
диагностики острого инфаркта миокарда довольно широко использовалось
определение в крови концентрации миоглобина, Миоглобин - это белок,
осуществляющий внутриклеточный транспорт кислорода. Он содержится и в миокарде,
и в скелетной мускулатуре, т.е. его специфичность для диагностики острого
инфаркта примерно такая же, как КФК, но ниже, чем МВ-КФК. Также, как КФК,
уровень миоглобина может повышаться в 2 - 3 раза после внутримышечных инъекций,
и диагностически значимым обычно считают повышение в 10 и более раз. Подъем
уровня миоглобина в крови начинается даже раньше, чем повышение активности КФК
Диагностически значимый уровень зачастую достигается уже через 4 часа и в
подавляющем большинстве случаев наблюдается через 6 часов после болевого
приступа. Однако держится высокая концентрация миоглобина в крови очень недолго
- всего несколько часов. Маленькая молекулярная масса, гораздо меньшая, чем у
КФК и других ферментов, позволяет миоглобину легко проходить через клубочковую
мембрану, что приводит к быстрому падению его концентрации в плазме. Поэтому
нормальные результаты определения уровня миоглобина в крови отнюдь не исключают
острого инфаркта миокарда. Достаточно просто, особенно если не повторять анализ
каждые 2 - 3 часа, пропустить пик его концентрации. В этом диагностическая
ценность определения миоглобина значительно уступает измерению активности КФК.
Не удалось, в отличие от КФК выявить и взаимосвязь между степенью повышения
концентрации миоглобина и размерами инфаркта миокарда. Таким образом,
определение уровня миоглобина в крови по своей диагностической значимости
уступает анализам, выявляющим активность КФК, а тем более МВ-КФК. Единственно,
когда можно отдать предпочтение измерению концентрации миоглобина, это случаи
поступления больных в стационар менее чем через 6 - 8 часов после начала
болевого приступа. Но и этот вопрос нуждается в дальнейшем изучении. Зато уже
сейчас, вероятно, можно сделать заключение о нецелесообразности измерения
концентрации миоглобина в моче, так как показано, что при высокой
концентрационной способности почек его концентрация в моче может быть высокой и
у абсолютно здоровых людей.
Если увлечение миоглобином
проходит, то определение содержания в крови тропонина-Т и тропонина-1 (изоформ
сократительного белка тропонииа) все более широко используется как в научных,
так и в клинических целях. Эти изоформы высокоспецифичны именно для миокарда.
Их чувствительность настолько велика, что даже затрудняет клиническую
интерпретацию результатов анализа. Показано, что миокардиальные изоформы
тропонина повышаются не только при инфаркте миокарда, но и при нестабильной
стенокардии. В то же время отсутствие повышения в серии заборов крови
тропонина-Т или I достаточно
надежно исключает кардиальную патологию.
Как говорилось в начале данного
раздела, определения активности ACT,
числа лейкоцитов и скорости оседания эритроцитов в настоящее время практически
уже не должны использоваться для диагностики острого инфаркта миокарда в силу
крайне низкой специфичности этих показателей. Однако контроль числа лейкоцитов
и СОЭ чрезвычайно важен для своевременного распознавания инфекционных или
аутоиммунных осложнений в течение инфаркта миокарда.
Лейкоцитоз при остром
неосложненном инфаркте миокарда появляется уже через 2-3 часа после начала
ангинозного приступа, нарастает в течение 2-4 дней, а к 5 - 7 дню количество
лейкоцитов обычно нормализуется. Характерным считается небольшой сдвиг
лейкоцитарной формулы влево и отсутствие в крови эозинофилов. Признаками,
указывающими на то, что течение самого инфаркта миокарда, вероятно, осложнилось
каким-либо воспалительным процессом, можно считать количество лейкоцитов в
крови более 20 - 25 тыс /мм3 с резким сдвигом формулы влево и (или) сохранение
повышенного количества белых кровяных клеток более 1 недели после ангинозного
приступа.
Повышение СОЭ отражает
происходящее при любой некротически-воспалительной реакции изменение белкового
спектра крови, в частности альфа-2 глобулина и фибриногена,. СОЭ начинает
повышаться значительно позднее повышения количества лейкоцитов (обычно только
на 4 - 5-й день), что приводит к известному симптому "ножниц" - СОЭ
еще только нарастает, а лейкоцитоз уже снижается. При неосложненном течении
инфаркта миокарда величина СОЭ редко превышает 30 - 35 мм/ч и может держаться
достаточно долго - 2 - 3 недели. Очень высокое и длительно сохраняющееся СОЭ,
наряду с эозинофилией, характерно для осложняющего течение инфаркта миокарда
синдрома Дресслера.
Обобщая данные различных
авторов, изучавших вопросы лабораторной диагностики острого инфаркта миокарда,
можно предложить следующие практические рекомендации относительно использования
рассмотренных методов.
· У пациентов, поступивших в
течение первых 24 часов после ангинозного приступа, производится определение
активности КФК в крови. Это следует делать даже в тех случаях, когда по
клиническим и электрокардиографическим данным диагноз инфаркта миокарда не
вызывает сомнения, так как степень повышения активности КФК информирует врача о
размерах инфаркта миокарда и прогнозе.
· Если активность КФК
находится в пределах нормы или повышена незначительно (в 2 - 3 раза), либо у
пациента имеются явные признаки поражения скелетной мускулатуры или головного
мозга, то для уточнения диагноза показано определение активности МВ-КФК.
· Нормальные величины
активности КФК и МВ-КФК, полученные при однократном заборе крови в момент
поступления больного в клинику, недостаточны для исключения диагноза острого
инфаркта миокарда. Анализ необходимо повторить хотя бы еще 2 раза через 12 и 24
часа.
· Если ангинозные
боли повторяются у больного после госпитализации, то рекомендуется измерять КФК
и МВ-КФК сразу после приступа и через 12 и 24 часа.
· Миоглобин в крови целесообразно
определять только в первые часы после болевого приступа. Повышение его уровня в
10 раз и больше указывает на некроз мышечных клеток, однако нормальный уровень
миоглобина отнюдь не исключает инфаркта.
· Определение ферментов
нецелесообразно у бессимптомных больных с нормальной ЭКГ. Диагноз на основании
одной только гиперферментемии ставить все равно нельзя - должны быть
клинические и (или) электрокардиографические признаки, указывающие на
возможность инфаркта миокарда.
· Контроль количества
лейкоцитов и величины СОЭ необходимо проводить при поступлении пациента и затем
не реже 1 раза в неделю, чтобы не пропустить инфекционные или аутоиммунные
осложнения острого инфаркта миокарда.
инфаркт миокарда внутрикоронарный
Лечение
На догоспитальном этапе важно
провести неотложные и реанимационные мероприятия, купировать боль,
ликвидировать тяжелые нарушения ритма, острой недостаточности кровообращения,
правильно транспортировать пациента в стационар.
В острый период предписывают
строгий постельный режим, назначают диету с исключением продуктов,
способствующих метеоризму. В это время пациенту можно придавать пассивное
положение полусидя, приподнимая головной конец кровати. Довольно рано можно
назначать лечебную гимнастику. Очень важно вселить уверенность в положительном
исходе болезни, в чем немаловажная роль принадлежит медицинской сестре.
Во всех случаях при инфаркте
миокарда в первую очередь ликвидируют болевой приступ, проводят борьбу с острой
сердечнососудистой недостаточностью. Болевой приступ купируют препаратами
группы опиатов: промедола - 1-2 мл 1-2% раствора с изотоническим раствором натрия
хлорида в/в. Для усиления анальгетических свойств его вводят вместе с
препаратами, потенцирующими его действие (1 мл 2,5% раствора аминазина;
антигистаминные препараты: 1 мл 1% раствора димедрола или 2 мл 2% раствора
супрастина; анальгетики: 2 мл 50% раствора анальгина). Растворы вводятся
изолированно, не в смеси. Если АД не менее 100/60 мм рт. ст., начать помощь
надо с сублингвального приема нитроглицерина 1-2 таблетки, каждые 2-3 минуты до
уменьшения боли. В стационаре нитроглицерин вводится внутривенно капельно.
Для купирования болевого
приступа применяют метод нейролептанальгезии. Этот метод представляет собой
общую анастезию, достигаемую при внутривенном введении сильного анальгетика
фентанила и нейролептика дроперидола.
В первые дни заболевания желательно
давать больным кислород со скоростью 2-6 л. в мин., так как артериальная
гипоксемия выражена почти во всех случаях.
С целью повышения артериального
давления вводят мезатон, кофеин, кордиамин, преднизолон. При резком понижении
артериального давления внутривенно капельно вводят адреналин, норадреналин.
Кроме основных, известных,
принципов неотложной терапии острого ИМ, в настоящее время его лечение включает
методы, ограничивающие размеры ИМ. Такая стратегия лечения основывается на
наличии временного "окна", на протяжении которого при восстановлении
кровотока возможна полная реституция миокарда; она включает также защиту
миокарда как в зоне ишемического повреждения, так и в зоне "риска",
которая может быть источником осложнений и продолжающегося развития инфаркта.
Современная лечебная стратегия
в ранние сроки развития ИМ прежде всего предусматривает реперфузию
окклюзированной КА. Это осуществляется методами тромболизисаи чрескожной
внутрикоронарной ангиопластики.
Реперфузия (реваскуляризация)
осуществляется введением средств, лизирующих тромбы (препараты «первого
эшелона»), в сочетании с медикаментами, обуславливающими снижение агрегации
тромбоцитов, предотвращающими новые тромбозы (гепариниаспирин- препараты
"второго эшелона").
Не менее важным является устранение
важнейшего патогенетического фактора - спазма поврежденных коронарных артерий,
что в свою очередь осуществляется длительным введением коронароактивных
препаратов. Необходимо также и улучшение периферического кровотока.
На базе крупных международных
исследований, проводившихся в строго стандартизированных условиях, разработана
методика проведения реперфузии. Важной ее составной частью является
тромболизис.
Тромболизис может проводиться
внутривенно или внутрикоронарно. Введение препаратов в вену обычно не позволяет
полностью обеспечить их достаточную концентрацию в зоне коронарного тромба.
Внутрикоронарный же лизис возможен лишь под прямым контролем коронарографии,
определяющей и место введения препарата, и контроль его эффективности. Успех
раннего (1-1,5 часа) тромболизиса очень высок. Непосредственно во время
процедуры как правило исчезают боли, ЭКГ-нарушения, состояние коллапса.
Показаниям к реперфузии служат:
1) стенокардические боли длительностью 20-30 минут, не купирующиеся
нитроглицерином; 2) появление на ЭКГ патологического зубца (или повышение
ВТ-сегмента на 2 мм не менее чем в двух отведениях (iI-l’
и аУР при диафрагмальном поражении; двух прекорнальных или I
и аУ1 при переднем); 3) длительность острых нарушений не более 4-6 часов; 4)
возраст больных не старше 75 лет.
К противопоказаниям относятся:
1) длительность болевого приступа свыше б часов; 2) возраст больных старше 75
лет; 3) артериальная гипертензия более 190/110 мм рт. ст.; 4) Мозговой инсульт,
перенесенный в сроки ближе 4 месяцев; 5) Злокачественные новообразования,
полипы; 6) Повышенная кровоточивость; 7) Наличие беременности.
Для тромболизиса применяются
препараты группы стрептокиназ. Приводим схему тромболизиса одним из наиболее
активных препаратов - целиазой. Она применяется внутривенно капельно или
внутрикоронарно. Препарат перед введением растворяется в изотоническом растворе
хлористого натрия или 5% глюкозе, затем вводится внутривенно в дозе 3 млн ВД в
течение 18-24 часов. Предварительно делается инъекция преднизалона (60 мг). Начальная
скорость введения целиазы 30 капель в 1 мин, затем замедляется до 15 капель в
мин.
Внутрикоронарно медленно
вводится до 500 ЕД.
Сразу после введения целиазы
начинаются инъекции гепарина в суточной дозе 20 тыс. ЕД, а затем назначается
аспирин.
В последние годы наиболее
эффективным из фибринолитиков признан тканевый активатор плазминогена.
У части больных, леченных
фибринолитиками (до 20%) на протяжении 2-3 суток развивается ретромбоз. Вновь
появляются клинические ЭКГ-признаки окклюзии коронаров. Иногда при этом
приходится осуществлять повторный тромболизис или проводить хирургическое
лечение.
Для профилактики ретромбоза
используют средства, влияющие на тромбообразование, особенно на агрегацию
тромбоцитов. Из них эффективным является применение гепарина в виде непрерывной
или прерывистой инфузий в дозах примерно 20-25 тысяч ЕД в сутки, а также малые
дозы аспирина (160 мг сутки).
Грозным осложнением тромболиза
является развитие реперфузионного Синдрома (PC).
Сущность реперфузионного
синдрома заключается в том, что при восстановлении коронарного кровообращения
патологические продукты нарушенного метаболизма миокарда и вазоконстриктивные
вещества из резко поврежденных областей устремляются в соседние с ними
малоповрежденные и нормальные зоны. Реперфузионный синдром разной степени
выраженности развивается тогда, когда восстановление кровообращения проведено в
сроки более 60-120 минут от обтурации КА. Все его проявления соответствуют
клинике "потрясенного" миокарда, при этом более легкими из них являются
кратковременные аритмии.
Кроме тромболизиса применяется
операция чрескожно внутрикоронарной ангиопластики: Суть ее заключается в прямом
расширении просвета сосуда в месте сужения. Операция проводится механическим
или лазерным инструментом, вводимым в суженый сосуд через катетер. Она может
быть высокоэффективна и тогда, когда тромболизис невозможен или не удается
полностью, сосуд резко сужен. Эффективна ангиопластика при сужении 1-2 крупных
сосудов.
Проведение чрескожной
внутрикоронарной ангиопластики встречает ряд трудностей. Часть их идентична
вышеописанным, часть обусловлена техническими трудностями (травма стенки
сосуда).
Решение проблемы полной
ликвидации последствий коронарного тромбоза, то есть профилактики ИМ, возможно
только в зоне "временного окна" длительностью менее 2 часов.
В случае диагностики ИМ в сроки
от двух до пяти-шести часов от появления его первых признаков стратегия терапии
изменяется. Тромболизис и ангиопластика в этом «временном окне» не могут
полностью восстановить миокард. В центре зоны с нарушенным кровоснабжением уже
образовался некроз. Однако его размеры могут этим и ограничиться, если не
допустить распространения некроза на зону "риска", то есть область
поврежденного миокарда, путем ангиопластики и тромболизиса.
Основными задачами лечения ИМ в
этот период являются: ограничение зоны некроза, защита поврежденного миокарда,
лечение осложнений.
Прямой тромболизис и
аннгиопластика показаны и в эти сроки, так как возможна частичная
реваскуляризация краевой зоны. Большое значение приобретают антикоакулянты типа
гепарина и аспирина, которые позволяют уменьшить опасность дальнейшего
тромбообразования и тромбоэмболии. Эти препараты (г е п а р и н на протяжении
5-7 дней, аспирин в малых дозах - до 0,3 грамма в сутки) содействуют
дезагрегации тромбоцитов, улучшению реологии крови.
Снятие спазмов КА в этот период
также играет важную роль. Для защиты поврежденного миокарда, а также в случае
реперфузионного синдрома важно улучшение метаболизма миокарда, в частности,
снижения уровня свободных радикалов, перекисных соединений. Этой цели служит
применение антиоксидантов глютамина, гутимина, токоферола, цитохрома С,
каталазы, аллопуринола. Они эффективны при применении до начала вмешательства.
Снижение уровня свободных
радикалов приводит к повышению синтеза макроэргов, восстановлению функции
миокарда.
Защите миокарда способствует и
применение кортикостероицов: они нормализуют состояние клеточных мембран. Их
противовоспалительное действие снижает лейкоцитарный лизис миоцитов, улучшается
реология крови, что способствует снятию периферического блока.
Существенным направлением
защиты миокарда является снижение нагрузки на сердце. Этой цели способствует
длительное перманентное введение нитратов внутривенно не менее 24 часов, затем
интрадермально и внутрь.
К препаратам, снижающим пред- и
постнагрузку, относятся также антагонисты кальция. При этом следует обращать
внимание на то, какой будет частота сердечных сокращений при их введении,
тахикардия усиливает работу сердца и потребность в кислороде в связи со вторичной
стимуляцией симпатического отдела вегетативной нервной системы. Поэтому
соответственно индивидуальным особенностям пациента назначают верапамил или
дилтиазем. Применение нифедипина в первые дни требует осторожности в связи с
возможностью усиления работы сердца.
Сейчас разработаны новые, более
высокоэффективные антагонисты кальция, производные дигидропиридина - фелодипин
и амплодипин, не вызывающие тахикардии. Антагонисты кальция являются
кардиопротекторами благодаря выведению из действия ионов кальция, разгрузке
сердца, улучшению коронарного кровотока, снятию спазмов КА.
Методом наилучшей защиты
миокарда многие авторы считают применение блокаторов бета-адренергических
рецепторов (бета-блокаторов).
Их действие осуществляется за
счет снижения потребления кислорода миокардом. Кроме прямого тормозящего
влияния на сократимость сердца, они понижают артериальное давление и урезают
частоту сердечных сокращений, уменьшают адренергические влияния. В
экспериментах показано, что бета-блокаторы (ББ) селективно увеличивают
субэндокардиапьный кровоток, что очень существенно для ишемизированного сердца.
Подавление адренергического эффекта также способствует нормализации метаболизма
жирных кислот, что способствует повышению синтеза АТФ. Кроме того, ББ тормозят
агрегацию тромбоцитов.
Таким образом, применение ББ
полностью обосновано в остром периоде ИМ, однако невозможно при выраженной
гипотензии (артериальное давление ниже 100 мм рт.ст.), брадикардии (пульс менее
60 ударов в минуту), поперечной блокаде, бронхоспасгических состояниях, отеке
легких (или его угрозе).
По данным многих
исследователей, ББ достоверно снижают раннюю и позднюю летальность при ИМ.
В острейшем периоде ББ
применяются внутривенно под контролем пульса, артериального давления, ЭКГ затем
они назначаются при необходимости внутрь. Чаще применяется обзидан, анаприлин
по 10-20 мг внутривенно. В последние годы наилучшим считается м е т о п р о л о
л (в вену 10-15 мг или в таблетках по 5 мг внутрь). Он является
кардиоселективным ББ.
Общая принципиальная схема
лечения ИМ в начале его развития представлена в табл. 10.
В схему лечения не включены
препараты для снятия боли и коррекции аритмий, лечения острой недостаточности
кровообращения.
Инотропная поддержка
обеспечивается введением симпатомиметиков под строгим контролем ЧСС и АД.
Наилучшими являются добутамин, адреналин, амринон (при сочетании с нитратами).
Сердечные гликозиды опасны дня
поврежденного миокарда. Их ограниченное применение возможно лишь при отчетливом
застое в малом круге и мерцательной аритмии.
Объем лечебной помощи, конечно,
тесно связан с тяжестью состояния больных.
При неосложненных формах ИМ в
первые 2 часа бывает достаточно использования тромболитических препаратов и
ангиопластики, применения нитратов внутривенно. У более тяжелых больных к
лечению сразу же подключаются кортикостероиды и антиоксиданты.
Во второй период
(продолжительностью от 2 до 5 часов) объем вмешательства должен содержать
полный набор медикаментов. При этом индивидуально решается вопрос о
необходимости применения различных коронароакшвных препаратов.
В третий период (свыше 6 часов)
тромболиз КС и ангиопластика не проводятся. Остальное лечение соответствует
тяжести состояния.
Сестринский процесс при
инфаркте миокарда
|
Обследование
пациента
|
Сестринский
диагноз
|
Планирование
сестринской помощи пациенту
|
Выполнение
плана сестринской помощи
|
Оценка
полученных результатов
|
|
Жалобы
пациента: - интенсивная боль за грудиной и в области сердца; - резкая
слабость - чувство страха смерти
|
Существующие
проблемы: - интенсивная боль за грудиной; - возбуждение; - слабость; - страх
смерти; - снижение АД.
|
Краткосрочные
цели. 1. Установить строгий постельный и эмоциональный покой; 2. Устранить
боль с помощью средств, расширяющих коронарные сосуды сердца (нитраты). 3.
Вызвать врача. 4. Обеспечить доступ кислорода, оксигенотерапия. 5. С целью
устранения болевого приступа приготовить ненаркотические и наркотические
анальгетические средства для инъекций. 6. Приготовить все необходимое для
снятия ЭКГ. 7. Мониторинг АД и пульса. 8. Приготовить нужные лек. препараты
для применения нейролептоанальгезии. 9. С целью повышения артериального
давления приготовить кардиотонические препараты для инъекций. 10. С целью
быстрейшего прерывания тромбообразования в коронарных сосудах, для
профилактики нового тромбоза и для снижения свертываемости крови приготовить
фибринолитические и антикоагулянтные препараты. 12. Следить за общим
состоянием пациента и своевременно исполнять все дальнейшие назначения врача.
|
1.
Уложить пациента горизонтально. Расстегнуть стесняющую одежду. Успокоить
больного. 2. Дать под язык одну таблетку нитроглицерина (0,0005 г) или 1-2
дозы Нитроминта. Если боль не купирована, через 3-5 минут повторить прием
нитроглицерина или нитроминта под язык (если САД более 100 мм.рт.мт.) 3.
Вызвать врача немедленно. 4. Подать увлажненный кислород. 5. По назначению
врача ввести: - Анальгин 50% - 4 мл в/м или в/в; - Баралгин - 5 мл в/м или
в/в; - Трамал 10% - 2 мл в/в на физ. растворе. При продолжающихся болях в
сердце ввести назначенные врачом препараты: - Морфин гидрохлорид 1% - 1 мл
п/к или в/в на физ. растворе. - Атропин сульфат 0,1% - 1 мл п/к. - Промедол
2% 0 1 мл п/к или в/в струйно на физ. растворе. 6. Снять ЭКГ. 7. Контроль
пульса и АД. 8. По назначению врача ввести: - Фентанил 0,005% - 1-2 мл в/в
медленно, струйно на физ. растворе; - Дроперидол 0,25% - 1-2 мл в/в медленно,
струйно на физ. растворе. - Седуксен 0,5% - 2 мл в/в струйно на физ.
растворе. 9. По назначению врача ввести: - Кординамин 2-4 мл п/к или в/в
струйно на физ. растворе. При САД ниже 90 мм.рт.ст.: - Мезатон 1% - 1 мл в/в
струйно на физ. растворе. 10. По назначению врача вводить: - Стрептокиназа
750000 ЕД в/в на физ. растворе струйно медленно, через 15-30 минут повторить.
- АПСАК - 30 мг в/в струйно на физ. растворе; - Аспирин 325 мг, разжевать; -
Гепарин - 10000 ЕД в/в струйно на физ. растворе. 11. Ввести препараты,
назначенные врачом: - Атропин сульфат 0,1% - 1 мл п/к (при брадикардии). -
Лидокаин 250-500 мг в/в (при экстрасистолях, пароксизмальной тахикардии) -
Новокаинамид - 10% 10 мл в/в струйно на физ. растворе (при пароксизмальной
тахикардии) - Дигоксин 0,025% - 1 мл в/в струйно на физ. растворе(при
пароксизмальной тахикардии). 12. Следить за функцией сердечно-сосудистой
системы (пульс, АД) и о всех изменениях в состоянии пациента сообщить своевременно
врачу, точно и своевременно исполнять все его назначения.
|
Боли
в сердце прекратились. Показатели АД и пульса улучшились. Общее состояние
пациента улучшилось. Больной успокоился.
|
Профилактика
Профилактика инфаркта миокарда
определяется борьбой с атеросклеротическим поражением венечных сосудов и
нарушениями со стороны нервной системы, которые вызывают спазмы этих сосудов,
ведущие к уменьшению кровоснабжения сердечной мышцы. Важнейшим профилактическим
мероприятием для лиц, страдающих склерозом венечных сосудов сердца, является
диетический режим. Прежде всего, необходимо иметь в виду большой вред
переедания. Важно следить за весом тела, не допускать его нарастания сверх
физиологических норм. При наклонности к ожирению необходимо снижение питательности
(калорийности) пищи за счет ограничения жиров и углеводов (мучные и сдобные
изделия). Количество белков (нежирные мясо и рыба, творог) не должно быть ниже
установленных норм (100-150 г). Важно обогащать пищевой рацион овощами и
фруктами, т. к. доказано задерживающее влияние на развитие атеросклероза
витамина С, содержащегося в большом количестве в этих продуктах.
Исходя из этого, следует
дополнительно применять витамин С в виде настоя шиповника, черной смородины или
медикаментозных препаратов (аскорбиновая кислота и пр.). Весьма полезно
систематическое проведение периодических курсов лечения йодом. Существенным
элементом профилактики инфаркта миокарда является воздействие на нервную
систему. С этой точки зрения особенно важно установить правильную смену работы
и отдыха, организовать нормальный, достаточный сон (не менее 7-8 часов ночью и
1-2 часов днем). Необходим рациональный отдых в выходные дни и правильное
использование ежегодных отпусков.
Курение табака и употребление
спиртных напитков приносят большой вред больным, страдающим стенокардией или
перенесшим инфаркт миокарда. В профилактике инфаркта миокарда у лиц, страдающих
стенокардией, большую роль играет применение нитроглицерина, который необходимо
принимать каждый раз при появлении первых болевых ощущений в сердце. Лечебная
физкультура должна быть также использована для профилактики инфаркта миокарда.
Литература
1. Матусова А.П. Практическая кардиология 1999
год.
. Кардиология: ключи к диагнозу, 1998
год. Шпектор А.В., Васильева Е.Ю.