Изучение кинетики вирус-клеточного взаимодействия с помощью флуоресцентного маркера DND-167 при инфицировании вирусом гриппа культуры клеток MDCK
Оглавление
1. Введение и обзор
литературы
Вирус гриппа
Рецепторное
взаимодействие вируса и клетки
Цель работы
. Теоретическая часть
Кинетическая
модель связывания вируса с клеткой
Кинетическая
модель процесса эндоцитоза
Конкурентная
модель
. Материалы и методы
Материалы
Измерение
параметра эффективности ингибитора (IC50) методом ФОЕ
Метод
иммуноферметного анализа
Метод
флуоресцентной детекции
. Экспериментальная
часть
Данные,
полученные методом ФОЕ
Данные метода
иммуноферментного анализа (ИФА) [41]
Данные,
полученные методом флуоресцентной детекции
. Результаты
. Заключение
Итоги работы:
Выводы:
. Список литературы
1.
Введение и обзор литературы
· Вирус гриппа
Грипп - серьезное респираторное заболевание, поражающее ежегодно до 20%
мирового населения. Во время пандемий гриппа, происходящих приблизительно
каждые десять лет, высоковирулентные штаммы вызывают необычайно высокий уровень
смертности, особенно у пожилых людей. Страшнейшая пандемия в истории, пандемия
1918 г. унесла жизни 20 млн. человек. Эпидемиологи полагают, что человечеству
угрожает новая пандемия, которая может быть вызвана вариантами
высоко-патогенных вирусов Н5, приобретшими способность передаваться человеку.
Вирус гриппа А имеет мембранную оболочку, внутри которой располагается
вирусный геном, ассоциированный с белками. Оболочка частицы вируса гриппа, не
содержащая клеточных белков, сформирована липидным бислоем плазматической
мембраны, в котором находятся три интегральных белка: гемагглютинин (HA, до 500 копий на вирион),
нейраминидаза (NA, около 100
копий на вирион) и белок ионного канала М2 [1-2]. Под оболочкой вириона
располагается слой матриксного белка М1. В полости вириона локализуются 8
сегментов генома, представленного одноцепочечной РНК негативной полярности и
кодирующего 10 вирусных белков, один из которых - неструктурный NS1. Вирусный
геном ассоциирован с четырьмя белками (нуклеопротеин (NP), белки PB1, PB2 и PA), и формирует рибонуклеопротеиновые
комплексы (частицы) [3-4]. Комплексы имеют вид палочковидных структур размерами
30-110нм. [5-6] и образованы спирально уложенными молекулами нуклеопротеина,
вокруг которого «обернута» вирусная РНК [7] (Рисунок 1).

В состав каждого комплекса входит 37 - 97 молекул нуклеопротеина [4]. Под
электронным микроскопом, при изучении методом негативного контрастирования,
вирус гриппа А в суспензионных препаратах плеоморфен. Диаметр сферических
частиц составляет 80 - 120 нм. Вирионы окружены отчетливой оболочкой, на
которой видны «шипики» (spikes) длиной 10 - 14 нм и диаметром 4 - 6 нм [4],[8].
Первой и критической стадией инфекционного процесса является связывание
вируса гриппа со специфическими рецепторами на поверхности клеток. НА необходим
вирусу для узнавания и прикрепления к клетке-мишени, то есть он опосредует
самую первую стадию инфекции. Клеточным рецептором, который связывается с
гемагглютинином, является в первом приближении N-ацетилнейраминовая кислота
(Neu5Aс), а точнее - некоторые сиалоолигосахариды. Кроме того, на следующем
этапе НА обеспечивает проникновение вируса внутрь клетки, опосредуя слияние
мембран вириона и клетки. Широко распространено мнение, что именно изменение
специфичности связывания с рецепторами может быть тем механизмом, который
приведет к появлению нового пандемичного штамма вируса гриппа [9-11].
· · Рецепторное взаимодействие вируса и клетки
Первые этапы вирусной инфекции, независимо от того, о каком вирусе идет
речь, традиционно принято называть адсорбцией, проникновением и «раздеванием»
(разрушением вирусной оболочки). Под адсорбцией принято рассматривать первичный
контакт вируса с клеткой. Часто этот контакт сначала бывает очень слабым -
обратимая адсорбция. Затем прочность контакта возрастает - необратимая
адсорбция. Эти термины в равной степени применимы для описания начальной стадии
проникновения в клетки любых вирусов. Вероятно, что во многих случаях имеет
место процесс прикрепления вируса к клетке вследствие физико-химической
комплиментарности между поверхностью вируса и молекулами рецепторов, находящихся
на поверхности клетки, который индуцирует в клетке изменения, необходимые для
проникновения в нее вируса [12]. Что же касается таких относительно больших
белковых структур, как капсидные вирионы, то для них известен только один
механизм проникновения в клетку - это рецепторно-опосредованный эндоцитоз.
Возможно, что в образовании рецепторных связей принимают участие и ионы
культуральной среды. Рецептором, как правило, служит расположенный на
поверхности клетки белок или гликопротеин. На поверхности клетки имеются
различные рецепторы, каждый из которых специфичен для своего вируса.
Специфичность этих рецепторов не абсолютна, что приводит к возможности
группировки вирусов по этому свойству в своеобразные «семейства». Вирусы,
родственные друг другу по данному признаку, могут быть родственны и по другим
признакам, однако это условие не является обязательным. На поверхности
единичной клетки может содержаться от 104 до 105 копий каждого вида рецепторов
[13].
Следует подчеркнуть, что сам факт адсорбции вируса на клетке еще никоим
образом не означает инициации вирусной инфекции. Связи, образующиеся при
адсорбции между вирусом и клеткой, могут быть «слабыми», а адсорбция
«обратимой», то есть вирион может покидать поверхность клетки. Однако некоторые
из адсорбировавшихся на клетке вирионов связываются ней более прочными
«необратимыми» связями. Такие связи приводят к резкому понижению pH в месте связывания - еще одному
эффекту вирус - клеточного взаимодействия, возникающему в результате
конформационных изменений HA
[14-17]. Вследствие этого процесса, а также эффекта трансмембранного потенциала
[18] в месте связывания вируса с клеточными рецепторами понижается от
нейтрального значения (pH~7)
до значений порядка 6.
В основе начального связывания самых различных вирусов с клеткой могут
лежать принципиально сходные процессы. Напротив, проникновение вирионов в
клетку и активация вирусного генома могут происходить у разных вирусов
по-разному. Некоторые вирусы присоединяются к клеточным рецепторам настолько
быстро, что адсорбция лимитируется лишь диффузией [13].
Предполагается, что для вируса гриппа специфичен один тип рецепторов,
производная сиаловых кислот [19-21]. Прочность связывания увеличивается с
повышением температуры, что также обуславливается и постепенным захватыванием
вируса рецепторами, латеральная подвижность которых в плазматической мембране
увеличивается при повышении температуры.
Связавшийся с рецептором вирус гриппа проникает в клетку, образуя
клатриновый (эндосомальный) пузырек, который переходит в раннюю эндосому
клетки, значение pH в которой ~6.
Далее происходит постепенное закисление среды в эндосоме (до значения pH~5,5 - 5), благодаря чему вирус
гриппа сливается с ее мембраной и вирусный геном оказывается в цитоплазме
клетки в виде отдельных сегментов - частиц рибонуклеопротеина. Эти частицы
должны попасть в ядро, где происходит репликация и транскрипция генома вируса
гриппа [22]. Адресная доставка вирусного генома обеспечивается наличием на
частицах рибонуклеопротеина соответствующих сигнальных последовательностей [6].
В ядре клетки происходит репликация и транскрипция вирусной РНК и формирование
дочерних частиц рибонуклеопротеина, которые мигрируют в цитоплазму, а затем - к
месту почкования вируса на плазматической мембране [23]. Синтез гемагглютинина
и нейраминидазы происходит на полисомах шероховатого ЭПР, остальные белки
синтезируются на свободных полисомах [24-26]. Вирусный белок М1 взаимодействует
как с цито-плазматическим концом гемагглютинина, так и с его внутримембранной
частью [27], и таким образом играет критическую роль в почковании вируса гриппа
[28-29]. Фермент нейраминидаза необходим вирусу для выхода из клетки - в его
отсутствие НА одного вириона взаимодействует с сиалированными углеводными
цепями соседнего вириона или уже инфицированной клетки, в результате связанный
вирус не способен к дальнейшему размножению; NA удаляет сиаловую кислоту и тем
самым дает вирусу возможность отсоединиться от соседнего вируса или мембраны
клетки-хозяина, то есть делает вирус подвижным и способным к новому жизненному
циклу.
Современные методы исследования позволяют проследить весь цикл
взаимодействия клетки с отдельной вирусной частицей в реальном времени [30-33],
однако эти новые данные мало использованы для построения одной общей теории
процесса вирус - клеточного взаимодействия, способной прогнозировать влияние
различных штаммов вируса гриппа на культуру клеток или живой организм, а также
для возможных путей блокирования данного процесса.
Подавление распространения вирусной инфекции вероятнее всего на этапе
связывания вируса с клеточными рецепторами [34] по принципу ингибирования
НА-опосредованной адгезии вируса гриппа с помощью синтетических аналогов [19],
эффективность которых характеризуется параметром IC50. IC50 -
доза ингибитора, необходимая для 50% подавления заражения, которую можно
проанализировать в культуре клеток. Нахождение данного параметра напрямую
связано с получением не только данных об эффективности противовирусного
препарата, но и нахождением параметров кинетических уравнений, описывающих процесс
эндоцитоза.
В работе [35] проанализировано стационарное состояние адсорбированного
вируса, неспособного к проникновению, в зависимости от различных типов
связывания - моновалентного, мультивалентного и мультивалентного с насыщением
поверхности клетки вирусом. К сожалению, полученные аналитические выражения
слишком громоздки для практического применения и включают в себя большое число
неизвестных параметров, что также затрудняет их использование.
Следует отметить, что многие экспериментальные данные получены именно в
предположении простейшей модели связывания, когда молекулы лиганда и рецептора
рассматриваются как свободные и моновалентные. В действительности
взаимодействие является мультивалентным. К тому же, в реальной биологической
системе взаимодействие вирус-клетка, как правило, происходит в условиях, когда
один из реагентов является иммобилизованным на поверхность либо культуральной
посуды, либо в тканях организма, что является случаем гетерогенного связывания.
При моделировании мультивалентного связывания наибольшее распространение
получило «приближение эквивалентных мест связывания» («equivalent site approximation»), в котором места для связывания
лиганда полагаются идентичными и взаимодействующими с различными рецепторами
независимо [36]. При этом пренебрегается возможными внутримолекулярными
реакциями, которые, например, могут иметь место для мультивалентных рецепторов
[37].
При таком подходе мультивалентный лиганда с валентностью n может связаться с поверхностью
клетки i=1,…,n раз. Анализ в случае наличия кооперативного связывания (в
случае сильно выраженной положительной кооперативности) может быть сильно
упрощен [38], если предположить, что кооперативное лиганд-рецепторное
взаимодействие описывается схемой
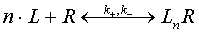
Даже
в равновесии и в случае очень сильных упрощающих предположений, уравнения на
концентрации реагентов достаточны сложны.
Значения
константы скорости ассоциации комплекса антиген-антитело опубликованные в
научной литературе, колеблются от 106 до 108 М-1с-1. В то время как значения
для константы скорости диссоциации комплекса антиген-антитело варьируются в
больших пределах от 10-4 до 10000 с-1 [39]. Такая разница в разбросе значений
для констант скоростей прямой и обратной реакций ведет к предположению, которое
на сегодняшний день является общепризнанным взглядом: константы скорости прямой
реакции связывания отличаются для разных молекул антигена и антитела несильно,
а имеющиеся различия в константах связывания обусловлены в основном различиями
в константе скорости диссоциации. Выражение для равновесной константы
диссоциации легко получить из уравнения 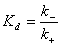 (учитывая
(1.1)):
(учитывая
(1.1)):
Особенностью
методического подхода, реализованного в данной работе, является определение
кинетических параметров вирус - клеточной системы с помощью детекции изменения pH
при образовании вирус-рецепторного комплекса (необратимой адсорбции) и при
проникновении вирусной частицы в эндосому клетки.
·
Цель работы
Целью данной работы является изучение кинетики активации клетки в
результате рецептор-обусловленного эндоцитоза вирусной частицы. В ходе
выполнения работы решались следующие задачи:
o Разработка нового метода исследования вирус-клеточного
взаимодействия с применением флуоресцентной детекции
o Построение теоретической модели и разработка методики нахождения
кинетических параметров вирус-клеточного взаимодействия и определения
эффективности ингибитора с применением флуоресцентной детекции Применение
построенной теоретической модели для аппроксимации результатов кинетического
эксперимента Сравнение стандартных вирусологических (ФОЕ и ИФА)
и нового флуоресцентного методов оценки эффективности ингибитора
2. Теоретическая часть
· Кинетическая модель связывания вируса с клеткой
(соответствие с условиями проведения эксперимента при 4˚С)
Отличительной особенностью взаимодействия вируса с клеткой является
фазовая гетерогенность системы. При связывании вируса гриппа с культурой клеток
(моновалентная модель) схема реакции имеет вид, схожий со схемой связывания
вируса гриппа с аналогом клеточного рецептора (белок фетуин):
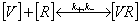
где
[V]- концентрация свободного вируса в суспензии
[R] - концентрация свободных рецепторов
на поверхности клеток
[VR] -концентрация вируса на поверхности
клетки, связанного с клеточными рецепторами
[V0,] [R0] - начальная концентрация вирусных частиц и клеточных
рецепторов соответственно
k+, k- - кинетические константы связывания
вируса гриппа с клеткой: ассоциации и диссоциации соответственно
kin -
константа проникновения вируса внутрь клетки (константа эндоцитоза)
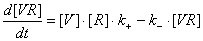
где
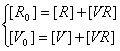 (закон сохранения вещества для вирусных частиц и для
рецепторов на поверхности клетки)
(закон сохранения вещества для вирусных частиц и для
рецепторов на поверхности клетки)
Приближения:
· [R]>>[VR] ;
· 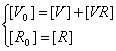 ;
;
тогда дифференциальное уравнение примет вид:
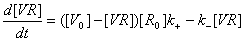
откуда
можно найти скорость изменения концентрации вируса на поверхности клетки:
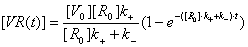
Таким
образом, концентрация вируса на поверхности клетки зависит как и от начальной
концентрации вируса так и от концентрации рецепторов на поверхности клетки. А
скорость насыщения зависит от начальной концентрации вируса в суспензии. На
временах 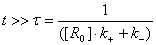 наступает насыщение клеточных рецепторов вирусом (уже
со сделанной оговоркой, что [V0]<<[R0]) Т.е. на таких временах
связывание вируса с клеточными рецепторами можно рассматривать как равновесный
процесс.
наступает насыщение клеточных рецепторов вирусом (уже
со сделанной оговоркой, что [V0]<<[R0]) Т.е. на таких временах
связывание вируса с клеточными рецепторами можно рассматривать как равновесный
процесс.
(соответствие с условиями проведения эксперимента при 37˚С)
Одним из этапов заражения вирусом клетки является процесс эндоцитоза.
Рассмотрим его в рамках кинетической модели. Этому посвящен ряд статей [39-40]
и их модели заслуживают отдельного рассмотрения, но все они отличаются
сложностью в обработке и расчете параметров взаимодействия вируса с живой
клеткой (и имеют ряд приближений на этом этапе - этапе расчета параметров
взаимодействия вируса с живой клеткой). Мы же попробуем создать упрощенную
модель связывания вируса гриппа с живой клеткой, которая не будет требовать
приближенных методов анализа и будет адекватно описывать связывание вируса с
рецепторами и проникновение вируса внутрь. Поскольку только вирус, связанный с
поверхностью клетки, способен проникнуть внутрь клетки, то разумно весь процесс
первого этапа заражения вирусом клетки разбить на две последовательные реакции:
связывание вируса с клеточными рецепторами и проникновение связанного вируса
внутрь клетки (процесс эндоцитоза), или в виде схемы:
где [V]- концентрация свободного вируса в
суспензии
[R] - концентрация свободных рецепторов
на поверхности клеток
[VR]s/in -концентрация
вируса на поверхности/внутри клетки, связанного с клеточными рецепторами
[V0,] [R0] - начальная концентрация вирусных частиц и клеточных
рецепторов соответственно
k+, k- - кинетические константы связывания
вируса гриппа с клеткой: ассоциации и диссоциации соответственно
kin -
константа проникновения вируса внутрь клетки (константа эндоцитоза)
Получаем систему уравнений, моделирующую связывание вируса с клеткой и
проникновение вируса в клетку:
Приближения:
· [R]>>[VR]S,
· [R]>>[V];
· 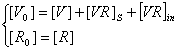 ,
подставляем в систему (2.6), получаем:
,
подставляем в систему (2.6), получаем:
Принято (как и ранее), что концентрация (соответственно и количество)
свободных рецепторов не изменяется, что является следствием экспериментального
ограничения: концентрация вируса много меньше концентрации рецепторов.
Если сделать соответствующую замену:
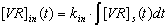
то
систему дифференциальных уравнений первого порядка можно свести к
дифференциальному уравнению второго порядка:
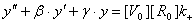
где
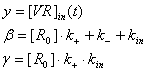
Это уравнение решается и записывается в виде суммы общего решения yo и частного yч: y= yo+ yч
Составим
характеристическое уравнение (т.е. ищем решение в виде 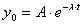 ):
):
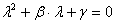
Решения
этого квадратного уравнения имеют вид:
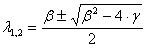
Поэтому
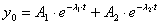
И
решение неоднородного уравнения (2.7):
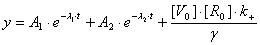
или
для концентрации вирусных частиц на поверхности клетки [VR]s(t):
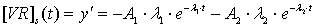
Поскольку
в начальный момент времени концентрация вирусных частиц на поверхности клетки,
а следовательно, и внутри клетки, равна нулю, то, подставляя эти значения в [VR]s(t),
получим:

Данная
зависимость представляет собой зависимость концентрации вируса на поверхности
клетки от концентраций связывающихся веществ и от кинетических характеристик
связывания вируса с клеткой.

От начальной концентрации вируса зависит только величина максимального
пика, а скорости (сама кинетика) зависят от кинетических параметров и начальной
концентрации свободных рецепторов. Видно, что при отсутствии эндоцитоза (g=0) формула переходит в уже известную
(2.4).
Таким образом, суммарная концентрация вируса, участвующего в процессе
эндоцитоза описывается уравнением:
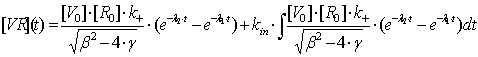
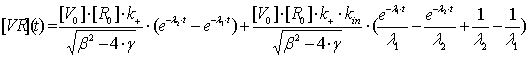
Рассмотрим
поведение функции (2.17) во времени. С увеличением времени взаимодействия
вирусных частиц с клетками суспензии, количество комплексов вирус-клетка
постепенно увеличивается с нуля до некоторого максимального значения [VR]m (до
момента времени tm - время насыщения клеточных рецепторов) после чего
количество вируса на поверхности клеток начнет уменьшаться, а количество вируса
внутри клеток расти. Т.е если клетки физически способны вместить в себе все
вирусные частицы из суспензии, то через достаточно большой временной промежуток
весь вирус уйдет внутрь клетки, что не противоречит физической сути процесса,
поскольку количество вируса уменьшается и, все меньше вирусных частиц может
сесть на клетку, поэтому и наступает такой момент времени, когда концентрация
вируса на поверхности клетки достигает своего максимума (с последующим спадом).
Найдем
время tm:
Поскольку
в этой точке функция (2.17) достигает своего максимума, то ее производная равна
нулю:
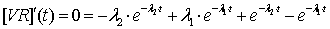
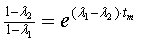
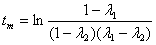
Это
характерное время (время насыщения) зависит от всех кинетических констант, и
его можно использовать как еще один параметр для оценки исследуемых свойств
системы - рецепторной специфичности. Также видно, что при отсутствии эндоцитоза
(kin=0) это время насыщения бесконечно, что означает
насыщение клеточных рецепторов вирусом и установление равновесия.
· Конкурентная модель
(связывание вируса с рецепторами клетки и конкурентом (аналогом
клеточного рецептора - белком фетуином))

Добавление в систему вирус- клетка дополнительных «претендентов» на
связывание с вирусными рецепторами приводит к добавлению к системе (2.5)
дополнительного уравнения, отвечающего за образование нового комплекса
вирус-конкурент.
где [V]- концентрация свободного вируса в
суспензии
[R] - концентрация свободных рецепторов
на поверхности клеток
[VR]s,in -концентрация
вируса на поверхности и внутри клетки
[L] - концентрация конкурента (молекул
фетуина)
[VL] - комплекс вирус-конкурент
(молекулы фетуина)
k+, k- - кинетические константы связывания
вируса гриппа с клеткой: ассоциации и диссоциации соответственно
k+1, k-1 - кинетические константы
связывания вируса гриппа с блокатором: ассоциации и диссоциации соответственно
kin
-константа проникновения вируса внутрь клетки (константа эндоцитоза)
Приближения:
· [L]>>[VR]S
· [L]>>[V], подставляем в систему (2.21),
получаем:
Решение данной системы достаточно громоздко и сложноразрешимо в рамках
наших допущений ввиду наличия большого количества промежуточных величин.
Однако, анализируя данную систему, можно полагать, что наличие блокатора сопровождается
некоторыми изменениями решения (2.17). Снижение концентрации вируса на
поверхности клетки будет сопровождаться сдвигом, а, следовательно, и
уменьшением пика [VR]m, таким образом, уменьшится
концентрация вируса и внутри клетки. Значит, наличие блокатора может
спровоцировать остановку, или, вероятнее, торможение процесса эндоцитоза.
3.
Материалы и методы
· Материалы
1. Вирус. Вирус гриппа, штамм A/Aichi/2/68,
получен из Института полиомиелита и вирусных энцефалитов РАМН, г. Москва,
прошедший пять пассажей на лёгких мышей и один-два пассажа на культуре клеток MDCK. Гемагглютинирующая активность
материала составляла 256 ед. Очистка и концентрирование вируса с помощью
фильтра-концентратора Vivaspin
20 (300кДа) и центрифуги (4500 об/мин., 30 мин., t=4ºC)
2. Растворы для реакций
· Раствор фетуина 0.1%-ный в фосфатном буферном растворе
· Стандартный фосфатный буферный раствор (PBS - Phosphate Buffer Solution) в физиологическом растворе,
поддерживающий рН 7,2
· Питательная среда RPMI 1640.
· Субстрат:{9ml. H2O +1ml. NaAc(0,5M) +60 mkl.H2O2+6mkg.OFD}
· Измерение параметра эффективности ингибитора (IC50) методом
ФОЕ
Метод ингибирования фокусообразующих единиц
В работе для измерения концентрации вирусных частиц использована методика
связывания вируса с молекулами фетуина. Суть её заключается в следующем.
Оболочечный белок вируса гриппа, гемагглютинин, имеет сродство к определённым
клеточным рецепторам, сиаловым кислотам. Молекулы фетуина - это модель клеточного
рецептора, к которому вирус также имеет специфичное сродство через
взаимодействие с сиаловыми кислотами. Конъюгированный с ферментом фетуин при
связывании с вирусными частицами позволяет количественно измерить концентрацию
вирусных частиц по величине концентрации продуктов ферментативной реакции. По
количеству вирионов на поверхности напрямую определяется концентрация вирусных
частиц.
Алгоритм определения параметра IC50 методом фокусообразующих единиц (ФОЕ)
1. Готовится раствор фетуина (1мг/1мл PBS).
2. Добавляется в 96-луночные круглодонные стерильные планшеты по
100 мкл поддерживающей среды (ИГЛА ДМЕМ,100 ед/мл пенецилина,100 мкг/мл
стрептомицина, 300 мкг/мл L-глютамин
, 10 мкг/мл ДЕАЕ-декстрана (Sigma),
5 мкг/мл трипсина TPCK)
. Готовятся серийные двукратные разведений блокатора фетуин,
начиная с разведения 1:20 путем переноса 50 мкл пробы в последующую лунку; из
лунок последнего ряда удаляется 50 мкл после последнего разведения блокатора.
. Добавляется в лунки по 50 мкл вирусной суспензии, содержащей
~500 ФОЕ вируса; инкубируется 30 мин при температуре 35оC.
. Удаляется ростовая среда из лунок планшета с монослоем клеток MDCK; монослой двукратно промывается
средой для разведения вируса. Перенос (после окончания инкубации) из планшета с
разведениями сывороток по 100 мкл в соответствующие лунки планшета с монослоем
клеток
. Инкубируется при 35 оC в течение 18 часов в CO2
атмосфере.
. Удаляется из планшета содержимое (без промывки), добавляется по
50 мкл охлажденного ацетона (80%) в каждую лунку; на 15 минут при комнатной
температуре
. Промываюется планшет фосфатно-буферным раствором (ФБР) 2-3 раза
по 200 мкл на лунку
. Готовится разведение 1:2000 моноклональных антител к белку NP вируса гриппа А (CDC, Atlanta, Lot
03-0325L) в ФБР, содержащем 1% бычьего сывороточного
альбумина и 0.1% Твин 20, и по 50 мкл добавляется в каждую лунку. 35оC на 60 минут.
. Клетки промываются дистиллированной водой 2-3 раза по 200 мкл на
лунку; удаляются лишние капли.
. Добавляется по 50 мкл на лунку раствора конъюгированных биотином
антител кролика к иммуноглобулинам мыши (1/3000 в ФБР); на 30 минут при 35 оC.
. Клетки промываются дистиллированной водой 2-3 раза по 200 мкл на
лунку.
. Добавляется 50 мкл на лунку раствора конъюгированного
пероксидазой хрена стрептавидина (1/2000 в ФБР); на 30 минут при 35 оC.
. Клетки промываются дистиллированной водой 2-3 раза по 200 мкл на
лунку.
. Добавляется в каждую лунку по 100 мкл раствора субстрата (9ml. H2O +1ml. NaAc(0,5M) +60
mkl.H2O2+6mkg.OFD); при комнатной температуре в темноте 30 минут.
. Планшет промывается под краном. В каждую лунку добавляется по 50
мкл дистиллированной воды.
. Подсчитываются под микроскопом образовавшиеся фокусные единицы
(зараженные клетки) в каждой отдельной лунке.
Данные о количестве зараженных клеток позволяют построить зависимость
числа инфицирования клеток от концентрации блокатора фетуин. С помощью
полученной зависимости, определяется параметр IC50 - концентрация ингибитора, при которой число
образовавшихся комплексов равно половине от числа комплексов в случае
отсутствия конкурента ([IC50]=моль/мл) вещества.
Расчет IC50 проводится методом пробит-анализа на основе полученных
экспериментальных зависимостей «Доза ингибитора- ингибирующий эффект»
Данный параметр определяется с точностью, соответствующей погрешности
пипеток используемых при титровании вирусной суспензии и статистической
погрешности, определяемой при подсчете фокусов в монослое клеток.
· Метод иммуноферметного анализа
вирус грипп инфицирование
клетка флуоресцентная детекция
Существуют различные экспериментальные методы исследования взаимодействия
антиген-антитело на молекулярном уровне, которые позволяют исследовать
структуру и динамику этого взаимодействия.
В настоящее время самым распространенным методом является метод
иммуноферментного анализа (ИФА, ELISA).
Метод принципиально сходен с РИА, но меткой является молекула фермента,
ковалентно связанная с одним из реагентов, а после разделения связанных и
свободных реагентов проводится ферментативная реакция, дающая в результате
окрашенный продукт, в условиях избытка субстрата. Реакция останавливается (или
самотормозится), и количество наработанного продукта измеряется
спектрофотометрическим способом. Метод характеризуется высокой
чувствительностью.
Наибольшее значение ИФА имеет для определения наличия антител или
антигенов в крови или других биологических жидкостях в различных тест-системах.
Наиболее распространенными объектами являются белки, их мембранные фракции,
вирусные частицы, реже фиксированные клетки. Проведение кинетических
исследований затруднено в силу большого количества стадий, необходимых по
протоколу, после процесса непосредственного связывания антигена и антитела.
Особенностью методического подхода, реализованного в работе [41],
является определение кинетических закономерностей вирус-клеточного
взаимодействия вириона с модельными клеточными рецепторами (фетуин) и живыми
чувствительными к вирусу гриппа клетками (MDCK).
·
Метод флуоресцентной детекции
LysoSensor blue DND-167 Для наблюдения изменений,
происходящих с клетками на первых стадиях проникновения вирусной частицы в
клетку (Рисунок 4) применяли лизосенсор - рН-зависимый флюоресцентный маркер DND-167, интенсивность флюоресценции
которого увеличивается при понижении рН в месте связывания вируса с клеточными
рецепторами и внутри эндосомы от нормального значения до рН ~5 (Рисунок 5).

DND-167
имеет большую π-систему. В водной среде он может существовать как в виде
положительно, так и отрицательных ионов. Концентрация каждой из его форм
зависит от значения рН среды. При повышении рН он депротонируется превращаясь в
отрицательный ион, при понижении соответственно, наоборот. Калибровочная
зависимость интенсивности флюоресценции DND-167 от величины рН позволяет изучать кинетику
лизосомальной активации клетки, индуцированной проникновением вируса в клетку.
Для проверки степени применимости красителя DND-167 к нашей задаче был снят спектр флуоресцении для
различных pH среды.
Измерения проводились спектрофлуориметре RF-520 (Shimadzu, Япония)
(Рисунок 6). Для исследования изменения спектра флуоресценции было приготовлено
четыре пробирки с разными пробами. Каждая проба помещалась во флуориметр, где в
течение всего эксперимента облучалась одной и той же длиной волны (360нм.). При
помощи флуориметра измерялся спектр эмиссии пробы в диапазоне 380-500 нм.
(рабочий диапазон красителя LysoSensor Blue DND-167 по паспортным данным)
(Рисунок 7).

Образцы DND167 приготовлены в фосфатно-солевом
буфере (ФСБ), поддерживающем определённые значение рН. Для проведения
эксперимента были выбраны следующие значения pH: 2, 4,3, 5,3, 6,4. pH измерялся при помощи pH
метра PerpHecT METER (погрешность ± 0.05). Общая концентрация красителя во всех пробах была
одинаковой.

Интенсивность флуоресценции прямо пропорциональна интенсивности
поглощённого излучения и вероятности излучения кванта при переходе из
возбужденного состояния в основное, то есть квантовому выходу флуоресценции:
Iфлуоресценции
= Iпоглощённая·j ,
где j - квантовый
выход флуоресценции.
Из представленных на рисунке 7 результатов видно, что спектры поглощения
и флуоресценции зависят от значения рН. Отсюда можно сделать вывод о некоторых
деталях механизма флуоресценции.
Зависимость интенсивности флуоресценции от рН:
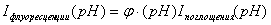
Но
квантовый выход флуоресценции j от рН не зависит, то есть:

Таким
образом, показано, что уменьшение флуоресценции DND-167 при
уменьшении рН вызвано не уменьшением квантового выхода, а уменьшением величины
поглощения. Этот результат необходим для адекватной оценки полученных данных
при работе с данным флуорофором на имеющемся оборудовании.
Также
необходимо заметить, что длина волны пика флюоресценции (Рисунок 7) изменяется
не более, чем на 4-5нм. и составляет 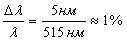 , что
является незначительным при сравнении с изменением интенсивности флуоресценции
в пробах с различными pH.
, что
является незначительным при сравнении с изменением интенсивности флуоресценции
в пробах с различными pH.
TECAN
Infinite 200 Разработанная в теоретической части работы
кинетическая модель позволяет выделить два основных параметра, характеризующих
взаимодействие вируса с клеткой - это константа диссоциации, константа
проникновения и скорость изменения внутриэндосомальной рН. Экспериментальные
исследования на монослое культуры клеток MDCK с
использованием штамма вируса гриппа А/Aichi/2/68 и фетуина,
молекулы-блокатора связывания вируса с клеткой, проводились на флуориметре TECAN
серии Infinite 200 (Рисунок 8). Детектор в Infinite 200-
ФЭУ, опционально чувствительный в УФ и красной областях; диапазон длин волн для
измерения интенсивности флуоресценции: Ex 230 - 850 нм, Em 280 - 850 нм.
(Рисунок 9); оптическая ширина щели Ex: < 9нм. для λ>295нм., Em: <20нм.; точность развертки спектра
<±2нм. для λ>295нм.; диапазон измерения поглощения 0- 3OD с точностью
< ± (1% + 0.010 OD). Температурный диапазон - 5ºС до 42ºС (поддерживается с точностью до 0.5 ºС).


При добавлении в лунку к окрашенному DND-167 клеточному монослою вирусной суспензии,
происходит связывания вирионов с клеточными рецепторами за время порядка 5-10
минут, что приводит к пониженю pH в
результате действия транс-мембранного потенциала и, как следствие, росту
интенсивности флуоресценции лизо-сенсора. Из данных, полученных при изучении
спектра флуоресценции красителя DND-167
(Рисунок 7), можно сделать вывод, что чувствительности прибора (0.5 fmol/лунка
при измерении поверхностной флуоресценции) и точности измерения интенсивности
флуоресценции TECAN Infinite 200 для каждой лунки планшета-96black, будет достаточно при изменении pH в диапазоне от 6 до 5 (что
соответствует диапазону изменения pH на поверхности и в эндосоме клетки при проникновении вирусной частицы).
Во время снятия зависимости интенсивности флуоресценции от времени,
параллельно отслеживалось появление флуоресцирующих меток в клеточной суспензии
на инвертированном микроскопе Olympus CK40. Первые
исследования, проведенные на планшете 96-white показали, что помимо флуоресценции, спровоцированной
активацией лизо-сенсора DND-167,
имеется сильная флуоресценция самого пластика планшета, что вносит большие
помехи, создавая неравномерный фон (таким образом в микроскопе наблюдались
четкие светящиеся границы лунок микропланшета). Дальнейшие эксперименты
проводились на черных 96 - луночных планшетах с прозрачным дном, что дало
возможность в разы уменьшить фон окружения. При микроскопическом изучении
культуры клеток результат активации лизо-сенсора наблюдали в виде большого
количества светящихся точек в клеточной суспензии, которые отсутствовали до
активации.
Алгоритм определения параметра IC50=Kd методом флуоресцентной детекции
1. Готовятся растворы фетуина (1мг/1мл PBS).
2. Добавляется в 96-луночные круглодонные стерильные планшеты по
100 мкл поддерживающей среды RPMI
. Готовятся серийные двукратные разведения блокатора фетуина,
начиная с разведения 1:20 путем переноса 50 мкл пробы в последующую лунку; из
лунок последнего ряда удаляется 50 мкл после последнего разведения блокатора.
. Добавляется в лунки по 50 мкл вирусной суспензии, содержащей
~500 ФОЕ вируса; инкубация 30 мин при температуре 35оC
. Добавляется LysoSensorBlueDND-167 к концентрированной клеточной
суспензии в соотношении 1/500. Инкубирование при 35 оC в течение 20 минут.
. Разводится окрашенная DND-167 клеточная суспензия поддерживающей средой RPMI (35 оC) в
10 раз, добавляется в планшет по 50 мкл в лунку к суспензиям вирус-фетуин.
. Проводятся измерения во флуориметре Infinite 200 при 37 оC в течение необходимого времени (время исследуемого в данной
работе процесса 20-30 минут)
Полученная зависимость интенсивности флуоресценции от времени для
различных концентраций блокатора фетуин, позволяет найти параметр эффективности
ингибитора IC50 за счет 50% подавления сигнала
интенсивности флуоресценции красителя DND-167.
В отличие от биологического метода (Фокусообразующих единиц (ФОЕ)),
методика флуоресцентной детекции более точно определяет эффективность
ингибитора за счет высокой чувствительности прибора. Также, что немаловажно при
работе с живыми системами, данный метод позволяет проводить все необходимые
манипуляции в течение 25 минут, в отличие от метода ФОЕ, требующего большего
времени (порядка 24 часов).
Решение обратной задачи для нахождения кинетических параметров системы
вирус-клетка.
Получение зависимости интенсивности флуоресценции от времени при
проникновении вируса в клетку дает возможность определять константы скоростей
связывания вирусных частиц с клеточными рецепторами (k+ и k_) и
проникновения внутрь клетки (kin)
данной системы решая обратную задачу с помощью подбора соответствующих
параметров в уравнениях, описывающих адсорбцию вируса на клетке:

его
проникновение внутрь клетки:
и
суммарную концентрацию вируса, участвующего в процессе эндоцитоза:
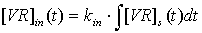
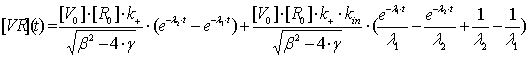
I=a·Is+b·Iin
Таким
образом суммарная интенсивность флуоресценции от времени, детектируемая
прибором:
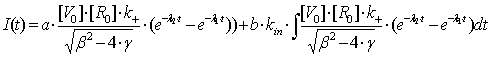
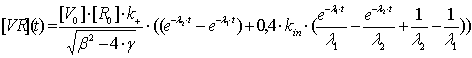
Поскольку
эти коэффициенты a и b взаимозависимы, то положим a=1.
Границы
соотношений коэффициентов a и b определяются из данных, приведенных на рисунках 7 и
10.

Согласно этим данным, соотношение между интенсивностью при pH=6 и интенсивностью при pH=5,5 равно примерно 2,5, т.е.:
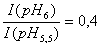
Таким образом, полученная зависимость I(t) (3.8) может
быть записана в виде:
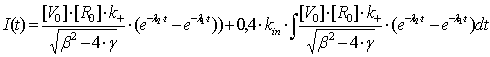
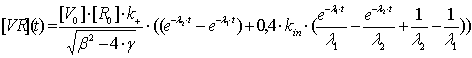
В итоге, полученная экспериментально интенсивность флуоресценции может
быть описана уравнением (3.11) для нахождения необходимых кинетических
параметров, а теоретическая зависимость концентрации вируса на поверхности и
внутри клетки, изображенная на рисунке 2, приобретает вид:

На данном рисунке 11 детектируемый сигнал - сумма интенсивностей на
поверхности и внутри клетки (с соответствующим коэффициентом b=0,4) и есть решение уравнения
(3.12).
4. Экспериментальная часть
Одной из основных задач данной дипломной работы является изучение
взаимодействия вируса гриппа именно с живой клеткой. Живая система
характеризуется своей изменчивостью во времени, она постоянно находиться в
движении. Поэтому при проведении экспериментов очень важно следить за более или
менее одинаковыми внешними и внутренними условиями эксперимента. Например,
очень важно следить за концентрацией вирусных частиц в суспензии: это влияет не
только на определение параметров связывания вируса с клеткой, но и на
применимость самой модели (должно соблюдаться условие [R]>>[V],
см. Теоретическую часть). Главной изменяющейся единицей в этом процессе
является клетка, а точнее ее рецепторы.
При проведении экспериментального изучения кинетики взаимодействия вируса
с живой культурой клеток предварительно были охарактеризованы следующие
параметры:
1. оптимальный возраст монослоя клеток, при котором рецепторные
свойства клеток меняются незначительно за время проведения кинетического
эксперимента (~48 часов [41])
2. оптимальная концентрация клеток и, как следствие, концентрации
клеточных рецепторов(R=N∙r, N - количество
клеток в монослое, r - количество
рецепторов на поверхности одной клетки) (~106 клеток в лунке)
. концентрация вирусных частиц в суспензии, используемой для
эксперимента, (~10-13M, ~27
по ГА (гемаглютинирующая активность))
· Данные, полученные методом ФОЕ
Как уже было упомянуто в разделе Материалы и Методы, в основе методики
ингибирования фокусообразующих единиц лежит подвление количества фокусов
(зараженных вирусом гриппа штамма A/Aichi/2/68 монослоя клеток MDCK) различными концентрациями аналога
клеточных рецепторов - блокатора фетуина. Методика пробит - анализа позволила
получить необходимый параметр эффективности данного ингибитора на основе
полученных экспериментальных зависимостей «Доза ингибитора - ингибирующий
эффект».
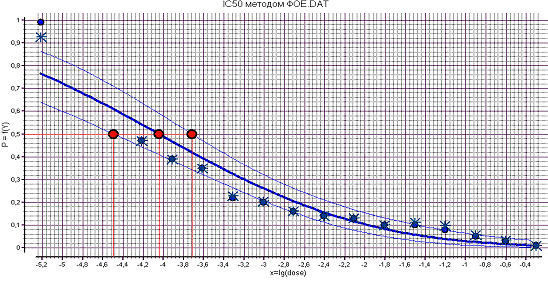

На
рисунке 12 представлена зависимость процента подавления заражения культуры
клеток MDCK вирусом гриппа штамма A/Aichi/2/68
от логарифма дозы ингибитора фетуин. Рассчитанный IC50 составляет 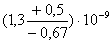 М.
М.
· Данные метода иммуноферментного анализа (ИФА) [41]
На рис.13 представлено взаимодействие штаммов вируса гриппа с аналогом
клеточного рецептора белком фетуином (при +100 С) как в виде экспериментальных
точек, так и теоретическое, представляющее собой прямую линию, проведенную
через экспериментальные точки в координатах Скэтчарда, согласно уравнению:
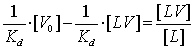

Тангенс угла наклона (рисунок 13) характеризует равновесную константу
ассоциации. Т.е. чем больше угол наклона прямой, тем меньше константа
ассоциации, соответственно больше константа диссоциации. Из данных, приведенных
на рисунке 13, получим константу взаимодействия вируса гриппа штамма
A/Aichi/2/68 с аналогом клеточных рецепторов белком фетуин (при +100С):
Kd=
(0,64±0,1)·10-10М.
Далее аналогичным способом рассматриваются кинетики взаимодействия вируса
с культурой клеток линии MDCK
при +320С и +100С по данным которых мы сможем определить кинетические
параметры, необходимые для решения обратной задачи (рисунки 14,15)


Исследуя зависимости, приведенные на рисунках 14 и 15 были получены
кинетические параметры, приведенные в таблице 1
Таблица 1 Кинетические параметры,
полученные методом ИФА
|
Т, 0С
|
Kd, M
|
k+, M-1·s-1
|
k-, s-1
|
kin, s-1
|
|
+10
|
(3,1±0,3)·10-11
|
(3,3±0,3)·104
|
(1±0,1)·10-4
|
0
|
|
+32
|
(8±0,6)·10-11
|
(1±0,1)·105
|
(3±0,4)·10-4
|
(2±0,2)·10-4
|
Данные параметры позволят более адекватно подобрать аппроксимацию для
решения обратной задачи флуоресцентной детекции, а также позволят оценить
степень достоверности результатов полученных методом флуоресцентной детекции.
· Данные, полученные методом флуоресцентной детекции
Для более быстрой оценки IC50 и
для более тщательного исследования вирус-клеточного взаимодействия мы
предлагаем новый метод - флуоресцентной детекции. Суть его заключается в
детекции изменений, происходящих на поверхности и внутри клетки во время
процесса эндоцитоза (подробнее - Материалы и Методы).
Для этого мы использовали лизо-сенсор DND-167, интенсивность флуоресценции которого резко
увеличивается при понижении pH в
диапазоне от 6, до 5. Этот же диапазон соответствует изменению pH на поверхности и в эндосоме клетки
при проникновении вируса. Таким образом, наблюдая изменение интенсивности
флуоресценции окрашенного вируса на поверхности и внутри клетки, мы можем
судить о стадии процесса эндоцитоза в текущий момент времени.

На рисунке 16 изображена зависимость интенсивности флуоресценции от
времени, прямопропорциональная концентрации вируса, участвующего в процессе
эндоцитоза (3.6). На первых 10 минутах взаимодействия вируса с клеточными
рецепторами виден пик флуоресценции, что говорит о начале адсорбции вируса на
поверхность клеток (в данном случае DND-167 активируется за счет понижения pH в местах связывания вируса с клеткой, происходящего в
результате конформационных изменений HA). Далее, интенсивность не спадает до нуля, а выходит на некоторый
уровень, что свидетельствует о постепенном проникновении вируса в клетку (здесь
начинается активация лизо-сенсора DND-167 за счет снижения pH в
эндосоме клетки). Данную интерпритацию подтверждает та же зависимость, но для
ингибированного фетуином (концентрация ~3·10-8М) вируса: пик флуоресценции
сдвигается в район 16 минут, что говорит о торможении процесса адсорбции за
счет введения конкурента; общая интенсивность падает ~ в 5 раз, что говорит о
торможении всего процесса эндоцитоза и постепенной остановке проникновения
вируса в клетку.
) Нахождение параметра эффективности ингибитора IC50
Исследуя зависимость интенсивности сигнала флуоресценции после 20 минут
взаимодействия вируса с клеточной суспензией от концентрации блокатора фетуина,
стало очевидно, что чем больше концентрация ингибитора, тем сильнее подавляется
сигнал флуоресценции. Таким образом был проведен расчет IC50 методом
пробит-анализа на основе полученных экспериментальных зависимостей «Доза
ингибитора - ингибирующий эффект» используя результаты зависимости подавления
сигнала флуоресценции от концентрации блокатора фетуина.

На рисунке 17 представлена зависимость доли подавления заражения культуры
клеток MDCK вирусом гриппа штамма A/Aichi/2/68 от логарифма дозы ингибитора фетуин.
Рассчитанный
IC50 составляет 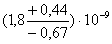 М.
М.
)
Применение построенной теоретической модели на кинетическом эксперименте
Расчет
теоретической зависимости концентрации вируса на поверхности и внутри клетки в
зависимости от времени и начальной концентрации вируса и клеточных рецепторов
позволяет получить кинетические параметры системы вирус гриппа A/Aichi/2/68
- рецепторы клеток MDCK, используя зависимость интенсивности флуоресценции от
времени методом решения обратной задачи.
Используя
данные, полученные методом иммуноферметного анализа, мы подобрали необходимые
коэффициенты для корректной аппроксимации зависимости флуоресценции от времени.
Расчеты проводились при подстановке в уравнение (3.12) начальной концентрации
вируса [V0]= 3,5·10-13M и начальной
концентрации свободных клеточных рецепторов [R0]= 3·10-10M.

По полученной аппроксимации сигнала флуоресценции, приведенной на рисунке
18, получена зависимость концентрации вируса участвующего в процессе эндоцитоза
от времени.
Также по данным аппроксимации рассчитаны кинетические параметры системы
вирус-клетка, находящейся при температуре 370C.
Таблица 2 Кинетические параметры системы «вирус- клетка», полученные
методом флуоресцентной детекции
k+,
(М·min) -1
|
k-,(М·min
)-1
|
kin,(М·min)-1
|
|
37
|
1,5·109
|
0,04
|
0,3
|
Приведенные в таблице 2 данные говорят о быстром осаждении вируса на
клетку, так как максимальная концентрация вируса достигает [VR]m= 2·10-14М (Рисунок 18), а значит время насыщения
клеточных рецепторов вирусом принимает значение tm= 2,6±0,5мин. (см. Теоретическая часть. Модель процесса
эндоцитоза). Это можно объяснить не только самой оптимальной для данного
процесса температурой (37°С), но и тем фактом, что и вирус и клетки находились
в суспензии (в отличие от метода ИФА и ФОЕ, где клетки находились в монослое).
Константа проникновения (kin)
также достаточно высока, что объясняется быстрой адсорбцией вируса на клетку за
счет насыщения системы «вирус - клетка» клеточными рецепторами.
5. Результаты
В нашей работе была получена степень эффективности ингибитора
(противовирусного препарата) методами ФОЕ (стандартный вирусологический метод)
и флуоресцентной детекции. Обработка результатов ингибирования фокусов и
интенсивности флуоресценции системой пробит- анализа позволяет находить
необходимый параметр IC50,
а также сравнивать различные методики для его нахождения.

На рисунке 19 представлены полученные IC50 для ингибитора фетуин методами ФОЕ и флуоресцентной
детекции, которые не отличаются на уровне значимости 5%. Данные о степени
эффективности ингибитора приведены ниже в таблице 3.
Также при решении обратной задачи метода флуоресцентной детекции были
получены кинетические параметры системы «вирус- клетка», полученные для данного
вируса Aichi и клеток линии MDCK методом ИФА. Данные о кинетических
константах также приведены ниже в таблице 3.
Таблица 3 Кинетические параметры, полученные различными методами (*[40])
|
метод
|
T0C
|
k+, М-1·s-1
|
k-, М-1·s-1
|
kin, М-1·s-1
|
tнасыщ, min
|
IC50, М
|
|
ФОЕ
|
37
|
-
|
-
|
-
|
-
|
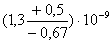
|
|
Флуоресц. детекции
|
37
|
(2,5±0,2)·108
|
(6,6±0,5)·10-4
|
(5±0,3)·10-3
|
2,6±0,4
|
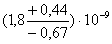
|
|
ИФА
|
32
|
(1±0,1)·105
|
(3±0,4)·10-4
|
(2±0,2)·10-4
|
30±2
|
-
|
|
ИФА
|
10
|
(3,3±0,3)·104
|
(1±0,1)·10-4
|
0
|
-
|
-
|
|
(A/PR8/34)+ MDCK*
|
20
|
-
|
-
|
2,6·10-4
|
-
|
-
|
Полученные значения, приведенные в таблице 3 хорошо согласуются между
собой: при увеличении температуры возрастают k+ и kin
(за счет повышения пластичности мембраны клетки (можно сказать ее плавления),
что приводит большей гибкости и в конечном итоге к более быстрому (за счет
этого с ростом температуры уменьшается tнасыщ) и более крепкому взаимодействию нескольких рецепторов
с одним вирионом).
k -
остается практически неизменным.
kin
возрастает резко: от отсутствия эндоцитоза при 100С до резкого увеличения на
порядок при 370С (в сравнении с 320С).
Однако, существенные различия между параметрами, полученными данными
методами можно объяснить тем, что во всех методиках, кроме флуоресцентной
детекции (ФОЕ, ИФА, [40]) использовался клеточный монослой, тогда как в методе
флуоресцентной детекции для насыщения системы клеточными рецепторами,
использовалась клеточная суспензия, что объясняет самую быструю адсорбцию
вируса на клетку.
Таблица 4 Сравнительная характеристика методов ФОЕ, ИФА и флуоресцентной
детекции на основании полученных результатов
|
метод
|
IC50
|
[VR]in(t)
|
[VR]s(t)
|
k±
|
tнасыщ
|
kd(Vi+ing)
|
kd(Vi+cells)
|
Рабочее время
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
~24ч.
|
|
ИФА
|
-
|
-
|
+
|
+
|
+
|
+
|
+
|
~1,5ч.
|
|
Фл. детекции
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
~30м.
|
В таблице 4 приведена сравнительная характеристика методов,
рассматривающихся в данной работе. Разработанный нами метод (флуоресцентной
детекции) позволяет получить данные о системе в любой момент времени, что
является несомненным преимуществом над другими методиками. Методом
флуоресцентной детекции можно определить параметр эффективности ингибитора IC50, концентрацию вируса не только на
поверхности [VR]s(t), но и внутри клетки [VR]in(t), а также интересующие кинетические
параметры системы «вирус - клетка». Время, затраченное на проведение
эксперимента по которому определяются все необходимые параметры флуоресцентным
методом ~ 30минут, что является наименьшим экспериментальным временем.
6. Заключение
Для исследования вирус- клеточного взаимодействия разработан новый метод
флуоресцентной детекции, основанный на измерении степени активации клетки
(изменение внутреклеточного pH) в
ходе процессов связывания и проникновения вируса в клетку. Экспериментальные
исследования показали, что ингибирование интенсивности флюоресценциии
коррелирует с ингибированием инфекционности вируса гриппа, поэтому данный метод
позволяет определять степень эффективности вирусного ингибитора
(противовирусного препарата), что было подтверждено с помощью общепризнанного
метода фокусообразующих единиц (ФОЕ). Используя метод флуоресцентной детекции
были получены кинетические параметры системы «вирус- клетка», которые не только
не противоречат ранее известным, но и совпадают в пределах разумных возможных
допущений (что подтверждается данными полученными методами иммуноферметного
анализа (ИФА), а также литературными данными [40])
Немаловажен и тот факт, что часто при работе с биологическими системами,
наименьшее время проведения эксперимента говорит о лучшей точности определяемых
параметров. Именно поэтому метод флуоресцентной детекции можно рассматривать
как один из наиболее современных и точных методов современной биофизики.
Разработана кинетическая модель взаимодействия вируса с клеткой,
учитывающая процесс эндоцитоза, которая достаточно хорошо описывает
экспериментально наблюдаемый процесс активации лизо-сенсора DND-167 в результате рецептор-
обусловленного эндоцитоза. Данная кинетическая модель позволяет решать обратную
задачу флуоресцентной детекции и находить необходимые кинетические параметры
системы, а также прогнозировать поведение штамма вируса на первых этапах
процесса эндоцитоза (связывание и проникновение).
· Итоги работы:
o Разработан новый метод определения эффективности ингибитора и
кинетических параметров системы «вирус-клетка» с применением флуоресцентной
детекции
o Построена теоретическая модель процесса вирус-клеточного
взаимодействия
· Выводы:
o Полученные IC50 с
помощью стандартного вирусологического и нового флуоресцентного методов не
отличаются на уровне значимости 5%
o Теоретическая модель, описывающая эндоцитоз, применима для
расчетов кинетических параметров системы «вирус- клетка»
o Разработанная методика измерения степени активации методом
флуоресцентной детекции в различные моменты времени позволяет судить о стадиях
процесса эндоцитоза, в которых находится система «вирус-клетка».
7.
Список литературы
1. Compans R.W., Choppin P.W. Reproduction of
myxoviruses. Comprehensive virology, N.Y., p.179-252, 1975.
2. Naim H.Y., Roth M.G. Basis for the selective
incorporation of glycoproteins into the influenza virus envelope. Virology,
p.4831-4841, 1993.
. Heggeness M.H., Smith P.R., Ulmanen I.
Studies of the helical nucleocapsid of influenza virus. Virology, p.466-470,
1982.
. Lamb R.A., Krug R.M. Orthomyxoviridae : the
viruses and their replication. In: Fields Virology. Edited by B. N. Fields, D.
M. Knipe, P.M. Howley. Philadelphia: Lippincott-Raven, p.1353-1395, 1996.
. Compans R. W., Content J., Duesberg P. H.
Structure of the ribonucleoprotein of influenza virus. Virology, p.795 - 800,
1972.
. Wu W.W. H., Weaver L.L., Pante N.
Ultrastructural Analysis of the Nuclear Localization Sequences on Influenza A
Ribonucleoprotein Complexes. Molecular Biology, p. 910-916, 2007.
. Baudin F., Bach C., Cusack S. et al.
Structure of influenza virus RNP: I. Influenza virus nucleoprotein melts
secondary structure in panhandle RNA and exposes the bases to the solvent.
EMBO, p. 3158-3165, 1994.
. Elleman C.J., Barclay W.S. The M1 matrix
protein controls the filamentous phenotype of influenza A virus. Virology,
p.144-153, 2004.
. Horimoto T, Kawaoka Y. Influenza: lessons
from past pandemics, warnings from current incidents. Natl. Rev. Microbiology,
p.591-600, 2005.
. Baigent S.J., McCauley J.W. Influenza type A
in humans, mammals and birds: determinants of virus virulence, host-range and
interspecies transmission. BioEssays, p.657-671, 2003.
. Matrosovich M.N., Klenk H.-D., Kawaoka Y.
Receptor specificity, host range and pathogenicity of influenza viruses.
Influenza Virology: Current Topics. Kawaoka Y. (Ed.). Caister Academic Press,
Wymondham, England, p.95-137, 2006.
12. С. Лурия, Дж. Дарнелл, Д.Балтимор, Э. Кэмпбелл, Общая
вирусология, Мир, 1981.
13. McClintock P. R., Billups L.C., Notkins A.L.,
Receptors for encephalomyocarditis virus on murine and human cells, Virology,
106, 261 - 227, 1980.
. Korte T., Herrmann A., pH-Dependent binding
of the fluorophore bis-ANS to influenza virus reflects the conformational
change of hemagglutinin. European Biophysics Journal, p.105-113, 1994.
. S. Patterson, J.S. Oxford. Early interaction
between animal viruses and the host cell: relevance to viral vaccines. Vaccine,
p.79-90, 1986.
. Blumenthal R., Bali-Puri Anu, Walter A.,
Covell D., Eidelman Ofer. pH-dependent Fusion of Vesicular Stomatitis Virus
with Vero Cells. Biological Chemistry, p.13614-13619, 1986.
. Daniel L. Floyd, Justin R. Ragains, John J.
Skehel, Stephen C. Harrison, Antoine M. van Oijen. Single-particle kinetics of
influenza virus. PNAS, p.15382-15387, 2008.
18. Плюснина Т.Ю., Лаврова А.И., Ризниченко Г.Ю., Рубин
А.Б.. Моделирование неоднородного распределения и колебаний трансмембранного
потенциала и pH вблизи внешней стороны мембраны
клетки водоросли Chara coralline. Биофизика, с. 492-499, 2005.
19. Matrosovich M.N., Mochalova L.V., V.P.Marinina, N.E.Byramova, N.V.Bovin. Synthetic polymeric sialoside inhibitors of influenza virus receptor-binding activity. FEBS Lett., 209-211, 1990.
20. M.N.Matrosovich, A.S.Gambaryan, A.B.Tuzikov, N.E.Byramova, L.V.Mochalova, A.A.Golbraikh, M.D.Shenderovich, J.Finne, N.V.Bovin. Probing of the receptor-binding sites of the H1 and H3 influenza A and influenza B virus hemagglutinins by synthetic and natural sialosides. Virology, p.111-121, 1993.
21. A.S.Gambaryan, V.E.Piskarev, A.M.Sakharov, A.B.Tuzikov, N.V.Bovin, N.E.Nifant'ev, M.N.Matrosovich. H1, H3, and B human influenza virus recognition of sialyloligosaccharides. FEBS Lett., p.57-60, 1995.
. Melike Lakadamyali, Michael J. Rust, Xiaowei
Zhuang. Endocytosis of influenza viruses. Microbes and infections, p.929-936,
2004.
. Boerries Brandenburg, Lily Y. Lee, Melike
Lakadamyali, Michael J. Rust, Xiaowei Zhuang, James M. Hogle. Imaging
Poliovirus Entry in Live Cells. PLOS Biology, p.1543-1555, 2007.
. Martin K., Helenius A. Nuclear transport of
influenza virus ribonucleoproteins: the viral matrix protein (M1) promotes
export and inhibits import. Cell, p.117-130, 1991.
. Whittaker G., Bui M., Helenius A. The role of
nuclear import and export in influenza virus infection. Cell Biology, p.67-71
1996.
. Hess S.T., Kumar M., Verma A. Quantitative
electron microscopy and fluorescence spectroscopy of the membrane distribution
of influenza hemagglutinin. Cell Biology, p.965-976, 2005.
. Ali A., Avalos R.T., Ponimaskin E. Influenza
Virus Assembly: Effect of Influenza Virus Glycoproteins on the Membrane
Association of M1 Protein. Virology, p.8709-8719, 2000.
. Lohmeyer J., Talens L.T., Klenk H.D.
Biosynthesis of the influenza virus envelope in abortive infection. Genetic
Virology, p.73-88, 1979.
. Yasuda J., Bucher D.J., Ishihama A. Growth
control of influenza A virus by M1 protein: analysis of transfectant viruses
carrying chimeric M gene. J.Virology, p.8141-8146, 1994.
. Chen Chen, Xiaowei Zhuang. Epsin 1 is a
cargo-specific adaptor for the clathrin-mediated endocytosis of the influenza
virus. PNAS, p.11790-11795, 2008.
. Boerries Brandenburg, Xiaowei Zhuang. Virus
trafficking - learning from single- virus tracking. Microbiology, p.197-208,
2007.
. Michael J Rust, Melike Lakadamyali, Feng
Zhang, Xiaowei Zhuang. Assembly of endocytic machinery around individual
influenza viruses during viral entry. Nature Structural and Molecular Biology,
p.567-573, 2004.
. Tatsuya Sakai, Masanobu Ohuchi, Masaki Imai,
Takafumi Mizuno, Kazunori Kawasaki, Kazumichi Kuroda, Shohei Yamashina. Dual
Wavelength Imaging Allows Analysis of Membrane Fusion of Influenza virus inside
cell. Virology, p.2013-2018, 2006.
. T.J.Wickham, R.R.Granados, H.A.Wood,
D.A.Hammer, and M.L.Shuler. Biophys.J., Vol.58, p.1501-1516, 1990.
. Perelson A.S. DeLisiC., Wiegel F.W. eds.,
Marcel Dekker. Some mathematical models of receptor clustering by multivalent
ligands: in Cell surface dynamics: concepts and models. New York, p.223-275,
1983.
. Posner R.G., Wofsy C., Goldstein B. The
kinetics of bivalent ligand-bivalent receptor aggregation: ring formation and
the breakdown of the equivalent site approximation. Math. Bioscience., v. 126,
p.171-190, 1995.
38. Варфоломеев С.Д., Гуревич К.Г., Биокинетика. Москва: Наука 1999.
. Abraham R. Tzafriria., David Wua, Elazer R.
Edelmana. Analysis of compartmental models of ligand-induced endocytosis.
Theoretical Biology, p.127-138 2004.
. Nunes-Correia, Isabel (Univ of Coimbra);
Ramalho-Santos, Joao; Nir, Shlomo; Pedroso de Lima, Maria C. Interactions of
influenza virus with cultured cells: Detailed kinetic modeling of binding and
endocytosis. Biochemistry, p.1095-1101, 1999.
41. Сальников А.С., Изучение влияния рецепторной специфичности
штаммов вируса гриппа на кинетику вирус- клеточного взаимодействия.
Новосибирск, 2006.