Возможности внекишечной декомпрессии брюшной полости при острой кишечной непроходимости
ВОЗМОЖНОСТИ
ВНЕКИШЕЧНОЙ ДЕКОМПРЕССИИ БРЮШНОЙ ПОЛОСТИ ПРИ ОСТРОЙ КИШЕЧНОЙ НЕПРОХОДИМОСТИ
ДИССЕРТАЦИЯ
на
соискание ученой степени кандидата медицинских наук
Введение
Актуальность проблемы
Лечение больных с острой кишечной
непроходимостью - одна из наиболее сложных задач ургентной хирургии. Несмотря
на совершенствование оказания высокотехнологичной помощи населению (особенно
реанимационной) и оптимизацию организационных мероприятий летальность при
данном заболевании остается очень высокой - 18%-20% (Александров Н.Н. с соавт.,
1980; Белкания С.П., 1983; Петров В.П., Ерюхин И.А, 1989; Нифантьев О.Е.,
1989).
В последнее десятилетие в литературе
обсуждается вопрос о внутрибрюшном давлении и его влиянии на гомеостаз
организма. По мнению А.П. Чадаева (2003), Sugerman R. (1999), основное патологическое
влияние повышенного внутрибрюшного давления заключается в нарушении
микроциркуляции не только в замкнутом пространстве, которым является брюшная
полость, но и в других органах. Ишемия органов, заключенных в брюшной полости
приводит к угасанию их функций, а в дальнейшем к системным гемодинамическим
нарушениям (Шигаев М.Ю., 2005; Долишний В.Н., Шигаев М.Ю., 2007; Тимербулатов
В.М, 2008; Sugrue M. et al., 1998; Malbrain
M.L. et al, 2005; Parr M.J., 2006). В отечественной литературе этот синдром получил название
синдром брюшной полости, в иностранной - abdominal compartment syndrome.
Клинико-патофизиологические механизмы развития этого синдрома, а также меры его
профилактики и лечения, в настоящее время изучены недостаточно (Чадаев А.П. и
соавт., 2003). Это побуждает обращать внимание на ряд компонентов патогенеза
острой кишечной непроходимости, ранее казавшихся малозначимыми или
неизвестными. В частности недостаточно изучены возможности внекишечной
декомпрессии брюшной полости при ликвидации кишечной непроходимости, что и
определило цель и задачи настоящего исследования.
Цель работы: разработать, научно обосновать, внедрить в клиническую практику
способ хирургической коррекции повышенного внутрибрюшного давления и улучшить
результаты лечения больных острой кишечной непроходимостью.
Задачи исследования:
1. Изучить физические
свойства фасциально-апоневротических структур передней брюшной стенки.
2. На основании полученных
данных разработать способ хирургической коррекции повышенного внутрибрюшного
давления в эксперименте.
. Провести экспериментальное
обоснование коррекции повышенного внутрибрюшного давления предложенным
способом.
. Оценить результаты лечения
больных кишечной непроходимостью при сочетании кишечной и внекишечной
декомпрессии брюшной полости.
Научная новизна
На основании оригинального
экспериментального исследования доказана возможность внекишечной коррекции
внутрибрюшного давления.
Показано, что рассечение передних
листков влагалищ прямых мышц живота увеличивает линейные размеры передней
брюшной стенки и объём брюшной полости.
Ушивание раны апоневроза по белой
линии живота при выполненной декомпрессивной фасциотомии приводит к снижению
нагрузки на швы на 30-45%.
Доказано, что толщина и растяжимость
переднего и заднего листков влагалищ прямых мышц живота зависят от расположения
листков, пола людей, а прочность - от расположения листков.
Установлено, что имеется связь между
внутрибрюшным и средним артериальным давлениями, что определяет нарушение
перфузии внутренних органов.
Практическая значимость
1. Экспериментально
разработанная методика рассечения передних листков влагалищ прямых мышц живота
позволяет улучшить результаты лечения больных кишечной непроходимостью за счет
внекишечной коррекции давления в брюшной полости.
2. Усовершенствован алгоритм
диагностики больных острой обтурационной толстокишечной непроходимостью,
который позволяет контролировать эффективность лечения больных этой патологией.
. Данные о физических
свойствах апоневротических листков передней брюшной стенки могут быть
использованы при разработке реконструктивных операций на передней брюшной
стенке.
Положения, выносимые на
защиту
1. Прочность и растяжимость
переднего и заднего листков влагалища прямых мышц живота обеспечивают
функциональную состоятельность брюшной стенки при условии повреждения одного из
листков.
2. Увеличение линейных
размеров передней брюшной стенки при повышении внутрибрюшного давления
лимитируется растяжимостью листков влагалищ прямых мышц живота и зависит от его
формы.
. Декомпрессивная фасциотомия
передних листков влагалищ прямых мышц живота в условиях повышенного ВБД
позволяет увеличить объём брюшной полости на 2000 - 4000 мл, что способствует
снижению внутрибрюшного давления.
. Комбинированная (кишечная и
внекишечная) декомпрессия брюшной полости улучшает результаты лечения больных с
ОКН за счет раннего восстановления системной внутриорганной перфузии.
Апробация работы
Основные положения работы обсуждены
на расширенном межкафедральном совещании по хирургии ТГМА (14 апреля 2009),
Тверском региональном обществе хирургов (23 апреля 2009).
Внедрение результатов
работы
Результаты исследования внедрены в
практическую деятельность областного онкологического диспансера, г. Тверь,
городских клинических больниц №4 и №6, г. Тверь. Данные, полученные автором,
используются в учебном процессе на кафедре факультетской хирургии с курсом
онкологии.
Личный вклад автора в
проведение исследования
Автором проведены анатомические
исследования на нефиксированных трупах людей разного пола и возраста.
Разработан и запатентован способ внекишечной декомпрессии брюшной полости.
Проведены экспериментальные исследования на незамороженных трупах людей.
Статистическая обработка материала выполнена с использованием современных
статистических методов. Автором выполнены операции больным с кишечной
непроходимостью и оценены их результаты.
1. Современные взгляды
на патогенез и лечение острой кишечной непроходимости (обзор литературы)
До настоящего времени основным
критерием оценки эффективности лечения кишечной непроходимости является частота
летальных исходов. В немногочисленных специализированных центрах абдоминальной
хирургии число летальных исходов приближено к 2-3%. В большинстве же
общехирургических отделений этот показатель составляет около 18-20%. Такое
различие в показателях летальности зависит от оказания медицинской помощи этой
категории больных. Критерии хирургической и реанимационной помощи данной
категории больных недостаточно разработаны. Дискуссионность ряда проблем
патогенеза, хирургического и консервативного лечения кишечной непроходимости
диктует необходимость разработки и внедрения рациональных путей своевременной
диагностики заболевания и лечения таких больных с учетом данных
экспериментальных и клинических исследований.
1.1 Эпидемиология острой кишечной непроходимости
Острая кишечная непроходимость (ОКН)
- это заболевание, характеризующееся нарушением пассажа кишечного содержимого в
направлении от желудка к прямой кишке, объединяющее осложненное течение
различных по этиологии заболеваний и патологических процессов (Александров Н.Н.
с соавт., 1980; Астапенко В.Г., Максимов С.С., 1982; Белкания С.П., 1983;
Петров В.П., Ерюхин И.А, 1989; Нифантьев О.Е., 1989).
ОКН занимает четвертое-пятое место
по распространенности среди острых хирургических заболеваний и составляет 3,8%
от всех острых хирургических заболеваний брюшной полости (Макаров А.А., 1998;
Алиев С.А., 1998, 1999; Брискин Б.С., 1999; Ерюхин И.А. с соавт., 1999;
Мартынюк В.В., 2004; Савельев В.С., 2006; Ammaturo C., Cirillo F., 1999). Частота встречаемости ОКН
по уровню препятствия: тонкокишечная 60-70%; толстокишечная 30-40% (Mucha P., 1987; Chadle W.G., Garr E.E., 1988; Richards W.O., Williams L.F., 1988).
Наиболее частой причиной кишечной
непроходимости являются спайки брюшной полости (Женчевский Р.А., 1989; Menzies D., 1999; Miller G., 2000). Эта форма непроходимости
начала встречаться чаще в связи увеличением количества операций на органах
брюшной полости и успешного лечения гнойно-воспалительных заболеваний брюшной
полости, в том числе перитонитов различной этиологии (Гостищев В.К. и соавт.,
1992; Мартов Ю.Б., 1998; Жебровский В.В., Эльбашир М.Т., 2004). Другой причиной
кишечной непроходимости является опухолевое поражение кишки, что особенно у лиц
пожилого и старческого возраста. В этой возрастной группе опухоли толстой кишки
имеют осложненное течение в 42,5% - 86,2% случаев (Александров Н.Н. с соавт.,
1980; Белкания С.П., 1983; Ерюхин И.А, 1989; Нифантьев О.Е., 1989). По данным
Э.В. Луцевича и соавт. (1982), чаще непроходимость толстой кишки встречается у
лиц пожилого и старческого возраста (53%). В этой возрастной группе преобладают
опухолевые обтурационные формы кишечной непроходимости. Средний возраст
больных, страдающий спаечной кишечной непроходимостью меньше, чем больных с опухолевой
непроходимостью. Обтурационная непроходимость в 2 раза чаще развивается при
раке левой половины ободочной кишки, чем её правой половины (Мартынюк В.В.,
Давыдов М.И., 2004, Касчиато Д. 2008). По данным Г.А. Ефимова и Ю.М. Ушакова
(1984), у 90%-100% больных с осложненным раком ободочной и прямой кишок
выявляется III-IV стадии заболевания. Рост случаев рака толстой кишки не приводит к
существенному росту случаев кишечной непроходимости, что связано с улучшением
диагностики рака толстой кишки.
Несмотря на выраженную клиническую
картину и большие возможности для выявления непроходимости при раке ободочной
кишки, эти больные поступают в стационары в более поздние сроки. Так, позднее
24 часов от начала заболевания госпитализируется 75%-90%, тогда как при других
формах острой кишечной непроходимости позже суток в стационар поступают
8,8%-29% больных. Такая разница в сроках госпитализации связана с постепенным
нарастанием симптомов (Луцевич Э.А., 1982; Алиев А.С., 2005).
При одной и той же форме кишечной
непроходимости, показатели летальности различные (Александров Н.Н. с соавт.,
1980; Белкания С.П., 1983; Петров В.П., Ерюхин И.А, 1989; Нифантьев О.Е.,
1989). Это объясняется длительностью болезни, временем обращения за медицинской
помощью, возрастом больного, наличием сопутствующей патологии. Так, по мнению
А.С. Алиева (2005), у больных старшей возрастной группы частота
послеоперационных осложнений и летальность выше, чем в других возрастных
группах. При сочетании кишечной непроходимости и хронических заболеваний в
стадии декомпенсации показатели летальности увеличиваются в среднем на 20%
(Кныш В.И. и соавт., 2001). При спаечной непроходимости диагностика бывает
затруднительной, что приводит к некоторой отсрочке хирургического лечения, а,
следовательно, к увеличению частоты послеоперационных осложнений и летальности.
Эти же авторы связывают высокую частоту летальных исходов с развитием
гнойно-септических осложнений в брюшной полости, пневмоний, нарушений в системе
коагуляции (ТЭЛА).
Таким образом, несмотря на разработку
новых диагностических и лечебных мероприятий, летальность при кишечной
непроходимости остаётся высокой. Перспектива снижения летальности, по-видимому,
будет определяться изучением поликомпонентного патогенеза ОКН и созданием на
его основе рациональной системы лечения (как консервативного, так и
хирургического).
1.2 Патофизиологические
механизмы обтурационной кишечной непроходимости
Многокомпонентный патогенез кишечной
непроходимости не позволяет выделить в нем доминирующие механизмы. В зависимости
от вида и уровня кишечной непроходимости отмечается преобладание того или иного
фактора. Важную роль в развитии непроходимости играет механический фактор,
вызывающий обструкцию просвета кишки (как извне, так и изнутри).
Большинство авторов полагают, что ключевым
моментом патогенеза являются расстройства внутристеночной микроциркуляции,
которые поддерживают не только местные изменения, но и определяют развитие
гиповолемии (Мещерякова М.А., 1973; Лебзак К.Ф., 1980; Кравчук А.А., 1985;
Ерюхин И.А. и соавт., 1985). Суть изменений микроциркуляции составляют спазм
артериол, расширение венул вследствие компрессии сосудов брыжейки, что приводит
к экстравазации компонентов крови с образованием отека слизистой кишки и
микрокровоизлияний, агрегации форменных элементов (Кащенко Л.Г., Мильдзихов
Г.У., 1990; Титова Г.П. с соавт., 1999). Ряд авторов объясняет развитие этих
процессов влиянием биологических аминов, приводящих к параличу прекапиллярных
сфинктеров, развитию стаза в микрососудах, агрегации форменных элементов (Липшиц
Р.У. и соавт., 1991; Высоцкий Ю.А., 1994; Милюков В.Е., Сапин М.Р., 2006; Enochsson L. et al, 1982). Эти изменения
приводят к интерстициальному отеку, усугубляемому расстройством
коллиодно-осмотических и электролитных взаимоотношений плазмы и интерстициальной
жидкости (Фесенко В.П. и др., 1990; Richards W.O., 1988). Изменения
гемоциркуляции при ОКН усиливают развитие пареза и приводят к переполнению
кишечника жидким содержимым. Скопление жидкости и газов выше места препятствия
способствует росту внутрикишечного давления. Рост внутрикишечного давления
приводит к нарушению капиллярного кровообращения внутри кишечной стенки,
начиная с уровня 15 мм. рт. ст. При 40 мм. рт. ст происходит полное опустошение
микроциркуляторного русла кишечной стенки (Добряков Б.С., Лебзак К.Ф., 1979;
Дедерер Ю.М., 1981; Попова Т.С. и соавт., 1991). Ряд авторов не согласны с этим
утверждением, т.к. проведенные исследования указывают на сохранность кровотока
при таком уровне давления (Shikata J. et al., 1983). При этом все сходятся во мнении, что длительная
интралюминальная гипертензия (в течение 3 - 6 часов) на уровне 40 - 60 мм. рт.
ст. приводит к массивным кровоизлияниям по ходу прямых сосудов. Под влиянием
ишемии, активации процессов пероксидации, воздействия микробных и тканевых
токсинов возникает деструкция кишечной стенки по типу геморрагического инфаркта
(Жижин Ф.С., 1985; Биленко М.В., 1989; Нечаев Э.А и соавт., 1993; Telford G.L., 1993; Pastores S., 1996; Santini S.A., 1997).
Подобные изменения особенно характерны для престенотического участка кишки
(Макарова Н.П., Троицкий Б.С., Пескова Н.Г., 2000; Затолокина М.А., 2008).
Рядом авторов, в патогенезе ОКН,
признается ведущее значение нарушений моторной функции кишечника.
Патологическая импульсация из пораженной кишки приводит к стрессовой активации
симпатической нервной системы и угнетению кишечной моторики (Гальперин Ю.М.,
1975; Эттингер А.А. и др., 1986, 1987; Курыгин А.А., 1984; Царев Н.И., 1990).
Стойкие механизмы блокады перистальтики включаются на фоне циркуляторной гипоксии
и нарастающих явлений эндогенной интоксикации (Дедерер Ю.М., 1981; Зайцев В.П.,
1987). Установлена прямая связь между региональной гемодинамикой и двигательной
активностью тонкой кишки. По данным А.П. Эттингера (1986) и Е.Н. Васина (1988)
именно гипоксия, несмотря на высокую устойчивость нервных сплетений кишки к
ишемии, приводит к постепенной утрате передачи возбуждения по интрамуральному
энтеральному нервному аппарату. Ряд авторов (Белый В.Я., 1987) считает главной
причиной утраты энтеромиоцитами способности к восприятию импульсов к
сокращению, потерю электролитов и особенно калия. В.Г. Середин (1988) и E.A. Deitch (1989) доказывают, что
главное угнетающее действие на мышечную активность кишки имеют эндотоксины
микроорганизмов. Появление эндотоксинов в просвете кишки, а затем и её стенке,
связано с микробной колонизацией тонкой кишки на фоне пареза. В.Н. Чернов и
соавт. (1999) и M. Hill (1985) полагают, что наиболее физиологичным и эффективным
механизмом защиты от избыточной колонизации тонкой кишки является ее
перистальтическая активность. По мере развития пареза происходит интенсивная
колонизация тонкой кишки (Ackay M.N. et al., 1996). При развитии внутристеночных расстройств микроциркуляции
отмечается транслокация бактерий в портальный кровоток (Галлеев Ю.М., 2008;
Kale I.T., 1998; Deitch E.A., 2006). Бактериальная колонизация и продукты
деградации (лизосомальные ферменты) лейкоцитов, атакующих микроорганизмы,
приводят к дегенеративным изменениям микроворсинок эпителиоцитов, усугубляемым
микроциркуляторными нарушениями (Deandhare R., 1980, Levett
P.W., 1981; Garcia-Perez J.C., 2005). Отмечено, что через 15 минут
после пережатия верхней брыжеечной артерии происходит разобщение эпителия и
базальной мембраны, а через 1 час после создания экспериментальной кишечной
непроходимости бактерии переходят в лимфатические узлы брыжейки (Гостищев В.К.
и соавт., 2006; Mishina Y., Hozie Y., 1980; MacFie J., 2006). R.D. Berg в 1983 году, обобщив результаты своих исследований, касающихся
проблем транслокации бактерий выделил три основных фактора, способствующих
этому процессу: повышение концентрации бактерий в тонкой кишке; нарушение
физиологической целостности слизистой оболочки тонкой кишки; снижение
резистентности эпителиоцитов к экстремальным факторам.
Эндотоксикоз при ОКН носит
многокомпонентный характер. Основным источником интоксикации при кишечной
непроходимости является сам кишечник. Его роль как источника интоксикации
определяется нарушением барьерной функции кишечной стенки и развитием
дисбактериоза за счет миграции в проксимальные отделы анаэробной флоры (Попов
В.А., 1982; Ерюхин И.А. и соавт., 1989; Рухляда Н.В., 1989; Чернов В.Н., Белик
М.Б и др., 1998; Смирнов К.В., 1990). Нарушение барьерной функции кишечной
стенки некоторое время компенсируется детоксицирующим влиянием печени, до
момента присоединения второго источника интоксикации - перитонита. Появление
перитонита приводит к переходу эндотоксемии в лимфатическое русло и значительно
ухудшает состояние больного не только в связи с нарастанием общей токсической
массы во внутренних средах, но и за счет длительного её там нахождения (Mattei
Р., 2006)
Метаболические нарушения,
возникающие вслед за циркуляторной гипоксией, представлены, в первую очередь,
расстройством водно-электролитного баланса. Потеря жидкости с рвотой,
транссудация в полость кишечника, отек кишечной стенки, перитонит со
значительным количеством экссудата приводят к тяжелой гипогидратации
(гиповолемии). При этом наиболее важным аспектом являются потери калия,
приводящие к развитию гипокалемического алкалоза (Дедерер Ю.М., 1971;
Александров И.Н., 1980; Русаков В.И. и соавт., 1982; Рябов Г.А., 1983; Ерюхин
И.А., Петров В.П., 1998).
Таким образом, в основе патогенеза
кишечной непроходимости лежит нарушение микроциркуляции в кишечной стенке, последствия
которой хорошо изучены. Однако остаётся непонятным, только ли нарушением
пассажа по кишечной трубке можно объяснить нарушение микроциркуляции и
последующее развитие системных нарушений? Очевидно, имеет место некие системные
факторы, способные влиять на гомеостаз. Среди таких факторов в настоящее время
все большее число исследователей выделяет повышение внутрибрюшного давления. В
литературе появляются сведения о связи внутрибрюшного давления и кишечной
непроходимости (Татьков С.С., 1998; Абакумов М.М. и соавт., 2003; Шигаев М.Ю.,
2005; Malbrain M.L., 2005, 2006). Они заключаются в констатации факта повышения
внутрибрюшного давления при ОКН, ориентирует на необходимость его мониторинга и
оценку динамики, влияние его коррекции на показатели летальности. При этом
влияние повышенного внутрибрюшного давления на течение послеоперационного
периода больных с ОКН остается малоизученным.
В литературе четко обозначено
суждение, что повышение внутрибрюшного давления оказывает отрицательное влияние
не только на микроциркуляцию в органах брюшной полости, но и на весь организм
человека «от макушки до носков» (Sugerman
H.J., 1999; Balogh Z., 2007; Wauters J., 2007).
В норме ВБД равно 0 - 3 мм. рт. ст.
Выделяют 4 степени внутрибрюшной гипертензии по J.M. Burch. I степень - 10-15 см. вод. ст.; II - степень - 16-25 см.
вод. ст.; III степень - 23-35 см. вод. ст.; IV степень - более 35 см.
вод. ст.
Повышение давления в брюшной полости
приводит к компрессии крупных сосудов, определяющей основные изменения
центральной гемодинамики. Прямое действие повышенного ВБД на нижнюю полую вену
приводит к снижению венозного возврата и преднагрузки из-за депонирования крови
(Ho K.W. et al., 1998; Wachsberg R.H. et al., 1998; P.J. Pickhardt et al., 1999; Cernea D., 2006). Высокое ВБД увеличивает
среднегрудное давление, которое отражается на работе сердца и приводит к
снижению градиента давления на миокард, ограничивая диастолическое заполнение
желудочков. (Barnes G.A. et al.,
1989; Cullen D.J. et al., 1989; Kitano Y. et al., 1999). Увеличение внутригрудного давления повышает давление в легочных
капиллярах, уменьшает ударный объём сердца, снижает венозный возврат (Vivier E., 2006). Сердечный выброс в
начальных стадиях может не изменяться или повышаться вследствие повышения
объёма циркулирующей крови за счет снижения спланхнического кровотока, а затем
снижается, несмотря на компенсаторную тахикардию (Cheatham M.L., 2007). Снижение спланхнического
кровотока обуславливается ростом общего периферического сопротивления сосудов,
что связано с прямым сдавливанием обширного сосудистого ложа брюшной полости, а
затем и рефлекторно в ответ на снижение сердечного выброса. Артериальное
давление может длительное время оставаться нормальным за счет повышения ПСС.
Повышение внутригрудного давления могут приводить к неадекватному повышению
центрального венозного давления и давления заклинивания легочной артерии.
Следовательно, наличие высоких значений ЦВД вовсе не означает отсутствие
гиповолемии (Hering R. et al., 1998; Sugerman
H.J. et al., 1999). Поэтому показатели давления в крупных сосудах не
отражают истинного состояния гемодинамики и объёма циркулирующей крови (Markou N., 2004; Küntscher M.V., 2006; Duperret S., 2007). По мнению Cheatham M.L. (1999) достоверное представление о
гемодинамике можно получить только путем измерения сердечных объёмов и
сердечных индексов с помощью эхокардиографии.
Со стороны системы дыхания также
происходят значительные изменения. Дислокация диафрагмы в грудную полость
приводит к значительному росту внутригрудного давления, в результате чего
снижаются дыхательный объем и функциональная остаточная емкость легких (Cullen D.J., 1989; Obeid F., 1995). Снижение динамического
комплайенса грудной клетки перераспределяет вентиляцию в основном в верхушки
легких (Ranieri V.M., 1997). Ухудшается вентиляционно-перфузионное отношение, что
приводит к открытию легочного шунта (Pelosi P., 2007). Сниженный сердечный выброс ещё больше повышает легочный
шунт (изменения, подобные вышеописанным, были обнаружены также при ОКН - А.Н.
Кузнецов, В.Е. Милюков, 2008). Данные изменения приводят к снижению
эффективности дыхания и нарастанию тяжелых метаболических сдвигов, которые
представлены гипоксемией, гиперкапнией и респираторным ацидозом (Gudmundsson F.F., 2004).
Особенностью почечной дисфункции при
повышении внутрибрюшного давления, в первую очередь, является снижение
почечного кровотока, которое приводит к снижению гломерулярной фильтрации и
росту уровней мочевины и креатинина (Caldwell
C.B., 1986; Meldrum
D.R., 1997; Sugrue M., 1999; Shear W., 2006). Снижение почечного кровотока обусловлено несколькими
факторами: прямой компрессией паренхимы, которая определяет повышение почечного
сосудистого сопротивления (Stone H.H., 1977; Watson
R.A., 1998; Doty J.M., 1999); снижением сердечного выброса (Lindström P., 2003); сдавлением почечных вен и
ростом интравенозного давления за счет прямой компрессии нижней полой вены.
Подобные изменения почечного кровотока способствуют гормональным сдвигам,
которые представлены повышением секреции антидиуретического гормона, ренина и
альдостерона (Doty J.M., 2000). Снижение венозного возврата значительно уменьшает
продукции натрий-уретического пептида предсердий. Все это приводит к развитию
вначале олигоурии, а затем и анурии (Harman
P.K., 1982; Sugrue M., 1999; Ma Y.M. 2005; Altintas F., 2001; Cleva Rd.R., 2001). В соответствии с данными этих авторов, снижение диуреза
отмечается уже при уровне ИАГ более 10-15 мм. рт. ст. Анурия развивается при
уровне ИАГ, равной или превышающей 30 мм. рт. ст. (Lindström P., 2003). При разрешении
полиорганной недостаточности, обусловленной интраабдоминальной гипертензией,
гемодинамические показатели и функция внешнего дыхания восстанавливаются
практически сразу (Shelly M.P., 1987; Губайдуллин Р.Р., Бутров В.В., 2004). Почечные же
нарушения сохраняются довольно продолжительное время, что связано с развитием
острого тубулярного некроза (Malbrain
M.L. et al, 1997; Sugrue M. et al., 1998; Roumen
R.M., 1998; de Laet I. et al., 2007).
В комплекс полиорганной
недостаточности при интраабдоминальной гипертензии (ИАГ) входят изменения со
стороны нервной системы (Malbrain
M.L., 2000). Основная их причина - рост внутричерепного давления,
связанный с нарушением оттока крови по яремным венам, вследствие высокого
внутригрудного давления, и снижением кровотока в поясничном венозном сплетении,
приводящего к повышению давления ликвора (Bloomfield G.L., 1997, Citerio G., 2001). Это приводит к снижению
перфузионного давления мозга, что поддерживает гипоксию мозга (Bloomfield G.L., 1999; Deeren D.H., 2005; de Laet I., 2007).
В основе местных патофизиологических
изменений в брюшной полости лежит непосредственное влияние повышенного
внутрибрюшного давления на полые органы желудочно-кишечного тракта,
порто-кавальную и мезентериальную системы (Чадаев А.П., 2003; Diebel et al., 1992). Снижение
спланхнического кровотока непропорционально уменьшению сердечного выброса и
развивается раньше (Friedlander M.H., 1998; Gudmundsson
F.F., 2001). Кровообращение в брюшной полости начинает зависть от
перфузионного давления (разницы между средним артериальным давлением и
внутрибрюшным давлением). Именно его величина в конечном итоге определяют
ишемию внутренних органов (Cheatham
M.L., 2000). ИАГ выше уровня 15 мм. рт. ст. приводит к ухудшению
кровообращения во всех органах брюшной полости (Diebel et al., 1992).
Мезентериальный кровоток падает более чем на 73% от исходного уровня при ИАГ 25
мм. рт. ст., существующей более 1 часа, а кровоток в слизистой оболочке тонкой
кишки более чем на 61%, что свидетельствует о значительной органной ишемии и
высокой восприимчивости тонкой кишки к повреждающему фактору повышенного ВБД
(Чадаев А.П., 2003; Caldwell C.B., 1987; Bongard F., 1995; Diebel et al., 1997; Sugerman
H.J., 2001; Schwarte
L.A., 2004; Unsal M.A., 2006). При повышении ВБД выше 10 мм. рт. ст наблюдается
снижение моторики тонкой кишки; наиболее вероятное объяснение данного факта -
нарушение внутристеночного кровообращения (Хрипун А.И., 1999; Madl M., 2003). Причинами изменения
кровотока в тонкой кишке являются: прямая механическая компрессия вен брюшной
полости; влияние БАВ, проявляющееся в генерализованной вазоконстрикции. Также
чревные сосуды имеют хорошо развитый местный миогенный механизм контроля
сосудистого тонуса (Kashtan J., 1981), а повышенное внутрисосудистое давление может запустить и
этот механизм вазоконстрикции.
Потеря ишемизированной слизистой
защитной функции приводит к бактериальной транслокации в системный кровоток и
брюшную полость, что инициирует развитие сепсиса (Cheng J.T., 2003; Polat C., 2003; Yagci G., 2005; Sukhotnik I., 2006). Транслокация бактерий при
уровне ИАГ более 25 мм. рт. ст развивается в течение одного часа (Diebel L.N. et al., 1997; Doty J.M., 2002). Поражение
желудочно-кишечного тракта представлены ишемией кишечной стенки, отёком
слизистой оболочки кишечника и внутриклеточным ацидозом, что способствует
экссудации жидкости в просвет кишки, и усугубляет ИАГ (Samel S.T., 2002; Celik V., 2004; Duzgun A.P., 2006).
Исследования, проведенные (Diebel L.N., 1992; Yokoyama Y., 2002; Hsu Y.P., 2004; Dalfino L., 2006; Cresswell A.B., 2007), доказывают, что
артериальный печеночный кровоток начинает уменьшаться при ИАГ 10 мм. рт. ст., а
портальный начинает страдать при уровне ИАГ равном и более 20 мм. рт. ст.
Рост внутрибрюшного давления
вызывает изменение лимфодинамики по грудному лимфатическому протоку, которая
полностью прекращается при уровне ИАГ 30 мм. рт. ст. (Moore-Olufemi S.D., 2005). Падение скорости тока
лимфы замедляет всасывание перитонеального экссудата, уменьшая лимфатический
дренаж кишечной стенки. Блокада венозного и лимфатического путей приводит к ещё
большему отеку слизистой кишечника и усиливает экссудацию (Cothren C.C., 2004). Падение сердечного выброса
и развивающаяся олигоурия, а также проведение инфузионной терапии, способствуют
секвестрации жидкости в интерстициальном пространстве, и ещё больше усиливают
отек слизистой кишечника.
Отмечено, что появление симптомов
полиорганной недостаточности при повышенном ВБД начинается с уровня 10 мм. рт.
ст. При уровне 35 мм. рт. ст. полиорганная недостаточность развивается у всех
пациентов и без специальной хирургической коррекции приводит к 100%
летальности. Повышение внутрибрюшного давления выше 10 мм. рт. ст. в течение
1-2 суток приводит к летальности 3 - 7% случаев, а при увеличении этой величины
до 35 и более мм. рт. ст. в течение 6 - 7 часов приводит к летальности в 100%
случаев. Большинство ученых сходится во мнении, что гораздо более важным
показателем в оценке тяжести состояния больного служит динамика внутрибрюшной
гипертензии (Шигаев М.Ю., 2005; Долишний В.Н., Шигаев М.Ю., 2007; Тимербулатов
В.М, 2008; Sugrue M. et al., 1998; Malbrain
M.L. et al, 2005; Parr M.J., 2006).
Повышение давления в замкнутой
полости зависит от растяжимости её стенок и объёма ее содержимого; эта
зависимость нелинейна. Растяжимость брюшной стенки уменьшается по мере
увеличения содержимого живота, и ВБД возрастает непропорционально резко в ответ
на одинаковый прирост объёма (Barners
G.E., 1985; Schein M., 1995). По-видимому, при быстром увеличении объёма
компенсаторные возможности растяжимости передней брюшной стенки не успевают
развиться (растяжимость зависит от выраженности эндоабдоминальной фасции, мышц
живота, апоневрозов).
Таким образом, на основании
литературных данных можно предположить, что развивающаяся при острой кишечной
непроходимости полиорганная недостаточность, имеет много общего с патогенезом
полиорганной недостаточности при повышенном внутрибрюшном давлении. Это
позволяет с определенной долей вероятности утверждать, что коррекция
внутрибрюшного давления при кишечной непроходимости, особенно в далеко зашедших
стадиях имеет принципиальное значение.
брюшной кишечный
непроходимость хирургический
1.3 Анатомические
особенности передней брюшной стенки
Воскресенский Н.В. и Горелик С.Л.
(1965), сообщают, в симметричных половинах брюшной стенки имеются три широкие
мышцы и одна прямая мышца, которые определяют её равновесие, устойчивость к
внутрибрюшному давлению, особенно в вертикальном положении тела. Являясь
ведущим звеном в регуляции последней, эти мышцы связаны апоневротическими и
фасциальными элементами, поддерживающими анатомическую и функциональную связь
обеих сторон (Потехин П.П., 1977; Артемьев В.Н., 1975,1983; Рахимов М., 1975;
Тоскин К.Д., Жебровский В.В., 1990; Заривчацкий М.Ф., 1996; Рехачёв В.П., 1999;
Рзаев Д.О., 2002). В литературе имеется небольшое количество работ, содержащих
сведения о фасциально-апоневротических структурах (ФАС) передней брюшной стенки
(Сорокин А.П., 1973, 1986; Потехин П.П., 1977; Лаврова Т.Ф., 1979). Вентральные
апоневрозы боковых мышц живота изучено достаточно хорошо. Известны их
топографо-анатомическое взаимоотношение в боковых отделах и впереди прямых
мышц, особенности расположения у людей с различными типами телосложения
(Вагапова В.Ш., 1970, Жуков В.М., 1971,1973). Жуков В.М. (1972) считает, что
расположение, размеры апоневрозов, а также линия перехода мышечных пучков в
сухожильные зависят от формы живота. Однако влагалище прямой мышцы живота
рассматривается лишь как футляр, не имеющий для функционирования мышцы
принципиального значения. В работе Бикмуллина Р.К. и соавт. (1998) показано,
что прямые мышцы, их влагалище, белая линия живота и пирамидальные мышцы
образуют единый биомеханический аппарат. Направление и характер работы прямых
мышц формируют продольные соединительнотканные образования в белой линии живота
и передней пластинке влагалища, упруго противодействующие растяжению боковых
мышц. В работах Потехина П.П. (1977) описывается микроскопическое строение
апоневрозов боковых мышц в функционально различных участках передней брюшной
стенки. По его мнению, широкие мышцы живота формируют вентральные апоневрозы,
структура и выраженность которых определяются действием мышечных пучков,
взаимодействием с соседними мышцами и друг с другом. По данным А.П. Сорокина
(1967, 1986) значительные по величине и сравнительно однородные по характеру
силы формируют адекватные по толщине коллагеновые пучки, незначительно
связанные между собой солитарными пучками. При увеличении смещения коллагеновых
волокон относительно друг друга усиленно развиваются эластические волокна на
границе смещающихся слоев (Сорокин А.П., 1973, Hukins D.W., 1985, Pasquali-Ronchetti et al 1985, 1997). Степень
развития эластических волокон, направление их и взаимосвязь определяется
разнообразием сил смещения. В ФАС передней брюшной стенки эластические волокна
располагаются больше в косо-поперечном направлении и меньше в косо-продольном,
а их количество в различных отделах изменчиво. В местах повышенного давления
внутренних органов на переднюю брюшную стенку фибробласты продуцируют гликопротеины,
которые цементируют сухожильные пучки настолько плотно, что границы между
пучками первого и второго порядков стираются (Горбунов Н.С., 1999). Эти же
клетки продуцируют и эластин, что способствует созданию сложной эластической
сети, стремящейся вернуть растянутые образования к исходному состоянию. Можно
думать, что основными факторами формирования соединительно-тканного комплекса
передней брюшной стенки являются не только внешние воздействия, но и
воздействия внутренних органов на переднюю брюшную стенку (Макаров А.К., 1984;
Мишанин М.Н., 2001; Горбунов Н.С., 2006). В работах В.Е. Дерябина (1990), Н.С.
Горбунова и соавт. (2000,2003,2006) было показано, что строение ФАС передней
брюшной стенки ассиметрично. Правая половина живота имеет пучковое строение, а
левая пучково-волокнистое строение. По мнению вышеуказанных авторов, это
связано с неоднозначным воздействием внутренних органов на отдельные участки
передней брюшной стенки.
Сухожильные пучки апоневроза имеют
такое же направление, как и мышечные. Основным в механическом отношении
является слой извитых грубых коллагеновых пучков, которые лежат на некотором
расстоянии друг от друга. По мере удаления от мышцы промежутки между пучками
становятся шире. На всем протяжении эти пучки изолированы от соседних и почти
не имеют анастомозирующих конструкций, что объясняется неодновременным
действием групп мышечных волокон на волокна сухожилия. Основной слой
коллагеновых пучков апоневроза покрыт волокнистыми оболочками (поверхностной и
глубокой фасциями апоневроза), в которых поверхностные волокна переплетаются
между собой. Обе оболочки апоневроза являются фасцией сухожилия с четкой
пространственной ориентацией волокон. По мере приближения к основному слою
коллагеновых пучков фасциальные волокна приобретают более упорядоченный ход, а
самые глубокие ориентированы строго сверху вниз, с латеральной стороны в
медиальную. Волокна одной фасции переходят в другую через щели между пучками
апоневроза, окутывая их со всех сторон. Внутренняя фасция апоневроза развита
слабее, она тоньше и рыхлая. Преимущественное развитие наружной волокнистой
оболочки связывают с давлением внутренних органов на переднюю брюшную стенку.
Под действием этого давления коллагеновые пучки расходятся в стороны, что
приводит к утолщению этих пучков.
При морфологическом исследовании ФАС
прямых мышц живота были обнаружены особенности, характерные для разных форм
живота (Макаров А.К., 1986).
У людей с формой живота,
расширяющейся вверх, отмечено преобладание коллагеновых и эластических волокон
в передней пластинке влагалища прямых мышц живота, образующих трехслойную
конструкцию. Для задней пластинки характерно меньшее количество волокнистых
элементов; лучше выражен внутренний перитеноний, плотно срастающийся с
поперечной фасцией и брюшиной (Горбунов Н.С. и соавт. 2003).
У людей с овоидной формой живота
толщина передней пластинки в эпигастральной области достоверно больше, чем у
предыдущей формы, за счет большей толщины и объёма соединительнотканных пучков.
(Горбунов Н.С. и соавтр. 2003, 2006). Волокнистые элементы в задней пластинке в
эпигастрии характеризуются преобладанием коллагеновых элементов.
У людей с формой живота,
расширяющейся вниз передняя пластинка влагалища прямых мышц живота характерно
меньшее количество эластических волокон по сравнению с апоневрозом других
областей. Задняя пластинка несколько усложнена. Сухожильные пучки поперечной
мышцы живота, которые принимают участие в её образовании срастаются между
собой, а внутренний перитеноний здесь имеет наибольшую толщину - 187±23 мкм
(Горбунов Н.С. и соавтр. 2003,2006). Эти особенности подтверждаются при
эхолокации передней брюшной стенки (Когут Б.М., 2002).
Если в большинстве работ изучается
гистологические особенности ФАС, то лишь в единичных работах есть указания на
их физические характеристики (Вихров С.П., 2006; Ромашкин-Тиманов М.В., 2007).
Однако и в этих работах исследуются физические свойства
фасциально-апоневротического комплекса в целом. При этом отмечается, что
«апоневротический мешок» прямой мышцы эпигастральной области обладает прочность
около 101х105 Па и с возрастом уменьшается. Тем не менее, почти не
встречаются указания на физические свойства листков влагалища прямых мышц
живота.
Таким образом, исследование свойств
ФАС передней брюшной стенки, позволит путем воздействия на них, моделировать
размеры живота, что может быть использовано для предупреждения и лечения ряда
хирургических заболеваний и их осложнений.
1.4 Тактика лечения
острой кишечной непроходимости
Лечение острой кишечной
непроходимости в значительной мере определяется общим состоянием больного,
видом непроходимости, степенью интоксикации, данными, полученными при
обследовании и результатами консервативного лечения. Полнота и адекватность
консервативных мероприятий определяются дифференцированно с учетом формы ОКН,
тяжести общего состояния больных, наличия или отсутствия показаний к операции.
По мнению С.А. Алиева (2005), продолжительность консервативного лечения прямо
коррелирует с длительностью обтурации, глубиной метаболических нарушений и
предполагаемым объемом планируемого хирургического вмешательства. Коррекция
системных нарушений составляет суть консервативной терапии и предоперационной
подготовки, которые включают в себя коррекцию водно-электролитных расстройств,
дезинтоксикационную, спазмолитическую терапию, лечение энтеральной
недостаточности (Ерюхин И.А., 1998; Гешелин С.А., 1998; Пугаев А.В., 2003;
Тарасенко Э.И., 2003; Пахомова Г.В., 2004).
Восстановлению функции кишечника
способствует декомпрессия желудочно-кишечного тракта, так как растяжение
кишечника влечет за собой нарушение микроциркуляции в стенке кишки и
прогрессирование энтеральной недостаточности (Ханевич М.Д., 1993; Ерюхин И.А.,
1998)
Безуспешность консервативного
лечения является основным показанием к оперативному вмешательству (Аликов А.А.,
1998; Топузов Э.Г., 1997; Амелин В.М. и др., 1998; Тотиков В.З. и др., 2001;
Алиев С.А., 2005). Согласно представлениям ряда авторов, консервативное лечение
должно быть ограничено 6 часами при его неэффективности (Тотиков В.З. и др.,
2001; Алиев С.А., 2005; Asbun H.J., 1989). По мнению Г.В. Пахомовой, возможен более длительный, до
24 часов, период консервативного лечения. Основным эффектом консервативного
лечения, по мнению некоторых исследователей, считается отхождение кала и газов
и свободный пассаж бария по кишечной трубке. Однако другие ученые считают, что
положительный эффект должен быть оценен прежде всего по нормализации системных
сдвигов (Ерюхин И.А., Петров В.П., 1998; Wilson M.S., 1999).
В зависимости от формы кишечной
непроходимости применяются различные виды хирургических пособий, способствующих
восстановлению пассажа по ЖКТ: рассечение множественных спаек; резекции
измененных отделов кишки; устранения заворотов, инвагинаций, узлообразований
или резекции этих образований без предварительных манипуляций на измененной
кишке.
При колоректальной опухолевой
непроходимости выполняются одноэтапные или двухэтапные операции в зависимости
от стадии опухолевого процесса и выраженности проявлений непроходимости и
возраста больного, наличия перитонита. (Аликов, А.А., 1998; Брискин Б.С., 1999;
Пугаев А.В. и соавт., 1999, 2003; Ханевич М.Д., 2005). Одноэтапные
первично-радикальные операции при осложненном раке ободочной кишки в настоящее
время применяются несколько чаще в связи с успехами современной реаниматологии
(Пахомова Г.В., 1987; Иноятов И.М., 1991; Алиев С.А., 2001; Михайлов А.П.,
2003; Racette D.L. et al., 1987). Однако ряд исследователей считают предпочтительным
выполнение двух- или трехэтапных операций особенно у лиц пожилого и старческого
возрастов (Алиев С.А., 2001, Яицкий Н.А. и др., 2004; Пугаев А.В., Ачкасов
Е.Е., 2005).
Большое значение в борьбе с
интоксикацией придается удалению токсичного кишечного содержимого, которое
скапливается в приводящем отделе кишки. Опорожнение приводящих участков кишки
обеспечивает декомпрессию кишки (Пахомова Г.В., 1987, 2003; Ерюхин И.А., Петров
В.П., 1998). Выбор способа дренирования кишечника зависит от предпочтения
хирургов. Оптимальным вариантом такой декомпрессии является назоинтестинальное
дренирование тонкой кишки по Вангенштину с помощью зонда Miller-Abbot (Горский
В.А. и соавт., 1993; Нечаев Э.А. и соавт., 1993; Шуркалин Б.К., 1999; Чернов
В.Н. и др., 1999; Гузеев А.И., 2002; Cheatham
M.L., Chapman W.C., 1995; Nelson R., 2005). Некоторые авторы отмечают его недостатки, как то:
техническая сложность дренирования, инфицирование желудка, пищевода,
трахеобронхиального дерева кишечной флорой, с развитием риносинуситов,
пролежней и кровотечений из стенки пищевода (Демидов Г.И., 1984; Шуркалин Б.К.,
1999; Абдулджалилов М.Н., 2003; Лебедев и соавт., 2004).
По мнению ряда авторов,
предпочтительнее выполнение интубации тонкой кишки ретроградно, через энтеро- и
цекостому. Основной причиной сдержанного отношения к открытой ретроградной
интубации является необходимость наложения стомы и опасность её западения, а
также трудноконтролируемые изменения гомеостаза, возникающие при этом (Сумин
В.В., Жижин Ф.С., 1986; Давыдов Ю.А. и соавт, 1992).
Другой метод, предложенный J.M.
Ferris и G.K. Smith в 1956 г. и подробно описанный в отечественной литературе
Ю.М. Дедерером (1962) - интубация тонкой кишки через гастростому, лишен этого
недостатка. Он показан пациентам, которым проведение зонда через нос невозможно
или нарушение носового дыхания из-за зонда может повысить риск
послеоперационных легочных осложнений.
Основными задачами продленной
декомпрессии является: удаление из просвета кишки токсичного содержимого. Зонд,
с декомпрессионно-детоксикационной целью, необходимо устанавливать в просвете
кишки на 3-6 суток (Женчевский Р.А., 1989; Зюбрицкий Н.М., Слабинский В.В.,
1991; Сапожков А.Ю., Никольский В.И., 1992; Тарасенко Э.И., 2007; Cheatham M.L., 1995; Wilson M.S., 1999; Nelson R., 2005). Этот срок, по их мнению,
не зависит от времени восстановления перистальтики, и объясняется
необходимостью проведения внутрикишечной детоксикационной терапии и раннего
энтерального питания (Любенко Л.А. и соавт., 1987; Ерюхин И.А., 1988).
Декомпрессия толстой кишки при её непроходимости достигается также наложением
колостомы или трансректальным дренированием толстой трубкой. Восстановление
самостоятельной перистальтики является основным критерием устранения
внутрикишечной гипертензии и внутристеночной микроциркуляции.
Существующие методики лечения
кишечной непроходимости, в частности дренирование тонкой кишки, способны
обеспечить снижение уровня внутрибрюшного давления. Очевидно, что коррекция
уровня внутрибрюшного давления при кишечной непроходимости устраняет его
негативное влияние на системные показатели организма (Татьков С.С., 1998;
Чадаев А.П., Хрипун А.И, 2003). В ряде исследований подтверждается
положительное влияние сочетания назоинтестинальной интубации с
герниологическими приемами закрытия брюшной полости на течение
послеоперационного периода (Комаров Н.В., Маслагин А.С, 1996; Гаин Ю.М и
соавт., 2001; Рощин Г.Г. и соавт., 2002; Белоконев В.И. и соавт., 2007, 2008;
Тимербулатов В.М. и соавт., 2008; Burrows R. et al., 1995; Ciresi
D.L. et al., 1999; Marwah S., 2005). По данным Гаина Ю.М. и соавт. (2004),
назогастроинтестинальная зондовая декомпрессия в сочетании с патогенетической
терапией синдрома энтеральной недостаточности позволяет уменьшить ВБД в среднем
на 10,5±4,33 мм. рт. ст. Этот вывод является предпосылкой к сочетанию интубации
тонкой кишки с декомпрессивными методиками ушивания лапаротомной раны, которые
систематизированы и сведены к трем основным вариантам А.П. Чадаевым, (2003).
Первый вариант - это закрытие
брюшной полости только кожными швами. При кишечной непроходимости данный
вариант наиболее оправдан, если имеются явления перитонита и тяжелое состояние
больного (по APACHE II более 20 баллов).
Второй вариант, связанный с
использованием синтетических заплат, применим при необходимости повторных
санации брюшной полости (метод лапаростомии, предложенный D.H. Wittmann).
Третий вариант основан на временной
декомпрессии брюшной полости с помощью провизорных мышечно-апоневротических
швов. После снижения внутрибрюшного давления и восстановления кишечной моторики
провизорные швы можно затягивать окончательно. Эту манипуляцию рекомендуют
выполнять под пролонгированной перидуральной анестезией. Считается, что
основными критериями для ликвидации временного дефекта в ране являются снижение
внутрибрюшного давления на 10 мм. рт. ст ниже критического (т.е. 25 мм. рт. ст)
и положительный миоэлектрический ответ кишки на пробную медикаментозную
стимуляцию (Чадаев А.П., Хрипун А.И., 2003; Scott B.G., 2005; Fantus R., 2006). Однако существующие
методики временного закрытия брюшной полости применимы при кишечной
непроходимости только в стадии полиорганной недостаточности на фоне перитонита.
В ряде исследований показана возможность коррекции внутрибрюшного давления
выполнением герниологических приемов. В большинстве своем они использованы при
лечении больных с перитонитами различной этиологии. Однако именно такие приемы
наиболее приемлемы для закрытия брюшной полости больным с кишечной
непроходимостью при отсутствии явлений перитонита. Среди таких методик
наибольшее значение имеет рассечение передних листков влагалищ прямых мышц
живота (Белоконев В.И. и соавт., 2007, 2008; Dakin G.F., 2004; Marwah S., 2005; Leppäniemi A.K., 2006). Увеличивая объём брюшной
полости, они определенно влияют на уровень внутрибрюшного давления. Тем не
менее, эти же авторы указывают на возможность развития вентральных грыж в
отдаленном послеоперационном периоде.
Послеоперационное лечение ОКН
включает следующие обязательные направления: возмещение ОЦК, коррекция
электролитного и белкового состава крови; лечение эндотоксикоза, в том числе
обязательная антибактериальная терапия; восстановление моторной, секреторной и
всасывательной функций кишки, то есть лечение энтеральной недостаточности.
Похожие принципы лежат в основе дифференцированного подхода к профилактике и
лечению полиорганной недостаточности при повышенном ВБД (Каракозов М.Р., 2003;
Богданов А.А., 2004; Мхоян Г.Г., 2007; Balogh Z., 2003; Burch G.E., 1996; Cheatham M.L., 2000; Malbrain M.L., 2005; Sugrue M., 2005). Лечебные мероприятия
должны корректироваться в зависимости от клинических симптомов и этапов
хирургических вмешательств. Методы консервативного лечения могут быть
суммированы в 5 основных групп (Мхоян Г.Г. и др., 2007): инфузионная терапия;
увеличение комплайенса передней брюшной стенки (миорелаксация, эпидуральная
анестезия), эвакуация кишечного содержимого; эвакуация свободной жидкости из
брюшинной полости; коррекция капиллярной утечки и положительного баланса
жидкости. Целью восстановления волемического статуса является, прежде всего,
поддержание уровня перфузионного давления. Коррекция капиллярной утечки и
водно-электролитного баланса достигается ультрафильтрацией и стимуляцией
диуреза, при этом удаляется из организма «лишняя жидкость» и уменьшается
интерстициальный отек. Оценить степень гиповолемии при этом очень сложно,
однако рекомендуется избегать водной нагрузки, поскольку без адекватной
декомпрессии брюшной полости, она может усилить отек кишечной стенки, увеличить
экссудацию в её просвет и тем самым ещё больше повысить внутрибрюшное давление.
Дыхательная недостаточность при
повышении ВБД похожа на таковую при синдроме острого повреждения легких.
Больным при уровне ВБД выше 15 мм. рт. ст уже требуется респираторная
поддержка, при чем требуется не только нормализация газового состава крови, но
и выбор максимально щадящей вентиляционной поддержки. По мнению В.Е. Милюкова
(2008) неадекватная респираторная поддержка в условиях повышенного ВБД приводит
к некрозу ткани легкого. Некоторые анестезиологи предпочитают проводить ИВЛ с
ПДКВ равным ВБД.
Как следует из приведенных
литературных источников в настоящее время результаты лечения больных с острой
кишечной непроходимостью нельзя считать достаточно эффективными. Такое
положение обусловлено отсутствием единой концепции патогенеза ОКН и определения
ведущих звеньев этого процесса. При этом недостаточно учитывается роль ВБД, как
фактора, влияющего не только на микроциркуляцию в кишечной стенке, но и на
кровоток в других органах. Изучение компартмент-синдрома при устранении
гигантских вентральных грыж определило возможности применения герниологических
технологий для уменьшения критических показателей внутрибрюшного давления у
больных кишечной непроходимостью. Следовательно, изучение возможности
внекишечной декомпрессии брюшной полости является важным научно-практическим
аспектом в разработке методов лечения ОКН.
2. Общая характеристика
экспериментальных и клинических материалов. Методики исследования
2.1 Материалы
исследований
.1.1 Материалы
экспериментального исследования
Экспериментальный раздел
исследования выполнен на 85 человеческих трупах в возрасте от 25 до 78 лет на
базе Тверского областного бюро судебно-медицинской экспертизы. Для исследования
выбирались нефиксированные человеческие трупы в сроки от 10 до 20 часов с
момента констатации биологической смерти. На основании положений о возрастных
изменениях физических свойств передней брюшной стенки умершие разделены на две
возрастные группы до 60 лет и старше 60 лет. В выборку включались умершие, не
имевшие заболеваний и травм брюшной полости и передней брюшной стенки на момент
секционного исследования. Распределение умерших по полу и возрасту представлено
в табл. 2.1.
Таблица 2.1. Возрастно-половой
состав исследованных
|
Пол
|
Число умерших в возрасте
|
Всего
|
|
до 60 лет
|
старше 60 лет
|
|
|
Мужской
|
15
|
16
|
31
|
|
Женский
|
14
|
40
|
54
|
|
Всего
|
29
|
56
|
85
|
Как следует из табл. 2.1.,
большинство включенных в исследование трупов были женского пола (65,8%). В
возрасте старше 60 лет было 56 объектов исследования.
Причиной смерти данного контингента
больных явились острые и хронические общесоматические заболевания и
черепно-мозговая травма (табл. 2.2.).
Таблица 2.2. Причины летальных
исходов в изучаемой группе
|
Причины летальных исходов
|
Число наблюдений
|
|
Травмы, не совместимые с жизнью Болезни системы органов
кровообращения Болезни системы органов дыхания
|
29 50 6
|
|
Всего умерших
|
85
|
Как следует из данных таблицы 2.2., наиболее
частой причиной смерти больных явилась декомпенсация хронических
сердечно-сосудистых заболеваний.
Модель экспериментального повышения
ВБД, методика регистрации показателей и условия забора материала для
исследования физических свойств апоневроза во всех опытах были одинаковыми.
Антропометрические измерения
проводили с помощью гибкой измерительной ленты (общая длина 150 см).
Внутрибрюшное давление
регистрировали с помощью двух датчиков: водного манометра (аналог аппарата
Вальдмана), соединенного с уретральным катетером Фолея №20, введенным в мочевой
пузырь и манометра, соединенного с другой, дополнительно введенной в брюшную
полость, трубкой диаметром 0,6 см.
Тензиометрическое исследование
проводили с помощью электронного аппарата PES TН-312 (максимальная нагрузка 10 кг,
минимальная градуировка 10 г.).
Исследование биомеханических свойств
апоневроза передней брюшной стенки осуществлялось с помощью разрывной машины «Ninius olsen» модель H5KS Serial №H5KS 1777 на базе ОАО
«Экофлон», г. Санкт-Петербург.
.1.2 Материалы
клинического исследования
Проведен анализ хирургического
лечения 35 больных с острой кишечной непроходимостью на клинических базах
кафедры факультетской хирургии с курсом онкологии Тверской государственной
медицинской академии (МУЗ ГКБ №6, хирургическое отделение; ГУЗ ТОКОД,
гастроэнтерологическое отделение). Возрастной состав изучаемого контингента
больных отражен в табл. 2.3.
Таблица 2.3. Возрастно-половой
состав больных с кишечной непроходимостью
|
Пол
|
Число больных в возрасте
|
Всего
|
|
до 60 лет
|
старше 60 лет
|
|
|
Мужской
|
4
|
8
|
12
|
|
Женский
|
6
|
17
|
23
|
|
Всего
|
10
|
25
|
35
|
Все больные были доставлены в
хирургические отделения города скорой медицинской помощью по экстренным
показаниям. Для сепарации больных на группы использована классификация кишечной
непроходимости, предложенная В.П. Петровым (1989). В соответствии с этой
классификацией, у всех включенных в выборку больных имела место обтурационная
кишечная непроходимость, причиной которой были опухоль толстой кишки (35
больных). Все больные были подразделены на две группы: контрольная (группа А) и
основная (группа В). В группу А отнесены больные, которым по поводу острой
кишечной непроходимости выполнялись назоинтестинальная интубация и традиционное
ушивание лапаротомной раны наглухо. В группу В отнесены больные, которым по
поводу острой кишечной непроходимости хирургическая лечебная программа
дополнялась декомпрессивной фасциотомией. Критерием включения в выборку,
являлся уровень дооперационного ВБД, превышающий 20 см. вод. ст. (II степень по классификации
Burch J.M.).
Таблица 2.4. Распределение больных
по уровню непроходимости в исследованных группах
|
Группы
|
Число больных с обтурационной непроходимостью
|
Всего
|
|
вызванной опухолями ободочной кишки
|
вызванной опухолями прямой кишки
|
|
|
Контрольная
|
8
|
12
|
20
|
|
Основная
|
7
|
8
|
15
|
|
Всего
|
15
|
20
|
35
|
В контрольную группу отнесены 20
больных - с опухолевой патологией ободочной кишки - 8 (22,8%), прямой кишки -
12 (34,4%). В основную группу отнесены 15 больных - с опухолевой патологией
ободочной кишки - 7 (20%), прямой кишки - 8 (22,8%), (табл. 2.4.). Как следует
из приведенных в таблице 2.4. данных, распределение больных по причинам
кишечной непроходимости не имело статистически значимых отличий (p>0,1).
У всех больных до операции признаки
перитонита отсутствовали. Если при лапаротомии обнаруживались явления
перитонита, то больные исключались из исследования.
Большинство пациентов были
госпитализированы в течение первых трех суток от начала заболевания, причем в
первые сутки от начала заболевания госпитализировано 40% больных.
Во всех случаях больные были
обследованы по стандартной методике. Диагноз кишечной непроходимости
верифицировался рентгенологически. Объём предоперационного обследования больных
также был стандартным и включал клинический анализ крови, биохимический анализ
крови (сахар, мочевина, креатинин, билирубин, белок, электролиты), общий анализ
мочи, ЭКГ.
На дооперационном этапе были также
диагностированы сопутствующие заболевания, распределение которые отражено в
таблице 2.5.
Таблица 2.5. Частота общесоматических
заболеваний в изучаемых группах больных
|
Возраст больных
|
45-54
|
55-65
|
66-75
|
76-80
|
|
Число заболеваний на одного пациента
|
1,5
|
1,55
|
2,3
|
5
|
|
Всего больных
|
8
|
20
|
12
|
2
|
Как следует из данных табл. 2.6,
общее число заболеваний составило 1,93 на одного больного. У каждого пациента
старше 50 лет, а контингент таких больных составил более 80% всех
оперированных, констатировано, как минимум, одно сопутствующее заболевание,
которое могло осложнить течение основной патологии. Уровень соматической
патологии в группах А и В не отличался (p>0,1).
Оперативное лечение выполнялось в
различные сроки с момента поступления больного. Средний срок от поступления до
оказания хирургического пособия составлял от 3 до 24 часов. Данный факт
объясняется несколькими причинами: необходимостью предоперационной подготовки;
стиханием клинической картины на фоне консервативного лечения с последующей
атакой болезни в ближайшие сроки; поздним обращением больных в хирургический
стационар.
Объём предоперационной подготовки
соответствовал общепринятому и был направлен на нормализацию
водно-электролитного баланса и стабилизацию основных жизненноважных параметров.
Объём хирургического лечения больных
в исследуемых группах зависел от общего состояния больных к моменту операции и
распределился следующим образом (табл. 2.6.).
Таблица 2.6. Объём хирургического
лечения больным с обтурационной непроходимостью в исследованных группах
|
Вид вмешательства
|
Общее количество манипуляций в исследуемых группах
|
|
Контрольная (n=20)
|
Основная (n=15)
|
|
Основной этап операции
|
Резекция толстой кишки
|
11
|
9
|
|
Наложение обходного анастомоза
|
2
|
2
|
|
Наложение разгрузочной колостомы
|
12
|
9
|
|
Завершающий этап операции
|
Назоинтестинальная интубация, дренирование брюшной полости
|
20
|
15
|
|
Ушивание операционной раны наглухо
|
20
|
-
|
|
Ушивание раны, дополненное декомпрессивной фасциотомией
|
-
|
15
|
|
Всего манипуляций на одного больного
|
3,25
|
3,33
|
Основным показанием к выполнению
назоинтестинальной интубации считали увеличение диаметра тонкой кишки до 4 и
более сантиметров и наличие субсерозных кровоизлияний в кишечной стенке.
Общее число манипуляций в
контрольной группе составило 65, при этом число выполненных операций составляет
25, т.к. у четырёх больных с опухолью сигмовидной кишки выполнялась резекция
кишки и накладывалась проксимальная колостома. Как видно из данных таблицы 2.6,
на одного больного приходилось 3,25 манипуляций.
Общее число манипуляций в основной
группе составило 50, при этом число выполненных операций составляет 20, т.к. у
трех больных с опухолью толстой кишки выполнялась резекция кишки и
накладывалась проксимальная колостома (на одного больного приходилось 3,33
манипуляции).
Объём хирургического вмешательства в
группах А и В не имел отличий (p>0,1).
В исследованных группах умерло двое
больных. В контрольной группе 1 больной (5%) умер через одни сутки после
операции в связи с развитием тромбоэмболии легочной артерии. В основной группе
умер 1 больной (6,6%) через 48 часов после операции в связи с развившимся
инфарктом миокарда.
Специальными компонентами пред- и
послеоперационного мониторинга больных являлось определение уровня ВБД, частоты
дыхания, систолического, диастолического и среднего артериального давления,
частоты сердечных сокращений, диуреза, времени восстановления самостоятельной
перистальтики.
Для оценки состояния органной
перфузии определялись два показателя: абдоминальное перфузионное давление и
вегетативный индекс Кедро.
Абдоминальное перфузионное давление
(АПД) определялось по формуле
АПД=АДср-ВБД,
где АДср - среднее артериальное
давление, ВБД - внутрибрюшное давление. В норме АПД должно приблизительно
соответствовать АДср. Чем меньше показатель АПД по сравнению с АДср, тем хуже
прогноз и по возможности развития абдоминального компартмент-синдрома и по
выживаемости.
Интегральный критерий - вегетативный
индекс Кедро (ВИ), рассчитывался по формуле:
ВИ=(1-D/P)·100,
где D - диастолическое АД, P - частота сердечных сокращений. В
норме ВИ равен (+5) - (+7). Считается, что при стрессе происходит рост
активности симпатической нервной системы, что приводит к повышению рассчитываемого
показателя. Отрицательные значения говорят о повышении тонуса парасимпатической
нервной системы. Изменения активности того или иного звена вегетативной нервной
системы отражаются на работе сердечнососудистой системы. Состояние
микроциркуляции также зависит от влияния вегетативной нервной системы.
Повышении активности симпатической нервной системы определяет спазм
прекапиллярных сфинктеров, тем самым ухудшает микроциркуляцию. Таким образом,
ВИ может служить косвенным критерием состояния микроциркуляции (органной
перфузии).
Определение этих показателей несет
значительную информацию, т.к. позволяет определить степень развития синдрома
брюшной полости.
.2 Методы исследования
.2.1 Методы
экспериментальных исследований
Методика лапарометрического исследования
В работе проводилось
антропометрическое исследование по методике НИИ Антропологии МГУ, описанной в
пособии В.В. Бунака «Антропометрия» (1941). Поперечные размеры живота
определялись по методике Т.Ф. Лавровой (1979), рис. 2.1.
A ACDB
Рис.
2.1. Конфигурация передней брюшной стенки во фронтальной плоскости
в положении лёжа
Измерения на трупах проводились в
горизонтальном положении, лежа на спине. Поперечные размеры передней брюшной
стенки измерялись на четырех уровнях:
1. расстояние между нижними
точками десятых ребер (размер A);
2. расстояние между
передне-верхними остями подвздошных костей (размер B);
. поперечный размер на уровне
пупка; боковые точки были размещены на передних подмышечных линиях (размер D);
. поперечный размер на
середине расстояния между размерами А и D (размер C).
Данные измерения позволили
охарактеризовать форму живота в соответствии с формулой поперечного индекса
живота (ПИЖ) по В.М. Жукову (1972): ПИЖ = (dist. bicostarum / dist.
interspinosa) х100. На основании поперечного индекса живота у исследованных
трупов выделяли три формы живота:
ПИЖ < 97,5 - форма живота,
расширяющаяся вниз;
ПИЖ в интервале от 97,5 до 102,5 -
овоидная форма живота;
ПИЖ > 102,5 - форма живота,
расширяющаяся вверх.
Измерение размеров передней брюшной
стенки проводилось трехкратно. Первым этапом измерялись размеры до повышения
уровня внутрибрюшного давления. Вторым этапом проводилось измерение после
повышения внутрибрюшного давления до уровня в 27,2 см. вод. ст. Третьим этапом
размеры передней брюшной стенки оценивались после выполнения декомпрессивной
фасциотомии на фоне внутрибрюшного давления в 27,2 см. вод. ст.
Методика барометрического
исследования
В основу измерения давления в
брюшной полости положен закон Паскаля о равенстве давления жидкости и газа во
всех отделах замкнутого пространства. При работе над моделями критические цифры
ВБД определялись двумя методами: косвенным и прямым. Косвенный метод основан на
измерении давления в мочевом пузыре. В мочевой пузырь вводился катетер Фолея,
через который в мочевой пузырь вводился теплый физиологический раствор. После
этого катетер Фолея присоединялся к аппарату Вальдмана. Прямой метод основан на
измерении давления в брюшной полости. С этой целью в брюшную полость вводилась
силиконовая трубка и присоединялась к воздушному манометру.
Модель экспериментального повышения
ВБД (Хитрова Е.Н. и соавт., 2007) газовым способом была нами модифицирована. С
этой целью в брюшную полость устанавливалась ещё одна силиконовая трубка,
соединенная с насосом известного объёма.
Нами была принята гипотеза, что
наиболее часто синдром брюшной полости развивается с уровня в 20 мм. рт. ст.
(эта величина принята нами за основу в эксперименте). Уровень давления в 20 мм.
рт. ст (27,2 см. вод. ст) достигался введением 3050-3900 мл воздуха. Количество
воздуха, вводимое в брюшную полость, зависело от исходного уровня ВБД.
Уровень внутрибрюшного давления
регистрировался четырехкратно. Первое измерение проводилось до повышения
внутрибрюшного давления. После чего ВБД увеличивали до 27,2 см. вод. ст. Второе
измерение ВБД проводилось после рассечения апоневроза по белой линии живота на
протяжении 12-15 см. Брюшинный листок не вскрывался (так как этого не позволяла
выбранная модель эксперимента). Третье измерение ВБД проводилось после ушивания
раны по белой линии без декомпрессивной коррекции. Четвертым этапом
регистрировались значения ВБД после ушивания раны апоневроза, дополненного
декомпрессивной фасциотомией.
Методика выполнения декомпрессивной
фасциотомии
Декомпрессивная фасциотомия в
эксперименте выполнялась по следующей методике (патент №2368332 РФ).
Производилось рассечение тканей передней брюшной стенки до апоневроза по
средней линии от мечевидного отростка до середины расстояния между пупком и
лоном. После этого подкожная клетчатка отсепаровывалась от переднего листка
влагалища прямых мышц живота в эпигастральной области на четыре сантиметра
кнаружи от белой линии живота с обеих сторон. Рассечение переднего листка
влагалищ прямых мышц живота начинали с уровня пупка, отступя латерально на 1,0
см от белой линии живота, и продолжали на 15 см вверх до мечевидного отростка.
При этом проводилось отсечение первой сухожильной перемычки от переднего листка
влагалища прямых мышц живота для придания большей мобильности листкам
апоневроза. Волокна прямой мышцы от задней стенки апоневроза не отделялись
(рис. 2.2.). При проведении серии экспериментальных исследований, дополнительно
вскрывался апоневроз по белой линии живота (брюшинный листок не вскрывался,
т.к. этого не позволяла выбранная модель эксперимента).
Декомпрессивная фасциотомия в
клинике выполнялась по тем же принципам. После этого проводилось ушивание
апоневроза по белой линии живота и ушивание подкожной клетчатки и кожи.
Операцию завершали дренированием послеоперационной раны трубчатым дренажом
диаметром 0,8 см, введенным через контрапертуру. Дренажная трубка на двое суток
подсоединялась к вакуумному аспиратору Редона. Дренаж удалялся при дебите менее
50 мл.

Рисунок 2.2. Фотография передней
брюшной стенки умершей женщины. Края раны сведены шестью швами; рассечены
передние листки влагалищ прямых мышц живота (1 край рассеченного переднего
листка влагалища прямой мышцы живота, 2 первая сухожильная перемычка, 3
рассеченная белая линия).
Методика тензиометрического
исследования в эксперименте
Тензиометрическое исследования
заключалось в измерении силы, прикладываемой к нити, необходимой для сведения
краев операционной раны. В двух сериях экспериментов изучались различия,
приложенных на каждый шов векторов сил при традиционном её ушивании и после
проведения декомпрессивной фасциотомии. Для определения силы, необходимой для
сведения краев раны был использован электронный измерительный прибор PES TH-312. Изучение
тензиометрических свойств передней брюшной стенки осуществлялось после
достижения критического значения ВБД - 27,2 см. вод. ст. (считается, что с
этого уровня вероятность развития абдоминального компартмент синдрома
значительно увеличивается - Bloomfield
G.L., 1995). Техника проведения эксперимента.
1. Ушивание раны проводили
шестью швами (для ушивания использовали нить матен №6 длиной 30 см),
наложенными на расстоянии 2,0 - 3,0 см один от другого. Неоднозначность
выбранного промежутка зависела от высоты эпигастральной области. Маркировка
нити проводилась от нижнего края раны к верхнему. Второй шов всегда
накладывался на уровне пупка, пятый шов - на уровне первых сухожильных
перемычек прямых мышц живота.
2. Один из концов нити
скручивали таким образом, чтобы сформировать петлю, необходимую для
прикрепления к аппарату PES TH-312.
. Силу, необходимую для
сведения краев раны считывали с дисплея прибора PES TH-312 в момент
соприкосновения краев раны.
В первой серии эксперимента
измерялась сила, прикладываемая к нити, необходимая для сведения краев раны при
ушивании раны без декомпрессивной фасциотомии.
Во второй серии эксперимента
оценивали силу, прикладываемую к нити, необходимую для сведения краев раны при
ушивании раны, дополненном декомпрессивной фасциотомией.
Методика изучения физических
характеристик переднего и заднего листков влагалищ прямых мышц живота
Для определения физических
параметров (толщины, прочности и растяжимости) листков влагалища прямых мышц
живота использовалась методика растягивания ткани до разрыва. Материал для
проведения исследования извлекался из нефиксированных тел умерших обоих полов.
Методом случайной выборки участки влагалища иссекались с правой либо левой
стороны от срединной линии. Передняя брюшная стенка была условно поделена на
четыре зоны, обозначенных арабскими цифрами 1, 2, 3, 4. Зона 1 - передний
листок влагалища прямой мышцы живота в эпигастрии выше пупка. Зона 2 - задний
листок влагалища прямой мышцы живота в эпигастрии выше пупка. Зона 3 -
апоневроз прямых мышц в гипогастральной области дистальнее дугообразной линии.
Зона 4 - поперечная фасция на участке дистальнее дугообразной линии. Размеры
лоскута для исследования составляли не менее 3 х 4 см (12 см²). Образцы препаратов
длиной 3 см и шириной 4 см тщательно отделялись от окружающих тканей и
укладывались в ёмкости со стерильным 0,9% раствором хлорида натрия; ёмкости
маркировались. Полученный материал доставлялся втечение 12 часов в
термоизоляционной камере (T - 5-7 0С) для проведения физического эксперимента.
Перед проведением эксперимента образцы стратифицировались по размеру 1 х 2 см
(2 см²) + 6 мм необходимых для
закрепления образца в зажимах. Всего исследовано 130 образцов
фасциально-апоневротических структур передней брюшной стенки. В лаборатории
кусочки влагалищ прямых мышц живота закреплялись в аппарате. Проводилось автоматическое
измерение их толщины. Затем устройство растягивало препарат до разрыва со
скоростью 100 мм/мин. Кривая разрыва записывалась на графической карте.
Перерасчет проводился в мм растяжения и в относительных величинах (100% -
полный разрыв, 75% растяжения, 50% растяжения, 25% растяжения). Также
оценивалась сила, прикладываемая к образцу в момент начала разрыва.
Все данные исследования
протоколировались. Для этого использовались следующие документы:
1. Протокол исследования
трупа (см. приложение №1)
2. Графическая карта
регистрации биомеханических свойств апоневроза (см. приложение №2).
.2.2 Методики
клинического исследования
При работе в клинике основным
документом являлась учетная карта больного с острой кишечной непроходимостью,
см. приложение №3.
Все данные дооперационного периода
собирались за 1 час до проведения операции. В послеоперационном периоде
регистрация проводилась в определенные сроки. Регистрируемые показатели
отражали состояние на конкретный момент времени, а не представляли собой среднее
значение за истекший временной промежуток. Внутрибрюшное давление
регистрировали с помощью измерительной линейки и прозрачной трубки, соединенной
с уретральным катетером Фолея №20, введенным в мочевой пузырь. Регистрацию
показателей гемодинамики проводили с помощью аппарата SCHILLER Argus LCM (Swiss).
Методика регистрации внутрибрюшного
давления в клинике
При измерении давления в мочевом
пузыре пациент находился в положении лежа на спине. В мочевой пузырь
устанавливался мочевой катетер Фолея №№18-20. В мочевой пузырь перед каждым
измерением давления вводилось 80 мл стерильного физиологического раствора
подогретого до 38 градусов по Цельсию. Катетер соединялся с прозрачной
силиконовой трубкой. Уровень внутрибрюшного давления оценивался по отношению к
нулевой отметке - верхнему краю лонного сочленения. В качестве измерительного
прибора использовалась градуированная линейка.
Методика статистической обработки
материала
Статистическая обработка проводилась
методом оценки значимости различия параметров распределения в независимых
выборках. Производилось вычисление среднего значения (М), максимальных (Max.) и
минимальных (Min) величин, среднеквадратического отклонения (s). Производилось
вычисление критерия Стьюдента (t) для определения значимости различий между средними величинами в
исследуемых группах (Бенсман В.М., 2002, Гланц С., 1998). Наряду с этим
вычислялся непараметрический критерий Крускала-Уоллиса (χ2), и проводился корреляционный анализ (коэффициент корреляции
Пирсона, r) для определения значимости различий между группами и связи между
определяемыми показателями. При анализе исходили из положения, что для
медико-биологических исследований достаточен 95%-ный доверительный интервал.
Поэтому различия считались статистически значимыми при p≤0,05. Обработка данных
выполнена с помощью персонального компьютера с программным обеспечением Windows 2007.
3. Изучение возможностей
внекишечной декомпрессии брюшной полости (экспериментальное исследование)
.1 Физические свойства
влагалищ прямых мышц живота
Для обоснования возможности
рассечения передних листков влагалищ прямых мышц живота с целью увеличения
объема брюшной полости было проведено экспериментальное исследование, которое
должно было доказать, что задний листок влагалища прямых мышц живота обладает
такими прочностными характеристиками, которые бы позволили выдерживать
повышенное внутрибрюшное давление, а в дальнейшем удерживать переднюю брюшную
стенку от релаксации. При этом не учитывались свойства прямой мышцы, имеющей
прочность 1,2*105 Па, растяжимость 75% (С.П. Вихров и соавт., 2006).
Проводилась оценка трех показателей:
толщины апоневроза на различных уровнях передней брюшной стенки, растяжимости
листков апоневроза, прочности на разрыв. Для достижения целей эксперимента
объекты исследования, от которых забирался материал, были поделены по возрасту
и полу (гл. 2, табл. 1). Оценка толщины образцов у лиц обоего пола и разного
возраста. проводилась автоматически, при закреплении в клеммы аппарата.
У мужчин толщина апоневроза в
эпигастральной области практически одинаковая у переднего и заднего листков
влагалища прямой мышцы живота. Средние значения составляют 800 и 850 микрон
соответственно. Толщина апоневроза в гипогастральной области выше, чем во всех
остальных участках и составляет 970 микрон (p>0,05). Выраженность поперечной
фасции на участке ниже пупка незначительная, и её толщина в среднем равна 670
микронам (см. рис. 3.1.). Такое соотношение толщины апоневроза на различных
участках передней брюшной стенки у мужчин, возможно, объяснить тем фактом, что
мышечный массив на участке выше пупка более развит, особенно у лиц с формой
живота, расширяющейся вверх (Горбунов Н.С., 1998, 2006).
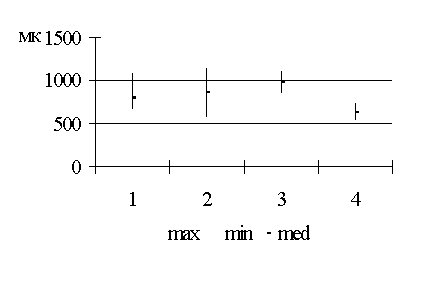
Рис. 3.1. Максимальная (max), минимальная (min)
и средняя (med) толщина образцов апоневроза прямых мышц живота в разных областях
передней брюшной стенки у мужчин в микронах.
. передний листок влагалища
прямой мышцы живота в эпигастрии
. задний листок
влагалища прямой мышцы живота в эпигастрии
. апоневроз прямой мышцы
в гипогастрии
. поперечная фасция
живота в гипогастрии
У женщин толщина
апоневроза на разных участках брюшной стенки имеет иное соотношение. Абсолютные
значения толщины переднего листка больше, чем заднего листка влагалища прямых
мышц живота (850 и 700 микрон соответственно), однако статистически значимой
разницы не обнаружено (p>0,1).
Толщина апоневроза в гипогастральной области и заднего листка влагалища прямых
мышц живота практически одинакова (p>0,1).
Наиболее вероятно, такое распределение обусловлено более частой встречаемостью
у женщин формы живота, расширяющейся вниз, при которой мышечный массив более
развит на участке ниже пупка (рис. 3.2).
Оценка полученных данных
показала, что толщина переднего листка у мужчин и женщин практически
одинаковая, тогда как задний листок апоневроза у мужчин более толстый, чем у
женщин (p>0,05). Однако у женщин он сопоставим с толщиной апоневроза в гипогастральной
области.
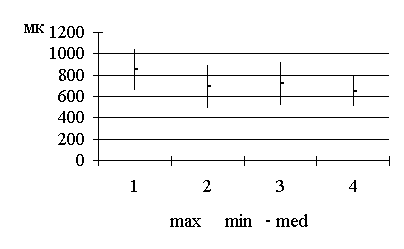
Рис. 3.2. Максимальная (max), минимальная (min)
и средняя (med) толщина образцов апоневроза прямых мышц живота в разных областях
передней брюшной стенки у женщин в микронах.
. передний листок
влагалища прямой мышцы живота в эпигастрии
. задний листок
влагалища прямой мышцы живота в эпигастрии
. апоневроз прямой мышцы
в гипогастрии
. поперечная фасция
живота в гипогастрии
Исследование толщины
апоневроза у трупов в возрасте до 60 лет позволило выявить, что у лиц обоего
пола наибольшую толщину имеет апоневроз в гипогастральной области (около 1000
микрон). Толщина листков влагалищ прямых мышц живота в эпигастральной области
(каждого в отдельности) у лиц до 60 лет меньше, чем в гипогастральной области
(880 микрон у переднего листка и 875 микрон у заднего). При этом суммарная
толщина обоих листков влагалища прямых мышц живота в эпигастральной области в
1,7 раза выше, чем в гипогастральной области. Толщина поперечной фасции в
гипогастральной области в 1,7 раза меньше, чем апоневроза в гипогастральной
области (см. рис. 3.3.).
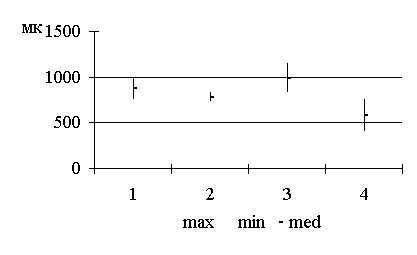
Рис. 3.3. Максимальная (max), минимальная (min)
и средняя (med) толщина образцов апоневроза прямой мышцы живота в разных
областях передней брюшной стенки у людей в возрасте до 60 лет в микронах
. передний листок
влагалища прямой мышцы живота в эпигастрии
. задний листок
влагалища прямой мышцы живота в эпигастрии
. апоневроз прямой мышцы
в гипогастрии
. поперечная фасция
живота в гипогастрии
При оценке толщины
образцов апоневрозов у лиц старше 60 лет было обнаружено, что наибольшей
толщиной (по абсолютным значениям) обладает передний листок влагалища
апоневроза прямых мышц живота. Толщина апоневроза, формирующего задний листок и
апоневроза в гипогастральной области примерно одинаковые (около 700 микрон).
Можно предположить, что передний листок влагалища прямой мышцы живота имеет
большую держательную нагрузку, чем задний в пределах эпигастральной области.
Толщина заднего листка влагалища прямых мышц живота у лиц старше 60 лет, меньше
в 1,08 раза, чем у переднего и в 1,003 раза меньше, чем у лиц до 60 лет;
статистически значимой разницы в показателях не обнаружено (p>0,01). Кроме того, отмечается очень маленький разброс величин
толщины переднего и заднего листков апоневроза (около 150 мк). Данный факт
говорит о жесткости этих конструкций (рис. 3.4).
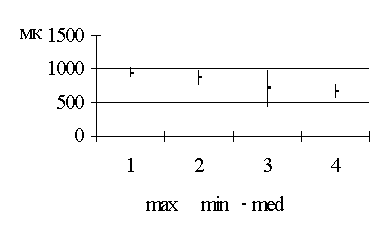
Рис. 3.4. Максимальная (max), минимальная (min)
и средняя (med) толщина образцов апоневроза прямых мышц живота в разных областях
передней брюшной стенки у людей в возрасте старше 60 лет в микронах
. передний листок
влагалища прямой мышцы живота в эпигастрии
2. задний листок влагалища
прямой мышцы живота в эпигастрии
3. апоневроз прямой мышцы в
гипогастрии
. поперечная фасция живота в
гипогастрии
На рисунке 3.5. представлено общее
распределение толщины апоневроза передней брюшной стенки вне зависимости от пола
и возраста.
Толщина листков апоневроза на разных
участках брюшной стенки различная и зависит от пола и возраста. При оценке
распределения отмечено, что толщина апоневроза наибольшая у переднего листка
влагалища прямых мышц живота и апоневроза в гипогастральной области (880
микрон), что в 1,14 раза больше, чем у заднего листка влагалища прямых мышц
живота. Тем не менее, разница в показателях статистически незначима (p>0,05). У мужчин задний листок
влагалища апоневроза прямой мышцы живота толще, чем у женщин. Разброс величин
толщины апоневроза больше в гипогастральной области (около 400 микрон), тогда
как апоневроз, формирующий листки влагалища прямых мышц жестко фиксирован в
пределах 100 микрон вне зависимости от пола и возраста. Отсутствие достоверной разницы
в толщине между листками влагалища прямых мышц в эпигастральной области в
различных возрастных группах позволяет говорить о приблизительно одинаковой
нагрузке на оба листка. Как у мужчин, так и у женщин листки влагалищ прямых
мышц живота были не тоньше 500 мк.
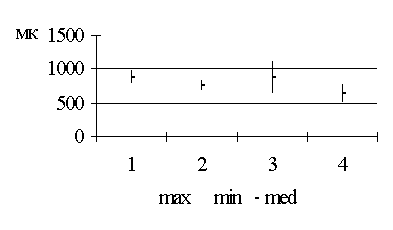
Рис. 3.5. Максимальная (max), минимальная (min)
и средняя (med) толщина образцов апоневрозов прямой мышцы живота в разных
областях передней брюшной стенки в микронах (сводные данные).
. передний листок
влагалища прямой мышцы живота в эпигастрии
2. задний листок влагалища
прямой мышцы живота в эпигастрии
3. апоневроз прямой мышцы в
гипогастрии
. поперечная фасция живота в
гипогастрии
Следующим этапом исследования
образцов апоневрозов явилось определение растяжимости его листков, т.е.
определения относительного удлинения листков апоневроза от исходной длины до
начала разрыва образцов. Растяжение осуществлялось в двух направлениях: в
продольном и поперечном по отношению к белой линии живота. Растягивание,
закрепленного в клеммах аппарата, образца апоневроза проводилось до разрыва со
скоростью 100 мм/мин. Растяжимость оценивалась в зависимости от пола и возраста
исследованных.
У мужчин наибольшей растяжимостью
обладает апоневроз прямых мышц живота в гипогастральной области (около 50% от
исходной длины), которая в среднем 1,5 раза больше, чем в других областях
передней брюшной стенки (p>0,05). Разброс относительного удлинения очень велик от 30 до
70%, что позволяет говорить о способности этой конструкции значительно
деформироваться.
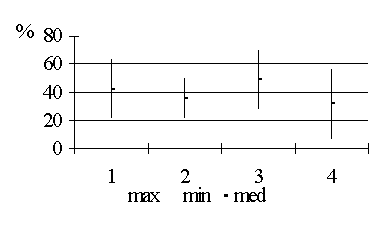
Рис. 3.6. Максимальная (max), минимальная (min)
и средняя (med) растяжимость образцов апоневроза прямой мышцы живота в разных
областях передней брюшной стенки в% у мужчин
. передний листок
влагалища прямой мышцы живота в эпигастрии
2. задний листок влагалища
прямой мышцы живота в эпигастрии
3. апоневроз прямой мышцы в
гипогастрии
. поперечная фасция живота в
гипогастрии
Задний листок апоневроза имеет
среднюю величину относительного удлинения (37%) и наименьший разброс этой
величины (20%). Этот факт позволяет определить его как более жесткую
конструкцию, с низкой способностью к деформации. Это связано с существованием
поверхностной и глубокой фасций апоневроза, предотвращающих более значительное
расхождение волокон, а также большим количеством коллагеновых волокон. У мужчин
задний листок влагалища имеет высокий предел прочности (устойчивость к
растяжению), рис. 3.6. Сила, необходимая для разрыва, наибольшая для данной
категории ткани (среднее значение 35,9 Н). Для сравнения сила, необходимая для
разрыва переднего листка влагалища прямых мышц больше всего на 7 Н.
Несколько иной представляется
растяжимость листков апоневроза у женщин. Относительное удлинение до начала
разрыва у переднего и заднего листков влагалищ прямых мышц живота имеет разницу
около 8% (p>0,1). Задний листок влагалища прямых мышц живота также как и у
мужчин имеет меньшее относительное удлинение (в среднем на 37% от исходной
длины), а разброс показателя растяжимости ограничен в пределах 30%. Таким
образом, у женщин задний листок влагалища прямых мышц имеет низкую способность
деформироваться - низкие упругие свойства (рис. 3.7.).
При растягивании листков в
продольном и поперечном направлении установлено, что растяжимость в поперечном
направлении на 20% выше, чем в продольном для заднего листка и на 35% для
переднего листка. Этот факт, по-видимому, обусловлен тем, что пучки
коллагеновых волокон лежат на некотором расстоянии друг от друга, ориентированы
косо продольно к поверхности и практически не анастомозируют между собой.
При оценке растяжимости листков
апоневроза по различным возрастным группам было установлено, что вне
зависимости от возраста распределение растяжимости остается примерно
одинаковым. Наибольшей растяжимостью обладает апоневроз в гипогастральной
области, наименьшей задний листок влагалища прямых мышц живота. Однако разброс
показателей у лиц моложе 60 лет, в целом, на 40% больше, чем у лиц старше 60
лет (рис. 3.8 и 3.9.). Данный факт наиболее вероятно можно объяснить большей
эластичностью апоневрозов у лиц молодого возраста.
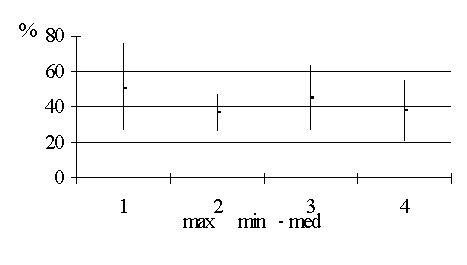
Рис. 3.7. Максимальная (max), минимальная (min)
и средняя (med) растяжимость образцов апоневроза прямых мышц живота в разных
областях передней брюшной стенки в% у женщин
. передний листок
влагалища прямой мышцы живота в эпигастрии
. задний листок
влагалища прямой мышцы живота в эпигастрии
. апоневроз прямой мышцы
в гипогастрии
. поперечная фасция
живота в гипогастрии
Растяжимость апоневроза
в гипогастральной области больше, чем в других областях передней брюшной стенки
в среднем в 1,5 раза (p>0,05).
Данный факт можно объяснить особенностью пространственного расположения и
конфигурацией коллагеновых и эластических волокон в данной зоне, а также
влиянием внутренних органов на переднюю брюшную стенку (А.Г. Кочетков, А.Л.
Колесников, 1997). Наименьшее значение растяжимости имеет задний листок
влагалища прямых мышц живота. Этот факт можно объяснить тремя основными
причинами. Первая - это преобладание коллагеновых волокон в заднем листке
апоневроза влагалища прямых мышц живота, которые очень сильно переплетаются
между собой, а, иногда, и срастаются. Вторая связана с распределением давления
на листки апоневроза: давление на плоскость апоневроза изнутри меньше, чем
снаружи. Кроме того, грубые коллагеновые волокна заднего листка смещаются
только в продольном направлении. Третья причина связана с наличием очень
плотных перитенониев (наружного и внутреннего).
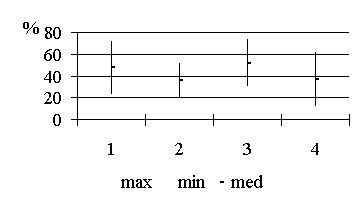
Рис. 3.8. Максимальная (max), минимальная (min)
и средняя (med) растяжимость образцов апоневроза прямых мышц живота в разных
областях передней брюшной стенки в% у людей в возрасте до 60 лет
1. передний листок влагалища
прямой мышцы живота в эпигастрии
2. задний листок влагалища
прямой мышцы живота в эпигастрии
. апоневроз прямой мышцы в
гипогастрии
. поперечная фасция живота в
гипогастрии
Растяжимость переднего листка
влагалища превышает растяжимость заднего, и связано это с тем, что в её составе
больше эластических волокон. Эти эластические волокна ориентируются вдоль
коллагеновых (Горбунов Н.С., 2006). Кроме того, сухожильные волокна имеют, как
правило, продольное или косо-продольное направление. Этим обстоятельством можно
объяснить и столь большой разброс относительного удлинения (на 20-60% от
исходной длины).
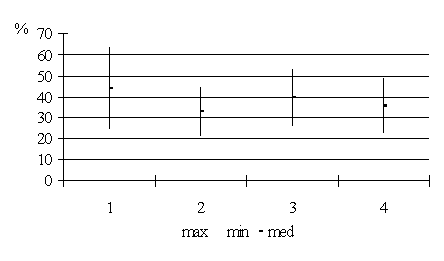
Рис. 3.9. Максимальная (max), минимальная (min)
и средняя (med) растяжимость образцов апоневроза прямой мышцы живота в разных
областях передней брюшной стенки в% у людей в возрасте старше 60 лет
. передний листок
влагалища прямой мышцы живота в эпигастрии
. задний листок
влагалища прямой мышцы живота в эпигастрии
. апоневроз прямой мышцы
в гипогастрии
Отмечено, что в среднем
разрыв образцов заднего листка влагалища прямых мышц живота наступал при
относительном удлинении в 40,4% (в абсолютных значениях это составляет 11,9±5,0
мм). Для растяжения апоневроза на каждые 3 мм, требовалось прикладывать силу,
приблизительно равную удвоенному значению предыдущего этапа, табл. 3.1.
Таблица 3.1. Критические
значения растяжимости заднего листка влагалища прямой мышцы живота у людей
|
Растяжимость в%
|
Растяжимость в мм
|
Сила в Н
|
|
25%
|
3,2±2,7
|
5,5±4,4
|
|
50%
|
5,8±2,5
|
14,7±8,8
|
|
75%
|
8,8±4,0
|
28,0±14,5
|
|
100%
|
11,9±5,0
|
35,9±17,8
|
При оценке прочности листков
апоневроза определялась их способность противостоять разрыву. На рисунке 3.10
представлена прочность листков, оцененная в момент наступления разрыва. При
этом было отмечено, что наибольшим пределом прочностью обладает передний листок
влагалища прямых мышц живота. При оценке пределов прочности других листков было
обнаружено, что он наименьший у апоневроза в гипогастральной области. Было
показано, что для разрыва заднего листка требуется приложить силу в среднем
35,9 Н (т.е. на образец оказывалось давление равное 47,8*105 Па).
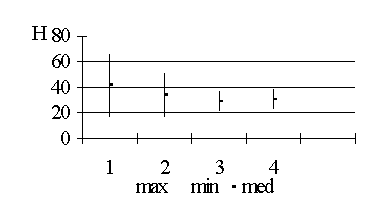
Рис. 3.10. Максимальная
(max), минимальная (min)
и средняя (med) сила, приложенная к образцам апоневроза прямой мышцы живота в
разных областях передней брюшной стенки, для наступления разрывав Н.
1. передний листок влагалища
прямой мышцы живота в эпигастрии
2. задний листок влагалища
прямой мышцы живота в эпигастрии
. апоневроз прямой мышцы в
гипогастрии
. поперечная фасция живота в
гипогастрии
Таким образом, можно отметить, что
прочностные характеристики заднего листка апоневроза прямых мышц живота в эпигастральной
области позволяют использовать его в качестве единственного листка апоневроза
передней брюшной стенки, при котором не нарушается анатомическая целостность
брюшного пресса. Растяжимость футлярообразующего субстрата позволяет в
значительной мере увеличивать объем брюшной полости.
.2 Результаты
лапарометрического исследования при выполнении декомпрессивной фасциотомии
Особенности функции передней брюшной
стенки предполагают возможность физиологического увеличения объёма брюшной
полости в процессе нормального функционирования организма. Эта реакция является
приспособительной. Однако при заболеваниях, сопровождающихся быстрым повышением
внутрибрюшного давления, такого резерва оказывается недостаточно. Для
доказательства изменения резервного объёма брюшной полости при рассечении
передних листков влагалищ прямых мышц живота проведено измерение размеров
передней брюшной стенки в условиях повышенного внутрибрюшного давления.
Предполагается, что форма живота при повышении внутрибрюшного давления может изменяться,
тем самым, создавая максимально возможное резервное пространство.
В трех сериях эксперимента было
проведено измерение размеров передней брюшной стенки.
Оценка результатов измерения
исходных размеров позволила разделить контингент исследуемых по формам живота в
соответствии с предложением Лавровой Т.Ф. (1979) на три группы. Наибольшую
группу составили трупы с формой живота, расширяющейся вниз - 37. У 11 умерших
была форма живота, расширяющейся вверх. Шесть трупов имели овоидную форму
живота. При расчете распределения в выборке отмечено соответствие форм живота с
общим распределением в популяции - 6,1:1,8:1,0. Средние значения размеров
передней брюшной стенки в исследуемой группе трупов представлены в таблице 3.2.
Таблица 3.2. Показатели размеров
передней брюшной стенки при разной форме живота, (М±σ)
|
Уровни измерения
|
Среднее расстояние между контрольными точками при форме живота в
см:
|
|
расширяющейся вверх N=11
|
расширяющейся вниз N=37
|
овоидной N=6
|
|
A
|
39,86±1,64 см
|
33,9±3,8 см
|
36±0,63 см
|
|
B
|
34,18±1,14 см
|
40,6±3,38 см
|
36±0 см
|
|
C
|
38,4±1,35 см
|
35,47±3,7 см
|
40,16±1,5 см
|
|
D
|
36,1±1,35 см
|
38,6±3,52 см
|
43,5±2,5 см
|
Различия размеров, определяющих
формы живота (размер А и размер В) статистически значимы для форм,
расширяющихся вверх и вниз (p<0,001), не значимы для овоидной формы живота (p>0,1), рис. 3.11.
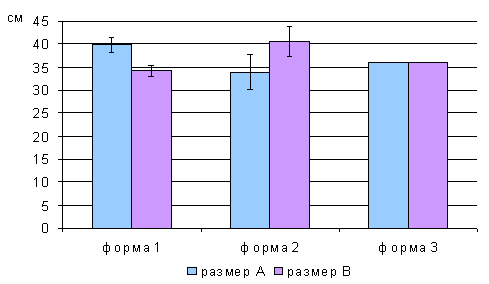
Рис. 3.11. Соотношение размеров
передней брюшной стенки, определяющих форму живота.
Форма 1 - расширяющаяся вверх
(размер А > размера B; t = 21, p<0,001).
Форма 2 - расширяющаяся вниз (размер
А < размера B; t = 9.57, p<0,001).
Форма 3 - овоидная (размер А =
размеру B).
Отмечено, что группу с формой
живота, расширяющейся вниз, составили, преимущественно, трупы женского пола (32
трупа женского пола, 5 трупов мужского пола, в соотношении 6,4:1). В то время
как в группы с двумя другими формами живота (расширяющейся вверх и овоидной)
входили преимущественно трупы мужского пола (11 трупов мужского пола и 6 трупов
женского пола, в соотношении 1,84:1). Данное распределение соответствует
среднему соотношению в популяции (Горбунов Н.С., 1999), табл. 3.3.
Следовательно, изучаемая выборка является частью генеральной совокупности.
Таблица 3.3. Распределение
исследуемых по полу и формам живота
|
Форма живота
|
Пол
|
|
Мужской (%)
|
Женский (%)
|
Всего
|
|
Расширяющаяся вверх
|
7 (13%)
|
4 (8%)
|
11 (21%)
|
|
Расширяющаяся вниз
|
5 (9%)
|
32 (58%)
|
37 (69%)
|
|
Овоидная
|
3 (6%)
|
3 (6%)
|
6 (10%)
|
|
Всего
|
15 (28%)
|
39 (72%)
|
54 (100%)
|
Форма живота и размеры передней
брюшной стенки адекватно и обратимо изменяются при глубоком вдохе и выдохе,
после обильной еды и при переходе человека из горизонтального в вертикальное
положение (Горбунов Н.С., 1999). При этом в соответствии с законом Паскаля
давление должно равномерно распределиться на все отделы брюшной полости.
Логично предположить, что нагнетание
воздуха в брюшную полость приведет к равномерному распределению давления, и,
следовательно, к пропорциональному и симметричному увеличению размеров передней
брюшной стенки, так, что при этом сохранится соотношение между её размерами,
т.е. сохранится форма живота. Как следует из приведенных в табл. 3.4. данных,
соотношения размеров живота при быстром повышении внутрибрюшного давления
сохраняются не во всех случаях.
Таблица 3.4. Размеры передней
брюшной стенки при разных формах живота при внутрибрюшном давлении в 27,2 см.
вод. ст., (М±σ)
|
Уровни измерения
|
Среднее расстояние между контрольными точками при форме живота в
см:
|
|
расширяющейся вверх N=11
|
расширяющейся вниз N=37
|
овоидной N=6
|
|
A
|
41,73±1,74 см
|
36,7±3,77 см
|
37,83±0,75 см
|
|
B
|
40,27±1,0 см
|
47,1±4,91 см
|
41±1,1 см
|
|
C
|
40,18±0,98 см
|
37,73±4 см
|
43,3±1,63 см
|
|
D
|
41,1±1,3 см
|
47,31±6,44 см
|
52,7±1,86 см
|
Установлено, что при повышении
внутрибрюшного давления до 27 см. вод. ст. происходит увеличение всех линейных
размеров передней брюшной стенки. В большей степени изменяется размер D - на 19%, что можно объяснить
отсутствием костных структур в данном участке передней брюшной стенки. Размеры
А и C увеличиваются только на 6% вне зависимости от формы живота, что,
по-видимому, связано с наличием реберного каркаса грудной клетки. Размер В
увеличивается в среднем на 16%.
При форме живота, расширяющейся
вниз, размер А увеличился в 1,08 раза (t = 3,18, p<0,05), размер B в 1,16 раза (t = 6,63, p<0,001), размер C в 1,06 раза (t = 2,52, p<0,05), размер D в 1,22 раза (t = 7,25, p<0,001). Таким образом, размеры
живота увеличиваются так, что пропорции, определяющие форму живота,
расширяющуюся вниз, сохраняются. Размер А меньше размера В (t=12,38, p<0,001), рис. 3.12.
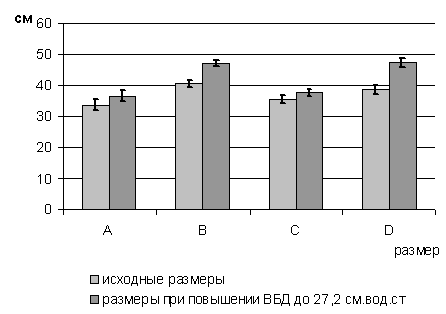
Рис. 3.12. Размеры передней брюшной
стенки при форме живота, расширяющейся вниз до и после повышения ВБД
При форме живота, расширяющейся
вверх, изменение размеров передней брюшной стенки происходит следующим образом:
размер A увеличился в 1,05 раза (t = 2,6, p<0,05), размер B увеличился в 1,18 раза (t=13,24, p<0,001), размер C увеличился в 1,05 раза (t=3,56, p<0,05), размер D увеличился в 1,14 раза (t=8,85, p<0,001). Несмотря на то, что поперечные размеры живота
достоверно увеличиваются, соотношение между ними значительно меняется (размер A практически не увеличивается,
тогда, как размер B увеличивается значительно), поэтому соотношение, определяющее
форму живота, не сохраняется (t=2,5, p>0,02), рис. 3.13.
При овоидной форме живота изменение
размеров также происходит непропорционально: размер A увеличивается в 1,05 раза (t=4,57, p<0,05), размер B увеличивается в 1,14 раза (t=11,0, p<0,001), размер C увеличивается в 1,08 раза (t=3,5, p<0,01), размер D - в 1,21 раза (t=7,25, p<0,001), рис. 3.14.
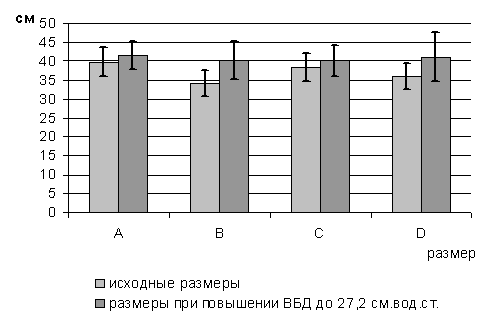
Рис. 3.13. Размеры передней брюшной
стенки при форме живота, расширяющейся вверх до и после повышения ВБД
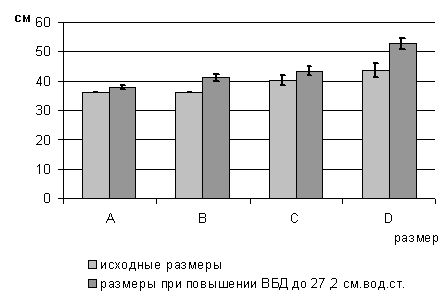
Рис. 3.14. Размеры передней брюшной
стенки при овоидной форме живота до и после повышения ВБД
Как следует из данных рис. 3.14.
повышение ВБД привело к изменению соотношений между размерами А и В (t=16,7, p<0,001).
Таким образом, отмечено, что при
любой форме живота увеличение внутрибрюшного давления приводит к достоверному
увеличению поперечных размеров передней брюшной стенки в среднем на 11%. В
результате расчетов установлено, что увеличение поперечных размеров живота при
повышении ВБД сопровождается пропорциональными изменениями при форме живота,
расширяющейся вниз. При двух других формах соотношение размеров практически
полностью изменяется; овоидная форма живота стремиться к форме, расширяющейся
вниз, а форма, расширяющаяся вверх - к овоидной форме. При снижении давления до
исходных значений соотношение размеров, определяющих форму живота,
восстанавливалось.
Большее увеличение нижних поперечных
размеров брюшной стенки с изменением формы живота свидетельствуют о наличии
анатомических образований, препятствующих аналогичной подвижности брюшной
стенки в верхних отделах. Предложенный способ рассечения переднего листка
влагалища прямых мышц живота с отсечением первой сухожильной перемычки от него
может позволить увеличить мобильность брюшной стенки так, что произойдет к
увеличение, именно, поперечных размеров, а, следовательно, и объёма живота. Целью
третьего этапа лапарометрии явилось доказательство данного факта. Для
достижения цели эксперимента выполнялась декомпрессивная фасциотомия и
проводилось послойное ушивание раны передней брюшной стенки. После этого
давление в брюшной полости повышали до 27,2 см. вод. ст. Результаты третьей
серии эксперимента представлены в таблице 3.5.
Как следует из данных таблицы 3.5,
происходит увеличение размеров передней брюшной стенки. Увеличение поперечных
размеров (А - на 36%; C - на 35%, D - на 16%) передней брюшной стенки в эпигастральной области
является статистически значимым (tA=14,8, p<0,001; tC=14,4, p<0,001; tD=6,08 p<0,001). Размер B увеличивается на 5,5% (tB=2,51, p<0,05) - в этой зоне декомпрессивная фасциотомия не
выполнялась.
Таблица 3.5. Средние размеры
передней брюшной стенки при повышенном ВБД до и после декомпрессивной
фасциотомии, (M±σ)
|
Уровни измерения
|
Расстояние между контрольными точками измерения, см
|
|
До выполнения фасциотомии
|
После выполнения фасциотомии
|
|
А
|
37,34±3,8 см
|
50,87±5,48 см
|
|
B
|
45,04±5,12 см
|
47,50±5,14 см
|
|
C
|
38,85±3,9 см
|
52,43±5,72 см
|
|
D
|
46,64±6,3 см
|
54,00±6,25 см
|
Для создания давления в 27,2 см.
вод. ст. требуется объём воздуха в среднем на 2100±800 мл больше, чем в случае
глухого ушивания раны передней брюшной стенки (p<0,001). Это обстоятельство
очевидно связано с увеличением объёма брюшной полости за счет выполнения
декомпрессивной фасциотомии.
Для оценки возможных последствий
фасциотомии на сохранность анатомических структур передней брюшной стенки
оценивались ещё два показателя - диастаз между краями раны апоневроза и наличие
пролапса прямой мышцы в рану. Диастаз между краями раны апоневроза оценивался в
сантиметрах и регистрировался в центральном отделе апоневротической раны, т.е.
в месте наибольшего расхождения краев. Наличие пролапса мышцы оценивалось по
признаку есть/нет. Было отмечено, что расхождение краев прямых мышц живота при
повышении давления до 27,2 см. вод. ст. составляло в среднем 6,7±1,82 см (с
каждой из сторон) от белой линии. При этом в 52 случаях (96%) пролапса мышцы в
апоневротическую рану не выявлено.
В ходе расчетов с изменением формы
живота и его поперечных размеров при повышении внутрибрюшного давления и при
выполнении декомпрессивной фасциотомии выявлены следующие особенности:
. Форма живота при повышении
внутрибрюшного давления сохраняется не во всех случаях, т.к. соотношения между
размерами значительно изменяются;
. Линейные значения поперечных
размеров передней брюшной стенки при повышении внутрибрюшного давления
достоверно увеличиваются на 11%;
. Выполнение декомпрессивной
фасциотомии приводит к увеличению линейных значений поперечных размеров брюшной
стенки в эпигастральной области на 38%;
. Увеличение размеров передней
брюшной стенки сопровождается увеличением объёма брюшной полости в среднем на
2,5 литра.
.3 Результаты
барометрических исследований при восстановлении целостности передней брюшной
стенки после лапаротомии
Основной задачей данного этапа
экспериментального исследования было определение возможности уменьшения
внутрибрюшного давления путем выполнения декомпрессивной фасциотомии.
При измерении исходного уровня
внутрибрюшного давления у трупов (до начала проведения эксперимента) было
установлено, что его значения в среднем составляют 7,12±1,95 см. вод. ст.
Данный факт объясняется тем, что в кишечной трубке умершего начинаются процессы
брожения и / или гниения (К.И. Хижнякова, 1986), что приводит к вздутию желудка
и кишечника. Другим моментом, определяющим рост ВБД, является уплотнение мышц
передней брюшной стенки, наступающее при трупном окоченении. По вышеописанной
ранее методике проводилось измерение исходных значений ВБД. В таблице 3.6
представлены исходные показатели ВБД в изучаемой группе.
Таблица 3.6. Исходные значения
внутрибрюшного давления
|
Число объектов исследования
|
Максимальное значение см. вод. ст.
|
Минимальное значение см. вод. ст.
|
Среднее значение см. вод. ст.
|
Стандартное отклонение σ
|
|
54
|
13,1
|
4
|
7,12
|
1,95
|
Обнаружено, что значения уровня
внутрибрюшного давления (исходного) зависят от формы живота и толщины передней
брюшной стенки. Так более высокие значения внутрибрюшного давления чаще
встречались у трупов, имеющих форму живота, расширяющуюся вниз. Данный факт
можно объяснить тем, что среди исследуемых, чаще встречались трупы лиц женского
пола, для которого более характерна форма живота, расширяющаяся вниз (37
трупов). В данной группе также встречалось повышенное отложение жира в
подкожной клетчатке передней брюшной стенки (в мезогастральной и
гипогастральной областях), что приводило к увеличению индекса массы тела и толщины
передней брюшной стенки. Более высокие показатели уровня ВБД были выявлены у
трупов более длительных сроков хранения (от 15 до 20 часов после констатации
смерти), что связано с трупным окоченением и газообразованием в кишечной трубке
вследствие аутолиза. У трупов людей с формой живота, расширяющейся вверх или
овоидной формой (17 трупов), повышенные значения уровня внутрибрюшного давления
отмечались в основном при длительном хранении.
Следующим этапом выполнено
нагнетание воздуха в свободную брюшную полость с целью создания уровня ВБД
равного 27,2 см. вод. ст. После этого выполнялось рассечение апоневроза по
белой линии без вскрытия брюшинного листка. При этом отмечено значительное
снижение внутрибрюшного давления у всех исследуемых объектов. Значения ВБД после
лапаротомии представлены в табл. 3.7.
Таблица 3.7. Значения ВБД после
рассечение апоневроза по белой линии живота
|
Число объектов исследованияМаксимальное значение см. вод.
ст.Минимальное значение см. вод. ст.Среднее значение см. вод. ст.Стандартное отклонение
σ
|
|
|
|
|
|
54
|
6
|
2
|
3,31
|
0,11
|
Было установлено, что среднее
арифметическое значение ВБД после рассечения апоневроза составило 3,31±0,11 см.
вод. ст. (т.е. уменьшается на 88% от уровня в 27,2 см. вод. ст. (p<0.001)). Снижение ВБД отмечено
во всех случаях вне зависимости от каких-либо условий.
В целом среднее арифметическое
значение ВБД после рассечения апоневроза по белой линии живота без вскрытия
брюшинного листка на 50% меньше, чем его исходное значение.
В третьей серии измерений
внутрибрюшное давление оценивалось после ушивания раны апоневроза без
декомпрессивной коррекции. Результаты данного измерения представлены в табл.
3.8.
Таблица 3.8. Значения ВБД после
ушивания раны передней брюшной стенки без декомпрессивной коррекции
|
Число объектов исследованияМаксимальное значение см. вод.
ст.Минимальное значение см. вод. ст.Среднее значение см. вод. ст.Стандартное
отклонение σ
|
|
|
|
|
|
54
|
36,2
|
29,1
|
32,93
|
1,55
|
Как показал анализ представленного
материала, среднее арифметическое значение ВБД после восстановления целостности
передней брюшной стенки составило 32,93±1,55 см. вод. ст. При этом отмечено,
что повышение давления ограничивалось пределами в 29,1-36,2 см. вод. ст.
Следовательно, при условии, что количество воздуха в брюшной полости не
менялось, восстановление целостности передней брюшной стенки без дополнительных
декомпрессивных мероприятий приводило к росту давления в среднем на 5,73 см.
вод. ст.
После традиционного восстановления
целостности брюшной стенки отмечается увеличение уровня ВБД в 9,94 раза от
уровня достигнутого после рассечения апоневроза (p>0,05). Также было выявлено
отсутствие связи между формой живота и приростом внутрибрюшного давления
(критерий Спирмена, r = 0,06).
Четвёртым этапом эксперимента было
определение уровня ВБД при ушивании раны апоневроза с декомпрессивной
фасциотомией. Предварительно швы, наложенные для глухого ушивания раны,
снимались. Это приводило к снижению давления в брюшной полости до значений,
обозначенных во второй серии эксперимента. Далее проводились декомпрессивная
фасциотомия и ушивание раны. При этом объём воздуха, введенного в брюшную
полость, оставался прежним (новая порция воздуха не нагнеталась). Результаты
четвёртой серии эксперимента представлены в таблице 3.9.
Таблица 3.9. Значения ВБД при
ушивании раны передней брюшной стенки с декомпрессивной фасциотомией
|
Число объектов исследованияМаксимальное значение см. вод.
ст.Минимальное значение см. вод. ст.Среднее значение см. вод. ст.Стандартное
отклонение σ
|
|
|
|
|
|
54
|
24
|
19,2
|
21,08
|
1,32
|
Среднее значение ВБД при ушивании
раны с декомпрессивной фасциотомией составило 21,08±1,32 см. вод. ст. При этом
отмечено, что снижение ВБД произошло в 1,56 раза (в среднем на 11,8 см. вод.
ст) по сравнению с внутрибрюшным давлением при глухом ушивании раны (p>0,001). Внутрибрюшное давление
снизилось в среднем на 6,12 см. вод. ст. по сравнению с уровнем в 27,2 см. вод.
ст.
При сравнении показателей в
различных сериях эксперимента выявлено, что выполнение только декомпрессивной
фасциотомии приводит к значительному снижению уровня внутрибрюшного давления.
Различие в полученных результатах по критерию Стьюдента статистически значимо (t=33; р < 0,001).
При анализе полученных данных
отмечено, что уровень внутрибрюшного давления у трупов в сроки от 10 до 20
часов с момента констатации смерти больше, чем у живых людей. Отмечается
зависимость между уровнем исходного внутрибрюшного давления и формой живота
(критерий Крускала-Уоллиса χ2 = 35,46, р<0,001).
При форме живота, расширяющейся вниз уровень внутрибрюшного давления выше, чем
при других формах живота. В дальнейшем, в связи с условиями проводимого
эксперимента, корреляции между уровнем внутрибрюшного давления и формой живота
выявить не удается, поскольку при повышении давления изменяется форма живота.
При нагнетании воздуха в свободную брюшную полость для создания уровня ВБД
равного 27,2 см. вод. ст. до выполнения декомпрессивной фасциотомии требуется
от 3050 до 3900 мл воздуха (такая разница в объёме вводимого воздуха,
обусловлена уровнем исходного ВБД и степенью трупного окоченения мышц передней
брюшной стенки). При рассечении апоневроза по белой линии во всех случаях
отмечено снижение ВБД. Ушивание, рассеченного по белой линии живота, апоневроза
наглухо приводит к увеличению уровня ВБД в 9,94 раза от уровня достигнутого
после рассечения апоневроза. Ушивание раны апоневроза, дополненное
декомпрессивной фасциотомией, приводит к уменьшению уровня ВБД в среднем на
11,8 см. вод. ст. (9 мм. рт. ст.) по сравнению с ушиванием раны наглухо. При
этом необходимо учитывать тот факт, что декомпрессия брюшной полости
осуществлялась только выполнением фасциотомии. При выполнении декомпрессивной
фасциотомии для создания уровня ВБД в 27,2 см. вод. ст. требовался больший
объём воздуха (4350-6800 мл). Таким образом, проведенный эксперимент
подтверждает гипотезу, что декомпрессивная фасциотомия приводит к увеличению
объёма брюшной полости и уменьшению внутрибрюшного давления.
.4 Результаты
тензиометрических исследований при восстановлении целостности передней брюшной
стенки после лапаротомии
При проведении данного этапа
экспериментального исследования оценивалась сила, воздействующая на нить,
которую необходимо приложить для сведения краев раны. Проводилось сравнение
данного показателя при ушивании апоневроза до и после выполнения
декомпрессивной фасциотомии. В соответствии с выбранной моделью эксперимента
дополнительное количество воздуха в брюшную полость не вводилось. Результаты
тензиометрии при ушивании раны до фасциотомии представлены в таблице 3.10.
Таблица 3.10. Результаты
тензиометрии при глухом ушивании раны
|
Показатели
|
Сила (Н), необходимая для сведения краев раны на шве:
|
|
Номер шва
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
М
|
9,93
|
11,45
|
9,82
|
9,43
|
10,34
|
9,11
|
|
σ
|
3,4
|
3,67
|
2,79
|
3,06
|
3,73
|
3,22
|
|
Min
|
3,724
|
4,998
|
4,214
|
4,312
|
3,234
|
3,43
|
|
Max
|
18,62
|
20,58
|
15,582
|
15,876
|
16,072
|
14,896
|
Наибольший интерес для анализа
представляли швы под номерами 1, 2, 5, так как, именно, эти швы лежат на
«опорных точках» передней брюшной стенки, т.е. в местах наибольшего
сосредоточения сухожильных волокон. Первый шов дает представление о нагрузке на
нить на участке ниже пупка (приблизительно уровень linea arcuata). Второй шов дает
представление о силе, воздействующей на нить, которую необходимо приложить для
сведения краев раны на уровне пупка. На пятом шве оценивался тот же показатель
на уровне первой сухожильной перемычки прямых мышц живота. При оценке различий
в силе, которую необходимо приложить, чтобы сопоставить края раны на разных
уровнях (швы 1,2,5 - т.е. в местах наибольшего сосредоточения сухожильных
волокон) выявлено, что место наложения шва достоверно не влияет на данный
показатель, т.е. различий в силе нет (р<0,1). Тем не менее, сопоставление
силы, которую необходимо приложить, чтобы свести края раны между швами 1,2,5 и
3,4,6 также не выявило статистически значимой разницы, что позволяет предположить,
что количество сухожильных волокон на разных участках передней брюшной стенки
существенно не влияет на данный показатель при сохраненной целостности
влагалищного апоневротического мешка (рис. 3.15.).

Рис. 3.15. Распределение
силы (Н), необходимой для сведения краев раны передней брюшной стенки до
выполнения декомпрессивной фасциотомии (М±σ).
При анализе полученных
данных отмечено, что существуют группы с высокой и низкой нагрузкой на швы.
Медиана высокой нагрузки на нить для первого шва составила 13,34 Н (ИР 9,996 -
18,62 Н), для второго шва она составила 15,15 Н (ИР 12,25 - 20,58 Н), для
пятого шва она составила 13,57 Н (ИР 11,074 - 16,072 Н). Медиана низкой
нагрузки на нить для первого шва составила 4,9 Н (ИР 3,724 - 9,722 Н), для
второго шва составила 8,7 Н (ИР 4,998 - 10,78 Н), для пятого шва составила 7,11
Н (ИР 3,234 - 9,8 Н). При этом было отмечено, что группу с высокой нагрузкой на
нить, составляли трупы с высоким ВБД (более 9,8 Н - 23 трупа). Группу с низкой
нагрузкой на швы составили трупы с низкими значениями внутрибрюшного давления
(менее 9,8 Н - 31 труп). При сопоставлении силы, необходимой для сопоставления
краев раны и уровня внутрибрюшного давления обращала на себя внимание сильная
прямая положительная связь этих показателей (коэффициент корреляции Пирсона, r=0,74, p>0.001). При
сопоставлении формы живота и нагрузки на нить не выявлено связи (коэффициент
Спирмена, r=0,02).
Следующим этапом
эксперимента выполнялась декомпрессивная фасциотомия. Рана апоневроза ушивалась
и измерялась нагрузка на швы. Результаты этого этапа эксперимента отражены в
табл. 3.11.
Таблица 3.11. Результаты
тензиометрии при декомпрессивном ушивании раны
|
Показатели
|
Сила (Н), необходимая для сведения краев раны на шве:
|
|
Номер шва
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
М
|
6,92
|
7,82
|
6,7
|
5,84
|
5,7
|
5,5
|
|
σ
|
2,58
|
2,62
|
2,0
|
2,0
|
1,9
|
2,17
|
|
Min
|
2,94
|
3,332
|
2,94
|
2,842
|
2,548
|
2,744
|
|
Max
|
13,72
|
14,896
|
11,76
|
9,898
|
9,408
|
9,8
|
Анализ данного материала позволил
оценить связь между силой, которую необходимо приложить к нити для
сопоставления краев раны и местом наложения шва при выполнении декомпрессивной
фасциотомии. Так отмечено, что нагрузка на 1,2,5 швы достоверно отличается (p>0,001) между собой; наименьшая
нагрузка приходится на пятый шов, что связано с отсечением сухожильной
перемычки от переднего листка влагалища апоневроза прямых мышц живота. Также
отмечено, что нагрузка на 1,2,5 и 3,4,6 швы достоверно отличается между собой (p>0,05), что позволяет сделать
окончательный вывод о том, что количество сухожильных волокон существенно не
влияет на силу, необходимую для сведения краев лапаротомной раны. Однако данный
факт подтверждает, что нагрузка на швы в значительной степени зависит от
целостности влагалищного апоневротического мешка прямых мышц живота (рис.
3.16.).

Рис. 3.16. Распределение
силы (Н), необходимой для сведения краев раны передней брюшной стенки после
выполнения декомпрессивной фасциотомии (М±σ)
Тем не менее, нарушение
целостности апоневротического мешка прямых мышц живота не приводит к нарушению
работы мышц брюшного пресса так, как сохраняются точки фиксации прямых мышц
живота, целостность спигелевой линии и не повреждаются нервные волокна прямой
мышцы живота.
При анализе полученных
данных также было отмечено, что существуют группы с высокой и низкой нагрузкой
на нить. Медиана высокой нагрузки на нить для первого шва составила 9,22 Н (ИР
7,056 - 13,72 Н), для второго шва она составила 10,09 Н (ИР 7,84 - 14,896 Н),
для пятого шва она составила 7,52 Н (ИР 5,88 - 9,408 Н). Медиана низкой
нагрузки на нить для первого шва составила 4,93 Н (ИР 2,94 - 6,762 Н), для
второго шва составила 5,86 Н (ИР 3,332 - 7,742 Н), для пятого шва составила
4,24 Н (ИР 2,548 -5,586 Н). В группе с меньшей нагрузкой на нить преобладали
трупы с низким внутрибрюшным давлением - 31 труп; в группе с высокой нагрузкой
на нить - трупы с высоким внутрибрюшным давлением - 23 трупа.
При оценке полученных
данных выявлено, что нагрузка на нить каждого шва при выполнении
декомпрессивной фасциотомии заметно падает (в среднем на 35,1%). Нагрузка на
первый шов снизилась на 34% (t1
=10, р>0,001). Нагрузка на второй шов снизилась на 32% (t2=11,6, p>0,001). Снижение
нагрузки на третий и четвертый швы составило 32% и 38% соответственно (t3=7,35, p>0,001; t4=7,05, p>0,001). Наибольший
интерес представляет снижение нагрузки на пятый шов на 45%, что связано с
отсечение первой сухожильной перемычки от передней стенки влагалища прямых мышц
живота (t5=8,99, p>0,001). Для шестого
шва отмечено снижение нагрузки на 40% (t6=6,64,
p>0,001), рис. 3.17.
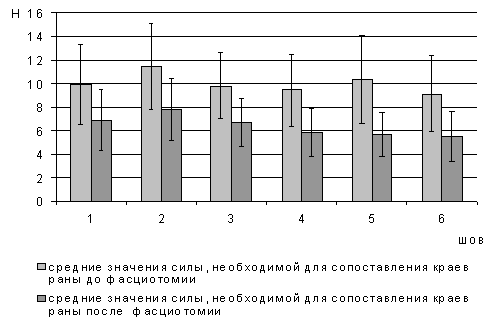
Рис. 3.17. Изменение
тензиометрических свойств лапаротомной раны при выполнении декомпрессивной
фасциотомии
По результатам
экспериментального исследования по изучению возможности уменьшения
внутрибрюшного давления путем рассечения передних листков влагалищ прямых мышц
живота были установлены следующие данные:
. При повышении
внутрибрюшного давления пропорции размеров, определяющих формы живота,
сохраняются не во всех случаях.
. Выполнение
декомпрессивной фасциотомии сопровождается увеличением поперечных размеров
передней брюшной стенки в эпигастральной области. Это приводит к увеличению
объёма брюшной полости, что подтверждается необходимостью введения в брюшную
полость большего объёма воздуха.
. Выполнение
декомпрессивной фасциотомии приводит к снижению уровня внутрибрюшного давления
при уровне в 27,2 см. вод. ст. в среднем на 6,12 см. вод. ст.
. Выполнение
декомпрессивной фасциотомии сопровождается уменьшением силы, прикладываемой к
нити, необходимой для сведения краев операционной раны в среднем на 35,1%.
. Прочностные
характеристики заднего листка влагалища прямых мышц позволяют оставлять его в
качестве единственного листка апоневроза в эпигастральной области без
существенного дефекта в функционировании брюшного пресса.
Заключение
Лечение больных с острой
кишечной непроходимостью является одной из самых сложных проблем ургентной
абдоминальной хирургии. Это обусловлено частотой этой нозологии, высокой
летальностью, составляющей 18-20%, неоднозначностью тактических решений при
лечении этой патологии. Негативно влияет на результаты лечения острой кишечной
непроходимости позднее оказание хирургической помощи этим больным, а зачастую
недостаточный объём хирургического и анестезиологического пособия.
Многокомпонентный патогенез этого заболевания является мало изученным. Одним из
аспектов данного заболевания является повышение внутрибрюшного давления. В
литературе 60-70-х годов XX
века этот фактор отождествлялся, прежде всего, с внутрикишечным давлением
(Дедерер Ю.М., 1971). По мнению Sugerman,
повышение внутрибрюшного давления имеет как местные, внутрибрюшные эффекты, так
и системные. Наиболее важным местным эффектом является нарушение внутрибрюшной
органной микроциркуляции, которое приводит к угасанию функций органов брюшной
полости. Из системных эффектов наиболее значимыми являются угнетение
макрогемодинамики, функции дыхания и мочевыделения, ликвородинамики. В
проведенных ранее исследованиях установлено, что повышение уровня ВБД свыше 15
мм. рт. ст., является показанием к декомпрессии брюшной полости (Каракозов
М.Р., 2003; Богданов А.А., 2004; Мхоян Г.Г., 2007; Balogh Z., 2003; Burch G.E., 1996; Cheatham M.L., 2000; Malbrain M.L., 2005; Sugrue M., 2005).
Одним из наиболее
значимых способов коррекции внутрибрюшной гипертензии считается
назогастроинтестинальная интубация. Тем не менее, назогастроинтестинальная
интубация при глухом ушивании раны не обеспечивает должной декомпрессии брюшной
полости. В ряде работ, посвященных лечению распространенных перитонитов,
обсуждался вопрос о коррекции повышенного ВБД путем декомпрессивного закрытия
лапаротомной раны или её открытого ведения. Однако, существующие варианты
открытого ведения раны чреваты развитием послеоперационных грыж, кишечных
свищей и не всегда приемлемы для случаев кишечной непроходимости.
Тем не менее, существуют
различные пластические приемы, благодаря которым возможно достичь и первичного
ушивания лапаротомной раны и обеспечить коррекцию уровня внутрибрюшного
давления в послеоперационном периоде.
Отсутствие
унифицированного подхода к коррекции внутрибрюшной гипертензии у больных с
кишечной непроходимостью связано с немногочисленностью проведенных исследований
по этому вопросу.
В связи с этим была
поставлена цель работы: разработать, научно обосновать, внедрить в клиническую
практику способ хирургической коррекции повышенного внутрибрюшного давления и
улучшить результаты лечения больных острой кишечной непроходимостью.
Для достижения
поставленной цели решались следующие задачи:
1. Изучить физические свойства
фасциально-апоневротических структур передней брюшной стенки.
2. На основании полученных
данных разработать способ хирургической коррекции повышенного внутрибрюшного
давления в эксперименте.
. Провести экспериментальное
обоснование коррекции повышенного внутрибрюшного давления предложенным
способом.
. Оценить результаты лечения
больных кишечной непроходимостью при сочетании кишечной и внекишечной
декомпрессии брюшной полости.
Для решения поставленных задач было
проведено экспериментальное и клиническое исследования.
Экспериментальное исследование
проведено на базе Тверского ОБСМЭ. Использованы нефиксированные человеческие
трупы (n=85) без признаков насильственной смерти. Для исследования
выбирались трупы без явных деформаций передней брюшной стенки и без
предшествующих лапаротомий. Большинство включенных в исследование трупов были
женского пола (70,5%). Возраст исследуемых был от 45 до 80 лет, 72%
исследованных были в возрасте старше 60 лет.
Данный этап исследования был основан
на проведении четырёх серий экспериментов. На 31 трупе различного пола была
разработана техника операции, которую мы обозначили как «декомпрессивная
фасциотомия». Её смысл заключался в рассечении передних листков апоневроза
влагалищ прямых мышц с отсечением первой сухожильной перемычки от него в
эпигастральной области. При этом предполагалось, что остающиеся неповрежденными
задний листок и прямые мышцы способны противостоять повышенному внутрибрюшному
давлению. В ходе исследования установлено, что растяжимость футлярообразующих
субстратов (передний и задний листки влагалища прямых мышц живота) позволяет
увеличить объем брюшной полости. Благодаря этому свойству поперечные размеры
передней брюшной стенки увеличиваются в среднем на 11%. Толщина листков
влагалищ прямых мышц живота связана с полом, возрастом, а также с
топографическим расположением исследованных образцов. Толщина переднего листка
в эпигастральной области больше, чем у заднего. У мужчин толщина переднего
листка влагалища прямых мышц живота составляет 800 мк, у женщин - 850 мк. При
этом у женщин толщина заднего листка сопоставима с толщиной апоневроза в
гипогастральной области. Прочность заднего листка влагалищ прямых мышц живота
составляет 35,9 Н и превышает таковую у апоневроза в гипогастральной области.
Таким образом, в ходе экспериментального исследования установлена возможность
выполнения декомпрессивной фасциотомии для снижения уровня внутрибрюшного
давления, а прочность заднего листка влагалища прямых мышц живота позволяют
оставлять его в качестве единственной апоневротической структуры.
Для доказательства изменения объёма
брюшной полости при повышении внутрибрюшного давления на 54 трупах обоего пола
было проведено лапарометрическое исследование. Проводилось измерение поперечных
размеров живота по 4 намеченным линиям:
1. расстояние между нижними
точками десятых ребер (размер A);
2. расстояние между
передне-верхними остями подвздошных костей (размер B);
. поперечный размер на уровне
пупка; боковые точки были размещены на передних подмышечных линиях (размер D);
. поперечный размер на
середине расстояния между размерами А и D (размер C).
Первое измерение позволило оценить
исходные размеры. С их помощью определена форма живота. Согласно условиям эксперимента
все последующие измерения проводились при уровне внутрибрюшного давления равном
27,2 см. вод. ст (20 мм. рт. ст.). В результате измерения было установлено, что
повышение внутрибрюшного давления приводит к увеличению всех линейных
поперечных размеров брюшной стенки в среднем на 11%. Повышение внутрибрюшного
давления приводит к изменению соотношения размеров передней брюшной стенки так,
что исходная форма живота сохраняется не во всех случаях. Увеличение поперечных
размеров живота при повышении внутрибрюшного давления сопровождается
пропорциональными изменениями лишь при форме живота, расширяющейся вниз. При
двух других формах соотношение размеров практически полностью изменяется;
овоидная форма живота стремиться к форме, расширяющейся вниз, а форма,
расширяющаяся вверх - к овоидной форме. Полученные данные также показали, что
эпигастральный и мезогастральный отделы передней брюшной стенки имеют меньшую
подвижность, чем гипогастральный отдел. Этот факт связан с наличием реберного
каркаса. Следующим этапом исследования была оценка изменения размеров при
декомпрессивной фасциотомии, что приводило к увеличению поперечных размеров (А
- на 36%; C - на 35%, D - на 16%) передней брюшной стенки в эпигастральной области (tA=14,8, p<0,001; tC=14,4, p<0,001; tD=6,08 p<0,001). Размер B увеличивается на 5,5% (tB=2,51, p<0,05) - в этой зоне
декомпрессивная фасциотомия не выполнялась. Эти данные позволяют говорить об
увеличении объёма брюшной полости.
Установлено, что для создания
давления в 27,2 см. вод. ст. после выполнения декомпрессивной фасциотомии
требуется объём воздуха в среднем на 2100±800 мл больше, чем в случае глухого
ушивания раны передней брюшной стенки (p<0,001). Это обстоятельство
очевидно связано с увеличением поперечных размеров на участке, где выполнялась
декомпрессивная фасциотомия, т.е. с увеличением объёма брюшной полости.
Для оценки барокомпрессивного
эффекта декомпрессивной фасциотомии проводилось четырёхкратное измерение уровня
внутрибрюшного давления: перед исследованием, после рассечение апоневроза без
рассечения брюшины, после ушивания раны передней брюшной стенки наглухо и после
ушивания раны, дополненного декомпрессивной фасциотомией. При анализе
полученных данных отмечено, что уровень внутрибрюшного давления у трупов в
сроки от 10 до 20 часов с момента констатации смерти составляет 7,12±1,95 см.
вод. ст. Отмечается зависимость между уровнем исходного внутрибрюшного давления
и формой живота (критерий Крускала-Уоллиса χ2 = 35,46, р<0,001).
При нагнетании воздуха в свободную
брюшинную полость для создания уровня ВБД равного 27,2 см. вод. ст. до
выполнения декомпрессивной фасциотомии требуется от 3050 до 3900 мл воздуха
(такая разница в объёме вводимого воздуха, обусловлена уровнем исходного ВБД и
степенью трупного окоченения мышц передней брюшной стенки). При рассечении
апоневроза во всех случаях отмечено снижение уровня ВБД до 3,31 см. вод. ст.
Ушивание, рассеченного по белой линии живота, апоневроза наглухо приводит к
увеличению уровня внутрибрюшного давления на 5,73 см. вод. ст. Ушивание раны апоневроза,
дополненное декомпрессивной фасциотомией, приводит к уменьшению уровня ВБД в
среднем на 11,8 см. вод. ст. по сравнению с давлением при ушивании раны наглухо
(декомпрессия брюшной полости в эксперименте осуществлялась только выполнением
фасциотомии). Для создания уровня ВБД в 27,2 см. вод. ст. после выполнения
декомпрессивной фасциотомии требовался больший объём воздуха (4350-6800 мл).
Таким образом, проведенный эксперимент подтвердил гипотезу о том, что
декомпрессивная фасциотомия приводит к увеличению объёма брюшной полости и
уменьшению внутрибрюшного давления.
Следующей частью экспериментального
исследования явилось изучение тензиометрических свойств раны передней брюшной
стенки при её ушивании, дополненном фасциотомией. Определено шесть стандартных
точек с интервалами между швов в 2-3 см при ушивании апоневротической раны. При
этом второй шов всегда совпадал с уровнем пупка, а пятый шов накладывался у
первой сухожильной перемычкой прямых мышц живота. Оценка данных полученных при
ушивании брюшной стенки показала, что нагрузка на нить каждого шва при
выполнении декомпрессивной фасциотомии уменьшается (в среднем на 35,1%, по
сравнению с ушиванием раны наглухо). Разница в силе, необходимой для сведения
краев раны составила: на первый шов 34% (t1 =10, р<0,001); второй шов 32% (t2=11,6, p<0,001); третий и четвертый швы - 32 и 38% соответственно (t3=7,35, p<0,001; t4=7,05, p<0,001); пятый шов - 45%, что
связано с отсечение первой сухожильной перемычки от передней стенки влагалища
прямых мышц живота (t5=8,99, p<0,001); шестой шов -40% (t6=6,64, p<0,001). Максимальное снижение силы, необходимой для сведения
краев раны на пятый шов убедительно доказывает, что фиксация переднего листка
влагалища прямых мышц живота сухожильными перемычками определяет стабильность
передней брюшной стенки.
В клинической части исследования
определялась возможность внекишечной декомпрессии брюшной полости путем
выполнения фасциотомии. Оценено влияние декомпрессии брюшной полости на
основные показатели гомеостаза организма, такие как: среднее артериальное
давление, частота сердечных сокращений, частота дыхательных движений, суточный
диурез. Проведен анализ хирургического лечения 35 больных с острой кишечной
непроходимостью на клинических базах кафедры факультетской хирургии с курсом
онкологии Тверской государственной медицинской академии. Возраст поступавших в
отделения больных был от 45 до 80 лет, из них женщины составили 64%, мужчины -
36%. Все больные были доставлены в хирургические отделения города скорой
медицинской помощью по экстренным показаниям. Для сепарации больных на группы
использована классификация кишечной непроходимости, предложенная В.П. Петровым
(1989). В соответствии с этой классификацией все выбранные больные были
отнесены к группе обтурационной кишечной непроходимости. У всех больных
кишечная непроходимость была вызвана опухолями толстой кишки (35 больных). Все
больные были подразделены на две группы: контрольная (группа А) и основная
(группа В). В контрольную группу отнесены больные, оперированные по поводу острой
кишечной непроходимости, которым выполнялись назоинтестинальная интубация и
традиционное ушивание лапаротомной раны наглухо. В основную группу отнесены
больные, оперированные по поводу острой кишечной непроходимости, которым
хирургическая лечебная программа дополнялась декомпрессивной фасциотомией.
Обязательным условием включения больного в выборку являлся уровень
дооперационного ВБД, превышающий 20 см. вод ст.
Большинство пациентов были
госпитализированы в течение первых трех суток от начала заболевания, причем в
первые сутки от начала заболевания госпитализировано всего 40% больных.
Всем больным проводился стандартный
объём диагностических процедур и предоперационной подготовки.
Объём операции зависел от тяжести
состояние и включал себя интубацию тонкой кишки, резекцию толстой кишки, либо
наложение разгрузных проксимальных колостом или обходных анастомозов.
Мониторинг ВБД в послеоперационном
периоде дал возможность оценить динамику его уровня в представленных группах
больных. Было установлено, что ушивание лапаротомной раны приводит к увеличению
внутрибрюшного давления в первые 24 часа выше исходного на 28-33% (вторая
степень по Burch) вне зависимости от способа декомпрессии. В контрольной группе
(группа А) такой уровень давления сохранялся в течение ещё 3 суток с
последующим постепенным снижением и нормализацией к седьмым суткам после
операции. В основной группе (группа В) снижение уровня ВБД до нормальных
значений отмечено к четвертым суткам послеоперационного периода. Доказано, что
увеличение подвижности передней брюшной стенки при фасциотомии способствует не
только быстрому снижению ВБД, но и более быстрой нормализации этого показателя
(в среднем на 72 часа). Данные факт однозначно указывает на то, что только лишь
назоинтестинальная интубация при кишечной непроходимости обтурационного генеза
неспособна обеспечить должной декомпрессии брюшной полости. В частности,
суммарный градиент давления в контрольной группе был в 1,5 раза выше, чем в
основной группе (25,24 см. вод. ст. в группе А и 17,27 см. вод. ст. в группе
В). При временнóй оценке различий в уровне ВБД в представленных группах выявлена
статистически значимая разница в величинах показателя (p<0,001). Нормализация уровня
внутрибрюшного давления способствовала восстановлению микроциркуляции органов
брюшной полости. Характерным признаком восстановления кровотока в кишечной
стенке мы считаем нормализацию пассажа содержимого желудочно-кишечного тракта.
Это проявлялось уменьшением кишечного отделяемого по назоинтестинальному зонду.
В основной группе зонд удалялся на третьи сутки в связи уменьшением отделяемого
до 500±110 мл/сутки, тогда как в контрольной группе до пятых суток отделяемое
по зонду составляло в среднем 1500±280 мл/сутки.
Состояние гемодинамики в
послеоперационном периоде характеризовалось артериальной гипотензией в течение
72 часов в контрольной и 48 часов в основной группах. Восстановление нормальной
органной перфузии доказывалось нормализацией среднего артериального давления (в
группе В давление достигает значения в 90 мм. рт. ст. раньше на 48 часов, чем в
группе А (критерий Крускала-Уоллиса составляет χ2 = 22,1, р<0,001)).
Нормализация центральной гемодинамики определяет быстрое восстановление
адекватного суточного диуреза. В основной группе самостоятельный
нестимулированный диурез за вторые стуки после операции составил 1,5 литра
против 0,5 литра в контрольной группе.
Была обнаружена связь между уровнем
внутрибрюшного давления и средним артериальным давлением в динамике. Отмечено,
что по мере уменьшения внутрибрюшного давления увеличивается среднее
артериальное давление (r=-0.93, p<0.001). Также выявлено, что по мере уменьшения внутрибрюшного
давления снижается частота сердечных сокращений и частота дыхательных движений,
т.е. нивелируются системные эффекты повышенного внутрибрюшного давления. Изучение
состояния вегетативной нервной системы показало, коррекция ВБД сопровождается
снижением тонуса симпатической нервной системы. Разница в сроках восстановления
данных показателей в основной и контрольной группах статистически значима (p<0.05).
Исходя из выше представленных
данных, можно утверждать, что коррекция внутрибрюшного давления является
перспективным направлением в лечении больных с острой обтурационной кишечной
непроходимостью с уровнем ВБД выше 20 см. вод. ст., причем лучший эффект
достигается сочетанием кишечной и внекишечной декомпрессии брюшной полости.
Выводы
1. Изучение физических свойств ФАС
передней брюшной стенки показало, что прочность и растяжимость переднего и
заднего листков влагалища прямых мышц живота в эпигастральной области могут
обеспечить полноценное функционирование брюшной стенки при нарушении
целостности одного из этих образований.
2. Экспериментально разработанный
способ декомпрессии брюшной полости предполагает рассечение переднего листка
влагалища прямых мышц живота с отсечением от них первых сухожильных перемычек.
3. Рассечение передних листков
влагалища прямых мышц живота в условиях повышенного ВБД увеличивает линейные
размеры передней брюшной стенки на 30%, объём брюшной полости от 2 до 4 литров,
обеспечивает снижение уровня ВБД на 22,5% и уменьшает нагрузку на швы,
накладываемые на апоневроз на 35%.
4. Декомпрессивная фасциотомия
способствует интегрированному восстановлению функций организма, прежде всего за
счет стабилизации органной перфузии.
Практические рекомендации
1. Больным
обтурационной кишечной непроходимостью на этапе дооперационного обследования
показано измерение внутрибрюшного давления с целью диагностики его повышения.
Это позволить в дальнейшем проводить коррекцию лечебной программы.
2. Увеличение внутрибрюшного
давления свыше 20 см. вод. ст. в сочетании с другими симптомами ОКН может
являться одним из показаний к операции.
3. При уровне
внутрибрюшного давления более 20 см. вод. ст. для дополнительной декомпрессии
брюшной полости, кроме назоинтестинальной интубации, требуется коррекция объёма
брюшной полости. Один из способов такой коррекции - рассечение передних листков
влагалища прямых мышц живота.
4. Оценка
разницы между средним артериальным и внутрибрюшным давлениями в
послеоперационном периоде позволяет оценить уровень органной перфузии и
корректировать объём инфузионной терапии. При уменьшении разницы между средним
артериальным давлением и внутрибрюшным давлением необходимо увеличивать объём
инфузионной терапии.
5. Оценка формы
живота может позволить прогнозировать развитие и особенность течения
интраабдоминальной гипертензии у больных с острой кишечной непроходимостью. У
больных с формой живота, расширяющейся вниз интраабдоминальная гипертензия
всегда будет протекать тяжелее, т.к. объём брюшной полости при этой форме
изменяется в меньшей степени.
Список литературы
брюшной кишечный
непроходимость хирургический
1. Абакумов, М.М. Значение синдрома высокого
внутрибрюшного давления в хирургической практике (обзор литературы)/ М.М.
Абакумов, А.Н. Смоляр // Хирургия. -2003. - №12. - С. 66-72
2. Абдулжалилов, М.Н. Пути повышения эффективности
назоинтестинального дренирования у больных с острой кишечной непроходимостью и
перитонитом/ М.Н. Абдулжалилов // Хирургия, 2003. - №4. - С. 39-41.
. Александров, Н.Н. Неотложная хирургия при раке толстой
кишки / Н.Н. Александров [и др.]. Минск: Беларусь, 1980. - 303 с.
. Алиев, С.А. Спорные и нерешенные вопросы хирургической
тактики при перфорации толстой кишки/ С.А. Алиев // Вестник хирургии, 2001. -
№4. - С. 44-48.
. Алиев, С.А. Первично-радикальные оперативные
вмешательства при острой непроходимости ободочной кишки опухолевого генеза у
больных пожилого и старческого возраста // С.А. Алиев // Хирургия, 2001. - №8.
- С. 44-50.
. Алиев, С.А. Современные тенденции и перспективы в
хирургическом лечении опухолевой непроходимости ободочной кишки у больных
старших возрастных групп/ С.А. Алиев // Рос. онкол. журн. - 2005. - №4. - С.
21-29.
. Аликов, А.А. Хирургическая тактика при кишечной
непроходимости опухолевой этиологии у пожилых больных: автореф. дис. … канд.
мед. наук. - Ростов-на-Дону, 1998. - 22 с.
. Артемьев, В.Н. О возрастных особенностях
соединительнотканных структур передней брюшной стенки человека/ В.Н. Артемьев
// Вопросы морфологии соединительной ткани. - Омск, 1975. -148 с.
. Артемьев, В.Н. Развитие и морфохимические особенности
соединительнотканных образований передней брюшной стенки: Автореф. дис. … канд.
мед. наук/В.Н. Артемьев. - Омск, 1975. -21 с.
. Артемьев, В.Н. Сравнительная характеристика возрастных изменений
некоторых соединительнотканных образований тела человека/ В.Н. Артемьев, Б.А.
Путинцев // Эпителий и соединительная ткань в нормальных, экспериментальных и
патологических условиях: Тезисы конференции морфологов Сибири. - Тюмень, 1983.
- С. 3-5.
. Ассиметрия передней брюшной стенки /Н.С. Горбунов [и др.]
// - Красноярск: Из-во КрасГМА, 2006. -131 с.
. Бактериальная транслокация в условиях острой
непроходимости кишечника / В.К. Гостищев [и др.] // Вестник РАМН, 2006. -
№9-10. - С. 34-38.
. Белоконев, В.И. Использование герниологических приемов
пластики передней брюшной стенки для профилактики абдоминального
компартмент-синдрома у больных с острой хирургической патологией / В.И.
Белоконев, Л.Б. Гинзбург, Ю.А. Вострецов // Альманах Института хирургии им.
А.В. Вишневского, 2008. - Т.3, №2. - С. 132.
. Белый, В.Я. Патофизиологические аспекты и пути
патогенетической терапии острого разлитого перитонита: автореф. дис. … д-ра
мед. наук. - Л., 1987. -24 с.
. Бикмуллин, Р.А. Биомеханические аспекты структуры передней
стенки полости живота/ Р.А. Бикмуллин, А.Г. Габбасов // Морфология. -1998. -
№3. - с. 24-25.
. Биленко, М.В. Ишемические и реперфузионные повреждения
органов / М.В. Биленко. - М.:Медицина, 1989. - 368 с.
. Биомедицинское материаловедение / С.П. Вихров [и др.]. -
М.: «Горячая линия - Телеком», 2006. - 384 с.
. Брискин, Б.С. Обтурационная непроходимость при раке
ободочной кишки // Б.С. Брискин, Г.М. Смаков // Хирургия, 1999. - №5. - С.
37-40.
. Бузунов, А.Ф. Лапаростомия/ А.Ф. Бузунов. - М.
Практическая медицина, 2008. -202 с.
. Бунак, В.В. Антропометрия/ В.В. Бунак. - М. Наркомпрос.
СССР, 1941. -368 с.
. Вагапова, В.Ш. К вопросу о структуре апоневрозов широких
мышц живота человека/ В.Ш. Вагапова // Научно-методологические вопросы изучения
мягкого остова: Материалы симпозиума. - Горький, 1970. - С. 108-109.
. Влияние тяжести полиорганной недостаточности на тактику,
объём и результаты лечения обтурационной опухолевой толстокишечной
непроходимости/ А.В. Пугаев и [и др.] // Рос. онкол. жур. - 2003. - №6. - С.
20-27.
. Внутрибрюшное давление при острой непроходимости толстой
кишки / В.М. Тимербулатов [и др.] // Анналы хирургии, 2008. - №5. - С. 36-39.
. Воскресенский, Н.В. Хирургия грыж брюшной стенки / Н.В.
Воскресенский, С.Л. Горелик. - М.: Медицина, 1965. - 231 с.
. Выбор объёма оперативного вмешательства при обтурационной
непроходимости ободочной кишки /Г.В. Пахомова [и др.]. // Хирургия. - 2003. -
№6. - С. 55-59.
. Гаин, Ю.М. Синдром энтеральной недостаточности при
перитоните: теоретические и практические аспекты, диагностика и лечение / Ю.М.
Гаин, С.И. Леонович, С.А. Алексеев. - Молодечно: Победа, 2001. -265 с.
. Гаин, Ю.М. Синдром абдоминальной компрессии / Ю.М. Гаин,
С.А. Алексеев, В.Г. Богдан // Белорус. мед. журн. - 2004. - №3. - С. 31-37.
. Гауенс, Я.К. Трансназальный декомпрессионный зонд и
медикаментозная стимуляция моторики кишечника в лечении аппендикулярного
перитонита у детей раннего возраста / Я.К. Гауенс, А.М. Эпгелис, М.М. Веверис
// Вестник хирургии. -1986. - Т.137, №9. - С. 107-109.
. Гешелин, С.А. Неотложная онкохирургия / С.А. Гешелин.
Киев: «Здоров`я», 1998. - С. 91-96.
. Горбунов, Н.С. Морфофункциональные закономерности
взаимоотношения передней брюшной стенки и внутренних органов: автореф. дис…док.
мед. наук/Н.С. Горбунов. - Новосибирск, 1999. - 42 с.
. Горбунов, Н.С. Лапаротомии и послойное строение передней
брюшной стенки/ Н.С. Горбунов, И.В. Киргизов, П.А. Самотесов. - Красноярск,
[б.и.], 2002. -99 с.
. Горбунов, Н.С. Соединительнотканный остов передней
брюшной стенки/ Н.С. Горбунов, В.И. Чикун, А.В. Илларионова. - Красноярск,
[б.и.], 2003. -88 с.
. Губайдуллин, Р.Р. Интраоперационная оптимизация
биомеханики дыхания у больных с кишечной непроходимостью/ Р.Р. Губайдуллин,
В.В. Бутров // Анестезиолю иреаниматол., 2004. - №2. - С. 17-19.
. Губайдуллин, Р.Р. Нарушения в системе транспорта кислорода
и пути их коррекции у больных с внутрибрюшной гипертензией в периоперационном
периоде: автореф. дис. … д-ра мед. наук. - Москва, 2005. -47 с.
. Гузеев, А.И. Интубация тонкой кишки в неотложной
абдоминальной хирургии / А.И. Гузеев // Вестн. хирургии. - 2002. - №2. - С.
92-95.
. Дедерер, Ю.М. Патогенез и лечение острой непроходимости
кишечника/ Ю.М. Дедерер. - М.:Медицина, 1971. -270 с.
. Демидов, Г.И. Выбор способа декомпрессии кишечника для
профилактики и лечения послеоперационной кишечной непроходимости/ Г.И. Демидов,
А.Ю. Сапожков, Н.И. Гончаренко, В.И. Никольский // Вестник хирургии, 1984. - Т
132. - №2. - С. 39-42.
. Длительная декомпрессия кишечника при остром перитоните и
кишечной непроходимости / Л.А. Любенко и [и др.] // Клинич. хирургия, 1987. -
№4. - С. 30-32.
. Долишний, В.Н. Внутрибрюшное давление при острой
тонкокишечной непроходимости/ В.Н. Долишний, М.Ю. Шигаев // Вестник хирургии.
-2007. - Т.166, №3. - С. 26-28.
. Ерюхин, И.А. Декомпрессия тонкой кишки при острой
непроходимости кишечника/ И.А. Ерюхин, П.Н. Зубарев, Н.В. Рухляда // Вест.
хирургии, 1988. - Т.141, №11. - С. 15-20.
. Ерюхин, И.А. Кишечная непроходимость/ И.А. Ерюхин, В.П.
Петров, М.Д. Ханевич. - С.-Пб.: Питер., 1999. - 448 с.
. Женский живот (формы, размеры, изменчивость)/ Н.С.
Горбунов [и др.]. - Красноярск: Из-во КрасГМА, 2004. -125 с.
. Жижин, Ф.С. Гемодинамика тонкой кишки при повышении
внутрипросветного давления /Ф.С. Жижин // Интраорганная гемодинамика
пищеварительной и выделительной систем. - Горький: ГМИ, 1985. - С. 48-53.
. Жуков, В.М. Возрастные и половые особенности топографии
передней брюшной стенки: автореф. дис…канд. мед. наук/В.М. Жуков. - Воронеж,
1972. - 20 с.
. Жуков, В.М. Топография безмышечных участков передней
брюшной стенки у людей разного возраста/ В.М. Жуков // Материалы 2 Всесоюзного
симпозиума. - Горький, 1973. - С. 86-88.
. Заричавский, М.Ф. Большие и гигансткие послеоперационные
вентральные грыжи/ М.Ф. Заричавский, В.Ф. Яговкин. Пермь, [б.и.], 1996. -142 с.
. Золотко, Ю.Л. Атлас топографической анатомии человека. М.
Медицина, 1967. -272 с.
. Зюбрицкий, Н.М. Применение декомпрессии кишечника при его
непроходимости / Н.М. Зюбрицкий, В.В. Слабинский // Клинич. хирургия, 1991. -
№2. - С. 24-26.
. Иммуно-микробиологическая характеристика тонкой кишки и
транслокация энтеральной микрофлоры при острой кишечной непроходимости / В.Н.
Чернов [и др.] // Журн. микробиол., 1999. - №4. - С. 70-74.
. Когут, Б.М. Ультразвуковая морфометрия передней брюшной
стенки человека/ Б.М. Когут, Г.Ю. Синагурский // Тезисы докладов 3 съезда
Российской ассоциации врачей ультразвуковой диагностики в перинатологии и
гинекологии. Ультразвуковая диагностика. - М., 1996. - №3. - С. 56.
. Комаров, Н.В. Лапаростомия в лечении перитонита./Н.В.
Комаров, А.С. Маслагин. Н. Новгород: Из-во НГМА, 1996. - 52 с.
. Краснопеева, Г.А. Постмортальная изменчивость живота и
передней брюшной стенки у мужчин при судебно-медицинской экспертизе: Автореф.
дис…канд. мед. наук/ Г.А. Краснопеева. - Красноярск, 2005. -28 с.
. Кузнецов, А.Н. Морфологические изменения в легких при
острой кишечной непроходимости /А.Н. Кузнецов, В.Е. Милюков // Социальные
аспекты хирургической помощи населению в современной России: материалы
Всероссийской науч. конф. (Успенские чтения, выпуск 5). - Тверь, 2008. - С.
143.
. Кузнецов, А.Н. Поражение легких при острой кишечной
непроходимости, осложненной перитонитом / А.Н. Кузнецов, В.Е. Милюков //
Социальные аспекты хирургической помощи населению в современной России:
материалы Всероссийской науч. конф. (Успенские чтения, выпуск 5). - Тверь,
2008. - С. 144.
. Курыгин, А.А. Дренирование тонкой кишки и интестинальная
терапия при перитоните и кишечной непроходимости / А.А. Курыгин, М.Д. Ханевич.
С.-Пб.: [б.и.], 1992. - 71 с.
. Куцык, Ю.Б. Дренирование кишечника при острой кишечной
непроходимости // Ю.Б. Куцык // Анналы хир. гепатол., 1998. - Т.3, №3. - С.
349.
. Лаврова, Т.Ф. Клиническая анатомия и грыжи передней
брюшной стенки/Т.Ф. Лаврова. - М. Медицина, 1979. -104 с.
. Лапарометрическая характеристика симптомов/ Н.С. Горбунов
[и др.]. - Красноярск, [б.и.], 2001. -257 с.
. Лебедев, А.Г. Желудочно-кишечная интубация в лечении
тонкокишечной непроходимости / А.Г. Лебедев, Г.В. Пахомова, Н.С. Утешев //
Врач. -2004. - №6. - С. 41-43.
. Лебзак, К.Ф. Внутрикишечная гипертензия и интрамуральный
кровоток при паралитических состояниях желудочно-кишечного тракта и влияние
декомпрессии на течение перитонита: автореф. дис. … канд. мед. наук. -
Новосибирски, 1980. -20 с.
. Лечение обтурационной кишечной непроходимости
обусловленной раком ободочной кишки Т 3-4/А.В. Пугаев [и др.] // Рос. онкол.
журн., 1999. - №6. - С. 25-30.
. Лечение опухолевой толстокишечной непроходимости /М.Д.
Ханевич [и др.] // Вестн. хирургии, 2005. - Т.164, №1. - С. 85-89.
. Макаров, А.К. Изменчивость структур передней брюшной
стенки у людей с различной формой живота/А.К. Макаров, Н.С. Горбунов //
Морфологические науки - практической медицине и биологии: Тез. докл. респ.
науч. конф. - Омск, 1986. - с 61-62.
. Макаров, А.К. Структурная зависимость элементов передней
брюшной стенки от внутрибрюшного давления/ А.К. Макаров, Н.С. Горбунов //
Молодые ученые Красноярья - практическому здравоохранению: Тез.краев. науч.
конф. молодых ученых. - Красноярск, 1984. - С. 1.
. Макарова, Н.П. Роль состояния престенотических отделов
ободочной кишки в выборе хирургической тактики у больных с опухолевой
обтурационной кишечной непроходимостью / Н.П. Макарова, Б.С. Троицкий, Н.Г.
Пескова // Рос. онкол. журн., 2000. - №2. - С. 46-48.
. Макарова, Н.П. Выбор хирургической тактики при
обтурационной толстокишечной непроходимости / Н.П. Макарова, Б.С. Троицкий,
Е.Г. Быков // Хирургия. -2000. - №8. - С. 45-48.
. Мартынюк, В.В. Рак толстой кишки: Заболеваемость,
смертность, факторы риска, скрининг // Практическая онкология /под ред. С.А.
Тюляндина, В.М. Моисеенко. С.-Пб.:Центр ТОММ, 2004. - №1. - С. 151-161.
. Мишанин, М.Н. Изменчивость форм живота и размеров
передней брюшной стенки у мужчин: Автореф. дис…канд. мед. наук/М.Н. Мишанин. -
Красноярск, 2001. -35 с.
. Милюков, В.Е. Патогенез метаболических нарушений при динамической
кишечной непроходимости (обзор литературы)/ В.Е. Милюков, М.Р. Сапин // Рос.
журн. гастроэнтерол., гепатол., колопроктол. - 2006. - Т. 16, №6. - С. 70-72.
. Мониторинг внутрибрюшного давления в комплексной оценке
тяжести текущего перитонита/ А.П. Чадаев [и др.] // Хирургия. - 1993. - №12. -
С. 91-92.
. Морфологическая картина тонкого кишечника при острой
кишечной непроходимости/ М.А. Затолокина и [и др.] // Рос. журн. гастроэнтерол,
гепатол, колопроктол., 2008. - Т.28, №5. - Приложение №32. - С. 48.
. Морфофункциональная оценка тонкой кишки при механической
непроходимости кишечника / Ю.М. Галеев и [и др.] // Рос. журн. гастроэнтерол,
гепатол, колопроктол., 2008. - Т.28, №5. - С. 45-53.
. Морфофункцинальные нарушения в тонкой кишке при острой
обтурационной кишечной непроходимости / Г.П. Титова [и др.] // Архив патол.,
1999. - Т.61, №2. - С. 27-30.
. Мхоян, Г.Г. Интенсивная терапия и анестезиологическое
обеспечение при внутрибрюшной гипертензии / Г.Г. Мхоян, Р.В. Акопян, А.К.
Оганесян // Анестезиол. и реаниматол. - 2007. - №5. - С. 40-46.
. Нечаев, Э.А. Дренирование тонкой кишки при перитоните и
кишечной непроходимости / Э.А. Нечаев, А.А. Курыгин, М.Д. Ханевич // С.-Пб.
[б.и], 1993. - 238 с.
. Никольский, В.И. Непроходимость кишечника при
внутрибрюшных абсцессах / В.И. Никольский, А.Ю. Сапожков // Тезисы V съезда хирургов Средней Азии и
Казахстана. - Ташкент, 1991. - Ч. 1. - С. 192-194.
. Никольский, В.И. Абсцессы живота. /В.И. Никольский, А.Ю.
Сапожков. - Пенза, 1994. - 204 с.
. Нифантьев, О.Е. Механическая кишечная непроходимость
/О.Е. Нифантьев. Красноярск: Из-во Краснояр. Ун-та, 1989. -208 с.
. Острая опухолевая непроходимость ободочной кишки у
больных пожилого и старческого возраста /А.П. Михайлов и [и др.] // Вестн.
хирургии, 2003. - Т.162, №6. - С. 25-28.
. Патогенез острой кишечной непроходимости / В.И. Русаков
[и др.] // Хирургия. - 1982. - №10. - С. 5-9.
. Пахомова, Г.В. Хирургическое лечение обтурационной
непроходимости ободочной кишки: автореф. дис. … д-ра мед. наук. - Москва, 1987.
- 36 с.
. Пахомова, Г.В. Совершенствование методов лечения
обтурационной непроходимости ободочной кишки / Г.В. Пахомова, Т.Г. Подловченко
// Скорая мед. помощь. - 2004. - Т.5, №3. - С 115-116.
. Попова, Т.С. Синдром кишечной недостаточности / Т.С.
Попова, Т.Ш. Тамазашвили, А.Е. Шестопалов. - М. Медицина, 1991. -240 с.
. Портальная и системная бактериемия как проявление
функциональной несостоятельности энтерального барьера при острой непроходимости
кишечника/ В.Н. Чернов и [и др.] // Вестник хирургии. - 1998. - Т.157, №4. - С.
46-49.