Экстракция америция и европия тетраоктил дигликольамидом во фторированных полярных разбавителях
Экстракция америция и
европия тетраоктил дигликольамидом во фторированных полярных разбавителях
Введение
Интенсивное развитие ядерной энергетики привело к накоплению
жидких и твердых радиоактивных отходов, представляющих серьёзную опасность для
окружающей среды. Уменьшить количество радиоактивных отходов возможно,
совершенствуя технологии переработки ядерного горючего, в частности, уменьшая
объём подлежащих захоронению и утилизации уже имеющихся отходов. Основным
способом переработки отходов ядерного топлива является жидкостная экстракция.
При переработке ядерного топлива образуются отходы как
высокой, так и средней активности, содержащие долгоживущие радионуклиды (90Sr,
137Cs и актиниды). Наибольшую опасность представляют долгоживущие b/g-излучатели и a-излучатели -
трансурановые элементы. Необходимо решать проблему хранения этих радионуклидов.
Большую часть растворов с высоким содержанием в них солей
долгоживущих нуклидов можно обработать, а затем отделить низкоактивные отходы,
чтобы их можно было захоронить в поверхностном хранилище, а продукты
высокоактивных долгоживущих нуклидов разместить в геологических формациях или в
долговременном хранилище. Эти высокоактивные отходы (ВАО) занимают лишь
несколько процентов от общего объёма, и после их экстракции появляется
возможность захоронить эту малую долю в хранилищах, отвечающих требованиям по
хранению ВАО.
Возможны два альтернативных способа переработки отработанного
топлива:
1.
Неразделенная
смесь долгоживущих радионуклидов остекловывается, и полученные стеклоблоки
направляются на временно контролируемое хранение в специальное хранилище. Срок
выдерживания таких отходов - 50 - 100 лет - для обеспечения разрушения
радионуклидов 137Cs и 90Sr.
В этом случае неизбежно выявляется ряд недостатков: большой
объем материала, остекловывающегося вместе с радионуклидами, повышает затраты
как на стадии варки стекла, так и при хранении отходов. Кроме того, целый ряд
макрокомпонентов (как-то кристаллизующиеся в отдельную фазу при остекловывании
благородные металлы) оказывает вредное влияние на качество получаемого стекла.
2.
Альтернативным
способом является выделение долгоживущих радионуклидов из общей массы и
концентрирование их в малых объемах растворов, подлежащих остекловыванию и
дальнейшему хранению. Оставшаяся после выделения радионуклидов балластная масса
отходов направляется на отверждение для последующего приповерхностного хранения
в виде низкоактивных отходов.
Были начаты исследования по извлечению актинидов и
долгоживущих продуктов деления из кислых растворов, остающихся после
растворения отработанного топлива. В дальнейшем актиниды (америций, кюрий) и
продукты деления, такие как 135Cs, предполагается подвергать
процессу трансмутации или капсулировать в специальные матрицы.
Для выделения актинидов уже было предложено несколько
процессов, основанных на различных экстрагентах. А именно:
1.
TRUEX-процесс,
в котором в качестве экстрагента используется октил - (фенил) - N,
N-диизобутилкарбамоилметилфосфиноксид (CMPO),
2.
DIAMEX-процесс, использующий
N, N, N', N'-диметилдибутилтетрадецилмалонамид (DMDBTDMA),
3.
DIDPA-процесс,
использующий диизодецилфосфорную кислоту,
4.
TRPO-процесс,
основанный на применении в качестве экстрагента триалкилфосфиноксида [1 - 5].
Все эти процессы, проходившие тестирование как на модельных,
так и на реальных ВАО, тем не менее, имеют ряд недостатков. В частности,
таковыми для TRUEX-процесса являются недостаточная реэкстракция америция и
кюрия при сниженной кислотности и образование побочных продуктов, вызванное
разложением экстрагента. DIDPA-процесс, в свою очередь, не применим к
концентрированным ВАО без предварительной денитрации, которая приводит к
осаждению актинидов. Недостаток TRPO-процесса - в его невозможности применения
в интервалах кислотности 3 - 4 М HNO3, обычно встречающейся в
растворах ВАО. Полностью сжигаемый DMDBTDMA, хоть и рассматривался как
перспективный вариант, всё же является слабым экстрагентом по отношению к
америцию и кюрию в интервалах кислотности меньше 3 М HNO3 [3].
Таким образом, для того чтобы минимизировать объем отхода,
нужны соединения, способные эффективно и избирательно удалить нуклиды из кислой
и / или сильно засоленной среды. Фосфорорганические соединения, применяющиеся в
настоящее время в экстракционных процессах, имеют ряд серьезных недостатков, в
частности, невысокую селективность и недостаточную радиационную устойчивость. В
связи с этим актуален поиск более эффективных катионсвязывающих соединений.
Помимо всего прочего, немаловажен и тот факт, что в понятие
промышленного экстрагента входит не только само вещество, используемое для
выделения радионуклидов, но и разбавитель, применяемый для приготовления
растворов, необходимых для проведения процесса экстракции катионов из кислых и
сильно засоленных сред. Поэтому также необходимо и развитие исследований в
области поиска наиболее эффективных разбавителей для экстрагентов.
1. Аналитический обзор
.1 Моно- и диамиды как перспективные экстрагенты
радионуклидов
диамид экстрагент радионуклид европий
Для минимизации вторичных отходов, возникающих в процессе
переработки радиоактивных отходов, была разработана CHON-концепция, принятая во
Франции. Данная концепция предусматривает использование в качестве разбавителя
и экстрагента полностью сжигаемые вещества, состоящие только из углерода (C),
водорода (H), кислорода (O) и азота (N). В соответствии с СНON-концепцией в
европейских странах и в Японии в качестве растворителей в экстракционных
процессах используются керосин, додекан, гидрированный тетрапропилен.
Одним из классов веществ, исследуемых на возможность
применения в качестве экстрагентов для извлечения актинидов, являются амиды.
Продукты радиолитического разложения амидов в большинстве своем - это амины и
карбоновые кислоты, которые не влияют на экстракционный процесс и могут быть
просто удалены (вымыты) из экстрагента щелочной или кислотной промывкой.
Отработанные экстрагенты можно полностью сжечь и тем самым уменьшить объем
вторичных отходов.
1.1.1 Моноамиды
Известно, что моноамиды, которые разрабатывались как
альтернатива трибутилфосфату (ТБФ), хорошо экстрагируют четырехвалентные и
шестивалентные актиниды [6 - 9]. В качестве растворителей амидов обычно
используется n-додекан или ксилол.
Работы по исследованию радиационной устойчивости моноамидов
показали, что наибольшей радиационной устойчивостью обладают симметричные
моноамиды. Разветвление в алкильных группах, связанных с амидным атомом
моноамида, в сравнении с линейными алкильными группами, уменьшает радиационную
деградацию. Устойчивость к радиации среди амидов уменьшается в ряду: симметричные
моноамиды > несимметричные моноамиды > диамиды [10, 11].
1.1.2 Диамиды
Различные диамиды дикарбоновых кислот также активно изучаются
в последнее время как потенциальные экстрагенты для извлечения актинидов и
лантанидов из ВАО. Диамиды наряду с четырехвалентными и шестивалентными
актинидами [12, 13] экстрагируют и трехвалентные актиниды, и лантаниды [14,
15].
Лучше всего изучены диамиды малоновой и дигликолевой кислот,
для которых были разработаны технологические процессы переработки ВАО, поэтому
они будут рассмотрены более подробно ниже. Наравне с указанными диамидами в
последнее время возник интерес к диамидам дипиколиновой кислоты, как к
перспективным экстрагентам для извлечения РЗЭ.
1.2 Диамиды малоновой кислоты (малонамиды)
Малонамиды - вещества общей формулы, представленной на
рисунке 1, где R, R’ = Alk, R»= Alk или H.
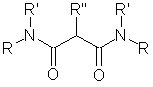
Рисунок 1 - Общая формула малонамидов
Химические свойства малонамидов зависят от их строения, а
именно - от природы заместителей у атомов азота и центрального атома углерода.
Так, малонамиды, замещенные по центральному атому углерода длинными алкильными
группами, а также окси-алкильными группами, обладают наилучшими экстракционными
свойствами (по сравнению с незамещенными) [1].
Тип заместителя у атома азота также имеет большое значение.
Наилучшими экстракционными свойствами обладают малонамиды с несимметричными
алкильными заместителями, а наличие фенильных заместителей у атома азота
повышает экстракционные свойства экстрагента [2].
Малонамиды извлекают актиниды и лантаниды из растворов
азотной кислоты [4]. При этом их экстракционная способность различна и
ограничена образованием третьей фазы, которое стимулируется повышением
основности молекулы и снижением длины алкильной цепочки заместителя R или R'.
Образования третьей фазы можно избежать путем добавления
моноамидов. При добавлении ди-2-этилгексилацетамида в качестве модифицирующего
компонента малонамида третья фаза образуется при более высокой концентрации
кислоты, чем при экстракции малонамидом без модификатора [5].
Малондиамиды экстрагируют РЗЭ по сольватному механизму:
Me3+aq + 3 NO3-aq
+ nLorg = Me (NO3)3·Ln org (1)
где Ме - РЗЭ (или америций, кюрий), L - лиганд (малондиамид).
Экстракционная способность малонамидов с различными
алкильными заместителями по отношению к актинидам и лантанидам убывает в ряду:
U (VI) > Nd (III) > La (III) > Am (III) > Eu (III). Состав основных
экстрагируемых частиц образуемых в кислой среде имеет вид: Nd(NO3)3·3L,
Eu(NO3)3·2L, UO2(NO3)2·2L,
Am(NO3)3·3L, где L - малонамид [1, 16].
Тип растворителя оказывает существенное влияние на
экстракционную способность любой системы. Проведенные исследования показали,
что экстракционная способность DMDBTDMA по отношению к Am уменьшается в ряду:
нитробензол > n-додекан > n-гексан > 1,2 - дихлорэтан > декалин
> циклогексан > диэтилбензол > толуол [17].
Как и моноамиды, диамиды экстрагируют кислоту в различных
формах [18]. Экстракция кислот объясняется конкурирующим образованием
следующих аддуктов: L2•HNO3, L•HNO3, L•(HNO3)2,
L•(HNO3)3 - для азотной кислоты, и L2•HClO4
и L•HClO4 - для хлорной. В случае образования L2•HNO3
и L•HNO3, малонамид и HNO3 связаны водородными связями,
тогда как в случае образования L•(HNO3)2, L•(HNO3)3
и L•HClO4, один H+ переносится от одной молекулы кислоты
на одну из C=O групп малонамида. Различное поведение хлорной и азотной кислот
может быть объяснено различием силы кислоты: HClO4 является более
сильной кислотой, по сравнению с HNO3. Перенос протона с азотной
кислоты на диамид зависит от диэлектрической константы органического
растворителя, при этом ее высокие значения наиболее благоприятны для
образования ионных пар.
Разработанный в конце 80-х годов французскими учеными
DIAMEX-процесс использует в качестве экстрагента малонамиды. В этой
технологической схеме актиниды и РЗЭ экстрагируются из растворов, содержащих 3
- 5 моль/л HNO3 растворами диметилдибутилтетрадецил-малонамида или
других алкилмалонамидов в додекане. DMDBTDMA был выбран в качестве основного
экстрагента благодаря его высокой растворимости в промышленном растворителе
(гидрированный тетрапропилен) и низкой склонности к образованию третьей фазы
при экстракции из растворов различного состава [19].
Для исследования возможностей данного процесса был проведен
ряд тестов на реальных отходах и модельных растворах [20].
«Горячий» статический тест, проведенный на реальном ВАО (3,5
моль/л HNO3) показал, что экстрагент состава 0,5 моль/л DMDBTDMA в
гидрированном тетрапропилене успешно извлекает за один контакт ~75% лантанидов
и актинидов.
В результате проведения динамического теста на модельном
растворе было достигнуто практически полное извлечение (99%) для La, Ce, Nd, Eu
и Pd [19].
.3 Дигликольамиды как экстрагенты
Дигликольамиды (рисунок 2) - это тридентатные экстрагенты,
предложенные для переработки высокоактивных отходов. Помимо своей способности
экстрагировать щелочноземельные металлы и РЗЭ [21, 22] дигликольамиды
обладают высокой экстракционной способностью по отношению к актинидам и
лантанидам [23].
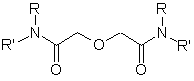
Рисунок 2 - Структура дигликольамида
Как и в случае малонамидов, важную роль в экстракционной
способности дигликольамидов играет их строение. Исследование экстракции
актинидов дигликольамидами с различными алкильными заместителями показало, что
увеличение длины алкильной цепочки заместителя снижает экстракционную
способность экстрагента за счет возникновения стерических затруднений [24].
Диамиды дигликолевой кислоты экстрагируют металлы по
сольватному механизму. Экстракционный механизм может быть выражен следующим уравнением:
Men+aq + n(NO3-)aq + aDGA = Me (NO3)n·(DGA)a (2)
где Меn+ - ион актинида или лантанида, DGA -
дигликольамид.
Традиционными растворителями, применяемыми для растворения
дигликольамидов, являются алифатические углеводороды, например, n-додекан, удовлетворяющий
CHON-концепции. Однако, среди исследованных веществ только диамиды с
гексильными (TPOPDA), октильными (TOOPDA) и додецильными (TDOPDA) заместителями
характеризуются достаточной растворимостью в n-додекане. Причина малой
растворимости диамидов с короткими алкильными заместителями в n-додекане
заключается в высокой полярности и гидрофильности данных веществ.
Широко изучалась экстракция и разделение Eu (III) и Am (III)
синергентными смесями дигликольамидов с такими кислыми экстрагентами, как β-дикетоны. Синергетный эффект смеси дигликольамидов с
теноилтрифторацетоном (ТТА) был обнаружен при экстракции Eu (III), Am (III), Th
(IV), U (VI) и Np (V) из перхлоратных растворов [25 - 27]. Был определен
состав экстрагируемых комплексов: M(TTA)3(DGA) (M=Eu, Am), Th(TTA)3(DGA)
(X), UO2(TTA)2(DGA) (DGA=диамид, X-=ClO4-
или CH2ClCOO-). Хорошие экстракционные свойства N, N’ -
диметил-N, N’ - дигексилдиамида дигликолевой кислоты позволили предложить
способ разделения актинидов (III), (IV), (V) и (VI) степеней окисления. На
первой стадии Th (IV) экстрагируется раствором TTA в толуоле, далее раствором
диамида в толуоле экстрагируются Am (III) и U (VI), и затем производится
экстракция Np (V) раствором диамида в нитробензоле [28].
1.3.1 TODGA как перспективный экстрагент для
извлечения радионуклидов из азотнокислых растворов
Признано, что наилучшими экстракционными свойствами среди
диамидов дигликолевой кислоты обладает N, N, N’, N’ - тетраоктил-дигликольамид
(TODGA) (Рисунок 3). Он обладает высокой растворимостью в алифатических
углеводородах и характеризуется высокими значениями коэффициентов распределения
при экстракции актинидов (III) и лантанидов (III) из азотнокислых растворов [29,
30].
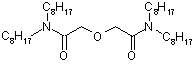
Рисунок 3 - Структура N, N, N’, N’ -
тетраоктил-дигликольамида (TODGA)
Коэффициенты распределения америция и кюрия достаточно высоки
(> 30) при экстракции из растворов азотной кислоты (с концентрацией выше 1М)
0,1М раствором TODGA в n-додекане и достаточно низки (< 0,01) при
реэкстракции 0,01 моль/л раствором азотной кислоты. Экстракция лантаноидов
происходит также хорошо [31].
Экстракционная способность к трехвалентным катионам (Am3+
и Eu3+) у TODGA выше, чем к уранил-иону. Дигликольамиды имеют в
своем строении два карбонильных кислорода и один эфирный кислород. Проведенные
структурные исследования показали, что молекула дигликольамида координируется
различным образом при экстракции разных металлов. Особое значение для механизма
образования комплекса с металлом имеет вклад эфирного кислорода [32]. В
таблице 1 представлены данные по экстракции актинидов и лантанидов и
коэффициенты разделения от Am [30].
Таблица 1 - Экстракция металлов из 1М HNO3.
Экстрагент - 0,1М TODGA в n-додекане
|
Металл
|
DM
|
DM/DAm
|
|
La (III)
|
5,3
|
0,18
|
|
Eu (III)
|
265
|
8,8
|
|
Lu (III)
|
631
|
21
|
|
Th (IV)
|
147
|
4,9
|
|
U (VI)
|
0,8
|
0,027
|
|
Np(V)
|
0,0056
|
0,00020
|
|
Am(III)
|
30
|
1,0
|
|
Cm(III)
|
78
|
2,6
|
|
Cf(III)
|
156
|
5,2
|
Экстракционная способность TODGA по отношению к актинидам
уменьшается в ряду: An(IV) > An(III) > An(VI) > An(V), причём тяжелые
актиниды экстрагируются лучше, чем более легкие. Для 1М HNO3: D
(Th(IV)), D (Cm(III)) > D (Am(III)) [33].
Исследование экстракционных свойств TODGA показывает, что
экстракционная способность данного диамида строго зависит от степени окисления
извлекаемого элемента. Коэффициент распределения достигающий значений выше 50
был получен при экстракции Ca (II), Sc (II), Y (III), Zr (IV), Ln (III), Hf
(IV), Bi (III), актинидов (III) и (IV), с ионным радиусом равным 100 пм для
двухвалентных, 87 - 116 пм для трехвалентных и 83 - 105 пм для четырехвалентных
элементов. Методом сдвига равновесия был определен состав экстрагируемых
комплексов: M(TODGA)3(NO3)n или M(TODGA)4(NO3)n,
где n = 3 или 4, кроме Ca (II) - Ca(TODGA)2(NO3)2
[34].
Экстракционная способность TODGA и его гомологов по отношению
к щелочноземельным металлам изменяется в ряду Ca (II) > Sr (II) > Ba (II)
[35]. Таким образом, с увеличением ионного радиуса извлекаемого металла
происходит снижение коэффициентов распределения (ионные радиусы: 112, 125, и
142, для Ca, Sr и Ba, соответственно). Аналогичная зависимость экстракционной
способности от ионного радиуса была получена и для лантаноидов [30].
Предположительный механизм экстракции щелочноземельных металлов описывается
следующим уравнением:
M2+ + 2NO3- + 2TODGA + HNO3 M(NO3-)2(TODGA)2(HNO3) [35] (3)
Экстракционная способность TODGA была исследована в 11
растворителях. Наибольшие значения коэффициенты распределения металлов
принимают при использовании растворителей с высокими диэлектрическими
константами (нитробензол, 1-октанол), и наименьшие при использовании
хлорированных и ароматических растворителей [30].
Таблица 2 - Экстракция Am и Eu из 1 М HNO3.
Экстрагент - 0,1М TODGA в растворителе
|
Органический
растворитель
|
DAm
|
DEu
|
|
Нитробензол
|
220
|
>500
|
|
1,2 - Дихлорэтан
|
9,9
|
34
|
|
1-Октанол
|
81
|
>500
|
|
Этилацетат
|
>500
|
>500
|
|
Хлороформ
|
0,12
|
0,097
|
|
Диэтиловый эфир
|
100
|
300
|
|
Бензол
|
0,39
|
0,83
|
|
Толуол
|
0,3
|
0,79
|
|
Тетрахлорметан
|
0,095
|
0,39
|
|
n-Додекан
|
30
|
265
|
|
n-Гексан
|
33
|
>500
|
Исследование экстракции америция из различных кислот раствором
0,1 моль/л TODGA в додекане показало, что коэффициенты распределения Am
возрастают в ряду: HCl < HNO3 << HClO4 [36,
37]. В случае соляной кислоты существенного изменения коэффициентов
распределения не происходит вплоть до 2 моль/л HCl. Значения коэффициентов
распределения при экстракции из HClO4 являются наибольшими и
практически не меняются с изменением концентрации кислоты от 0,1 до 6 моль/л.
Высокие DAm при экстракции из хлорной кислоты можно объяснить, так
называемым, перхлоратным эффектом, замеченным ранее для бидентантых
экстрагентов [38, 39]. Например, добавление хлорной кислоты к
азотно- и фосфорнокислым растворам вызывает значительный рост (на несколько
порядков) коэффициентов распределения америция при его экстракции CMPO.
В случае экстракции Am из HNO3, коэффициенты
распределения металла резко возрастают с ростом концентрации кислоты вплоть до
концентрации 3 моль/л, при которой значения коэффициентов распределения выходят
на плато - происходит насыщение экстрагента. Коэффициенты распределения U в
данных условиях продолжают расти вплоть до 6 моль/л HNO3 [30].
Еще одной характерной особенностью TODGA, наравне с
образованием третьей фазы, является склонность к агрегации при экстракции
кислоты. Агрегаты представляют собой сферические обратные мицеллы, состоящие из
полярного центра, содержащего молекулы воды и ионы экстрагируемого металла,
окруженного примерно четырьмя молекулами TODGA [40]. Состав агрегатов
сильно зависит от кислотности водной фазы. 0,1 моль/л раствор TODGA, при
равновесной концентрации азотной кислоты в водной фазе меньшей 0,7 моль/л,
представляет собой смесь мономеров и димеров. При повышении кислотности водной
фазы, молекулы экстрагента образуют более крупные агрегаты содержащие вплоть до
семи молекул TODGA [41, 42].
Исследования радиационной стабильности TODGA показало, что
основными продуктами радиолиза являются диоктиламин и N, N’ - диоктилмоноамиды.
Использованный в качестве растворителя n-додекан повышает радиолиз, за счет
сенсибилизирующего эффекта n-додекана. Добавление таких веществ, как бензол или
N, N’ - диоктилгексанамид, к раствору TODGA в n-додекане защищает TODGA от
радиолиза. В системе TODGA-n-додекан-HNO3, соэкстрагируемая кислота
не оказывает промотирующего действия на радиолиз дигликольамида. В сравнении с
другими экстрагентами, например малонамидами, TODGA характеризуется меньшей
радиолитической устойчивостью. При комнатной температуре TODGA обладает высокой
гидролитической устойчивостью [43]
На использовании TODGA в качестве экстрагента основан так
называемый ARTIST-процесс, разработанный японскими учеными. Данный процесс
включает два этапа: изоляция U (VI) от продуктов деления с помощью
разветвленных алкильных производных моноамидов и соэкстракция актинидов с
использованием TODGA. Другое назначение данного процесса заключается в
применении его для разделения трехвалентных актинидов и лантанидов и в
отделении актинидов от продуктов деления, 90Sr и 137Cs [33].
2. Цели и задачи работы
диамид экстрагент радионуклид европий
Целью данной работы явилось изучение
экстракционного извлечения европия и америция из кислых сред тетраоктил
дигликольамидом в полярных фторированных разбавителях.
Для достижения этой цели поставлены следующие задачи:
1 Исследование экстракционных свойств татраоктил
дигликольамида в полярных фторированных разбавителях по отношению к европию и
амерцию в кислых средах.
2 Изучение влияния типа растворителя на экстракцию.
Изучение влияния типа кислой среды на экстракционные способности TODGA.
3. Экспериментальная часть
.1 Объекты исследования
Объектами исследования являются экстрагент и разбавители. В
качестве экстрагента использовали тетраоктил дигликольамид. В исследовательской
работе, в качестве растворителей для тетраоктил дигликольамида, были
использованы тяжелые фторированные полярные растворители такие как:
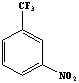
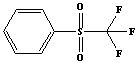
метанитробензотрифторид (Ф-3), фенилтрифторметилсульфон (ФС-13) и
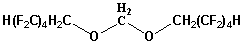
1,1,2,2,3,4,4,10,10,11,11,12,12,13,13 гексадекафтор - 6,8 - диоксатридекан
(формаль-2), а также используемые для сравнения полярные не фторированные
растворители - дихлорэтан и не полярные расворители - додекан. Основные
свойства растворителей указаны в таблице 3.
Таблица 3 - Свойства использованных растворителей
|
Наименование
растворителя
|
Структурная
формула
|
Плотность, d420 г/см3
|
Диэлектрическая
проницаемость, e
|
Вязкость, При
20 oC, МПа*с
|
|
ДХЭ
|
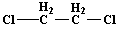
|
1,252
|
10,4
|
0,89
|
|
Ф-3
|
|
1,436
|
22,3
|
3,02
|
|
Формаль-2
|
|
1,673
|
-
|
13,4
|
|
Додекан
|
С12Н26
|
0,749
|
2,016
|
1,26
|
|
ФС-13
|
|
1,410
|
29,0
|
3,60
|
Растворитель Ф-3 очищали последовательной двукратной
промывкой раствором 1 М гидроокиси натрия, затем 3 М азотной кислотой,
дистиллированной водой до нейтральной реакции и фильтрованием через бумажный фильтр.
ДХЭ очищали промывкой 6 М серной кислотой и дистиллированной водой до
нейтральной реакции. Сушили над безводным углекислым калием и перегоняли при
атмосферном давлении. Формаль-2 очищали перегонкой при пониженном давлении.
Экстрагент - тетраоктил дигликольамид (TODGA) был предоставлен фирмой
«Katchem», РЖЕЖ, Чехия. Другие
амиды были синтезированы в Институте Органической химии Национальной Академии
наук Украины (Киев, Украина). Свойства впервые синтезированных соединений
представлены в таблица 4.
Таблица 4 - Формулы и ПМР-спектры диамидов дигликолевой
кислоты
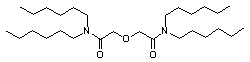
N, N, N`, N` - Тетрагексил дигликольамида
|
(АМ-1))1H NMR (d, ppm, (CDCl3,
TMS): 0.86 (m, 12H, CH3), 1.26 (s 24H, N(CH2)2(CH2)3CH3),
1.51 (m, 8H, NCH2CH2), 4.15 (t, J = 7.4 Hz, 4H,
NCH2), 3.28 (t, J = 7.4 Hz, 4H, NCH2),
4.32 (s, 4H, C(O) CH2OCH2C(O))
|
|
N, N, N`, N` - Тетраоктил дигликольамида
|
(АМ-2 TODGA))1H NMR (d, ppm, (CDCl3,
TMS): 0.86 (m, 12H, CH3), 1.26 (s 32H, N(CH2)2(CH2)3CH3),
1.51 (m, 8H, NCH2CH2), 4.15 (t, J = 7.4 Hz, 4H,
NCH2), 3.28 (t, J = 7.4 Hz, 4H, NCH2),
4.32 (s, 4H, C(O) CH2OCH2C(O))
|
|
Продолжение таблицы 4
|
2 -
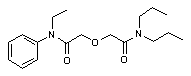
[(Этил-фенил-карбамоил) - метокси] - N, N-диприпил-ацетамид (АМ-3)1H ЯМР спектр (d, ppm, (CDCl3, TMS): 0.89 (m, 6H, N(CH2)2CH3), 1.11 (t, J = 7.4 Hz, 3H, NCH2CH3), 1.53 (m, 4H, NCH2CH2), 3.21 (m, 4H, NCH2CH2CH3 + NCH2CH3),
3.75 (m, 2H, NCH2CH2CH3),
3.93 (s, 2H, OCH2C(O)), 4.28 (s, 2H, OCH2C(O)),
7.15 (d, J = 12.6 Hz, 2H, ArH), 7.38 (t, J = 7.4 Hz, 3H, ArH).
|
|
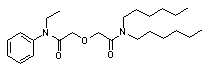
|
2 -
[(Этил-фенил-карбамоил) - метокси] - N, N-дигексил-ацетамид (АМ-4)1H NMR (d, ppm, (CDCl3,
TMS): 0.87 (m, 6H, N(CH2)5CH3),
1.11 (t, J = 7.4 Hz, 3H, NCH2CH3), 1.23 (m, 4H, N(CH2)2(CH2)3), 1.46 (m, 4H, NCH2CH2(CH2)3CH3), 3.22 (m, 4H, NCH2(CH2)4CH3 + NCH2CH3), 3.72 (m, 2H, NCH2(CH2)4CH3), 3.93 (s, 2H, OCH2C(O)), 4.26 (s, 2H, OCH2C(O)), 7.12 (d, J = 12.6 Hz, 2H, ArH), 7.39 (t, J = 7.4 Hz, 3H, ArH).
|
|
3.2 Методика эксперимента
Экстракцию проводили в полипропиленовых пробирках объемом 1.5
мл, при t=(22±1)
С0 и времени контакта фаз 3 минуты. После перемешивания смесь водной
и органической фаз в соотношении 1:1 разделяли центрифугированием при частоте
2200 об/мин в течение 5-10 минут. Затем отбирали аликвотную часть раствора для
анализа.
Экстрацию азотной кислоты проводили в полипропиленовых
пробирках объёмом 5,4 мл, при t=(22±1) 0С и времени контакта фаз 3 минуты,
В:О=1:1. Затем методом титрования, используя в качестве титранта 0,1М NaOH и в качестве индикатора
бром-крезол зеленый, определяли количество азотной кислоты в водной фазе. В
органической фазе определяли по формуле:
Сорг.= Сисх. - С вод. (4)
Коэффициент распределения определяли:
HNO3 =[HNO3]орг/[HNO3]вод. (5)
3.3 Методика определения
Для определения коэффициента распределения Am (III) и Eu (III), в полиэтиленовую
пробирку объёмом 1,5 мл, помещали по 0,6 мл органической и водной фаз
необходимого состава, и перемешивали при температуре 20±2˚C в течение 5
минут (по данным предварительных опытов этого времени достаточно для
установления равновесия). Водная фаза содержала 1·10-6 М нитрата
европия и радиоизотопную метку соответствующего элемента (Am241, Eu152). Основной массив данных
получен при совместной экстракции америция (III) и европия (III). Ранее определено, что
коэффициенты распределения при совместном извлечении практически не отличаются
от коэффициентов при раздельном извлечении Am/Eu. Фазы разделяли
центрифугированием при 2200 об/мин в течение 10 минут, затем аликвоты по 0,4 мл
органической и водной фаз помещали в полиэтиленовые пробирки ёмкостью 0,5 мл.
Коэффициент распределения определяли на сцинтилляционном γ-спектрометре «DeskTop InSpector» на основе NaJ-детектора 51Ч51 мм
с колодцем производства фирмы «Canberra». Продолжительность измерения выбирали
так, чтобы погрешность радиометрических измерений не превышала 10%. По
результатам анализа рассчитывали коэффициент распределения металла по формуле:
M = Aорг/Aвод (6)
где Aорг(вод) - удельная активность в органической
(водной) фазе, Бк / мл.
Коэффициент разделения пары Am / Eu определяли как:
Кр = DAm / DEu (7).
4.
Результаты и обсуждение
Результаты изучения экстракции америция и европия различными
диамидами дигликолевой кислоты приведены в таблицах 3 и 4.
Таблица 5 - Экстракция Am (III) и Eu (III) из азотнокислых сред
дигликольамидами
|
Дигликольамид в Ф-3
|
|
0,01 M АМ-2
|
0,04 M АМ-3
|
0,04 M AM-4
|
|
CHNO3исх
|
DAm
|
DEu
|
DAm
|
DEu
|
DAm
|
DEu
|
|
0,1
|
-
|
-
|
0,19
|
0,19
|
0,24
|
0,26
|
|
0,3
|
0,53
|
0,81
|
0,55
|
0,58
|
0,67
|
0,76
|
|
1,0
|
2,9
|
11
|
2,6
|
4,1
|
3,1
|
11
|
|
3,0
|
3,7
|
28
|
8,7
|
40
|
10
|
64
|
|
6,0
|
0,35
|
3,3
|
10
|
120
|
12
|
150
|
Таблица 6 - Эффективность экстракции Am (III) и Eu (III) из 1 M и 3 M азотной кислоты
тетрагексил дигликольамидом (АМ-1)
|
ФС-13
|
Нитробензол
|
Ф-3
|
|
СМ-1,
M
|
1,0 M
|
3,0 M
|
1,0 M
|
3,0 M
|
1,0 M
|
3,0 M
|
|
DEu
|
DAm
|
DEu
|
DAm
|
DEu
|
DAm
|
DEu
|
DAm
|
DEu
|
DAm
|
DEu
|
DAm
|
|
0,1
|
90
|
82
|
440
|
330
|
230
|
160
|
600
|
250
|
420
|
112
|
630
|
270
|
|
0,05
|
67
|
19
|
230
|
40
|
200
|
48
|
330
|
60
|
180
|
32
|
260
|
95
|
|
0,025
|
16
|
5,9
|
45
|
9,1
|
48
|
14
|
52
|
11
|
40
|
10
|
190
|
28
|
|
0,001
|
2,5
|
1,5
|
3,8
|
1,4
|
7,2
|
2,9
|
4,7
|
1,4
|
5,8
|
2,3
|
15
|
3,7
|
Данные таблиц 3 и 4 свидетельствуют, что максимальной экстракционной
способностью из изученных диамидов обладает тетрагексилдиамид дигликолевой
кислоты (АМ-1). Его экстракционные свойства заметно лучше, чем для
триалкилмонофенилпроизводных и совпадают с экстракционными свойствами
тетраоктилдиамида дигликолевой кислоты (TODGA). Также очевидно, что разбавитель
существенно влияет на экстракционные свойства экстрагента и разделение америций
- европий. Для поиска наиболее эффективной экстракционной системы целесообразно
изучить экстракционную способность TODGA во фторированных разбавителях.
Экстракционная способность TODGA ранее была исследована в 11 различных
растворителях. Наибольшие значения коэффициенты распределения металлов
принимают при использовании таких растворителей как: этилацетат > диэтиловый
эфир > нитробензол > 1-октанол, и наименьшие при использовании
хлорпроизводных метана, этана и ароматических растворителей (таблица 2).
В данной работе сравнение полярных тяжелых фторированных
(ПТФ) растворителей проводили с ДХЭ и додеканом. Выбор растворителей для сравнения
обусловлен тем, что ДХЭ и додекан, а также их аналоги, наиболее распространены
в жидкостной экстракции. Кроме этого, практически во всех опубликованных работ,
где исследуется экстракционные свойства диамидов дигликолевой кислоты, в
качестве растворителя используют додекан.
4.1 Экстракция азотной кислоты
Экстракцию радионуклидов проводим из азотнокислых сред.
Обосновывается это тем, что при переработке ОЯТ методом жидкостной экстракции
используют в основном азотнокислые растворы. Рафинат PUREX-процесса, для
фракционирования которого планируется использовать изучаемые здесь экстрагенты,
также является азотнокислым.
Диамиды дигликолевой кислоты относятся к классу нейтральных
экстрагентов. Экстракционные свойства данных экстрагентов сильно зависят от кислотности
среды. Для определения влияния природы разбавителя на эффективность и
селективность экстракции системами на основе TODGA, необходимо изучить
экстракцию азотной кислоты.
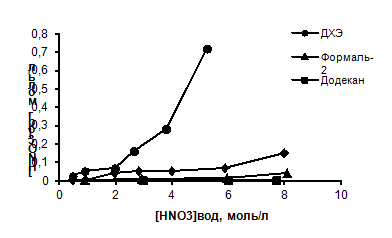
Рисунок 4 - Изотерма экстракции азотной кислоты различными
разбавителями
Как видно из рисунка 4, заметная экстракция азотной кислоты для
всех разбавителей наблюдается при [HNO3]вод > 4 M. Наименьшие значения экстракции азотной кислоты
наблюдается для Ф-3, а наибольшие для ДХЭ. В случае формаль-2 наблюдается
значительное увеличение экстракции азотной кислоты при [HNO3]вод > 6 M.
Природа растворителя практически не влияет на экстракцию азотной кислоты
растворами TODGA в разбавителе (рисунок 5). Представленные
данные показывают, что при экстракции азотной кислоты растворами TODGA, на 1 M TODGA
экстрагируется 3 M HNO3.
4.2 Экстракция европия и америция из азотной кислоты
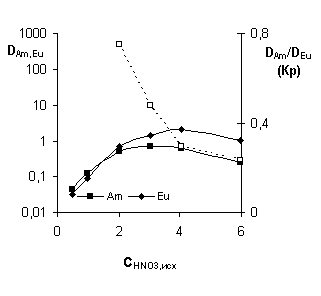
Рисунок 6 - Зависимость эффективности экстракции америция
(III) и селективности разделения пары Am / Eu тетраоктил дигликольамидом в
растворителе от концентрации азотной кислоты
Из представленных на рисунке 6 данных видно, что зависимость
коэффициента распределения америция от концентрации азотной кислоты, для всех
растворителей, за исключением додекана, имеет максимум. Максимум экстракции Am из азотной кислоты для
ДХЭ и Ф-3 наблюдается при концентрации (исходной) кислоты в районе 2 - 3
моль/л. Для формаль-2 максимум смещен в область 5 - 6 моль/л (рисунке 3 (Г)). В
случае додекана, где максимума значения коэффициента распределения не
наблюдается, в области CHNO3 > 4 M явное увеличения
значений DAm,Eu не наблюдается. Также
показано, что максимум экстракции европия находится в том же кислотном
интервале, что и для америция. Стоит отметить, что система на основе формаль-2
как растворителя эффективнее извлекает америций и европий чем системы на основе
ДХЭ и Ф-3 на всем интервале изучаемой кислотности. В сравнении с додеканом,
система на основе формаль-2 эффективнее экстрагирует америций в области CHNO3 > 2,5 M. Следует отметить, что
значения коэффициентов распределения америция и европия, при экстракции из 3 M HNO3, для додекана и
формаль-2 вполне соизмеримы. Так, при экстракции америция и европия раствором
0,01 M TODGA в формаль-2 из азотной кислоты с концентрацией более 3 M D (Am и Eu) > 50 (Таб. 7). При
таких высоких значениях коэффициента распределения (> 50) имеет место
высокая погрешность определения (> 50%), в виду чего полученные результаты
не являются достаточно достоверными.
Таблица 7 - Экстракция америция (III) и европия (III) раствором 0,01 M тетраоктил дигликольамида
в растворителе из азотнокислых сред. Растворитель - ДХЭ, Ф-3, ФС-13 и Формаль-2
|
0,01 M TODGA в Растворителе
|
|
ДХЭ
|
Ф-3
|
Додекан
|
Формаль-2
|
|
CHNO3исх
|
1 M
|
3 M
|
1 M
|
3 M
|
1 M
|
3 M
|
1 M
|
3 M
|
|
DAm
|
0,12
|
0,73
|
2,9
|
3,6
|
0,09
|
60
|
1,1
|
54
|
|
DEu
|
0,09
|
1,5
|
11
|
28
|
0,89
|
>
300
|
9,9
|
>
300
|
|
Кр (DAm / DEu)
|
1,3
|
0,5
|
0,26
|
0,13
|
0,10
|
-
|
0,11
|
-
|
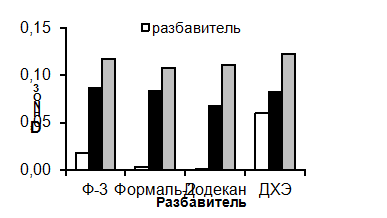
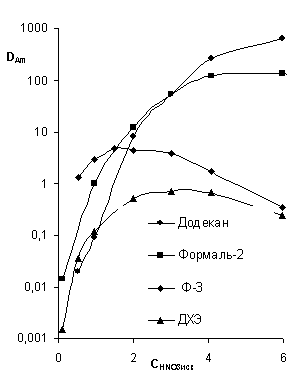
В случае других представленных на рисунке 2 растворителей
максимальный коэффициент распределения для европия равен 28 (Ф-3, Таб. 7). На
основании данных, представленных на рисунке 7 (А), изучаемые растворители можно
расположить в ряд, отражающий возрастание эффективности экстракции Am и Eu для систем с тетраоктил
дигликольамидом: ДХЭ < Ф-3 << Додекан < Формаль-2.
Все представленные системы эффективнее экстрагируют европий.
Для всех растворителей (рисунок 7) коэффициент разделения пары Am/Eu (DAm / DEu) монотонно уменьшается с
увеличением концентрации азотной кислоты, т.е. чем выше концентрация кислоты,
тем лучше экстрагируется европий относительно америция. По селективности
экстракции пары Am/Eu тетраоктил дигликольамидом в растворителе можно расположить в ряд
по снижению значений коэффициентов разделения (DAm /DEu): ДХЭ < Ф-3 <<
Додекан < Формаль-2.
 A)
A)
Рисунок 7 - Эффективность извлечения америция (III) и
селективность разделения пары Am / Eu при экстракции из азотнокислой среды
Как видно, ряды эффективности и селективности экстракции
совпадают. С ростом кислотности среды разница в коэффициенте разделения
металлов для изучаемых растворителей уменьшается. В случае фторированных
растворителей при концентрации кислоты более 3 M разница в коэффициенте
разделения пары Am/Eu практически отсутствует, в то время как системы с ДХЭ
демонстрируют существенное отличие от указанной тенденции (так, Кр(DAm/DEu) ДХЭ в 2 раза
превышает соответствующую величину для систем с фторсодержащими
растворителями).
4.3 Определение состава экстрагируемых комплексов
Существуют 2 метода определения состава экстрагируемого
комплекса: метод сдвига равновесия и метод насыщения.
Метод сдвига равновесия
Установление состава экстрагируемых комплексов TODGA с металлом (Am, Eu) проводилось методом
сдвига равновесия при экстракции из 3 M HNO3 (рисунок 5). Определены сольватные числа для
комплексов америция и европия в системах вида «TODGA в растворителе». Сольватные
числа для комплекса европия, в случае ДХЭ, додекана, Ф-3 и Формаль-2 имеют
значения 2,6; 3,6; 3,3; 2,8 соответственно. Приведенные сольватные числа
показывают, что происходит образование комплекса, состав которого
характеризуется соотношением TODGA: Eu, равным 3:1. Найдено, что при экстракции
америция растворами TODGA в данных разбавителях сольватные числа имеют значения 1,9; 4,1
2,9; 2,5 для ДХЭ, додекана, Ф-3 и Формаль-2, соответственно. Из представленных
результатов можно заключить, что образуется комплекс состава TODGA: Am: 4:1 для додекана, 3:1
для Ф-3 и Формаль-2, 2:1 для ДХЭ.
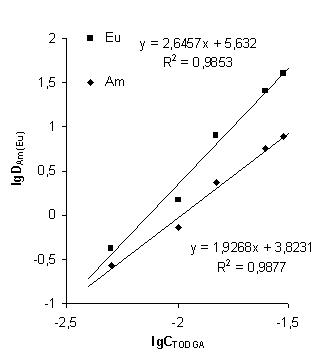
Рисунок 8 - Экстракция Am(III) и Eu (III) из 3 моль/л HNO3 в
зависимости от концентрации TODGA. Растворитель - Ф-3, Формаль-2 и ДХЭ
Данные по составу экстрагируемых комплексов для додекана и
ДХЭ хорошо согласуются с данными работы [44]. Образование комплекса металла с
экстрагентом можно описать следующим уравнением:
M3+(вод) + 3 NO3-(орг) + 3 L(орг) ↔ M(NO3)3L3(орг) (8)
где L = TODGA.
Метод насыщения
Из изотермы экстракции европия 0,1М раствором TODGA в Ф-3 следует, что
насыщенный раствор экстрагента содержит ~5,8 г/л (0,038М) европия, что
соответствует сольватному числу 2,6. Такое сольватное число можно объяснить
наличием в органической фазе смеси комплексов состава 2:1 и 3:1. Для насыщенных
растворов экстрагента выпадения осадков при стоянии не обнаруживается.
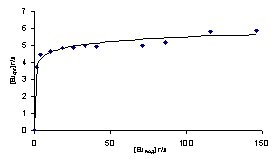
Рисунок 9 - Изотерма экстракции европия
4.4 Экстракция европия и америция из кислых сред
В таблице 8 представлены данные по экстракции металлов как из
азотнокислых сред так и из хлорно- и солянокислых сред. Данные полученные в
этой работе для додекана соответствуют данным работы [45].
Таблица 8 - Экстракция америция (III) и европия (III) тетраоктил
дигликольамидом из кислых сред. Растворитель - ДХЭ, Ф-3, Додекан и Формаль-2
|
Растворитель
|
Концентрация
кислоты (исх.), моль/л
|
|
CHNO3,
|
CHCIO4, моль/л
|
CHCI, моль/л
|
|
1
|
3
|
1
|
3
|
1
|
3
|
|
ДХЭ
|
CTODGA,
M
|
0,01
|
0,003
|
0,1
|
|
DAm
|
0,12
|
0,73
|
73
|
1,2
|
<
0,001
|
0,004
|
|
DEu
|
0,09
|
1,5
|
590
|
9,8
|
0,002
|
0,011
|
|
Кр (DAm / DEu)
|
1,3
|
0,5
|
0,12
|
0,12
|
-
|
-
|
|
Ф-3
|
CTODGA,
M
|
0,01
|
0,003
|
0,1
|
|
DAm
|
2,9
|
3,6
|
7,4
|
0,74
|
-
|
0,05
|
|
DEu
|
11
|
28
|
82
|
8,6
|
-
|
0,28
|
|
Кр (DAm / DEu)
|
0,26
|
0,13
|
0,09
|
0,09
|
-
|
-
|
|
Додекан
|
CTODGA,
M
|
0,01
|
0,003
|
0,1
|
|
DAm
|
0,09
|
52
|
>1000
|
>1000
|
<
0,001
|
0,01
|
|
DEu
|
0,89
|
380
|
>500
|
>1000
|
-
|
-
|
|
Кр (DAm / DEu)
|
0,18
|
0,14
|
-
|
-
|
-
|
-
|
|
Формаль-2
|
CTODGA,
M
|
0,01
|
0,003
|
0,01
|
|
DAm
|
1,1
|
54
|
>1000
|
>
500
|
-
|
0,20
|
|
DEu
|
9,9
|
>
300
|
>
500
|
>
1000
|
-
|
2,3
|
|
Кр (DAm / DEu)
|
0,11
|
-
|
-
|
-
|
-
|
0,09
|
Показано, что порядок в ряду эффективности экстракции
америция (европия) при переходе от азотной кислоты к хлорной сохраняется: ДХЭ
< Ф-3 << Формаль-2<Додекан. Установлено, что извлечение Am и Eu из хлорнокислых сред
происходит значительно эффективнее, чем из азотнокислых, т.е. для TODGA также проявляется
перхлоратный эффект, наблюдаемый при экстракции бидентатными нейтральными
соединениями. Из солянокислых сред экстракция практически не происходит, за
исключение систем на основе Формаль-2, как растворителя.
Показано, что максимальной экстракционная способностью из
изученных дигликольамидов обладает тетрагексилдиамид дигликолевой кислоты
(АМ-1). Его экстракционные свойства заметно лучше, чем для
триалкилмонофенилпроизводных и совпадают с экстракционными свойствами
тетраоктилдиамида дигликолевой кислоты (TODGA).
Изучено влияние растворителя на экстракцию америция, европия
и азотной кислоты тетраоктилдиамидом дигликолевой кислоты (TODGA). Показано,
что экстракционная способность по отношению к америцию и европию возрастает в
ряду: ДХЭ < Ф-3 << Додекан << Формаль-2.
Определена селективность экстракции пары Am/Eu тетраоктил
дигликольамидом в растворителе. В ряду: ДХЭ < Ф-3 << Додекан <
Формаль-2 наблюдается снижение коэффициента разделения DAm / DEu.
Методом сдвига равновесия, а также для Ф-3 методом насыщения,
был установлен состав экстрагируемых комплексов америция и европия с
тетраоктилдиамидом дигликолевой кислоты. Установлено, что для ДХЭ характерно
сольватное число равное 2 - Am, 3 - Eu, а в случае Ф-3, додекана и формаль-2 сольватное
число равно 3 - 4.
5. Расчет затрат на выполнение НИР
Затраты на проведение исследовательской дипломной работы
складываются из текущих и капитальных затрат.
Текущие затраты включают в себя расходы на использование в
процессе выполнения исследования сырье, материалы, реактивы, различные виды
энергии, на заработную плату исполнителя работы, руководителя, консультантов и
привлеченных лиц, стеклянную посуду и приборы; расходы связанные с выполнением
специальных анализов и общеинститутские накладные расходы. Для определения
общей суммы текущих затрат составляется смета, которая рассчитывается по
отдельным статьям, отражающим состав текущих затрат при выполнении
исследования. Все цены при расчете взяты на 4 квартал 2007 года.
Капитальные затраты могут иметь место в том случае, если для
данной работы приобретается и монтируется специальное оборудование и приборы;
для выполнения данной работы специальное оборудование не приобретались, поэтому
капитальных затрат не было.
5.1 Затраты на сырьё, материалы и реактивы
Затраты на сырьё, материалы и реактивы (Зм),
израсходованные на проведение исследования, определяются последующей формуле:
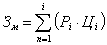 , (А1)
, (А1)
где: Pi -
расход i-гo вида материальных ресурсов, нат. ед.;
Цi -
планово-заготовительная цена, руб./ед.
Таблица А1 - Расчет затрат на сырьё, материалы и реактивы
|
Наименование
сырья, материалов, реактивов
|
Тех. х-ка
|
Ед. изм.
|
Кол-во
израсходованного материала
|
Цена по
прейскуранту, за ед. изм., руб.
|
Сумма, руб.
|
|
HNO3
|
чда
|
кг
|
2
|
32,5
|
65
|
|
HClO4
|
ЧДА
|
кг
|
1
|
480
|
480
|
|
HCl
|
ХЧ
|
кг
|
0.5
|
29,9
|
14,95
|
|
H2SO4
|
ЧДА
|
кг
|
0.1
|
29,5
|
2,95
|
|
NaOH
|
ЧДА
|
кг
|
0.2
|
36,9
|
7,38
|
|
Na2CO3
|
ЧДА
|
кг
|
0.5
|
34
|
17
|
|
TODGA
|
|
кг
|
0,008
|
1560
|
12,48
|
|
Ф-3
|
Ч
|
кг
|
0,5
|
240
|
120
|
|
ФС-13
|
Ч
|
кг
|
0,020
|
150
|
3
|
|
Формаль-2
|
Ч
|
кг
|
0,1
|
2600
|
260
|
|
ДХЭ
|
Ч
|
кг
|
0,1
|
46
|
4,6
|
|
Додекан
|
Ч
|
кг
|
0,1
|
350
|
35
|
|
Радиоактивные
изотопы(Am241, Eu152, Sr85,
Sm145)
|
|
Ku
|
|
|
5000
|
|
ИТОГО
|
|
|
|
|
6022,36
|
|
Прочие
материалы (фильтровальная бумага, индикатор, прочие реактивы)
|
|
|
5% от основ
расходов на реактивы
|
|
301,12
|
|
Итого
|
6323,48
|
5.2 Расчет энергетических затрат
Затраты на электроэнергию (Зэ) определяются
следующим образом:
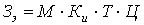 , (А2)
, (А2)
где: М - паспортная мощность электроприборов,
использованных при выполнении работы, кВт;
Ки
- коэффициент использования мощности электрооборудования (принимается Ки
= 0.7);
Ц - цена за
1кВт∙ч электроэнергии, руб. (Ц=1.55 руб./(кВт*ч.));
Т - время
работы электрооборудования за весь период работы, ч.
Результаты расчета энергетических затрат представлены в таблице
А2.
Таблица А2 - Расчет потребляемой электроэнергии
|
Наименование
приборов
|
М, кВт
|
Т, ч
|
А, кВт∙ч
|
|
ЭВМ
|
0.3
|
300
|
90
|
|
Сушильный шкаф
|
0,8
|
300
|
240
|
|
γ-спектрометр
«DeskTop InSpector»
|
0,4
|
300
|
120
|
|
Центрифуга
|
2,0
|
300
|
600
|
|
Итого
|
|
|
1050
|
Из таблицы видно, что было затрачено 1050 кВт∙ч.
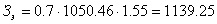 руб.
руб.
5.3 Расчет затрат на холодную воду
В состав энергетических затрат входят затраты на электроэнергию,
воду израсходованную в процессе исследования.
Затраты на воду (Зв) рассчитываются по формуле:
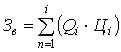 , (А3)
, (А3)
где: Qi
- объём израсходованной воды (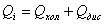 ), м3;
), м3;
Цi -
цена за 1 м3 воды (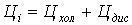 ), руб.;
), руб.;
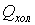 ,
,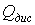 - объём холодной и дистиллированной воды (
- объём холодной и дистиллированной воды (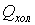 = 0,2 м3,
= 0,2 м3, 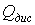 =2 м3);
=2 м3);
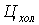 ,
,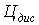 - цена за 1 м3 холодной и
дистиллированной воды (
- цена за 1 м3 холодной и
дистиллированной воды (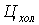 = 26 руб.,
= 26 руб., 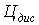 = 50 руб.).
= 50 руб.).
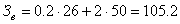 руб.
руб.
5.3.1 Расчет затрат на основную заработную
плату
Затраты на основную заработную плату
складываются из заработной платы исполнителя, руководителя и консультанта.
Затраты на основную заработную плату
исполнителя определяется умножением размера месячной стипендии исполнителя на
число месяцев, отводимых на выполнение дипломной работы:
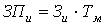 , (А4)
, (А4)
где: Зи - среднемесячная стипендия исполнителя,
руб./месяц;
Тм -
число месяцев выполнения работы.
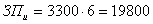 руб.
руб.
Затраты на основную заработную плату руководителя, консультантов
определяются из среднечасовой зарплаты этих лиц и норм затрат их рабочего
времени на одну дипломную работу.
руководителя исследования:
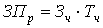 , (А5)
, (А5)
где: Зч - часовая тарифная ставка руб./час; Тч
- количество часов.
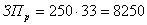 руб.
руб.
Для консультантов по экономике и охране труда, а также рецензента
работы среднечасовая заработная плата составляет 185 руб.; норма затрат
консультантов по экономике и охране труда по 1 часу:
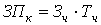 , (А6)
, (А6)
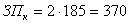 руб.
руб.
Итого основная заработная плата:
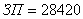 руб.
руб.
5.3.2 Расчет затрат на дополнительную заработную плату
Дополнительная заработная плата составляет 20% от суммы затрат по
статье «Основная заработная плата»:
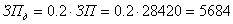 руб.
руб.
5.3.3 Отчисления на социальное страхование
Отчисления на социальное страхование составляет 26% от суммы
основной и дополнительной заработной платы: 8867,04 руб.
5.3.4 Расчет затрат на посуду
Таблица А3 - Расчет затрат на посуду
|
Наименование
|
Кол-во
|
Цена руб./шт.
|
∑, руб.
|
|
Колба мерная
250 мл
|
6
|
41
|
246
|
|
Делительная
воронка 500 мл
|
1
|
409
|
409
|
|
Колбы мерные с
одной отметкой 100 мл 500 мл 1000 мл
|
6 2 1
|
34 105 316
|
204 110 316
|
|
Бюретка 5 мл
|
2
|
110
|
220
|
|
Стакан низкий
ТС 50 мл
|
2
|
18
|
36
|
|
Цилиндр мерный
500 мл 25 мл
|
1 5
|
449 81
|
449
|
|
Механические
дозаторы
|
2
|
3272,5
|
6545
|
|
Посуда
одноразовая (пробирки, наконечники для мех. дозаторов, пипетки)
|
|
|
8000
|
|
Итого
|
16535
|
Так как после завершения исследования посуда была сдана, то в
состав текущих затрат включается только сумма амортизационных отчислений. Таким
образом затраты на посуду определяются по формуле:
3п = Н∙С, (А7)
где: Зп - затраты на посуду, руб.
Н - норма амортизационных отчислений (40% от общих
затрат на посуду), %.
С - общая стоимость используемой посуды, руб.
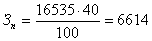 руб.
руб.
5.3.5 Расчет суммы затрат амортизационных отчислений
Амортизационные отчисления рассчитывались по формуле:
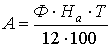 , (А8)
, (А8)
где: Ф - стоимость используемого оборудования, руб.;
На
- годовая норма амортизации, %;
Т - время их
использования, мес.
Сумма амортизационных отчислений приведена в таблице А4.
Таблица А4 - Расчет суммы амортизационных отчислений
|
Наименование
оборудования
|
Кол-во, шт.
|
Ф, руб.
|
На, %
|
Т, мес.
|
А, руб.
|
|
Центрифуга
|
1
|
61000
|
10.4
|
6
|
3172
|
|
Сушильный шкаф
|
1
|
35000
|
10.4
|
6
|
614,64
|
|
γ-спектрометр
«DeskTop InSpector»
|
1
|
130000
|
10.4
|
6
|
6760
|
|
Компьютер
|
1
|
12000
|
10.4
|
3
|
312
|
|
Итого
|
10858,64
|
5.3.6 Накладные расходы
Накладные расходы, включающие затраты на содержание
вспомогательного и административно-управленческого персонала, на отопление,
освещение, на уборку и ремонт зданий, командировочные, канцелярские и прочие
хозяйственные расходы, принимаем в размере 50% к сумме основной и
дополнительной заработной платы:
Нр=0,5∙(28420+5684)=17052 руб.
5.3.7 Смета затрат на проведение НИР
Смета затрат на проведение НИР приводится в таблице А5.
Таблица А5 - Полная смета затрат на проведение НИР
|
Наименование
статей затрат
|
Сумма, руб.
|
Доля статей в
общей сумме затрат, %
|
|
Энергетические
затраты: 1. электроэнергия 2. вода (и холодная, и дистиллированная)
|
1139,75 105,20
|
1,27 0,12
|
|
Итого
|
1244,95
|
1,38
|
|
Основная
заработная плата: 1. исполнителя 2. руководителя 3. консультант
|
19800 8250 370
|
22,02 9,17 0.41
|
|
Итого
|
28420
|
31,6
|
|
Дополнительная
заработная плата
|
5684
|
6,32
|
|
Отчисления на
социальное страхование
|
8867,04
|
9,86
|
|
Амортизационные
отчисления
|
10858,64
|
12,07
|
|
Посуда
|
6614
|
7,35
|
|
Затраты на
сырьё, материалы и реактивы
|
6323,48
|
7,03
|
|
Итого прямых
затрат
|
72881,35
|
81,04
|
|
Накладные
расходы
|
17052
|
18,96
|
|
Всего затрат
|
89933,35
|
100
|
5.4 Определение договорной цены на НИР
При переходе научных подразделений на хозрасчет, важным
показателем оценки проводимого исследования является договорная цена на НИР (Цнир):
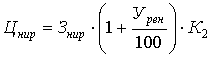 , (А9)
, (А9)
где: Цнир - договорная цена на НИР, руб.
Знир - затраты на выполнение исследовательской работы, руб.
Урен - уровень рентабельности, %.
К2
- коэффициент, учитывающий поощрительную надбавку за качество работы.
Уровень рентабельности при выполнении научно-исследовательских
работ, не принадлежащих к государственному, республиканскому или отраслевому
заказам, составляет 20%.
Поощрительная надбавка за качество работы для исследований,
носящих практическое значение, определяется коэффициентом 1,2. Определяется по
формуле:
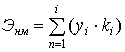 , (А10)
, (А10)
где: уi -величина
частного показателя, баллы;
ki -весовой
коэффициент i-го частного показателя.
Таблица А6 - Частные показатели и весовые коэффициенты
|
Показатель
|
Величина
показателя
|
Значение
весовых коэффициентов
|
|
Степень новизны
|
70
|
0.33
|
|
Научно-технический
уровень
|
30
|
0.33
|
|
Глубина
воздействия
|
50
|
0.33
|
Рассчитаем величину научно-технического эффекта Энм:
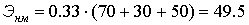
По таблице А7 определяем коэффициент, учитывающий величину
надбавки.
Таблица А7 - Зависимость коэффициента поощрительной надбавки К
от величины достигнутого научно-технического эффекта Энм
|
Величина
достигнутого научно технического эффекта Энм, баллы
|
Коэффициент
поощрительной надбавки (за качество работы) К
|
|
<15
|
1.0
|
|
16-30
|
1.1
|
|
31-50
|
1.2
|
|
51-70
|
1.3
|
|
71-90
|
1.4
|
|
91-100
|
1.5
|
Он составляет К=1.2 (для величины научно технического
эффекта от 31 до 50 баллов).
Таким образом:
Цнир= 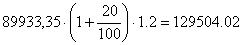 руб.
руб.
Результаты, полученные в данной исследовательской работе,
представляют собой большую ценность для продолжения дальнейших научных
исследований в области жидкостной экстракции РЗЭ и ТПЭ. Высокоэффективный
экстрагент - TODGA, исследуемый в этой работе, может стать непосредственным
конкурентом используемых сейчас нейтральных экстрагентов. Приведенные новые
фторсодержащие разбавители и системы на их основе могут найти свое применение
не только в ядерно-топливном цикле, получении РЗЭ, но и в области получения
других групп металлов.
Список источников
1. E.A. Mowafy, H.F. Aly. Extraction
behaviours of Nd(III), Eu(III), La(III), Am(III) and U(VI) with some substituted
malonamides from nitrate medium. /Solv. Extr. Ion Exch., 2002, 20 (2), pp.177 -
194.
2. L. Sprjuth, J.O. Liljenzin, M.I. Hudson, M.G.B. Drew, P.B.
Iveson, C. Madic. Comparison of extraction behaviour and basicity of some
substituted malonamides. /Solv. Extr. Ion Exch., 2000, 18 (2), pp. 1 - 23.
. G.R. Mahajan, D.R. Prabhu, V.K. Manchanda, L.P. Badheka.
Substituted malonamides as extractants for partitioning of actinides from
nuclear waste solutions. /Waste Management, 1998, 18, pp. 125 - 133.
4. C. Cuillerdier, C. Musikas, P. Hoel, L. Nigond, X. Vitart. Malonamides as
new extractants for nuclear waste solution. /Sep. Sci. and Technol., 1991; 26
(9), 1229-1244.
. B.F. Smith, K.V. Wilson, R.R. Gibson, M.M. Jones, G.D.
Jarvinen. Amides as phase modifiers for N, N-tetraalkylmalonamide extraction of
actinides and lanthanides from nitric acid solutions. /Sep. Sci. Technol.,
1997, 32 (1 - 4), pp. 149 - 173.
6. G.M. Gasparini, G. Grossi. Long chain disubstituted
aliphatic amides as extracting agents in industrial applications of solvent
extraction. /Solv. Extr. Ion Exch., 1986, 4 (6), рр. 1233-1271.
. C. Musikas. Solvent extraction for the chemical separation
of the 5f elements /Inorg. Chim. Acta, 1987, 140 (1 - 2), pp.197 - 206.
. N. Condamines, C. Musikas. Extraction by N,
N-dialkylamides. II. Extraction of actinide cations /Solv. Extr. Ion Exch.,
1992, 10 (1), рр. 69 - 100.
. D.R. Prabhu, G.G. Mahajan, G.M. Nair, M.S. Extraction of
Uranium(VI) and Plutonium(V) with unsymmetrical monoamides. /Radiochim. Acta, 1993, 60
(2 - 3), pp. 109 - 113.
. P.B. Ruikar, M.S. Nagar, M.S. Subramanian. Extraction of
uranium, plutonium and some fission products with γ-irradiated unsymmetrical and branched chai dialkylamides.
/J. Radioanal. Nucl. Chem., 1993, 176 (2), pp.103 - 111.
. E.A. Mowafy. The effect of previous gamma-irradiation on
the extraction of U(VI), Th(IV), Zr(IV), Eu(III) and Am(III) by various amides.
/J. Radioanal. Nucl. Chem., 2004, 260 (1), pp.179 - 187.
12. M.C. Charbonnel, C. Musikas. Subramanian. Extraction
by N, N′-tetrabutylglutar-amides. II. Extraction of U(VI), Pu(IV) and
some fission products. /Solv. Extr. Ion Exch., 1989, 7 (6), рр. 1007-1025.
. C Shen, B. Bao, J. Zhu, Y. Wang, Z. Cao. The structure
effect of N, N, N′, N′-alkylamide in the extraction of uranium and
thorium. /J. Radioanal. Nucl. Chem. Lett., 1996, 212 (3), 187 - 196.
. L. Nigond, N. Condamines, P.Y. Cordier, J. Livet, C.
Madic, C. Cuillerdier, C. Musikas, M.J. Hudson. Recent advances in the
treatment of nuclear wastes by the use of diamide and picolinamide extractants.
/Sep. Sci. Technol., 1995, 30, pp. 2075-2099.
. T. Nakamura, C. Miyke. Extraction of Lanthanide(III) and
Uranyl(VI) from Nitric Acid Solutions by N, N’ - dimethyl-N, N’ -
dibutyl-malonamide. /Solv. Extr. Ion Exch., 1995, 13 (2), pp. 253 - 273.
. V.K. Manchanda, P.N. Pathak. Amides and diamides as
promising extractants in the back end of the nuclear fuel cycle: an overview.
/Sep. Pur. Tech., 2004, 35, pp. 85 - 103.
17. S. Sriram, V.K. Manchanda. Transport of metal ions
across a supported liquid membrane (SLM) using Dimethyldibutyltetradecyl - 1,3
- malonamide (DMDBTDMA) as the carrier. /Solvent Extr. Ion Exch. 2002, 20 (1),
pp. 97 - 114.
18. L. Nigond, C. Musikas, C. Cuillerdier. Extraction by N, N, N′,
N′-tetraalkyl-2 alkyl propane - 1,3 diamides. II. U(VI) and Pu(IV) /Solv.
Extr. Ion Exch., 1994, 12 (2), рр. 297 - 323.
19. O. Courson, M. Leburn, R. Malmbeck, G. Pagliosa, K. Rцmer, B. Sдtmark, J.-P. Glatz.
Partitioning of minor actinides from HLLW using the DIAMEX process. Part 1 -
Demonstration of extraction performances and hydraulic behaviour of the solvent
in a continuous process. /Radiochim. Acta, 2000, 88, pp. 857 - 863.
. D. Serrano-Purroy, P. Baron, B. Christiansen, J.-P. Glatz,
C. Madic, R. Malbeck, G. Modolo. First demonstration of a centrifugal solvent
extraction process for minor actinides from a concentrated spent fuel solution.
/Sep. Pur. Tech., 2005, 45, pp. 157 - 162.
21. H. Stephan, K. Gloe, J. Beger, P. Muhl. Liquid-liquid
extraction of strontium with amido podands. /Solvent Extr. Ion Exch., 1991, 9
(3), рр. 435 - 458.
. H. Stephan, K. Gloe, J. Beger, P. Muhl. Liquid-liquid
extraction of metal ions with amido podands.II. /Solvent Extr. Ion Exch., 1991,
9 (3), рр. 459 - 469.
23. Y. Sasaki, G.R. Choppin. Extraction of Np(V) by N, N′-dimethyl-N,
N′-dihexyl-3-oxapentanediamide /Radiochim. Acta, 1998, 80 (2), pp. 85 -
88.
. J. Chen, S. Wang, X. Wang. Studies on the extraction of
actinides, europium and technetium by diamide derivatives. /Proceeding of
International Conference Global 2003, New Orleans, LA, Sept. 16 - 20, 2003;
2, pp. 1915-1919.
. Y. Sasaki, G.R. Choppin. Solvent extraction of Eu, Th, U,
Np and Am with N, N′-dimethyl-N, N′-dihexyl-3-oxapentanediamide and
its analogous compounds. /Anal. Sci., 1996, 12 (2), pp. 225 - 230.
26. Y. Sasaki, G.R. Choppin. Extraction behaviors of Eu, Th, U
and Am with diamides + thenoyltrifluoroacetone. /J. Radioanal. Nucl. Chem.,
1996, 207 (2), pp. 383 - 394.
27. Y. Sasaki, T. Adachi, G.R. Choppin. Solvent extraction study
of actinide elements by N, N’ - dimethyl-N, N’ - dihexyl-3-oxapentanediamide
and thenoyltrifluoroacetone. /J. Alloy Compd., 1998, pp. 271 - 273, 799 - 802.
. Y. Sasaki, G.R. Choppin. Extraction and mutual separation
of actinide(III), (IV), (V) and (VI) ions by N, N'-dimethyl-N,
N'-dihexyl-3-oxapentanediamide and thenoyltrifluoroacetone. /Radioanal. Nucl.
Chem., 2000, 246 (2), pp. 267-273.
. Y. Sasaki, S. Tachimori. Extraction of actinides (III),
(IV), (V), (VI), and lanthanides(III) by structurally tailored diamides. /Solv.
Extr. Ion Exch., 2002, 20 (1), pp. 21 - 34.
. Y. Sasaki, Y. Sugo, S. Suzuki, S. Tachimori. The novel
extractants, diglycolamides, for the extraction of lanthanides and actinides in
HNO3 - n-dodecane system. /Solv. Extr. Ion Exch., 2001, 19 (1), pp.
91 - 103.
31. Y. Morita, Y. Sasaki, S. Tachimori. Development of
TODGA extraction process for high-level liquid waste - preliminary evaluation
of actinide separation by calculation. /Proceeding of International Conference.
Global-2001, Paris, France, Sept. 9 - 14, 2001, paper 036.
. M. Hirata, P. Guilbaud, M. Dobler, S. Tachimori. Molecular
dynamics simulations for the complexation of Ln3+ and UO22+
ions with tridentate ligand diglycolamides (DGA). /PCCP: Phys. Chem. Chem.
Phys., 2003, 5, pp. 691 - 695.
33. Y. Sasaki, S. Suzuki, S. Tachimori, T. Kimura. An innovative
chemical separation process (ARTIST) for treatment of spent nuclear fuel.
/Global 2003, New Orleans, LA, Sept. 16 - 20, 2003, 2, pp. 1266-1269.
. Z.-X. Zhu, Y. Sasaki, H. Suzuki, S. Suzuki, T. Kimura.
Cumulative study on solvent extraction of elements by N, N, N’, N’ -
tetraoctyl-3-oxapentanediamide (TODGA) from nitric acid into n-dodecane. /Anal.
Chim. Acta, 2004, 527, pp. 163 - 168.
. S. Tachimori, S. Suzuki, Y. Sasaki, A. Apichaibukol.
Solvent extraction of alkaline earth metal ions by diglycolic amides from
nitric acid solutions. /Solvent Extr. Ion Exch. 2003, 21 (5), pp. 707 - 715.
. S.A. Ansari, P.N. Pathak, V.K. Manchanda, M. Husain, A.K.
Prasad, V.S. Parmar. N, N, N’, N’, - Tetraoctyl Diglycilamide (TODGA): A
Promising Extractant for Actinide-Partitioning from High-Level Waste (HLW).
/Solv. Extr. Ion Exch., 2005, 23 (4), pp. 463 - 479.
. S. Tachimori, Y. Sasaki, S. Suzuki. Modification of
TODGA-n-dodecane solvent with a monoamide for high loading of lanthanides(III)
and actinides(III). /Solv. Extr. Ion Exch., 2002, 20 (6), pp. 687 - 699.
38. M.K. Chmutova, M.N. Litvina, N.P. Nesterova, B.F. Myasoedov,
M.I. Kabachnik. Solv. Extr. Ion Exch., 1992, 10 (3), pp. 439 - 458.
. И.В.
Смирнов. Природа аномальных эффектов при экстракции лантанидов и актинидов
бидентатными нейтральными фосфорорганическими экстрагентами: роль
гидросольватов протона. /Тезисы докладов Пятой Российской конференции по
радиохимии. Радиохимия-2006. Дубна, 23 - 27 октября, 2006. с. 108.
. S. Nave, G. Modolo, C. Madic, F. Testard. Aggregation
Properties of N, N, N’, N’ - Tetraoctyl-3-oxapentanediamide (TODGA) in
n-Dodecane. /Solv. Extr. Ion Exch. 2004, 22 (4), pp. 527-551.
. T. Yaita, A.W. Herlinger, P. Thiyagarajan, M.P. Jensen.
Influence of Extractant Aggregation on the Extraction of Trivalent f-Element
Cations by a Tetraalyldiglycolamide. /Solv. Extr. Ion Exch., 2004, 22 (4), pp.
553 - 571.
42. H. Narita, T. Yaita, K. Tamura, S. Tachimori. Study on the
extraction of trivalent lanthanide ions with N, N’ - dimethyl-N, N’ - diphenyl
malonamide and diglycolamide. /J. Radioanal. Nucl. Chem., 1999, 239 (2), pp.
381 - 384.
. Y. Sugo, Y. Sasaki, S. Tachimori. Studies on hydrolysis
and radiolysis of N, N, N’, N’ - tetraoctyl-3-oxapentane - 1,5 - diamide.
/Radiochim. Acta, 2002, 90, pp. 161 - 165.
44. Y. Sasaki, P. Rapold, M. Arisaka, M. Hirata, T. Kimura. An
additional insight into the correlation between the distribution ratios and the
aqueous acidity of the TODGA system. / Solv. Extr. Ion Exch. 2007, 25, pp.
187-204.
. S.A. Ansari, P.N. Pathak, V.K. Manchanda, M. Husain, A.K. Prasad,
V.S. Parmar. N, N, N’, N’ - Tetraoctyl diglycolamide (TODGA): a promising
extractant for actinide-partitioning from high-level waste (HLW). / Solv. Extr. Ion Exch. 2005, 23, pp. 463-479.
46.
ГОСТ 12.0.001-74 ССБТ. Опасные и вредные производственные факторы.
Классификация. - В кн.: и др. - М.: Издательство стандартов, 1981. - 10 - 13 с.
.
Вредные вещества в промышленности / Под ред. Лазарева Н.В.В 3-х т. - М,: Химия,
1977. - 677 с.
.
Пожаровзрывобезопасность веществ и материалов и средства их тушения // Справ.,
изд. в 2х книгах // под ред. Баратова А.Н., Котильченко А.Я.М.: Химия, 1997
.
ГОСТ 12.1.019-79 ССБТ. Электробезопасность. - М.: Издательство стандартов,
1985. - 44 с.
.
НПБ 105-03. Определение категорий помещений и зданий по взрывопожарной и пожарной
опасности. - М.: Гл. Упр. Гос. противопожарной службы. МВД РФ, 1996. - 322 с.
.
ГОСТ 12.1.004 - 76 ССБТ. Пожарная безопасность. Общие требования. - М.:
Издательство стандартов, 1992. - 78 с.
.
СНиП 23-05-95. Естественное и искусственное освещение. Нормы проектирования. -
М.-Стройиздат, 1995. - 48 с.
.
ГОСТ 12.4.021-75 ССБТ. Системы вентиляции. Общие требования. М.: Издательство
стандартов, 1975. - 5 - 8 с.
.
Л.П. Захаров. Техника безопасности в химической лаборатории: справ. - Л.:
Химия, 1991.-336 с.