Фундаментальные законы и теории химии
Следствие из закона Авогадро
Закон Авогадро - в равных объёмах различных
газов, взятых при одинаковых температуре и давлении, содержится одно и тоже
число молекул.
Закон был сформулирован в 1811 году Амедео
Авогадро (1776-1856), профессором физики в Турине.
Первое следствие из закона Авогадро: один моль
любого газа при одинаковых условиях занимает одинаковый объём.
При нормальных условиях, т.е. при 0° С (273К) и
101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным
объёмом газа Vm.
Второе следствие из закона Авогадро: молярная
масса первого газа равна произведению молярной массы второго газа на
относительную плотность первого газа по второму.
Задача. Найти массу неизвестного газа, если
известно, что его молярная масса вдвое больше, чем у оксида азота (II),
образец которого при н.у. занимает объём 2,24л
Решение:
1) Mr(NO) = 14+16= 30 г/моль
2) Количество вещества: v=V/
Vm
v=2,24
/
22,4 = 0,1 моль
) Найдем молярную массу неизвестного
газа:
Mr(газа)
= Mr(NO)×2
= 30 ×
2 = 60 г/моль
4) Массу газа находим из формулы:
v=m/
Mк
m= 0,1 моль×60
г/моль = 6 г
Ответ: 6 г
Строение атомов.
Природа химической связи
химический
реакция гидролиз растворимость
Что такое квантовые числа? Какие свойства
орбиталей и электронов они отражают? Какие значения принимают? Определите
максимально возможное число электронов на каждом энергетическом уровне атомов
алюминия и меди.
Квантовые числа, целые (0, 1, 2,...) или
полуцелые (1/2, 3/2, 5/2,...) числа, определяющие возможные дискретные значения
физических величин, которые характеризуют квантовые системы (атомное ядро,
атом, молекулу) и отдельные элементарные частицы.
Энергетические уровни разделяются на подуровни.
Энергию электрона на подуровне и форму атомной орбитали характеризует
орбитальное квантовое число l.
Значение l зависит от главного квантового числа n:
l принимает значения от 0 до (n-1), т. е. 0, 1, 2, 3… (n-1). В пределах данного
энергетического уровня совокупность электронов, характеризующихся одинаковым
значением l, называется энергетическим подуровнем. Подуровни обозначают
буквами:
Орбитальное квантовое число l 0 1 2 3
Обозначение энергетического подуровня s p d f
Таким образом, при l = 0, 1, 2, 3 электроны
находятся соответственно на s-, p-, d-, f-подуровнях. Электроны различных
подуровней называют s-, p-, d-, f-электронами. В этом случае говорят также о
состояниях s-, p-, d-, f-электронов или s-, p-, d-, f-атомных орбиталях.
Число энергетических подуровней в уровне не
должно превышать главное квантовое число n.
Каждый подуровень составлен из орбиталей, число
которых определяется магнитными квантовым числом ml. Магнитное
квантовое число ml определяет возможные ориентации орбитали в
пространстве. Оно связано с орбитальным квантовым числом и может принимать
целочисленные значения от -l до +l, включая ноль.
Определенному значению l соответствует (2l + 1)
возможных значений магнитного квантового числа. Число значений ml
указывает на число атомных орбиталей в подуровне и число возможных направлений,
по которым они могут ориентироваться в пространстве.
Таким образом, электроны в атоме располагаются
по энергетическим уровням, удаленность которых от ядра характеризуется
значением главного квантового числа n; уровни состоят из подуровней, число
которых для каждого уровня не превышает значение n; в свою очередь подуровень
состоит из орбиталей, количество которых задается числом значений магнитного
квантового числа m. Квантовые числа n, l, ml характеризуют орбиталь.
Кроме движения вокруг ядра, электрон вращается
вокруг собственной оси. Это движение получило название «спин». Спиновое
квантовое число ms характеризует два возможных направления вращения
электрона вокруг собственной оси (по часовой стрелке или против). Спиновое
квантовое число ms принимает два значения: +½
и -½.
Электроны с разными спинами обычно обозначаются противоположно направленными
стрелками ↓↑.
Четыре квантовых числа n, l, ml, ms полностью
характеризуют состояние электрона в атоме. Согласно принципу Паули в атоме не
может быть двух электронов с одинаковыми значениями всех четырех квантовых
чисел. Принцип Паули определяет максимальное число электронов на одной
орбитали, уровне и подуровне.
алюминий. Порядковый номер 13 , расположен в 3
периоде (3 энергетических уровня)
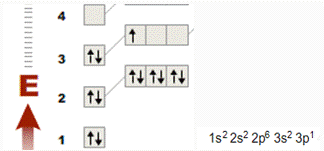
Рис.
медь. Порядковый номер 29 , расположен в 4
периоде (4 энергетических уровня)
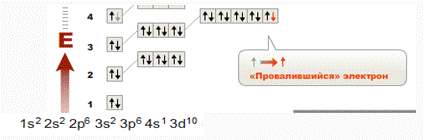
Рис.
Периодическая
система элементов (ПСЭ)
Найдите в ПСЭ два элемента, атомы которых в
невозбуждённом состоянии имеют на 3d-
подуровне пять неспаренных электронов. Напишите формулы высших оксидов этих
элементов и соответствующих этим оксидам гидроксидов. Приведите их названия.
а) хром

Рис.
Высшая степень окисления +6, формула высшего
оксида CrO3 - кислотный оксид (красный цвет). Образует кислоты - хромовая
H2CrO4 и
двухромовая H2Cr2O7.
б) марганец.
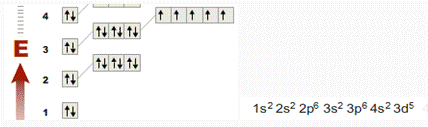
Рис.
Высшая степень окисления - +7. Формула высшего
оксида Mn2O7 (кислотный оксид). Зеленовато-бурая маслянистая жидкость (tпл=5,9
°C), неустойчив при комнатной температуре; сильный окислитель, при
соприкосновении с горючими веществами воспламеняет их, возможно со взрывом.
Образует марганцевую кислоту - HMnO4
Основные теории химических
процессов. Энергетика химических реакций
Какие типы термодинамических реакций Вы знаете?
Экзотермическая реакция - химическая реакция,
сопровождающаяся выделением теплоты
Эндотермическая реакция - химическая реакция,
сопровождающаяся поглощением теплоты.
Задача. Сколько тепла выделится при сгорании
100л угарного газа?
Решение:
Уравнение реакции:
CO(г) +1/2 O2
(г) → CO2(г)
∆H
= ∑∆Hпрод
- ∑∆Hисх
∆H
=(-393,51) - ((-110,53) + 1/2×0)
= - 282, 98 кДж/моль
Значит, при сгорании 1 моль угарного газа
выделяется 282,98 кДж теплоты. 100 л - это 100 / 22.4 = 4.46 моль СО.
Пропорция: 1 моль CO
--------------- 282,98 кДж теплоты 4.46 моль CO
------------ х кДж х = 4.46×282,98/1=1262,
09 кДж=1,262 МДж
Ответ: 1,262 МДж
Кинетика химических
реакций
Объясните зависимость скорости реакции
температуры. Приведите формулировку и математическое выражение приближенного
правила Вант - Гоффа. Поясните понятие температурного коэффициента скорость
химических реакций.
В первом приближении влияние температуры на
скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х.
Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС
при повышении температуры на каждые 10 градусов скорость химической реакции
возрастает в 2-4 раза:
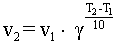
где γ
- температурный коэффициент, принимающий значения от 2 до 4.
Задача. На сколько градусов следует повысить
температуру в реакционной системе, чтобы скорость реакции возросла в 100 раз
(температурный коэффициент скорости 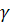 =2,78)
=2,78)
Решение:
По условию: ν2/ν1=100
∆t
= 10 ×
lg (100) / lg
(2.78)
∆t
= 45
Ответ: на 45 0С
Химическое
равновесие
Дайте формулировку принципа Ле - Шателье. На
примере обратимой реакции 2NO2(г)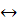 2NO(г)+
O2(г) -
Q (реакция
эндотермическая) разберите влияние концентрации веществ, давления в системе,
температуры и присутствия катализатора на химическое равновесия.
2NO(г)+
O2(г) -
Q (реакция
эндотермическая) разберите влияние концентрации веществ, давления в системе,
температуры и присутствия катализатора на химическое равновесия.
Принцип Ле-Шателье - внешнее воздействие на
систему, находящуюся в состоянии равновесия, приводит к смещению этого
равновесия в направлении, при котором эффект произведенного воздействия
ослабляется.
Увеличение давления смещает равновесие в сторону
реакции, ведущей к уменьшению объема. (в сторону обратной реакции)
Повышение температуры смещает равновесие в
сторону эндотермической реакции.(в прямом направлении)
Увеличение концентрации исходных веществ и
удаление продуктов из сферы реакции смещают равновесие в стoрону прямой
реакции. (в сторону прямой реакции)
Катализаторы не влияют на положение равновесия.
Задача. Равновесие в реакции 2NO(г)+
O2(г) 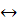 2NO2(г)
установилось при следующих концентрациях (моль/л): NO
- 0.32; О2 - 0.24; NO2
- 0.20. Рассчитайте исходные концентрации NO
и О2, а также константу равновесия.
2NO2(г)
установилось при следующих концентрациях (моль/л): NO
- 0.32; О2 - 0.24; NO2
- 0.20. Рассчитайте исходные концентрации NO
и О2, а также константу равновесия.
Решение:
р = [NO2]2/([O2]∙[NO]2)
= 0,22/(0,24∙0,322) = 1.62
Исходные концентрации равны сумме равновесных
концентраций и концентраций вступивших в реакции веществ. Последние можно
определить из стехиометрических соотношений:
NO
+
O2
⇄
2NO2
[NO]прореаг.
=
[NO2]
=
0.2 моль/л;
[O2]прореаг.
= 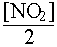 = 0.1 моль/л.
= 0.1 моль/л.
Отсюда: [NO]0
= [NO] + [NO]прореаг.
= 0.2 + 0.32 = 0.52 моль/л;
[O2]0
=
[O2]
+
[O2]прореаг.
=
0.1 +
0.24 =
0.34 моль/л.
Растворы
Что такое растворимость? Влияние различных
факторов на растворимость. Что такое коэффициент растворимости? В каких
единицах он выражается?
Растворимость - способность вещества
образовывать с другими веществами однородные системы - растворы, в которых
вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Растворимость выражается концентрацией растворённого вещества в его насыщенном
растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к
100 г или 100 см³ (мл)
растворителя (г/100 г или см³/100
см³).
Растворимость газов в жидкости зависит от
температуры и давления. Растворимость жидких и твёрдых веществ - практически
только от температуры.
Коэффициент растворимости - масса вещества,
содержащаяся в 100 г растворителя для получения насыщенного раствора при данной
температуре. По величине коэффициента растворимости твердые вещества делят на
хорошо растворимые (S >10 г), малорастворимые (10 г > S > 0,01 г) и
практически нерастворимые (S < 0,01 г). Обычно при повышении температуры
растворимость твердых веществ увеличивается, газов - уменьшается.
Задача. Вычислите молярную концентрацию
эквивалента и молярную концентрацию 16% - ного раствора хлорида алюминия,
плотность которого 1.149г/мл.
Решение:
) Молярная масса AlCl3:
Mr(AlCl3)
= 133,5 г/моль, фактор эквивалентности равен f = 1/3
) Найдем массу вещества, содержащуюся в 1
литре раствора:= 1000×1.149×0.16
= 183.84 г
) Число моль v
= 183.84/133.34 = 1.38 моль
) Молярность раствора рассчитывается по
формуле:
СM = m/M(AlCl3) = 1.38
(моль/литр)
) Нормальность СN = M/f = СM×3
= 1.38×3=
4.14
) Моляльность Сm = v×1000/(1149-183.84)
= 1.38×1000/965.16
= 1.429
Растворы
неэлектролитов
Дайте определения понятию «разбавленный
раствор». Объясните, почему изменяется температура кипения растворов по
сравнению с чистом растворителем.
Разбавленный раствор - раствор с низким
содержанием растворённого вещества.
Понижение давления насыщенного пара воды
(растворителя) над раствором приводит к повышению температуры кипения и
понижению температуры плавления раствора по сравнению с температурами кипения и
плавления чистого растворителя.
Задача. При какой температуре будет кипеть 50% -
ный раствор сахарозы С12Н22О11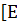 (Н2О)=0.52
(Н2О)=0.52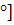 ?
?
Решение:
Допустим дан 1 кг воды в которой растворена
сахароза, тогда:
= 100×
(С12Н22О11)/( m (С12Н22О11
)+ 1000)(С12Н22О11) = 1000 г= 1000/342 = 2,92
моль/кг
Δt = 2,92×0,52
= 1,52°Скип. = 100 + 1,52 = 101,52°С
Ответ: 101,52°С
Растворы
электролитов
Дайте определение понятию «степень
электролитической диссоциации». Приведите формулу для расчета степени
диссоциации.
Отношение числа диссоциированных молекул к
общему числу растворенных молекул называется степенью диссоциации (α).
Степень диссоциации выражают в долях единицы или в процентах.
В зависимости от степени диссоциации веществ в
0,1 н растворе при 298К электролиты иногда условно подразделяют на сильные α>0,3;
средние 0,3<α>0.03
и слабые α<0,03.
Степень диссоциации зависит от химической
природы вещества, температуры, концентрации и увеличивается с понижением
концентрации и увеличением температуры раствора.
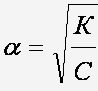
К - константа диссоциации
С- концентрация раствора
Задача. Рассчитайте, во сколько раз изменится
степень диссоциации слабой кислоты, если разбавить раствор в 25 раз.
Решение:
) По условию - электролит слабый,
поэтому:= С×α2
) Константа диссоциации не изменяется при
разбавлении, поэтому выражения для исходного и разбавленного растворов можно
приравнять:
С1α12
= С2α22
С1α12
= 1/25×С2(α1)2
С1α12
= 1/25С1×α22
|:С1
α 12
=
25×
α
22
n = α
12/ α
22 = 25. α
= 5 раз
Ионное произведение
воды. Водородный показатель рН
Дайте определенное понятия понятие «Водородный
показатель» . Приведите формулу для его определения. Какие значение рН
характерны для кислого раствора? Водородный показатель, pH - мера активности (в
очень разбавленных растворах она эквивалентна концентрации) ионов водорода в
растворе, и количественно выражающая его кислотность, вычисляется как
отрицательный (взятый с обратным знаком) десятичный логарифм активности
водородных ионов, выраженной в молях на литр:
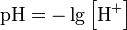
Кислая среда рН<7
нейтральная среда рН = 7
Щелочная среда рН> 7
Задача. Концентрация ионов водорода Н+
равна 4.47×10-8моль/л.
Определите рН раствора.
Решение:
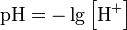
pH = 7.35
Гидролиз солей
Почему растворимые соли щелочных и
щелочноземельных металлов не гидролизуются по катиону? Привести 2 примера
молекулярных и ионных уравнений соответствующих реакций.
Соли щелочных и щелочных металлов образованы из
сильных оснований. Поэтому гидролиз будет проходить только по аниону
(кислотному остатку слабой кислоты)
СH3СООNa
+ HOH →
СH3СООH
+ NaOH
СH3СОО-
+ Na+
+ HOH →
СH3СООH
+ Na+
+ OH-
СH3СОО-
+ HOH →
СH3СООH
+ OH-
(рН>7)
Ba(NO2)2 + HOH
→ Ba(OH)NO2+HNO2
Ba 2+ + 2NO2-+
HOH → Ba(OH)NO2-+HNO2
Задача. Рассчитать рН в растворе ацетата натрия
концентрацией 0.1моль/л. (Кдис.СН3СООН= 1.8 ×10-5)
Решение:
СН3СООН - слабый электролит,
диссоциирует обратимо:
СН3СООН↔ СН3СОО-
+ Н+
1) Степень диссоциации вычисляем по закону
разбавления Оствальда:
α=√К/С = √
1.8 ×10-5
/ 0,1 = 1,34 ×10-2
2) Определяем концентрацию катионов
водорода:
[H+] = α
× CM
= 1,34
×10-2
× 0.1 = 1.34 ×10-3
) Вычисляем водородный показатель:
рН = -lg
[H+]
= - lg(1.34 ×10-3)
= 2.87
Буферные растворы
Перечислите основные свойства буферных
растворов.
Способность раствора поддерживать определенное
значение рН называется буферным действием, а растворы, обладающие таким
свойством, называются буферными.
Важным свойством буферных растворов является их
способность сохранять постоянное значение рН при разбавлении раствора. Растворы
кислот и оснований не могут называться буферными растворами, т.к. при
разбавлении их водой рН раствора изменяется.
Задача. В каких молярных отношениях следует
взять растворы солей дигидрофосфата и гидрофосфата натрия, чтобы получить
буферную систему с рН = 6.35? Кд(по2-ступени Н3РО4)= 6.2 ×
10-8
Решение:
Фосфатный буфер:
Соли фосфатного буферного раствора NaH2PO4
и Na2HPO4
диссоциируют
по схемам:
NaH2PO4↔
Na+ + H2PO4-
Na2HPO4↔
2Na+ + HPO42-
1) рН
= 6,35, тогда
[H+] = 4,47×
10-7
) [H+] = Kд
С кисл/Ссоли
,47×
10-7 = 6.2 × 10-8
С кисл/Ссоли
С кисл/Ссоли = 4,47×
10-7/= 6.2 × 10-8
С кисл/Ссоли =7,2
Молярные соотношения, например, NaH2PO4
- 7.2 моль; Na2HPO4
- 1 моль
Окислительно -
восстановительные реакции
Дайте определение окислительно-восстановительным
реакциям. Какие реакции называются реакциями внутримолекулярными
окисления-восстановления? Приведите пример. Определите в данной реакции
молярную массу эквивалента окислителя.
Химические реакции, протекающие с изменением
степени окисления элементов, входящих в состав реагирующих веществ, называются
окислительно-восстановительными.
Во внутримолекулярных реакциях окислитель и
восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции
протекают, как правило, при термическом разложении веществ, содержащих
окислитель и восстановитель.
(NH4)2Cr2O7→Cr2O3
+ N20
+ H2O
N-3
- 6е →N20
6| ×1-
восстановитель, окисление
Cr+6
+6e →2Cr+3 6|
×1-
окислитель, восстановление (Mrэкв
= 52/6 = 8,66 г/моль-экв)
(NH4)2Cr2O7→Cr2O3
+ N2
+ 4H2O
Задача. Какой объем хлора (н.у.) можно получить
при взаимодействии 200мл 18%-ного раствора перманганата калия (плотность
раствора 1.12г/мл) с раствором соляной кислоты?
KMnO4
+ HCl→ KCl
+ MnCl2
+ Cl2↑
+ H2O
|
Mn+7
+5ē
→ Mn+2
|
×2
|
|
2Cl-1
- 2ē
→ Cl20
|
×5
|
------------------------
Mn+7 + 10Cl-1 → 2Mn+2 + 5Cl20
KMnO4 + 16HCl→ 2KCl
+ 2MnCl2 + 5Cl2↑ + 8H2O
1) Найдем массу 200 мл перманганата калия: m=ρ×V
m= 1.12 ×
200 = 224 г
) Рассчитаем массу 18%-ного раствора:
w= m(в-ва)/m(p-pa)
×
100%
m(в-ва) = w×
m(p-pa)
/100% = 18% × 224 / 100% = 40.32
г
3) Mr(KMnO4)
= 158 ×
2 = 316
) Из пропорции найдем объем выделившегося
хлора:
,32 г - V
г/моль - 5 ×
22,4 л/моль
V = 40,32×
5 ×
22,4/ 316 = 14.29 л
Ответ: 14.29 л
Комплексные
соединения
Какая ковалентная связь называется
донорно-акцепторной? Какой атом или ион является донором, а какой акцептором в
следующих комплексных ионах: 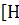 3
3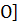 +,
+, 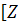 n(NH3)4]
2+,
[BF4]- ?
n(NH3)4]
2+,
[BF4]- ?
У атома бора в ионе [BF4]- после
образования связей с атомами фтора остается одна свободная валентная орбиталь -
акцептор.  3
3 +
обладает электроном - донор.
+
обладает электроном - донор.
 n(NH3)4]
2.
У азота есть свободные электроны - донор
n(NH3)4]
2.
У азота есть свободные электроны - донор
Донорно-акцепторный механизм (иначе
координационный механизм) - способ образования ковалентной химической связи
между двумя атомами или группой атомов, осуществляемый за счет неподеленной
пары электронов атома-донора и свободной орбитали атома-акцептора.
тетрагидроксоалюминат (III)
натрия Na[Al(OH)4]
гексацианоферрат (III)калия
K4[Fe(CN)6]
дихлородинитроплатинат(II)
натрия. Na2[Pt(NO2)2Cl2]
Химия элементов: s
- элементы
Дайте сравнительную характеристику элементов IA
подгруппы в свете теории электронного строения атомов. Как изменится атомный
радиус, энергия ионизации и сродства к электрону при переходе от лития к
францию. Как щелочные металлы реагируют с кислородом, галогенами, серой.
Приведите уравнение реакции.
Щелочные металлы - это элементы 1-й группы
периодической таблицы химических элементов (главной подгруппы I
A группы) - литий
Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. При растворении
щелочных металлов в воде образуются растворимые гидроксиды, называемые
щелочами.
У всех этих элементов абсолютно одинаково
построен последний валентный слой, они все имеют конфигурацию s1.
Очевидно, что валентные электроны щелочных
металлов могут быть легко удалены, потому что атому энергетически выгодно
отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех
щелочных металлов характерны восстановительные свойства. Это подтверждают
низкие значения их потенциалов ионизации (потенциал ионизации атома цезия -
один из самых низких) и электроотрицательности (ЭО).
Таблица
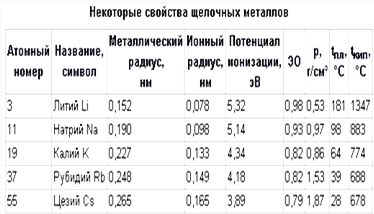
Номер группы, как правило, указывает на число е,
способных участвовать в образовании хим. связей (валентные электроны). -
физический смысл номера группы.
Важнейшие характеристики атомов: размеры,
энергия ионизации, сродство к электрону, электроотрицательность.
Атомные радиусы - орбитальные радиусы атомов
изменяются периодически. В группах с ростом заряда ядер ОР атомов
увеличиваются. В главных подгруппах такое увеличение происходит в большей
степени. Радиус лития меньше радиуса франция. С увеличением порядкового номера
радиус атома увеличивается
Энергия ионизации - минимальная Е, которую
требуется затратить на то, чтобы удалить данный е с атомной орбитали
невозбужденного атома на большее расстояние от ядра без сообщения ему
кинетической энергии. По сути энергия ионизации характеризует металлические
свойства. В 1 подгруппе металлические свойства от лития к францию уменьшаются,
следовательно, энергия ионизации уменьшается.
Сродство к электрону атома - энергия, которая
выделяется (или затрачивается) при присоединении в нейтральному атому е с образованием
отрицательного иона. В подгруппах сверху вниз уменьшается, но не всегда
монотонно.
А) Взаимодействие с кислородом. Продукты горения
щелочных металлов на воздухе имеют разный состав в зависимости от активности
металла.
Только литий сгорает на воздухе с образованием
оксида стехиометрического состава:
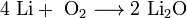
При горении натрия в основном образуется
пероксид натрия с небольшой примесью надпероксида натрия:

В продуктах горения калия, рубидия и цезия
содержатся в основном надпероксиды:
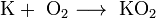
Б) Взаимодействие с другими веществами. Щелочные
металлы реагируют со многими неметаллами. При нагревании они соединяются с
галогенами, серой с образованием, соответственно, галогенидов, сульфидов:
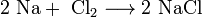
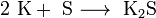
Химия элементов: р
- элементы
Докажите амфотерность оксида и гидроксида
алюминия, написав уравнения реакций.
Амфотерность (двойственность свойств)
гидроксидов и оксидов многих элементов проявляется в образовании ими двух типов
солей.
Например, для гидроксида и оксида алюминия:
а) 2Al(OH)3
+ 3SO3 = Al2(SO4)3 + 3H2O2О3
+ 3H2SO4 = Al2(SO4)3 +
3H2O
б) 2Al(OH)3
+ Na2O = 2NaAlO2 + 3H2O (в
расплаве)2О3
+ 2NaOH(т) = 2NaAlO2
+ H2O
(в расплаве)
В реакциях (а) Al(OH)3 и Al2О3
проявляют свойства основных гидроксидов и оксидов, то есть они подобно щелочам
реагируют с кислотами и кислотными оксидами, образуя соль, в которой алюминий
является катионом Al3+.
Напротив, в реакциях (б) Al(OH)3 и Al2О3
выполняют функцию кислотных гидроксидов и оксидов, образуя соль, в которой атом
алюминия Al(III) входит в состав аниона (кислотного остатка) AlО2−.
Сам элемент алюминий проявляет в этих
соединениях свойства металла и неметалла. Следовательно, алюминий - амфотерный
элемент.
Задача. При пропускании сероводорода через
бромовую воду окраска, присущая брому, исчезла, одновременно образовалась 0,64
г серы. Какая масса брома вступила в реакцию?
H2S
+ Br2
→ S + 2HBr
Решение:
1) Найдем количество образовавшейся серы
v=m(S)/Mr
v=0.64 / 32 = 0.02
моль (это количество соответствует количеству брома)
2) Mr
(Br2)
= 160 г/моль
Найдем массу брома, вступившего в реакцию:
m=v
×
Mr (Br2)
= 0.02 ×
160 = 3.2 г
Ответ: 3,2 г
Химия элементов: d
- элементы
Приведите орбитальную диаграмму и электронную
формулу атома марганца. Какие валентные возможности и степени окисления
проявляет марганец в соединениях? напишите формулы оксидов, гидроксидов,
кислот,солей марганца. Какими свойствами обладает оксид марганца(II)
и оксид марганца(VII)
.
Напишите уравнение реакций, подтверждающие эти свойства.
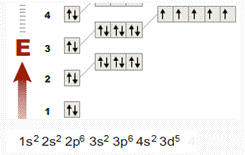
Рис.
Характерные степени окисления марганца: +2, +3,
+4, +6, +7 (+1, +5 мало характерны).
При окислении на воздухе пассивируется.
Порошкообразный марганец сгорает в кислороде (Mn + O2 → MnO2).
Марганец при нагревании разлагает воду, вытесняя
водород
(Mn + 2H2O →(t) Mn(OH)2
+ H2↑), образующийся гидроксид марганца замедляет реакцию.
Марганец образует следующие оксиды: MnO, Mn2O3,
MnO2, MnO3 (не выделен в свободном состоянии) и
марганцевый ангидрид Mn2O7.2O7 в
обычных условиях жидкое маслянистое вещество тёмно-зелёного, очень
неустойчивое; в смеси с концентрированной серной кислотой воспламеняет
органические вещества. При 90 C Mn2O7 разлагается со
взрывом. Кислотный оксид, ему соответствует кислота - HMnO4
(марганцовая кислота).
Наиболее устойчивы оксиды Mn2O3
и MnO2, а также комбинированный оксид Mn3O4
(2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) со щелочами
в присутствии кислорода образуются манганаты:
2MnO2
+ 4KOH + O2
→ 2K2MnO4
+ 2H2O
(оксид марганца II) - Mn(OH)2
(гидроксид марганца II).
Гидроксид Mn(OH)2 проявляет все
свойства оснований, его отличительная особенность - окисление кислородом воздуха
до гидроксида марганца(IV) бурого цвета:
Mn(OH)2 + О2 + 2Н2О
= 2Mn(OH)4.
Соли марганца(II) обычно розового цвета, а в
растворах - бесцветные, устойчивые на воздухе. Соли марганца(II) служат
реактивом на озон. Пропитанная раствором хлорида марганца(II) бумага в
присутствии озона чернеет:
Сl2 + О3 + 3Н2О
= Mn(OH)4 + 2HCl + O2.