Синтез ароматических полиаминосоединений - высокоэффективных мономеров для ПБИ
Введение
Полимерные
материалы играют все большее значение в жизнедеятельности человека. Они
используются в машиностроении
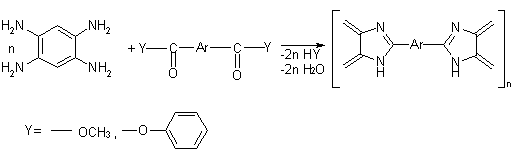
<#"555934.files/image001.gif">
где
X = разные
Схема
1
Вскоре,
Фогель и Марвелл [13] исследовали реакцию дифениловых эфиров ароматических
дикарбоновых кислот с бис-о-фенилендиамином в расплаве при 220-280°С, а затем
при температуре 400°С (при 0,1 мм рт. ст.) в твердой фазе. В результате реакции
были получены полностью ароматические ПБИ с высокой термостойкостью, что и
привлекло к ним внимание исследователей.
В
дальнейшем среди возможных путей создания термостойких полимеров наибольшее
развитие получил поликонденсационный метод синтеза ПБИ, а именно,
полициклоконденсация (ПЦК). К наиболее распространенным методам синтеза ПБИ,
являющихся продуктами взаимодействия о,о'-ароматических тетрааминов с
ароматическими дикарбоновыми кислотами или их производными относятся [14,15,16]
)
Синтез в расплаве или реакция Марвела [17,18,19,20,21,22];
)
Полициклоконденсация (ПЦК) в ПФК или реакция Ивакуры [23];
)
ПЦК в реагенте Итона (РИ) [24];
)
Двухстадийная ПЦК [23].
)
Реакция восстановительной полигетероциклизации (ВПГЦ) [25,26].
Все
эти процессы в большей или меньшей степени используются для получения
полибензимидазолов.
.1
Синтез в расплаве или реакция Марвела
Синтез
ПБИ по реакции Марвела заключается в сплавлении о,о'-дизамещенных ароматических
тетрааминов с ароматическими дикарбоновыми кислотами [27] или их производными с
последующей твердофазной термообработкой продуктов реакции в среде инертного
газа или в вакууме по нижеприведенной схеме. В качестве производных
ароматических дикарбоновых кислот наиболее часто используются эфиры,
диметиловые или дифениловые, в частности, доступной изофталевой кислоты (ИФК)
[16-21,28,29,30,31]
Схема
2
причем
лучшие результаты получаются во втором случае [28-31], что связано с рядом
обстоятельств:
- более высокой электрофильной реакционной способностью
дифениловых эфиров дикарбоновых кислот по сравненю с самими дикарбоновыми
кислотами или их диметиловыми эфирами [32];
- пластифицирующим влиянием выделяющегося фенола на
образующуюся полимерную систему, определяющим повышение ее подвижности и
облегчающим как протекание реакций по концевым группам, приводящих к увеличению
молекулярных масс полимеров, так и интенсификацию реакций внутримолекулярной
циклизации, приводящих к повышению степеней циклизации этих систем [32,33,34];
- каталитическим действием фенола, выделяющегося в
качестве побочного продукта и способствующего как увеличению молекулярных масс,
так и увеличению степеней циклизации ПБИ.
Синтез
ПБИ в условиях реакции Марвела обладает такими достоинствами, как осуществление
процесса в отсутствие растворителей, возможность достижения высоких молекулярных
масс и степеней циклизации полимеров.
Реакция
Марвела с применением дифениловых эфиров ароматических дикарбоновых кислот была
успешно использована при синтезе незамещенных ПБИ, поли-N-алкилбензимидазолов,
поли-N-арилбензимидазолов, поли-1,2-ариленбензимидазолов.
Однако,
этому процессу присущи и отдельные недостатки:
-
необходимость использования в
качестве исходных соединений свободных ароматических тетрааминов, отдельные
представители которых очень неустойчивы к окислению;
- необходимость использования для достижения высоких
степеней циклизации и молекулярных масс ПБИ высокой (до +400°С) температуры и,
желательно, вакуума, что создает значительные трудности в аппаратурном
оформлении процессов. Кроме того, синтез ПБИ при столь высоких температурах
приводит к протеканию нежелательных побочных и вторичных процессов (сшивки,
деструкции и т. д.), часто негативно отражающихся на свойствах целевых
полимеров.
.2
Полициклоконденсация в ПФК или реакция Ивакуры
Одним
из наиболее распространенных каталитических методов синтеза ПБИ является
реакция ПЦК в ПФК или «реакция Ивакуры» [23]. Синтез полибензимидазолов по
реакции Ивакуры осуществляется в соответствии со схемой [35];
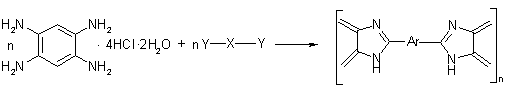
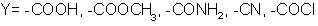
Схема
3
Известно
[23], что ПФК действует одновременно как сильная протонная кислота и кислота
Льюиса. Как следствие, она увеличивает положительный заряд на углеродном атоме
карбонильной группы и тем самым приводит к повышению его электрофильной
реакционной способности. С учетом этого факта общий механизм образования
полибензимидазолов в ПФК был представлен Ивакурой с сотрудниками в следующем
виде:
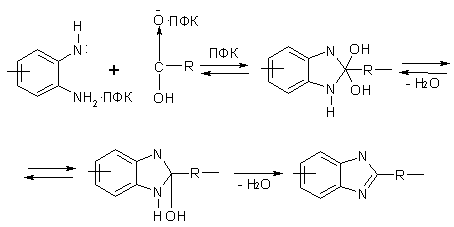
Схема
4
Синтез
ПБИ в ПФК осуществляется в гомогенных условиях в интервале температур 150-200°С
и приводит к получению высокомолекулярных и хорошо зациклизованных продуктов.
Термодинамически движущей силой реакции синтеза полибензимидазолов в ПФК
является образование ароматических гетероциклов [36]. С учетом возможности
диссоциации амидных связей в ПФК на исходные амины и карбоновые кислоты следует
принять, что нарастание молекулярных масс ПБИ в ПФК осуществляется за счет
образования гетероциклических фрагментов.
Несмотря
на очевидные достоинства синтеза ПБИ в ПФК:
- достижения высоких молекулярных масс и степеней
циклизации в сравнительно мягких условиях;
- возможность использования нестойких
тетрафункциональных нуклеофильных соединений в виде их гидрохлоридов, что, в
частности, позволило получить в последние годы семейство
стержневидныхмакромолекул ПБИ;
существуют
и недостатки в протекании синтеза:
- высокая коррозионная активность ПФК;
- высокая вязкость растворов полимеров ПФК;
.3
Полициклокондесация в реагенте Итона
Реактив
Итона представляет собой раствор Р205 в
метансульфокислоте в весовом соотношении 1:10 [37]. Этот реагент может
использоваться в качестве растворителя и конденсирующего агента для получения
высокомолекулярных стержнеобразных ПБИ [24,38]. Так, ПЦК гидрохлоридов
3,3'-диаминобензидина (ДАБ) и 3,3'-дигидроксибензидина с различными
ароматическими и алифатическими дикарбоновыми кислотами в смеси Р205:СН3SО3Н
были получены высокомолекулярные волокно- и пленкообразующие полимеры со
значениями приведенной вязкости, в зависимости от условий проведения синтеза,
до 6 дл/г (в H2S04, при 25°С) [37].
Данный
метод, несомненно, имеет преимущества перед традиционными методами синтеза ПБИ
благодаря:
-
высокой скорости процесса при
относительно невысоких температурах (100-140°С), что обеспечивается эффективным
действием смеси Р205:СН3SО3Н как растворителя
и конденсирующего агента;
- хорошей растворяющей способностью исходных соединений
для синтеза ПБИ, что позволяет проводить синтез в гомогенных условиях, а также
невысокой вязкостью даже при комнатной температуре;
- возможность использования гидрохлоридов тетрааминов,
неустойчивых к окислению на воздухе, что позволяет расширить базу получаемых
ПБИ.
Однако
ему присущи и существенные недостатки:
-
летучесть, токсичность и дороговизна
метансульфокислоты, а также гигроскопичность пентаксида фосфора и его
склонность к гидролизу;
-
чрезвычайная агрессивность реагента и
его сильная коррозионная активность при повышенных температурах;
-
ограниченное использования в качестве
мономеров соединений, содержащих лактонные, фталидные и фталимидные
группировки, поскольку в среде РИ они являются центрами разветвлений, что
приводит к получению полимера трехмерного строения;
необходимость
разбавления реакционных растворов перед их осаждением, что приводит к
увеличению объёма, как растворителей, так и осадителей;
-
разложение реагента выше 150°С с
выделением продуктов деструкции, которые могут вступать в реакцию с исходными
соединениями, нарушая эквимольность, а также сульфирование образующегося
полимера при температурах деструкции [39,40].
.4
Двустадийная полициклоконденсация
Универсальным
методом синтеза ПБИ представляется двустадийная ПЦК [14, 16, 24, 41],
предполагающая четкое разделение стадий синтеза форполимеров и их циклизацию.
Обычно первые стадии подобных процессов осуществляются путем взаимодействия
ароматических тетрааминов с дихлорангидридами ароматических дикарбоновых кислот
в среде амидных растворителей при температурах, не превышающих 30°С, после чего
образовавшиеся форполимеры либо перерабатываются в изделия (пленки, волокна)
или выделяются из реакционных растворов, тщательно отмываются от растворителей
и побочных продуктов реакции и затем подвергаются термической твердофазной
полициклодегидратации:
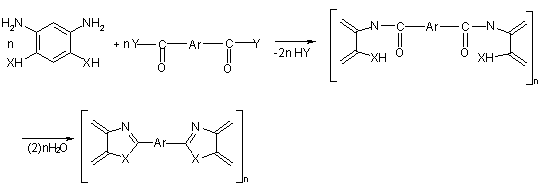
где X= NH, -NR-; Y= OH-, Cl-;
R=H-, Alk-, C6H5-; R’= Alk-, C6H5-
Схема
5
Необходимым
условием успешного протекания этого процесса является селективность
низкотемпературного полиамидирования, определяемая сравнительной нуклеофильной
реакционной способностью соседних функциональных групп ароматических
тетрааминов и электрофильной реакционной способностью ацилирующих агентов [42,
43].
Реакции
термической твердофазной полициклодегидратации о-замещенных полиамидов,
приводящие к образованию целевых ПБИ обычно осуществляются путем ступенчатого
подъема температуры от комнатной до 300-350°С и проводятся в вакууме или
инертной атмосфере. Подобные реакции успешно используются, как для получения
поли-N-арилбензимидазолов, так и незамещенных ПБИ.
Процессу
присущ ряд существенных недостатков:
-
необходимость использования в
качестве мономеров свободных ароматических или специально синтезированных
N-замещенных тетрааминов;
-
проблематичность осуществления в ряде
случаев селективного полиамидирования;
- необходимость осуществления процесса твердофазной
полициклодегидратации форполимеров при высокой температуре (300-350°С) в
вакууме, что существенно осложняет аппаратурное оформление процесса;
- проблематичность достижения высоких степеней
циклизации полибензимидазолов в условиях твердофазной полициклодегидратации.
.5
Реакция восстановительной полигетероциклизации
Синтез
ПБИ этим методом осуществляется путем получения о-нитрозамещенных гетероцепных
полимеров (ароматических полиамидов) с последующим восстановлением нитрогрупп
до аминогрупп и одновременной циклизацией полученных полимеров в соответствии
со схемой [25, 26]:
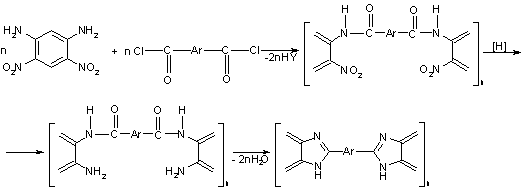
Схема
6
Сопоставление
схем синтеза ПБИ традиционным методом и методом восстановительной ПГЦ
свидетельствует о наличии у последнего ряда существенных преимуществ:
-
в качестве исходных соединений в
реакции ВПГЦ используются о,о'-динитрозамещенные бифункциональные мономеры,
которые значительно доступнее, дешевле и устойчивее к окислению по сравнению с
ароматическими тетрааминами, применяемыми в традиционном методе синтеза
полибензимидазолов;
- использование о,о'-динитрозамещенных бифункциональных
соединений позволяет проводить первые стадии синтеза полибензимидазолов
(селективное полиамидирование) без протекания побочных процессов. Это
определяет возможность применения во всех случаях в качестве ацилирующих
агентов доступных иреакционноспособных дихлорангидридов дикарбоновых кислот;
побочный
продукт первой стадии реакции (НС1), связанный амидным растворителем, можно
непосредственно использовать в сочетании с различными металлами и в первую очередь
с активированным железом для восстановления нитрогрупп в аминогруппы, а также,
для катализа образования бензимидазольныхциклов [44, 45];
Реакции
восстановительной ПГЦ предпочтительнее проводить в виде непрерывных процессов в
среде N-метил-2-пирролидона (N-МП), являющегося эффективным растворителем
гетероцепных и гетероциклических полимеров. Обязательным условием успешного
протекания процесса является растворимость полимеров на всех стадиях процесса,
поскольку в противном случае выделяющийся из растворов полимер обволакивает
активированное железо, что затрудняет дальнейшее протекание процесса. К
недостаткам метода можно отнести следующие:
-
трудность удаления из полимеров солей
железа, отрицательно влияющих на электрофизические и термические характеристики
материалов на основе ПБИ;
- возможная неполнота протекания полигетероциклизации,
определяющая наличие в целевых ПБИ незациклизованных и, соответственно, менее
стабильных фрагментов.
.
Механизм реакции гетерополиконденсации
По
мнению Коршака и других [46] процесс происходит следующим образом:
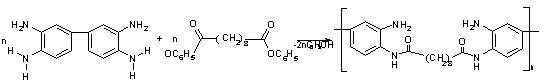
Схема
7
На
2-ой стадии происходит дегидроциклизация полиаминоамина с образованием
имидазольного цикла:
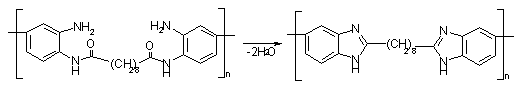
Схема
8
Вразидло
и Левин [47] предположили механизм, что образование имидазольного гетерацикла
при синтеза полибензимидазолов протекает по следующему механизму:
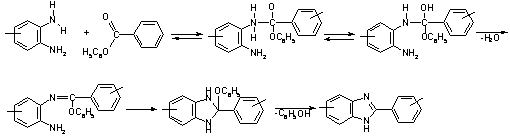
Схема
9
Грей
и сотрудники [48] предложили механизм, в котором после стадии образования
полиаминоамида предполагается промежуточное образование
гидроксибензимидазольной структуры, которая далее дегидратируется, образуя
бензимидазол:
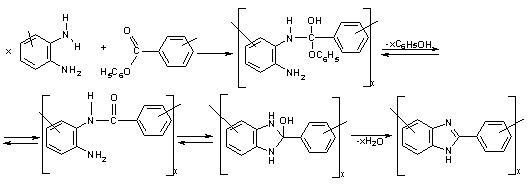
Схема
10
Поэтому,
не полностью циклизованный полимер имеет следуещее строение:
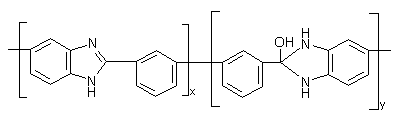
Схема
11
синтез ароматический мономер
полибензимидазол
3. Свойства полибензимидазолов
.1 Жесткоцепные полибензимидазолы
Полимеры, полученные с использованием 3,3’ -
диаминобензидина, например: обладают исключительно высокой
термостойкостью, выделяя летучие продукты при нагревании, начиная с температуры
400-600°С [49, 50-54].
Схема 12
Так,
полибензимидазолы на основе изомерных фталевых кислот при нагревании в инертной
атмосфере до 600°С теряют около 5%, до 700°С-13% массы. Полимеры на основе 2,7-
и 2,3- нафталиндикарбоновых кислот менее стабильны. Они теряют 25-30% массы при
500°С. Термостойкость полимеров на основе 2,6-нафталиндикарбоновой кислоты на
воздухе и в инертной атмосфере близка к термостойкости полимеров на основе
фталевых кислот; а 2,3-нафталиндикарбоновой кислоты - к алифатическим аналогам.
Эти результаты можно объяснить меньшей делокализацией π-связей в ядре нафталина по сравнению
с бензолом, и, следовательно, их неравноценностью.
Большинство ПБИ растворимо на холоду только в
концентрированных серной и муравьиной кислотах. Некоторые ПБИ, содержащие в
боковой группе или основной цепи объемные заместители, растворимы в амидных
растворителях и ДМСО.
При сравнении аналогичных ПБИ, синтезированных в
полифосфорной кислоте и методом поликонденсации дифениловых эфиров дикарбоновых
кислот с 3,3’-диаминобензидином, ПБИ, полученные в полифосфорной кислоте,
растворимы лучше, но термостойкость несколько хуже.
.2 Ароматические ПБИ с мостиковыми группами в цепи и
заместителями в гетероцикле или в бензольном кольце
ПБИ на основе 3,3’,4,4’- тетрааминодифенилового эфира
и различных дикарбоновых кислот [55, 56]:
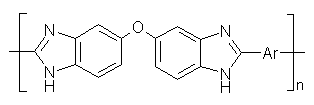
 , где Ar =
, где Ar =
Схема 13
Введение проcтой эфирной связи между бензимидазольными циклами придает полимерам
повышенную растворимость по сравнению с ПБИ на основе 3,3’ -
диаминобензидина. Кроме концентрированных H2SO4 и HCOOH они полностью растворяются в ДМСО и амидных
растворителях. Исследование термостойкости этих полибензимидазолов показало,
что они достаточно термостойки (потери в массе наблюдаются при температурах
480-500°С), но несколько уступают по термостойкости аналогичным полимерам без
мостиковой группы [57].
Нараяном и Марвелом [58] твердофазной поликонденсацией
синтезированы полибензимидазолы, содержащие сульфоновую группу между
бензимидазольными фрагментами:
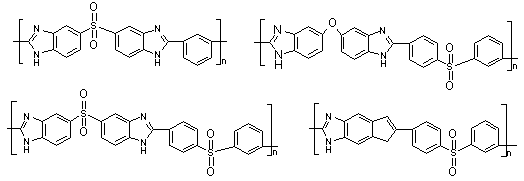
Схема 14
Все полученные полимеры, кроме ПБИ на основе
тетрааминобензола растворимого лишь частично, растворяются в амидных
растворителях, ДМСО и концентрированных H2SO4 и HCOOH, но уступают по термостойкости полибензимидазолам с
кислородным мостиком и имеют также невысокие молекулярные массы, что может быть
связано с низкой нуклеофильностью 3,3’,4,4’- тетрааминодифенилсульфона.
Коршаком В.В., Цейтлинем Г.М. и Павловым А.И. [59]
были синтезированы ПБИ с карбонильной группой в цепи из дифенилизофталата и
3,3’,4,4’-тетрааминобензофенона:
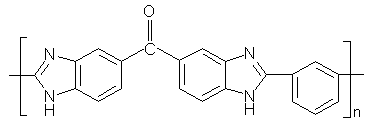
Схема 15
Полученный полимер растворяется в концентрированных H2SO4 и HCOOH
на холоду, а при нагревании - ДМАА и крезоле.
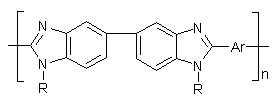
Коршаком с сотрудниками [60] синтезирован ряд полибензимидазолов
на основе 3,3’,4,4’-тетрааминодифенилметана и дифениловых эфиров дикарбоновых
кислот:
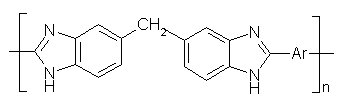
 ,где Ar =
,где Ar =
Схема 16
Полибензимидазолы, содержащие группу CH2 между бензимидазольными циклами, обладают
относительно лучшей растворимостью по сравнению с ПБИ на основе 3,3’ -
диаминобензидина, а по термостабильности незначительно уступают полностью
ароматическим полимерам [49, 53, 54].
ПБИ на основе дикарбоновых кислот, содержащих наряду с
ароматическими ядрами метиленовые группы, например m- и n-
фенилендиуксусные кислоты [61, 62]:
 , где X= -O-
, где X= -O-
Схема 17
растворимы в H2SO4 и ДМАА, имеют низкие температуры стеклования
(280-290°С).
Полибензимидазолы, содержащие метильные заместители в
бензольном ядре и (или) гетероцикле [63]: растворимы в ДМФА, пиридине,
бензиловом спирт, крезолах, циклогексаноле. Они обладают также достаточно
высокой термостойкостью, их интенсивное разложение при нагревании на воздухе
начинается при температурах 440-480°С.
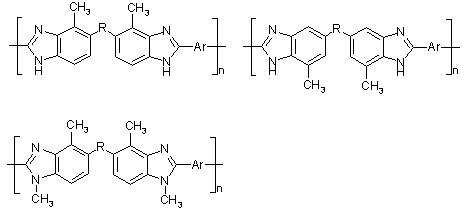 , где
, где
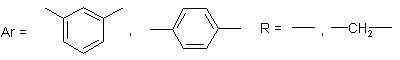
Схема 18
В работах [64, 65] из
4,4’-дианилино-3,3’-диаминодифенила и дифениловых эфиров изофталевой, дифеновой
и 4,4’-дифенилдикарбоновой кислот путем твердофазной поликонденсации получили
ряд поли(N-фенил)бензимидазолов:
 , где R = H-, Ph-
, где R = H-, Ph-
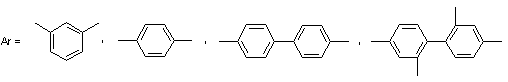
Схема 19
Сравнение замещенных и незамещенных полибензимидазолов
показало, что введение N-фенильного
заместителя приводит к резкому повышению растворимости полимеров. Так,
полибензимидазол на основе 3,3’-диаминобензидина и дифенилтерефталата
растворяется только в концентрированных H2SO4, HCOOH и ДМСО, а соответствующий ему по строению N-фенилзамещенный полимер
растворяется, кроме того в амидных растворителях и циклогексаноле.
Из всех известных ПБИ наиболее практическое применение нашел полимер на
основе 3,3’- диаминобензидина и дифенилизофталата, применяемый для получения
ПБИ-волокон.
4. Физико-химические свойства полибензимидазолов
Полибензимидазолы представляют собой продукты от
желтого до оранжевого цвета; плотность их составляет 1,2-1,4 г/см3.
Некоторые их свойства приведены в табл. 1.
Таблица 1
Температуры размягчения и разложения полибензимидазолов
|
1
|
2
|
3
|
4
|
5
|
6
|
|
№
|
Элементарное звено
|
Т разм,°С
|
Т разл (в N2),°С
|
Т разл (на воздухе),°С
|
Литературный источник
|
|
1
|
|
590
|
|
[67]
|
|
|
2
|
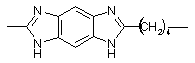 Тпл = 490 Тпл = 490
|
|
420
|
[67]
|
|
|
3
|
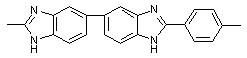
|
|
500
|
[67,98]
|
|
|
4
|
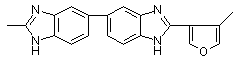 Тпл > 400 Тпл > 400
|
480
|
|
[67]
|
|
|
5
|
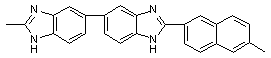 550 550
|
|
|
[76]
|
|
|
6
|
|
|
|
[67]
|
|
|
7
|
|
200
|
|
[67, 76]
|
|
|
8
|
|
400
|
|
[76]
|
|
|
9
|
|
500
|
|
[67]
|
|
|
10
|
|
460
|
|
[66]
|
|
|
11
|
 Тпл = 530 Тпл = 530
|
585
|
|
[87]
|
|
|
12
|
 Тпл = 420-450 Тпл = 420-450
|
|
450
|
[71]
|
|
|
13
|
 Тпл = 470 Тпл = 470
|
|
|
[67,78]
|
|
|
14
|
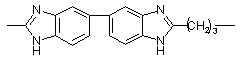 275, Тпл = 420 275, Тпл = 420
|
|
|
[72]
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
15
|
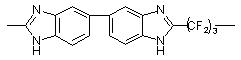
|
|
410
|
[70,80]
|
|
|
16
|
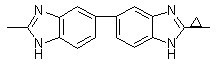
|
|
350
|
[68]
|
|
|
17
|
 Тпл = 450 Тпл = 450
|
|
|
[67,78]
|
|
|
18
|
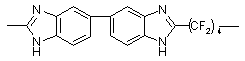
|
|
410
|
[77,93]
|
|
|
19
|
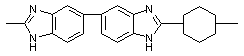
|
|
350
|
[68]
|
|
|
20
|
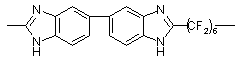
|
|
|
[76]
|
|
|
21
|
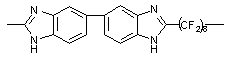 234, Тпл = 470 234, Тпл = 470
|
|
350
|
[69,73, 74, 79]
|
|
|
22
|
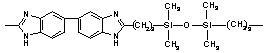 220 220
|
|
|
[67]
|
|
|
23
|
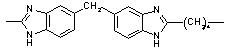
|
|
|
[81]
|
|
|
24
|
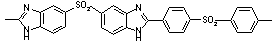 Тпл = 510 Тпл = 510
|
|
|
[75]
|
|
|
25
|
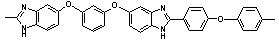 Тпл = 495 Тпл = 495
|
|
|
[82]
|
|
|
26
|
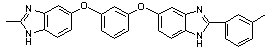 Тпл = 330 Тпл = 330
|
|
|
[82]
|
|
|
27
|
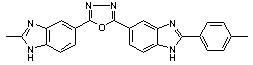 Тпл > 400 Тпл > 400
|
500
|
|
[87]
|
|
|
28
|
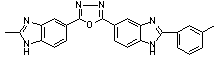 Тпл = 525 Тпл = 525
|
520
|
|
[87]
|
|
|
29
|
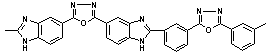 Тпл = 480 Тпл = 480
|
480
|
|
[87]
|
|
|
30
|
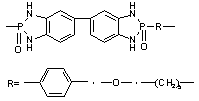
|
|
|
[83,84]
|
|
|
31
|
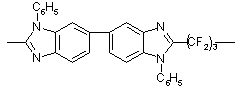
|
|
|
[80]
|
|
|
32
|
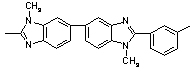
|
|
|
[85]
|
|
|
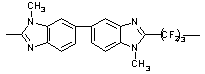
33
|
|
|
|
[80]
|
|
|
34
|
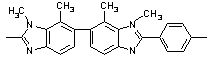 345 345
|
|
450
|
[86]
|
|
|
35
|
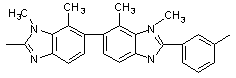 335 335
|
|
410
|
[86]
|
|
|
36
|
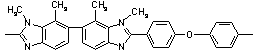 320 320
|
|
415
|
[86]
|
|
|
37
|
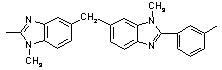 350 350
|
|
450
|
[86]
|
|
|
38
|
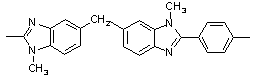 380 380
|
|
480-490
|
[86]
|
|
|
39
|
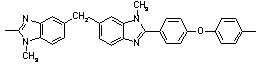 340 340
|
|
450
|
[86]
|
|
|
40
|
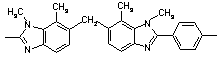 245 245
|
|
410
|
[86]
|
|
|
41
|
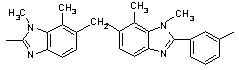 230 230
|
|
395
|
[86]
|
|
|
42
|
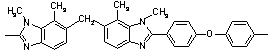 210 210
|
|
400
|
[86]
|
|
|
43
|
|
|
|
[85]
|
|
|
44
|
|
|
|
[89]
|
|
|
45
|
|
700
|
600
|
[89]
|
|
|
46
|
 > 500 > 500
|
|
500
|
[88]
|
|
|
47
|
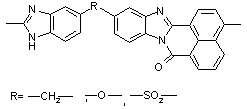 500-550 500-550
|
|
450-500
|
[90]
|
|
|
48
|
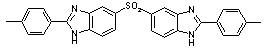
|
|
|
[91,93]
|
|
|
49
|
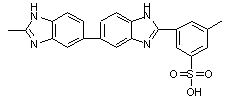
|
|
|
[92]
|
|
|
50
|
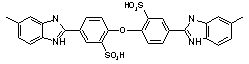
|
|
|
[93]
|
|
|
51
|
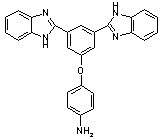
|
|
|
[93]
|
|
|
52
|
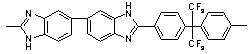
|
|
|
[94,97]
|
|
|
53
|
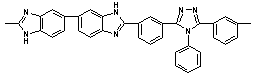
|
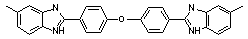
|
|
[95]
|
|
|
54
|
|
|
|
[96]
|
|
Как видно из данных таблицы все ПБИ обладают высокими
температурами размягчения (210 - 550)°С и разложения (200 - 700)°С.
.1 Температурные переходы ПБИ
Незамещенные полностью ароматические
полибензимидазолы, в которых отсутствуют «шарнирные» группы и атомы в
нуклеофильном компоненте, а электрофильный компонент состоит из n-замещенных или конденсированных
ароматических ядер, разлагаются при температуре ниже температуры размягчения
или плавления (табл. 1, №1, 3, 5-9). Полимеры, содержащие «шарнирные» атомы или
группы в остатке кислоты или тетрамина, размягчаются в интервале
температур 250-450°С. Длительная термообработка
полибензимидазолов в высоком вакууме приводит к повышению температуры
размягчения на 20-50°С [88]. Температура размягчения полимера тем ниже, чем
выше в нем содержание групп, повышающих гибкость макромолекулы.
Полибензимидазолы с двумя или более простыми эфирными связями в звене (табл. 1,
№ 24-26) плавятся в интервале температур 300-500°С. Плавкие продукты образуются
и в том случае, если в состав тетрамина и/или кислотного компонента входят
оксадиазольные или фурановые циклы (табл. 1, №4, 11, 27-29). Полибензимидазолы
с алифатическими звеньями в цепи (табл. 1, №2, 13-21, 23) размягчаются в интервале
температур 230-280°С, температура их плавления составляет 420-470°С.
Температуры начала разложения полибензнмидазолов
приведены в табл. 1. Полибензимидазолы с алифатическими группами (табл.1, № 2,
13-21, 23) имеют более низкую термостойкость, чем полностью ароматические
полимеры. В инертной среде разложение начинается при 450-470°С, а на воздухе -
около 350°С. Разложение начинается по метиленовым группам основной цепи. Замена
СН2 (табл. 1. №15, 18, 20, 31, 33) на CF2-группы сопровождается уменьшением термостойкости. Деструкция
в этом случае начинается с отщепления HF за счет водорода имидазольного цикла и фтора дифторметиленовой группы.
Полимеры с алициклическими группами в основной цепи по
термостойкости занимают промежуточное положение между алифатическими и
ароматическими полибензимидазолами (табл.1 № 16, 19).
По термостойкости полибензимидазолы
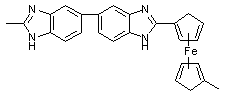
ферроцендикарбоновой кислоты (№10) аналогичны алифатическим полнбензимидазолам.
Термостойкость полибензимидазолов с нафталиновыми
группами в основной цепи зависит от изомерии использованных
нафталиндикарбоновых кислот (№5-8). Свойства полибензимвдазолов
2,6-нафталиндикарбоновых кислот такие же, как и у других ароматических
полибензимидазолов. На основе же 1,2- и 1,7-нафталиндикарбоновых кислот
получают полимеры, которые по термостойкости занимают промежуточное положение
между алифатическими и ароматическими полибензимидазолами.
При введении в структуру мостовых групп термостойкость
понижается в следующей последовательности: O > CH2
> SO2.
Полибензимидазсгяы с N-алкилзамещенными группами имеют несколько более высокую
стойкость к термической и окислительной деструкции (№32-45).
Полибензимидазолы
с N-фенилзамещенными циклами имеют значительно более
высокую стойкость к термической и термоокислительной деструкции, что особенно
проявляется в условиях термостарения. При замене группы -С= в имидазольном
цикле на бор (боримидазолы) или 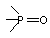 (№ 30)
термостабильность не повышается, но улучшается растворимость полимера. Введение
в макромолекулы полибензимилазолов кремнийорганических групп в остатках
кислотного компонента (№12, 22) не приводит к увеличению термостойкости и
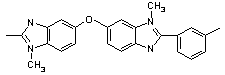
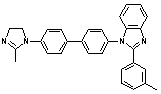
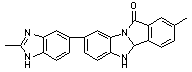
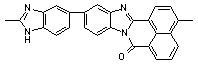
вызывает понижение температуры размягчения [71]. Полибензимидазолы (№45-47)
благодаря частично-лестничной структуре имеют более высокую термостойкость, чем
обычные полибензимидазолы.
(№ 30)
термостабильность не повышается, но улучшается растворимость полимера. Введение
в макромолекулы полибензимилазолов кремнийорганических групп в остатках
кислотного компонента (№12, 22) не приводит к увеличению термостойкости и
вызывает понижение температуры размягчения [71]. Полибензимидазолы (№45-47)
благодаря частично-лестничной структуре имеют более высокую термостойкость, чем
обычные полибензимидазолы.
Таблица 2
Влияние химического строения исходных веществ на кристалличность и
растворимость полибензимидазодов
|
Исходные вещества
|
Кристал-личность
|
Растворимость, %
|
|
тетраамин
|
дифениловый эфир дикарбоновой
кислоты
|
|
HCOOH
|
ДМСО
|
ДМФА
|
|
3,3'-Диамино- бензидин
|
Терефталевой
|
+
|
2-3
|
0,5- 1
|
Нерастворим
|
|
Изофталевой
|
0
|
5-6
|
20
|
Растворим частично
|
|
4,4'-Дифенилди- карбоновой
|
+
|
Растворим частично
|
Нерастворим
|
|
|
Дифеновой
|
0
|
20
|
20
|
20
|
|
3,5 - Пиридиндикарбоновой
|
+
|
10-15
|
20
|
Растворим частично
|
|
2,5-Фурандикарбоновой
|
+
|
3-4
|
20
|
20
|
|
1,2,4,5-Тетра- аминобензол
|
Терефталевой
|
+
|
2-3
|
Нерастворим
|
|
|
Изофталевой
|
+
|
5-6
|
|
|
|
Адипиновой
|
+
|
20
|
Растворим частично
|
Нерастворим
|
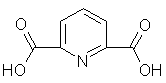
Таблица 3
Температура размягчения и термостойкость полибензимидазолов
|
Тетраамин
|
Дикарбоновая кислота
|
Температура размягчения, °С
|
Потеря массы в азоте, %
|
|
|
|
400oC
|
500oC
|
550oC
|
600oC
|
|
Тетраамино-бензол
|
Терефталевая
|
-
|
2,8
|
1,0
|
1,9
|
4,0
|
|
Изофталевая
|
-
|
0,7
|
0,3
|
1,4
|
1,4
|
|
3,3’-Диамино-бензидин
|
Терефталевая
|
-
|
1,0
|
0
|
1,7
|
1,0
|
|
Изофталевая
|
-
|
0,6
|
0,4
|
1,3
|
2,2
|
|
2,6-Пиридиндикарбоновая
|
-
|
0,2
|
0,5
|
1,4
|
2,7
|
|
2,5-Фурандикарбоновая
|
480 (разл.)
|
1,4
|
2,6
|
2,8
|
2,0
|
|
2,7-Нафталиндикарбоновая
|
-
|
0,4
|
2,6
|
2,8
|
2,0
|
|
4,4'-Дифенилдикарбоновая
|
-
|
0,3
|
0,8
|
0,3
|
2,1
|
|
3,3' ,4,4'-Тетраамино- дифенилметан
|
Изофталевая
|
380-390
|
-
|
5,16
|
15,45
|
31,30
|
|
Терефталевая
|
400-410
|
-
|
3,44
|
7,95
|
15,35
|
|
3,3’-Диамино-бензидин
|
4,4' - Дифенил-оксиддикарбоновая
|
460-470
|
-
|
5,44
|
7,41
|
10,20
|
|
3,3’,4,4’- Тетрааминодифенил-метан
|
|
350-370
|
-
|
3,40
|
7,24
|
16,20
|
|
3,3’,4,4’- Тетраамино-дифенилоксид
|
бис-(4-Карбоксифенил)-метилфосфиноксид
|
380-400
|
-
|
27,50
|
39,80
|
47,85
|
|
3,3’,4,4’- Тетраамино-дифенилметан
|
1,4- Фенилендиборная
|
500
|
-
|
2,64
|
7,16
|
12,80
|
|
3,3’-Диаминобензидин
|
2,6- Нафталиндикарбоновая
|
-
|
-
|
5,0
|
10
|
15
|
|
2,3- Нафталиндикарбоновая
|
-
|
-
|
25
|
20
|
35 (700 oC)
|
|
2,7- Нафталиндикарбоновая
|
-
|
-
|
25
|
30
|
40 (700 oC)
|
|
4,5- Имидазолдикарбоновая
|
-
|
5
|
5
|
7-10
|
|
|
Ферроцендикарбоновая
|
-
|
-
|
25
|
25
|
30
|
|
Малеиновая
|
-
|
-
|
20
|
-
|
25
|
|
3,3’-Диаминобензидин
|
2,2’- Дифенилдикарбоновая
|
-
|
-
|
20
|
-
|
25
|
|
Перфторпробковая
|
-
|
-
|
30
|
-
|
35
|
|
Перфторглутаровая
|
-
|
-
|
40
|
-
|
50
|
5. Структура мономеров, используемых для синтеза ПБИ
Как видно из вышеприведенного материала в качестве мономеров для
получения ПБИ используются различные ароматические тетраамины:
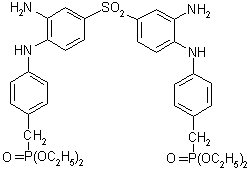 [99],
[99],
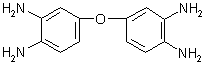 [100],
[100],
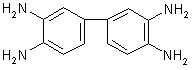 [100] и
производные ароматических дикарбоновых кислот:
[100] и
производные ароматических дикарбоновых кислот:
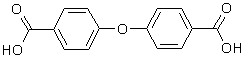 [101],
[101],
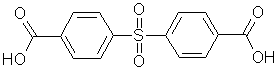 [102],
[102],
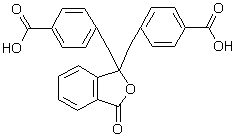 [101]
[101]
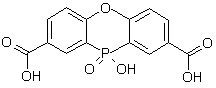 [100]
[100]
 [18],эфиры
[48, 103, 104], нитрилы [105, 106].
[18],эфиры
[48, 103, 104], нитрилы [105, 106].
В целом структурное многообразие не сильно велико. При этом использование
тетрааминов не сильно желательно, потому что отдельные представители мало
устойчивы и легко окисляемы как во время хранения, так и в процессе синтеза
полимеров, что ведет к ухудшению качества полимерного материала. Поэтому
применение самоконденсирующихся мономеров более перспективно. Однако, примеров
таких соединений невелико.
Так для синтеза ПБИ АБ типа (поли-2,5-бензимидазола)
используется один мономер (3,4-диаминобензойная кислота), в среде содержащей CH3SO3H
и P2O5. Это гораздо проще и дешевле. В то время как ПБИ
синтезируются из двух функциональных мономеров, которые являются дороже, чем
для синтеза АБПБИ [107].
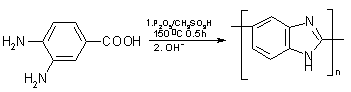
Но
есть существенные недостатки использования для синтеза ПБИ АБ типа свободной
3,4-диаминобензойной кислоты (ДАБК), т.к это сопровождается частичным
окислением мономера во время синтеза, что выражается в потемнении реакционного
раствора и сильно сказывается на молекулярном весе получаемого полимера. К тому
же свободная ДАБК очень трудно поддается очистке и всегда содержит 1-2% трудно
идентифицируемых примесей, что далает получение высокомолекулярных полимеров на
ее основе весьма проблематичным.
Так же для получения ПБИ АБ типа используется 3,4-диамино-4´-карбоксидифенилоксид,
гомополиконденсацией которого в реактиве Итона при 140°С синтезирован
поли-2-(4'_оксифенилен)-5-бензимидазол, растворимый в органических
растворителях [108].
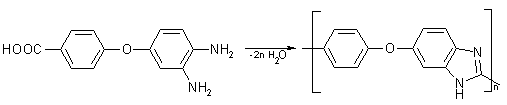
Список литературы:
1. Балев Ф.С. / Полимерные материалы в машиностроении и методы снижения
их горючести // Вестник Харьковского национального автомобильно-дорожного
университета.- 2007.- № 38. С. 176-179.
2. Морыганов
А.П. , Захаров А.Г., Живетин В.В. / Перспективные полимерные материалы для
химико-текстильного производства // Ж. Рос. хим. об-ва им. Д.И. Менделеева.-
2002.- Т. XLVI, № 1, С. 58-66.
3. http://works.tarefer.ru/94/100172/index.html
. Дирш, А.В. Исследование взаимодействия полиакриламидных гидролей с
биологическими тканями: диссертация канд. мед. наук: 14.00.16: защищена 2004 /
Дирш А. В.
. Айзенштейн Э.М. Технические полимерные материалы в автомобилестроении /
Э.М. Айзенштейн // Технический текстиль.- 2004.- №9.
. Одинокова, О. А. Теоретические основы использования полимерных
материалов в технологии судостроения: автореферат: 05.08.04: защищена 2004 /
Одинокова О.А.
. http://www.motoravia.ru/files/spec.zip/folder2/318677.php
8. Могнонов Д.М.,
Дашицыренова М.С., Пинус И.Ю., Мазуревская Ж.П., Дорошенко Ю.Е., Ярославцев
А.Б. / Термодинамические
характеристики смесей полигетероариленов//
Высокомол. соед.- 2010. Т. 52.
№ 6 <http://elibrary.ru/contents.asp?issueid=866216&selid=15109861>. С.
956-962.
9. Воробьева Г.Я. Химическая
стойкость полимерных материалов. -М., 1981. -138с.
. Лейкин А.Ю., Окатова О.В.,
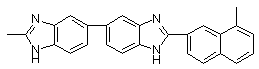
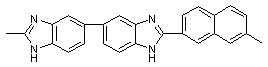
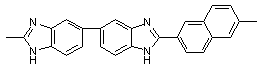
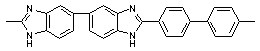
Ульянова Н.Н., Сазанов Ю.Н., Русанов А.Л., Лихачев Д.Ю./ Новые бензимидазол-2-ил замещенные
полибензимидазолы: синтез, свойства и гидродинамические характеристики // Высокомол. соед.- 2009. Т. 51. № 3 <http://elibrary.ru/contents.asp?issueid=531819&selid=11714187>.
С. 537-542.
11.
Пономарев, И.И. Синтез новых полибензимидазолов для высокотемпературных
топливных элементов на водороде : диссертация канд. хим. наук : 02.00.06 :
место защиты Москва : 2010 / Пономарев, И. И.
.
http://works.tarefer.ru/94/100035/index.html
13. Vogel H., Marvel C.S., // Polybenzimidazoles. I. New
Thermally Stable Polymers / J. Polym. Sci.- 1961, V. 50, pp. 511-539.
14.
Korshak V.V., Teplyakov М.М., J. Macromolec. Sci. С, 1971, V. 5, № 2, Р. 409.
. Кронгауз
Е.С., Русанов А.Л., Ренард Т.Л., Успехи химии, 1970, Т.39, № 9,1. C.1591.
. Коршак
В.В., Тепляков М. М., Прогресс полимерной химии, Под ред. Коршака В.В. М., 1969, С. 198.
.
Marvel С.S., Polymer Preprints,
1964, V. 5, № 1, P. 167.
.
Marvel С.S., SPE J, 1965, V. 5, №
1, P. 29.
.
Marvel C.S., Polymer Preprints, 1965, V. 6, № 1, p. 15.
.
Marvel C.S., Pure Appl. Chem, 1968, V. 16, № 23, P. 351.
.
Marvel C.S., Appl. Polymer Symp, 1973, № 22, P. 47.
22.
Marvel C.S., J. Macromolec. Sci. C, 1975, V. 13, № 2, P. 219.
. Коршак
В.В., Термостойкие полимеры, М., 1969, С. 411.
24.
Mitsuru Ueda, Masaki Sato, Amane Mochizuki., Macromolecules 1985, 18, P.2723.
. Коршак В.В., Русанов A.Л, Тугуши Д.С., II Успехи химии, 1981, Т. 50, № 12, С. 2250.
26.
Korshak V.V., Rusanov A.L., Tugushi D.S., Polymer, 1984, V. 25, № 11, P. 1539.
27. Коршак
В.В., Успехи химии, 1982, Т. 51, № 12, С. 2096.
28.
Neuse Е.W., Advances in Polymer
Sci., V. 47, N. Y., 1982. P. 1.
.
Marvel C.S., SPE J, 1964, V. 20, № 3, P. 220.
30.
Moyer W.W., Cole C., Anyos Т.,J.
Polymer Sci, A 1965, V. 3, № 6, P. 2107.
31. Коршак
В.В., Цейтлин Г.М., Павлов А.И., Докл. АН СССР, 1965, Т. 163, № 1, С. 116.
.
Korshak V.V., Rusanov A.L., Plieva L.Kh., Faserforschung und Textiltechnik,
1977, B. 28, № 8, S. 371.30
33. Чернихов
А.Я., Исаева В.А., Обзорная информация, Сер. Пластмассы и синтетич Смолы, М.,
1980, 35 с.
34.
Vogel Н., Marvel C.-S., J.
Polymer Sci, 1961, V. 50, № 154, P. 511.
.
Imai Y., Uno K., Iwakura Y., Makromolek. Chem, 1965, B. 83, S. 179.
36.
Ueda M., Sugita H., Sato M., J. Polymer Sci. Polym. Chem, 1986, V.24, P.1019.
.
Ueda M.; Uchiyama К.; Капо Т.,
Synthesis, 1984, 323.
.
Ueda M.; Капо Т., Makromol. Chem.,
Rapid Commun., 1984, 5, 833.
39. Бюллер К.-У. Тепло- и термостойкие полимеры. -М., 1984. -1056с.
40.
Ueda М., Sugita Н., Sato М. J., Polymer Sci. Polym. Chem.,
1986, V.24, P. 1019.
. Коршак B.B., Русанов А.Л., Изв. АН
СССР, Сер. хим., 1970, № 2, С. 289.
. Коршак
В.В., Казакова Г.В., Русанов А.Л., Высокомолек. Соединения, 1989, Т. 31 А, № 1,
С.5.
. Коршак
В.В., Русанов А.Л., Polymery, 1970, V. 15, № 8, Р. 400.
.
Вознесенская H.H., Берендяев В.И., Котов Б.В., Воишев B.C., Праведников А.Н.,
Высокомолек. Соед. Б, 1974, Т. 16, № 2, С. 114.
. Коршак
В.В., Гвердцители И.М., Тугуши Д.С., Джапаридзе З.Ш., Русанов А.Л., Цейтлин
Г.М., Чернихов А.Я., Докл. АН СССР, 1978, Т. 240, №4, С. 873.
. Коршак
В.В., Фрунзе Т.М., Курашев В.В., Изынеев А.А., / Исследование реакции
образования полибензимидазолов // Доклады АН СССР.- 1963, Т. 149, С. 104-108.
47.
Wrasidlo W., Levine H.H. / Polybenzimidazoles. I. Reaction Mechanism
and Kinetics. // J. Polym. Sci.- 1964, V. A2, № 11, pp. 4795-4808.
48.
Gray D.N., Shulman G.P., Conley R.T. /The Mechanism of Polybenzimidasole
Formation by Condensation of Aromatic Tetramines and Esters and the Structure
of the resulting Polycondensates. // J. Macromol. Sci.- 1967, V. Al, № 3, pp.
395-411.
49.
Vogel Н., Marvel С.S., // Polybenzimidazoles. I. New Polymers / J. Polym. Sci.- 1961, V. 50, pp.
511 -539.
50. Ли Г.,
Стоффи Д., Невилл К. Новые линейные полимеры. Пер. с англ. М: Химия, 1972.- С. 280.
51.
Bajoj I., Vankataravani В. // Polybenzimidazoles: Preparation and Mechanism оf
Formation / J. Scient. Ind. Res.- 1970, V. 29, pp. 18-28.
52. Iwakura Y. Uno K., Imai
Y. // Polyphenylenebenzimidazoles / J. Polym. Sci.- A2, № 6, pp. 2605-2615.
53.
Vogel H., Marvel C. S. // Polybenzimidazoles. II. / J. Polym. Sci.- 1963, V. Al, № 5, pp. 1531-1541.
54. Kopшак В.В., Манучарова И.Ф., Изынеев
А.А., Фрунзе Т. М. // Исследование термостойкости некоторых новых
полибензимндазолов, полнамидо-бензимидазолов и полиэфиробензимидазолов /
Высокомолек. соед.- 1966, Т. А8, С. 777-781.
55. Коршак
В.В., Изынеев А.А., Вдовнна Л.И. / Синтез новых полибензимидазолов // Известия
АН СССР. Сер. химическая.- 1966, № 4, С. 772.
56.
Foster К.Т., Marvel С.S. // Polybenzimidazoles IV.
Polybenzimidazoles, containing Aryl Ether Linkages. // J. Polym. Sci.- 1965, V.
A3, № 2, pp. 417-421.
57.
Foster R.Т., Marvel C.S. / Potybenzimidazoles IV.
Polybenzimidazoles containing Aryl Ether Linkages. / J. Polym. Sci.- 1965, V.
A3, pp. 417-421.
58.
Narayan Т.V.L., Marvel C.S. /
Potybenzimidazoles IV. Polybenzimidazoles containing Aryl Sulphone Linkages. /
J.Polym. Sci.- 1967, V. Al, pp. 1113-1118.
59. Коршак
В.В., Цейтлин Г.М., Павлов А.И., Кулагин В.Н., Салаллаш Н. // Полибензоксазолы
и полибензимндазолы, содержащие карбонильные группы / Пластмассы.- 1971, № 7,
С. 280-284.
60. Фрунзе
Т.М., Коршак В.В., Изынеев А.А // Полибензимидазолы на основе 3,3’,4,4’-
тетрааминодифенилметана / Высокомолек. соед.- 1965, Т. 7, № 2, С. 280-284.
61.
Tzur Y., Levine Н.Н., Levy М. // Effects of structure on
properties of some aromatic-aliphatic polybenzimidazoles. / J. Polym. Sci.:
Polym. Chem. Ed.- 1974, V. 12, № 7, pp. 1515-1529.
.
Tsur Y., Levy M. // TGA-MS degradation studies of some new aliphatic-aromatic
polybenzimidazoles. / J. Polym. Sci,: Polym. Chem. Ed.- 1974, V. 12, № 7, pp.
1531-1539.
.
Korshak V.V., Teplyakov M.M., Fedorova R.D. // Synthesis and Investigation of
Polybenzimidazoles containing Alkyl Substituens in Aromatic Nuclei / J. Polym.
Sci.: Polym. Chem. Ed.-
1971, V. A-1, № 9,
pp. 1027-1048.
64. Коршак
В.В., Цейтлин Г.М., Черкасова Г.М., Русанов А.Л., Березкина Н.А. // Синтез и
исследований ароматических поли-(N-
фенил)бензимидазолов / Высокомолек. соед, Т. All, № 1, С.22-29.
65. Коршак
В.В., Родэ В.В., Цейтлин Г.М.,Черкасова Г.М, Березкина Н.А. // Синтез и
исследование некоторых полибензимидазолов / Высокомолек. соед.- 1969, Т. All, № 1, С. 35-42.
66.
Е. Marvel, SPE J. 20 (1964), 220.
67.
H. Vogel, J. Polymer Sci. 50 (1961) 154, 511-539.
68.
S. lnoue, Makromolekulare Chem. 95 (1966), 236-247.
69.
F. Trischler, J. Polymer Sci. 11 (1967) 7, 1325-1331.
70.
Р. Гитина, Высокомолек. соед., 8, 1966, 9, 1535-1538.
71.
J. Mulvaney, J. Polymer Sci. 50 (1961), 541-547.
72.
H. Vogel, J. Polymer Sci. A 1 (1963), 1531-1541.
.
S. Frenkel, J. Polymer Sci. С 2 (1969) 22, 813-825.
. Л. Лайус,
Пластмассы, 8, 1965, 34-38.
75. T.
Narayan, J. Polymer Sci. A 1 5 (1967) 5, 1113-1118.
76. C.
Marvel, J. Polymer Sci. 2 (1964) 6, 2559-2569.
77. Hongting
Pu, Lin Wang, Haiyan Pan, Decheng Wan / Synthesis and characterization of
fluorine-containing polybenzimidazole for proton conducting membranes in fuel
cells // J. Polymer Sci. A.- 2010.- V. 48, № 10, P. 2115-2122.
78. H. Адрова, Высокомолек. соед., 7, 1965,
2, 305-307.
79. F.
Trischler, J. Polymer Sci. 13 (1969), 1, 101-106.
80. P. Гитина, Высокомолек. соед., Б 9,
1967, 6, 447-452.
81. А.
Изынеев Высокомолек. соед., 7, 1965, 2, 280-286.
82. В.
Коршак,'Изв. АН СССР. сер. хим., 9, 1968, 2143-2144
83. Н.
Адрова ДАН СССР, сер. хим., 158, 1964, 130-137
84. Н.
Адрова, ДАН СССР, сер. хим., 158, 1966, 18-26
85. М.
Тепляков, Высокомолек. соед., Б 9, 1967, 10 767-769
. М.
Тепляков, Высокомолек. соед., А 11, 1969 8, 1858- 1862.
87. J.
Preston, J. Polymer Sci. A 5 (1967), 2429-2438.
88. В.
Коршак, Высокомолек. соед., А 14, 1972, 12, 2647-2652.
89. В.
Коршак, ДАН СССР, 198, 1971, 4, 841-843.
90. В
Коршак, Тр. Моск. хим.-техн. ин-та, 1972, 70, 175-177.
91. Alexander L. Gulledge, Bin Gu, Brian C. Benicewicz. A
new sequence isomer of AB-polybenzimidazole for high-temperature PEM fuel cells
// J. Polymer Sci. A.- 2012.- V. 50, № 2, P. 306-313.
92. Owen D. Thomas, Timothy J. Peckham, Uma Thanganathan,
Yunsong Yang and Steven Holdcroft / Sulfonated polybenzimidazoles: Proton
conduction and acid-base crosslinking // J. Polymer Sci. A.- 2010.- V. 48, №
16, P. 3640-3650.
93.
Julien
Jouanneau, Laurent Gonon, Gérard Gebel, Vincent Martin, Regis
Mercier / Synthesis
and characterization of ionic conducting sulfonated polybenzimidazoles // J.
Polymer Sci. A.- 2010.- V. 48, № 8, P. 1732-1742.
.
Guoqing Qian, Brian C. Benicewicz / Synthesis and characterization of high
molecular weight hexafluoroisopropylidene-containing polybenzimidazole for
high-temperature polymer electrolyte membrane fuel cells // J. Polymer Sci. A.-
2009.- V. 47, № 16,
P. 4064-4073.
.
Potrekar R.A., Kulkarni M.P., Kulkarni R.A., Vernekar S.P. / Polybenzimidazoles
tethered with N-phenyl 1,2,4-triazole units as polymer electrolytes for fuel
cells // J. Polymer Sci. A.- 2009.- V. 47, № 9, P. 2289-2303.
.
Kulkarni Mahesh, Potrekar Ravindra, Kulkarni R. A., Vernekar S. P. / Synthesis
and characterization of novel polybenzimidazoles bearing pendant phenoxyamine
groups // J.
Polymer Sci. A.- 2008.- V. 46, № 17, P. 5776-5793.
.
Shih-Wei Chuang and Steve Lien-Chung Hsu / Synthesis and properties of a new
fluorine-containing polybenzimidazole for high-temperature fuel-cell
applications // J.
Polymer Sci. A.- 2006.- V. 44, № 15, P. 4508-4513.
.
Tai-Shung Chung, Zhen-Liang Xu, Cheng-Hon Alfred Huan / Halo formation in
asymmetric polyetherimide and polybenzimidazole blend hollow fiber membranes //
J. Polymer Sci.
B.- 1999.- V.
37, № 14, P. 1575-1585.
99.
M.B. Gieselman, J.R. Reynolds, Macromolecules, 1993, 26, 5633.
100. И.И.
Пономарев, М.Ю. Жаринова, П.В. Петровский, 3.С. Клеменкова, «Новые
поли-1,2,3-триазолсульфокислоты для протонпроводящих мембран топливного
элемента», Доклады Академии Наук, 2009, том 429, № 4, с. 490-495.
. В.В. Коршак
Термостойкие полимеры. M., 1969, 411.
102.
M. Ueda, M. Sato, A. Mochizuki. Macromolecules, 1985, 18, 2723.
.
Mitsuhashi К., Marvel С.S. Polybenzimidazoles IV, containing
aryl ether linkages // J. Polymer Sei. -1965. A, № 4, p. 1661-1663.
.
Foster R.T., Marvel C.S. Poly-2,6-(m-phenylene)-3,5-dimetyl- diimidazolebenzene
// J.Polym. Sei. -1965. -A3, №2. -p. 417-421.
.
Iwakura Y., Uno K., Imai J. Polybenzimidazoles // J. Polym. Sci. Part A. -1964.
-vol.2, № 6, p.2605-2615.
.
Ivakura J., Uno K., Chan N. Polymer containing the benzimidazole and the
quinazoline unit in the main chain // Macromol. Chem. -1975, 176, p.23-26.
.
Kim H.-J., Cho S.Y., An S.J., Eun Y.C., Kim J.-Y.,Yoon H.-K., Kweon H.J., Yew
K.H. // Macromol. Rapid Commun. 2004. V. 8. P. 894.
. Лейкин
А.Ю., Русанов А.Л., Бегунов Р.С., Фоменков А.И., Синтез и свойства поли [2-(4´-оксифенилен)-5-бензимидазола] и
протонпроводящей мембраны на его основе. Высокомолекулярные соединения, серия C, 2009, Т 51, № 7, С. 1264-1268.