Проектирование цеха и технологии получения триоксида молибдена в условиях Сорского месторождения медно-молибденовых руд
Введение
Роль тугоплавких редких металлов в современной
технике весьма велика. Тугоплавкие металлы характеризуются рядом общих областей
применения. Большинство из них является легирующими металлами и компонентами
жаропрочных и коррозионностойких сплавов, используется в электровакуумной
технике.
Их производство в настоящее время достигло
значительных масштабов и непрерывно развивается. Молибден один из наиболее
широко используемых тугоплавких редких металлов.
Данный курсовой проект посвящен проектированию цеха
и технологии получения триоксида молибдена в условиях Сорского месторождения
медно-молибденовых руд в Усть-Абаканском районе Республики Хакасия.
1. Общая часть
1.1 Свойства молибдена
Молибден относится к числу так называемых
звездных (космических0 элементов: он обнаружен в солнечном спектре и в
метеоритах. Содержание молибдена в земной коре 0,0025 %; в морской воде (0,5÷2,0)
мкг/л.
Цвет и внешний вид металла зависят от способа
его получения. Плавленый молибден - блеклый, очень светлый. Молибденовый порошок,
полученный восстановлением оксида, темно-серый. Молибден механически прочный и
пластичный металл. При 0 ˚С электросопротивление молибдена в три раза
выше, чем у меди, и при повышении температуры до 1700 ˚С оно возрастает
примерно в 10 раз. Высокая тугоплавкость молибдена позволяет использовать его
ленту или проволоку в качестве нагревательных элементов электрических печей
сопротивления.
Молибден парамагнитен и хорошо проводит
электрический ток.
Азот образует с молибденом твердые и жидкие
растворы; предельная растворимость азота в молибдене при 1860 ˚С
составляет 1,08 %.
Литой и плотноспеченный молибден при нагревании
до ~ (550÷600) ˚С
сгорает в атмосфере кислорода (воздуха) с образованием триоксида. Молибденовый
порошок окисляется при еще более низкой температуре, а ультрадисперсные порошки
пирофорны. Растворимость кислорода в молибдене очень мала. Для предотвращения
взаимодействия молибдена с кислородом при повышенных температурах металл
покрывают защитными покрытиями.
Сера взаимодействует с молибденом при
температурах выше ~ 400 ˚С с образованием сульфидов MoS2
и MoS3. Взаимодействие
молибдена с сероводородом при более высокой температуре также ведет к
образованию сульфида молибдена. Дисульфид молибдена благодаря слоистой стуктуре
используют в качестве смазки для металлических поверхностей. При Т ≤20˚С
MoS2 является
полупроводником.
Минеральные кислоты легко реагируют с
молибденом. Азотная кислота. А также ее смеси с HCl
и H2SO4
окисляет и растворяет молибден. Концентрированная азотная кислота задерживает
растворение металла, создавая пассивирующую пленку оксидов. Разбавленная HCl
хорошо растворяет металл, концентрированная - значительно медленнее. Плавиковая
кислота быстро растворяет молибден.
Силициды молибдена чрезвычайно жароустойчивы.
Расплавленные Na,
K, Li,
Ca, Pb
и Bi в отсутствие
окислителей даже при высокой температуре не действует на молибден; жидкие Al,
Zn и Fe
активно с ним взаимодействуют [1].
1.2 Применение молибдена
Структура потребления молибдена и его соединений
выглядит следующим образом, %: сплавы стальные - 47,0, специальные - 3,0; сталь
нержавеющая - 20,0, инструментальная - 9,0, литая - 7,0; химические продукты -
9,0; металлический молибден - 4,0.
Из приведенных данных следует, что около 80 %
молибдена используют в черной металлургии для легирования сталей и чугунов.
введение молибдена в стали повышает их эксплуатационные характеристики - предел
упругости, сопротивление износу и удару. инструментальные стали содержат (1÷1,5)
% молибдена, а в быстрорежущих сталях содержание молибдена составляет (5÷8,5)
%, когда молибден заменяет вольфрам. Молибден повышает красностойкость
инструментальных сталей, их твердость и прочность. В высоколегированные стали
молибден вводят в форме ферромолибдена.
Коэффициент термического расширения молибдена
близок к коэффициенту термического расширения специальных стекол, что
определяет его применение в виде вводов в электровакуумные приборы и колбы
мощных источников света.
Молибденовую проволоку, ленту и прутки
используют в качестве нагревательных элементов электрических печей, работающих
в атмосфере водорода, аргона или вакууме.
В авиации и ракетной технике для изготовления
газовых турбин и деталей двигателей применяют молибден, легированный титаном,
цирконием, ниобием и другими металлами.
MoS2, имеющий
слоистую структуру, используют в качестве смазки в интервале температур (40÷350)
˚С. MoS3, MoО3,
MoО2 применяют в
качестве катализаторов при гидрировании нефти и углей. Перспективным является
применение молибдата аммония в производстве микроудобрений [1].
1.3 Характеристика сырья для
получения молибдена
Известно около 20 минералов молибдена, из
которых промышленное значение имеют четыре: молибденит MoS2,
повелит CaMoО4, молибдит
Fe2(MoО4)3∙7,5H2O
и вульфенит PbMoО4.
Молибденит MoS2
- самый распространенный и наиболее промышленно важный минерал молибдена. Это
мягкий свинцово-серого цвета минерал с металлическим блеском. По внешнему виду
он напоминает графит. Плотность MoS2
(4,7÷4,8)
г/см3, твердость по минералогической шкале (1÷1,5).
Молибденит залегает большей частью в кварцевых
жилах, во многих случаях ассоциируясь с шеелитом, вольфрамитом, касситеритом,
пиритом, халькопиритом, арсенопиритом, висмутовым блеском и другими минералами.
Часто в состав молибденита входит в виде изоморфной примеси рассеянный редкий
металл рений (0,1÷0,0001) %. В
результате выветривания в верхних зонах рудных жил молибденит окисляется,
образуя молибденовые охры, молибдит, повеллит и вульфенит.
Повелит CaMoО4
чаще встречается как вторичный минерал - продукт окисления молибденита и реже
как первичный минерал. Цвет повелита варьирует от белого до серого, плотность
(4,35÷4,52)
г/см3, твердость по минералогической шкале 3,5.
Повелит легко растворяется в соляной кислоте,
чем пользуются в химическом анализе для раздельного определения окисленного и
сульфидного молибдена.
Молибдит (ферримолибдит) - Fe2(MoО4)3∙nH2O
(n=7÷8)
- имеет лимонно-желтый цвет. Встречается в зонах окисления молибденитовых руд в
участках с повышенным содержанием оксидов железа. Плотность минерала 4,5 г/см3.
Молибдит и молибденсодержащие оксиды железа представляют интерес как источник
молибдена при разработке месторождений с развитыми зонами окисления.
Основное количество молибдена добывают в
настоящее время из эндогенных месторождений гидротермального происхождения. С
точки зрения задач обогащения можно ограничиться подразделением молибденовых
руд на следующие три группы.
Скарновые рудные залежи. В месторождениях этого
типа молибденит часто вместе с шеелитом, молибдо-шеелитом и некоторыми
сульфидами залегает в кварцевых жилах, заполняющих трещины в скарнах. Нерудные
минералы - кальцит, кварц, флюорит, гранат и др.
Простые (монометаллические)
кварцево-молибденитовые руды. Молибденит залегает в кварцевых жилах небольшой
мощности. Содержание других сульфидов незначительное. Руды обычно богаче по
содержанию молибдена по сравнению с месторождениями других типов, но их доля в
общей добыче молибдена невелика.
Штокверковые руды занимают преобладающее место в
запасах и добыче молибдена. В рудах преобладают кварц-молибденитовые и кварц-сульфидные
прожилки. В некоторых рудах содержание меди невелико, в других превалирует
медь, а содержание молибдена незначительное.
Для месторождений, в которых молибденит
ассоциируется с сульфидами меди, характерно повышенное содержание рения в
молибденитовых концентратах.
В рудах всех типов в той или иной мере могут
быть развиты зоны окисления, содержащие вторичные минералы: повелит,
ферримолибдит, молибденсодержащие оксиды железа. На отдельных участках руды
могут быть чисто окисленными или смешанными. Типичный пример - Сорское
месторождение в Хакассии, где в зоне окисления, простирающейся на глубину (25÷50)
м, находятся чисто окисленные и смешанные руды [2].
1.4 Характеристика места
строительства цеха получения триоксида молибдена
В настоящее время Сорское предприятие
представляет собой большой производственный комплекс численностью 2000 человек.
Три года назад на базе ГОКа был создан Сорский ферромолибденовый завод -
крупнейшей производитель ферромолибдена в стране.
Сорский производственный комплекс создан на базе
крупнейшего в России молибденового месторождения и ведет разработку Сорского
месторождения медно-молибденовых руд в Усть-Абаканском районе Республики
Хакасия. До начала 2006 года основными видами продукции комбината были
молибденовый и медный концентраты.
Сорский производственный комплекс - это
современное предприятие, имеющее сертификат соответствия международному
стандарту качества, использующее передовые технологии. ООО «Сорский ГОК» -
первое в России горнорудное предприятие, получившее в августе 2001 года
сертификат соответствия системы менеджмента качества международного стандарта.
Взятые за ориентир высокие стандарты
производства заставляют сорских металлургов с особой требовательностью
подходить к обеспечению экологической безопасности производства.
Хвосты, которые остаются после процесса
переработки и обогащения, складируются на хвостохранилище. Это сложнейший
гидротехнический объект, за состоянием которого постоянно следят специалисты
Сорского производственного комплекса. Что касается стоков, то и за ними ведется
внутренний и внешний контроль.
На проведение природоохранных мероприятий,
реализацию программ снижения воздействия на экологию выделяются крупные
средства, к совместной работе привлекаются независимые эксперты и лаборатории. Выделяются
средства на обучение и повышение квалификации собственных специалистов,
занимающихся разработкой и внедрением программ и проектов экологической
направленности.
Перспективная цель управляющей компании
«Союзметаллресурс» и коллектива Сорского производственного комплекса - сделать
комплекс флагманом российской горнорудной промышленности, что подразумевает не
только высокие производственные показатели, но и соответствие международным
стандартам по экологической безопасности и охране труда, высокий уровень
социальной ответственности предприятия [3].
2.
Технологическая часть
.1 Характеристика способов получения
триоксида молибдена
Молибденитовые концентраты служат исходным
сырьем для производства ферромолибдена и химических соединений различной степени
чистоты: триоксида молибдена, парамолибдата аммония, молибдата натрия,
молибдата кальция.
Основной, широко применяемый в промышленной
практике способ разложения молибденитовых концентратов - окислительный обжиг.
Продукт обжига - огарок, содержащий триоксид молибдена и примеси других
соединений, поступает на выплавку ферромолибдена и служит исходным продуктом
для производства химических соединений, важнейшее из которых триоксид
молибдена. Для его получения применяют способ возгонки триоксида из огарков или
гидрометаллургические схемы переработки огарка.
Разработаны гидрометаллургические способы
окисления молибденита, исключающие окислительный обжиг. К ним относятся
разложение азотной кислотой, окисление кислородом под давлением в щелочных и
кислых средах, обработка концентрата растворами гипохлорита натрия.
Представляют интерес хлорные способы переработки молибденовых огарков или
непосредственно молибденитовых концентратов.
2.2 Окислительный
обжиг молибденитовых концентратов
При обжиге молибденитовых концентратов протекает
ряд химических реакций. Они могут быть подразделены на четыре группы:
1) окисление молибденита с образованием
триоксида молибдена;
2) вторичное взаимодействие между тиоксидом
молибдена и молибденитом с образованием диоксида молибдена;
) окисление сульфидных минералов
сопутствующих элементов с образованием оксидов и сульфатов;
) взаимодействие между триоксидом
молибдена и кислородными соединениями примесей с образованием молибдатов.
На практике обжиг молибденитовых концентратов
проводят в многоподовых печах с механическим перегребанием и в печах кипящего
слоя.
Многоподовые печи обеспечивают хорошее
перемешивание, осуществление противотока материала и газов и интенсивное
окисление во взвешенном состоянии в моменты пересыпания материала с пода на
под. В печах этого типа возможно ведение процесса за счет теплоты реакций.
Температура на подах не должна превышать (580÷600)
˚С.
Обжиг ведут в печах с 8, 12 и 16 подами и
диаметром от 6 до 6,5 м. Температуру регулируют подачей воздуха отдельно на каждый
под. Газы отводятся с каждого пода в общий газоход.
На первых двух подах в основном происходит
испарение влаги и выгорание флотореагентов. На последующих 3 - 6 подах
молибденит окисляется до MoO3
, который реагирует с MoS2. На 7 - 8 подах происходит дальнейшее окисление MoS2
и большей части MoO2
до MoO3 . На 9 - 11
подах, где установлены форсунки, содержание общей серы снижается до (0,02÷0,05)
%.
Для поддержания строго определенной температуры,
не допускающей спекания материала и для возможно меньшего взаимного контакта
частиц, обжиг ведут в печах кипящего слоя (КС).
Для запуска печи первоначально создают в ней
кипящий слой из огарка, который разогревают горелками или подогретым воздухом.
Затем включают систему питания печи концентратом. После достижения в слое
оптимальной температуры (560÷570
˚С) далее она поддерживается автоматической системой регулирования.
Вследствие близости температур возгорания
молибденитового концентрата в КС (500÷510
˚С) и начала спекания огарков (580÷590
˚С) обжиг концентрата можно проводить лишь при относительно низкой
температуре в слое, поддерживаемой в пределах (560÷570)
˚С [2].
2.3 Разложение азотной кислотой
Азотная кислота (20÷50)
%-ой концентрации при нагревании активно окисляет молибденит. Взаимодействие в
основном описывается реакцией:
MoS2+6HNO3=H2MoO4+2H2SO4+6NO
(1)
При температуре разложения (80÷90)
˚С и концентрации кислоты выше 20 % в начальный период весь окислившийся
молибден находится в растворе, однако затем быстро выделяется молибденовая
кислота и резко снижается концентрация молибдена в растворе.
При проведении процесса в системе, включающей
регенерацию азотной кислоты из выделяющихся оксидов азота, общий расход кислоты
близок к стехиометрическому.
Регенерация азотной кислоты включает следующие
стадии:
окисление NO
кислородом
NO+O2=2NO2;
(2)
абсорбцию NO2
в
воде
NO2+H2O=HNO2+HNO3; (3)
диспропорционирование
HNO2
HNO2=1/3HNO3+2/3NO+1/3H2O; (4)
результирующая реакция абсорбции NO2
NO2+H2O=2HNO3+NO.
(5)
Разложение проводят в аппаратуре из нержавеющей
стали. При периодическом режиме целесообразно проводить двустадийное разложение
по принципу противотока.
Примерно 80 % молибдена (от исходного в пульпе)
находится в осадках в составе молибденовой кислоты. Осадки выщелачивают
аммиачной водой, растворы молибдата аммония перерабатывают по обычной схеме
[2].
Окисление кислородом в кислых средах
Среди различных описанных в литературе вариантов
автоклавного окисления кислородом в кислых средах наиболее перспективен
«симоли-процесс», при котором в качестве катализатора в водную пульпу вводят
некоторое количество азотной кислоты. Окисление протекает за счет кислорода,
однако непосредственно реагирует с молибденитом азотная кислота, которая
постоянно возобновляется вследствие взаимодействия кислорода с монооксидом азота.
Таким образом, в прцессе протекают реакции (2) - (4) [2].
Разложение молибденитового концентрата проводят
в автоклаве при (150÷160) ˚С
в течение 1,5 ч.
Примерно (75÷80)
% молибдена от исходного количества содержится в твердой фазе в составе
молибденовой кислоты. Кек с фильтра обрабатывают аммиачной водой, из аммиачного
раствора путем выпаривания досуха и прокалки осадка получают технический
триоксид молибдена.
Окисление кислородом в щелочных средах
Процесс описывается следующей суммарной
реакцией:
MoS2+4,5O2+6OH-=MoO42-+2SO42-+3H2O. (6)
Окисление S2-
до SO42- протекает через
стадию образования тиосульфата S2O32-.
Механизм окисления включает следующие стадии:
хемосорбция молекулы О2 на активных участках
поверхности
MoS2+O2=MoS2[O2](адс)
(быстро); (7)
обратимая адсорбция второй молекулы О2
MoS2[O2](адс)+O2=MoS2[2O2](адс)
(медленно); (8)
образование активного комплекса
MoS2[2O2](адс)=[MoS2…2O2](акт)
(медленно); (9)
взаимодействие активного комплекса с ОН--ионами
[MoS2…2O2](акт)+OH-=MoO2(OH)++S2O22-
(быстро);
(10)
взаимодействие промежуточного оксокатиона с ОН-
MoO2(OH)++OH-=MoO42-+2H+ (быстро);
(11)++OH-=H2O
(быстро); (12)
S2O22-+0,5O2=S2O32-
(быстро). (13)
Ионы тиосульфата затем окисляются в растворе
кислородом до SO42-.
Окисление растворами гипохлорита натрия
Гипохлорит натрия в щелочном растворе окисляет
все сульфидные минералы, в частности молибденит:
MoS2+9ClO-+6OH-=MoO42-+3H2O+9Cl-+2SO42-.
(14)
Концентраты обрабатывают растворами гипохлорита
натрия при температурах не выше 40 ˚С. Скорость реакции линейно возрастает
с увеличением концентрации гипохлорита и мало зависит от концентрации щелочи.
Высокое извлечение молибдена при окислительном
выщелачивании растворами гипохлорита натрия достигается даже при обработке
бедных руд, содержащих 0,015 % Mo
(~ 93 %), если процесс ведут методом перколяции.
.4 Выбор и технико-экономическое
обоснование предлагаемой технологии получения триоксида молибдена
Из вышеперечисленных методов получения триоксида
молибдена мы выбираем окислительный обжиг в печах КС.
Окислительный обжиг применительно к стандартным
концентратам характеризуется высокими экономическими показателями. Получаемые
огарки непосредственно направляют на получение чистых соединений.
Опыт работы промышленных печей показал несомненные
преимущества обжига в КС в случае последующей гидрометаллургической переработки
огарков:
1) производительность печи в 15-20 раз выше,
чем у многоподовой;
2) процесс полностью автоматизирован;
3) обжиг ведут за счет теплоты реакции при
строго определенной температуре;
) качество получаемых огарков выше, чем в
подовых печах;
) улучшенный массо- и теплообмен, что
ведет к увеличению скорости реакции;
) возможность непрерывного проведения
процесса.
Для переработки огарка мы выбираем способ
аммиачного выщелачивания, так как способ возгонки дает возможность получить
триоксид молибдена достаточно высокой чистоты лишь из богатых с малым
содержанием примесей молибденитовых концентратов. Другой недостаток возгонки -
малая насыпная масса возогнанного триоксида молибдена, что затрудняет его
дальнейшую переработку [2].
2.5 Описание
технологии получения триоксида молибдена
технологическая схема получения триоксида
молибдена из молибденитового концентрата.
Концентрат
Бетонит, Н2О Воздух
Грануляция
% NH4OH
Гранулы
Приготовление
9 % NH4OH
Окислительный обжиг
% NH4OH
Огарок ПГС
Выщелачивание Пылеулавливание
Пульпа Газы Пыль
Фильтрация На обезвреживание
Кек Раствор (NH4)2S
Очистка от примесей
Пульпа
Фильтрация
Очищенный раствор Сульфатный кек Н2О
Выпарка Промывка
ПГС (NH3,
H2O)
Насыщенный раствор Пульпа
Улавливание Кристаллизация Фильртация
Отделение ПМА Кек Промывные воды
Раствор ПМА В отвал На приготовление
% NH4OH
Сушка и прокалка
ПГС (NH3,
H2O)
MoO3
Молибденитовый концентрат вместе с оборотной
пылью, бетонитом и водой поступает на грануляцию. Полученные гранулы отправляют
на окислительный обжиг в печах КС.
В печи создают кипящий слой из огарка, который
разогревают горелками, затем включают систему питания печи.
Вследствие близости температур возгорания
молибденитового концентрата в КС (500÷510
˚С) и начала спекания огарков (580÷590
˚С) обжиг концентрата можно проводить лишь при относительно низкой
температуре в слое, поддерживаемой в пределах (560÷570)
˚С.
С газами уносится (20÷40)
% концентрата. Система, состоящая из циклонов и мокрого электрофильтра,
обеспечивает полное улавливание пыли. Пыль возвращают на обжиг после
предварительной грануляции.
Огарок непрерывно выгружается и поступает на
выщелачивание.
Молибденовые огарки выщелачивают (8÷10)
%-ным раствором аммиака на холоду или при нагревании до (50÷60)
˚С. При обработке огарка аммиачной водой триоксид молибдена извлекается в
раствор. Кроме триоксида молибдена в аммиачной воде легко растворяются
молибдаты и сульфаты меди, цинка, никеля, молибдаты железа растворяются
частично. Расход аммиака колеблется от 120 до 140 % от стехиометрического, при
этом необходимо сохранять в конечных растворах избыточную концентрацию аммиака
для предотвращения образования полимолибдатов.
В зависимости от состава огарков извлечение молибдена
в аммиачный раствор составляет (80÷90)
%.
Полученные аммиачные растворы содержат много
примесей. Примеси меди и железа могут быть достаточно полно выделены из
растворов осаждением их сульфидов сернистым аммонием.
Количество добавляемого сернистого аммония
тщательно контролируют, так как при избытке его в растворе образуются
сульфосоли молибдена, загрязняющие конечный продукт. Раствор сернистого аммония
вливают в аммиачный раствор небольшими порциями. Избыток сернистого аммония
ликвидируют, добавлением некоторого количества свежего аммиачного раствора.
Объемистый осадок сульфидов меди и железа
сорбирует некоторое количество молибдата аммония, вследствие этого потери
молибдена с осадком составляют примерно 0,3 %.
Полученную пульпу фильтруют и направляют
очищенный раствор на выпарку с целью выделения ПМА.
Выпарку проводят в две стадии. Предварительно
выпарку ведут до плотности (1,2÷1,23)
гр/см3, после чего растворы отстаивают и затем фильтруют для отделения
небольшого осадка сульфидов меди и железа. Затем проводят основную выпарку до
плотности (1,38÷1,4) гр/см3
после чего горячий раствор фильтруют и собирают в кристаллизаторе.
По мере охлаждения из раствора выделяется
мелкокристаллический осадок ПМА, который отделяют от маточного раствора
центрифугированием и промывают холодной дистиллированной водой непосредственно
в центрифуге. Проводят несколько последовательных кристаллизаций. ПМА от первых
двух кристаллизаций поступает на термическое разложение для получения триоксида
молибдена.
Термическое разложение проводят при (450÷500)
˚С в трубчатых печах непрерывного действия.
При соответствующем режиме работы полученный
порошок триоксида молибдена однороден и имеет бледно-желтый цвет. Белые
включения свидетельствуют о неполном разложении соли, а черные включения -
показатель частичного восстановления MoO3
аммиаком, что возможно при недостаточно быстром удалении газообразных продуктов
разложения [2].
3. Металлургические расчеты
.1 Расчет материального баланса
получения триоксида молибдена
Расчёт проводится по технологической схеме,
представленной на рисунке 1.
По данным практики принимаем следующий состав
концентрата, % : Мо - 48; Fe - 1,59; Сu - 0,69; S - 33,9; SiO2 - 9,8; Na2O -
0,13; Al2O3 - 0,21; CaO - 0,5; прочие - 4,8.
Минералогический состав концентрата представлен
следующим образом: молибден содержится в виде MoS2, медь - в CuFeS2, железо - в
FeS2 и CuFeS2, оксид кальция - в CaCO3, оксиды алюминия, натрия и кремния - в
NaAlSi3O8, сера - в MoS2, FeS2, CuFeS2.
По данным о составе молибденитового концентрата
проводим расчет рационального состава концентрата. Расчет ведем на 100 кг
концентрата. Результаты расчета сведены в таблицу 1.
Таблица 1 - Рациональный состав концентрата
|
Составляющие
концентрата
|
Mo
|
Fe
|
Cu
|
S
|
SiO2
|
Na2O
|
Al2O3
|
CaO
|
CO2
|
Прочие
|
Всего
|
|
MoS2
|
48
|
|
|
32,1
|
|
|
|
|
|
|
80,1
|
|
FeS2
|
|
0,98
|
|
1,12
|
|
|
|
|
|
|
2,1
|
|
CuFeS2
|
|
0,61
|
0,69
|
0,7
|
|
|
|
|
|
|
2
|
|
SiO2
|
|
|
|
|
9
|
|
|
|
|
|
9
|
|
NaAlSi3O8
|
|
|
|
|
0,76
|
0,13
|
0,21
|
|
|
|
1,1
|
|
CaCO3
|
|
|
|
|
|
|
|
0,5
|
0,4
|
|
0,9
|
|
Прочие
|
|
|
|
|
|
|
|
|
|
4,8
|
4,8
|
|
Итого
|
48
|
1,59
|
0,69
|
33,9
|
9,8
|
0,13
|
0,21
|
0,5
|
0,4
|
4,8
|
100
|
Расчет процесса окислительного обжига
молибденитового концентрата в печах кипящего слоя [4]
В процессе окислительного обжига протекают
следующие реакции:
MoS2 + 7/2О2
= MoO3 + 2SO2 (15)+ 6MoO3 =7 MoО2
+ 2SO2 (16)+ 3/2O2 = MeO + SO2 (17)
SO2 + O2 =2SO3 (18)+ O2 = MeSO4
(19)+ MoO3 = MeMoO4 (20)+ MoO3= MeMoO4 + SO3 (21)+ MoO3= CaMoO4 + CO2 (22)
Состав шихты грануляции
Принимаем, что для приготовления гранул к
концентрату необходимо добавить 31,5 % оборотной пыли, 10 % бетонита и 20 %
воды. Тогда шихта будет содержать 100 кг концентрата, 31,5 кг оборотной пыли,
10 кг бетонита и 20 кг воды. Рациональный состав оборотной пыли приведен в
таблице 2.
Таблица 2 - Рациональный состав оборотной пыли
|
Составляющие
оборотной пыли
|
Mo
|
Cu
|
Fe
|
SSO4
|
SS
|
CaO
|
SiO2
|
Al2O3
|
Na2O
|
O
|
Прочие
|
Всего
|
|
MoO3
|
37,9
|
|
|
|
|
|
|
|
|
18,93
|
|
56,78
|
|
MoS2
|
9
|
|
|
|
6,01
|
|
|
|
|
|
|
15,01
|
|
FeMoO4
|
0,26
|
|
0,15
|
|
|
|
|
|
|
0,17
|
|
0,58
|
|
CuMoO4
|
0,13
|
0,09
|
|
|
|
|
|
|
|
0,09
|
|
0,31
|
|
CaMoO4
|
0,47
|
|
|
|
|
0,28
|
|
|
|
0,24
|
|
0,99
|
|
Fe2(SO4)3
|
|
|
0,16
|
0,13
|
|
|
|
|
|
0,27
|
|
0,56
|
|
Fe2O3
|
|
|
1,25
|
|
|
|
|
|
|
0,54
|
|
1,79
|
|
CuSO4
|
|
0,24
|
|
0,12
|
|
|
|
|
|
0,25
|
|
0,61
|
|
CuO
|
|
0,4
|
|
|
|
|
|
|
|
0,1
|
|
0,5
|
|
CaSO4
|
|
|
|
0,21
|
|
0,37
|
|
|
|
0,33
|
|
0,91
|
|
Al2O3
|
|
|
|
|
|
|
|
3,63
|
|
|
|
3,63
|
|
Na2O
|
|
|
|
|
|
|
|
|
0,67
|
|
|
0,67
|
|
SiO2
|
|
|
|
|
|
|
13,34
|
|
|
|
|
13,34
|
|
Прочие
|
|
|
|
|
|
|
|
|
|
|
4,32
|
4,32
|
|
Итого
|
47,7
|
0,73
|
1,56
|
0,46
|
6,01
|
0,65
|
13,34
|
3,63
|
0,67
|
20,92
|
4,32
|
100
|
С пылью в шихту поступает, кг: 17,89 MoO3; 4,73
MoS2; 0,18 FeMoO4; 0,1 CuMoO4; 0,31 CaMoO4; 0,18 Fe2(SO4)3; 0,56 Fe2O3; 0,19
CuSO4; 0,16 CuO; 0,29 CaSO4; 4,2 SiO2; 1,14 Al2O3; 0,21 Na2O; 1,36 прочие.
Состав бетонита, %: 46 SiO2; 0,5 CaO; 38 Al2O3;
15 H2O; 0,5 прочие.
С бетонитом в шихту поступает, кг: 4,6 SiO2; 3,8
Al2O3; 0,05 CaO; 1,5 H2O; 0,05 прочие.
Тогда шихта грануляции будет содержать, кг:
17,89 MoO3; 84,83 MoS2; 2,1 FeS2; 2 CuFeS2; 1,1 NaAlSi3O8; 0,9 CaCO3; 0,18
FeMoO4; 0,1 CuMoO4; 0,31 CaMoO4; 0,18 Fe2(SO4)3; 0,56 Fe2O3; 0,19 CuSO4; 0,16
CuO; 0,29 CaSO4; 17,8 SiO2; 4,94 Al2O3; 0,21 Na2O; 0,05 CaO; 21,5 H2O; 6,21
прочие. Всего 161,5 кг.
Материальный баланс процесса грануляции приведен
в таблице 3.
Таблица 3 - Материальный баланс грануляции
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Концентрат
|
100
|
|
61,92
|
1.
Гранулы
|
161,5
|
63,03
|
100
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoS2
|
80,1
|
48
|
49,60
|
MoO3
|
17,89
|
11,92
|
11,08
|
|
FeS2
|
2,1
|
|
1,30
|
MoS2
|
84,83
|
50,84
|
52,53
|
|
CuFeS2
|
2
|
|
1,24
|
FeS2
|
|
1,30
|
|
SiO2
|
9
|
|
5,57
|
CuFeS2
|
2
|
|
1,24
|
|
NaAlSi3O8
|
1,1
|
|
0,68
|
NaAlSi3O8
|
1,1
|
|
0,68
|
|
CaCO3
|
0,9
|
|
0,56
|
CaCO3
|
0,9
|
|
0,56
|
|
Прочие
|
4,8
|
|
2,97
|
FeMoO4
|
0,18
|
0,08
|
0,11
|
|
2.
Оборотная пыль
|
31,5
|
15,03
|
19,50
|
CuMoO4
|
0,1
|
0,04
|
0,06
|
|
В
том числе:
|
|
|
|
CaMoO4
|
0,31
|
0,15
|
0,19
|
|
MoO3
|
17,89
|
11,92
|
11,08
|
Fe2(SO4)3
|
0,18
|
|
0,11
|
|
MoS2
|
4,73
|
2,84
|
2,93
|
Fe2O3
|
0,56
|
|
0,35
|
|
FeMoO4
|
0,18
|
0,08
|
0,11
|
CuSO4
|
0,19
|
|
0,12
|
|
CuMoO4
|
0,1
|
0,04
|
0,06
|
CuO
|
0,16
|
|
0,10
|
|
CaMoO4
|
0,31
|
0,15
|
0,19
|
CaSO4
|
0,29
|
|
0,18
|
|
Fe2(SO4)3
|
0,18
|
|
0,11
|
SiO2
|
17,8
|
|
11,02
|
|
Fe2O3
|
0,56
|
|
0,35
|
Al2O3
|
4,94
|
|
3,06
|
|
CuSO4
|
0,19
|
|
0,12
|
Na2O
|
0,21
|
|
0,13
|
|
CuO
|
0,16
|
|
0,10
|
CaO
|
0,05
|
|
0,03
|
|
CaSO4
|
0,29
|
|
0,18
|
H2O
|
21,5
|
|
13,31
|
|
Al2O3
|
1,14
|
|
0,71
|
Прочие
|
6,21
|
|
3,85
|
|
Na2O
|
0,21
|
|
0,13
|
|
|
|
|
|
SiO2
|
4,2
|
|
2,60
|
|
|
|
|
|
Прочие
|
1,36
|
|
0,84
|
|
|
|
|
|
3.
Бетонит
|
10
|
|
6,19
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
SiO2
|
4,6
|
|
2,85
|
|
|
|
|
|
Al2O3
|
3,8
|
|
2,35
|
|
|
|
|
|
Na2O
|
0,05
|
|
0,03
|
|
|
|
|
|
H2O
|
1,5
|
|
0,93
|
|
|
|
|
|
Прочие
|
0,05
|
|
0,03
|
|
|
|
|
|
4.
H2O
|
20
|
|
12,38
|
|
|
|
|
|
Итого
|
161,5
|
63,03
|
100
|
Итого
|
161,5
|
63,03
|
100
|
Рациональный состав огарка и оборотной пыли
Для расчет принимаем, что содержание сульфидной
серы в огарке равно 0,6 %, а в оборотной пыли - 6 %. Железо на 10 % связано в
Fe2(SO4)3, на 80 % в Fe2O3, на 10 % в FeMoO4. Медь на 60 % окисляется до CuO,
на 30 % до CuSO4, 10 % меди образует CuMoO4. Оксид кальция на 10 % образует
CaMoO4, а остальной образует CaSO4. Оксиды алюминия, кремния, натрия и прочие
переходят в огарок и пыль без изменений.
Тогда в пыли и огарке будет находиться:
Fe в Fe2(SO4)3: 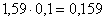 кг,
кг,
количество Fe2(SO4)3: 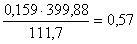 кг,
кг,
всего Fe2(SO4)3: 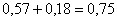 кг.
кг.
Fe в Fe2O3: 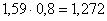 кг,
кг,
количество Fe2O3: 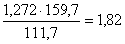 кг,
кг,
всего Fe2O3:  кг.
кг.
Fe в FeMoO4: 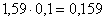 кг,
кг,
количество FeMoO4: 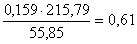 кг,
кг,
всего FeMoO4: 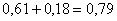 кг.в CuO:
кг.в CuO: 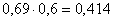 кг,
кг,
количество CuO: 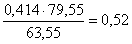 кг,
кг,
всего CuO: 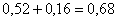 кг.в CuSO4:
кг.в CuSO4:
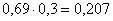 кг,
кг,
количество CuSO4:  кг,
кг,
всего CuSO4: 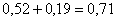 кг.в
CuMoO4:
кг.в
CuMoO4: 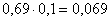 кг,
кг,
количество CuMoO4: 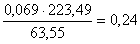 кг,
кг,
всего CuMoO4: 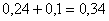 кг.в
CaMoO4:
кг.в
CaMoO4: 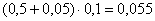 кг,
кг,
количество CaMoO4: 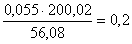 кг,
кг,
всего CaMoO4: 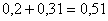 кг.в CaSO4:
кг.в CaSO4:
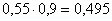 кг,
кг,
количество CaSO4: 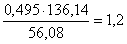 кг,
кг,
всего CaSO4: 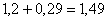 кг.
кг.
O3: 5,15 кг.O: 0,34 кг.: 18,56 кг.
Прочие: 6,21 кг.
Распределение этих составляющих
между огарком и пылью следующее: 65 % переходит в огарок, 35 5 - в пыль.
В огарке будет содержаться, кг: 0,49
Fe2(SO4)3; 1,55
Fe2O3; 0,51 FeMoO4 (в нем 0,23 Mo); 0,44 CuO; 0,46 CuSO4; 0,22
CuMoO4 (в нем 0,09 Mo); 0,33 CaMoO4 (в нем 0,16 Mo); 0,97
CaSO4; 3,35 Al2O3; 0,22 Na2O; 12,06 SiO2; 4,04 прочие. Всего 24,64 кг.
Рассчитаем количество огарка, исходя
из содержания в нем сульфидной серы (0,6 %). Принимаем количество огарка равным
х кг. Тогда в нем сульфидной серы будет 0,006х . Определяем количество MoS2 в огарке,
так как сульфидная сера связана только с молибденом:
MoS2 - Mo -
2S
,06 - 95,94
- 64,12- b - 0,006х
Тогда MoS2=0,015х.
В
нем 0,009х молибдена и 0,006х серы.
Общее количество молибдена в огарке
составит
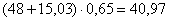 кг.
кг.
Количество молибдена, связанного в
триоксид MoO3, будет равно:
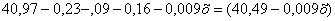 кг.
кг.
Количество MoO3: MoO3 - Mo - 3O
,94 - 95,94 - 48
a - b -
(40,49-0,009х)
=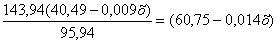 кг.
кг.
Количество огарка будет равно 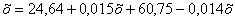 . Отсюда
х=85,47 кг.
. Отсюда
х=85,47 кг.
В нем MoS2 содержится
1,28 кг (Mo=0,77 кг; S=0,51 кг),
MoO3=59,55 кг (Mo=39,69 кг; O=19,86 кг).
Рациональный состав огарка
представлен в таблице 4.
Таблица 4
- Рациональный состав огарка
|
Составляющие
огарка
|
Mo
|
Cu
|
Fe
|
SSO4
|
SS
|
CaO
|
SiO2
|
Al2O3
|
Na2O
|
O
|
Прочие
|
Всего
|
|
MoO3
|
39,69
|
|
|
|
|
|
|
|
|
19,86
|
|
59,55
|
|
MoS2
|
0,77
|
|
|
|
0,51
|
|
|
|
|
|
|
1,28
|
|
FeMoO4
|
0,23
|
|
0,13
|
|
|
|
|
|
|
0,15
|
|
0,51
|
|
CuMoO4
|
0,09
|
0,06
|
|
|
|
|
|
|
|
0,07
|
|
0,22
|
|
CaMoO4
|
0,16
|
|
|
|
|
0,09
|
|
|
|
0,08
|
|
0,33
|
|
Fe2(SO4)3
|
|
|
0,14
|
0,12
|
|
|
|
|
|
0,23
|
|
0,49
|
|
Fe2O3
|
|
|
1,08
|
|
|
|
|
|
|
0,47
|
|
1,55
|
|
CuSO4
|
|
0,18
|
|
0,09
|
|
|
|
|
|
0,19
|
|
0,46
|
|
CuO
|
|
0,35
|
|
|
|
|
|
|
|
0,09
|
|
0,44
|
|
CaSO4
|
|
|
|
0,23
|
|
0,4
|
|
|
|
0,34
|
|
0,97
|
|
Al2O3
|
|
|
|
|
|
|
|
3,35
|
|
|
|
3,55
|
|
Na2O
|
|
|
|
|
|
|
|
|
0,22
|
|
|
0,22
|
|
SiO2
|
|
|
|
|
|
|
12,06
|
|
|
|
|
12,06
|
|
Прочие
|
|
|
|
|
|
|
|
|
|
|
4,04
|
4,04
|
|
Итого
|
40,94
|
0,59
|
1,35
|
0,44
|
0,51
|
0,49
|
12,06
|
3,35
|
0,22
|
21,48
|
4,04
|
85,47
|
В пыль
перейдет,
кг:
0,26 Fe2(SO4)3; 0,83 Fe2O3; 0,28 FeMoO4 (в
нем
0,12 Mo); 0,24 CuO; 0,25 CuSO4; 0,12 CuMoO4 (в
нем
0,05 Mo); 0,18 CaMoO4 (в нем
0,09 Mo); 0,52 CaSO4; 1,8 Al2O3; 0,12 Na2O; 6,5 SiO2; 2,17 прочие.
Всего
13,27 кг.
В ней общее количество молибдена
составит 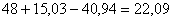 кг, в том
числе связанного в MoS2 и MoO3
кг, в том
числе связанного в MoS2 и MoO3 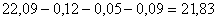 кг.
кг.
Расчет количества пыли проводим
аналогично расчету количества огарка. Принимаем количество пыли - у кг. Тогда в
ней сульфидной серы будет 0,06у. Количество MoS2 в пыли будет равно:
- Mo - 2S
,06 - 95,94 - 64,12- b - 0,06у
Тогда MoS2=0,15у.
В
нем находится 0,09у молибдена и 0,06у серы.
Количество молибдена, связанного в MoO3, равно
(21,83-0,09у) кг.
Количество MoO3 в пыли:
- Mo
- 3O
,94 - 95,94 - 48
a - b
- (21,83-0,09у)
Отсюда MoO3=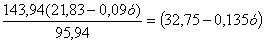 кг.
кг.
Количество пыли будет равно
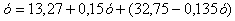 .
.
Отсюда у=46,72 кг, в ней MoS2
содержится 7,01 кг (Mo=4,21 кг; S=2,8 кг),
MoO3 - 26,44 кг (Mo=17,62 кг; O=8,82 кг).
Рациональный состав пыли представлен
в таблице 5.
Таблица 5 - Рациональный состав оборотной пыли
|
Составляющие
огарка
|
Mo
|
Cu
|
Fe
|
SSO4
|
SS
|
CaO
|
SiO2
|
Al2O3
|
Na2O
|
O
|
Прочие
|
Всего
|
|
MoO3
|
17,62
|
|
|
|
|
|
|
|
|
8,82
|
|
26,44
|
|
MoS2
|
4,21
|
|
|
|
2,8
|
|
|
|
|
|
|
7,01
|
|
FeMoO4
|
0,12
|
|
0,07
|
|
|
|
|
|
|
0,09
|
|
0,28
|
|
CuMoO4
|
0,05
|
0,03
|
|
|
|
|
|
|
|
0,04
|
|
0,12
|
|
CaMoO4
|
0,09
|
|
|
|
|
0,05
|
|
|
|
0,04
|
|
0,18
|
|
Fe2(SO4)3
|
|
|
0,07
|
0,06
|
|
|
|
|
|
0,13
|
|
0,26
|
|
Fe2O3
|
|
|
0,58
|
|
|
|
|
|
|
0,25
|
|
0,83
|
|
CuSO4
|
|
0,1
|
|
0,05
|
|
|
|
|
|
0,1
|
|
0,25
|
|
CuO
|
|
0,19
|
|
|
|
|
|
|
|
0,05
|
|
0,24
|
|
CaSO4
|
|
|
|
0,12
|
|
0,21
|
|
|
|
0,19
|
|
Al2O3
|
|
|
|
|
|
|
|
1,8
|
|
|
|
1,8
|
|
Na2O
|
|
|
|
|
|
|
|
|
0,12
|
|
|
0,12
|
|
SiO2
|
|
|
|
|
|
|
6,5
|
|
|
|
|
6,5
|
|
Прочие
|
|
|
|
|
|
|
|
|
|
|
2,17
|
2,17
|
|
Итого
|
22,09
|
0,32
|
0,72
|
0,23
|
2,8
|
0,26
|
6,5
|
1,8
|
0,12
|
9,71
|
2,17
|
46,72
|
Расход кислорода на образование огарка и пыли:
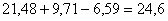 кг.
кг.
Всего для проведения обжига
потребуется кислорода:
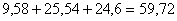 кг.
кг.
Для обеспечения кипения гранул
принимаем линейную скорость воздуха равной 30 см/с. При этом коэффициент
избытка воздуха равен 5. В процесс вводится кислорода: 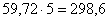 кг. С этим
кислородом поступает азота из воздуха:
кг. С этим
кислородом поступает азота из воздуха: 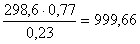 кг. Тогда необходимое количество
воздуха составит:
кг. Тогда необходимое количество
воздуха составит: 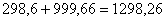 кг или
кг или 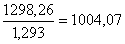 м3, где
1,293 г/ м3-удельный вес воздуха. Количество избыточного кислорода:
м3, где
1,293 г/ м3-удельный вес воздуха. Количество избыточного кислорода: 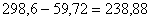 кг.
кг.
Состав обжиговых газов приведен в
таблице 6.
Таблица 6 - Состав
обжиговых газов
|
Количесиво
|
Соединения
|
Всего
|
|
SO2
|
SO3
|
CO2
|
H2O
|
N2
|
O2изб
|
|
|
кг
|
51,13
|
15,98
|
0,4
|
21,5
|
999,66
|
238,86
|
1327,55
|
|
м3
|
17,88
|
4,47
|
0,2
|
26,73
|
799,16
|
167,2
|
1015,64
|
|
%
(масс)
|
3,85
|
1,21
|
0,03
|
1,61
|
75,31
|
17,99
|
100
|
|
%
(объем)
|
1,76
|
0,44
|
0,02
|
2,63
|
78,69
|
16,46
|
100
|
Материальный баланс процесса обжига сведен в
таблице 7.
Расчет процесса аммиачного выщелачивания
молибденитовых огарков
На выщелачивание поступает 85,47 кг
молибденитового огарка. В нем находится, кг: 59,55 MoO3; 1,28 MoS2; 0,51
FeMoO4; 0,22 CuMoO4; 0,33 CaMoO4; 0,49 Fe2(SO4)3; 1,55 Fe2O3; 0,46 CuSO4; 0,44
CuO; 0,97 CaSO4; 12,06 SiO2; 3,35 Al2O3; 0,22 Na2O; 4,04 прочие.
При выщелачивании протекают следующие химические
реакции:
+2NH4OH=(NH4)2MoO4+ H2O (23)+8NH4OH=(NH4)2MoO4+[Fe(NH3)6](OH)2+6H2O
(24)
CuMoO4+6NH4OH=(NH4)2MoO4+[Cu(NH3)4](OH)2+4H2O
(25)+6NH4OH=[Cu(NH3)4](OH)2+(NH4)2SO4+4H2O (26)
Таблица 7 - Материальный баланс обжига гранул
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Гранулы
|
161,5
|
63,03
|
11,06
|
1.
Огарок
|
85,47
|
40,94
|
5,86
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
17,89
|
11,92
|
1,23
|
MoO3
|
59,55
|
39,69
|
4,08
|
|
MoS2
|
84,83
|
50,84
|
5,81
|
MoS2
|
1,28
|
0,77
|
0,09
|
|
FeS2
|
2,1
|
|
0,14
|
FeMoO4
|
0,51
|
0,23
|
0,03
|
|
CuFeS2
|
2
|
|
0,14
|
CuMoO4
|
0,22
|
0,09
|
0,02
|
|
NaAlSi3O8
|
1,1
|
|
0,08
|
CaMoO4
|
0,33
|
0,16
|
0,02
|
|
CaCO3
|
0,9
|
|
0,06
|
Fe2(SO4)3
|
0,49
|
|
0,03
|
|
FeMoO4
|
0,18
|
0,08
|
0,01
|
Fe2O3
|
1,55
|
|
0,11
|
|
CuMoO4
|
0,1
|
0,04
|
0,01
|
CuSO4
|
0,46
|
|
0,03
|
|
CaMoO4
|
0,31
|
0,15
|
0,02
|
CuO
|
0,44
|
|
0,03
|
|
Fe2(SO4)3
|
0,18
|
|
0,01
|
CaSO4
|
0,97
|
|
0,07
|
|
Fe2O3
|
0,56
|
|
0,04
|
Al2O3
|
3,35
|
|
0,23
|
|
CuSO4
|
0,19
|
|
0,01
|
Na2O
|
0,22
|
|
0,02
|
|
CuO
|
0,16
|
|
0,01
|
SiO2
|
12,06
|
|
0,83
|
|
CaSO4
|
0,29
|
|
0,02
|
Прочие
|
4,04
|
|
0,28
|
|
SiO2
|
17,8
|
|
1,22
|
2.
Оборотная пыль
|
46,72
|
22,09
|
3,20
|
|
Al2O3
|
4,94
|
|
0,34
|
В
том числе:
|
|
|
|
|
Na2O
|
0,21
|
|
0,01
|
MoO3
|
26,44
|
17,62
|
1,81
|
|
CaO
|
0,05
|
|
0,00
|
MoS2
|
7,01
|
4,21
|
0,48
|
|
H2O
|
21,5
|
|
1,47
|
FeMoO4
|
0,28
|
0,12
|
0,02
|
|
Прочие
|
6,21
|
|
0,43
|
CuMoO4
|
0,12
|
0,05
|
0,01
|
|
2.
Воздух
|
1298,26
|
|
88,94
|
CaMoO4
|
0,18
|
0,09
|
0,01
|
|
В
том числе:
|
|
|
|
Fe2(SO4)3
|
0,26
|
|
0,02
|
|
O2
|
298,6
|
|
20,46
|
Fe2O3
|
0,83
|
|
0,06
|
|
N2
|
999,66
|
|
68,48
|
CuSO4
|
0,25
|
|
0,02
|
|
|
|
|
CuO
|
0,24
|
|
0,02
|
|
|
|
|
CaSO4
|
0,52
|
|
0,04
|
|
|
|
|
Al2O3
|
1,8
|
|
0,12
|
|
|
|
|
Na2O
|
0,12
|
|
0,01
|
|
|
|
|
SiO2
|
6,5
|
|
0,45
|
|
|
|
|
Прочие
|
2,17
|
|
0,15
|
|
|
|
|
3.
Газы
|
1327,55
|
|
90,94
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
SO2
|
51,13
|
|
3,50
|
|
|
|
|
SO3
|
15,98
|
|
1,09
|
|
|
|
|
CO2
|
0,4
|
|
0,03
|
|
|
|
|
H2O
|
21,5
|
|
1,47
|
|
|
|
|
N2
|
999,66
|
|
68,48
|
|
|
|
|
O2изб
|
238,88
|
|
16,36
|
|
Итого
|
1459,76
|
63,03
|
100
|
Итого:
|
1459,74
|
63,03
|
100
|
молибден технология
получение триоксид
Рассчитываем количество аммиака, необходимого
для выщелачивания триоксида молибдена по реакции (23). Расход аммиака составит
29,01 кг, при этом образуется 81,1 кг (NH4)2MoO4
и 7,46 кг H2O.
По реакции (24) расходуется 0,33 кг аммиака и
образуется 0,23 кг (NH4)2MoO4,
0,23 кг [Fe(NH3)6](OH)2
и 0,13 кг H2O.
По реакции (25) расходуется 0,02 кг аммиака и
образуется 0,19 кг (NH4)2MoO4,
0,16 кг [Cu(NH3)4](OH)2
и 0,07 кг H2O.
По реакции (26) расходуется 0,61 кг аммиака и
образуется 0,48 кг [Cu(NH3)4](OH)2,
0,38 кг (NH4)2SO4
и 0,05 кг H2O.
Всего необходимо аммиака 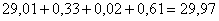 кг.
кг.
Принимаем, что избыток аммиака равен
40 %. Это будет 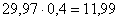 кг. Всего
потребуется аммиака
кг. Всего
потребуется аммиака  кг.
кг.
Выщелачивание проводится 9 %-ым
раствором аммиака. Тогда количество аммиачного раствора составит 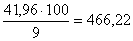 кг, или
кг, или 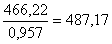 м3, где
0,957 кг/м3 - плотность раствора 9 %-го аммиака.
м3, где
0,957 кг/м3 - плотность раствора 9 %-го аммиака.
Количество нерастворимого остатка
составит:
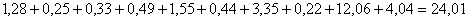 кг.
кг.
Кроме того, в остаток перейдет часть
молибдена из раствора в результате протекания реакции (27).
CaSO4+(NH4)2MoO4=
CaMoO4+(NH4)2SO4 (27)
В результате реакции образуется 1,43
кг CaMoO4, 0,94 кг (NH4)2SO4 и
расходуется 1,4 кг (NH4)2MoO4.
Общее количество кека составит  кг. В кеке
содежится молибдена:
кг. В кеке
содежится молибдена:
в MoS2 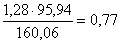 кг,
кг,
в FeMoO4 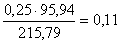 кг,
кг,
в CaMoO4 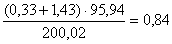 кг
кг
Итого 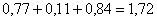 кг, или
кг, или 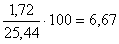 %.
%.
В огарке было молибдена:
в MoO3 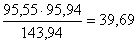 кг,
кг,
в MoS2 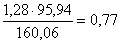 кг,
кг,
в FeMoO4 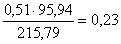 кг,
кг,
в CuMoO4 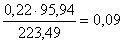 кг,
кг,
в CaMoO4 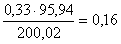 кг.
кг.
Всего 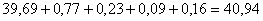 кг.
кг.
В растворе будет молибдена 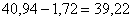 кг.
Извлечение молибдена в раствор составит
кг.
Извлечение молибдена в раствор составит 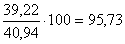 %.
%.
Общее количество раствора после
выщелачивания оставит:

Результаты расчетов сводим в таблицу
8.
Таблица 8 - Материальный баланс процесса
выщелачивания
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Огарок
|
85,47
|
40,94
|
15,49
|
1.
Раствор
|
526,27
|
95,39
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
59,55
|
39,69
|
10,79
|
(NH4)2MoO4
|
80,12
|
39,22
|
14,52
|
|
MoS2
|
1,28
|
0,77
|
0,23
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,12
|
|
FeMoO4
|
0,51
|
0,23
|
0,09
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
|
CuMoO4
|
0,22
|
0,09
|
0,04
|
(NH4)2SO4
|
1,32
|
|
0,24
|
|
CaMoO4
|
0,33
|
0,16
|
0,06
|
H2O
|
431,97
|
|
78,30
|
|
Fe2(SO4)3
|
0,49
|
|
0,09
|
NH4OHизб
|
11,99
|
|
2,17
|
|
Fe2O3
|
1,55
|
|
0,28
|
2.
Кек
|
25,44
|
1,72
|
4,61
|
|
CuSO4
|
0,46
|
|
0,08
|
В
том числе:
|
|
|
|
|
CuO
|
0,44
|
|
0,08
|
MoS2
|
1,28
|
0,77
|
0,23
|
|
CaSO4
|
0,97
|
|
0,18
|
FeMoO4
|
0,25
|
0,11
|
0,05
|
|
Al2O3
|
3,35
|
|
0,61
|
CaMoO4
|
0,33
|
0,84
|
0,06
|
|
Na2O
|
0,22
|
|
0,04
|
Fe2(SO4)3
|
1,55
|
|
0,28
|
|
SiO2
|
12,06
|
|
2,19
|
Fe2O3
|
0,44
|
|
0,08
|
|
Прочие
|
4,04
|
|
0,73
|
CuO
|
3,35
|
|
0,61
|
|
2.
Раствор
|
|
|
|
Al2O3
|
0,22
|
|
0,04
|
|
аммиака
|
466,22
|
|
84,51
|
Na2O
|
12,06
|
|
2,19
|
|
В
том числе:
|
|
|
|
SiO2
|
0,49
|
|
0,09
|
|
NH4OH
|
41,96
|
|
7,61
|
Прочие
|
4,04
|
|
0,73
|
|
H2O
|
424026
|
|
76859,47
|
|
|
|
|
|
Итого
|
551,69
|
40,94
|
100
|
Итого
|
551,71
|
40,94
|
100
|
Расчет процесса фильтрации и промывки
На фильтрацию и промывку поступает 551,71 кг
пульпы и вода.
В таблице 9 приведен материальный баланс
фильтрации и промывки.
Таблица 9 - Материальный баланс фильтрации и
промывки
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Пульпа
|
551,71
|
40,94
|
98,64
|
1.
Раствор
|
526,27
|
39,22
|
94,09
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
раствор
|
526,27
|
39,22
|
94,09
|
(NH4)2MoO4
|
80,12
|
39,22
|
14,32
|
|
(NH4)2MoO4
|
80,12
|
39,22
|
14,32
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,11
|
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,11
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
(NH4)2SO4
|
1,32
|
|
0,24
|
|
(NH4)2SO4
|
1,32
|
|
0,24
|
H2O
|
431,97
|
|
77,23
|
|
H2O
|
431,97
|
|
77,23
|
NH4OHизб
|
11,99
|
|
2,14
|
|
NH4OHизб
|
11,99
|
|
2,14
|
2.
Кек
|
25,44
|
1,72
|
4,55
|
|
кек
|
25,44
|
1,72
|
4,55
|
В
том числе:
|
|
|
|
|
MoS2
|
1,28
|
0,77
|
0,23
|
MoS2
|
1,28
|
0,77
|
0,23
|
|
FeMoO4
|
0,25
|
0,11
|
0,04
|
FeMoO4
|
0,25
|
0,11
|
0,04
|
|
CaMoO4
|
0,33
|
0,84
|
0,06
|
CaMoO4
|
0,33
|
0,84
|
0,06
|
|
Fe2(SO4)3
|
1,55
|
|
0,28
|
Fe2(SO4)3
|
1,55
|
|
0,28
|
|
Fe2O3
|
0,44
|
|
0,08
|
Fe2O3
|
0,44
|
|
0,08
|
|
CuO
|
3,35
|
|
0,60
|
CuO
|
3,35
|
|
0,60
|
|
Al2O3
|
0,22
|
|
0,04
|
Al2O3
|
0,22
|
|
0,04
|
|
Na2O
|
12,06
|
|
2,16
|
Na2O
|
12,06
|
|
2,16
|
|
SiO2
|
0,49
|
|
0,09
|
SiO2
|
0,49
|
|
0,09
|
|
Прочие
|
4,04
|
|
0,72
|
Прочие
|
4,04
|
|
0,72
|
|
2.
Вода
|
7,63
|
|
1,36
|
3.
Пром. вода
|
7,63
|
|
1,36
|
|
Итого
|
559,34
|
40,94
|
100
|
Итого
|
559,34
|
40,94
|
100
|
Процесс очистки от меди и железа
На очистку от примесей поступает раствор, кг:
80,12 (NH4)2MoO4; 0,64 [Cu(NH3)4](OH)2; 0,23 [Fe(NH3)6](OH)2; 1,32 (NH4)2SO4;
431,97 H2O; 11,99 NH4OHизб. Всего 526,27 кг.
Примеси меди и железа выделяют осаждением их
сульфидов сернистым аммонием. При этом протекают реакции:
[Cu(NH3)4](OH)2+(NH4)2S+4H2O=
CuS+6NH4OH
(28)
[Fe(NH3)6](OH)2+(NH4)2S+6H2O=
FeS+8NH4OH (29)
По реакции (28) расходуется 0,26 кг (NH4)2S
и 0,28 кг H2O,
образуется 0,37 кг CuS
и 0,81 кг NH4OH.
По реакции (29) расходуется 0,08 кг (NH4)2S
и 0,13 кг H2O,
образуется 0,11 кг FeS
и 0,33 кг NH4OH.
Масса осадка составит 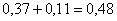 кг. Потери
молибдена с осадком 0,03 % от количества осадка, что составляет 0,0029 кг
(NH4)2MoO4.
кг. Потери
молибдена с осадком 0,03 % от количества осадка, что составляет 0,0029 кг
(NH4)2MoO4.
Материальный баланс очистки от меди и
железа представлен в таблице 10.
Таблица 10 - Материальный баланс
очистки от меди и железа
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Раствор
|
526,27
|
39,22
|
99,94
|
1.
Осадок
|
0,4829
|
0,001
|
0,09
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
80,12
|
39,22
|
15,21
|
(NH4)2MoO4
|
0,0029
|
0,001
|
0,00055
|
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,12
|
CuS
|
0,37
|
|
0,07
|
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
FeS
|
0,11
|
|
0,02
|
|
(NH4)2SO4
|
1,32
|
|
0,25
|
2.
Очищ. раствор
|
526,1271
|
39,218
|
99,91
|
|
H2O
|
431,97
|
|
82,03
|
В
том числе:
|
|
|
|
|
NH4OHизб
|
11,99
|
|
2,28
|
(NH4)2MoO4
|
80,1171
|
39,218
|
15,21
|
0,34
|
|
0,06
|
(NH4)2SO4
|
1,32
|
|
0,25
|
|
|
|
|
|
NH4OH
|
13,13
|
|
2,49
|
|
|
|
|
|
H2O
|
431,56
|
|
81,95
|
|
Итого
|
526,61
|
39,22
|
100
|
Итого
|
526,61
|
39,22
|
100
|
Выпарка, охлаждение и центрифугирование
На выпарку поступает раствор очищенный от
примесей, кг: 80,1171 (NH4)2MoO4; 1,32 (NH4)2SO4; 13,13 NH4OH; 431,56 H2O.
Всего 526,1271.
Выпаривание проводим на 75 %. После
выпаривания остается 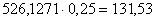 кг
раствора.
кг
раствора.
В процессе выпарки протекают
реакции:
7(NH4)2MoO4=(NH4)6Mo7O24+8
NH3+4 H2O (30)
NH4OH=NH3+H2O (31)
В реакции (30) участвует 75 %
(NH4)2MoO4 при этом образуется 50,96 кг ПМА, 5,97 кг NH3 и 3,16 кг H2O. В реакции
(31) образуется 6,38 кг NH3 и 6,75 кг H2O.
Материальный баланс выпарки,
охлаждения и центрифугирования представлен в таблице 11.
Таблица 11 - Материальный баланс
выпарки, охлаждения и центрифугирования
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Очищ. раствор
|
526,1271
|
39,218
|
100
|
1.
Влажный осадок
|
66,25
|
30,578
|
12,59
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
80,1171
|
39,218
|
15,23
|
ПМА
|
50,96
|
29,4
|
9,69
|
|
(NH4)2SO4
|
1,32
|
|
0,25
|
30%
раствора
|
15,29
|
1,178
|
2,91
|
|
NH4OH
|
13,13
|
|
2,50
|
2.
Раствор
|
113,94
|
8,64
|
21,66
|
|
H2O
|
431,5
|
|
82,01
|
В
том числе:
|
|
|
|
|
|
|
|
(NH4)2MoO4
|
17,66
|
8,64
|
3,36
|
|
|
|
|
(NH4)2SO4
|
1,16
|
|
0,22
|
|
|
|
|
H2O
|
95,12
|
|
18,08
|
|
|
|
|
3.
ПГС
|
345,9371
|
|
65,75
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
NH3
|
12,35
|
|
2,35
|
|
|
|
|
H2O
|
333,5871
|
|
63,40
|
|
Итого
|
526,1271
|
39,218
|
100
|
Итого
|
526,1271
|
39,218
|
100
|
Промывка
Материальный баланс промывки представлен в
таблице 12.
Таблица 12
- Материальный баланс промывки
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Влажный осадок
|
66,25
|
30,578
|
81,25
|
1.
Влажный осадок
|
66,25
|
29,4
|
81,25
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
ПМА
|
50,96
|
29,4
|
62,50
|
ПМА
|
50,96
|
29,4
|
62,50
|
|
30%
раствора
|
15,29
|
1,178
|
18,75
|
H2O
|
15,29
|
|
18,75
|
|
2.
H2O
|
15,29
|
|
18,75
|
2.
Раствор
|
15,29
|
1,178
|
18,75
|
|
Итого
|
81,54
|
30,578
|
100
|
Итого
|
81,54
|
30,578
|
100
|
Сушка и прокалка
В процесс сушки и прокалки поступает влажный
осадок, содержащий 50,96 кг ПМА.
При прокаливании ПМА протекает реакция:
(NH4)6Mo7O24 = 7 MoO3 + 6 NH3 + 3H2O
(32)
В ходе этой реакции образуется 44,12 кг MoO3;
4,48 кг NH3 и 2,36 кг H2O.
Материальный баланс процессов сушки и прокалки
приведен в таблице 13.
Таблица 13 - Материальный баланс сушки и
прокалки
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
1.
Влажный осадок
|
66,25
|
29,4
|
100
|
1.
MoO3
|
44,12
|
29,4
|
66,60
|
|
В
том числе:
|
|
|
|
2.
ПГС
|
22,13
|
|
33,40
|
|
ПМА
|
50,96
|
29,4
|
76,92
|
В
том числе:
|
|
|
|
|
H2O
|
15,29
|
|
23,08
|
NH3
|
4,48
|
|
6,76
|
|
|
|
|
H2O
|
17,65
|
|
26,64
|
|
Итого
|
66,25
|
29,4
|
100
|
Итого
|
66,25
|
29,4
|
100
|
Таблица 14 - Сквозной материальный баланс
получения триоксида молибдена на 100 кг молибденитового концентрата
|
Поступило
|
Получено
|
|
Компонент
|
т
|
Мо,
т
|
%
|
Компонент
|
т
|
Мо,
т
|
%
|
|
Грануляция
|
|
1.
Концентрат
|
100
|
48
|
61,92
|
1.
Гранулы
|
161,5
|
63,03
|
100
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoS2
|
80,1
|
48
|
49,60
|
MoO3
|
17,89
|
11,92
|
11,08
|
|
FeS2
|
2,1
|
|
1,30
|
MoS2
|
84,83
|
50,84
|
52,53
|
|
CuFeS2
|
2
|
|
1,24
|
FeS2
|
2,1
|
|
1,30
|
|
SiO2
|
9
|
|
5,57
|
CuFeS2
|
2
|
|
1,24
|
|
NaAlSi3O8
|
1,1
|
|
0,68
|
NaAlSi3O8
|
1,1
|
|
0,68
|
|
CaCO3
|
0,9
|
|
0,56
|
CaCO3
|
0,9
|
|
0,56
|
|
Прочие
|
4,8
|
|
2,97
|
FeMoO4
|
0,18
|
0,08
|
0,11
|
|
2.
Оборотная пыль
|
31,5
|
15,03
|
19,50
|
CuMoO4
|
0,1
|
0,04
|
0,06
|
|
В
том числе:
|
|
|
|
CaMoO4
|
0,31
|
0,15
|
0,19
|
|
MoO3
|
17,89
|
11,92
|
11,08
|
Fe2(SO4)3
|
0,18
|
|
0,11
|
|
MoS2
|
4,73
|
2,84
|
2,93
|
Fe2O3
|
0,56
|
|
0,35
|
|
FeMoO4
|
0,18
|
0,08
|
0,11
|
CuSO4
|
0,19
|
|
0,12
|
|
CuMoO4
|
0,1
|
0,04
|
0,06
|
CuO
|
0,16
|
|
0,10
|
|
CaMoO4
|
0,31
|
0,15
|
0,19
|
CaSO4
|
0,29
|
|
0,18
|
|
Fe2(SO4)3
|
0,18
|
|
0,11
|
SiO2
|
|
11,02
|
|
Fe2O3
|
0,56
|
|
0,35
|
Al2O3
|
4,94
|
|
3,06
|
|
CuSO4
|
0,19
|
|
0,12
|
Na2O
|
0,21
|
|
0,13
|
|
CuO
|
0,16
|
|
0,10
|
CaO
|
0,05
|
|
0,03
|
|
CaSO4
|
0,29
|
|
0,18
|
H2O
|
21,5
|
|
13,31
|
|
Al2O3
|
1,14
|
|
0,71
|
Прочие
|
6,21
|
|
3,85
|
|
Na2O
|
0,21
|
|
0,13
|
|
|
|
|
|
SiO2
|
4,2
|
|
2,60
|
|
|
|
|
|
Прочие
|
1,36
|
|
0,84
|
|
|
|
|
|
3.
Бетонит
|
10
|
|
6,19
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
SiO2
|
4,6
|
|
2,85
|
|
|
|
|
|
Al2O3
|
3,8
|
|
2,35
|
|
|
|
|
|
Na2O
|
0,05
|
|
0,03
|
|
|
|
|
|
H2O
|
1,5
|
|
0,93
|
|
|
|
|
|
Прочие
|
0,05
|
|
0,03
|
|
|
|
|
|
4.
H2O
|
20
|
|
12,38
|
|
|
|
|
|
Итого
|
161,5
|
63,03
|
100
|
Итого
|
161,5
|
63,03
|
100
|
|
Окислительный
обжиг
|
|
1.
Гранулы
|
161,5
|
63,03
|
11,06
|
1.
Огарок
|
85,47
|
40,94
|
5,86
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
17,89
|
11,92
|
1,23
|
MoO3
|
59,55
|
39,69
|
4,08
|
|
MoS2
|
84,83
|
50,84
|
5,81
|
MoS2
|
1,28
|
0,77
|
0,09
|
|
FeS2
|
2,1
|
|
0,14
|
FeMoO4
|
0,51
|
0,23
|
0,03
|
|
CuFeS2
|
2
|
|
0,14
|
CuMoO4
|
0,22
|
0,09
|
0,02
|
|
NaAlSi3O8
|
1,1
|
|
0,08
|
CaMoO4
|
0,33
|
0,16
|
0,02
|
|
CaCO3
|
0,9
|
|
0,06
|
Fe2(SO4)3
|
0,49
|
|
0,03
|
|
FeMoO4
|
0,18
|
0,08
|
0,01
|
Fe2O3
|
1,55
|
|
0,11
|
|
CuMoO4
|
0,1
|
0,04
|
0,01
|
CuSO4
|
0,46
|
|
0,03
|
|
CaMoO4
|
0,31
|
0,15
|
0,02
|
CuO
|
0,44
|
|
0,03
|
|
Fe2(SO4)3
|
0,18
|
|
0,01
|
CaSO4
|
0,97
|
|
0,07
|
|
Fe2O3
|
0,56
|
|
0,04
|
Al2O3
|
3,35
|
|
0,23
|
|
CuSO4
|
0,19
|
|
0,01
|
Na2O
|
0,22
|
|
0,02
|
|
CuO
|
0,16
|
|
0,01
|
SiO2
|
12,06
|
|
0,83
|
|
CaSO4
|
0,29
|
|
0,02
|
Прочие
|
4,04
|
|
0,28
|
|
SiO2
|
17,8
|
|
1,22
|
2.
Оборотная пыль
|
46,72
|
22,09
|
3,20
|
|
Al2O3
|
4,94
|
|
0,34
|
В
том числе:
|
|
|
|
|
Na2O
|
0,21
|
|
0,01
|
MoO3
|
26,44
|
17,62
|
1,81
|
|
CaO
|
0,05
|
|
0,0034
|
MoS2
|
7,01
|
4,21
|
0,48
|
|
H2O
|
21,5
|
|
1,47
|
FeMoO4
|
0,28
|
0,12
|
0,02
|
|
Прочие
|
6,21
|
|
0,43
|
CuMoO4
|
0,12
|
0,05
|
0,01
|
|
2.
Воздух
|
1298,26
|
|
88,94
|
CaMoO4
|
0,18
|
0,09
|
0,01
|
|
В
том числе:
|
|
|
|
Fe2(SO4)3
|
0,26
|
|
0,02
|
|
O2
|
298,6
|
|
20,46
|
Fe2O3
|
0,83
|
|
0,06
|
|
N2
|
999,66
|
|
68,48
|
CuSO4
|
0,25
|
|
0,02
|
|
|
|
|
|
CuO
|
0,24
|
|
0,02
|
|
|
|
|
|
CaSO4
|
0,52
|
|
0,04
|
|
|
|
|
|
Al2O3
|
1,8
|
|
0,12
|
|
|
|
Na2O
|
0,12
|
|
0,01
|
|
|
|
|
|
SiO2
|
6,5
|
|
0,45
|
|
|
|
|
|
Прочие
|
2,17
|
|
0,15
|
|
|
|
|
|
3.
Газы
|
1327,55
|
|
90,94
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
SO2
|
51,13
|
|
3,50
|
|
|
|
|
|
SO3
|
15,98
|
|
1,09
|
|
|
|
|
|
CO2
|
0,4
|
|
0,03
|
|
|
|
|
|
H2O
|
21,5
|
|
1,47
|
|
|
|
|
|
N2
|
999,66
|
|
68,48
|
|
|
|
|
|
O2изб
|
238,88
|
|
16,36
|
|
Итого
|
1459,76
|
63,03
|
100
|
Итого:
|
1459,74
|
63,03
|
100
|
|
Аммиачное
выщелачивание
|
|
1.
Огарок
|
85,47
|
40,94
|
15,49
|
1.
Раствор
|
526,27
|
39,22
|
95,39
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
59,55
|
39,69
|
10,79
|
(NH4)2MoO4
|
80,12
|
39,22
|
14,52
|
|
MoS2
|
1,28
|
0,77
|
0,23
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,12
|
|
FeMoO4
|
0,51
|
0,23
|
0,09
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
|
CuMoO4
|
0,22
|
0,09
|
0,04
|
(NH4)2SO4
|
1,32
|
|
0,24
|
|
CaMoO4
|
0,33
|
0,16
|
0,06
|
H2O
|
431,97
|
|
78,30
|
|
Fe2(SO4)3
|
0,49
|
|
0,09
|
NH4OHизб
|
11,99
|
|
2,17
|
|
Fe2O3
|
1,55
|
|
0,28
|
2.
Кек
|
25,44
|
1,72
|
4,61
|
|
CuSO4
|
0,46
|
|
0,08
|
В
том числе:
|
|
|
|
|
CuO
|
0,44
|
|
0,08
|
MoS2
|
1,28
|
0,77
|
0,23
|
|
CaSO4
|
0,97
|
|
0,18
|
FeMoO4
|
0,25
|
0,11
|
0,05
|
|
Al2O3
|
3,35
|
|
0,61
|
CaMoO4
|
0,33
|
0,84
|
0,06
|
|
Na2O
|
0,22
|
|
0,04
|
Fe2(SO4)3
|
1,55
|
|
0,28
|
|
SiO2
|
12,06
|
|
2,19
|
Fe2O3
|
0,44
|
|
0,08
|
|
Прочие
|
4,04
|
|
0,73
|
CuO
|
3,35
|
|
0,61
|
|
2.
Раствор
|
|
|
|
Al2O3
|
0,22
|
|
0,04
|
|
аммиака
|
466,22
|
|
84,51
|
Na2O
|
12,06
|
|
2,19
|
|
В
том числе:
|
|
|
|
SiO2
|
0,49
|
|
0,09
|
|
NH4OH
|
41,96
|
|
7,61
|
Прочие
|
4,04
|
|
0,73
|
|
H2O
|
424,26
|
|
76,90
|
|
|
|
|
|
Итого
|
551,69
|
40,94
|
100
|
Итого
|
551,71
|
40,94
|
100
|
|
Фильтрация
и промывка
|
|
1.
Пульпа
|
551,71
|
40,94
|
98,64
|
1.
Раствор
|
526,27
|
39,22
|
94,09
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
раствор
|
526,27
|
39,22
|
94,09
|
(NH4)2MoO4
|
80,12
|
39,22
|
14,32
|
|
(NH4)2MoO4
|
80,12
|
39,22
|
14,32
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,11
|
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,11
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
(NH4)2SO4
|
1,32
|
|
0,24
|
|
(NH4)2SO4
|
1,32
|
|
0,24
|
H2O
|
431,97
|
|
77,23
|
|
H2O
|
431,97
|
|
77,23
|
NH4OHизб
|
11,99
|
|
2,14
|
|
NH4Ohизб
|
11,99
|
|
2,14
|
2.
Кек
|
25,44
|
1,72
|
4,55
|
|
кек
|
25,44
|
1,72
|
4,55
|
В
том числе:
|
|
|
|
|
MoS2
|
1,28
|
0,77
|
0,23
|
MoS2
|
1,28
|
0,77
|
0,23
|
|
FeMoO4
|
0,25
|
0,11
|
0,04
|
FeMoO4
|
0,25
|
0,11
|
0,04
|
|
CaMoO4
|
0,33
|
0,84
|
0,06
|
CaMoO4
|
0,33
|
0,84
|
0,06
|
|
Fe2(SO4)3
|
1,55
|
|
0,28
|
Fe2(SO4)3
|
1,55
|
|
0,28
|
|
Fe2O3
|
0,44
|
|
0,08
|
Fe2O3
|
0,44
|
|
0,08
|
|
CuO
|
3,35
|
0,60
|
CuO
|
3,35
|
|
0,60
|
|
Al2O3
|
0,22
|
|
0,04
|
Al2O3
|
0,22
|
|
0,04
|
|
Na2O
|
12,06
|
|
2,16
|
Na2O
|
12,06
|
|
2,16
|
|
SiO2
|
0,49
|
|
0,09
|
SiO2
|
0,49
|
|
0,09
|
|
Прочие
|
4,04
|
|
0,72
|
Прочие
|
4,04
|
|
0,72
|
|
2.
Вода
|
7,63
|
|
1,36
|
3.
Пром. Вода
|
7,63
|
|
1,36
|
|
Итого
|
559,34
|
40,94
|
100
|
Итого
|
559,34
|
40,94
|
100
|
|
Очистка
от меди и железа
|
|
1.
Раствор
|
526,27
|
39,22
|
99,94
|
1.
Осадок
|
0,4829
|
0,001
|
0,09
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
80,12
|
39,22
|
15,21
|
(NH4)2MoO4
|
0,0029
|
0,001
|
0,0006
|
|
[Cu(NH3)4](OH)2
|
0,64
|
|
0,12
|
CuS
|
0,37
|
|
0,07
|
|
[Fe(NH3)6](OH)2
|
0,23
|
|
0,04
|
FeS
|
0,11
|
|
0,02
|
|
(NH4)2SO4
|
1,32
|
|
0,25
|
2.
Очищ. раствор
|
526,13
|
39,22
|
99,91
|
|
H2O
|
431,97
|
|
82,03
|
В
том числе:
|
|
|
|
|
NH4OHизб
|
11,99
|
|
2,28
|
(NH4)2MoO4
|
80,12
|
39,22
|
15,21
|
|
2.
(NH4)2S
|
0,34
|
|
0,06
|
(NH4)2SO4
|
1,32
|
|
0,25
|
|
|
|
|
|
NH4OH
|
13,13
|
|
2,49
|
|
|
|
|
|
H2O
|
431,56
|
|
81,95
|
|
Итого
|
526,61
|
39,22
|
100
|
Итого
|
526,61
|
39,22
|
100
|
|
Выпарка,
охлаждение и центрифугирование
|
|
1.
Очищ. раствор
|
526,13
|
39,22
|
100
|
1.
Влажный осадок
|
66,25
|
30,578
|
12,59
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
80,12
|
39,22
|
15,23
|
ПМА
|
50,96
|
29,4
|
9,69
|
|
(NH4)2SO4
|
1,32
|
|
0,25
|
30%
раствора
|
15,29
|
1,178
|
2,91
|
|
NH4OH
|
13,13
|
|
2,50
|
2.
Раствор
|
113,94
|
8,64
|
21,66
|
|
H2O
|
431,50
|
|
82,01
|
В
том числе:
|
|
|
|
|
|
|
|
|
(NH4)2MoO4
|
17,66
|
8,64
|
3,36
|
|
|
|
|
|
(NH4)2SO4
|
1,16
|
|
0,22
|
|
|
|
|
|
H2O
|
95,12
|
|
18,08
|
|
|
|
|
|
3.
ПГС
|
345,94
|
|
65,75
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
NH3
|
12,35
|
|
2,35
|
|
|
|
|
|
H2O
|
333,59
|
|
63,40
|
|
Итого
|
526,13
|
39,22
|
100
|
Итого
|
526,13
|
39,22
|
100
|
|
Промывка
|
|
1.
Влажный осадок
|
66,25
|
30,58
|
81,25
|
1.
Влажный осадок
|
66,25
|
29,4
|
81,25
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
ПМА
|
50,96
|
29,40
|
62,50
|
ПМА
|
50,96
|
29,4
|
62,50
|
|
30%
раствора
|
15,29
|
1,18
|
18,75
|
H2O
|
15,29
|
|
18,75
|
|
2.
H2O
|
15,29
|
|
18,75
|
2.
Раствор
|
15,29
|
1,18
|
18,75
|
|
Итого
|
81,54
|
30,58
|
100
|
Итого
|
81,54
|
30,58
|
100
|
|
Сушка
и прокалка
|
|
1.
Влажный осадок
|
66,25
|
29,4
|
100
|
1.
MoO3
|
44,12
|
29,4
|
66,60
|
|
В
том числе:
|
|
|
|
2.
ПГС
|
22,13
|
|
33,40
|
|
ПМА
|
50,96
|
29,4
|
76,92
|
В
том числе:
|
|
|
|
|
H2O
|
15,29
|
|
23,08
|
NH3
|
4,48
|
|
6,76
|
|
|
|
|
|
H2O
|
17,65
|
|
26,64
|
|
Итого
|
66,25
|
29,4
|
100
|
Итого
|
66,25
|
29,4
|
100
|
Таблица 15 - Суточный материальный баланс
получения триоксида молибдена
|
Поступило
|
Получено
|
|
Компонент
|
т
|
Мо,
т
|
%
|
Компонент
|
т
|
Мо,
т
|
%
|
|
Грануляция
|
|
1.
Концентрат
|
22,06
|
10,59
|
61,92
|
1.
Гранулы
|
35,63
|
13,90
|
100,00
|
|
В
том числе:
|
|
|
В
том числе:
|
|
|
|
|
MoS2
|
17,67
|
10,59
|
49,60
|
MoO3
|
3,95
|
2,63
|
11,08
|
|
FeS2
|
0,46
|
|
1,30
|
MoS2
|
18,71
|
11,22
|
52,53
|
|
CuFeS2
|
0,44
|
|
1,24
|
FeS2
|
0,46
|
|
1,30
|
|
SiO2
|
1,99
|
|
5,57
|
CuFeS2
|
0,44
|
|
1,24
|
|
NaAlSi3O8
|
0,24
|
|
0,68
|
NaAlSi3O8
|
0,24
|
|
0,68
|
|
CaCO3
|
0,20
|
|
0,56
|
CaCO3
|
0,20
|
|
0,56
|
|
Прочие
|
1,06
|
|
2,97
|
FeMoO4
|
0,04
|
0,02
|
0,11
|
|
2.
Оборотная пыль
|
6,95
|
3,32
|
19,50
|
CuMoO4
|
0,02
|
0,01
|
0,06
|
|
В
том числе:
|
|
|
|
CaMoO4
|
0,07
|
0,03
|
0,19
|
|
MoO3
|
3,95
|
2,63
|
11,08
|
Fe2(SO4)3
|
0,04
|
|
0,11
|
|
MoS2
|
1,04
|
0,63
|
2,93
|
Fe2O3
|
0,12
|
|
0,35
|
|
FeMoO4
|
0,04
|
0,02
|
0,11
|
CuSO4
|
0,04
|
|
0,12
|
|
CuMoO4
|
0,02
|
0,01
|
0,06
|
CuO
|
0,04
|
|
0,10
|
|
CaMoO4
|
0,07
|
0,03
|
0,19
|
CaSO4
|
0,06
|
|
0,18
|
|
Fe2(SO4)3
|
0,04
|
|
0,11
|
SiO2
|
3,93
|
|
11,02
|
|
Fe2O3
|
0,12
|
|
0,35
|
Al2O3
|
1,09
|
|
3,06
|
|
CuSO4
|
0,04
|
|
0,12
|
Na2O
|
0,05
|
|
0,13
|
|
CuO
|
0,04
|
|
0,10
|
CaO
|
0,01
|
|
0,03
|
|
CaSO4
|
0,06
|
|
0,18
|
H2O
|
4,74
|
|
13,31
|
|
Al2O3
|
0,25
|
|
0,71
|
Прочие
|
1,37
|
|
3,85
|
|
Na2O
|
0,05
|
|
0,13
|
|
|
|
|
|
SiO2
|
0,93
|
|
2,60
|
|
|
|
|
|
Прочие
|
0,30
|
|
0,84
|
|
|
|
|
|
3.
Бетонит
|
2,21
|
|
6,19
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
SiO2
|
1,01
|
|
2,85
|
|
|
|
|
|
Al2O3
|
0,84
|
|
2,35
|
|
|
|
|
|
Na2O
|
0,01
|
|
0,03
|
|
|
|
|
|
H2O
|
0,33
|
|
0,93
|
|
|
|
|
|
Прочие
|
0,01
|
|
0,03
|
|
|
|
|
|
4.
H2O
|
4,41
|
|
12,38
|
|
|
|
|
|
Итого
|
35,63
|
13,90
|
100
|
Итого
|
35,63
|
13,90
|
100
|
|
Окислительный
обжиг
|
|
1.
Гранулы
|
35,63
|
13,90
|
11,06
|
1.
Огарок
|
18,85
|
9,03
|
5,86
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
3,95
|
2,63
|
1,23
|
MoO3
|
13,14
|
8,76
|
4,08
|
|
MoS2
|
18,71
|
11,22
|
5,81
|
MoS2
|
0,28
|
0,17
|
0,09
|
|
FeS2
|
0,46
|
|
0,14
|
FeMoO4
|
0,11
|
0,05
|
0,03
|
|
CuFeS2
|
0,44
|
|
0,14
|
CuMoO4
|
0,05
|
0,02
|
0,02
|
|
NaAlSi3O8
|
0,24
|
|
0,08
|
CaMoO4
|
0,07
|
0,04
|
0,02
|
|
CaCO3
|
0,20
|
|
0,06
|
Fe2(SO4)3
|
0,11
|
|
0,03
|
|
FeMoO4
|
0,04
|
0,02
|
0,01
|
Fe2O3
|
0,34
|
|
0,11
|
|
CuMoO4
|
0,02
|
0,01
|
0,01
|
CuSO4
|
0,10
|
|
0,03
|
|
CaMoO4
|
0,07
|
0,03
|
0,02
|
CuO
|
0,10
|
|
0,03
|
0,04
|
|
0,01
|
CaSO4
|
0,21
|
|
0,07
|
|
Fe2O3
|
0,12
|
|
0,04
|
Al2O3
|
0,74
|
|
0,23
|
|
CuSO4
|
0,04
|
|
0,01
|
Na2O
|
0,05
|
|
0,02
|
|
CuO
|
0,04
|
|
0,01
|
SiO2
|
2,66
|
|
0,83
|
|
CaSO4
|
0,06
|
|
0,02
|
Прочие
|
0,89
|
|
0,28
|
|
SiO2
|
3,93
|
|
1,22
|
2.
Оборотная пыль
|
10,31
|
4,87
|
3,20
|
|
Al2O3
|
1,09
|
|
0,34
|
В
том числе:
|
|
|
|
|
Na2O
|
0,05
|
|
0,01
|
MoO3
|
5,83
|
3,89
|
1,81
|
|
CaO
|
0,01
|
|
0,0034
|
MoS2
|
1,55
|
0,93
|
0,48
|
|
H2O
|
4,74
|
|
1,47
|
FeMoO4
|
0,06
|
0,03
|
0,02
|
|
Прочие
|
1,37
|
|
0,43
|
CuMoO4
|
0,03
|
0,01
|
0,01
|
|
2.
Воздух
|
286,40
|
|
88,94
|
CaMoO4
|
0,04
|
0,02
|
0,01
|
|
В
том числе:
|
|
|
|
Fe2(SO4)3
|
0,06
|
|
0,02
|
|
O2
|
65,87
|
|
20,46
|
Fe2O3
|
0,18
|
|
0,06
|
|
N2
|
220,52
|
|
68,48
|
CuSO4
|
0,06
|
|
0,02
|
|
|
|
|
|
CuO
|
0,05
|
|
0,02
|
|
|
|
|
|
CaSO4
|
0,11
|
|
0,04
|
|
|
|
|
|
Al2O3
|
0,40
|
|
0,12
|
|
|
|
|
|
Na2O
|
0,03
|
|
0,01
|
|
|
|
|
|
SiO2
|
1,43
|
|
0,45
|
|
|
|
|
|
Прочие
|
0,48
|
|
0,15
|
|
|
|
|
|
3.
Газы
|
292,86
|
|
90,94
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
SO2
|
11,28
|
|
3,50
|
|
|
|
|
|
SO3
|
3,53
|
|
1,09
|
|
|
|
|
|
CO2
|
0,09
|
|
0,03
|
|
|
|
|
|
H2O
|
4,74
|
|
1,47
|
|
|
|
|
|
N2
|
220,52
|
|
68,48
|
|
|
|
|
|
O2изб
|
52,70
|
|
16,36
|
|
Итого
|
322,02
|
13,90
|
100
|
Итого:
|
322,02
|
13,90
|
100
|
|
Аммиачное
выщелачивание
|
|
1.
Огарок
|
18,85
|
9,03
|
15,49
|
1.
Раствор
|
116,10
|
8,65
|
95,39
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
13,14
|
8,76
|
10,79
|
(NH4)2MoO4
|
17,67
|
8,65
|
14,52
|
|
MoS2
|
0,28
|
0,17
|
0,23
|
[Cu(NH3)4](OH)2
|
0,14
|
|
0,12
|
|
FeMoO4
|
0,11
|
0,05
|
0,09
|
[Fe(NH3)6](OH)2
|
0,05
|
|
0,04
|
|
CuMoO4
|
0,05
|
0,02
|
0,04
|
(NH4)2SO4
|
0,29
|
|
0,24
|
|
CaMoO4
|
0,07
|
0,04
|
0,06
|
H2O
|
95,29
|
|
78,30
|
|
Fe2(SO4)3
|
0,11
|
|
0,09
|
NH4OHизб
|
2,64
|
|
2,17
|
|
Fe2O3
|
0,34
|
|
0,28
|
2.
Кек
|
5,61
|
0,38
|
4,61
|
|
CuSO4
|
0,10
|
|
0,08
|
В
том числе:
|
|
|
|
|
CuO
|
0,10
|
|
0,08
|
MoS2
|
0,28
|
0,17
|
0,23
|
|
CaSO4
|
0,21
|
|
0,18
|
FeMoO4
|
0,06
|
0,02
|
0,05
|
|
Al2O3
|
0,74
|
|
0,61
|
CaMoO4
|
0,07
|
0,19
|
0,06
|
|
Na2O
|
0,05
|
|
0,04
|
Fe2(SO4)3
|
0,34
|
0,28
|
|
SiO2
|
2,66
|
|
2,19
|
Fe2O3
|
0,10
|
|
0,08
|
|
Прочие
|
0,89
|
|
0,73
|
CuO
|
0,74
|
|
0,61
|
|
2.
Раствор
|
|
|
|
Al2O3
|
0,05
|
|
0,04
|
|
аммиака
|
102,85
|
|
84,51
|
Na2O
|
2,66
|
|
2,19
|
|
В
том числе:
|
|
|
|
SiO2
|
0,11
|
|
0,09
|
|
NH4OH
|
9,26
|
|
7,61
|
Прочие
|
0,89
|
|
0,73
|
|
H2O
|
93,59
|
|
76,90
|
|
|
|
|
|
Итого
|
121,70
|
9,03
|
100
|
Итого
|
121,71
|
9,03
|
100
|
|
Фильтрация
и промывка
|
|
1.
Пульпа
|
121,71
|
9,03
|
98,64
|
1.
Раствор
|
116,10
|
8,65
|
94,09
|
|
В
том числе:
|
|
|
0,00
|
В
том числе:
|
|
|
|
|
раствор
|
116,10
|
8,65
|
94,09
|
(NH4)2MoO4
|
17,67
|
8,65
|
14,32
|
|
(NH4)2MoO4
|
17,67
|
8,65
|
14,32
|
[Cu(NH3)4](OH)2
|
0,14
|
|
0,11
|
|
[Cu(NH3)4](OH)2
|
0,14
|
|
0,11
|
[Fe(NH3)6](OH)2
|
0,05
|
|
0,04
|
|
[Fe(NH3)6](OH)2
|
0,05
|
|
0,04
|
(NH4)2SO4
|
0,29
|
|
0,24
|
|
(NH4)2SO4
|
0,29
|
|
0,24
|
H2O
|
95,29
|
|
77,23
|
|
H2O
|
95,29
|
|
77,23
|
NH4OHизб
|
2,64
|
|
2,14
|
|
NH4OHизб
|
2,64
|
|
2,14
|
2.
Кек
|
5,61
|
0,38
|
4,55
|
|
кек
|
5,61
|
0,38
|
4,55
|
В
том числе:
|
|
|
|
|
MoS2
|
0,28
|
0,17
|
0,23
|
MoS2
|
0,28
|
0,17
|
0,23
|
|
FeMoO4
|
0,06
|
0,02
|
0,04
|
FeMoO4
|
0,06
|
0,02
|
0,04
|
|
CaMoO4
|
0,07
|
0,19
|
0,06
|
CaMoO4
|
0,07
|
0,19
|
0,06
|
|
Fe2(SO4)3
|
0,34
|
|
0,28
|
Fe2(SO4)3
|
0,34
|
|
0,28
|
|
Fe2O3
|
0,10
|
|
0,08
|
Fe2O3
|
0,10
|
|
0,08
|
|
CuO
|
0,74
|
|
0,60
|
CuO
|
0,74
|
|
0,60
|
|
Al2O3
|
0,05
|
|
0,04
|
Al2O3
|
0,05
|
|
0,04
|
|
Na2O
|
2,66
|
|
2,16
|
Na2O
|
2,66
|
|
2,16
|
|
SiO2
|
0,11
|
|
0,09
|
SiO2
|
0,11
|
|
0,09
|
|
Прочие
|
0,89
|
|
0,72
|
Прочие
|
0,89
|
|
0,72
|
|
2.
Вода
|
1,68
|
|
1,36
|
3.
Пром. вода
|
1,68
|
|
1,36
|
|
Итого
|
123,39
|
9,03
|
100
|
Итого
|
123,39
|
9,03
|
100
|
|
Очистка
от меди и железа
|
|
1.
Раствор
|
116,10
|
8,65
|
99,94
|
1.
Осадок
|
0,11
|
0,0002
|
0,09
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
17,67
|
8,65
|
15,21
|
(NH4)2MoO4
|
0,0006
|
0,0002
|
0,0006
|
|
[Cu(NH3)4](OH)2
|
0,14
|
|
0,12
|
CuS
|
0,08
|
|
0,07
|
|
[Fe(NH3)6](OH)2
|
0,05
|
|
0,04
|
FeS
|
0,02
|
|
0,02
|
|
(NH4)2SO4
|
0,29
|
|
0,25
|
2.
Очищ. раствор
|
116,06
|
8,65
|
99,91
|
|
H2O
|
95,29
|
|
82,03
|
В
том числе:
|
|
|
0,00
|
|
NH4OHизб
|
2,64
|
|
2,28
|
(NH4)2MoO4
|
17,67
|
8,65
|
15,21
|
|
2.
(NH4)2S
|
0,08
|
|
0,06
|
(NH4)2SO4
|
0,29
|
|
0,25
|
|
|
|
|
|
NH4OH
|
2,90
|
|
2,49
|
|
|
|
|
|
H2O
|
95,20
|
|
81,95
|
|
Итого
|
116,17
|
8,65
|
100
|
Итого
|
116,17
|
8,65
|
100
|
|
Выпарка,
охлаждение и центрифугирование
|
|
1.
Очищ. раствор
|
116,06
|
8,65
|
100
|
1.
Влажный осадок
|
14,61
|
6,75
|
12,59
|
|
В
том числе:
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
17,67
|
8,65
|
15,23
|
ПМА
|
11,24
|
6,49
|
9,69
|
|
(NH4)2SO4
|
0,29
|
|
0,25
|
30%
раствора
|
3,37
|
0,26
|
2,91
|
|
NH4OH
|
2,90
|
|
2,50
|
2.
Раствор
|
25,14
|
1,91
|
21,66
|
|
H2O
|
95,19
|
|
82,01
|
В
том числе:
|
|
|
|
|
|
|
|
|
(NH4)2MoO4
|
3,90
|
1,91
|
3,36
|
|
|
|
|
|
(NH4)2SO4
|
0,26
|
|
0,22
|
|
|
|
|
|
H2O
|
20,98
|
|
18,08
|
|
|
|
|
|
3.
ПГС
|
76,31
|
|
65,75
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
NH3
|
2,72
|
|
2,35
|
|
|
|
|
|
H2O
|
73,59
|
|
63,40
|
|
Итого
|
116,06
|
8,65
|
100
|
Итого
|
116,06
|
8,65
|
100
|
|
Промывка
|
|
1.
Влажный осадок
|
14,61
|
6,75
|
81,25
|
1.
Влажный осадок
|
14,61
|
6,49
|
81,25
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
ПМА
|
11,24
|
6,49
|
62,50
|
ПМА
|
11,24
|
6,49
|
62,50
|
|
30%
раствора
|
3,37
|
0,26
|
18,75
|
H2O
|
3,37
|
|
18,75
|
|
2.
H2O
|
3,37
|
|
18,75
|
2.
Раствор
|
3,37
|
0,26
|
18,75
|
|
Итого
|
17,99
|
6,75
|
100
|
Итого
|
17,99
|
6,75
|
100
|
|
Сушка
и прокалка
|
|
1.
Влажный осадок
|
14,61
|
6,49
|
100
|
1.
MoO3
|
9,73
|
6,49
|
66,60
|
|
В
том числе:
|
|
|
|
2.
ПГС
|
4,88
|
|
33,40
|
|
ПМА
|
11,24
|
6,49
|
76,92
|
В
том числе:
|
|
|
|
|
H2O
|
3,37
|
|
23,08
|
NH3
|
0,99
|
|
6,76
|
|
|
|
|
|
H2O
|
3,89
|
|
26,64
|
|
Итого
|
14,61
|
6,49
|
100
|
Итого
|
14,61
|
6,49
|
100
|
Таблица 16 - Годовой материальный баланс
получения триоксида молибдена
|
Поступило
|
Получено
|
|
Компонент
|
кг
|
Мо,
кг
|
%
|
Компонент
|
кг
|
Мо,
кг
|
%
|
|
Грануляция
|
|
1.
Концентрат
|
7500
|
3600,19
|
61,92
|
1.
Гранулы
|
12113,15
|
4727,50
|
100
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoS2
|
6007,82
|
3600,19
|
49,60
|
MoO3
|
1341,82
|
894,05
|
11,08
|
|
FeS2
|
157,51
|
|
1,30
|
MoS2
|
6362,59
|
3813,20
|
52,53
|
|
CuFeS2
|
150,01
|
|
1,24
|
FeS2
|
157,51
|
|
1,30
|
|
SiO2
|
675,04
|
|
5,57
|
CuFeS2
|
150,01
|
|
1,24
|
|
NaAlSi3O8
|
82,50
|
|
0,68
|
NaAlSi3O8
|
82,50
|
|
0,68
|
|
CaCO3
|
67,50
|
|
0,56
|
CaCO3
|
67,50
|
|
0,56
|
|
Прочие
|
360,02
|
|
2,97
|
FeMoO4
|
13,50
|
6,00
|
0,11
|
|
2.
Оборотная пыль
|
2362,63
|
1127,31
|
19,50
|
CuMoO4
|
7,50
|
3,00
|
0,06
|
|
В
том числе:
|
|
|
|
CaMoO4
|
23,25
|
11,25
|
0,19
|
|
MoO3
|
1341,82
|
894,05
|
11,08
|
Fe2(SO4)3
|
13,50
|
|
0,11
|
|
MoS2
|
354,77
|
213,01
|
2,93
|
Fe2O3
|
42,00
|
|
0,35
|
|
FeMoO4
|
13,50
|
6,00
|
0,11
|
CuSO4
|
14,25
|
|
0,12
|
|
CuMoO4
|
7,50
|
3,00
|
0,06
|
CuO
|
12,00
|
|
0,10
|
|
CaMoO4
|
23,25
|
11,25
|
0,19
|
CaSO4
|
21,75
|
|
0,18
|
|
Fe2(SO4)3
|
13,50
|
|
0,11
|
SiO2
|
1335,07
|
|
11,02
|
|
Fe2O3
|
42,00
|
|
0,35
|
Al2O3
|
370,52
|
|
3,06
|
|
CuSO4
|
14,25
|
|
0,12
|
Na2O
|
15,75
|
|
0,13
|
|
CuO
|
12,00
|
|
0,10
|
CaO
|
3,75
|
|
0,03
|
|
CaSO4
|
21,75
|
|
0,18
|
H2O
|
1612,59
|
|
13,31
|
|
Al2O3
|
85,50
|
|
0,71
|
Прочие
|
465,77
|
|
3,85
|
|
Na2O
|
15,75
|
|
0,13
|
|
315,02
|
|
2,60
|
|
|
|
|
|
Прочие
|
102,01
|
|
0,84
|
|
|
|
|
|
3.
Бетонит
|
750,04
|
|
6,19
|
|
|
|
|
|
В
том числе:
|
0,00
|
|
|
|
|
|
|
|
SiO2
|
345,02
|
|
2,85
|
|
|
|
|
|
Al2O3
|
285,02
|
|
2,35
|
|
|
|
|
|
Na2O
|
3,75
|
|
0,03
|
|
|
|
|
|
H2O
|
112,51
|
|
0,93
|
|
|
|
|
|
Прочие
|
3,75
|
|
0,03
|
|
|
|
|
|
4.
H2O
|
1500,08
|
|
12,38
|
|
|
|
|
|
Итого
|
12113,15
|
4727,50
|
100
|
Итого
|
12113,15
|
4727,50
|
100
|
|
Окислительный
обжиг
|
|
1.
Гранулы
|
12113,15
|
4727,50
|
11,06
|
1.
Огарок
|
6410,59
|
3070,66
|
5,86
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
1341,82
|
894,05
|
1,23
|
MoO3
|
4466,49
|
2976,91
|
4,08
|
|
MoS2
|
6362,59
|
3813,20
|
5,81
|
MoS2
|
96,01
|
57,75
|
0,09
|
|
FeS2
|
157,51
|
|
0,14
|
FeMoO4
|
38,25
|
17,25
|
0,03
|
|
CuFeS2
|
150,01
|
|
0,14
|
CuMoO4
|
16,50
|
6,75
|
0,02
|
|
NaAlSi3O8
|
82,50
|
|
0,08
|
CaMoO4
|
24,75
|
12,00
|
0,02
|
|
CaCO3
|
67,50
|
|
0,06
|
Fe2(SO4)3
|
36,75
|
|
0,03
|
|
FeMoO4
|
13,50
|
6,00
|
0,01
|
Fe2O3
|
116,26
|
|
0,11
|
|
CuMoO4
|
7,50
|
3,00
|
0,01
|
CuSO4
|
34,50
|
|
0,03
|
|
CaMoO4
|
23,25
|
11,25
|
0,02
|
CuO
|
33,00
|
|
0,03
|
|
Fe2(SO4)3
|
13,50
|
|
0,01
|
CaSO4
|
72,75
|
|
0,07
|
|
Fe2O3
|
42,00
|
|
0,04
|
Al2O3
|
251,26
|
|
0,23
|
|
CuSO4
|
14,25
|
|
0,01
|
Na2O
|
16,50
|
|
0,02
|
|
CuO
|
12,00
|
|
0,01
|
SiO2
|
904,55
|
|
0,83
|
|
CaSO4
|
21,75
|
|
0,02
|
Прочие
|
303,02
|
|
0,28
|
|
SiO2
|
1335,07
|
|
1,22
|
2.
Оборотная пыль
|
3504,19
|
1656,84
|
3,20
|
|
Al2O3
|
370,52
|
|
0,34
|
В
том числе:
|
|
|
|
|
Na2O
|
15,75
|
|
0,01
|
MoO3
|
1983,11
|
1321,57
|
1,81
|
|
CaO
|
3,75
|
|
0,0034
|
MoS2
|
525,78
|
315,77
|
0,48
|
|
H2O
|
1612,59
|
|
1,47
|
FeMoO4
|
21,00
|
9,00
|
0,02
|
|
Прочие
|
465,77
|
|
0,43
|
CuMoO4
|
9,00
|
3,75
|
0,01
|
|
2.
Воздух
|
97374,69
|
|
88,94
|
CaMoO4
|
13,50
|
6,75
|
0,01
|
|
В
том числе:
|
|
|
|
Fe2(SO4)3
|
19,50
|
|
0,02
|
|
O2
|
22396,19
|
|
20,46
|
Fe2O3
|
62,25
|
|
0,06
|
|
N2
|
74978,50
|
|
68,48
|
CuSO4
|
18,75
|
|
0,02
|
|
|
|
|
|
CuO
|
18,00
|
|
0,02
|
|
|
|
|
|
CaSO4
|
39,00
|
|
0,04
|
|
|
|
|
|
Al2O3
|
135,01
|
|
0,12
|
|
|
|
|
|
Na2O
|
9,00
|
|
0,01
|
|
|
|
|
|
SiO2
|
487,53
|
|
0,45
|
|
|
|
|
|
Прочие
|
162,76
|
|
0,15
|
|
|
|
|
|
3.
Газы
|
99571,56
|
|
90,94
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
SO2
|
3834,95
|
|
3,50
|
|
|
|
|
|
SO3
|
1198,56
|
|
1,09
|
|
|
|
|
|
CO2
|
30,00
|
|
0,03
|
|
|
|
|
|
H2O
|
1612,59
|
|
|
|
|
|
|
N2
|
74978,50
|
|
68,48
|
|
|
|
|
|
O2изб
|
17916,96
|
|
16,36
|
|
Итого
|
109487,84
|
4727,50
|
100,00
|
Итого:
|
109486,34
|
4727,50
|
100
|
|
Аммиачное
выщелачивание
|
|
1.
Огарок
|
6410,59
|
3070,66
|
15,49
|
1.
Раствор
|
39472,36
|
2941,66
|
95,39
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
MoO3
|
4466,49
|
2976,91
|
10,79
|
(NH4)2MoO4
|
6009,32
|
2941,66
|
14,52
|
|
MoS2
|
96,01
|
57,75
|
0,23
|
[Cu(NH3)4](OH)2
|
48,00
|
|
0,12
|
|
FeMoO4
|
38,25
|
17,25
|
0,09
|
[Fe(NH3)6](OH)2
|
17,25
|
|
0,04
|
|
CuMoO4
|
16,50
|
6,75
|
0,04
|
(NH4)2SO4
|
99,01
|
|
0,24
|
|
CaMoO4
|
24,75
|
12,00
|
0,06
|
H2O
|
32399,48
|
|
78,30
|
|
Fe2(SO4)3
|
36,75
|
|
0,09
|
NH4OHизб
|
899,30
|
|
2,17
|
|
Fe2O3
|
116,26
|
|
0,28
|
2.
Кек
|
1908,10
|
129,01
|
4,61
|
|
CuSO4
|
34,50
|
|
0,08
|
В
том числе:
|
|
|
|
|
CuO
|
33,00
|
|
0,08
|
MoS2
|
96,01
|
57,75
|
0,23
|
|
CaSO4
|
72,75
|
|
0,18
|
FeMoO4
|
18,75
|
8,25
|
0,05
|
|
Al2O3
|
251,26
|
|
0,61
|
CaMoO4
|
24,75
|
63,00
|
0,06
|
|
Na2O
|
16,50
|
|
0,04
|
Fe2(SO4)3
|
116,26
|
|
0,28
|
|
SiO2
|
904,55
|
|
2,19
|
Fe2O3
|
33,00
|
|
0,08
|
|
Прочие
|
303,02
|
|
0,73
|
CuO
|
251,26
|
|
0,61
|
|
2.
Раствор
|
|
|
|
Al2O3
|
16,50
|
|
0,04
|
|
аммиака
|
34968,36
|
|
84,51
|
Na2O
|
904,55
|
|
2,19
|
|
В
том числе:
|
|
|
|
SiO2
|
36,75
|
|
0,09
|
|
NH4OH
|
3147,17
|
|
7,61
|
Прочие
|
303,02
|
|
0,73
|
|
H2O
|
31821,20
|
|
76,90
|
|
|
|
|
|
Итого
|
41378,96
|
3070,66
|
100
|
Итого
|
41380,46
|
3070,66
|
100
|
|
Фильтрация
и промывка
|
|
1.
Пульпа
|
41380,46
|
3070,66
|
98,64
|
1.
Раствор
|
39472,36
|
2941,66
|
94,09
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
раствор
|
39472,36
|
2941,66
|
94,09
|
(NH4)2MoO4
|
6009,32
|
2941,66
|
14,32
|
|
(NH4)2MoO4
|
6009,32
|
2941,66
|
14,32
|
[Cu(NH3)4](OH)2
|
48,00
|
|
0,11
|
|
[Cu(NH3)4](OH)2
|
48,00
|
|
0,11
|
[Fe(NH3)6](OH)2
|
17,25
|
|
0,04
|
|
[Fe(NH3)6](OH)2
|
17,25
|
|
0,04
|
(NH4)2SO4
|
99,01
|
|
0,24
|
|
(NH4)2SO4
|
99,01
|
|
0,24
|
H2O
|
32399,48
|
|
77,23
|
|
H2O
|
32399,48
|
|
77,23
|
NH4OHизб
|
899,30
|
|
2,14
|
|
NH4OHизб
|
899,30
|
|
2,14
|
2.
Кек
|
1908,10
|
129,01
|
4,55
|
|
кек
|
1908,10
|
129,01
|
4,55
|
В
том числе:
|
|
|
|
|
MoS2
|
96,01
|
57,75
|
0,23
|
MoS2
|
96,01
|
57,75
|
0,23
|
|
FeMoO4
|
18,75
|
8,25
|
0,04
|
FeMoO4
|
18,75
|
8,25
|
0,04
|
|
CaMoO4
|
24,75
|
63,00
|
0,06
|
CaMoO4
|
24,75
|
63,00
|
0,06
|
|
Fe2(SO4)3
|
116,26
|
|
0,28
|
Fe2(SO4)3
|
116,26
|
|
0,28
|
|
Fe2O3
|
33,00
|
|
0,08
|
Fe2O3
|
33,00
|
|
0,08
|
|
CuO
|
251,26
|
|
0,60
|
CuO
|
251,26
|
|
0,60
|
|
Al2O3
|
16,50
|
|
0,04
|
Al2O3
|
16,50
|
|
0,04
|
|
Na2O
|
904,55
|
|
2,16
|
Na2O
|
904,55
|
|
2,16
|
|
SiO2
|
36,75
|
|
0,09
|
36,75
|
|
0,09
|
|
Прочие
|
303,02
|
|
0,72
|
Прочие
|
303,02
|
|
0,72
|
|
2.
Вода
|
572,28
|
|
1,36
|
3.
Пром. вода
|
572,28
|
|
1,36
|
|
Итого
|
41952,74
|
3070,66
|
100
|
Итого
|
41952,74
|
3070,66
|
100
|
|
Очистка
от меди и железа
|
|
1.
Раствор
|
39472,36
|
2941,66
|
99,94
|
1.
Осадок
|
36,22
|
0,08
|
0,09
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
6009,32
|
2941,66
|
15,21
|
(NH4)2MoO4
|
0,22
|
0,08
|
0,0006
|
|
[Cu(NH3)4](OH)2
|
48,00
|
|
0,12
|
CuS
|
27,75
|
|
0,07
|
|
[Fe(NH3)6](OH)2
|
17,25
|
|
0,04
|
FeS
|
8,25
|
|
0,02
|
|
(NH4)2SO4
|
99,01
|
|
0,25
|
2.
Очищ. раствор
|
39461,64
|
2941,51
|
99,91
|
|
H2O
|
32399,48
|
|
82,03
|
В
том числе:
|
|
|
|
|
NH4OHизб
|
899,30
|
|
2,28
|
(NH4)2MoO4
|
6009,10
|
2941,51
|
15,21
|
|
2.
(NH4)2S
|
25,50
|
|
0,06
|
(NH4)2SO4
|
99,01
|
|
0,25
|
|
|
|
|
|
NH4OH
|
984,80
|
|
2,49
|
|
|
|
|
|
H2O
|
32368,73
|
|
81,95
|
|
Итого
|
39497,86
|
2941,66
|
100
|
Итого
|
39497,86
|
2941,66
|
100
|
|
Выпарка,
охлаждение и центрифугирование
|
|
1.
Очищ. раствор
|
39461,64
|
2941,51
|
100
|
1.
Влажный осадок
|
4969,02
|
2293,47
|
12,59
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
(NH4)2MoO4
|
6009,10
|
2941,51
|
15,23
|
ПМА
|
3822,20
|
2205,12
|
9,69
|
|
(NH4)2SO4
|
99,01
|
|
0,25
|
30%
раствора
|
1146,81
|
88,35
|
2,91
|
|
NH4OH
|
984,80
|
|
2,50
|
2.
Раствор
|
8545,96
|
648,03
|
21,66
|
|
H2O
|
32364,23
|
|
82,01
|
В
том числе:
|
|
|
|
|
|
|
|
|
(NH4)2MoO4
|
1324,57
|
648,03
|
3,36
|
|
|
|
|
|
(NH4)2SO4
|
87,00
|
|
0,22
|
|
|
|
|
|
H2O
|
7134,38
|
|
18,08
|
|
|
|
|
|
3.
ПГС
|
25946,67
|
|
65,75
|
|
|
|
|
|
В
том числе:
|
|
|
|
|
|
|
|
|
NH3
|
926,30
|
|
2,35
|
|
|
|
|
|
H2O
|
25020,37
|
|
63,40
|
|
Итого
|
39461,64
|
2941,51
|
100
|
Итого
|
39461,64
|
2941,501
|
100
|
|
Промывка
|
|
1.
Влажный осадок
|
4969,02
|
2293,47
|
81,25
|
1.
Влажный осадок
|
4969,02
|
2205,12
|
81,25
|
|
В
том числе:
|
|
|
|
В
том числе:
|
|
|
|
|
ПМА
|
3822,20
|
2205,12
|
62,50
|
ПМА
|
3822,20
|
2205,12
|
62,50
|
|
30%
раствора
|
1146,81
|
88,35
|
18,75
|
H2O
|
1146,81
|
|
18,75
|
|
2.
H2O
|
1146,81
|
|
18,75
|
2.
Раствор
|
1146,81
|
88,35
|
18,75
|
|
Итого
|
6115,83
|
2293,47
|
100
|
Итого
|
6115,83
|
2293,47
|
100
|
|
Сушка
и прокалка
|
|
1.
Влажный осадок
|
4969,02
|
2205,12
|
100
|
1.
MoO3
|
3309,18
|
2205,12
|
66,60
|
|
В
том числе:
|
|
|
|
2.
ПГС
|
1659,84
|
|
33,40
|
|
ПМА
|
3822,20
|
2205,12
|
76,92
|
В
том числе:
|
|
|
|
|
H2O
|
1146,81
|
|
23,08
|
NH3
|
336,02
|
|
6,76
|
|
|
|
|
|
H2O
|
1323,82
|
|
26,64
|
|
Итого
|
4969,02
|
2205,12
|
100
|
Итого
|
4969,02
|
2205,12
|
100
|
3.2 Выбор и расчет основного и
вспомогательного оборудования
Все оборудование выбираем исходя из объемов
перерабатываемого сырья в сутки.
Для грануляции выбираем чашевый окомкователь.
Окислительный обжиг будем проводить в печи КС
объемом 100 т.
Выщелачивание будем проводить в чанах с
мешалками. На выщелачивание поступает 121,7 т или 121,7/1,2=101,42 м3 пульпы,
где 1,2 - плотность пульпы, т/м3. В сутки будем проводить три загрузки по 33,8
м3. Исходя из того, что оборудование должно быть заполнено на 75 % нам
необходимо три чана по 15 м3.
Для фильтрации, промывки и отделения ПМА
выбираем нутч-фильтры БОУ10-2,6. Они полностью удовлетворяют нашим требованиям.
Нам необходимо три фильтра [5].
Очистку от меди и железа проводим в чанах с
мешалками. Расчет их проводим аналогично расчету чанов для выщелачивания. На
очистку поступает 116,17 т или 116,17/1=116,17 м3 раствора, где 1 - плотность
раствора, т/м3. В сутки будем проводить четыре загрузки по 38,72 м3, для этого
выбираем два чана по 20 м3.
Выпарку и охлаждение будем проводить в аппаратах
с двойным дном. На выщелачивание поступает 116,06 м3 раствора. В сутки будет
одна загрузка. Исходя из этого нам необходимо четыре аппарата по 40 м3.
Для сушки будем использовать муфельную печь, а
для прокалки семитрубную печь.
Для пылеулавливания выбираем скруббер Вентури.
Список основного и вспомогательного оборудования
представлен в таблице 17.
Таблица 17 - Список основного и вспомогательного
оборудования
|
№
п/п
|
Наименование
оборудования
|
Кол-во
|
Примечание
|
|
|
|
|
|
|
1
|
Печь
КС
|
1
|
|
Обжиг
КМФ
|
|
2
|
Муфельная
печь
|
1
|
|
Сушка
|
|
3
|
Семитрубная
печь
|
1
|
|
Прокалка
|
|
4
|
Чан
с мешалкой
|
3
|
15
м3
|
Выщелачивание
|
|
5
|
Чан
с мешалкой
|
2
|
20
м3
|
Очистка
|
|
6
|
Нутч-фильтр
БОУ10-2,6
|
3
|
|
Фильтрация,
прмывка, отделение ПМА
|
|
7
|
Аппарат
с двойным дном
|
4
|
40
м3
|
Выпарка,
кристаллизация
|
|
8
|
Чашевый
окомкователь
|
1
|
|
Грануляция
|
|
9
|
Скруббер
Вентури
|
1
|
|
Пылеулавливание
|
4. Экологическая часть
При обжиге молибденитового концентрата
образуются обжиговые газы, содержащие большое количество сернистого ангидрида.
При больших масштабах целесообразно применять очистку и утилизацию SO2.
Газы, содержащие SO2,
после тщательной их очистки и охлаждения до температуры (35÷40)
˚С промывают раствором, содержащим (NH4)2SO3.
При этом протекает реакция (33), в результате которой газ очищается.
(NH4)2SO3+SO2+H2O=2NH4HSO3 (33)
При нагревании полученного раствора бисульфита
аммония до кипения реакция идет в обратном направлении с выделением сернистого
ангидрида и получением раствора сульфита аммония.
Применяя последний процесс, получают сернистый
ангидрид высокой концентрации, который используют для получения элементарной
серы, серной кислоты и других ценных продуктов.
Полученный после отгонки SO2
раствор сульфита аммония охлаждают и снова используют для улавливания
сернистого ангидрида из газов.
При этом способе поглотитель совершает круговой
цикл - он поглощает SO2,
а затем после отгонки SO2
и последующего охаждения его используют повторно.
Хотя поглотитель все время и возвращается
обратно в цикл, все же он частично теряется (проливается, уносится с газами в
виде мелких брызг) и частично превращается в (NH4)2SO4.
Полученный сульфат аммония приходится выводить из цикла, а взамен в цикл
вводить аммиак для получения свежего (NH4)2SO3
в количестве, необходимом для возмещения потерь [7].
Заключение
В данном курсовом проекте рассмотрены различные
способы переработки молибденитового концентрата и выбран самый подходящий
вариант для переработки в условиях Сорского месторождения медно-молибденовых
руд.
Так же подобрана технология получения триоксида
молибдена, произведены все необходимые расчеты, выбрано основное и
вспомогательное оборудование и разработан план цеха.
Список использованной литературы
1. Коровин, С.С. Редкие и
рассеянные элементы. Химия и технология. В 3 кн. Кн. 2. Учебник для вузов /
Коровин С.С., Дробот Д.В., Федоров П.И. - М.: МИСИС, 1999. - 464 с.
2. Зеликман, А.Н. Металлургия
тугоплавких редких металлов. Учебник для вузов / Зеликман А.Н. - М.:
Металлургия, 1986. - 440 с.
. Козырев В.Б., Ковалёв Н.В.,
Ли О.В. Технологическая инструкция производства ферромолибдена. ООО «Сорский
ФМЗ», 2005. - 29 с.
. Михнев, А.Д. Расчеты
технологических процессов в металлургии тугоплавких редких металлов: учеб.
пособие / А.Д. Михнев, Л.П. Колмакова, О.Н. Ковтун. - ГОУ ВПО «Гос. ун-т цвет.
металлов и золота». - Красноярск, 2006. - 164 с.
. Полькин, С.И. Обогащение
руд цветных и редких металлов / Полькин С.И., Адамов Э.В. - М.: Недра, 1975. -
461 с.
. Основы обогащения полезных
ископаемых. В 2 т. Т. 1. Обогатительные процессы. Учебник для вузов / Авдохин
В.М. - М.: Издательство Московского государственного горного университета,
2006. -417 с.
. Гордон, Г.М.
Пылеулавливание и очистка газов в цветной металлургии / Гордон Г.М., Пейсахов
И.Л. - М.: Металлургия, 1977. - 456 с.