Микроволновый синтез гидроксилапатита
ВВЕДЕНИЕ
Гидроксилапатит (ГА) является основным неорганическим компонентом твердых
тканей человека, таких как кости, зубы, и т.д. Благодаря высокой биоактивности,
керамические материалы на основе ГА широко используются в медицине в различных
формах: гранулы, блоки, покрытия металлических имплантатов. Функциональные
свойства керамики на основе ГА зависят от многих факторов. Определяющими из них
являются характеристики исходного порошка ГА [1].
Последние исследования показали, что минеральный компонент костной ткани
состоит преимущественно из кальций-дефицитного, а не из стехиометрического ГА.
Поэтому желательно, что бы исходный порошок для получения керамики так же
представлял собой кальций-дефицитный гидроксилапатит. Кальций-дефицитный
гидроксилапатит (КДГА) представляет собой фосфат кальция с соотношением Са/Р
изменяющимся от 1,5 до 1,67. КДГА быстрее растворяются в телесной жидкости, и
имеет большую площадь удельной поверхности по сравнению с ГА. Для медицинского
использования интерес вызывает также β-ТСР, в который превращается КДГА в
случае, когда х=1,5. Нанокристаллический порошок КДГА представляет собой весьма
перспективный материал для получения керамики. Поэтому получение КДГА и
изучение его термостабильности является актуальной научной проблемой.
Наиболее распространёнными методами получения КДГА являются методы
химического осаждения из водных растворов. Они обладают рядом существенных
недостатков, главные из которых длительность процесса, значительное количество
примесей, нестабильность и плохая воспроизводимость получаемого состава [2].
Поэтому продолжаются поиски методов синтеза ГА свободных от этих недостатков.
Одним из них является недавнопредложенный твердофазный синтез ГА под
воздействием микроволнового излучения.
1.
АНАЛИТИЧЕСКИЙ ОБЗОР ЛИТЕРАТУРЫ: МИКРОВОЛНОВЫЙ СИНТЕЗ ГИДРОКСИЛАПАТИТА
1.1 Общие сведенья о микроволновом излучении
Микроволновое, или сверхвысокочастотное (СВЧ), излучение - это
электромагнитные волны длиной от одного миллиметра до одного метра(от 30 ГГц до
0,03 ГГц соответственно). Диапазон волн микроволнового излучения лежит между
длинами волн инфракрасного света и радиоволнами (см. рис. 1.). Микроволновое
излучение используются в микроволновых печах, радиолокации, радионавигации,
системах спутникового телевидения, сотовой телефонии и т.д. Микроволны
существуют в природе [3], их испускает Солнце.
Кухонные и промышленные микроволновые печи работают на частоте 2,45 ГГц.
Эта частота была выбрана как оптимальная по скорости нагрева воды, которой
больше всего содержится в продуктах питания и остается неизменной во всех
печах, чтобы избежать интерференции с радарными и телекоммуникационными
системами. На зависимости эффективности нагрева воды эта точка расположена на
спаде кривой (см. рис. 2.).
Давно известно, что разные материалы можно нагревать с помощью СВЧ
электромагнитных волн. Это нагревание является следствием взаимодействия
электрической компоненты электромагнитной волны с заряженными или полярными
частицами. В электрическом поле такие частицы упорядочиваются, и если поле
асцилирует, то их ориентация изменяется с каждой асциляцией. А теперь вспомним,
что частота микроволн 2450 Мгц. Один герц - это одно колебание в секунду,
мегагерц - один миллион колебаний в секунду. За один период волны поле меняет
свое направление дважды. Значит, поле, в котором находятся полярные частицы,
меняет полярность 4 900 000 000 раз в секунду. Под действием микроволнового
излучения молекулы кувыркаются с бешеной частотой и в буквальном смысле трутся
одна о другую при переворотах.
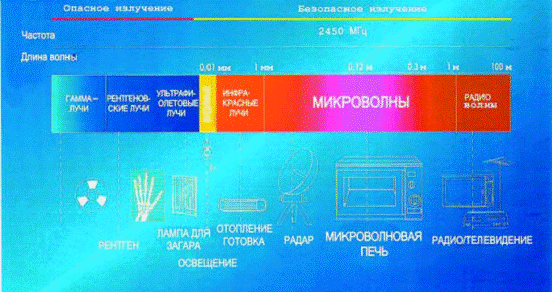
Рис.1.
Шкала электромагнитного излучения
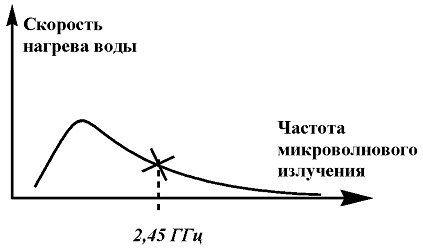
Рис. 2. зависимость скорости нагрева воды от частоты микроволнового
излучения
Так, переориентации частиц в фазе, активируемые переменным электрическим
полем, вызывают очень быстрое нагревание вещества, что выгодно отличает
микроволновое нагревание от традиционного.
Существует два основных механизма взаимодействия микроволнового излучения
с веществом. Если в конденсированной фазе существуют свободные заряженные
частицы, то они будут двигаться в соответствии с изменением электрического
поля, создавая электрический ток. Такая ситуация характерна для металлов,
графита, где в качестве подвижных заряженных частиц выступают электроны, и для
растворов электролитов, где ионы являются носителями заряда. Если фаза содержит
полярные молекулы, то они будут ориентироваться в приложенном электрическом
поле и переориентироваться при его асциляциях. Такое движение и соударения
молекул в конденсированной фазе и обуславливает нагревание. Таким образом,
микроволновое нагревание, в отличие от традиционного является как бы
нагреванием «изнутри». Другим свойством микроволнового нагревания является то,
что оно не затрагивает неполярные молекулы и такие материалы как кварц,
керамика и стекло, не содержащие воду, тефлон, полиэтилен, алканы и др.
остаются холодными при облучении.
Неоспоримые преимущества микроволнового нагревания по сравнению с
традиционным привели к тому, что микроволновое излучение стало незаменимо не
только в бытовых целях. Оно также оказалось чрезвычайно полезным для научных
исследований. Особенно активно новый способ нагревания начали использовать там,
где обычные методы термической обработки не могли дать требуемых результатов. В
частности синтез ГА, который ранее представлял собой достаточно сложный и
длительный процесс, с применением микроволнового нагревания значительно
упростился и стал намного эффективнее. О характеристиках порошка ГА,
полученного в результате синтеза под воздействием микроволнового излучения, и
будет рассказано далее.
1.2 Влияние микроволнового облучения на синтез ГА
Все работы, посвященные воздействию микроволнового излучения на синтез
ГА, можно разделить на две группы. Первую группу составляют работы, в которых
микроволновое излучение используют для улучшения стандартных методов получения
ГА. Например, для ускорения реакции, в результате, которой образуется ГА, но
при обычных условиях занимающей много времени. Ко второй группе относятся
работы, в которых микроволновое излучение выступает неотъемлемой частью
синтеза, без которой конечный продукт не мог бы быть получен. Научный интерес
вызывают оба направления, поэтому подробно остановимся на каждом из них.
Представителем первого направления является работа, в которой
нанокристаллический ГА был получен при помощи реакции водного осаждения. В
качестве исходных компонентов использовалась смесь гидроксида кальция (Са
(ОН)2) и гидрофосфата аммония ((NH4)2 НРО4), в соотношении Са/Р 1:1. В этом
исследовании реакция синтеза выгладила следующим образом:
Са(ОН)2 +6(NH4)2НРО4 → Са10 (РО4)6(ОН)2 +6Н2О +12NH4OH
Для формирования реакционной смеси, использовались 0,24М (NH4)2 НРО4 в
виде водного раствора, медленно добавляли к 0,4М водной суспензии гидроокиси
кальция, постоянно перемешивали при комнатной температуре [4]. Затем смесь
немедленно подвергалась микроволновому облучению (850 Вт) в течении 20 минут, в
результате чего образовывалась белая паста. После чего образец высушили методом
лиофилизационной сушки с тем, чтобы предотвратить агломерацию частиц.
В результате этого простого метода был получен нанокристаллический
гидроксилапаптит. Различия между этим методом и другими, заключаются в
следующем. Во-первых, требуется поддержание постоянного уровня рН потому, что
суспензия Са(ОН)2 является сильной щелочью. Сравнение с другими работами, о
которых сообщалось ранее показывает, что смеси Са/Р должны сохраняться при рН ³ 10 в течении реакции. Во-вторых, эта
реакция проводилась в воздушной атмосфере, в то время как другие исследователи
получали другие наночастицы при помощи гидротермального метода, для которого
необходимы достаточно высокая температура и давление. В-третьих, весь процесс
занимает всего лишь 3 часа от начала подготовки растворов, смешивания и
микроволнового облучения до формирования осадка. Побочный продукт NH4OH легко
удаляется путем испарения во время нагрева.
Дифрактограмма свежеприготовленного нГА (см. рис. 3а) подтверждает, что
полученный в ходе эксперимента продукт является ГА. Широкие, не очень хорошо
разрешаемые дифракционные пики говорят о том, что полученный продукт либо не
полностью кристаллизовался, либо кристаллы продукта очень малы. На снимках,
сделанных с помощью сканирующего электронного микроскопа (см. рис. 4,) четко
видно, что кристаллы полученного нГА имеют иглообразную форму. Микрофотографии
(см. рис. 4а) также подтверждают, что уширение дифракционных пиков на
дифрактограммах связано в большей степени с очень малым размерам кристаллов,
чем со слабой кристалличностью продукта. Размер большинства полученных частиц
нГАП составляет приблизительно 30 нм в диаметре и 200 нм в диаметре. Результаты
анализа динамического рассеяния света (DLS) полностью совпадают с результатами,
полученными с помощью электронной микроскопии.
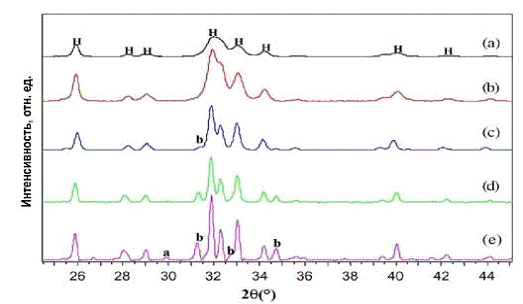
Рис. 3. Дифрактограммы порошка ГА: а) исходного, b) отожженного при
700оС, c) отожженного при 800оС, d) отожженного при 900оС, e) отожженного при
1200оС

Рис. 4. Исходный нГА и ГА отожженный при температурах между 700 и 1200оС
Размеры частиц, измеренные с помощью DLS, находятся в пределах 28 159 нм
(см. рис. 5.). Кристалличность нГА увеличивается при отжиге, об этом говорит
сужение дифракционных пиков (см. рис. 3(б)- (е)). Частицы нГА остаются
стабильными вплоть до температуры 700оС, о чем свидетельствует увеличение
интенсивности дифракционных пиков (см. рис. 3в) и отсутствие дополнительных
фаз. Так как дифракционные пики достаточно широки, мы считаем, что кристаллы
нГА все еще малы, но они уже намного больше исходных. Нагревание исходного нГА
до 800оС привело к еще лучшему разрешению дифракционных пиков (см. рис. 3(с)),
что говорит о росте все большего числа кристаллических плоскостей при высокой
температуре. Однако при этом появляется новая дифракционная линия на углах
31,1о 2q в виде небольшой ступеньки с левой
стороны пика ГА. Эта новая дифракционная линия отражает образование β-ТСР связанное с разложение нГА.
Дальнейший обжиг образцов при температурах 800оС и 1200оС привело к еще
большему расширению пиков и росту их интенсивностей. Это говорит о том, что чем
выше температура, тем уже становятся дифракционные пики, и, следовательно,
крупнее кристаллы.
Кроме того, с увеличением температуры увеличивается количество
дополнительной фазы и система превращается в двухфазную. Разложение ГАП
происходит при температурах 1000оС и 1200оС, что согласуется с ранее
полученными результатами.
Рост и укрупнение кристалликов ГА под воздействием тепла подтверждается
снимками сканирующей электронной микроскопии. На рис. 4а можно увидеть частицы
слабо сцепленные между собой. Из рис. 4 (в) видно, что размер зерен нГА,
обожженных при температуре 700оС остается в пределах 100 нм. Рис. 4(с)
показывает, что после отжига при Т=800оС размер зерна утраивается. Начиная с
этой температуры соседние наночастицы начинают спекаться в более крупные
образования [4]. При более высокой температуре (1200оС) рост зерен приводит к
образованию частиц размером до 1 мкм в диаметре (см. рис. 2d).
По результатам рентгеноспектрального анализа соотношение Са/Р в исходном
образце равно 1,52. Такое соотношение может принадлежать либо ТСР, либо кальций
дефицитному ГА. Обычно форму кальций-дефицитного гидроксилапатита (КДГА)
записывают как :
Са10-х(РО4)6-х(НРО4)х(ОН)2-х
ГА с В-типом замещения имеет формулу
Са10-х(NH4)y(РО4)6-х(CО3)хОН)2 , где (0£х£2)
Несмотря на то, что эти два соединения имеют апатитную структуру, их
соотношение стехиометричности Са/Р может изменятся от 1,5 до 1,67 [2].
Использование только EDS недостаточно, для идентификации ГА и ТСР.
ИК-спектроскопия является подходящим методом, с помощью которого можно
определить тип фосфата кальция, ГА , ТСР, содержащихся в образце.
Все ИК-спектры в данной работе тщательно сравнивались с ранее известными.
ИК-спектр, представленный на рис. 6., подтверждает, что полученный нГА имеет
апатитную структуру. Очень часто апатитная структура содержит атомы замещения.
Ими могут быть карбонаты, фториды, хлориды, фосфатные или же гидроксильные
группы. Из литературных источников известно, что дуплет линий поглощения в
районе 1450 и 1640 см-1, а также линия поглощения в районе 873 см-1,
принадлежащей карбонатным ионам, которые замещают фосфатные группы в структуре
апатита, образуя так называемый ГА В-типа замещения.
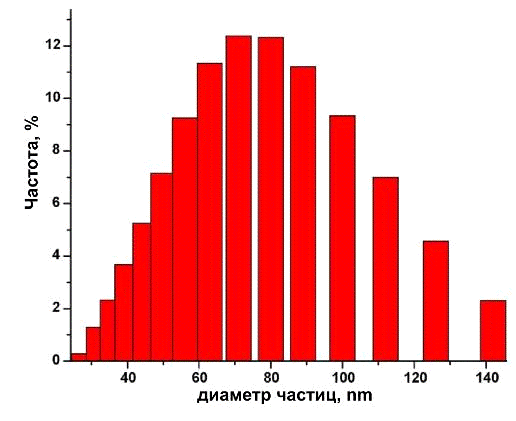
Рис. 5. Гистограмма, показывающая средний размер частиц, полученного нГА
во взвеси
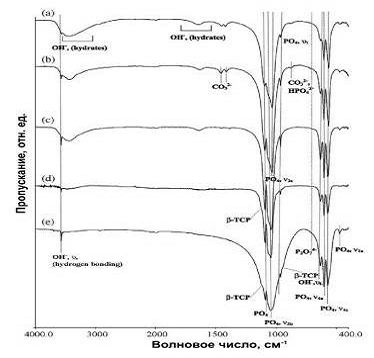
Рис. 6. ИК- спектры осажденного ГА: а) высушенный b) отожженный при
700оС, c) 800оС, d) 900оС, e) 1200оС
На рис. 6 (в)-(d) представлены ИК - спектры порошка нГА обожженного при
температурах 700-1200оС. На этих ИК - спектрах легко заметить изменение
интенсивностей линий поглощения и появление линий поглощения, соответствующие
карбонатным и гидроксильным группам. Было обнаружено, что при температуре 700оС
карбонатные ионы частично удаляются из структуры нГА. При температуре 800оС
порошок нГА полностью освободился от карбонатных групп. Кроме того, при этих
условиях происходят процессы превращения 2НРО42- в Р2О7, что влечет уменьшение
интенсивности полос поглощения НРО42- в интервале 870-840 см-1 и в то же время
появление новой линии поглощения на 715 см-1, которая принадлежит пирофосфатным
группам. Кроме того, необходимо отметить, что интенсивность линий поглощения
ОН- изменилась с увеличением температуры. Линия поглощения в районе 3500 см-1,
исчезают уже при температуре 700оС, указывая на то, что часть воды удаляется из
структуры нГА . При температуре 900оС линия поглощения ОН- полностью исчезает
(см. рис. 6d.), а на ИК- спектре становятся заметны ступеньки в районе 947, 974
и 1120 см-1, которые говорят о появлении β-ТСР, как дополнительной фазы. На ИК-
спектре образца нГА , обожженного при температуре 1200оС (см. рис. 6с.) линии
поглощения β-ТСР более заметными, помимо этого об увеличении β-ТСР говорит смещение линий поглощения
РО43- с 603 и 565 см-1 на 1090 и 1046 см-1. Это является следствием
термического распада ГА.
На рис. 7. представлены результаты термогравиметрического анализа (ТГА) и
дифференциального сканирования калориметрических измерений полученного порошка
ГА. Потеря массы на графике ТГА отражает термическую стойкость образца, а также
может дать представление о процессах химического разложения, испарения и
сублимации в образце при более высоких температурах. При нагревании до около
620оС, потеря массы составила 6,5% при полной потери массы 8,5% для данного
материала. Это изменение массы можно было бы отнести к частичному удалению
физически и химически адсорбированной воды [6]. Эти данные согласуются с
результатами ИК, где линии поглощения ОН- групп в диапазоне 3500 см-1 сужаются
при повышенных температурах.
По данным ИК - спектры образца нГА обожженного при температуре 800оС (см.
рис. 5(с)), потеря массы в диапазоне температур 600-900оС скорее всего соответствует
процессу декарбонизации ГА, в ходе которого выделяется СО2(g) и разложению
НРО42-, с выделением воды карбонатные полосы полностью исчезают при температуре
800оС. Заметим, что этот процесс разложения идет одновременно с образованием
нГА образца [5], о чем говорит значительное уменьшение интенсивности полос
поглощения, соответствующих воде, при 900оС. В этой работе DSC измерения были
выполнены чтобы исследовать эндо - или экзотермическую реакцию или возможные
фазовые переходы образца ГАП. Несмотря на общий вид кривой DSC они имеют три
эндотермических пика при 100, 842 и 1104оС, которые связаны с изменениями в
материале. Согласно TГA и ИК - спектрам, первый эндотермический пик отражает
выделение адсорбированной воды, дальнейшее нагревание до температуры 600оС
приводит к тому, что вода полностью удаляется из кристаллической решетки.
Второй эндотермический пик может быть связан с декарбонизацией и с
обезвоживанием ГА, а также с разложением ГАП в β-ТКФ, при этом последний процесс
включает разложение ГАП в β-ТКФ и α-ТКФ фазы.
Отметим, что кальций дефицитный и карбонатный ГА имеют тенденцию
распадаться на стехиометрический ГАП и ТКФ при температурах ниже 700оС. Тампиер
и др. обнаружили, что добавление Са(ОН)2 к кальций дефицитному апатиту может
компенсировать не стехиометричность и оказать положительное влияние на
стабильность ГАП при высоких температурах [7]. Это наблюдение совпадает с
результатами данной работы, так как нГА полученный в этой работе термически
устойчив вплоть до температуры 800оС.
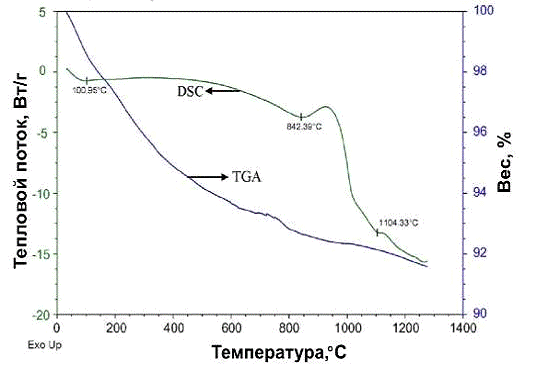
Рис. 7. Кривые DSC и TGA полученного нГА
Результаты этого исследования подтверждаются и другой работой. В качестве
исходных компонентов в ней использовали тетра нитрата кальция (Ca(NO3)2*4Н2О) и
ортофосфорной кислоты (H3PO3) как исходные материалы [18]. Нитрат кальция был
растворён в дистиллированной воде, в количестве достаточном для получения 0.5
моля раствора, в который добавили ортофосфорную кислоту, чтобы получить
отношение Ca/P 1,5. После 30 минут смешивания в смесь добавили аммиак. Осадок,
полученный после дальнейшего перемешивания в течение 30 минут, неоднократно
промывали, чтобы удалить нежелательные ионы (NH4+ и NO2-). Осадок в форме пасты
был подвергнут микроволновому облучению внутри микроволновой печи (2.45 ГГц, 800W)
в течение 15 мин [8]. Порошок КДГА был получали, размалывая получившийся
продукт в агатовой ступке.
На дифрактограммах, синтезированного КДГА, представленных на Рис. 8.,
видно, что образец полностью состоит из ГА и другие фазы отсутствуют. Даже при
том, что начальное соотношение Ca/P было 1,5, оно привело к формированию КДГА с
типичной для ГА (JCPDS-9-432) дифрактограммой. Размытые дифракционные максимумы
указывают нанокристалличность полученного порошка. Средний размер кристаллита
порошка был оценен, используя формулу Шеррера:
t = K α/B Cosθ
где t - средний размер кристаллита (нм); K является фактором формы (K =
0.9); α
- длина волны рентген (=
1.54056 для Cu Kα излучения); B - полная ширина в половине максимума
(радиан), и θ - угол дифракции Брэгга (°). Пик дифракции в 25.9° (2θ)
был выбран для
вычисления размера кристаллитов, поскольку он изолирован от других. Этот пик
соответствует (002) семейству плоскостей Миллера. Было обнаружено, что размер
кристаллита составил 36 нм. Параметры ячейки КДГА были вычислены методом
подбора наименьших квадратов и составили: а= 9.434 Å и c = 6.872 Å, которые подобны величинам, о
которых сообщали ранее, а именно, а = 9.438 Å и c = 6.886 Å.
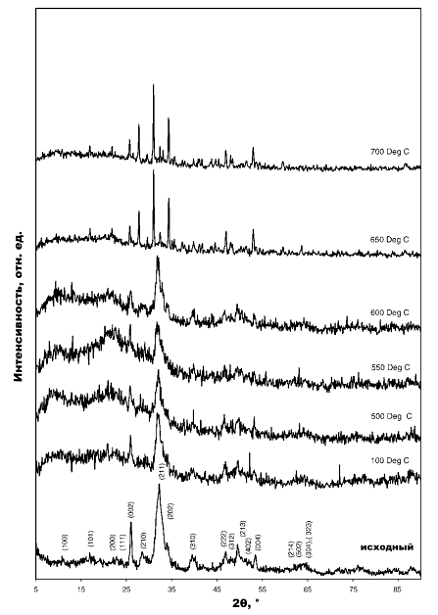
Рис. 1. Дифрактограммы исходного ГА и отожженного при разных температурах
Увеличение величины «а» параметра по сравнению со значением для
стехиометрического ГА 9.418 Å происходит из-за замещения HPO42-
ионом других ионов кристаллической решетки [7].
После тепловой обработки образцов КДГА при температурах 500, 550 и 600 °C
в образцах не появилась промежуточная фаза, такая как β-CPP,
но кристалличность была
ниже, чем у стехиометрического ГА . На дифрактограммах образцов, отожженных при
температурах 650 и 700°C, появляются дифракционные линии, соответствующие β-TCP
(JCPDS 9-169) и
отсутствуют линии ГА или β-CPP. Это подтверждает, что отношение Ca/P
синтезированного КДГА 1,5 [6]. P2O74- реагировал бы с OH-, чтобы сформировать
PO43- в районе 650°C. КДГА превратился в β-TCP при температуре ниже, чем сообщалось
[6], что, скорее всего, связано с наноразмерами полученного продукта.
ИК-спектры как синтезированного, так и отожженного при температуре 100°C
образцов, представленные на рис. 8., на которых присутствует линии поглощения
HPO42-, доказывают, что полученный апатит является КДГА. На ИК-спектрах также
присутствуют линии поглощения, принадлежащие OH- и PO43- группам, идентичные
ГА. Полосы поглощения, соответствующие, адсорбированной H2O и ионам CO3- также
были обнаружены на ИК-спектрах. КДГА отличается относительно низкой
интенсивностью линии поглощения OH- по сравнению со стехиометрическим ГА, что
подтверждает потерю ионов OH- из кристаллической решетки. Линия поглощения,
соответствующая HPO42- группе не наблюдалась на ИК-спектрах образцов,
отожженных при температуре выше 500°C. Сообщалось, что превращение HPO42- в
P2O74- происходит выше 200°C. Линия оглощения в районе 725 cm-1, которая
соответствует P2O74- группе, наблюдается на ИК-спектрах образцов, отожженных
при температуре 500°C, и исчезает на ИК-спектрах, образцов отожженных при более
высокой температуре (см. табл. 1.).
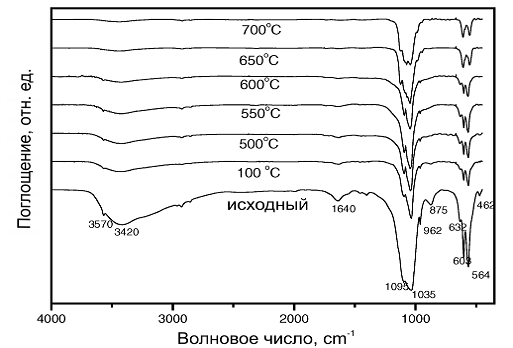
Рис.8. ИК-спектры исходного КДГА и отожженного при разных температурах
Таблица 1 Значение инфракрасных частот (cm-1) исходного КДГА и отожженного
при разных температурах
|
частота, cm-1
|
|
КДГА
|
β-TCP
|
|
Значения
|
исходный
|
100° C
|
500°C
|
550°C
|
600°C
|
650°C
|
700°C
|
|
PO43-колебание v2
|
471
|
471
|
473
|
472
|
-
|
-
|
|
PO43-колебание v4
|
564
|
564
|
565
|
566
|
567
|
554
|
552
|
|
PO43-колебание v4
|
603
|
603
|
602
|
602
|
602
|
606
|
608
|
|
Структурная OH-
|
633
|
633
|
634
|
631
|
631
|
-
|
-
|
|
P2O74-
|
-
|
-
|
725
|
-
|
-
|
-
|
-
|
|
HPO42-
|
875
|
875
|
-
|
-
|
-
|
-
|
-
|
|
PO43-- колебание v 1
|
962
|
962
|
962
|
962
|
962
|
947
|
943
|
|
PO43-колебание v 1
|
-
|
-
|
-
|
-
|
-
|
985
|
986
|
|
PO43- колебание v3
|
1034
|
1034
|
1042
|
1043
|
1044
|
1045
|
1042
|
|
PO43- колебание v3
|
-
|
-
|
1092
|
1091
|
1070
|
1072
|
|
HPO42-
|
1094
|
1094
|
-
|
-
|
-
|
-
|
-
|
|
PO43- колебание v3
|
-
|
-
|
-
|
-
|
-
|
1122
|
1119
|
|
CO32- v3
|
1402
|
-
|
-
|
-
|
-
|
-
|
-
|
|
CO32- v3
|
1455
|
-
|
-
|
-
|
-
|
-
|
-
|
|
H2O абсорбированная v2
|
1641
|
1632
|
1632
|
1642
|
1642
|
1642
|
1643
|
|
H2O абсорбированная
|
3400
|
3400
|
3400
|
3400
|
3400
|
3400
|
3400
|
|
Структурная OH -
|
3569
|
3570
|
3570
|
3570
|
3570
|
-
|
-
|
Это происходит из-за потери пирофосфата посредством реакции с ГА, в
результате которой формируется β-TCP [6].
Интенсивность гидроксилильных и фосфатных групп может использоваться для
определения кристалличности ГА. После высокотемпературной обработки образцов
линии поглощения вышеупомянутых групп имеют низкую интенсивность, что
согласуется с результатами рентгеноструктурного анализа, предлагающим низкую
кристалличность КДГА. На ИК-спектрах образцов, отожженых при температурах 650 и
700 °C, появляются линии поглощения в районе 947, 986 и 1122 cm-1,
соответствующие β-TCP. На этих ИК-спектрах также отмечено
отсутствие линий поглощения OH- группы. На ИК-спектрах всех образцов
присутствуют полосы поглощения адсорбированной воде.
Это может возникнуть из-за нанокристалличности полученного продукта а
также его высокой пористости, с которой связанна полоса поглощения
адсорбированной воды при более высоких температурах.
НА Рис. 9 представлены спектры комбинационного рассеянья синтезированого
КДГА и отожженного при температуре 100 °C. На этих спектрах видны характерные
линии P-O в районе 964 и 1046 с и O-P-O в районе 594 и 433 cm-1 принадлежащие
PO43- группе ГА. Небольшое отклонение от ранее сообщённых значений для HPO42-
группы было обнаружено. Отсутствие линии флюоресценции в районе 770-690 cm-1
характерной для гексогональной структуры стехиометрического ГА является явным
свидетельством искажения структуры КДГА вследствии внедрения HPO42-. Эти данные
подтверждают результаты рентгеноструктурного.
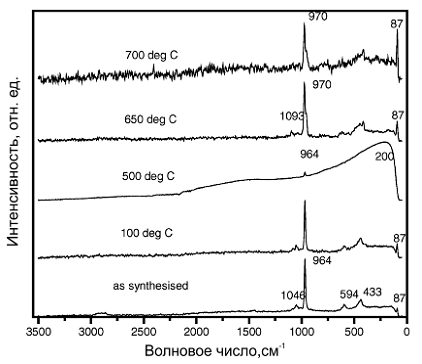
Рис.9. Спектры комбинационного рассеянья исходного КДГА и отожженного при
разных температурах
Таблица 2 Межплоскостное расстояние синтезированного КДГА
|
Межплоскостное расстояние, Å
|
|
Индексы Миллера
|
ГA
|
Исходный КДГА
|
XRD
|
SAED
|
|
(002)
|
3.44
|
3.40
|
3.34
|
|
(210)
|
3.08
|
3.07
|
3.02
|
|
(211)
|
2.81
|
2.81
|
2.68
|
|
(311)
|
2.15
|
2.15
|
2.17
|
|
(213)
|
1.84
|
1.85
|
1.88
|
|
(410)
|
1.78
|
1.77
|
1.76
|
На спектрах образца отожженного при температуре 500°C, заметна очень
слабая линия 964 cm-1, и большой широкий пик в районе 200 cm-1, которые
характерны для P2O74-, сформированного как промежуточный соединение в
шестиугольной структуре. На спектрах образцов отожженных при температуре 650 и
700 ° C, видны линии 970, 1093 и плечо в районе 964 cm-1 характерные для P-O а
также линия 409 cm-1 соответствующая O-P-O PO43- группы β-TCP
[10]. Степень
кристалличности образцов повышается с увеличением температуры отжига, о чем
говорит увеличение интенсивности линии 87 см-1 .
НА ри.10. представлены как светлопольные, так и темнопольные снимки,
сделанные с помощью TEM, а также результаты электронографии полученного КДГА.
На этих снимках видно, что частицы синтезированного КДГА имеют форму игл и
преимущественно собраны в скопления. Частицы 16-39 нм длиной и шириной 7-16 нм.
Результаты электронографии подтверждает нанокристалличность полученого КДГА.
Межплоскостное расстояние вычисленное с помощью электронографии (см. табл. 2.)
такое же как и рассчитанное с помощью рентгеноструктурного анализа и соответствует
ГА (JCPDS 9-432). Что в очередной раз доказывает формирование КДГА.

Рис.10.
Снимки просвечивающего электронного микроскопа: (а) светлопольные, (b)
темнопольные, (с) электронограмма
Все
вышеприведенные факты говорят о том, что микроволновое облучение является очень
удобным технологическим приёмом, для ускоренного получения КДГА с более
коротким временем подготовки по сравнению с другими доступными методами. При
этом частицы КДГА имеют наноразмеры, о чём свидетельствуют различные методы
исследований. Однако, в данных работах, микроволновое излучение использовалось
лишь как улучшение уже существующих методов синтеза. Как главный фактор синтеза
микроволновое излучение присутствует лишь в твердофазных реакциях, где без его
участия образование конечного продукта просто невозможно.
1.3 Твердофазный синтез ГА под воздействием микроволнового излучения
В качестве исходных компонентов для твердофазной реакции использовались
тетрагидрат нитрата кальция (Ca(NO3)2*4H2O) и фосфат натрия (Na3PO4 *12H2O).
Исходные компоненты смешивались в соответствии со стехиометрическим
соотношением (Са/Р=1,67). Потом перетирались в шаровой мельнице в течение 20
минут при комнатной температуре. После перемешивания исходную смесь помещали в
тефлоновые сосуды, а потом в конвекционную и микроволновую (LG, MS-2079T, 2.45GHz,
700W) печи. В микроволновой печи образцы облучали излучением мощностью 350W.
Было проведено четыре серии экпериментов:
1. микроволновое нагревание исходной смеси в течение 0,5 минут
(15секунд облучения, 15 секунд выдержка без облучения).
2. микроволновое нагревание исходной смеси в течение 1 минуты
(15секунд облучения, 15 секунд выдержка без облучения, после чего цикл
повторялся).
. резистивный обжиг исходной смеси в печи при температуре
80 0С, в течение 6 часов.
. микроволновое нагревание исходной смеси в течение 1 минуты
(непрерывное).
Полученный в результате продукт промывали этанолом и дистиллированной
водой несколько раз, что бы убрать непрореагировавшие ионы, а именно Na+, NO3-.
После этого продукт сушили под вытяжкой при температуре 80 0С, в течение 6
часов [11].
Для исследования, полученных продуктов использовали методы:
рентгеноструктурного, ИК-спектроскопического анализов, а также сканирующую и
просвечивающую микроскопию.
Ни рис. 11с. мы можем увидеть, что продукты полученные с помощью
термического отжига в течение 6 часов слабо кристаллизованы, в то время как
продукты, полученные с помощью микроволнового нагревания имеют
высококрислаллическую структуру, что видно на дифрактограммах (см. рис . 11a, b
и d). Пики на дифрактограммах (см. рис 11a, b и d) совпадают с пиками
гексагонального ГА. Предполагается, что относительное уширенные пики на рис
11а, связаны с меньшим размером частиц, что позже подтвердили снимки, сделанные
с помощью сканирующего электронного микроскопа (см рис 13а и b).
На рис 12 показаны ИК-спектры ГА частиц, полученных с помощью
микроволнового нагревания в течение 1 минуты. На спектрах видно присутствие OH-
и PO4 3- в конечном продукте. Например, полосы поглощения на 603 и 573 см-1
обусловлены колебаниями ν4 PO4 3- в ГА. Пики на 964 см-1 отражают колебания ν1 PO4 3- ,а 1091/1052 см-1 относятся к
ν3
PO4 3- . Полосы
поглощения, которые появляются на 3574 см-1, объясняются продольными
колебаниями OH-, а линия поглощения на 635 см-1 обусловлена колебательным
движением OH-.
На рис 13 показано строение и распределение по размерам ГА частиц,
полученных в различных условиях. На снимках сканирующего электронного
микроскопа (см. рис 13а и b) мы можем увидеть ГА наночастицы, полученные с
использованием микроволнового нагревания в течение 0,5 минут.
Однако при увеличение времени нагревания до 1 минуты, ГА наночастицы
превращаются в наностержни диаметром 60-80 nм и средней длинной 400 nм (см. рис
13с). На этих снимках мы можем также увидеть то, что ГА наностержни имеют
приблизительно одинаковое соотношение размеров и однородное строение. Сравнивая
рис 13а и 13с, мы можем сделать вывод о том, что время микроволнового
нагревания играет важную роль при образовании ГА наностержней. На рис 13d
показаны образцы, преимущественно состоящие из коротких стержнеобразных частиц
с малым форм-фактором.
Полученные результаты говорят о том, что в ходе эксперимента были успешно
получены ГА наночастицы и наностержни различных размеров [11]. Очевидно, что ГА
не может быть получен без микроволнового нагревания (см. рис 11с). Если для
обработки исходной смеси применять микроволновое нагревание, то ГА может быть
легко получен. Изменяя время микроволнового нагревания, можно получить
кристаллы ГА имеющие различное строение (см. рис 13а и 13с). продолжительность
микроволнового нагрева также существенно влияет на структуру и размер ГА
частиц. Можно сказать, что длительное микроволновое нагревание приводит к
образованию достаточно крупных ГА наностержней ГА, в отличие от периодического
микроволнового нагревания (см. рис 13с и 13d). Общеизвестно, что твердофазная
реакция обычно требует жёстких реакционных условий, таких как высокая
температура и давление, необходимых для преодоления низкой скорости диффузии
молекул и атомов в образце и большого количества дефектов. Именно поэтому не ГА
не был получен при конвекционном обжиге при температуре 80 0С в течение 6
часов.
нанокристаллический
кальций гидроксилапатит микроволновый
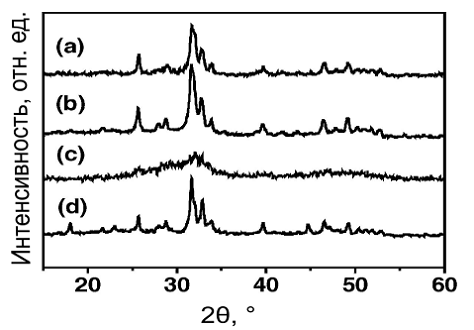
Рис.11. Дифрактограмы исходного ГА и ГА, полученного в результате разных
режимов нагрева: (a) микроволновое нагревание 0,5 мин, (b) микроволновое
нагревание 1 мин, (c) термический нагрев 80 0С, (d) продолжительное микроволновое
нагревание 1мин
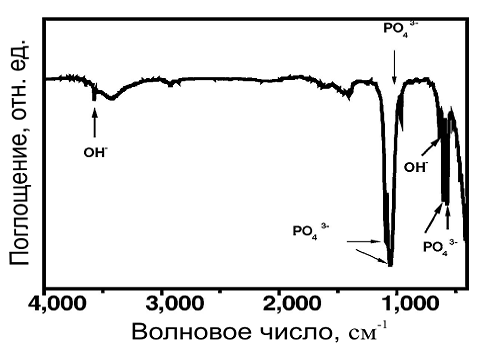
Рис.12. ИК-спектр синтезированного ГА, микроволновое нагревание 1 мин

Рис. 13. (a),(b) Снимки наночастиц ГА, полученных в результате
микроволнового нагревания 0,5 мин, сделанные с помощью сканирующего и
просвечивающего электронного микроскопа, (c) снимки наностержней ГА, полученных
в результате микроволнового нагревания 1 мин, (d) снимки скопления частиц ГА,
полученных в результате непрерывного микроволнового нагревания 1 мин
Ранее сообщалось, что если гидратированная соль реагирует с другими
реагентами, то кристаллическая вода высвобождается из структуры соли [8].
Молекулы этой воды создают слой жидкой плёнки на поверхности частицы соли,
фактически создавая жидкую микросреду для взаимодействующих веществ. Поэтому
наличие гидратных групп в соли может существенно понизить температуру
твердофазной реакции и чрезвычайно её ускорить. Таким образом, можно сказать,
что микроволновое нагревание и наличие гидратных групп во взаимодействующих
солях способствует диффузии, зародышеобразованию и росту частиц ГА.
Стержнеобразная форма ГА частиц объясняется наличием у гексагонального ГА
предпочтительной грани роста (002), что и приводит к образованию стержней, а не
частиц. Кроме того, движение PO4 3- , вследствие поляризации, под воздействием
быстро меняющегося электрического поля приводит к появлению в системе
установившихся анизатропических микродоменов, тем самым, способствуя росту
наностержней.
Подытоживая всё вышесказанное можно сказать, что данный метод позволяет
получить ГА наностержни в результате простой одношаговой твердофазной реакции
при комнатной температуре, осуществлённой при помощи микроволнового нагревания.
В работе сравнили микроволновое и конвекционное нагревание при синтезе ГА,
исследовали влияние времени микроволнового нагревания на характеристики
конечного продукта. Полученные результаты говорят о том, что микроволновое
облучение играет важную роль при синтезе ГА наностержней, так как с его помощью
можно значительно сократить время реакции и максимально упростить подготовку
синтеза. Поэтому данный метод является прорывом по сравнению с классическими
методами синтеза.
2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ: МИКРОВОЛНОВЫЙ ТВЕРДОФАЗНЫЙ СИНТЕЗ НАНОКРИСТАЛЛИЧЕСКОГО
КАЛЬЦИЙ ДЕФИЦИТНОГО ГИДРОКСИЛАПАТИТА
2.1 Объект исследования и методика проведения эксперимента
В данной работе изучены структура, примесный состав и термическая
стабильность нанокристаллического КДГА, полученного в результате микроволнового
твердофазного синтеза, а также исследовано влияние параметров облучения на
характеристики порошка.
Исходные компоненты реакционной смеси: тетрагидрат нитрата кальция
(Ca(NO3)2*4Н2О) и фосфат натрия (Na3PO4 ) в требуемом соотношении (Са/Р=1,67)
тщательно перемешивались и помещались в микроволновую печь. Затем они
подвергались воздействию микроволнового излучения различной длительности и
мощности. Для сравнения был проведен термический отжиг реакционной смеси.
Продукты синтеза исследовали методами рентгеноструктурного, ИК-спектрометрического,
масс-спектрометрического термогравиметрического анализов и методом растровой
электронной микроскопии.
2.2 Полученные результаты и их обсуждение
На рис.14. вы можете увидеть дифрактограммы исходных компонентов
(Ca(NO3)2*4Н2О и Na3PO4). Как видим, после того как их смешали, произошла
химическая реакция, которая, однако, не привела к образованию ГА. ГА также не
был получен и после того как смесь отожгли. Однако под воздействием
микроволнового облучения произошло образование высокодисперсной фазы,
дифрактограмма которой содержит наиболее характерные дифракционные отражения
нанокристаллического ГА.
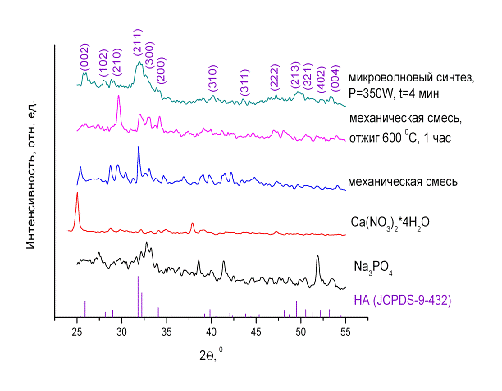
Рис. 14. Дифрактограммы исходной реакционной смеси и продуктов микроволнового синтеза
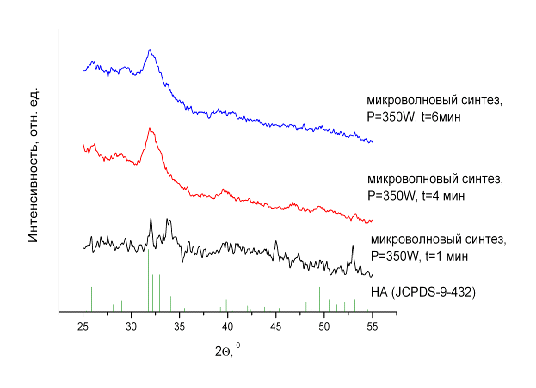
Рис. 15. Зависимость фазового состава продукта от длительности
микроволнового облучения
На процесс микроволнового синтеза можно воздействовать двумя параметрами,
а именно длительностью и мощностью микроволнового излучения. Результаты влияния
этих двух параметров излагаются далее.
Оказалось, что микроволновое облучение реакционной смеси длительностью
менее 1 минуты не приводит к образованию ГА (см. рис. 15.). Было установлено,
что воспроизводимый синтез нанокристаллического ГА происходит, начиная с
мощности 350W и длительности облучения 4 минуты. Более длительное облучение не
приводит к существенным изменениям в образовавшемся ГА.
Характеристики продукта изменяются при увеличении мощности микроволнового
излучения (см. рис. 16.). Анализ дифрактограмм показывает, что интенсивность и
разрешение линии 002 увеличивается, в то время как другие дифракционные линии
существенно не изменяются. Это говорит о том, что частицы ГА растут вдоль оси
с, оставаясь нанокристаллическими в остальных двух измерениях.
На снимках, сделанных с помощью растрового микроскопа (см. рис. 17),
видно, что полученный порошок ГА действительно является нанокристаллическим,
как показали дифрактограммы, потому что состоит из частиц размеры, которых
преимущественно находятся в нанодиапазоне.
С целью изучения термостабильности, полученного ГА, некоторое количество
синтезированного порошка отжигали до высоких температур (см. рис. 18.). Как
видим, изменения в фазовом составе порошка начинаются с температуры 700 0С.
Кроме того в образцах возникает некоторое количество β-ТСР. С увеличением температуры отжига
количество β-ТСР увеличивается. Так что при температуре 1150 0С порошок
почти полностью состоит из β-ТСР. Это значит, что полученный ГА
был действительно нестехиометрическим. Для определения природы
нестехиометричности порошок исследовали термогравиметрическим и
масс-спектрометрическим методами.
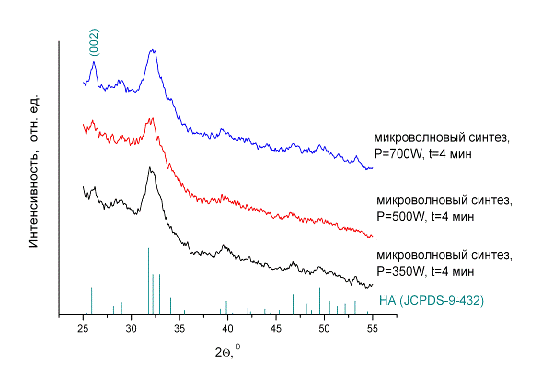
Рис. 16. Дифрактограммы образцов в зависимости от мощности микроволнового
излучения





Рис. 17. Микроволновый синтез: Р=350W, t=4мин (a); Р=500W, t=4мин (b); Р=700W t=4мин (c, d)
Термогравиметрические исследования (см. рис. 19), полученного ГА,
показали наличие потери массы в трёх температурных интервалах: 20-280 0С,
280-600 0С и 600-950 0С.
Природа потери массы была установлена с помощью масс-спектрометрии (см.
рис. 20.). Оказалось, что в первом интервале температур выделяется вода, во
втором преимущественно вода и углекислый газ, а в третьем только углекислый
газ. Предыдущие исследования показали, что газовыделение в интервале 20-280 0С
связано с выделением абсорбированной воды, в интервале 280-600 0С с реакциями
между НРО4 и карбонатами в кристаллической решетке, а в интервале 600-950 0С с
термическим разложением карбонатных ионов в кристаллической решетке ГА.
ИК - спектры образцов (см. рис. 21.) подтвердили данные результаты. Так
на ИК-спектрах исходного порошка действительно обнаруживаются полосы поглощения
Н2О (1640, 3420 см-1), НРО42- группы (875 см-1) и карбонатных ионов СО32- (872
(в-тип),1421, 1455 см-1). По мере отжига эти полосы исчезают, то есть примеси
выделяются в виде газообразных продуктов. Кроме того, с увеличением температуры
отжига кроме полос поглощения ГА появляются полосы поглощения, принадлежащие β-ТСР, интенсивность которых с
повышением температуры увеличивается.
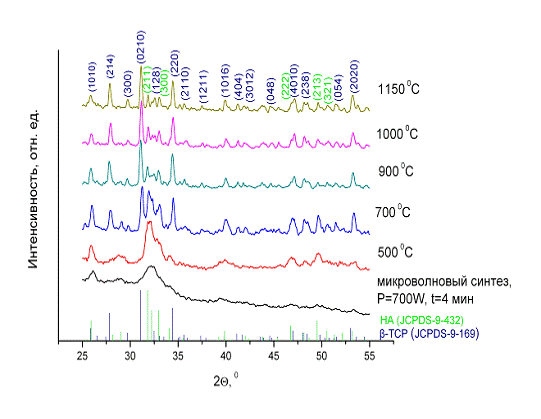
Рис. 18. Дифрактограммы образцов КДГА, отожженных при различной
температуре
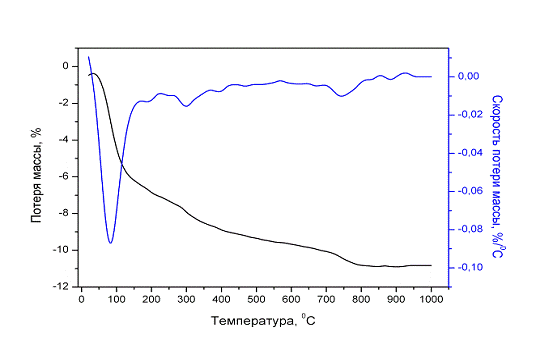
Рис. 19. Термогравиметрия
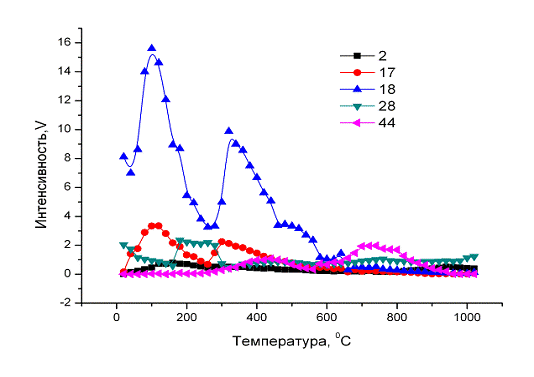
Рис. 20. Масс-спектры образцов; микроволновый синтез при Р=700W, t=4мин
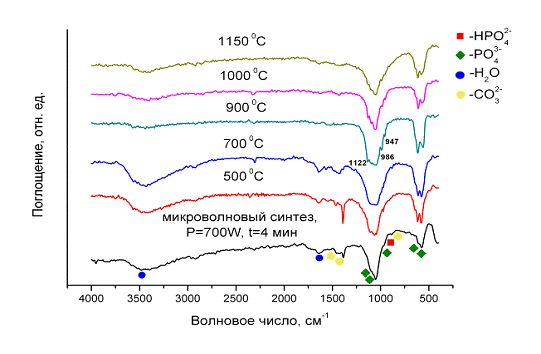
Рис. 21. ИК-спектры образцов КДГА, отожженных при различной температуре
ВЫВОДЫ
Таким образом, различные методы исследования дали хорошо согласующееся
результаты. Их можно свести к следующему.
Показана возможность получения нанокристаллического КДГА в результате
твердофазного микроволнового синтеза.
Обнаружено, что на структуру и морфологию частиц КДГА существенно влияет
длительность и мощность микроволнового излучения.
Впервые установлены особенности примесного состава синтезированного
порошка КДГА.
Впервые исследована термическая стабильность и изменения примесного и
фазового состава нанокристаллического КДГА, полученного данным методом, в
процессе отжига.
СПИСОК
ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Баринов
С. М., Комлев В.С. Биокерамика на основе фосфатов кальция.- М.: Наука, 2005. с
137-152.
2. Каназава
Т. Неорганические фосфатные материалы: Пер. с англ.- К.: Наукова думка, 1998. с
16-57.
3. Физическая
энциклопедия/ Под ред. А. М. Прохорова. - М.: 1988.
4. B.Vaidhynathan,
K. J. Rao, Rapid microwave assisted synthesis of hydroxyapatite// Mater. Sci, Vol 19, No 6. desember
1996 pp 1163-1165.
5. Siwaporn
Meejoo, Weerakanya Maneeprakorn, Pongtip Winotai, Phase and thermal stability
of nanocrystalline hydroxyapatite prepared via microwave heating// Thermochimica Acta 447 (2006)
115-120.
6. E.
Lerner, S. Sarig , R. Azory, Enhanced maturation of hydroxyapatite from aqueous solutions
using microwave irradiation// J. Mater. Sci. Mater. Med. 2 (1991) 138-141.
7. N.
Rameshbabu, K. Prasad Rao, T. S. Sampath Kumar, Acclerated microwave processing
of nanocrystalline hydroxyapatite// J. Mater. Sci. 40 (2005) 6319-6323.
8. Siddharthan,
S.K. Sedshadri ,T.S. Sampath Kumar, Microwave accelerated synthesis of
nanosized calcium deficient
hydroxyapatite// J. Mater. Sci. Mater.
Med. 15 (2004) 1279 - 1284.
. K.
J. Rao, B. Vaidhyanathan, M. Ganguli, and P. A. Ramakrishnan, Synthesis of
Inorganic Solids Using Microwaves// Chem. Mater. 1999, 11, 882 895.
. Y.
FANG, D. K. AGROWAL, D. M. ROY, R. ROY, Microwave sintering of hydroxyapatite
ceramics// J. Mater. Res., Vol 9, No
1, Jan 1994.
. JIE
MING CAO, JIE FENG, SHAO GAO DENG, XIN CHANG, JUN WANG, JIN SONG LIU, PENG LU,
HONG XIA LU, MING BO ZHENG, FANG ZHANG, JIE TAO, Microwave-assisted solid-state
synthesis of hydroxyapatite nanorods at room temperature// J. Mater. Sci. 40 (2005) 6311-6313.