Сравнительная характеристика некоторых биохимических признаков риса
ФЕДЕРАЛЬНОЕ
АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГООБРАЗОВАНИЯ
«УССУРИЙСКИЙ
ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ ИНСТИТУТ»
ФАКУЛЬТЕТ
БИОЛОГИИ, ХИМИИИ, ПСИХОЛОГИИ
КАФЕДРА
ХИМИИ
Сравнительная
характеристика некоторых биохимических признаков риса
Выполнила студентка V
курса группы С-2501
Ткач Е. П._________
Руководитель к.б.н., доцент
Жукова Н. И
Уссурийск
2012
Содержание
Введение
Глава 1. Материалы и методы
определения
1.1 Подготовка исследуемого
материала
.2 Колориметрическое определение
фосфорсодержащих веществ
1.2.1 Метод Лоури и
Лопесу в модификации Скулачева
.2.2 Определение
активности фосфорилазы (КФ 2.4.1.1)
.2.3 Определение
содержание фитина мокрым озолением
.2.4 Определение
содержание фитина без перерасчета из содержания неорганического фосфора
1.2.5 Пример расчета
Глава 2. Обсуждение результатов
исследования
Заключение
Литература
Приложение
Введение
Злаки (лат.
<#"550496.files/image001.gif">
Молибденовая синь в растворе
находится в коллоидном состоянии, легко адсорбируется поверхностно-активными
веществами. Перед фотометрированием нельзя фильтровать уже окрашенные растворы.
От природы восстановителя
зависит скорость реакции восстановления и чувствительность метода. Если в
исследуемом растворе содержится белок, то необходимо его предварительно
удалить.
Для этого в исследуемый раствор
добавляют раствор трихлоруксусной или хлорной кислоты. Раствор хорошо
перемешивают, осадок белка удаляют фильтрованием или центрифугированием. Если в
растворе присутствуют кислотолабильные фосфорные соединения, то фильтрование
или центрифугирование проводят на холоде, а кислоту из безбелкового раствора
удаляют. От трихлоруксусной кислоты можно освободиться путем повторного
встряхивания раствора с 5- 10-кратным объемом насыщенного водой эфира.
Трихлоруксусная кислота переходит при этом в эфирную фракцию. После
встряхивания и отстаивания эфир отсасывают водоструйным насосом. Хлорную
кислоту удаляют в виде калиевой соли (КСlO4),
образующейся при нейтрализации раствора 5н. раствором КОН. Вместо удаления
кислот безбелковый раствор можно просто нейтрализовать раствором NaOH.
При этом необходимо определить конечный объем пробы. Фосфат определяют прямо из
полученного безбелкового раствора.
Наибольшее распространение
среди колориметрических методов определения фосфора получил метод Фиске -
Суббароу. Однако в ходе проделанной работы использовался другой метод: Лоури и
Лопесу в модификации Скулачева - характеризующейся более высокой
чувствительностью, чем другие колориметрические методы, и позволяющий
определить от 0,3 до 6 мкг Р в 1 мл колориметрируемого раствора.
.2.1 Метод Лоури и Лопесу в
модификации Скулачева
Принцип этого метода состоит в
превращении фосфорномолибденового комплекса в «синь» под действием аскорбиновой
кислоты. Ускорение реакции и повышение чувствительности метода достигаются
присутствием ионов меди в инкубационной среде. Этот метод применяют в тех
случаях, когда в анализируемой вытяжке, кроме неорганического фосфора,
присутствуют лабильные органические фосфорсодержащие соединения. Восстановление
фосфорномолибденового комплекса проводится при более низкой кислотности среды
(рН 4), чем в методе Фиске-Суббароу (рН 0,65). В таких условиях лабильные
фосфорные соединения более устойчивы.
Реактивы (готовят на
бидистилляте):
) 0,1 М ацетатный буфер с рН 4;
) 1 % - ый раствор
молибденовокислого аммония, приготовленный на 0,05 н. растворе H2S04;
) 1 % - ый раствор аскорбиновой
кислоты, приготовленный на 0,001 М растворе сернокислой меди CuS04•5H20
(реактив нестоек, поэтому готовят небольшие порции в день определения)
Приготовление реактивов:
. Для получения
ацетатного буфера с заданной рН, обратились к справочной литературе [Лурье],
для того чтобы получить буфер с рН = 4, но СМ = 0,1. Поэтому вначале
приготовили 0,1М раствор с рН = 4, а затем разбавили его в два раза, получив
при этом необходимый 0,2М буфер с рН = 4.
Для приготовления ацетатного
буфера смешивали 18мл раствора 0,2М CH3COONa
и 82мл раствора 0,2М СН3СООН:
Ø Необходимую массу
соли и объем воды для получения 0,2М раствора CH3COONa
рассчитывали по формуле:
См
=  υ
= Cм
V
υ
= Cм
V
υ
(CH3COONa) = 0,018л.
0,2М
= 0,0036моль
υ = 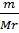 m
= Mr υ
m
= Mr υ
m
(CH3COONa)
= 0,0036моль 82г/моль = 0,2956г ≈ 0,30г
m
(Н2О) = 18г - 0,30г = 17,70г или 17,70мл, т. к. ρ(Н2О)
= 1г/мл
Ø Необходимый объем
кислоты и воды для приготовления раствора 0,2 М СН3СООН рассчитывали
по формуле:
υ (разбавл.
кислоты) = 0,2М 0,082л = 0,0164 моль
V
(рабочей
кислоты, которую имеем в лаборатории) = 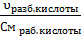
См раб. кислоты взяли
в справочнике [Лурье], но сначала определили ее плотность, при помощи
ареометра.
V
(рабочей
кислоты) = 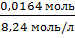 =
0,00199л = 1,99 мл≈ 2мл
=
0,00199л = 1,99 мл≈ 2мл
V
(Н2О) = 82мл - 2мл = 80мл
Приготовили 100 мл 0,2 М
раствора ацетатного буфера с рН = 4, затем разбавили в два раза и получили 200
мл 0,1М раствора ацетатного буфера с рН = 4
. Для приготовления 25мл
сернокислой меди, 0,06г CuSO4
растворили в 10-12мл воды, добавили 0,25г аскорбиновой кислоты и объем довели
до метки.
. Для приготовления
1%-ого раствора молибденовокислого аммония в 0,05н. H2S04,
1г чистого молибденовокислого аммония поместили в мерную колбу на 100мл и
довели объем до метки 0,05н H2S04
. Для приготовления
0,05н раствора H2S04,
0,140мл H2S04
(ρ
= 1,84)
разбавили водой до 100мл
. Для приготовления
стандартного раствора, растворили 0,044 гКН2Р04 в 100мл
воды, фосфат калия предварительно высушили при 100°С, 2 часа.
Ход анализа
,1 мл вытяжки, 5 мл ацетатного
буфера, 0,5 мл 1 %-го молибдата аммония и 0,5 мл раствора аскорбиновой кислоты.
Общий объем получили 6,1 мл и через 10 мин раствор колориметрировали с красным
светофильтром при 660 нм, в кювете с толщиной слоя 5 см относительно
бидистиллярованой воды.
Построение калибровочной кривой
Для построения калибровочной
кривой брали объемы фосфата от 0,05 до 0,5 мл. Объем ацетатного буфера изменяли
от 5,45 до 5 мл в зависимости от взятого объема фосфата. Общий объем смеси
(фосфат + реактивы) равен 6,5 см3 (табл. 1). В 1 мл приготовленного
рабочего раствора содержится 0,025 мг фосфора. Затем колориметрировали (табл.
2) и строили калибровочный график (рис. 22.). При построении калибровочного
графика на оси абсцисс откладывают концентрацию фосфора, а на оси ординат -
оптическую плотность растворов.
Таблица 1
Соотношение реактивов в
пробирках
|
Название
раствора
|
Номер
пробирки
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
Ацетатный
буфер мл
|
5,45
|
5,40
|
5,35
|
5,30
|
5,25
|
5,20
|
5,15
|
5,10
|
5,05
|
5,00
|
|
Стандартный
р-р мл
|
0,05
|
0,10
|
0,15
|
0,20
|
0,25
|
0,30
|
0,35
|
0,40
|
0,45
|
0,50
|
|
Молибдат
аммония мл
|
0,5
|
|
Аскорбиновая
к-та мл
|
0,5
|
|
Общий
объем мл
|
6,5
|
Таблица 2
Молибденово-синяя шкала окраски
|
Показатель
|
Номер
пробирки
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
Стандартный
р-р мл
|
0,05
|
0,10
|
0,15
|
0,20
|
0,25
|
0,30
|
0,35
|
0,40
|
0,45
|
0,50
|
|
С
(КН2РО4) 10-3 мг/мл
|
0,192
|
0,385
|
0,577
|
0,769
|
0,962
|
1,154
|
1,346
|
1,538
|
1,731
|
1,932
|
|
Оптическая
плотность Е660нм
|
0,13
|
0,15
|
0,17
|
0,19
|
0,21
|
0,23
|
0,25
|
0,27
|
0,29
|
0,31
|
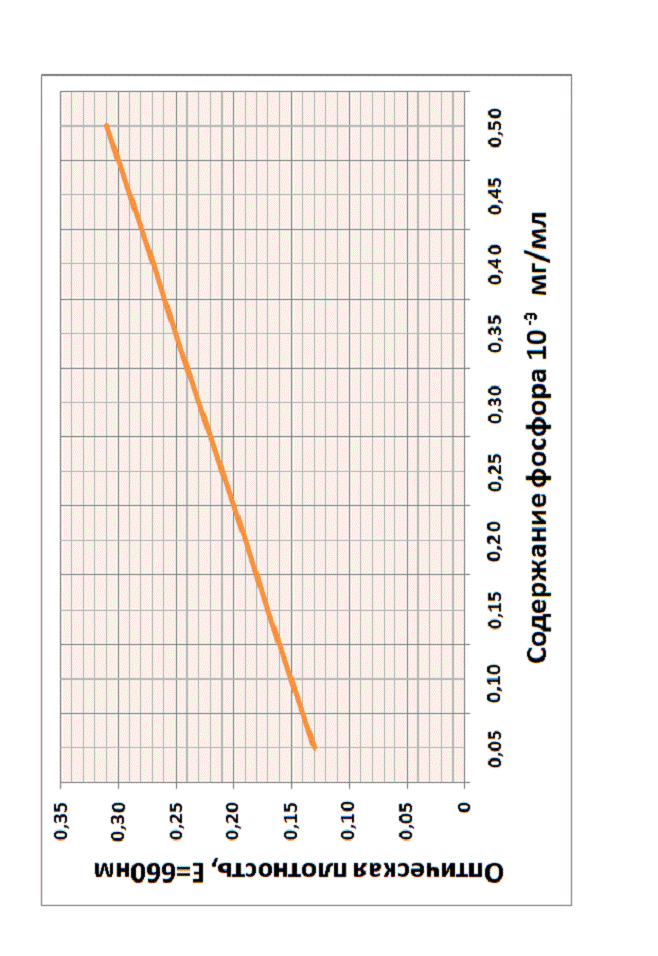
Рис. 22. Калибровочная кривая для определения Р2О5
Содержание фосфора (мг/100г)
вычисляют по формуле:
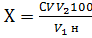 ;
;
где С - концентрация фосфора,
найденная по калибровочной кривой, мг/мл;
V
- общий объем пробы, мл;
V1-
объем пробы, взятой для определения фосфора мл;
V2
- конечный объем перед колориметрированием (10 мл);
н - масса навески, г.
.2.2 Определение активности
фосфорилазы (КФ 2.4.1.1)
Фосфорилаза катализирует
превращение крахмала в глюкозо-1-фосфат в присутствии неорганического фосфата:
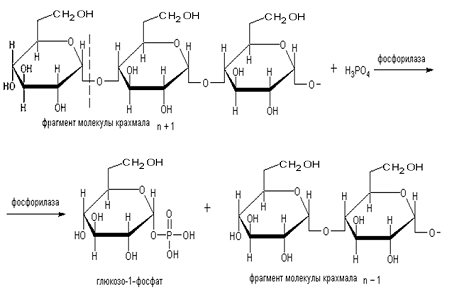
Эта реакция обратима. Однако
фосфорилаза синтезирует крахмал из глюкозо-1-фосфата только при наличии в
реакционной смеси следов крахмала в качестве «затравки». Концентрация
водородных ионов оказывает влияние на равновесие реакции. Принцип метода
основан на определении изменений в содержании неорганического фосфора или
крахмала в реакционной смеси под действием фосфорилазы.
Реактивы:
) реактив А (27,15мл 0,1М
фосфатного буфера с рН 7,2 + 72,40мл 0,9%-го раствора NaCl
+ 0,45мл 0,8%-го раствора MgS04);
) 3%-й раствор крахмала;
) 0,1М раствор фтористого
натрия;
) 10%-й раствор трихлоруксусной
кислоты (ТХУ).
Приготовление реактивов:
. Для получения 0,1М
фосфатного буфера с рН 7,2, смешали 17,7мл 0,1М КН2РО4 и
12,3мл 0,1М КОН;
. Для приготовления
раствора 0,1М КН2РО4, растворили 0,24г соли в 17,7мл
воды;
. Для получения раствора
0,1М КОН растворили 0,07г щелочи в 12,3мл воды;
. Для получения 0,9%-ого
раствора NaCl, растворили
0,9г соли водой в мерной колбе на 100мл;
. Для получения 0,8 % -
ого раствора MgS04, растворили
0,2 г соли водой в мерной колбе на 25 мл;
. Для приготовления
3%-ого раствора крахмала, 3г крахмала смешивали с 10мл холодной воды, получив
насыщенную кашицу, которую влили в 87мл горячей воды, немного прокипятили и
охладили;
. Для получения 0,1М
раствора NaF, 0,1г соли
растворили в мерной колбе на 25мл;
. Для получения 10% ТХУ,
растворили 10г кристаллической трихлоруксусной кислоты в мерной колбе на 100мл;
Ход анализа
В опытную пробирку налили 1мл
3%-го раствора крахмала, 2мл реактива А, 1мл 0,1М раствора фтористого натрия и
1мл вытяжки исследуемого объекта, выдержали в течение 2 ч при
температуре 37°С, перемешали затем в пробирку прилили 5мл 10%-го раствора ТХУ,
перемешали и довели содержимое пробирки водой до объема 10мл, затем осадок
отделили на центрифуге. Далее определяли фосфор по методу Лоури и Лопесу в
модификации Скулачева.
Параллельно проводили
контрольное определение, добавляя реактив А и фтористый натрий к прокипяченному
ферменту или после предварительного прекращения действия фермента 10%-м
раствором ТХУ (1мл фермента + 5мл 10%-го раствора ТХУ).
Активность фосфорилазы выражали
в миллиграммах связанного фосфора под действием фермента из 100г ткани. Количество
связанного фосфора определяли по разности между содержанием фосфора в
контрольной (неорганический фосфор) и опытной пробах (общий фосфор).
.2.3 Определение содержание
фитина мокрым озолением
В опытную пробирку налили 2мл
реактива А, 1мл 0,1М раствора фтористого натрия и 1мл исследуемой
вытяжки, которую предварительно прокипятили или можно добавить 5мл 10%-ого
раствора ТХУ, а потом 1мл вытяжки. Фосфор фитина после озоления определяли
колориметрическим методом по Лоури и Лопесу в модификации Скулачева, как
описано выше.
Количество найденного фосфора
(в Р2О5) умножали на коэффициент 1,55 и находили
содержание фитина в пересчете на инозитгексафосфорную кислоту.
1.2.4 Определение пленчатости
На дно фарфоровой ступки кладем тонкую
металлическую сетку, ею же обтягиваем пестик. Навеску помещаем в ступку и,
слегка надавливая на зерно пестиком и вращая его, отделяем пленки, избегая
раздавливания зерен. Затем просеиваем через сито с отверстиями размером 2,2×20
мм
или 1,8×20
мм. Оставшиеся необрушенные зерна вновь помещаем в ступку и шелушим до полного
обрушивания. Аналогично поступаем со второй навеской.
Полученные в результате механического или
ручного шелушения пленки взвешиваем до сотых долей грамма.
Показатель пленчатости выражаем в процентах (до
сотых долей) по отношению к массе взятой навески. Для этого полученную после
взвешивания массу пленок при исходной массе 5 г умножаем на 20, при массе
навески 10 г - на 10. Расхождения между результатами двух параллельных
определений не должны превышать 1,0%. За конечный показатель принимаем среднее
арифметическое двух показаний.
.2.5 Пример расчета
(Проростки на 14 сутки сорта
Ханкайский-52 урожая 2010 года)
Расчет содержания общего и
неорганического фосфора (мг / 100г)
Получив значение оптической
плотности, по Калибровочной кривой для определения Р2О5 (рис.
1.) можно найти значения содержания концентрации фосфора в изучаемой вытяжке
(табл. 7)
Таблица 3
Определение концентрации Р2О5
10-3 мг / мл
|
№
повторности
|
Опытная
проба
|
Контрольная
проба
|
|
Оптическая
плотность Е=660нм
|
концентрации
Р2О5 10-3 мг / мл
|
Оптическая
плотность Е=660нм
|
концентрации
С Р2О5 10-3 мг / мл
|
|
1
|
0,56
|
1,12
|
0,22
|
0,25
|
|
2
|
0,60
|
1,22
|
0,25
|
0,35
|
Далее значения подставляли в
формулу:
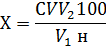
и вели расчет отдельно по
значениям контрольных и опытных проб (табл. 4 и 5)
Таблица 4
Определение содержания фосфора
в контрольных пробах мг/100г
|
№
повторности
|
концентрации
С Р2О5 10-3 мг / мл
|
V
|
V2
|
CVV2
100
|
V1
|
H
|
V1H
|
X
|
|
1
|
0,25
|
10
|
6,1
|
1,525
|
0,1
|
2,5
|
0,25
|
6,10
|
|
2
|
0,35
|
|
|
2,135
|
|
|
|
8,54
|
Таблица 5
Определение содержания фосфора
в опытных пробах мг/100г
|
№
повторности
|
концентрации
С Р2О5 10-3 мг / мл
|
V
|
V2
|
CVV2 100
|
V1
|
H
|
V1H
|
X1
|
|
1
|
1,12
|
10
|
6,1
|
6,832
|
0,1
|
2,5
|
0,25
|
27,33
|
|
2
|
1,22
|
|
|
7,442
|
|
|
|
29,77
|
Таким образом, среднее значение
Робщ.=28,55 мг/100г, а Рнеорг.=7,32 мг/100г.
Перевод значений общего и
неорганического фосфора
из мг/100г в %
На 100г приходится 28,55 мг Робщ
Х= 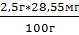 =
0,714 мг
=
0,714 мг
На 2,5г …………….. х мг Робщ
мг………….100%
У= 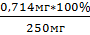 =
0,286% ≈ 0,29%
=
0,286% ≈ 0,29%
,714 мг……….У%
Определение активности
фосфорилазы (мг/100г)
Активность фосфорилазы выражали
в миллиграммах связанного фосфора под действием фермента из 100 г ткани.
Вычисляем количество связанного фосфора по разности между содержанием фосфора в
опытной (общий фосфор) и контрольной (неорганический фосфор) пробах (табл. 6)
Таблица 6
Определение количества
связанного фосфора мг/100г
|
№
повторности
|
X1
мг/100г
|
X2 мг/100г
|
X1
-
X2
мг/100г
|
|
1
|
27,33
|
6,10
|
21,23
|
|
2
|
29,77
|
8,54
|
21,23
|
Определение содержания фитина с
перерасчетами из содержания Робщ.
Количество найденного фосфора
(в Р2О5) умножали на коэффициент 1,55 и находили содержание
фитина в пересчете на инозитгексафосфорную кислоту (табл. 7).
Таблица 7
Пересчет на
инозитгексафосфорную кислоту мг/100г
|
№
повторности
|
X1 мг/100г
|
X1 *
1,55 мг/100г
|
|
1
|
27,33
|
42,36
|
|
2
|
29,77
|
46,14
|
Среднеарифметическое значение
получили 44,25 мг/100г
На 100г приходится 44,25 мг
Х= 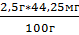 =
1,106 мг
=
1,106 мг
На 2,5г …………….. х мг Робщ
мг………….100%
У= 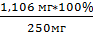 =
0,442% ≈ 0,44%
=
0,442% ≈ 0,44%
,106 мг……….У%
Глава 2. Обсуждение результатов исследования
Материалом исследования служили семена, шелуха и
проростки риса. Исследовался урожай 2008, 2009 и 2010 гг. Полученные результаты
представлены в таблицах.
Таблица 8
Количественное содержание фосфорсодержащих
веществ в семенах риса
|
Сорт
|
Робщий
(%)
|
Фитин
(%)
|
Фосфорилаза
(мг/100г ткани)
|
|
1
|
2
|
3
|
1
|
2
|
3
|
1
|
2
|
3
|
|
Дальневосточный
|
1,4
|
2,3
|
2,04
|
5,0
|
10,3
|
3,17
|
0,30
|
0,37
|
1,63
|
|
Дарий-23
|
1,3
|
2,8
|
2,14
|
3,8
|
2,8
|
3,31
|
0,27
|
0,98
|
2,16
|
|
Луговой
|
1,4
|
2,3
|
4,94
|
4,2
|
7,66
|
0,29
|
1,70
|
1,81
|
|
Приозёрный-61
|
1,4
|
3,2
|
5,34
|
3,4
|
3,2
|
8,27
|
0,31
|
1,10
|
2,04
|
|
Ханкайский-52
|
2,1
|
3,8
|
5,64
|
3,7
|
10,3
|
8,74
|
0,46
|
1,83
|
2,60
|
|
Ханкайский-429
|
1,4
|
3,8
|
4,03
|
2,2
|
3,9
|
6,24
|
0,32
|
1,22
|
1,61
|
|
Далинный
|
|
|
4,03
|
|
|
6,24
|
|
|
2,21
|
|
Рассвет
|
|
|
3,72
|
|
|
5,77
|
|
|
1,84
|
.- урожай 2008 года; 2 - урожай 2009 года; 3 -
урожай 2010 года.
Таблица 9
Количественное содержание фосфорсодержащих веществ
и фосфорилазы в проростках риса на 14 сутки
|
Сорт
|
Робщий
(%)
|
Фитин
(%)
|
Фосфорилаза
(мг/100г ткани)
|
|
1
|
2
|
3
|
1
|
2
|
3
|
1
|
2
|
3
|
|
Дальневосточный
|
0,20
|
0,64
|
0,37
|
0,31
|
3,12
|
0,57
|
2,12
|
4,39
|
1,40
|
|
Дарий-23
|
0,18
|
0,63
|
0,41
|
0,29
|
3,50
|
0,64
|
4,55
|
4,02
|
1,53
|
|
Луговой
|
0,19
|
0,85
|
0,41
|
0,30
|
3,31
|
0,64
|
1,14
|
6,41
|
2,28
|
|
Приозёрный-61
|
0,20
|
0,85
|
0,83
|
0,33
|
3,12
|
1,29
|
5,12
|
6,53
|
1,75
|
|
Ханкайский-52
|
0,21
|
0,77
|
0,29
|
0,33
|
4,16
|
0,44
|
5,29
|
5,01
|
0,27
|
|
Ханкайский-429
|
0,22
|
0,57
|
0,97
|
0,23
|
3,50
|
1,50
|
6,67
|
3,54
|
1,54
|
|
Рассвет
|
|
|
0,49
|
|
|
0,76
|
|
|
1,50
|
.- урожай 2008 года; 2 - урожай 2009 года; 3 -
урожай 2010 года.
Таблица 10
Количественное содержание фосфорсодержащих
веществ и фосфорилазы в проростках риса на 21 сутки
|
Сорт
|
Робщий
(%)
|
Фитин
(%)
|
Фосфорилаза
(мг/100г ткани)
|
|
1
|
2
|
3
|
1
|
2
|
3
|
1
|
2
|
3
|
|
Дальневосточный
|
0,13
|
1,29
|
0,18
|
0,20
|
1,8
|
0,28
|
0,61
|
1,6
|
1,53
|
|
Дарий-23
|
0,16
|
0,96
|
0,35
|
0,16
|
5,4
|
0,54
|
0,75
|
5,9
|
0,28
|
|
Луговой
|
0,14
|
1,15
|
0,27
|
0,21
|
1,8
|
0,42
|
1,02
|
0,8
|
0,53
|
|
Приозёрный-61
|
0,74
|
1,16
|
0,37
|
0,17
|
1,6
|
0,57
|
0,90
|
1,6
|
0,50
|
|
Ханкайский-52
|
0,19
|
1,29
|
0,32
|
0,29
|
1,7
|
0,50
|
1,60
|
2,1
|
0,25
|
|
Ханкайский-429
|
0,16
|
1,00
|
0,26
|
0,25
|
7,8
|
0,40
|
1,60
|
5,0
|
0,12
|
|
Рассвет
|
|
|
0,18
|
|
|
0,28
|
|
|
1,53
|
.- урожай 2008 года; 2 - урожай 2009 года; 3 -
урожай 2010 года.
Из таблицы 8 и 9 следует, что содержание общего
и неорганического фосфора в семенах урожая 2008 года больше (рис.22.), чем в
семенах урожая 2009 года в 4-7 раз [статья 1 и 2].
По погодным условиям 2008 и 2009 года резко
отличались. Прошлый год был более холодным и влажным, по сравнению с 2008,
вследствие таких погодных условий большая часть фосфора могла перейти в форму
запасающего вещества - фитина (рис.23.), содержание которого оказалась в 2-3
раза больше у урожая 2009 года.
Эксперимент был повторен с шелухой риса [2
статья], результаты представлены в таблице 14, согласно которым содержание
общего (рис.24.) и неорганического (рис.25.) фосфора в большинстве случаев
больше чем в муке и фитина (рис.26.) в том числе. Кроме того, содержание
фосфора и фитина у шелухи урожая 2009 года больше, чем у урожая 2008 года. Так
же, обнаружили, что в шелухе фосфорилаза обладает большей активностью, чем в
муке (рис.27.), возможно прорастающее растение использует энергию и питательные
вещества шелухи, как резерва.
Эксперименты были продолжены с проростками [3
статья]. Из таблицы 15 видно, что содержание фитина (рис.28.), общего (рис.29.)
и неорганического (рис.30 .) фосфора уменьшилось в проростках в 3-10 раз, на 14
сутки. Это можно объяснить резким увеличением активности фосфорилазы, которая
возросла в 2-50 раз (рис.31.), при этом у урожая 2009 года она значительно
больше, чем у урожая 2008 года.
В экспериментах с проростками, на 21 сутки,
данные немного поменялись [3 статья]. Содержание фитина (рис.32.), фосфора
общего (рис.33.) и неорганического (рис.34.), незначительное, но немного
больше, чем у 14-суточных проростков.
Активность фосфорилазы в проростках на 21 сутки
у урожая 2009 года меньше, чем у урожая этого же года на 14 сутки, при этом
больше чем у проростков урожая предыдущего года (рис.35.). Это можно объяснить
активным процессом фосфоролиза крахмала в развивающемся организме растения.
Во всех случаях наблюдалась положительная
корреляция между активностью фосфорилазы и содержанием общего фосфора
(рис.36,37, 38, 38.). На основании полученных количественных биохимических
данных, по питательной ценности, следует отметить исследуемые сорта риса
Ханкайский-52 и Ханкайский-429.
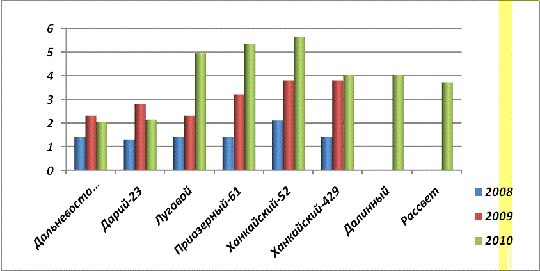
Рис. 22. Содержание общего фосфора в
семенах урожая 2008, 2009 и 2010 гг.
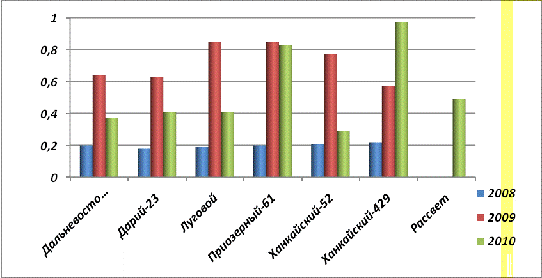
Рис. 23. Содержание общего фосфора в
проростках (14 сутки) урожая 2008, 2009 и 2010 гг.
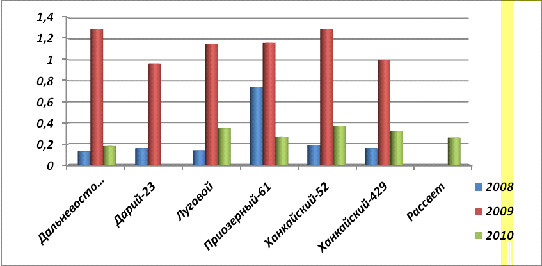
Рис. 24. Содержание общего фосфора в
проростках (21 сутки) урожая 2008, 2009 и 2010 гг.
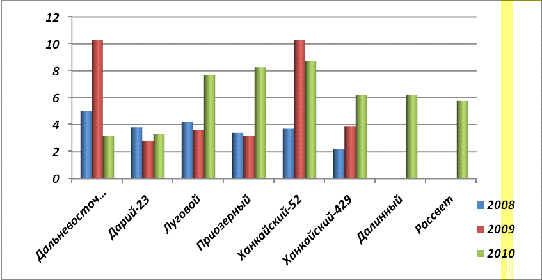
Рис. 25. Содержание фитина в семенах
урожая 2008, 2009 и 2010 гг.
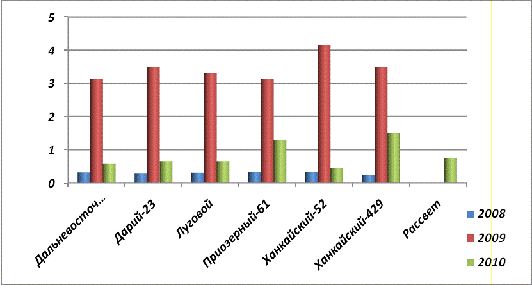
Рис. 26. Содержание фитина в
проростках (14 сутки) урожая 2008, 2009 и 2010 гг.
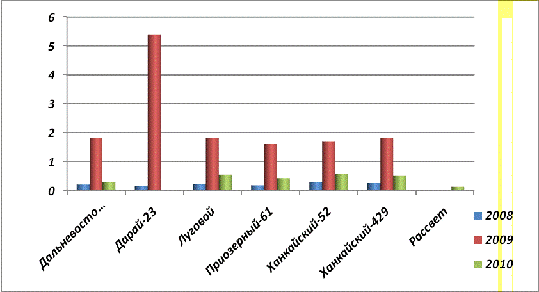
Рис. 27. Содержание фитина в
проростках (21 сутки) урожая 2008, 2009 и 2010 гг.

Рис. 28. Содержание фосфорилазы в семенах урожая
2008, 2009 и 2010 гг.
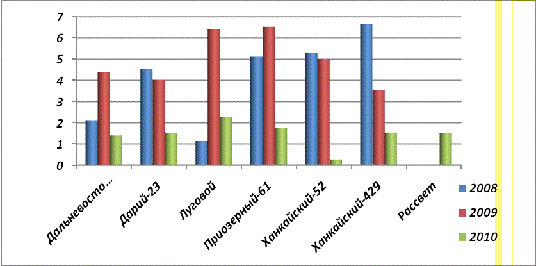
Рис. 29. Содержание фосфорилазы в
проростках (14 сутки) урожая 2008, 2009 и 2010 гг.
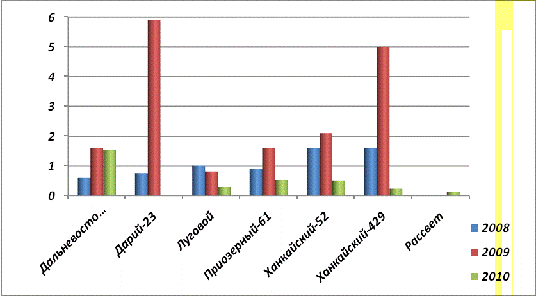
Рис. 30. Содержание фосфорилазы в
проростках (21 сутки) урожая 2008, 2009 и 2010 гг.
Заключение
Производство риса в мире неуклонно
растет, его объем только и России составляет более 500 тыс тонн в год.
Очевидно, что при таком объеме производства зерна на территории России и
образуются крупнотоннажные побочные продукты в виде рисовой шелухи и мучки
(отрубей), необходимость утилизации которых вызывается среди прочего и
природоохранными мероприятиями.
Проблемы использования шелухи в
больших предприятиях в городских районах отличаются от проблем утилизации на
мелких заводах в сельских районах. Вопросы, связанные с применением шелухи в
качестве корма животным, подробно рассмотрены. И хотя установлено, что рисовая
шелуха не имеет ценных питательных свойств, а в ряде случаев вызывает даже
падеж скота, тем не менее, она продолжает использоваться как добавка в корм
из-за своей дешевизны. Основная часть научных работ посвящена поиску путей
повышения питательных свойств шелухи. [земнуховой]
Как показали результаты нашего исследования
шелуху риса, можно использовать для получения фитина[2 статья]. Соли фитиновой
кислоты давно используются в медицине для стимуляции обмена веществ и
восстановления в организме баланса фосфора, для лечения гастрита, в виноделии
при производстве вин и коньяков, в качестве деметаллизаторов [земнуховой].
Чёткой взаимосвязи между содержанием фосфора,
фитина и активностью фосфорилазы применительно для каждого сорта не
установлено. Учитывая, значительную роль фосфора в процессах распада и синтеза
крахмала, можно сделать вывод о питательной ценности рассматриваемых зерен. На
основании полученных количественных биохимических данных, по питательной
ценности, следует отметить исследуемые сорта риса Ханкайский-52 и Ханкайский-429.