Гормоны коры надпочечников
ГОУ ВПО
«СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ХАНТЫ-МАНСИЙСКОГО АВТОНОМНОГО ОКРУГА»
Реферат
по нормальной физиологии
на
тему: «Гормоны коры надпочечников»
Сургут
2011г.
Введение
Кора надпочечников человека синтезирует более 40
различных стероидных гормонов. Биологически активные кортикостероиды объединяют
в 3 основных класса стероидных гормонов, которые обладают широким спектром
физиологических функций. Они включают глюкокортикоиды, минералокортикоиды и
адренальные андрогены. Эти гормоны образуются в различных слоях надпочечников
из холестерола, липопротеинов низкой плотности или ацетил коэнзима А, или
эфиров холестерина из внутриклеточных депо. В клубочковом слое коры
надпочечников синтезируются гормоны, участвующие в регуляции обмена натрия и
воды (альдостерон), пучковая и сетчатые зоны секретируют глюкокортикоиды и
андрогены. Спектр и количество гормонов, синтезируемых корой надпочечников и
половыми железами, различаются и зависят от активности определенных ферментных
систем стероидогенеза, например, ферменты 11β-гидроксилаза
и 21-гидроксилаза присутствуют только в надпочечниках, синтезируя стероиды,
специфичные для надпочечников. Утилизация происходит через образование в печени
водорастворимых конъюгатов с серной и глюкуроновой кислотой и экскрецию их с
мочой.
Надпочечники: морфо-функциональные
особенности коры надпочечников
Надпочечники - парные эндокринные железы,
расположенные ретроперитонеально над верхними полюсами почек на уровне Тh12 и
L1 позвонков. У взрослого человека надпочечник имеет треугольную форму размером
4x2x0,3 см. Масса одного надпочечника 4-5 г. Надпочечники состоят из двух
частей: коркового вещества - коры (на долю которой приходится около 80% массы
железы) и мозгового вещества. В коре надпочечников синтезируются стероидные
гормоны (минералокортикоиды, глюкокортикоиды и андрогены), в хромаффинной ткани
мозгового слоя - катехоламины (дофамин, норадреналин, адреналин).
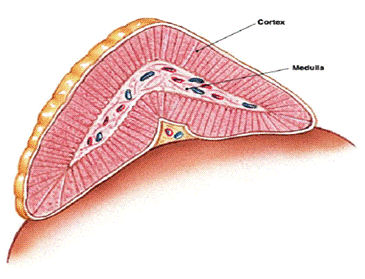
Рис. 1
Кора надпочечника формируется на 5-й неделе внутриутробного
периода из мезодермальных клеток, расположенных вблизи зачатка половых желез и
почек. Мозговое вещество является производным эктодермальных клеток нервного
гребешка. На 8-й неделе мезодермальные клетки начинают интенсивно размножаться,
и формируется 2 зоны коры: наружная - дефинитивная и эмбриональная (фетальная),
расположенная на границе с мозговым веществом. На 10-20-й неделе фетальная кора
быстро растёт, к 30-й неделе объём этой зоны увеличивается вдвое. В плодном
периоде на долю фетальной зоны приходится большая часть коры надпочечника.
Незадолго до рождения начинается дегенерация этой зоны и к концу первого года
жизни фетальная кора полностью исчезает. Фетальная кора синтезирует
преимущественно кортизол и дегидроэпиандростерон (ДГА). Последний в печени
плода преобразуется в 18"-производные, из которых в плаценте образуется
большая часть эстрогенов материнского организма (эстриол, эстрадиол и эстрон).
Объём дефинитивной коры к 30-й неделе значительно увеличивается. В течение
первого года жизни в дефинитивной коре определяются клубочковая, пучковая и
сетчатая зоны. Дифференцировка корковой части надпочечника завершается к
третьему году жизни. В дальнейшем кора продолжает увеличиваться в объёме
(особенно в период полового созревания), достигая окончательных размеров к 20
годам.
Клубочковая зона (15% толщины коры).
Представлена мелкими эпителиоидными клетками, содержащими небольшое количество
цитоплазмы. Здесь же встречаются крупные, богатые липидами, а также
вакуолизированные клетки и синцитий, образующие скопления типа клубочков. В
этой зоне синтезируются минералокортикоиды, главным образом альдостерон,
стимулятором синтеза которого являются ангиотензин II и в незначительной
степени адренокортикотропный гормон (АКТГ). Минералокортикоиды синтезируются
только в клубочковой зоне.
Пучковая зона (75% толщины коры). Тяжи
эндокринных клеток и находящиеся между ними кровеносные капилляры расположены
параллельно друг другу (в виде пучков). Это крупные кубические и полигональные
клетки; некоторые из них имеют по два ядра. Цитоплазма клеток вакуолизирована и
содержит большое количество липидов. Холестерин, которым богаты надпочечники,
содержится в основном в клетках этой зоны в большем количестве, чем в любой
другой ткани организма. Здесь синтезируются глюкокортикоиды (преимущественно
кортизол, который метаболизируется, в основном в печени и почках, в менее
активный кортизон -дегидрокортикостерон), а также андрогены. Синтез
глюкокортикоидов регулирует тропный гормон аденогипофиза - АКТГ.
Сетчатая зона (10% толщины коры). Наиболее
глубокая часть коры надпочечника, прилегающая к мозговому слою. Состоит из
переплетающихся между собой неправильной формы тяжей клеток небольшого размера,
содержащих пигмент, небольшое количество капель липидов и хорошо окрашиваемую цитоплазму.
В сетчатой зоне синтезируются андрогены (дегидроэпиандростерон и
андростендион), следовые количества эстрогенов, а также отчасти прогестерон и
глюкокортикоиды. Тропный гормон - АКТГ.
Формирование зон коркового вещества продолжается
до 11-14 лет. К этому периоду соотношение ширины клубочковой, пучковой и
сетчатой зон составляет 1:1:1. В дальнейшем (третье-пятое десятилетие) сетчатая
зона и особенно пучковая несколько расширяются, в связи с чем соотношение зон
составляет 1:2:2, а к 50 годам -1:3:2. Если масса надпочечника у взрослых
существенно не зависит от возраста, то типичное деление их на зоны характерно
для людей молодого возраста. Впоследствии пучковая зона утрачивает свойственную
ей колончатую структуру, между ней и сетчатой зоной появляются многочисленные
выросты, доходящие, с одной стороны, до капсулы, с другой - до мозгового
вещества. Инволюции сетчатой зоны с возрастом не наблюдается, клубочковая же
зона определяется в отдельных участках.
Стероидогенез в коре надпочечников
Надпочечники секретируют кортикостероиды,
являющиеся производными циклопентанопергидрофенантрена (в основе их химической
структуры лежит стероидное кольцо из 17 атомов углерода). К настоящему времени
известно около 100 соединений, но лишь немногие из них являются биологически
активными соединениями, которые разделяются на четыре группы: глюкокортикоиды,
минералокортикоиды, андрогены и эстрогены.
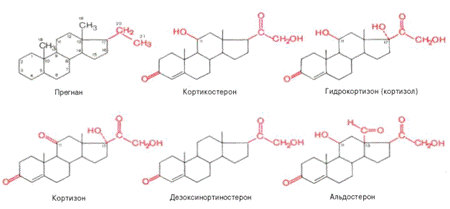
Рис. 2
Исходным продуктом синтеза кортикостероидов
является холестерин. Большая часть холестерина (80-90%) связана с жирными
кислотами и только 10% приходится на свободный холестерин, который в
надпочечниках содержится главным образом в эндоплазматических мембранах и
митохондриях, а эфиры холестерина сосредоточены в липидных каплях цитоплазмы.
Холестерин поступает в надпочечники из плазмы или синтезируется из ацетил-КоА.
Пополнение запасов холестерина находится под контролем АКТГ, под действием
которого ускоряется поступление свободного холестерина из плазмы, усиливается
внутриклеточный синтез холестерина de novo и стимулируется внутриклеточный
гидролиз эфиров холестерина в самих надпочечниках. АКТГ регулирует скорость
стероидогенеза в надпочечниках, изменяя метаболизм холестерина и его
перераспределение как внутри клетки, так и в митохондриях. Внеклеточные
липопротеиды являются важным регулятором синтеза холестерина в надпочечниках, и
при достаточном количестве внеклеточного холестерина наблюдается угнетение
внутриклеточного его синтеза.
Процессы стероидогенеза обеспечивают ферменты,
локализованные в митохондриях и гладкой эндоплазматической сети. Биосинтез
кортикостероидов начинается в митохондриях, где от поступающего холестерина под
влиянием P450SCC (20,22 десмолазы) происходит отщепление боковой цепи
холестерина и образование прегненолона, который является предшественником для
большинства кортикостероидов, секретирующихся в надпочечниках человека.
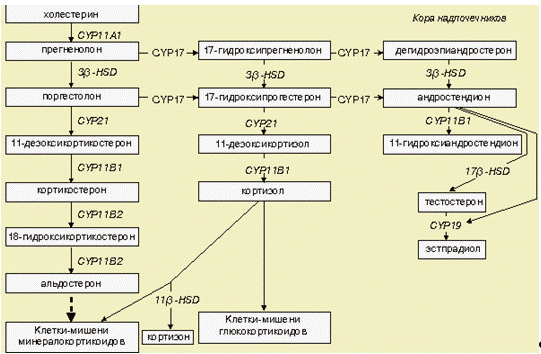
Рис. 3 - Стероидогенез в коре надпочечников
Главные продукты стероидогенеза выделены жирным
шрифтом. Первостепенные метаболические пути показаны сплошными толстыми
стрелками, второстепенные - сплошными тонкими стрелками. Действие гормонов
обозначено пунктирными стрелками. P450SCC - 20,22-десмолаза, Р450с17 - 17
3-гидро-ксилаза, 3-HSD - 11-гидроксистероиддегидрогеназа, Р450с21 -
21-гидроксилаза, Р450с11 - 11-гидроксилаза, Р450с18 - 18-гидроксилаза, Р450с19
- ароматаза, 17-HSD - 17-гидро-ксистероиддегидрогеназа
Глюкокортикоиды образуются в гладкой
эндоплазматической сети из прегненолона при участии фермента Р450с17 через
промежуточные продукты - 17 -гидроксипрегненолон и 17-гидроксипрогестерон. В
результате последующей реакции при участии Р450с21 происходит
гидро-ксилирование в 21-м положении с образованием 11-дезоксикортизола, который
в митохондриях подвергается дополнительному гидроксилированию в 11-м положении
при участии Р450с11, и в результате двух реакций гидроксилирования образуется
кортизол, который, как и дегидроэпиандростерон, представлен в пучковой и
частично в сетчатой зонах коры надпочечников. В этих зонах отсутствует фермент
P450aldo (альдос-теронсинтаза, Р450), необходимый для синтеза альдостерона.
Минералокортикоиды (альдостерон) образуются в
клетках клубочковой зоны, функции которых лишь частично находятся под контролем
АКТГ. Все три последних этапа синтеза альдостерона, а именно образование
кортикостерона из 11-дезоксикортикостерона, 18-гидроксикорти-костерона и
альдостерона, находятся под контролем фермента P450aldo.
Образование андрогенов в коре надпочечников
осуществляется в её сетчатом слое и отчасти в пучковой зоне конверсией 17
-гидроксипрегненолона в С-19 стероиды, к которым относится
дегидроэпиандростерон и дегидроэпиандростерон сульфат. Андростендион образуется
из 17-гидроксипрогестерона при участии фермента 17,20-десмолазы. Андростендион
может конвертироваться в тестостерон. У мужчин тестостерон надпочечникового
происхождения является лишь небольшой частью от общего уровня тестостерона,
циркулирующего в крови и экскретируемого с мочой.
Характер стероидогенеза определяется ферментными
системами, активность которых зависит от АКТГ. Комплексирование АКТГ с
рецептором инициирует серию последовательных реакций и активирование
цАМФ-зависимой протеинкиназы, которая в свою очередь приводит к
фосфорилированию белков рибосом, образованию и повышению активности ферментов
(холестеринэстеразы, P450SCC и др.), определяющих скорость стероидогенеза.
В тканях надпочечника под влиянием АКТГ
отмечается повышение синтеза ДНК и РНК, увеличиваются размеры клеток, объем
ядер, гипертрофируется ядрышко и пластинчатый комплекс, возрастает число
липидных клеток в цитоплазме митохондрий, увеличивается гладкая
эндоплазматическая сеть.
Гормоны коры надпочечников
Глюкокортикоиды - С21-стероиды
Самым биологически активным глюкокортикоидом,
секретируемым надпочечниками, является кортизол (на его долю приходится 80%).
Остальные 20% в порядке убывания активности составляют кортизон, кортикостерон,
11-дезоксикортизол и 11-дезоксикортикостерон. В сутки надпочечниками
секретируется 15-30 мг кортизола. Более 90 % кортизола циркулирует в крови
связанным с белками - преимущественно с - глобулином (кортикоидсвязывающим
глобулином илитранскортином) и небольшая часть связана с альбуминами,
обладающими к нему низкой аффинностью по сравнению с транскортином. Около 8%
кортизола плазмы является свободной фракцией, осуществляющей биологический
эффект.
Дефицит инсулина и эстрогены повышают содержание
транскортина, что приводит к увеличению кортизола, связанного с белками, в
результате чего увеличивается общая концентрация кортизола в плазме. Однако
уровень свободного кортизола, по-видимому, остается нормальным, а признаки и
симптомы избытка глюкокортикоидов отсутствуют.
Большинство синтетических аналогов
глюкокортикоидов связываются с транскортином менее эффективно (примерно 70%
связывания). Это может объяснить способность некоторых из них уже в низких
дозах вызывать побочные эффекты.
Заболевания печени и почек, а также длительный
приём глюкокортикоидов сопровождаются снижением содержания транскортина и
уменьшением фракции кортизола, связанного с этим белком, что приводит к
клиническим признакам избытка глюкокортикоидов.
Время циркуляции кортизола определяется
прочностью связывания с транскортином (период полураспада кортизола составляет
80-120 мин, кортикостерона - менее 60 мин).
Экскреция. Основным местом обмена кортизола
является печень, но почки, кишечник и легкие также принимают участие в обмене
кортикостероидов. В печени под влиянием ферментов 5- и 5"-редуктаз
происходит удаление кетоновой группы в кольце А и присоединение 4 атомов водорода
с превращением кортизола в тетрагидрокортизол и окисление гидроксильной группы
у С11 в кетоновую группу с превращением в тетрагидрокортизон. Эти метаболиты
образуют парные соединения с глюкуроновой и серной кислотами, а так как эфиры
этих соединений (глюкорониды) хорошо растворяются и плохо связываются с белками
крови, они экскретируются с мочой.
Свободный кортизол фильтруется в клубочках
почек, однако, 80-90% его реабсорбируется в канальцах и лишь незначительная
часть экскретируется с мочой в течение суток. Из выделенных с мочой продуктов
метаболизма кортизола тетрагидропроизводные составляют 50-60%, кортол и
кортолон - 25-35%, 17-кетостероиды - 5-8% и 1-3% составляет неизмененный
гормон.
Конъюгированные формы глюкокортикоидов
секретируются с жёлчью в ЖКТ, из них 20% теряется с калом, 80% всасывается в
кишечнике.
Функции глюкокортикоидов разнообразны - от
регуляции метаболизма до модификации иммунологического и воспалительного
ответов.
Углеводный обмен. Глюкокортикоиды повышают
концентрацию глюкозы в крови за счет увеличения скорости глюконеогенеза в
печени (влияние на синтез ключевых ферментов), снижения утилизации глюкозы на
периферии (периферический антагонизм действию инсулина), стимуляции
освобождения аминокислот (субстратов глюконеогенеза) в мышцах и тем самым
усиления неоглюкогенеза.
Белковый обмен. Глюкокортикоиды являются
катаболическими гормонами (увеличивают распад белка и тормозят его синтез).
Липидный обмен. Липолиз усиливается в области
верхних и нижних конечностей, липогенез - в других частях тела (туловище и
лицо). Эти дифференциальные эффекты придают больным (например, при синдроме
Иценко-Кушинга) характерный внешний вид.
Действие глюкокортикоидов на обмен кальция
выражается в негативном балансе из-за уменьшения всасывания кальция и усиления
его выделения, так как подавляется активность витамина D.
Иммунная система. В высоких дозах
глюкокортикоиды выступают как иммунодепрессанты (применяют для предупреждения
отторжения трансплантированных органов) за счет подавления активности
нейтрофилов и моноцитов, способности вызывать лимфопению и депрессию клеточных
иммунологических реакций.
Воспаление. Глюкокортикоиды обладают выраженным
противовоспалительным эффектом (играют большую роль в стабилизации клеточных
мембран и органелл). В значительной степени противовоспалительные и
антитоксические эффекты объясняются стабилизацией лизосомальных мембран, причем
предотвращается выделение ферментов, повреждающих клетки. Благодаря снижению
проницаемости капиллярного эндотелия улучшается микроциркуляция и уменьшается
экссудация лейкоцитов и тучных клеток. Универсальным механизмом
противовоспалительной и антидеструктивной активности глюкокортикоидов является
подавление транскрипции генов ферментов, участвующих в образовании липидных
медиаторов и влияние на метаболизм воспалительных медиаторов.
Синтез коллагена. Глюкокортикоиды при длительном
применении ингибируют синтетическую активность фибробластов и остеобластов, в
результате развиваются истончение кожи и остеопороз.
Скелетные мышцы. Длительное применение
глюкокортикоидов поддерживает катаболизм мышц, что приводит к их атрофии и
мышечной слабости.
Рецептор глюкокортикоидов (ген GCCR, 138040,
5q31-q32) - фактор транскрипции, полипептид из семейства онкогенов erb-A. По
аутосомно-доминантному типу наследуется несколько мутаций, приводящих к
развитию нечувствительности мишеней к глюкокортикоидам.
Основной регулятор синтеза глюкокортикоидов -
АКТГ, который синтезируется и накапливается в клетках передней доли гипофиза.
Секреция АКТГ и родственных пептидов контролируется кортикотропин-рилизинг-гормоном
(КРГ), секретируемым в срединном возвышении гипоталамуса. КРГ через портальный
кровоток поступает в переднюю долю гипофиза, где вызывает в свою очередь
секрецию АКТГ.
Также, к факторам, регулирующим секрецию АКТГ,
относят концентрацию свободного кортизола в плазме, стресс и цикл
сон-бодрствование. Кортизол снижает чувствительность кортикотрофов гипофиза к
КРГ и ингибирует его секрецию. Торможение секреции АКТГ, приводящее к атрофии
надпочечников при длительной терапии глюкокортикоидам, связано в основном с
подавлением секреции КРГ на уровне гипоталамуса, поскольку в этих условиях
экзогенное введение КРГ продолжает вызывать подъем уровня АКТГ в плазме.
Для синтеза и секреции кортиколиберина, АКТГ и
кортизола характерна выраженная суточная периодичность (т.н. циркадианный
ритм). Увеличение секреции кортизола наступает после засыпания и достигает
максимума при пробуждении.
Минералокортикоиды - С21 стероиды
Биологически активными минералокортикоидами в
порядке убывания активности являются алъдостерон, дезоксикортикостерон,
18-оксикортикостерон и 18-оксидезоксикортикостерон. Основная функция
минералокортикоидов - поддержание баланса электролитов жидкостей организма,
осуществляемая посредством, в первую очередь, увеличения реабсорбции ионов
натрия в почечных канальцах, что приводит к увеличению содержания воды в
организме и повышению АД. Кроме этого, минералокортикоиды увеличивают
реабсорбцию хлора и бикарбонатов, а также увеличивают экскрецию ионов калия
(приводящее к гипокалиемии) и ионов водорода.
Секретируемый надпочечниками альдостерон с
кровотоком достигает почек, где проникает в эпителиальные клетки дистальных
отделов канальцев и связывается со специфическим цитоплазматическим рецептором.
Альдостеронрецепторный комплекс затем перемещается в ядро и связывается с
рецепторами, вызывая стимуляцию мРНК и синтез соответствующего белка
(фермента), который и осуществляет повышенное выделение калия и задержку натрия
(обмен ионов натрия на калий в дистальных отделах канальцев).
Метаболизм. Альдостерон практически не
связывается с белками плазмы крови, по этой причине время его циркуляции в
крови (время полужизни) не превышает 15 мин. Альдостерон в печени
трансформируется в тетрагидроальдостерон-3-глюкоронид и в этом виде
экскретируется почками.
Секреция альдостерона в организме контролируется
следующими факторами: 1) активностью ренин-ангиотензинной системы; 2)
концентрацией ионов натрия и калия в сыворотке крови; 3) уровнем АКТГ; 4)
простагландинами и кинин-калликреиновой системой.
Таблица 1 - Факторы, регулирующие секрецию
ренина и альдостерона
|
Стимулирующие
|
Ингибирующие
|
|
переход
из горизонтального положения в вертикальное снижение внутрисосудистого
давления и объема вследствие дегидратации, кровотечения, приема диуретиков,
гипоальбуминемии стрессовые ситуации, повышение активности симпатической
нервной системы прием р-дреностимуляторов (изопреналин, адреналин)
ограничение приема натрия стимуляция секреции простагландинов, глюкагона,
брадикинина сердечная недостаточность и цирроз печени снижение кровотока в
почечной артерии
|
вазопрессин
Адреностимуляторы S-адреноблокаторы (индерал, обзидан) увеличение потребления
натрия с пищей
|
Ренин-ангиотензинная система представлена
набором компонентов, взаимодействующих в строгой последовательности. Ангиотензиноген,
образующийся в печени под влиянием ренина, местом секреции которого является
юкстагломерулярный аппарат кортикальных нефронов, конвертируется в ангиотензин
I. Последний в легких под влиянием «конвертирующих ферментов» (киназы II)
превращается в ангиотензин II (биологически активный октапептид), который
стимулирует секрецию альдостерона и вызывает сужение артериол. Таким образом,
увеличение секреции ренина является необходимым условием для усиления секреции
альдостерона.
Считается, что скорость образования ренина
зависит от: снижения давления в юкстагломерулярном аппарате почки
(барорецепторная гипотеза); состояния симпатической нервной системы
(адренергическая гипотеза); снижения концентрации натрия в области плотного
пятна-«macula densa» (гипотеза темного пятна). Факторы, регулирующие секрецию
ренина, представлены в таблице.
Ионы калия стимулируют секрецию альдостерона
непосредственно в клубочковой зоне коры надпочечника. Имеются многочисленные
данные о контроле секреции альдостерона АКТГ. Об этом свидетельствует и тот
факт, что суточный ритм секреции альдостерона (максимум высвобождения его в
утренние часы) совпадает с ритмом секреции АКТГ.
Уровень альдостерона в плазме изменяется при
трансфузии простагландинов; кроме того, ингибитор синтеза простагландинов
индометацин прерывает влияние натрия и увеличения внутрисосудистого объема на
секрецию альдостерона. Не исключено, что действие осуществляется совместно с
кининовой системой на уровне образования ренина или непосредственно
альдостерона.
Секреция альдостерона в сутки у практически
здоровых лиц при свободной диете и нормальном содержании в ней хлорида натрия
(поваренной соли) составляет от 100 до 500 нмоль/сут (30-150 мкг/сут) при
концентрации его в сыворотке крови от 15 до 400 нмоль/л (5-15 нг/100 мл).
Рецептор альдостерона (ген MCR, 264350, 4q31.1)
- внутриклеточный полипептид с молекулярной массой 107 кД, связывает
альдостерон (также кортизол, но не кортизон) и активирует транскрипцию генов.
Дефекты рецептора ведут к развитию псевдогипоальдостеронизма (задержка калия,
потеря натрия, артериальная гипертензия при нормальной или даже повышенной
секреции альдостерона).
Андрогены- С19-стероиды
В коре надпочечников синтезируются
дегидроэпиандростерон и в меньшей степени андростендион. Недостаточность
какого-либо фермента стероидогенеза (11-, 17- и 21-гидроксилазы) приводит к
повышенной секреции андрогенов и к изменениям наружных гениталий у плода,
нарушениям электролитного баланса и, в зависимости от типа ферментативного
дефекта и пола плода, к различным нарушениям полового созревания.
Патологии коркового вещества
надпочечников. Изменение метаболизма при гипо - и гиперсекреции
Гиперфункция надпочечников
Синдром Иценко-Кушинга
Чрезмерная продукция адренокортикальных гормонов
вызывает различные клинические синдромы. Однако наиболее обычной причиной
избытка глюкокортикоидов является назначение лекарственных препаратов.
Чрезмерная секреция кортизола надпочечниками (болезнь Иценко-Кушинга) обычно
обусловлена двусторонней гиперплазией надпочечников, вторичной к гиперсекреции
АКТГ передней долей гипофиза (микро - или макроаденомы) или продуцированию АКТГ
неэндокринными опухолями (мелкоклеточной карциномой легкого, медуллярной
карциномой щитовидной железы, опухолью тимуса, поджелудочной железы, яичников).
Примерно в 25 % случаев выявляют новообразования надпочечников, половина из них
имеет злокачественный характер.
Избыток глюкокортикоидов вызывает мышечную
слабость, кожные стрии, подкожные кровоизлияния и способствует гипотрофии мышц
и жировым отложениям на лице (лунообразное лицо), в межлопаточных областях
(«горб буйвола») и мезентеральном ложе (ожирение туловища). Типичны
артериальная гипертензия, сахарный диабет и эмоциональные расстройства.
Повышено содержание кортизола в плазме крови, а также концентрация в моче 17гидроксикортикостероидов.
Гипокалиемия, гипохлоремия и метаболический алкалоз чрезвычайно выражены,
особенно при эктопической продукции АКТГ.
Диагноз болезни Иценко-Кушинга требует
доказательства увеличения продукции кортизола и недостаточной супрессии секреции
кортизола с помощью дексаметазона (см. табл. 1462). Адекватным скринингтестом
является дексаметазоновая проба, которую проводят в течение ночи, или
определение содержания свободной фракции кортизола в моче. Диагноз несомненен
при недостаточности супрессии кортизола в моче менее 30 мкг в день или
кортизола плазмы крови менее 5 мг/дл, после приема 0,5 мг дексаметазона каждые
6 ч в течение 48 ч. Когда диагноз установлен, дальнейшие исследования
направлены на определение причины заболевания (см. табл. 1462). Обнаружение
низкого уровня АКТГ в плазме крови - признак аденомы или карциномы
надпочечника, а значительная концентрация АКТГ в плазме крови и (или)
недостаточность супрессии надпочечников высокой дозой дексаметазона говорит в
пользу АКТГпродуцирующей опухоли (гипофизарной или эктопической). Сканирующая
КТ черепа применяется для дифференциации гипофизарного источника АКТГ от
эктопического.
Хирургическое лечение опухоли надпочечников
требует иссечения опухоли и глюкокортикоидной терапии в послеоперационном периоде.
Транссфеноидальная хирургия эффективна при гиперсекреции гипофиза (см. гл.
146). При метастатической адренокортикальной карциноме применяют митотан в
дозах, постепенно повышающихся до 810 г/сут в 34 приема. Уменьшение массы
карциномы легкого может вызвать ремиссию эктопической болезни Кушинга.
Опухоли надпочечников обычно обнаруживают с
помощью абдоминальной КТ или МРТ. Первым шагом в изучении таких опухолей
является определение функционального статуса. Около 90 % - это
нефункционирующие образования. Карциномы составляют менее 1 % от всех
доброкачественных аденом надпочечников. При нефункционирующих аденомах
диаметром от 3 см и во всех случаях функционирующих аденом показано оперативное
лечение. Если от хирургического вмешательства воздерживаются, сканирование
повторяют каждые 36 мес.
Гиперальдостеронизм
Обусловлен гиперсекрецией надпочечниками
минералокортикоида альдостерона. Первичный альдостеронизм отражает поражение
надпочечников, а происхождение вторичного с ними не связано. У большинства
больных первичным гиперальдостеронизмом выявляют головные боли и мягкую
диастолическую гипертензию. Характерны значительная гипокалиемия и
гипернатриемия, обусловленная как задержкой Na, так и потерей воды изза
полиурии (нарушение концентрации мочи). Метаболический алкалоз и повышение
НСО3~ в сыворотке крови вызваны прониканием ионов водорода внутрь клеток и
выделением его с мочой. На ЭКГ - признаки недостаточности К в тканях (зубцы U,
аритмии, экстрасистолия). Критерии диагноза: 1) диастолическая гипертензия с необъяснимой
гипокалиемией; 2) гипосекреция ренина (о ней судят по низкой активности ренина
в плазме крови), которая не повышается адекватно при снижении ОЦК (ортостаз,
гипонатриемия) и 3) гиперсекреция альдостерона, не снижающаяся при повышении
ОЦК (солевая нагрузка). Абдоминальная компьютерная томография и (или) МРТ, а
также чрескожная трансфеморальная двусторонняя катетеризация надпочечниковых
вены, с одновременной флебографией надпочечников, могут способствовать
выявлению аденомы. У больных с аденомой надпочечника эффективен оперативный
метод лечения. Ограничение натрия и спиронолактон (25-100 мг/сут) назначают
больным с двусторонней гиперплазией надпочечников. Вторичный
Гиперальдостеронизм вызван повышением активности ренина плазмы (АРП) (табл.
1491).
Реже у больных с гипокалиемическим алкалозом и
артериальной гипертензией обнаруживают дезоксикортикостерон - секретирующие
аденомы. У таких больных АРП снижена и нормально или снижено содержание
альдостерона.
Синдромы избытка андрогенов надпочечников
Синдромы, характеризующиеся избытком андрогенов,
источником которых является сетчатая зона коры надпочечника, обусловлены
гиперпродукцией дегидроэпиандростерона (ДЭА) и андростендиона. Клинические
проявления у женщин включают гирсутизм, олигоменорею, акне и вирилизацию. Эти
синдромы могут явиться результатами гиперплазии, аденомы или карциномы.
Врожденная гиперплазия надпочечников обусловлена
различными ферментными дефектами метаболизма стероидных гормонов, передается по
аутосомнорецессивному типу как наследственная особенность. Чаще встречается
дефицит С21 гидроксилазы, ведущий к вирилизации детей женского пола и
недостаточности кортизола, с наличием или отсутствием тенденции к потере соли.
Результатом дефицита других ферментов могут быть различные фенотипические проявления.
Гипофункция надпочечников
Болезнь Аддисона
Развивается, когда > 90 % ткани надпочечников
разрушено хирургическим путем, туберкулезным процессом, гистоплазмозом,
кокцидиоидомикозом, криптококкозом или аутоиммунными механизмами. Двусторонние
метастазы опухолей, амилоидоз и саркоидоз относятся к редким причинам.
Клинические проявления включают утомляемость,
слабость, анорексию, тошноту и рвоту, пигментацию кожи и слизистых оболочек,
артериальную гипотензию и, периодически, гипогликемию. Рутинные лабораторные
показатели могут быть нормальны или характеризуются снижением содержания Na, C1
и НСО3~ в сыворотке крови при повышении содержания К. Истощение объема
внеклеточной жидкости усиливает артериальную гипотензию.
Диагностика требует определения способности
надпочечников продуцировать стероиды. Быстрым скринингтестом является
внутривенное введение 25 ЕД АКТГ (кортикотропина) с определением уровня
кортизола в плазме крови в базальных условиях и через 30 мин, и 60 мин после
введения препарата. Прирост менее 70 мкг/л от исходного говорит в пользу
недостаточности надпочечников. Для дифференциальной диагностики первичной и
вторичной недостаточности надпочечников вводят кортикотропин со скоростью 2
ЕД/ч в течение 24 ч. У здоровых экскреция 17гидроксистероидов повышается до 25
мг, а уровень кортизола в плазме крови растет и составляет более 400 мкг/л. При
вторичной недостаточности максимальное повышение уровня 17гидроксистероидов в
моче составляет 320 мг в день, а концентрация кортизола в плазме крови варьирует
в пределах 100400 мкг/л. При первичном заболевании наблюдают менее значительные
реакции.
Лечение - гидрокортизон, в период стресса
исходная дозировка - 100-200 мг/сут, при длительной заместительной терапии
постепенно снижается до 1537,5 мг/сут. С этой же целью применяют флюдрокортизон
(0,1 мг/сут). В неотложных случаях используют болюс гидрокортизона (100 мг
внутривенно) с последующим продолжением инфузии по 10 мг/ч.
Гипоальдостеронизм
Изолированная недостаточность альдостерона,
сочетающаяся с нормальной продукцией кортизола, которая появляется с
гипоренинизмом, как наследственный дефект биосинтеза, в послеоперационный
период, после удаления альдостеронсекретирующих аденом, при длительном
применении гепарина или гепариноидов, при претектальном заболевании нервной
системы и тяжелой постуральной гипотензии. У большинства больных имеется
необъяснимая гиперкалиемия, часто обостряющаяся в результате ограничения соли.
Гипоренинный Гипоальдостеронизм чаще встречают у
взрослых с легкой почечной недостаточностью и сахарным диабетом в сочетании с
гиперкалиемией и метаболическим ацидозом. Ежедневный прием флюдрокортизона
(0,10,2 мг) восстанавливает электролитный баланс при адекватном потреблении
соли. Некоторые больные нуждаются в более высоких дозах для коррекции гиперкалиемии.
Клиническое применение глюкокортикоидов
Глюкокортикоиды - фармакологические препараты,
применяемые при различных заболеваниях. Заместительная терапия показана больным
с болезнью Аддисона (гидрокортизон 1537,5 мг/сут). Стероиды применяют также при
ревматологических (РА, СКВ, васкулиты, височный артериит), гематологических
(гемолитическая анемия, лейкозы), неврологических (отек мозга) и пульмональных
заболеваниях (саркоидоз, ХОЗЛ) и эндокринной патологии (гиперкальциемия). Даже
столь небольшое количество, как 10 мг преднизона в день в течение 3 нед, может
вызвать супрессию надпочечников длительностью до 1 года. Стресс усиливает
надпочечниковый криз у таких больных, даже спустя месяцы после применения
глюкокортикоидов, такие больные должны иметь при себе соответствующую
информацию для экстремальных случаев. «Стрессовые дозы» глюкокортикоидов
эквивалентны 80160 мг гидрокортизона в день. Длительная терапия
глюкокортикоидами в фармакологических дозах ведет к увеличению массы тела,
артериальной гипертензии, «кушингоидному» изменению лица, сахарному диабету,
остеопорозу, миопатии, повышению внутриглазного давления, ишемическому некрозу
костей, инфекции, гиперхолестеринемии, гиперлипопротеидемии IV типа и другим
эффектам. Дозы наиболее распространенных глюкокортикоидов представлены в табл.
1494.
надпочечник кора гормон метаболизм
Таблица 2 - Препараты глюкокортикоидов
|
Название
|
Относительная
активность
|
|
|
Глюкокортикоидная
|
Минералокортикоидная
|
Эквивалентная
доза
|
|
Препараты
короткого действия
|
|
|
|
|
Гидрокортизон
(кортизол)
|
1,0
|
1,0
|
20,0
|
|
Кортизон
|
0,8
|
0,8
|
25,0
|
|
Препараты
средней продолжительности действия
|
|
|
|
|
Преднизон
|
4,0
|
0,8
|
5,0
|
|
Метилпреднизолон
|
5,0
|
0,5
|
4,0
|
|
Триамсинолон
|
5,0
|
0
|
4,0
|
|
Препараты
длительного действия
|
|
|
|
|
Дексаметазон
|
25,0
|
0
|
0,75
|
|
Бетаметазон
|
25,0
|
0
|
0,6
|
Регуляция секреции:
Глюкокортикоиды
Активирующие (нисходящие) влияния.
Непосредственный активатор синтеза и секреции кортизола - АКТГ. АКТГ выделяется
клетками передней доли гипофиза под действием кортиколиберина, поступающего в
кровь гипоталамо-гипофизарной воротной системы из гипоталамуса. Стрессовые
стимулы активируют всю нисходящую систему влияний, вызывая быстрое выделение
кортизола. Кортизол оказывает различные метаболические эффекты, направленные на
устранение повреждающей природы стресса.
Восходящее (тормозное) влияние по принципу
отрицательной обратной связи оказывает кортизол, подавляющий секрецию АКТГ в
передней доле гипофиза и кортиколиберина в гипоталамусе. В результате
уменьшается концентрация кортизола в плазме в то время, когда организм не
подвергается воздействию стресса.
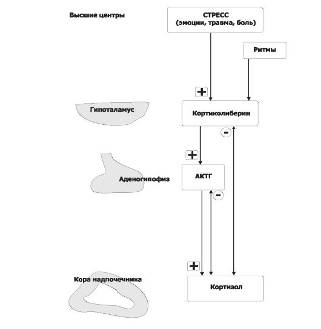
Рис. 4
Регуляторные контуры в системе
«гонадолиберин-АКТГ-кор - тизол». Символами «+» и «-» обозначены стимулирующие
и тормозящие влияния.
Ангиотензин II - компонент ренин-ангиотензиновой
системы - главный регулятор синтеза и секреции альдостерона. Этот пептид
стимулирует выброс альдостерона.
Сердечный натрийуретический фактор (атриопептин)
ингибирует синтез альдостерона.+. Эффекты гипо- и гипернатриемии реализуются через
ренин-ангиотензиновую систему.
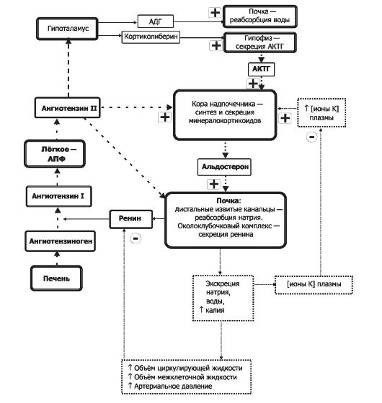
Рис. 5
Поддержание баланса в жидкостях организма.
Символами «+» и «-» обозначены стимулирующие и тормозящие влияния. АПФ -
ангиотензинпревращающий фермент.
К+. Эффекты ионов калия не зависят от содержания
в крови Na+ и ангиотензина II.
♦ Гиперкалиемия стимулирует секрецию
альдостерона.
♦ Гипокалиемия тормозит секрецию
альдостерона. Φ Простагландины.
♦ E1 и E2 стимулируют синтез альдостерона.
♦ F1a и F2a тормозят секрецию минералокортикоидов.
Травмы и стрессовые состояния увеличивают
секрецию альдостерона за счёт активирующего влияния АКТГ на кору надпочечников.
Заключение
Надпочечники являются для нас незаменимым
органом и выделяемые ими гормоны (особенно гормоны коры) жизненно необходимы
организму. Что происходит, когда надпочечники болеют? Заболевания надпочечников
- тяжелая эндокринная патология, при которой нарушается гормональный фон и
обмен веществ в организме. Негативное влияние на работу надпочечников оказывают
аутоиммунные процессы, инфекционные заболевания, черепно-мозговые травмы.
Надо сказать, что болеют они крайне редко -
важнейший для жизни орган хорошо защищен. Но этим не стоит пренебрегать, от
влияния очень многих вредных факторов мы можем сознательно избавить надпочечники.
Проводя регулярные профилактические процедуры: посещение врача, своевременный
анализ крови, избавление от вредных зависимостей - курение и алкоголя.
Литература
1. Биохимия:
учебник для вузов/ под ред. Е.С. Северина - 5-е изд., - М.: ГЭОТАР-Медиа, 2009.
- 768 с.
2. Нормальная
физиология: учебник / Орлов Р.С., Ноздрачев А.Д. - 2-е изд., исправл. и доп. -
М.: ГЭОТАР-Медиа, 2010. - 832 с.
. Пособие
по клинической биохимии / под ред. Л.В. Акуленко. - М.: ГЭОТАР-Медиа, 2007. -
256 с.
. http://www.voed.ru
. http://laboratory.rusmedserv.com/files/15_Gormony_Nadpochechnicov.pdf
. http://max.1gb.ru/endocrin/