Точность визуального тестового анализа в зависимости от способа построения цветовой шкалы
Точность
визуального тестового анализа в зависимости от способа построения цветовой
шкалы
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
. ЛИТЕРАТУРНЫЙ ОБЗОР
.1 Тестовый метод анализа
.1.1 Общая характеристика
.1.2 Области применения тест методов
1.1.3 Реагенты, носители и условия
выполнения тест-реакций
1.1.4 Метрологические характеристики
визуальных тест-методов и приемы их оценки
.2 Методы исследования процессов в
прозрачных и непрозрачных середах
.2.1 Спектрофотометрия
.2.2 Спектроскопия диффузного
отражения
.2.3 Твердофазная спектрофотометрия
(ТСФ)
.2.4 Цветометрия
.2.5 Использование компьютерных
программ и сканер-технологий
.3 Способы построения цветовых шкал
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Реактивы и оборудование
.2 Методики эксперимента
.2.1 Методики приготовления и
стандартизации растворов
.2.2 Методика подготовки
пенополиуретана для определения Fe3+, Co2+
.2.3 Методика подготовки
пенополиуретана для определения NO2-
.2.4 Методика модифицирования
желатиновых пленок
.2.5 Методика очистки растворов,
используемых в тест - определении железа на ППУ, от примесей железа (III)
.2.6 Методика выявления интервала
ненадежности
.2.7 Методика оценки предела
определения
.2.8 Методика тест-определения Fe3+
в виде тиоцианатных комплексов, сорбированных на ППУ
.2.9 Методика тест-определения Co2+
на ППУ
.2.10 Методика тест - определения
нитрит - ионов на ППУ
.2.11 Методика тест - определения
кобальта (II) в желатиновой пленке
.2.12 Методика измерения диффузного
отражения ППУ
.2.13 Методика оценки точности
визуального тест - определения для разных шкал
.2.14 Методика фотометрирования
желатиновых пленок
.2.15 Методика расчета координат
цвета
.3 Результаты и их обсуждения
.3.1 Результаты стандартизации
растворов
.3.2 Результаты выявления интервалов
ненадежности (ИН)
.3.3 Результаты оценки пределов
определения аналитов с использованием цветовой шкалы
.3.4 Результаты исследования влияния
на точность визуального тестирования аналитов способа построения цветовой шкалы
.4 Техника безопасности
ВЫВОДЫ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
В настоящее время большое внимание уделяется
тест-методам анализа как простым, дешевым и экспрессным методам оценки
содержания компонентов. Анализ с помощью тест-систем позволяет резко сократить
объем и время работы, привлечь неквалифицированный персонал, обходиться без
дорогостоящего оборудования.
В основе большинства тестовых определений лежат
химические реакции, протекающие в растворе или на сорбенте. При этом
появляющуюся окраску сравнивают со стандартной шкалой. В качестве сорбентов
используют бумагу, полимерные материалы, волокна, ксерогели, кремнеземы, пленки
и др.
Основные направления развития тест-методов
анализа заключаются в совершенствовании методологии определения, синтезе новых
и модернизации уже зарекомендовавших себя реагентов, расширении круга носителей
и их возможностей, варьирования природы и степени наполнения носителя.
Данная работа посвящена оценке визуального
тестового анализа в зависимости от способа построения цветовой шкалы для
определения разных ионов.
1.
ЛИТЕРАТУРНЫЙ ОБЗОР
.1 Тестовый
метод анализа
.1.1Общая характеристика
Одной из важнейших тенденций
современной аналитической химии является перемещения химического анализа из
лаборатории к месту, где находится объект анализа [1,2]. Тест-системы являются
массовыми и относительно дешевыми средствами для анализа "на месте"
[3].
Тест-системы для химического анализа
представляют собой простые, портативные, легкие и дешевые аналитические
средства и соответствующие экспрессные методики для обнаружения и определение
веществ без существенной подготовки пробы, без использования сложного
лабораторного оборудования, без сложной обработки результатов и подготовленного
персонала [3].
Основная цель использования
тест-методов - быстрая оценка наличия и полуколичественное определение
содержания компонентов, которые контролируются, проведение предварительного
скрининга проб при массовом анализе. Общий принцип большинства химических
тест-методов - это использование известных аналитических реакций и реагентов в
условиях и форме, которые обеспечивают визуальный эффект, который легко
измерить. Чаще всего это - интенсивность окраски носителя (бумаги, ксерогеля,
силикагеля), длина окрашенного участка на бумаге или в трубке.
Реакции, которые используются в
тест-методах, должны удовлетворять следующим требованиям [3]:
Ø селективность по
отношению к компоненту, который определяют;
Ø высокая
чувствительность;
Ø при использовании
цветных реакций - высокая контрастность и скорость окрашивания в присутствии
компонент, который обнаруживают или определяют;
Ø возможность
перевести реагенты в формы, которые можно использовать в тест-методах;
Ø устойчивость
реагентов при хранении именно в той форме, в которой они используются в
анализе;
Ø достаточная
устойчивость аналитического эффекта втечение времени.
В тест-методах используются химические
и биохимические реакции. В экологическом мониторинге окружающей среды большое
значение приобретают методы биологического тестирования. В основу применения
тест-методов положена методология скрининга (просеивания), используемая для
анализа большого числа образцов с помощью тщательно отработанных методов
качественного и полуколичественного анализа. Эта методология допускает
неправильные положительные результаты на присутствие анализируемого компонента.
В то же время она полностью исключает неправильные отрицательные результаты. По
этой причине все пробы, давшие положительную реакцию (например, на присутствие
пестицида в овощах), далее изучают с помощью более информативного метода
(хроматография). В свою очередь, все отрицательные результаты скрининга обычно
принимают как окончательные без какой либо дополнительной проверки. Таким
образом удается значительно сократить как объем, так и стоимость анализа. В то
же время к тест-методам в соответствии с этой методологией предъявляются
высокие требования по специфичности наблюдаемого при его применении отклика на
присутствие определенных компонентов в анализируемых образцах
[4].
1.1.2
Области
применения тест методов
На протяжении столетии химический
анализ осуществляется лабораториях. Это было связано с необходимостью
использовать специальную химическую посуду, специальное оборудование, а затем и
измерительные приборы. Это было связано с применением не всегда безвредных
химических веществ, что требовало как минимум хорошей вентиляции. Это
определялось длительностью, сложностью и трудоемкостью операций разделения
сложных смесей веществ. В значительной мере эти факторы действуют и в настоящее
время, поэтому сотни тысяч, миллионы химических анализов проводяться в условиях
лабораторий. И в этих лабораториях обычно много сложных и дорогостоящих
приборов
[3].
В последнее время положение
меняется: химический анализ постепенно перемещается из лабораторий к тем
местам, где находится анализируемый объект. Это одна из важнейших тенденций
аналитической химии.
Дело в том, что существуют огромные,
острые потребности во внелабораторном анализе. В некоторых областях такой
анализ уже широко применяется, для некоторых совершенно необходим, а в других
только начинается в той или иной мере [3]
:
Ø экспресс-контроль
технологических процессов
Ø обнаружение метана
в угольных шахтах
Ø обнаружение утечек
природного газа из газопроводов
Ø определение
монооксида углерода и углеводородов в автомобильных выхлопах
Ø экспресс-анализ в
поле для геологов-поисковиков
Ø быстрый анализ почв
(рН, азот, фосфор, калий)
Ø контроль пищевых
продуктов на рынках
Ø обнаружение
алкоголя в выдыхаемом воздухе водителей
Ø домашнее
определение сахара в крови и моче диабетиков и другие быстрые анализы
клинического назначения
Ø оперативный анализ
воды, в том числе питьевой, непосредственно потребителем
Ø анализ воздуха в
рабочей зоне и на улицах
Ø контроль содержания
озона в стратосфере
Ø космические
исследования (Луна, планеты)
Ø обнаружение
наркотиков в аэропортах, при обысках
Ø обнаружение боевых
отравляющих веществ
Ø обнаружение жидких
ракетных топлив в почве в местах падения первых ступеней ракет и местах аварий
Ø обнаружение
взрывчатых веществ
Анализ "на месте" имеет
много достоинств. Экономится время и средства на доставку проб в лабораторию и
на сам лабораторный анализ [3].
1.1.3 Реагенты, носители и условия
выполнения тест-реакций
Общий принцип большинства химических
тест-реакций - это использование известных аналитических реакций и реагентов в
условиях и в форме, которые обеспечивают визуальный и легко измеряемый эффект,
чаще всего тон или интенсивность окраски носителя (бумаги, ксерогеля,
силикагеля, волокна) или длины окрашенной зоны на бумаге или в трубке. В
тест-методах используют реагенты разной природы (органические и неорганические)
и разного механизма действия: кислотно-основные индикаторы, комплексообразующие
агенты, органические соединения с функциональными группами разной природы.
Реагенты закрепляют на твёрдых носителях или используют в виде заранее
приготовленных растворов. Водные или органические растворы реагентов используют
довольно редко, так как работать с ними в полевых условиях сложно; чаще
реагенты используют в сухом состоянии в виде порошков, смесей, таблеток,
горошин, гранул с инертным наполнителем (сахароза, крахмал) и наполнителями, создающими
определённую среду после растворения (фосфаты, карбонаты, цитраты) [3].
Синтезируют и новые, более
чувствительные и селективные реагенты, а также модифицируют уже известные. В
качестве модификаторов известных органических реагентов в тест-методах
используют поверхностно-активные вещества (ПАВ), чаще всего катионного типа.
Образующиеся при этом ионные ассоциаты являются более чувствительными и в
некоторых случаях более селективными реагентами [5].
В случае твёрдых носителей реагенты
иммобилизируют или за счёт адсорбции, испарения и других нехимических методов,
или в результате ковалентного (химического) закрепления.
) Физическая иммобилизация -
относительно слабая фиксация адсорбционно закреплённых водорастворимых
реагентов на поверхности носителя и, как следствие этого, частичное вымывание
их при контакте с раствором. Это является основным недостатком такого способа
иммобилизации. Малорастворимые в воде реагенты в этом случае более выгодны, так
как образуют более стабильные при хранении тест-формы; эти реагенты мало
вымываются из тест-матрицы при контакте с исследуемым раствором [6].
При физической иммобилизации твёрдый
носитель замачивают в растворе реагента и затем высушивают. Процесс может бать
одностадийным или многостадийным. Многостадийность может быть связана с
необходимостью создания защитного слоя, иммобилизации другого реагента и с
целью синтеза на носителе аналитического хромогенного реагента.
Физическая иммобилизация находит широкое применение в аналитической практике.
Примером физической иммобилизации может также быть сорбция комплекса,
образовавшегося в растворе, на твердую матрицу. Например определение железа и
кобальта в виде тиоцианатных комплексов на пенополиуретане. В основе метода
лежат реакции комплексообразования:
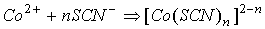
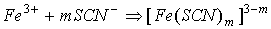
Возможно протекание реакции и в
матрице сорбента, например в желатиновой пленке. Например, опредление кобальта
в виде комплексов с нитрозо-Р-солью (1-нитрозо-2-нафтол-3,6-дисульфокислотой) в
желатиновой матрице. Структурная формула НРС имеет вид:
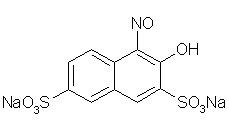
Химизм комплексообразования в случае кобальта
сводится к взаимодействию кобальта (II) и последующем его окисления в комплексе
до кобальта (III). В результате изменяется стехиометрии комплекса и константа
устойчивости. Кобальт (II) образует комплексы стехиометрии 1:3 и 1:2, а кобальт
(III) образует один комплекс стехиометрии 1:3. В высокой устойчивости комплекса
кобальта (III) убеждает его кинетическая инертность и после образования
устойчивость даже в сильно кислых средах часто используют на практике.
2) Химическая иммобилизация -
ковалентное связывание реагента с носителем. В качестве носителя используют
бумагу, силикагель, полимерные органические сорбенты. Ковалентное закрепление,
в отличие от адсорбционного, даёт возможность многоразового использования,
например, бумаг после разрушения образованного при определении комплекса путём
промывания водой или кислотой. Также возможно не только связывание реагента с
сорбентом, но и взаимодействие определяемого иона с носителем. Например,
определение нитрит-иона на с помощью пенополиуретана : нитрит
ион взаимодействует с концевой толуидиновой группой ППУ и в результате реакции
азосочетания образуется лимонно-желтая окраска.

где:  - полимерная цепь ППУ
- полимерная цепь ППУ
Основным преимуществом
модифицированных сорбентов, образованных с помощью иммобилизации реагентов,
является их химическая и механическая стойкость, а недостатком - сложность
процессов модификации и регенерации таких систем.
Кроме собственно аналитических
реагентов в тест-средства вводят и другие вещества - восстановители и
окислители, маскирующие агенты, смачивающие вещества, закрепители [3].
Целлюлоза - дешёвый природный
материал для поглощающих бумажных носителей. Присутствие в них активных групп
глюкопиранозидных колец вместе с пористостью структуры обусловливает широкие
возможности как сорбции на целлюлозу аналитических реагентов, так и химической
модификации целлюлозы с получением твёрдой матрицы на её основе с
разнообразными функциональными группами. Ковалентное закрепление индикатора или
реагента происходит по такому механизму [6]:
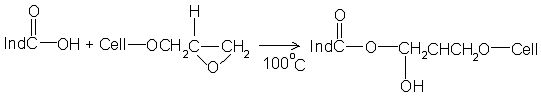
Пенополиуретаны (ППУ)
характеризуются мембранной ячеистой структурой полимерной матрицы, которая
содержит полимерные группы: уретановую, амидную, сложную эфирную, простую
эфирную, концевую толуидиновую (рис. ).
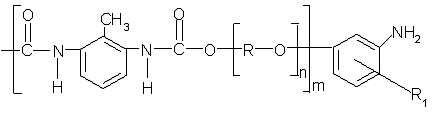
Рис.1.1
Фрагмент молекулы ППУ, где - [R-O]n - эфирная связь, R1= 2-CH3,
6-CH3
В синтезе ППУ в качестве исходных
продуктов используют многоатомные спирты (с молекулярной массой 400 - 6000) и
смеси 2,4- и 2,6-изомеров толуолдиизоцианата, при этом образуется ППУ на основе
простых и сложных эфиров.
Сорбционное концентрирование
позволяет значительно снизить предел определения без использования каких-либо
приборов. Обычно используют физический способ иммобилизации реагента на ППУ,
так как химическое закрепление, которое происходит при синтезе ППУ, - процесс
трудоёмкий.
Аналитические реагенты, закреплённые
на кремнезёмах и силикагелях, удобны для использования в тестовом анализе.
Тест-средства сохраняют химическую индивидуальность модификатора, имеют
механическую и химическую стойкость, высокую скорость массообмена. При
подготовке тест-средств на основе кремнезёмов наиболее часто используют
адсорбционное закрепление органических реагентов, которое зависит от структуры
кремнезёма, пористости и удельной поверхности сорбента.
Ещё один носитель, который можно
использовать в тест-системах, - это желатиновые плёнки [8]. Желатин получают
обработкой коллагена (природный фибриллярный белок) водной суспензией
гидроксида кальция (так называемый щелочной желатин) или разбавленной серной
кислотой (кислотный желатин). По химической природе желатин представляет собой
полидисперсную смесь низкомолекулярных полипептидов (М = 50000 - 70000) или их
агрегатов (М = 200000 - 300000) [9].
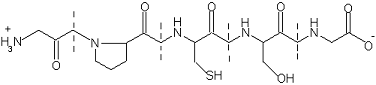
Рис 1.2 Фрагмент желатина
Желатин - типичный амфолит.
Изоэлектрическая точка щелочного желатина находится в интервале рН 4.8 - 5.1, а
кислотного желатина - рН 7.0 - 9.5 [9]. Желатин при любых значениях рН
фактически является смесью структур, отличающихся зарядом, поэтому измеренная
значение рН в изоэлектрической точке является усреднённым по значению этого
показателя, которые отличаются до нескольких единиц рН. Известно, что
желатиновые слои по своей эластичности подобны резине, что свойственно
спиралями, образованным длинными цепочечными молекулами, соединёнными между
собой ограниченным количеством поперечных связей. На основе полимерного массива
с подобной структурой можно получить матричные системы с достаточно однородным
распределением иммобилизированного вещества, причём его молекулы остаются
стерически досягаемыми. Этим создаются благоприятные условия для протекания
различных химических процессов с участием иммобилизированного реагента [10].
Желатин как микропористое вещество имеет достаточно разветвлённую поверхность,
благодаря чему при контакте с водным раствором в его массив проникает как
растворитель, так и растворённые химические реагенты. Вода, проникая в
желатиновый массив, вызывает его изотропное набухание.
Наиболее часто желатин используют в
виде тонких плёнок. Так авторы работы [10] используют фотографические плёнки
для офсетной печати фирмы AGFA для разработки новых тест-систем и исследования
влияния желатинового геля на протолитические и комплексообразующие свойства иммобилизированных
аналитических реагентов. Исходные плёнки были бесцветными и прозрачными. Из них
предварительно были удалены галогениды серебра. В работе предложено
использовать плёнки с иммобилизированным 4-(2-пиридилазо)-резорцином для
визуального обнаружения и полуколичественного определения суммы шести ионов
металлов (Cu2+, Co2+, Cd2+, Zn2+,
Ni2+, Pb2+) в водных средах.
Для поддержания определённой среды
для оптимальных условий проведения тест-реакций с конкретными элементами разные
авторы предлагают или добавлять буферные растворы на стадии подготовки
тест-систем, или другие растворы, которые добавляют в исследуемый раствор.
Обычно используют растворы HCl, NaOH, HNO3, KHSO4,
лимонную кислоту, Na2B4O7,
Na2CO3,
KH2PO4
и др.
Химия тест-методов базируется, главным
образом, на цветных реакциях комплексообразования или на
окислительно-восстановительных реакциях. Особое внимание уделяют подбору и
рациональной комбинации реагентов, стабилизации смесей реагентов и растворов,
уменьшению негативных влияний благодаря добавлению маскирующих агентов [3].
.1.4 Метрологические характеристики
визуальных тест-методов и приемы их оценки
.1.4.1 Селективность
Обычно в тест-методах, которые
предлагают для обнаружения и определение того или иного компонента, используют
селективные реагенты и создают условия селективного определения. Как правило,
при физической иммобилизации на твердых матрицах селективность реагентов не
изменяется, а при химической иммобилизации улучшается [1]. В случае применения
в тест-методах малоселективних реакций используют способы маскировки и
отделения элементов, которые мешают определению. Так, чаще всего в качестве
маскуючих реагентов для металлов используют трилон Б, тиомочевину, цитраты,
тартраты, полиамины, фториды, пирофосфаты, роданиды, цианиды и другие [15].
.1.4.2 Максимальная погрешность
тест-определений с использованием цветовой шкалы
Погрешность при визуальных оценках,
не смотря на субъективный фактор, не больше чем погрешность инструментального
определения с помощью минифотометра. Метод колориметрии дает возможность
создать равноконтрастную колориметрическую шкалу, которую хорошо различает глаз
человека. Ряд стандартов обычно готовят в геометрической прогрессии с шагом 2
или 3. Если неизвестная концентрация компонента в пробе сх находится
между n и n+1 членами ряда стандартов, тогда, согласно правилам использования
цветовой шкалы сх = (сn + сn+1)/2, а Δс
= (сn+1 - сn)/2. В этом случае максимальная относительная
погрешность может быть оценена с помощью формулы:
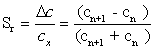 (1.1)
(1.1)
Если в ряде геометрической
прогрессии сn+1 = 2сn, тогда максимальная относительная
погрешность представляет приблизительно ± 33 %, если сn+1 = 3сn
- она составит ± 50 % (без учета вклада в погрешность других факторов).
Относительная погрешность достигнет значения ± 100 % при сn = 0 и сn+1
= с1.
1.1.4.3 Интервал ненадежности
(Область ненадежной реакции)
При постепенном понижении
концентрации компонента неизбежно достигается область, в пределах которой
аналит может дать как положительную, так и отрицательную реакцию. Этот диапазон
концентраций Комарь назвал областью ненадежной реакции, в настоящее время чаще
используют термин интервал ненадежности. Длина этого интервала характеризует
аналитические возможности метода [12]. Ниже интервала ненадежности лежат
концентрации, достоверность реакции для которых близкая к 0, выше -
концентрации, которые определяют с вероятностью, близкой к 1.
Для сравнения тест-систем удобно
пользоваться не абсолютной величиной интервала ненадежности, а относительной
[13]. За относительную ширину интервала ненадежности принимают отношение
разности верхней и нижней границ к значению нижней границы интервала
ненадежности. Тест-системы с узким интервалом ненадежности более удобны для
практического использования - они более устойчивы по отношению к внешним
факторам.
.1.4.4 Предел определения (нижняя
граница определяемых концентраций)
Предел определения аналита, согласно
[16], - это "наименьшее содержание аналита, которое может быть
количественно определено с помощью данной методики анализа вещества или
материала с установленными значениями характеристик погрешности или
неопределенности". Ранее такое же толкование имела метрологическая
характеристика "нижняя граница определяемых содержаний" [17, 18]. Ее
обозначали сн и относили, обычно, к результату определения с
погрешностью 33%. Подход к оценке сн для методик тест-определений с
использованием цветовой шкалы изложен в работах [8, 14, 19], он сводится к
экспериментальной оценке стандартного отклонения визуального определения
аналита (sс) вблизи искомой концентрации. Утроенная величина sс
приравнивается значению сн.
.1.4.5 Предел обнаружения
Предел определения (сmin)
- это наименьшее содержание аналита, при котором он может быть обнаружен по
данной методике анализа вещества или материала с заданной доверительной
вероятностью [11]. Из-за визуальной индикации компонента, который анализируют,
на результат влияют случайные факторы: разная чувствительность человеческого
глаза, освещенность, температура.
Методы оценки предела обнаружения
визуальных тест-методик, которые применяются в наше время, базируются на
роботах Н.П. Комаря [12] и содержат исследования частот обнаружения аналита в
области ненадежной реакции путем многочисленных наблюдений. Частота обнаружения
Р(с) - отношение положительного числа ответов наблюдателей к общему числу
наблюдений.
Для оценки предела обнаружения
авторы работ [13, 14] используют численный метод, проверяя гипотезы в
соответствии экспериментальной зависимости вероятности Р(с) в области
ненадежной реакции теоретическим функциям с помощью комплекса критериев: χ2,
Колмогорова - Смирнова (λ), коэффициентов
асимметрии (Ã) и
эксцесса (γ2).
Гипотезу в соответствии эмпирического распределения тому или иному
теоретическому принимают, если χ2експ
< χ2P,f, λексп < λP,f,
а
оценки Ã и
γ2
близкие
к нулю. Если эти условия выполняются для нескольких видов распределений,
преимущество отдают тому, для которого значения всех рассчитанных критериев
будут наименьшие.
.2 Методы исследования процессов в
прозрачных и непрозрачных середах
.2.1
Спектрофотометрия
Спектрофотометрией обычно называют
метод оптического молекулярного абсорбционного анализа. Объектом
спектрофотометрических измерений, как правило, являются растворы.
Фотометрируемый раствор помещают в кювету - сосуд с плоскими параллельными
прозрачными гранями.
Спектрофотометрический метод, будучи
абсорбционным, основан на измерении поглощения света. Его чаще всего измеряют
косвенно - путем сравнения интенсивностей света внешнего источника, падающего
на образец и прошедшего сквозь образец. Изменение интенсивности света при
прохождении через образец может быть вызвано светопоглощением не только
определяемого вещества, но и других компонентов (в частности растворителя), а
также рассеянием, отражением и т.д. Чтобы исключить влияние саморассеяния,
фотометрируемый раствор должен быть прозрачным. Прочие эффекты можно
скомпенсировать, используя раствор сравнения. В простейшем случае им является
чистый растворитель или раствор контрольного опыта. [20]
Основным законом спектрофотометрии
является закон Бугера-Ламберта-Бера:
A=εlc
(1.2)
Где:
ε-
молярный
коэффициент поглощения, лмоль-1см-1; l-
толщина поглощающего слоя, см; с-
концентрация вещества, моль/л;
Если в растворе присутствует
несколько поглощающих веществ, то оптическая плотность раствора равна сумме
вкладов каждого из компонентов:[20]
А=ε1lc1+ε2lc2+…+εnlcn
(1.3)
.2.2 Спектроскопия диффузного
отражения
Спектроскопия диффузного отражения
используется для регистрации спектров гетерогенных систем, порошков или твердых
веществ, имеющих неровную поверхность. Диффузное
отраженное от образца излучение собирается под широким углом и передается на
детектор:
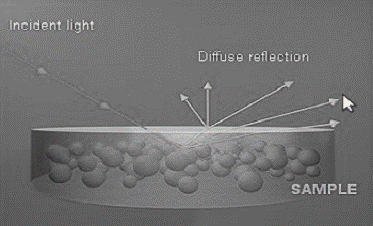
Рис 1.3 Схема процесса дифузного
отражения
реагент твердофазный
спектрофотометрия цветометрия
То есть измеряют количество света,
отраженного твердым образцом:
R=I/I0 (1.4)
Где:
R-
коэффициент отражения; I0-
интенсивность падающего на образец света; интенсивность
отраженного от образца света.
Наиболее общая теории СДО изложена
Кубелкой и Мунком. Для бесконечно толстого слоя окрашенных порошкообразных
материалов с диаметром частиц несколько микрометров выведено уравнение:
(1-R∞)2/2 R∞=β/S
(1.5)
Где:
R∞-абсолютное
диффузное отражение; β-коэффициент
поглощения; S-коэффициент
рассеяния света.
Вместо R∞ обычно использую
относительное диффузное отражение R, которое измеряют по отношению к стандартам
MgO или BaSO4. При этом значения β
стандартов
принимают равными нулю, а их абсолютное диффузное отражение - единице. Однако R∞
стандартов не превышает 0.98-0.99, и на практике имеют дело с отношением:
R∞ образца/ R∞
стандарта ≡ R (1.6)
С учетом этого допущения уравнение
(1.5) можно записать в виде:
F≡(1-R)2/2 R=β/S
(1.7)
Где:
F-
функция Кубелки-Мунка
Коэффициент рассеяния β
для
слабопоглощающих образцов связан с молярным коэффициентом поглощения (ε)
и
концентрацией сорбата (с) уравнением:
β=2,3·ε·с
(1.8)
Подставив то выражение в уравнение
(1.7) получим:
F≡(1-R)2/2 R≡2.3·ε·c/S
(1.9)
Откуда следует, что функция
Кубелки-Мунка линейно связана с концентрацией сорбата, а зависимость F=f(λ)
совпадает
со спектром его поглощения в растворе. Однако первое выполняется лишь для
толстого слоя мелкодисперсных слабопоглощающих образцов, а второе- при условии,
что S не зависит от длины волны. На диффузное отражение существенное влияние
оказывает размер частиц образца и его влажность. С уменьшением размера частиц F
увеличивается, что обусловлено уменьшением коэффициента рассеяния S. По этой
причине увеличивается диффузное отражение сухих образцов по сравнению с
влажными.[21]
.2.3 Твердофазная спектрофотометрия
(ТСФ)
Твердофазная спектрофотометрия
является современным гибридным методом анализа, рационально сочетающим
концентрирование и последующее прямое измерение светопоглощения сорбента после
сорбции им определяемого элемента. Метод ТСФ привлекателен в связи с
неограниченными возможностями сочетания органических реагентов и различных
сорбентов неорганической или органической природы.
Твердофазная спектрофотометрия была
предложена в 1976 году японскими химиками К. Йошимурой, Х. Ваки и С. Охаш,
впервые обнаружившими прямую пропорциональную зависимость между концентрацией
иона в исходном растворе и светопоглощением твердой фазы.
Немаловажное преимущество метода
состоит в том, что отсутствует стадия элюирования аналита, которая является
причиной снижения чувствительности определения вследствие разбавления
полученного концентрата [22].
Известно использование метода ТСФ
для разделения и определения V(IV) и V(V) [23], Co(II) [24,25], Hg(II) [26],
Cu(II) [27], Pd(II) [28] и некоторых других.
.2.4 Цветометрия
.2.4.1 Основные положения
цветометрии
Цветометрия - это наука о способах
измерения цвета и его количественное выражение. Метод цветометрии, состоящий в
расчете цветовых характеристик анализируемого объекта на основании имеющихся
спектральных параметров, позволяет как различить спектрально близкие вещества,
так и получить дополнительные сведения о них.
Существует два основных способа
измерения цвета, которые отличаются методикой расчета [29]: по спектральному
составу излучения или по числу отдельных цветов в смеси, которое дает
определяемый цвет. В соответствии с этой классификацией, все цветоизмеряющие
приборы и методики расчета координат цвета можно условно разделить в
зависимости от измеряемой величины на два вида:
Координаты цвета рассчитывают по
известному спектральному составу анализируемого соединения (спектру поглощения,
отражения и т.п.). Этот метод считается наиболее точным.
На основании измеряемой обшей
функции сложения цветов (нередко соответствует чувствительности фотоэлементов)
сразу получают координаты цвета определяемого компонента.
В зависимости от принципа, лежащего
в основе цветоизмеряющего прибора прогнозируют ошибку его измерений.
.2.4.2
Система
RGB
Математическое описание цвета в
цветометрии базируется на том, что любой цвет можно представить в виде смеси
(суммы) определенных количеств трех линейно независимых цветов. В качестве
основных цветов выбраны красный (R), зеленый (G) и синий (B), то есть три
монохроматических излучения с длинами волн (λ)
700, 546.1 и 453.8 нм соответственно [30].
График цветового охвата в данной
системе приведен на рис.1. Тут точка S1 соответствует цвету, который
находится в этом цветом пространстве, а S2 - цвету, который выходит
за его пределы. Такое представление удобнее проиллюстрировать геометрически.
Три основных цвета в ортогональной системе координат являются осями, а каждый
цвет, заданный тремя цветовыми координатами, отображается вектором S:
S = RR + GG + ВB
где R, G, В- координаты
красного,зеленого и синего цветов соответственно;, G, В -единичные ветора этих
цветов, которые смешивают.
Соединив точки единичных основных
цветов (R=1,G=1, В=1) друг с другом, получим треугольник, лежащий в единичной
плоскости. Эта плоскость примечательна тем, что цветовые векторы, имеющие
разную длину, но одинаковое направление, пересекают ее в одной и той же точке
S, которая характеризует насыщенность цвета.
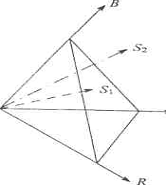
Рис. 1.4 Трехкоординатное цветовое
пространство RGB
Чтобы установить положение точки S
на единичной плоскости, вводят координаты цветности r, g, b, связанные с
координатами цвета R, G, В таким образом [30]:
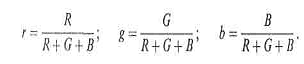
Из соотношений (1.10) следует, что r
+ g + b = 1, то есть для однозначного определения положения точки на единичной
плоскости достаточно двух координат цветности.
Восприятие цвета человеком вычисляют
по результатам экспериментов со смешением цветов [31]. В этих экспериментах
нужно визуально сравнить чистые спектральные цвета одинаковой интенсивности
(соответствующие монохроматическом свету с разными длинами волн) со смесями
трех основных цветов, которые дает аналитический прибор. Для сопоставления
чистый спектральный цвет и смесь трех цветов прибора располагают рядом на двух
половинках фотометрического поля сравнения. После уравнивания измеряют
количестве трех основных цветов и определяют их отношение к единичным
количествам этих цветов. Полученные величины являются цветовыми координатами
сравниваемого цвета в выбранной цветометрической системе координат. Описанная
процедура не позволяет уравнять большинство чистых спектральных цветов со
смесями трех основных цветов прибора. В таких случаях к сравниваемому цвету
добавляют некоторое количество одного из основных цветов, то есть допускается
отрицательное значение координаты цвета. По результатам нескольких наблюдателей
вычисляют усредненные количестве трех основных цветов (удельные координаты
цвета), смесь которых визуально не отличается от чистого спектрального цвета.
Графические зависимости количеств основных цветов от длины волны представляют
собой так называемые кривые добавления цветов. По этим кривым можно рассчитать
доли основных цветов, необходимых для получения смеси, которая визуально не
отличается от излучения сложного спектрального состава. Для этого цвет сложного
излучения представляют в виде суммы чистых спектральных цветов, соответствующих
его монохроматическим составляющим (с учетом их интенсивностей). Возможность
такого представления основана на одном из законов Грассмана, согласно которому
цветовые координаты цвета смеси равны суммам аналогичных координат всех цветов,
которые смешивают [32].
.2.4.3 Система XYZ
Для цветов, входящих в цветовой
охват системы RGB, функции добавления имеют положительные значения. Однако если
цвет выходит за пределы этого охвата, то функции добавления принимают
отрицательные значения, что создает неудобства при расчетах. В связи с этим
Международная комиссия по освещению (МКО) обобщила известные свойства цвета и
формулы для расчета изменения цветов и предложила неортогональную трехцветную
систему XYZ, описывающая спектральные свойства анализируемого объекта в виде
трехмерных векторных координат и позволяющий преодолеть указанный недостаток.
Интегральный деление интенсивности светового излучения на три составляющие
удобно для соотнесения с человеческим зрением (из-за наличия в сетчатке глаза
красно-, зелено-, и синечувствительных волокон).
Основу
предлагаемой системы координат XYZ составляют следующие положения [29]:
Ø для всех реальных
цветов координаты цвета XYZ имеют только положительные значения;
Ø координата Y
определяет яркость цвета;
Ø координаты
цветности белого равноэнергетического излучения находятся в центре тяжести
треугольника, лежащего на единичной плоскости.
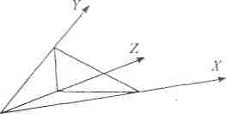
Рис. 1.5 Трехкоординатное цветовое
пространство XYZ
Для перехода из системы основных
цветов RGB в систему XYZ используют следующие соотношения:
X = XrR+ XGG + ХBВ, (1.11)= YRR +
YGG + YBB, (1.12)= ZrR + ZGG + ZBB, (1.13)
где XR, XG, XB, Yr, YG, Yb, Zr, ZG и
ZB- координаты основных цветов в трехкоординатном пространстве RGB.
Эти величины также
стандартизированы. Координаты цветности в новом цветовом пространстве будут
иметь вид:
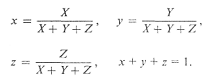 (1.14)
(1.14)
Единичная плоскость представляет
собой прямоугольный треугольник, который называют графиком цветности, вершинами
которого являются точки пересечения с векторами основных цветов. Векторы
спектральных цветов пересекают единичную плоскость по линии чистых спектральных
цветов (рис. 1.6), что ограничивает область существования реальных цветов.
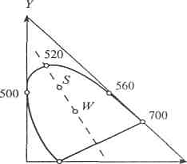
Рис. 1.6 Единичная плоскость в
системе XYZ и линия чистых спектральных цветов. Точки S и W соответствуют
координатам цветности данного и белого цветов. Цифры - длины волн излучения (λ,
нм).
Кроме координат X, Y, Z часто
используют такие характеристики, как цветовой тон (Т(λ))
и
чистота цвета (Р), которые однозначно определяют цветность излучения [30].
Очевидно, что любой реальный цвет может быть получен аддитивным смешением
белого и соответствующего монохроматического излучения. Цветовой тон
определяется точкой пересечения прямой, проходящей через координаты цветности
данного и белого цвета (точки S и W на рис. 1.6), с линией чистых спектральных
цветов. Чистота цвета показывает, в каких соотношениях смешанные
монохроматический и белый цвета, при этом чистота монохроматического излучения
равен единице, а белого - нулю.
1.2.4.4 Измерение малых цветовых
различий
Следует отметить, что использование
цветового графика в системе XYZ (МКO, 1931 г.) сопряжено с некоторыми
трудностями. Так, отдельные расстояния между двумя точками на диаграмме (рис.
1.6) не соотносятся с визуальным восприятием человека, поскольку шкала
диаграммы неравномерна. Кроме того, она не дает информации о светлоте цвета.
Рассмотренные выше системы позволяют делать лишь количественную оценку цвета,
однако визуально оценить с их помощью разницу между двумя цветами нельзя, так
как расстояние между точками в цветовом пространстве не соответствует различию,
которое надежно чувствует глаз [30]. Было сделано довольно много попыток
создания такого равноконтрастного пространства, в котором расстояние между
двумя точками коррелировало бы с визуально воспринимаемым изменением цветов.
Однако пока этого сделать не удалось. Международной комиссией по освещению
предложено в 1976 г. несколько таких квазиривноконтрастних систем, наиболее
распространенной из которых является CIELAB. Координаты L, А, В в этой системе
связаны с координатами X, Y, Z соотношениями:
= 116(Y/Y0)1/3-16, (1.15)=
500[(X/X0)1/3-(Y/Y0)1/3], (1.16)= 200[(Y/Y0)1/3-(Z/Z0)1/3] , (1.17)
где L - светлота, А, В - координаты
цвета (+ А - красная ось, -А -зеленая ось, + В -желтая ось, -В -синяя ось)
[34]; X0, Y0, Z0-координаты белого цвета в системе XYZ; оси А и В располагаются
в плоскости, перпендикулярной оси L (рис. 1.7).
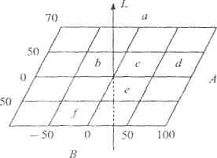
Рис. 1.7 Трехкоординатное цветовое
пространство LAB. Области белого (a), зеленого (b), серого (с), желтого (d),
пурпурного (е) и синего (f) цветов.
Расстояние между двумя точками в
трехкоординатной цветовом пространстве LAB характеризует полное цветовое
различие (ΔЕ),
которое вычисляют по формуле:
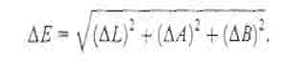 (1.18)
(1.18)
ΔL = L-L0,
ΔB
= B-B0,
ΔA
= A-A0
L, A, B, L0, B0,
A0 - координаты цвета определяемого образца и образца сравнения
соответственно [31].
Цветовой тон (Т) и насыщенность
цвета (S) определяются следующими соотношениями:
S2 = А2 + В2,
(1.19)
Т = arclg(B/A) (1.20)
Цветовое пространство CIELAB
наиболее приемлемо для расчетов, так как равные расстояния между точками,
которые соответствуют различным цветам, в любых частях этой системы координат
соотносятся с зрительным восприятием, что позволяет вести удобную мере для
количественного определения цветовых различий [34].
.2.5 Использование компьютерных
программ и сканер-технологий
С распространением цифровой
фотографии, настольных сканеров и компьютерных программ для обработки цветных
изображений появился быстрый, объективный и автоматизированный способ оценки
цветометричских функций окрашенных образцов. Полученный в результате численного
сканирования файл изображения представляется на экране монитора и может
автоматически с использованием стандартных программ, которые прилагаются к
сканеру, быть проанализированным как по характеристикам цветности так и по
отражающим возможностям или яркости. Современные сканеры и обслуживающие их
программы обработки изображений (графические редакторы) дают возможность для
оценки индикационная эффектов цветометрических пассивных дозиметров,
индикационных трубок, цветометрического анализа тонкослойных хроматограм, а
также для изучения цветометрических характеристик окрашенных сорбированных
веществ. В
настоящее время для измерения цвета существуют также портативные колориметры,
позволяющие производить измерения образцов, сравнивать их со стандартами и т.п.
Колориметрический
метод измерения цвета состоит в том, что измерительный свет, излучаемый лампой,
отражается образцом и воспринимается тремя сенсорами. Фильтры, создающие в трёх
цветных каналах спектральную чувствительность, соответствующую стандартным
спектральным функциям, в качестве таковых имитируют спектральную
чувствительность сетчатки глаза и соответствуют сенсорам глаза. Определение
сигнала сенсора получает стандартные цифровые величины XYZ для красного,
зелёного и синего цветов. Затем они используются для всех остальных
колориметрических вычислений.
Рис. 1.8 Схема колориметрического
метода измерения цвета. Цветовые доли красного, зеленого, и синего цветов
регистрируются тремя сенсорами
Для недорогих и надёжных
измерительных устройств создан простой принцип измерений. Но, несмотря на
постоянные усовершенствования, эти измерения не достигают абсолютной точности
спектрофотометра. [37].
1.3 Способы построения цветовых шкал
На данный момент проблеме оптимизации построения
цветовой шкалы для визуального тестового анализа уделяется постоянное внимание,
но не существует единого мнения как именно надо строить эти шкалы, какой критерий
являесть определяющим при выборе способа способа построения шкалы.
Такую шкалу можно готовить так, чтобы
концентрация определяемого элемента С в последовательно расположенных пробах
увеличивалась либо в соответствии с арифметической либо в соответствии с
геометрической прогрессией. Еще Н.П Комарь утверждал, что результаты анализа с
использованием геомертической прогрессии, в отличие от арифметической,
характеризуется постоянной по всей шкале величиной относительной погешности и
ее применение в колориметрии предпочтительно [42].
В книге А.К Бабко [43] отмечается, что наилучшее
воспричтие человеком различия в окраске растворов наблюдается при построении
шкал в геометрической прогрессии, а в случае, когда проба, не содержащая
определяемого элемента, имеет собственную окраску, можно строить арифметическую
шкалу. В этой же книге описывается критерий, равный 10% для оценки минимального
шага шкалы (разницы в интенсивности световых потоков) при построении
колориметрических шкал на основе окрашенных растворов.Несколько
позже по аналогии с критерием для растворов, предложенным А.К Бабко, для
построения цветовых шкал ввел критерий общего
цветового различия ΔЕ=10,
оцениваемый инструментально [44]. В дальнейших работах В.М. Иванова критерий
общего цветового разичия находил широкое применение при построении цветовых
шкал для тестового анализа ионов.
В дальнейшем критерий общего
цветового различия стал широкоиспользуемым в тестовом химическом анализе с
ипользованием метода цветометрии. С.Б Саввин с сотрудниками в своей
работе [2] градуировочную тест-шкалу строят на
основании известной зависимости общего цветового различия от содержания
определяемого элемента. Одной единице ΔЕ
соответствует один порог цветоразличия, поэтому значения концентраций
определеяемого элемента выбирают в соответствии с определенным шагом ΔЕ.
Надежное ощущение разницы в интенсивности световых потоков достигается при их
отличии на 10%. Поэтому, как утверждают автора, в варианте диффузного отражения
лучше всего использовать дискретные значения цветового различия с ΔЕ>10.
Также автора работы [2] утверждают, что при создании тест-шкалы нижней границей
определяемых содержаний любой тест-методики следует считать общее цветовое
различие в 10 условных единиц между исходным тест обрацом (Е0) и тест образцом,
прореагировавшим с определяемым элементом (Е):
Е-Е0=10
При разработке тест-метода для
определения урана (VI) с помощью СХ-5-Br-ПААФ с использованием метода
цветометрии для оценки изменения цвета и для нахождения взаимосвязи между
цветом сорбента и содержанием определяемого компонента, автора работы [38]
при построении шкалы для визуальной колориметрии соблюдали условие
равноконтрастности колориметрической системы CIELAB и ∆Е=10 и при
соблюдении прямолинейности координат цвета (А, В).Таким образом, в данной
работе концентрационный шаг для построения шкалы подбирался так, чтобы ∆Е=10:
ΔЕ
10 20 30 40 50 60
Смкгурана(VI)
5 10 30 70 150 220
В работе [39]
для построения градуировочной тест-шкалы для визуального определения
используется подход, подобный используемому в работе [2]: взяв постоянный шаг ∆Е
=10, получают изменение содержания определяемого элемента в тест-образце в
геометрической прогрессии.
Недавно было предложено использование шкалы с
концентрационным шагом, соответствующим ряду Фибоначчи [Фибоначчи]. В этом ряду
каждый последуюший член равен сумме двух предыдущих. Для начала этого ряда
выполняется арифметическая прогрессия, но начиная с 4-го члена, прогрессия
асимптотически приближается к геометрической с
q=1,618, известному
числу золотого сечения "Фи". Автора утверждают, что с использованием
этого ряда можно уменьшить величины абсолютной и относительной погрешностей
анализа, пригодность ряда Фибоначчи была проверена статистически на визуальном
тест-определении перхлоратов в виде их ионных ассоциатов с тионином,
сорбированных на ППУ. Авторами этой же работы было найдено, что хорошо
различимые точки на шклае характеризуются общим цветовым различием ΔЕ=5-6
а не 10, что говорит о том что нельзя безоговорочно принимать величину ΔЕ=10
в качестве универсального.
Таким образом, не существует единого критерия
для оценки минимального шага цветовой шкалы. Следовательно концентрационный шаг
необходимо подбирать индивидуально для каждой реакции в зависимости от
используемого сорбента, способа индикации (визуального или инструментального),
и многих других факторов.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Реактивы и оборудование
В данной работе были использованы следующие
реактивы и приборы
·
Нитрозо-Р-соль,
ч.д.а.;
·
Сульфосалициловая
кислота, ч.д.а.;
·
Мурексид,
ч.д.а.;
·
Хлорид
железа шестиводный, х.ч.;
·
Тиоцианат
калия, х.ч.;
·
Нитрат
кобальта, х.ч.;
·
Фторид
натрия, х.ч.;
·
Нитрит
натрия, х.ч.;
·
Кислота
серная, х.ч;
·
Кислота
соляная, х.ч.;
·
Аммиак
·
Бумага
фильтровальная;
·
Фотографическая
пленка для офсетной печати фирмы AGFA, из которой предварительно были удалены
галогениды серебра (бесцветная, прозрачная, с толщиной желатинового слоя ~ 20
мкм);
·
Пенополиуретан
(листовой, белого цвета, толщина 1 см)
·
Спектрофотометр
СФ-2000 с приставкой для измерения диффузного отражения;
·
Аналитические
весы ВЛР-200.
Все растворы готовились на дистилированной воде.
Мерная посуда, используемая при выполнении данной работы, была поверена, что
позволило измерять объемы растворов с погрешностью не более 0,2%.
2.2 Методики эксперимента
2.2.1 Методики приготовления и стандартизации
растворов
.2.1.1 Приготовление 100 мл раствора FeCl3
с концентрацией ≈0,3 моль/л
Раствор FeCl3 готовили из кристаллогидрата
состава FeCl3∙6Н20. На аналитических весах
взвешивают ≈8,108 г FeCl3∙6Н20. Навеску
количественно переносят в мерную колбу на 100 мл, растворяют ≈ в 30 мл
дистиллированной воды, доводят водой до метки и тщательно перемешивают.
Полученный раствор стандартизуют.
.2.1.2 Приготовление 100 мл раствора тиоцианата
калия с концентрацией 5 моль / л
На технохимических весах взвешивают 24,30 г
KSCN. Навеску количественно переносят в мерную колбу вместимостью 50 мл,
растворяют в ~ 30 мл дистиллированной воды, доводят водой до метки и тщательно
перемешивают.
.2.1.3 Методика приготовления растворов соляной
кислоты с концентрациями 0.4, 0.2, 3, 5 моль/л
Зная точную концентрацию исходной кислоты
рассчитать объем аликвоты исходной кислоты по формуле:
0=c(HCl)∙V/c0(HCl)
С помощью пипетки отобрать необходимую аликвоту
исходного раствора кислоты в мерную колбу вместимостью 100 мл, довести водой до
метки и тщательно перемешать.
2.2.1.4 Приготовление 100 мл раствора
сульфосалициловой кислоты с концентрацией 1 моль/л
На технохимических весах взвешивают 20 г
сульфосалициловой кислоты. Навеску количественно переносят в мерную колбу
вместимостью 100 мл, растворяют в ~ 50 мл воды, доводят раствор до метки водой
и тщательно перемешивают.
.2.1.5 Методика приготовления сухой индикаторной
смеси из мурексида (0,2%) и хлорида натрия
На аналитических весах берут навеску
мурексида массой 0,04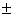 0,01 г и
навеску хлорида натрия массой 20 г. Навеску мурексида тщательно растирают в
фарфоровой ступке с хлоридом натрия до получения однородной смеси.
0,01 г и
навеску хлорида натрия массой 20 г. Навеску мурексида тщательно растирают в
фарфоровой ступке с хлоридом натрия до получения однородной смеси.
2.2.1.6 Методика приготовления 250 мл раствора Co(NO3)2
с концентрацией ≈0,1 моль/л
На аналитических весах взвешивают ≈4,574 г
Co(NO3)2.
Навеску количественно переносят в мерную колбу на 250 мл, растворяют ≈ в
50 мл дистиллированной воды, доводят водой до метки и тщательно перемешивают.
Приготовленный раствор стандартизуют.
.2.1.7 Методика приготовления 100 мл раствора
фторида натрия с концентрацией 1 моль/л
На аналитических весах взвешивают 4,1988 г NaF.
Навеску количественно переносят в мерную колбу вместимостью 100 мл, растворяют
в ~ 30 мл дистиллированной воды, доводят водой до метки и тщательно
перемешивают.
2.2.1.8 Методика приготовления 100 мл раствора
серной кислоты с концентрацией 0,2 моль / л
Определить плотность (ρ)
исходной
концентрированной серной кислоты, и установить по справочнику [41]
соответствующую молярную концентрацию c0. Рассчитать объем аликвоты
исходной кислоты по формуле:
0=c(H2SO4)∙V/c0(H2SO4).
С помощью пипетки отобрать необходимый аликвоту
исходного раствора кислоты в мерную колбу вместимостью 100 мл, довести водой до
метки и тщательно перемешать.
.2.1.9 Методика приготовления 100 мл раствора
нитрита натрия с концентрацией 0.01 моль/л
Для приготовления раствора нитрита натрия с
заданной концентрацией взвесить на аналитических весах ~ 0.069 г соли, навеску
количественно перенести в мерную колбу вместимостью 100 мл добавить 30-50 мл
воды чтобы растворить соль, довести до метки дистиллированной водой и тщательно
перемешать.
.2.1.10 Методика приготовления 50 мл
нитрозо-R-соли с концентрацией 3·10-2 моль/л
Для приготовления исходного раствора
нитрозо-R-соли с молярной концентрацией 3·10-2 моль/л, навеску
массой 0,5659 г нитрозо-R-соли количественно переносят в мерную колбу на 50 мл,
доводять до метки дистилированной водой и тщательно перемешивают.
2.2.1.11 Методика стандартизации исходного
раствора железа (III) с концентрацией ~ 0,3 моль / л
Кислый раствор FeCl3
нейтрализуют раствором NaOH
и устанавливают рН = 2,5. Добавляют 1 мл раствора сульфосалициловой кислоты с
концентрацией 1 моль / л и проводят титрование раствором ЭДТА до обесцвечивания
красной окраски. Перед окончанием титрования добавляют еще несколько капель
индикатора. Если в конце титрования раствор снова становится красным,
титрование продолжают. Концентрацию железа в растворе рассчитывают по формуле:
с(Fe3+)=c(ЭДТА)∙V(ЭДТА)/Vал
где: V
(ЭДТА) - объем титранта, c
(ЭДТА) - концентрация титранта, Vал
- аликвота раствора железа, который титруют. [40]
.2.1.12 Методика стандартизации исходного
раствора кобальта (II) с концентрацией ~ 0,1 моль / л
Для титрования отбирают 15 мл раствора кобальта
(ІІ) и помещают в колбу
для титрования. Добавляют 50 мл дистиллированной воды и 5 мл стандартного
буферного раствора с рН=9,18. При титровании раствором ЭДТА используют
индикатор мурексид (0,2%). При изменении окраски раствора с малиновой на желтую
добавляют каплю раствора аммиака - если раствор снова становится малиновым,
титруют дальше до устойчивой желтой окраски. Концентрацию кобальта (II)
рассчитывают по формуле:
с(Co2+)=c(ЭДТА)∙V(ЭДТА)/Vал
где: V
(ЭДТА) - объем титранта, c
(ЭДТА) - концентрация титранта, Vал
- аликвота раствора кобальта, который титруют.
2.2.2 Методика подготовки пенополиуретана для
определения Fe3+,
Co2+
Сорбент используют в виде таблеток диаметром 16
мм, толщиной 5-10 мм и весом 0,03-0,05 г, которые выбивают металлическим
пробойником из промышленного листа полимера. Для очистки от примесей таблетки
ППУ выдерживают 30 минут в растворе НCl
с концентрацией 0,1 моль / л, затем последовательно промывают водой до рН 5 - 6
и ацетоном, после чего высушивают до воздушно-сухого состояния. Подготовленные
таблетки хранят в бюксе в темном месте.
.2.3 Методика подготовки пенополиуретана для
определения NO2-
Для очистки от примесей таблетки ППУ поместить в
коническую колбу вместимостью 100 мл с пришлифованной пробкой и добавить 50-70
мл раствора хлороводородной кислоты с молярной концентрацией 0.1 моль/л.
Удалить из всех таблеток воздух, прижимая их с помощью стеклянной палочки к
стенкам колбы. Колбу закрыть пробкой и встряхивать её на механическом
вибросмесителе в течение 15 минут.
Таблетки промыть несколько раз дистиллированной
водой до рН 5-6, затем ацетоном, высушить между листами фильтровальной бумаги и
довести до воздушно-сухого состояния. Повторить обработку таблеток раствором
кислоты с молярной концентрацией 5 моль/л, встряхивая их в растворе кислоты в
течение 30 минут. Промыть водой до рН 5-6, затем ацетоном и довести до
воздушно-сухого состояния.
.2.4 Методика модифицирования желатиновых пленок
Определенное количество образцов желатинових
паленок конкретного размера (3,3 см·2,2 см) опускают на 30 минут в водный
раствор нитрозо-R-соли с молярной концентрацией 3∙10-3 моль/л
при рН = 2.Кислотность создается с помощью добавок соляной кислоты.
Таблица 2.1 Схема приготовления раствора для
модифицирования желатиновых пленок
|
Реактив
|
С0,моль/л
|
С, моль/л
|
Vал, мл
|
Vк, мл
|
|
Раствор НРС
|
3∙10-2
|
3∙10-3
|
2,5
|
25
|
|
Раствор HCl
|
0,1
|
0,01
|
2,5
|
25
|
С помощью пинцета пленки окрашенные в желтый
цвет вынимают из раствора и высушивают на воздухе. Модифицированные пленки
хранят при комнатной температуре в темном месте.
.2.5 Методика очистки растворов, используемых в
тест - определении железа на ППУ, от примесей железа (III)
Таблетки ППУ, подготовленные по методике 2.3,
опускали в растворы тиоцианата калия и соляной кислоты, удаляли пузырьки
воздуха и встряхивали на аппарате для механической встряхивания в течении 30
минут. Затем таблетки вынимали и выбрасывали, а процедуру повторяли до тех пор,
пока таблетки переставали окрашиваться в красный цвет.
.2.6 Методика выявления интервала ненадежности
Для выявления интервала ненадежности готовят
серию растворов, снижая концентрацию аналита до исчезновения сигнала.
Полученные тест-образцы располагают на фоне
белого листа. Контрольной группе наблюдателей (10 - 15 человек) предлагают
ответить на вопрос: "Появилась ли окраска тест-образца?" В
специальной таблице для записи наблюдений ответ "да" записывают в
виде "+", а ответ "нет" - в виде "-".
Область концентраций аналита, в которой часть
наблюдателей дадут положительные ответы, а часть - отрицательные, принимают за
интервал ненадежности.
2.2.7 Методика оценки предела определения
В качестве ориентировочного значения сн
принимают концентрацию ионов, которая "сверху" ограничивает интервал
ненадежности, т.е. концентрацию, которую обнаружили все наблюдатели.
Вблизи этой концентрации готовят цветовую шкалу
из 3-4 растворов, учитывая "холостой". При этом последующая
концентрация железа должна отличаться от предыдущей вдвое.
Готовят два стандартных раствора с такими
концентрациями ионов, чтобы они не совпадали с реперными точками шкалы.
Используя цветовую шкалу, предлагают наблюдателям (15-17 человек) определить
концентрацию железа в приготовленных растворах. Наблюдатели выбирают один из
трех вариантов ответов: "окраска таблетки ППУ соответствует или верхнему,
или нижнему, или среднему значению выбранного диапазона шкалы". Операцию
приготовления шкалы и стандартных растворов повторяют три раза, чтобы получить
не менее 50 результатов наблюдений.
Рассчитывают дисперсию и стандартное отклонение
определения концентрации Fe3+
по
формуле:
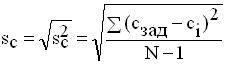
где сзад - концентрация ионов в
модельном растворе, N - общее число определений.
За окончательную оценку сн принимают
утроенное значение полученного стандартного отклонения:
сн = 3sc (2.2)
2.2.8 Методика тест-определения Fe3+
в
виде тиоцианатных комплексов, сорбированных на ППУ
Для определения железа в виде окрашенных
тиоцианатных комплексов на ППУ в колбу емкостью 25 мл вносят 2 мл KSCN
с концентрацией 5 моль/л и 2мл HCl
с концентрацией 0.4 моль/л (для создания рН≈1,5). Затем в колбу вносят
аликвоту FeCl3.
Полученный раствор выливают в чистую сухую конусную колбу, в нее опускают одну
подготовленную таблетку ППУ, из которой выдавливают пузырьки воздуха. Затем
раствор с таблеткой ППУ встряхивают на механическом встряхивателе на протяжении
15 минут, после чего таблетку вынимают, промакивают между листами
фильтровальной бумаги и высушивают на воздухе.
Методика приготовления растворов FeCl3
для создания цветовых шкал
Готовят четыре стандартных шкалы с разным
концентрационным шагом. Схемы приготовления рабочих растворов и растворов для
создания стандартных шкал приведены в табл. 2.2-2.3.
Таблица 2.2 Схема приготовления рабочих
растворов FeCl3
|
Vал,мл
|
Vк,мл
|
Ci(Fe3+)
,
мг/л
|
C0(Fe3+), мг/л
|
|
5
|
50
|
1721,2
|
17212,0
|
|
5
|
50
|
172,12
|
1721,2
|
|
2
|
50
|
6,8848
|
172,12
|
|
2
|
50
|
0,2754
|
6,8848
|
|
5
|
1,3769
|
6,8848
|
Таблица 2.3 Схема приготовления растворов FeCl3
для создания цветовых шкал (Vк=25
мл)
|
Шкала
с q=2
|
Шкала
с q=3
|
|
Ci(Fe3+)
,
мг/л
|
C0(Fe3+), мг/л
|
Vал,
мл
|
Ci(Fe3+)
,
мг/л
|
C0(Fe3+), мг/л
|
Vал,
мл
|
|
0
|
0
|
0
|
0
|
0
|
0
|
|
0,02
|
0,2754
|
1,8
|
0,02
|
0,2754
|
1,8
|
|
0,04
|
0,2754
|
3,6
|
0,06
|
0,2754
|
5,4
|
|
0,08
|
0,2754
|
7,3
|
0,18
|
6,8848
|
0,7
|
|
0,16
|
1,3769
|
2,9
|
0,54
|
6,8848
|
2
|
|
0,32
|
6,8848
|
1,2
|
|
|
|
|
0,64
|
6,8848
|
2,3
|
|
|
|
|
1,28
|
6,8848
|
4,6
|
|
|
|
|
Шкала
с q=1,5
|
Шкала
Фибоначчи
|
|
Ci(Fe3+)
,
мг/л
|
C0(Fe3+), мг/л
|
Vал,
мл
|
Ci(Fe3+)
,
мг/л
|
C0(Fe3+), мг/л
|
Vал,
мл
|
|
0
|
0
|
|
0
|
0
|
0
|
|
0,02
|
0,2754
|
1,8
|
0,02
|
0,2754
|
1,8
|
|
0,03
|
0,2754
|
2,7
|
0,03
|
0,2754
|
2,7
|
|
0,045
|
0,2754
|
4,1
|
0,05
|
0,2754
|
4,55
|
|
0,068
|
0,2754
|
6,1
|
0,08
|
0,2754
|
7,3
|
|
0,101
|
0,2754
|
9,2
|
0,13
|
1,3769
|
2,4
|
|
0,152
|
1,3769
|
2,8
|
0,21
|
1,3769
|
3,8
|
|
0,228
|
1,3769
|
4,1
|
0,34
|
1,3769
|
6,2
|
|
0,342
|
6,8848
|
1,3
|
0,55
|
1,3769
|
10
|
|
0,513
|
6,8848
|
1,9
|
0,89
|
6,8848
|
3,2
|
|
0,77
|
6,8848
|
2,8
|
|
|
|
.2.9 Методика тест-определения Co2+
на ППУ
Для определения кобальта в виде окрашенных
тиоцианатных комплексов на ППУ в колбу емкостью 25 мл вносят 2 мл KSCN
с концентрацией 5 моль/л, 2мл H2SO4
с концентрацией 0.2 моль/л (для создания рН≈2) и 2 мл NaF
с концентрацией 1 моль/л (для маскирования мешающего влияния примесей железа).
Затем в колбу вносят аликвоту Co(NO3)2.
Полученный раствор выливают в чистую сухую конусную колбу, в нее опускают одну
подготовленную таблетку ППУ, из которой выдавливают пузырьки воздуха. Затем
раствор с таблеткой ППУ встряхивают на механическом встряхивателе на протяжении
30 минут, после чего таблетку вынимают, промакивают между листами фильтровально
бумаги и высушивают на воздухе.
Методика приготовления растворов Co(NO3)2
для создания цветовых шкал. Готовят четыре стандартных шкалы с разным
концентрационным шагом. Схемы приготовления рабочих растворов и растворов для
создания стандартных шкал приведены в табл. 2.4-2.5.
Таблица 2.4 Схема приготовления рабочих
растворов Co(NO3)2
|
Vал,мл
|
Vк,мл
|
Сi(Co2+),мг/л
|
С0(Co2+),,мг/л
|
|
5
|
50
|
686,572
|
6865,72
|
|
2
|
50
|
27,46
|
686,572
|
|
5
|
50
|
2,75
|
27,46
|
|
5
|
50
|
0,275
|
2,75
|
Таблица 2.5 Схема приготовления растворов Co(NO3)2
для создания цветовых шкал (Vк=25
мл)
|
Шкала
с q=2
|
Шкала
с q=3
|
|
Сi(Co2+),мг/л
|
С0(Co2+),,мг/л
|
Vал,
мл
|
Сi(Co2+),мг/л
|
С0(Co2+),,мг/л
|
Vал,
мл
|
|
0
|
0
|
0
|
0
|
0
|
0
|
|
0,03
|
0,275
|
2,7
|
0,03
|
0,275
|
2,7
|
|
0,06
|
0,275
|
5,5
|
0,09
|
0,275
|
8,2
|
|
0,12
|
2,75
|
1,1
|
0,27
|
2,75
|
2,5
|
|
0,24
|
2,75
|
2,2
|
0,81
|
2,75
|
7,4
|
|
0,48
|
2,75
|
4,4
|
2,3
|
27,46
|
2,1
|
|
0,96
|
2,75
|
8,8
|
|
|
|
|
1,92
|
27,46
|
1,7
|
|
|
|
|
Шкала
с q=1,5
|
Шкала
Фибоначчи
|
|
Сi(Co2+),мг/л
|
С0(Co2+),,мг/л
|
Vал,
мл
|
Сi(Co2+),мг/л
|
С0(Co2+),,мг/л
|
Vал,
мл
|
|
0
|
0
|
0
|
0
|
0
|
0
|
|
0,03
|
0,275
|
2,7
|
0,02
|
0,275
|
1,8
|
|
0,045
|
0,275
|
4,1
|
0,03
|
0,275
|
2,7
|
|
0,0675
|
0,275
|
6,1
|
0,05
|
0,275
|
4,5
|
|
0,101
|
0,275
|
9,2
|
0,08
|
0,275
|
7,3
|
|
0,152
|
2,75
|
1,4
|
0,13
|
2,75
|
1,2
|
|
0,228
|
2,75
|
2,1
|
0,21
|
2,75
|
1,9
|
|
0,342
|
2,75
|
3,1
|
0,34
|
2,75
|
3,1
|
|
0,513
|
2,75
|
4,7
|
0,55
|
2,75
|
5
|
|
0,769
|
2,75
|
7
|
0,89
|
2,75
|
8,1
|
|
1,15
|
27,46
|
1
|
1,44
|
27,46
|
1,3
|
|
1,73
|
27,46
|
1,6
|
2,33
|
27,46
|
2,1
|
.2.10 Методика тест - определения нитрит - ионов
на ППУ
Приготовить рабочий раствор нитрита натрия путем
разбавления исходного (приготовленного по методике 2.2.9) в 100 раз. Для
приготовления стандартных шкал последовательно разбавлять исходный раствор в
мерных колбах на 25 мл, добавляя в каждую колбу определённый объём исходного раствора,
по 10 мл раствора соляной кислоты с молярной концентрацией 3 моль/л и доводя до
метки дистиллированной водой. Таким образом создаётся оптимальная для реакции
диазотирования ППУ концентрация HCl (1.2 моль/л).
Растворы из мерных колб вылить в конические
колбы вместимостью 100 мл с пришлифованными пробками, внести по одной таблетке
ППУ, удалить воздух из таблеток с помощью стеклянной палочки. Колбы закрыть
пробками и встряхивать на механическом вибросмесителе в течение 25 минут.
Растворы вылить из колб, придерживая таблетку стеклянной палочкой. Вынуть
таблетки из колб и промокнуть между листами фильтровальной бумаги. После такой
обработки таблетки приобретают лимонно-жёлтую окраску, интенсивность которой
возрастает с увеличением концентрации нитрит-ионов [45].
Методика приготовления растворов для создания
стандартных шкал для тест - определения нитрит ионов на ППУ
Для приготовления стандартных шкал используют
рабочий раствор NaNO2
с
концентрацией 4.6 мг/л, приготовленный разбавлением в 100 раз исходного раствора
(методика 2.2.7).
Готовят четыре шкалы с разным концентрационным
шагом. Схема приготовления растворов приведена в табл. 2.6
Таблица 2.6 Схема приготовления растворов NaNO2
для создания цветовых шкал (Vк=25
мл)
|
Шкала
с q=2
|
Шкала
с q=3
|
|
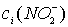 ,мг/л ,мг/л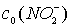 ,мг/лVал ,мг/лVал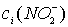 ,мг/л ,мг/л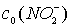 ,мг/лVал ,мг/лVал
|
|
|
|
|
|
|
0
|
0
|
0
|
0
|
0
|
0
|
|
0,1
|
4,6
|
0,55
|
0,1
|
4,6
|
0,55
|
|
0,2
|
4,6
|
1,1
|
0,3
|
4,6
|
1,65
|
|
0,4
|
4,6
|
2,2
|
0,9
|
4,6
|
4,9
|
|
0,8
|
4,6
|
4,35
|
2,7
|
4,6
|
14,7
|
|
1,6
|
4,6
|
8,7
|
|
|
|
|
Шкала
с q=1,5
|
Шкала
Фибоначчи
|
|
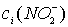 ,мг/л ,мг/л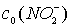 ,мг/лVал ,мг/лVал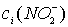 ,мг/л ,мг/л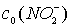 ,мг/лVал ,мг/лVал
|
|
|
|
|
|
|
0
|
0
|
0
|
0
|
0
|
0
|
|
0,1
|
0,55
|
0,1
|
4,6
|
0,55
|
|
0,15
|
4,6
|
0,8
|
0,2
|
4,6
|
1,1
|
|
0,23
|
4,6
|
1,25
|
0,3
|
4,6
|
1,65
|
|
0,34
|
4,6
|
1,85
|
0,5
|
4,6
|
2,7
|
|
0,51
|
4,6
|
2,8
|
0,8
|
4,6
|
4,35
|
|
0,76
|
4,6
|
4,1
|
1,3
|
4,6
|
7,1
|
|
1,14
|
4,6
|
6,2
|
2,1
|
4,6
|
11,4
|
|
1,71
|
4,6
|
9,3
|
|
|
|
.2.11 Методика тест - определения кобальта (II)
в желатиновой пленке
В колбу объемом 25 мл вносят аликвоту раствора
кобальта и 2,5 мл раствора соляной кислоты с концентрацией 0,01 моль/л для
создания рН=3 в растворе. Приготовленные растворы выливают в чашки Петри и
погружают в них модифицированные пленки на 20 минут. По истечении времени
пленки достают, промокают фильтровальной бумагой и сушат на воздухе.
Методика приготовления растворов для создания
стандартных шкал для тест - определения кобальта (II)
в желатиновой пленке. Для приготовления стандартных шкал отстандартизованный
раствор нитрата кобальта (II)
разбавляют и получают рабочие растворы необходимых концентраций. Далее работают
непосредственно с этими растворами. Схемы приготовления рабочих растворов и
приготовления четырех стандартных шкал с разными концентрационными шагами
приведены в табл. 2.7-2.8.
Таблица 2.7 Схема приготовления рабочих растворов
Co(NO3)2
|
Vал,мл
|
Vк,мл
|
Сi(Co2+),мг/л
|
С0(Co2+),,мг/л
|
|
5
|
50
|
686,572
|
6865,72
|
|
5
|
50
|
68,6572
|
686,572
|
|
5
|
50
|
6,86572
|
68,6572
|
Таблица 2.8 Схема приготовления растворов Co(NO3)2
для создания цветовых шкал (Vк=25
мл)
|
Шкала с
q=2
|
Шкала с
q=3
|
|
Сi(Co2+),мг/л
|
С0(Co2+),мг/л
|
Vал,
мл
|
Сi(Co2+),мг/л
|
С0(Co2+),мг/л
|
Vал,
мл
|
|
0
|
0
|
0
|
0
|
0
|
0
|
|
0,3
|
6,8657
|
1,1
|
0,3
|
6,8657
|
1,1
|
|
0,6
|
6,8657
|
2,2
|
0,9
|
6,8657
|
3,3
|
|
1,2
|
6,8657
|
4,4
|
2,7
|
68,6572
|
1
|
|
2,4
|
6,8657
|
8,7
|
8,1
|
68,6572
|
3
|
|
4,8
|
68,6572
|
1,8
|
|
|
|
|
9,6
|
68,6572
|
3,5
|
|
|
|
|
|
|
|
|
|
|
|
Шкала
с q=1,5
|
Шкала
Фибоначчи
|
|
Сi(Co2+),мг/л
|
С0(Co2+),мг/л
|
Vал,
мл
|
Сi(Co2+),мг/л
|
С0(Co2+),мг/л
|
Vал,
мл
|
|
0
|
0
|
0
|
0
|
0
|
0
|
|
0,3
|
6,8657
|
1,1
|
0,3
|
6,8657
|
1,1
|
|
0,45
|
6,8657
|
1,6
|
0,4
|
6,8657
|
1,5
|
|
0,68
|
6,8657
|
2,5
|
0,7
|
6,8657
|
2,5
|
|
1,01
|
6,8657
|
3,7
|
1,1
|
6,8657
|
4
|
|
1,52
|
6,8657
|
5,5
|
1,8
|
6,8657
|
6,6
|
|
2,28
|
6,8657
|
8,3
|
2,9
|
68,6572
|
1,1
|
|
3,42
|
68,6572
|
1,2
|
4,7
|
68,6572
|
1,7
|
|
5,13
|
68,6572
|
1,9
|
7,6
|
68,6572
|
2,8
|
|
7,7
|
68,6572
|
2,8
|
|
|
|
.2.12 Методика измерения диффузного отражения
ППУ
Измерения проводят на спектрофотометре СФ-2000 с
приставкой для измерения диффузного отражения. Таблетки ППУ закрепляют на
приставке. Отражение меряют относительно холостого образца в интервале длин
волн от 400 до 700 нм. Холостым образцом считается чистая пдготовленная
таблетка ППУ. Затем с помощью программы СФ-2000 для всех таблеток ППУ значения
диффузного отражения пересчитывают в значения общего цветового различия ΔЕ.
2.2.13 Методика оценки точности визуального тест
- определения для разных шкал
Приготовить четыре стандартных шкалы с разным
шагом для визуального тест-определения железа (ІІІ),
кобальта (II) или
нитрита, расположив окрашенные таблетки ППУ (пленки) на белом фоне в порядке
возрастания концентрации определяемых ионов для каждой шкалы. Большому числу
независимых наблюдателей задать вопрос: "Видите ли Вы различие в
интенсивности окраски соседних точек каждой из шкал?" Различие необходимо
оценивать для всех точек попарно. По результатам наблюдений сделать выводы о
вероятности определения ионов в каждом из концентрационных интервалов каждой из
шкал. Эту вероятность можно оценить как отношение числа наблюдателей,
ответивших "Да", к общему числу наблюдателей. С помощью компьютерной
программы СФ-2000 пересчитать полученные для всех таблеток ППУ значения
диффузного отражения в значения общего цветового различия (ΔΕ).
Для пленок значения общего цветового различия получить расчетным путем
(согласно методике). Сравнить результаты, полученные с помощью статистического
подхода и с помощью компьютерно - инструментальной (расчетной) обработки
данных.
.2.14 Методика фотометрирования желатиновых
пленок
Пленку с иммобилизированным реагентом или с
комплексом металла устанавливают в кюветном отделении. Поглощение пленки с
реагентом и поглощение пленки с комплексом измеряют относительно бесцветной
желатиновой пленки при определенной длине волны.
.2.15 Методика расчета координат цвета
Для нахождения координат цвета используют метод
выбранных координат. Значение светопропускания (для желатиновых пленок) или
диффузное отражение измеряют при всех длинах волн, указанных в табл.
Таблица 2.9 Значение длин волн для измерения
поглощения или отражения
|
Ордината
|
Х
|
У
|
Z
|
|
Длина волны, нм
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
19 20 21 22 23 24 25 26 27 28 29 30
|
424,4 435,5 443,9 452,1 461,2 474,0 521,2
544,3 552,4 558,7 564,1 568,9 573,2 577,4 581,3 585,0 588,7 592,4 596,0 599,6
603,3 607,0 610,9 615,0 619,4 624,2 629,8 636,6 645,9 663,0
|
465,9 489,5 500,4 508,7 515,2 520,6 525,4
529,8 533,9 537,7 541,4 544,9 548,4 551,8 555,1 558,5 561,9 565,3 568,9 572,5
576,4 580,4 584,8 589,6 594,8 600,8 607,7 616,1 627,3 647,4
|
414,1 422,2 426,3 429,4 432,0 434,3 436,5
438,6 440,6 442,5 444,4 446,3 448,2 450,1 452,1 454,0 455,9 457,9 459,9 462,0
464,1 466,3 468,7 471,4 474,3 477,7 481,8 487,2 495,2 511,2
|
Значение поглощения перечисляют в пропускания и
вносят в ранее приготовленные табл. 2.10.
Таблица 2.10 Значение пропускания или диффузного
отражения, которые необходимы для определения координат цвета
|
Ордината
|
Х
|
У
|
Z
|
|
Значения пропускання или отражения
|
|
1 30
|
|
|
|
|
Значения коэффициентов К
|
0,03269
|
0,03333
|
0,03938
|
Значение пропускания или отражения, приводимых в
каждом из столбцов в таблице 2.10 суммируют и полученную сумму домножают на
соответствующий коэффициент К.
Для желатиновых пленок координаты цвета
рассчитывают по формулам:
Х = Кх ΣТ(λіх)
(2.1)
У = Ку ΣТ(λіу)
(2.2)
Z
= Кz
ΣТ(λіz),
(2.3)
где
Х, У, Z
- координаты цвета;
Кх, Ку,
Кz
- значенния коэффициентов;
Т(λіj)
- значення пропускания (%) при длине волны λіj.
Зная величины Х, У, Z
рассчитывают координаты L,A,B
по формулам 1.15-1.17. Общее цветовое различие ΔЕ
рассчитывают по формуле 1.18.
2.3 Результаты и их обсуждения
2.3.1 Результаты стандартизации растворов
Результаты стандартизации исходного
раствора FeCl3 с
концентрацией ≈0,3 моль/л. Раствор FeCl3 стандартизовали
каждые три дня по методике 2.2.1.11, с использованием раствора ЭДТА с
концентрацией 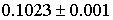 моль/л.
Пример определения приведен в табл. 2.11.
моль/л.
Пример определения приведен в табл. 2.11.
Таблица 2.11 Результаты трилонометрического
титрования раствора FeCl3
|
№
п/п
|
V(FeCl3),
мл
|
V(ЭДТА), мл
|
С(FeCl3), моль/л
|
|
1
|
5
|
15,1
|
0,3089
|
|
2
|
5
|
15,0
|
0,3069
|
|
3
|
5
|
15,0
|
0,3089
|
|
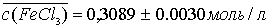
|
Результаты стандартизации исходного раствора Co(NO3)2
с концентрацией ≈0,1 моль/л
Раствор Co(NO3)2
стандартизовали по методике 2.2.1.12, с использованием раствора ЭДТА с
концентрацией  моль/л.
моль/л.
Пример определения приведен в табл.
2.12.
Таблица 2.12 Результаты
трилонометрического титрования раствора Co(NO3)2
|
№
п/п
|
V(Co(NO3)2),
мл
|
V(ЭДТА), мл
|
С(Co(NO3)2),
моль/л
|
|
1
|
15
|
17,73
|
0,1166
|
|
2
|
15
|
17,70
|
0,1165
|
|
3
|
15
|
17,70
|
0,1165
|
|
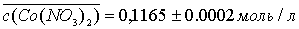
|
.3.2 Результаты выявления интервалов
ненадежности (ИН)
По методике 2.2.6 выявили интервалы
ненадежности обнаружения ионов Fe3+,Co2+, 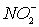 с
использованием тест - средств (табл. 2.13).
с
использованием тест - средств (табл. 2.13).
Таблица 2.13 Характеристики
интервалов ненадежности (ИН) изученных тест систем
|
Определяемый
ион
|
Реагент
|
Носитель
|
Границы
ИН, мг/л
|
Относительная
ширина ИН
|
|
Fe3+
|
KSCN
|
ППУ
|
0,01-0,02
|
1,0
|
|
Co2+
|
KSCN
|
ППУ
|
0,01-0,02
|
1,0
|
|
Co2+
|
NRS
|
желатиновая
пленка
|
0,1-0,25
|
|
|
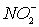 ─ППУ0,02-0,083,0 ─ППУ0,02-0,083,0
|
|
|
|
|
На основании установленных значений
относительной ширины ИН можно заключить, что реакция Co2+
с SCN-
на ППУ, по сравнению с реакцией Co2+
с NRS в желатиновой
матрице, имеет лучшие аналитические характеристики [12].
Значение верхней границы ИН приняли за
ориентировочное значение предела определения.
.3.3 Результаты оценки пределов определения
аналитов с использованием цветовой шкалы
В табл. 2.14-2.17 представлены результаты
экспериментальной оценки пределов определения аналитов, которые были найдены по
методике 2.2.7.
Таблица 2.14 Результаты
экспериментальной оценки предела определения железа (ІІІ) в виде 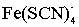 ,
сорбированном на ППУ (N=50)
,
сорбированном на ППУ (N=50)
Цветовая шкала, мг/л: 0; 0,02; 0,04
|
С(Fe3+), мг/л
|
Число
определений
|
Sc, мг/л
|
Сlim, мг/л
|
|
Введено,
мг/л
|
Найдено
с использованием цветовой шкалы, мг/л
|
|
|
|
|
0,023
|
0,02
|
28
|
0,0052
|
0,016
|
|
0,03
|
22
|
|
|
|
0,04
|
0
|
|
|
|
0,037
|
0,02
|
0
|
0,0061
|
0,018
|
|
0,03
|
34
|
|
|
|
0,04
|
16
|
|
|
|
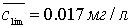
|
Таблица 2.15 Результаты
экспериментальной оценки предела определения кобальта (ІІ) в виде 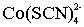 ,
сорбированном на ППУ (N=50)
,
сорбированном на ППУ (N=50)
Цветовая шкала, мг/л: 0; 0,02; 0,04.
|
С(Co2+), мг/л
|
Число
определений
|
Sc, мг/л
|
Сlim, мг/л
|
|
Введено,
мг/л
|
Найдено
с использованием цветовой шкалы, мг/л
|
|
|
|
|
0,034
|
0,020
|
7
|
0,0075
|
0,023
|
|
0,030
|
10
|
|
|
|
0,040
|
34
|
|
|
|
0,021
|
0,020
|
0,0080
|
0,024
|
|
0,030
|
40
|
|
|
|
0,040
|
0
|
|
|
|
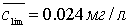
|
Таблица 2.16 Результаты экспериментальной оценки
предела определения нитрит-иона на ППУ (N=50)
Цветовая шкала, мг/л: 0; 0,10; 0,20.
|
С(NO2-),
мг/л
|
Число
определений
|
Sc,
мг/л
|
Сlim,
мг/л
|
|
Введено,
мг/л
|
Найдено
с использованием цветовой шкалы, мг/л
|
|
|
|
|
0,14
|
0,10
|
16
|
0,024
|
0,072
|
|
0,15
|
35
|
|
|
|
0,20
|
0
|
|
|
|
0,19
|
0,10
|
0
|
0,021
|
0,064
|
|
0,15
|
12
|
|
|
|
0,20
|
39
|
|
|
|

|
Таблица 2.17 Результаты экспериментальной оценки
предела определения кобальта (ІІ) в виде
комплекса с NRS в
желатиновой матрице
Цветовая шкала, мг/л: 0; 0,25; 0,50.
|
С(Co2+), мг/л
|
Число
определений
|
Sc, мг/л
|
Сlim, мг/л
|
|
Введено,
мг/л
|
Найдено
с использованием цветовой шкалы, мг/л
|
|
|
|
|
0,29
|
0,25
0
|
16
|
0,07
|
0,235
|
|
0,380
|
27
|
|
|
|
0,500
|
2
|
|
|
|
0,42
|
0,250
|
5
|
0,082
|
0,246
|
|
0,380
|
24
|
|
|
|
0,500
|
16
|
|
|
|
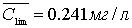
|
.3.4 Результаты исследования влияния на точность
визуального тестирования аналитов способа построения цветовой шкалы
Для исследования были точно приготовлены
цветовые шкалы с коэффициентами q=1,5;
2; 3 и с рядом Фибоначчи. Растворы для приготовления шкала готовили согласно
табл.
В случае приготовления шкал для определения
железа условия были изменены условия приготовления ППУ и растворов. Вместо
серной кислоты была использована соляная, так как она содержит меньшее
количество примесей железа, так как они смещают предел определения в область
более высоких концентраций ( примеси железа также взаимодействуют с тиоцианатом
калия, в результате холостая проба также приобретает окраску). Так как количественное
извлечение (97-99 %) тиоцианатных комплексов железа на ППУ достигается в
интервале рН 1-2, то мы выбрали середину этого интервала и создавали рН=1,5 с
помощью добавок соляной кислоты.
Были проверены две марки ППУ: 22-30 и 22-40. При
определении кобальта (ІІ)
и железа (III) в виде
тиоцианатных комплексов, сорбированных на ППУ, оказалось что лучше использовать
ППУ марки 22-40, при использовании же ППУ марки 22-30 мы получали окрашенные
таблетки с вкраплениями, неоднородностью окрашивания, слабой интенсивностью,
что делает их непригодными как для визуального так и для инструментального
определения. Результаты оценки точности визуального тест-определения аналитов с
использованием цветовых шкал с разными коэффициентами
Результаты экспериментальной оценки частот
обнаружения различия интенсивности окраски соседних точек тест-образцов
цветовых шкал представлены в табл.
Таблица 2.18 Частоты визуального определения
железа (III) в виде
тиоцианатных комплексов, сорбированных на ППУ, для разных концентрационных
интервалов
|
Интервал
c(Fe3+) мг/л
|
N
|
n
|
P,
%
|
Интервал
c(Fe3+) мг/л
|
N
|
n
|
P,
%
|
|
Шкала
q=2
|
Шкала
q=3
|
|
0-0,02
|
50
|
50
|
100
|
0-0,02
|
50
|
50
|
100
|
|
0,02-0,04
|
50
|
46
|
92
|
0,02-0,06
|
50
|
50
|
100
|
|
0,04-0,08
|
50
|
47
|
93
|
0,06-0,18
|
50
|
49
|
98
|
|
0,08-0,16
|
50
|
48
|
95
|
0,18-0,54
|
50
|
50
|
100
|
|
0,16-0,32
|
50
|
49
|
98
|
0,54-1,62
|
50
|
50
|
100
|
|
0,32-0,64
|
50
|
50
|
100
|
|
|
|
|
|
0,64-1,28
|
50
|
50
|
100
|
|
|
|
|
|
Интервал
c(Fe3+) мг/л
|
N
|
n
|
P,
%
|
Интервал
c(Fe3+) мг/л
|
N
|
n
|
P,
%
|
|
Шкала
q=1.5
|
Шкала
Фибоначчи
|
|
0-0,02
|
50
|
50
|
100
|
0-0,02
|
50
|
50
|
100
|
|
0,02-0,03
|
50
|
28
|
56
|
0,02-0,03
|
50
|
35
|
70
|
|
0,03-0,045
|
50
|
23
|
46
|
0,03-0,05
|
50
|
32
|
63
|
|
0,045-0,068
|
50
|
22
|
44
|
0,05-0,08
|
50
|
43
|
85
|
|
0,068-0,101
|
50
|
36
|
72
|
0,08-0,13
|
50
|
44
|
89
|
|
0,101-0,152
|
50
|
47
|
94
|
0,13-0,21
|
50
|
45
|
90
|
|
0,152-0,228
|
50
|
48
|
96
|
0,21-0,34
|
50
|
45
|
90
|
|
0,228-0,342
|
50
|
45
|
90
|
0,34-0,55
|
50
|
48
|
95
|
|
0,342-0,513
|
50
|
44,5
|
89
|
0,55-0,89
|
50
|
46
|
91
|
|
0,513-0,77
|
50
|
44
|
88
|
|
|
|
|
Таблица 2.19 Частоты визуального определения
кобальта (II) в виде
тиоцианатных комплексов, сорбированных на ППУ, для разных концентрационных
интервалов
|
Интервал
c(Co2+) мг/л
|
N
|
n
|
P,
%
|
Интервал
c(Co2+) мг/л
|
N
|
n
|
P,
%
|
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
0-0,03
|
50
|
48
|
95
|
0-0,03
|
50
|
48
|
95
|
|
0,03-0,06
|
50
|
47
|
94
|
0,03-0,09
|
50
|
49
|
97
|
|
0,06-0,12
|
50
|
45
|
90
|
0,09-0,27
|
50
|
50
|
100
|
|
0,12-0,24
|
50
|
46
|
91
|
0,27-0,81
|
50
|
50
|
100
|
|
0,24-0,48
|
50
|
49
|
97
|
0,81-2,3
|
50
|
48
|
96
|
|
0,48-0,96
|
50
|
48
|
96
|
|
|
|
|
|
0,96-1,92
|
50
|
47
|
95
|
|
|
|
|
|
Интервал
c(Co2+) мг/л
|
N
|
n
|
P,
%
|
Интервал
c(Co2+) мг/л
|
N
|
n
|
P,
%
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
0-0,03
|
50
|
48
|
95
|
0-0,03
|
50
|
48
|
95
|
|
0,03-0,045
|
50
|
22
|
45
|
0,03-0,04
|
50
|
26
|
52
|
|
0,045-0,0675
|
50
|
24
|
48
|
0,04-0,07
|
50
|
30
|
60
|
|
0,0675-0,101
|
50
|
40
|
80
|
0,07-0,11
|
50
|
33
|
65
|
|
0,101-0,152
|
50
|
38
|
75
|
0,11-0,18
|
50
|
40
|
80
|
|
0,152-0,228
|
50
|
35
|
70
|
0,18-0,29
|
50
|
45
|
90
|
|
0,228-0,342
|
50
|
68
|
0,29-0,47
|
50
|
46
|
92
|
|
0,342-0,513
|
50
|
33
|
65
|
0,47-0,76
|
50
|
47
|
93
|
|
0,513-0,769
|
50
|
33
|
65
|
0,76-1,23
|
50
|
48
|
95
|
|
0,769-1,15
|
50
|
46
|
92
|
1,23-1,99
|
50
|
46
|
91
|
|
1,15-1,73
|
50
|
43
|
85
|
|
|
|
|
Таблица 2.20 Частоты визуального определения
нитрит-ионов с помощью ППУ для разных концентрационных интервалов
|
Интервал
c(NO2-) мг/л
|
N
|
n
|
P,
%
|
Интервал
c(NO2-) мг/л
|
N
|
n
|
P,
%
|
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
0-0,1
|
50
|
50
|
100
|
0-0,1
|
50
|
50
|
100
|
|
0,1-0,2
|
50
|
50
|
100
|
0,1-0,3
|
50
|
50
|
100
|
|
0,2-0,4
|
50
|
50
|
100
|
0,3-0,9
|
50
|
50
|
100
|
|
0,4-0,8
|
50
|
50
|
100
|
0,9-2,7
|
50
|
31
|
62
|
|
0,8-1,6
|
50
|
50
|
100
|
|
|
|
|
|
Интервал
c(NO2-) мг/л
|
N
|
n
|
P,
%
|
Интервал
c(NO2-) мг/л
|
N
|
n
|
P,
%
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
0-0,1
|
50
|
50
|
100
|
0-0,1
|
50
|
50
|
100
|
|
0,1-0,15
|
50
|
50
|
100
|
0,1-0,2
|
50
|
50
|
100
|
|
0,15-0,23
|
50
|
50
|
100
|
0,2-0,3
|
50
|
50
|
100
|
|
0,23-0,34
|
50
|
50
|
100
|
0,3-0,5
|
50
|
50
|
100
|
|
0,34-0,51
|
50
|
46
|
92
|
0,5-0,8
|
50
|
50
|
100
|
|
0,51-0,76
|
50
|
18
|
36
|
0,8-1,3
|
50
|
46
|
92
|
|
0,76-1,14
|
50
|
21
|
42
|
1,3-2,1
|
50
|
7
|
14
|
|
1,14-1,71
|
50
|
35
|
70
|
|
|
|
|
Таблица 2.21 Частоты визуального определения
кобальта (II) в виде
комплексов с НРС в желатиновой матрице для разных концетрационных интервалов
|
Интервал
c(Co2+), мг/л
|
N
|
n
|
P,
%
|
Интервал
c(Co2+), мг/л
|
N
|
n
|
P,
%
|
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
0-0,3
|
50
|
49
|
98
|
0-0,3
|
50
|
50
|
100
|
|
0,3-0,6
|
50
|
50
|
100
|
0,3-0,9
|
50
|
50
|
100
|
|
0,6-1,2
|
50
|
46
|
92
|
0,9-2,7
|
50
|
50
|
100
|
|
1,2-2,4
|
50
|
47
|
94
|
2,7-8,1
|
50
|
49
|
98
|
|
2,4-4,8
|
50
|
48
|
96
|
|
|
|
|
|
4,8-9,6
|
50
|
47
|
94
|
|
|
|
|
|
Интервал
c(Co2+), мг/л
|
N
|
n
|
P,
%
|
Интервал
c(Co2+), мг/л
|
N
|
n
|
P,
%
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
0-0,3
|
50
|
48
|
96
|
0-0,3
|
50
|
48
|
96
|
|
0,3-0,45
|
50
|
31
|
62
|
0,3-0,4
|
50
|
16
|
31
|
|
0,45-0,68
|
50
|
33
|
65
|
0,4-0,7
|
50
|
25
|
50
|
|
0,68-1,01
|
50
|
40
|
80
|
0,7-1,1
|
50
|
48
|
96
|
|
1,01-1,52
|
50
|
23
|
46
|
1,1-1,8
|
50
|
46
|
92
|
|
1,52-2,28
|
50
|
48
|
96
|
1,8-2,9
|
50
|
48
|
96
|
|
2,28-3,42
|
50
|
43
|
85
|
2,9-4,7
|
50
|
48
|
96
|
|
3,42-5,13
|
50
|
35
|
69
|
4,7-7,6
|
50
|
44
|
88
|
|
5,13-7,70
|
50
|
50
|
100
|
|
|
|
|
Исходя из данных по частотам обнаружения
различий интенсивности окраски соседних точек тест-образцов цветовых шкал для
определения ионов кобальта, железа и нитрит-ионов видно, что для каждой из
систем наиболее работоспособными оказались шкалы, с конецентрационным шагом,
подчиняющимся геометрической прогрессии с коэффициентом q=2;
3. Для этих шкал между реперными точками каждого концентрационного интервала
более 90% наблюдателей видели различие в интенсивности окрашивания таблеток
(пленок). Таким образом, можно сделать вывод, что для всех исследованных нами
систем для тестового анализа с визуальной индикацией пригодны шкалы с
коэффициентом 2 и 3.
Результаты нахождения характеристик цвета
тест-образцов
Согласно методикам были найдены цветометрические
характеристики желатиновых пленок и ППУ соответственно. Пример расчета для
прозрачных (желатиновых пленок) и непрозрачных (ППУ) сред представлены в табл.
2.22-2.23
Таблица 2.22 Значения координат X, Y, Z, L, A, B
и общее цветовое различие ΔΕ для
комплекса Co2+ с NRS в желатиновой пленке
|
c(Сo2+) мг/л
|
X
|
Y
|
Z
|
A
|
B
|
L
|
ΔE
|
|
0,3
|
0,91
|
0,98
|
0,85
|
-1,57
|
3,97
|
8,79
|
0,88
|
|
0,9
|
0,92
|
0,97
|
0,84
|
-1,41
|
3,93
|
8,75
|
0,9
|
|
2,7
|
0,81
|
0,85
|
0,56
|
-0,75
|
7,1
|
7,64
|
3,14
|
|
8,1
|
0,72
|
0,71
|
0,32
|
1,37
|
10,31
|
6,23
|
7,21
|
Таблица 2.23 Значения координат X,
Y, Z, L, A, B и общее цветовое различие ΔΕ для
комплекса 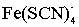 на ППУ
на ППУ
|
c(Fe3+)
мг/л
|
X
|
Y
|
Z
|
A
|
B
|
ΔΕ
|
|
0,02
|
97,9
|
84,5
|
28,1
|
8,4
|
4,1
|
93,7
|
4,3
|
|
0,04
|
84,5
|
70,8
|
23,3
|
12,5
|
4,5
|
87,4
|
8,5
|
|
0,08
|
78,3
|
64,8
|
21,4
|
14,1
|
4,2
|
84,4
|
12,8
|
|
0,16
|
73,8
|
58,5
|
17,5
|
19,9
|
9,2
|
81,0
|
18,1
|
|
0,32
|
70,8
|
55,4
|
16,8
|
19,4
|
8,6
|
79,2
|
22,4
|
|
0,64
|
57,6
|
42,4
|
11,9
|
27,5
|
11,3
|
71,2
|
32,3
|
|
1,28
|
61,1
|
43,5
|
7,9
|
32,2
|
30,3
|
72,0
|
42,3
|
Для разных шкал каждой из систем были найдены
величины общего цветового различия, которые в дальнейшем использовались для
оценки равноконтрастности шкал. Значения ΔΕ для
тест-образцов каждой из систем представлены в табл. 2.24-2.27.
Таблица 2.24 Значения общего
цветового различия ΔЕ для
комплексов 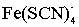 на ППУ
на ППУ
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
C(Fe3+),мг/л
|
ΔЕ
|
C(Fe3+),мг/л
|
ΔЕ
|
|
0,02
|
4
|
0,02
|
4
|
|
0,04
|
8
|
0,06
|
12
|
|
0,08
|
12
|
0,18
|
19
|
|
0,16
|
18
|
0,54
|
27
|
|
0,32
|
22
|
1,62
|
43
|
|
0,64
|
28
|
|
|
|
1,28
|
42
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
C(Fe3+),мг/л
|
ΔЕ
|
C(Fe3+),мг/л
|
ΔЕ
|
|
0,02
|
4
|
0,02
|
2,3
|
|
0,03
|
6
|
0,03
|
5
|
|
0,045
|
9
|
0,05
|
7
|
|
0,068
|
11
|
0,08
|
12,4
|
|
0,101
|
13
|
0,13
|
16,5
|
|
0,152
|
19
|
0,21
|
19,1
|
|
0,228
|
23
|
0,34
|
22,4
|
|
0,342
|
29
|
0,55
|
25,1
|
|
0,513
|
32
|
0,89
|
29,9
|
|
0,77
|
36
|
|
|
Таблица 2.25 Значения общего
цветового различия ΔЕ для
комплексов 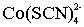 на ППУ
на ППУ
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
C(Co2+),мг/л
|
ΔЕ
|
C(Co2+),мг/л
|
ΔЕ
|
|
0,03
|
4
|
0,03
|
4
|
|
0,06
|
6
|
0,09
|
8
|
|
0,12
|
10
|
0,27
|
14
|
|
0,24
|
14
|
0,81
|
30
|
|
0,48
|
20
|
2,3
|
45
|
|
0,96
|
36
|
|
|
|
1,92
|
48
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
C(Co2+),мг/л
|
ΔЕ
|
C(Co2+),мг/л
|
ΔЕ
|
|
0,03
|
4
|
0,03
|
4
|
|
0,045
|
5
|
0,04
|
5
|
|
0,0675
|
6
|
0,07
|
6
|
|
0,101
|
8
|
0,11
|
8
|
|
0,152
|
11
|
0,18
|
10
|
|
0,228
|
13
|
0,29
|
14
|
|
0,342
|
18
|
0,47
|
19
|
|
0,513
|
22
|
0,76
|
28
|
|
0,769
|
24
|
1,23
|
39
|
|
1,15
|
40
|
1,99
|
47
|
|
1,73
|
44
|
|
|
Таблица 2.26 Значения общего цветового различия ΔЕ
тест-образцов шкал для определения содержания нитрит - ионов с помощью ППУ
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
C(NO2-),мг/л
|
ΔЕ
|
C(NO2-),мг/л
|
ΔЕ
|
|
0,1
|
4
|
0,1
|
4
|
|
0,2
|
13
|
0,3
|
17
|
|
0,4
|
19
|
0,9
|
24
|
|
0,8
|
23
|
2,7
|
27
|
|
1,6
|
27
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
C(NO2-),мг/л
|
ΔЕ
|
C(NO2-),мг/л
|
ΔЕ
|
|
0,1
|
4
|
0,1
|
4
|
|
0,15
|
9
|
0,2
|
12
|
|
0,23
|
14
|
0,3
|
17
|
|
0,34
|
17
|
0,5
|
20
|
|
0,51
|
20
|
0,8
|
23
|
|
0,76
|
23
|
1,3
|
26
|
|
1,14
|
25
|
2,1
|
27
|
|
1,71
|
27
|
|
|
Таблица 2.27 Значения общего цветового различия ΔЕ
для комплексов Co2+
c
NRS в желатиновой
матрице
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
c(Co2+), мг/л
|
ΔЕ
|
c(Co2+), мг/л
|
ΔЕ
|
|
0,3
|
0,88
|
0,3
|
0,88
|
|
0,6
|
0,91
|
0,9
|
0,9
|
|
1,2
|
0,99
|
2,7
|
3,14
|
|
2,4
|
2,45
|
8,1
|
7,21
|
|
4,8
|
4,66
|
|
|
|
9,6
|
6,47
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
с шагом q=fib
|
|
c(Co2+), мг/л
|
ΔЕ
|
c(Co2+), мг/л
|
ΔЕ
|
|
0,3
|
0,88
|
0,3
|
0,88
|
|
0,45
|
0,9
|
0,4
|
1,03
|
|
0,68
|
1,12
|
0,7
|
1,05
|
|
1,01
|
1,2
|
1,1
|
1,1
|
|
1,52
|
1,26
|
1,8
|
1,6
|
|
2,28
|
2,45
|
2,9
|
3,04
|
|
3,42
|
3,64
|
4,7
|
4,92
|
3,81
|
7,6
|
7,43
|
|
7,7
|
7,2
|
|
|
Сопоставление визуального и инструментального
определения аналитов с использованием цветовых шкал с разными коэффициентами
Чтобы выбрать оптимальную шкалу которая будет
соответствовать необходимым требованиям (равноконтрастность, Р>90%),
для удобства мы объединили результаты определения вероятности
определения ионов в каждом из концентрационных интервалов с значениями
разностей общего цветового различия соседних точек на цветовых шкалах. Эти
результаты представлены в табл. 2.28-2.31.
Таблица 2.28 Сопоставление P(C)
и разностей общего цветового различия определения железа (ІІІ)
для цветовых шкал с разными коэффициентами
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
Интервал
c(Fe3+)
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(Fe3+)
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,02
|
100
|
4
|
0-0,02
|
100
|
4
|
|
0,02-0,04
|
92
|
4
|
0,02-0,06
|
100
|
8
|
|
0,04-0,08
|
93
|
4
|
0,06-0,18
|
98
|
7
|
|
0,08-0,16
|
95
|
6
|
0,18-0,54
|
100
|
8
|
|
0,16-0,32
|
98
|
4
|
0,54-1,62
|
100
|
16
|
|
0,32-0,64
|
100
|
6
|
|
|
|
|
0,64-1,28
|
100
|
14
|
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
Интервал
c(Fe3+)
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(Fe3+)
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,02
|
100
|
4
|
0-0,02
|
100
|
4
|
|
0,02-0,03
|
56
|
2
|
0,02-0,03
|
70
|
3
|
|
0,03-0,045
|
46
|
3
|
0,03-0,05
|
63
|
2
|
|
0,045-0,068
|
44
|
2
|
0,05-0,08
|
85
|
5
|
|
0,068-0,101
|
72
|
2
|
0,08-0,13
|
89
|
4
|
|
0,101-0,152
|
94
|
6
|
0,13-0,21
|
86
|
3
|
|
0,152-0,228
|
96
|
4
|
0,21-0,34
|
87
|
3
|
|
0,228-0,342
|
90
|
6
|
0,34-0,55
|
85
|
3
|
|
0,342-0,513
|
89
|
3
|
0,55-0,89
|
91
|
5
|
|
0,513-0,77
|
88
|
4
|
|
|
|
Таблица 2.29 Сопоставление P(C)
и разностей общего цветового различия определения кобальта (ІІ)
в виде тиоцианатных комплексов,сорбированных на ППУ, для
цветовых шкал с разными коэффициентами
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
Интервал
c(Со2+)
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(Со2+)
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,03
|
95
|
|
0-0,03
|
95
|
|
|
0,03-0,06
|
94
|
2
|
0,03-0,09
|
97
|
4
|
|
0,06-0,12
|
90
|
4
|
0,09-0,27
|
100
|
6
|
|
0,12-0,24
|
91
|
4
|
0,27-0,81
|
100
|
16
|
|
0,24-0,48
|
97
|
6
|
0,81-2,3
|
96
|
15
|
|
0,48-0,96
|
96
|
16
|
|
|
|
|
0,96-1,92
|
95
|
12
|
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
с Фибоначчи
|
|
Интервал
c(Со2+)
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(Со2+)
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,03
|
95
|
|
0-0,03
|
80
|
|
|
0,03-0,045
|
45
|
1
|
0,03-0,04
|
52
|
1
|
|
0,045-0,0675
|
48
|
1
|
0,04-0,07
|
60
|
1
|
|
0,0675-0,101
|
80
|
2
|
0,07-0,11
|
65
|
2
|
|
0,101-0,152
|
75
|
3
|
0,11-0,18
|
80
|
2
|
|
0,152-0,228
|
70
|
2
|
0,18-0,29
|
90
|
4
|
|
0,228-0,342
|
68
|
5
|
0,29-0,47
|
92
|
5
|
|
0,342-0,513
|
65
|
4
|
0,47-0,76
|
93
|
9
|
|
0,513-0,769
|
65
|
2
|
0,76-1,23
|
95
|
11
|
|
0,769-1,15
|
92
|
16
|
1,23-1,99
|
91
|
8
|
|
1,15-1,73
|
85
|
4
|
|
|
|
Таблица 2.30 Сопоставление P(C)
и разностей общего цветового различия определения нитрит-иона на ППУ для
цветовых шкал с разными коэффициентами
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
Интервал
c(NO2-), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(NO2-), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,1
|
100
|
4
|
0-0,1
|
100
|
4
|
|
0,1-0,2
|
100
|
9
|
0,1-0,3
|
100
|
13
|
|
0,2-0,4
|
100
|
6
|
0,3-0,9
|
100
|
7
|
|
0,4-0,8
|
100
|
4
|
0,9-2,7
|
62
|
3
|
|
0,8-1,6
|
100
|
4
|
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
Фибоначчи
|
|
Интервал
c(NO2-), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(NO2-), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,1
|
100
|
4
|
0-0,1
|
100
|
4
|
|
0,1-0,15
|
100
|
5
|
0,1-0,2
|
100
|
8
|
|
0,15-0,23
|
100
|
5
|
0,2-0,3
|
100
|
5
|
|
0,23-0,34
|
100
|
3
|
0,3-0,5
|
100
|
3
|
|
0,34-0,51
|
92
|
3
|
0,5-0,8
|
100
|
3
|
|
0,51-0,76
|
36
|
3
|
0,8-1,3
|
92
|
3
|
|
0,76-1,14
|
42
|
2
|
1,3-2,1
|
14
|
1
|
|
1,14-1,71
|
70
|
2
|
|
|
|
Таблица 2.31 Сопоставление P(C)
и разностей общего цветового различия определения кобальта (ІІ)
в желатиновой пленке для цветовых шкал с разными коэффициентами
|
Шкала
с шагом q=2
|
Шкала
с шагом q=3
|
|
Интервал
c(Co2+), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(Co2+), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,3
|
98
|
0
|
0-0,3
|
100
|
0
|
|
0,3-0,6
|
100
|
0,03
|
0,3-0,9
|
100
|
0,02
|
|
0,6-1,2
|
92
|
0,08
|
0,9-2,7
|
100
|
2,24
|
|
1,2-2,4
|
94
|
1,46
|
98
|
4,07
|
|
2,4-4,8
|
96
|
2,21
|
|
|
|
|
4,8-9,6
|
94
|
1,81
|
|
|
|
|
Шкала
с шагом q=1,5
|
Шкала
с шагом q=fib
|
|
Интервал
c(Co2+), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
Интервал
c(Co2+), мг/л
|
Р,%
|
ΔЕi+1-ΔEi
|
|
0-0,3
|
96
|
0
|
0-0,3
|
96
|
0
|
|
0,3-0,45
|
62
|
0,02
|
0,3-0,4
|
31
|
0,15
|
|
0,45-0,68
|
65
|
0,22
|
0,4-0,7
|
50
|
0,02
|
|
0,68-1,01
|
80
|
0,08
|
0,7-1,1
|
96
|
0,05
|
|
1,01-1,52
|
46.
|
0,06
|
1,1-1,8
|
92
|
0,5
|
|
1,52-2,28
|
96
|
1,19
|
1,8-2,9
|
96
|
1,44
|
|
2,28-3,42
|
85
|
1,19
|
2,9-4,7
|
96
|
1,88
|
|
3,42-5,13
|
69
|
0,17
|
4,7-7,6
|
88
|
2,51
|
|
5,13-7,70
|
100
|
3,39
|
|
|
|
Из полученных значений общего цветового различия
для каждого тест-образца, мы нашли разности между соседними точками. Эти
значения сопоставляли с результатами визуальной оценки (вероятность обнаружения
различия в интенсивности соседних точек).
Для тест-системы для определения
железа в виде комплекса 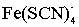 ,
сорбированного на ППУ, оказалось, что для шкалы с коэффициентом 2 значения
разностей ΔЕ между
реперными точками оказались равными ≈4 в в интервале концентраций железа
(III) 0,02-0,064
мг/л; для шкалы с коэффициентом 3 разности ΔЕ ≈7 в интервале
концентраций 0,02-0,54 мг/л. Выше указанных концентраций наблюдается большой
скачек интенсивности окрашивания таблеток. Для шкал с шагом 1,5 и Фибоначчи
разности ΔЕ
приблизительно одинаковы и равны от 2 до 4 единиц.
,
сорбированного на ППУ, оказалось, что для шкалы с коэффициентом 2 значения
разностей ΔЕ между
реперными точками оказались равными ≈4 в в интервале концентраций железа
(III) 0,02-0,064
мг/л; для шкалы с коэффициентом 3 разности ΔЕ ≈7 в интервале
концентраций 0,02-0,54 мг/л. Выше указанных концентраций наблюдается большой
скачек интенсивности окрашивания таблеток. Для шкал с шагом 1,5 и Фибоначчи
разности ΔЕ
приблизительно одинаковы и равны от 2 до 4 единиц.
Исходя из полученных данных мы
определили, что более 90% наблюдателей лучше различали по цвету соседние точки
при разности (ΔЕi+1-ΔEi)≥4.
Это значение можно признать минимальным для визуального цветоразличия оттенков
красного цвета на белом фоне бумаги.
При определении кобальта в виде
тиоцианатных комплексов, сорбированных на ППУ наблюдается подобная ситуация.
Равноконтрастность шкалы с коэффициентом 2 соблюдается в концентрационном
интервале 0,03-0,048 мг/л (ΔЕi+1-ΔE≈4)i, затем
наблюдается скачек в значениях ΔЕi+1-ΔEi, хотя во всем
концентрационном интервале, охватываемом этой шкалой, почти все наблюдатели
(Р>90%) видели различие в интенсивности между соседними точками шкалы. Шкалы
с коэффициентом 1,5 и с шагом Фибоначчи являются плохо воспроизводимыми и кроме
того, несмотря на их равноконтрастность в довольно широком концентрационном
интервале их нельхя использовать для визуального тестового анализа (Р≈45-75%).
Таким образом, минимальным значением для визуального цветоразличия оттенков
голубого цвета на белом фоне можно принять значение (ΔЕi+1-ΔEi,)≈4.
При определении нитрит-иона
устойчивая желтая окраска образуется за счет хемосорбции, в отличие от других
изученных систем (физическая иммобилизация). Как видно из приведенной таблицы,
все исследуемые шкалы вполне работоспособны, за исключением шкалы с
коэффициентом 1.5, которая не подходит для определения нитрит-ионов с
концентрациями выше 0.5 мг/л. Хорошо различимые точки на шкале с коэффициентом
2 характеризуются разностью (ΔЕi+1-ΔEi,) ≈
4÷6; на шкале с коэффициентом 3 - (ΔЕi+1-ΔEi,) ≈
8÷12; на шкале с коэффициентом 1.5 - (ΔЕi+1-ΔEi,) ≈ 4; на шкале Фибоначчи - (ΔЕi+1-ΔEi,) ≈ 5.
При использовании желатинових
пленок для определения кобальта (ІІ) в виде комплексов с НРС, значения
общего цветового различия оказались очень низкими. В концентрационном интервале
0,3-2,4 мг/л применения инструментального метода индикации оказался
неоправданным, так как при расчете значения общего цветового различия для точек
данного интервала мы получаем значения приблизительно одинаковые. Но для
визуального тестового анализа этот интервал можно использовать. При визуальной
оценке было выявлено, что наиболее работоспособными также оказались шкалы с
коэффициентами 2 и 3, но для инструментального анализа можно пользоваться этими
шкалами только при содержании кобальта больше 2 мг/л, что сужает возможности
применения метода цветометрии к данной системе.
Таким образом, при исследовании
четырех систем мы доказали, что нельзя безоговорочно применять критерий ΔЕ=10 в
качестве универсального. Это значение необходимо экспериментально находить и
подбирать индивидуально для каждой реакции в зависимости от сорбента, цвета
окрашиваемого комплекса, условий определения, цвета фона и т.п.
Для всех четырех систем оказались
рабочими шкалы с коэффициентами 2 и 3, что говорит о том, что использование
геометрической прогрессии при построении шкал предпочтительнее арифметичсской и
ряда Фибоначчи.
2.4 Техника безопасности
В работе в химической лаборатории сотрудники
должны соблюдать правила техники безопасности, чтобы не допускать несчастных
случаев вследствие тепловых и химических ожогов, отравлений ядовитыми
веществами, поражения электрическим током, механических ранений, порезов.
При попадании кислоты на кожу или в глаза
необходимо смыть ее большим количеством воды.
При работе с вредными веществами эксперимент
проводят под тягой с опущенными стеклами. Используемые в работе приборы должны
быть заземлены. Все операции по проведению анализа выполняют в соответствии с
основными правилами безопасности в химической лаборатории.
ВЫВОДЫ
1. Выявлены интервалы ненадежности и
пределы определения ионов для исследуемых тест систем
2. На основе метода цветометрии и
визуального восприятия окраски тест-образцов из четырех цветовых шкал каждой из
исследуемых тест систем выбраны шкалы с коэффициентами геометрической
прогрессии q = 2 и q
= 3
. Установлено, что минимальное значение
шага ΔE
на шкале для 90%-го цветоразличия оттенков продукта тест-реакции на белом фоне
бумаги не равно 10 и это значение индивидуально для каждой тест-системы
СПИСОК ЛИТЕРАТУРЫ
1. Золотов Ю.А. Химический
анализ без лабораторий: тест-методы // Вестник
российской академии наук. - 1997. - Т.
67,№6. - С. 508 - 513.
2. Савин С.Б., Дедкова В.П.,
Швоева О.П. Сорбционно-спектроскопические и тест-методы определения ионов
металлов на твердой фазе ионообменных материалов // Успехи химии. - 2000. -
Т.69,№3.
- С.203-217.
3. Золотов Ю.А., Иванов В.М.,
Амелин В.Г. Химические тест-методы анализа. М.: Едиториал УРСС. - 2002.
-
304с.
. Евгеньев М.И
Тест-методы и экология // Соросовский образовательный журнал. - 1999. -№11. -
С. 29-34
. Амелин В.Г., Иванов В.
М. // Журнал аналитической химии, 2000, т.55, № 4, с. 411.
6. Островская В.М., Запорожец
О.А., Будников Г.К., Чернавская Н.М. Вода. Индикаторные системы. - М.:Винити,
Эконикс, 2002. - 226с
. Дмитренко С. Г., Золотов Ю.
А. . Пенополиуретаны в химическом анализе: сорбция различных веществ и её
аналитическое применение // Успехи химии. - 2002.
- Т.71. №2. - с.180 - 197.
8. Никитина Н. А. Тест-методы
химического анализа с визуальной индикацией: метрологическое обеспечение, новые
тест-системы. Диссертация на соискание учёной степени кандидата химических
наук. Харьков, 2006.
. Михайлов О. В.
Низкотемпературный темплантный синтез в метилгексацианоферратных желатин-иммобилизованных
матричних системах // Рос. Химический журнал. - 2000. №3. - с.70-79.
10. Холін Ю.В. Кількісний
фізико-хімічний аналіз комплексоутворення у гетерогенних системах. - Харків:
ХНУ, 2002. - 38с.
. Холин Ю.В., Никитина Н.А.,
Пантелеймонов А.В., Решетняк Е.А., Бугаевский А.А., Логинова Л.П.
Метрологические характеристики методик обнаружения с бинарным откликом. - Х.:
Тимченко, 2008. - с.21
. Комарь Н.П. Основы
качественного химического анализа. Харьков: ХГУ, 1955. - 447 с
. Решетняк Е.А., Никитина Н.А.,
Логинова Л.П., Островская В.М. Предел обнаружения в тестовом анализе. Влияющие
факторы
//
Журн.
аналит.
химии.
- 2005. - Т.60, № 10. - С. 1102 - 1109
. Решетняк Е.А., Никитина
Н.А., Холин Ю.В., Светлова Н.В., Островская В.М. О достоверной оценке метрологических
характеристик тестового анализа // Вестн. Харьк. нац. ун-та. Сер. Химия. -
2003. - Вып. 10(33), № 596. - С. 90-97.
15. Лазарева А.М.,
Харламова И.П. Справочник
химика-аналитика.
-
М.:
Металлургия. - 1976. - 184с.
. Национальный стандарт
Российской Федерации ГОСТ Р 52361-2005 "Контроль объекта аналитический.
Термины и определения". М.: ИПК "Издательство стандартов", 2005.
. Рекомендации по
метрологической оценке результатов определения // Журн. аналит. химии. - 1978.
- 33, № 3. - С. 607-609.
. Бланк А.Б. О нижней границе
определяемых содержаний и пределе обнаружения // Журн. аналит. химии. - 1979. -
34, № 1. - С. 5-9.
. Островская В.М., Решетняк
Е.А., Никитина Н.А., Пантелеймонов А.В., Холин Ю.В. Тест-метод определения
металлов индикаторной бумагой и его метрологические характеристики // Журн.
аналит. химии. - 2004. - 59, № 10. - С. 1101-1108.
. Гармаш А.В. Введение в
спектроскопические методы анализа. Оптические методы анализа. М.:РАН - 1995. -
38с.
21. Качин
С.В.,
Козель Н.А., Сагалаков С.А., Калякина О.П., Кононова О.Н. Методы твердофазной
спектроскопии в анализе воздуха рабочей зоны //Вестн. Красноярск. Гос. Ун-та.
Серия ест.наукри - 2003.- №2. - с 115-122.
. Линник Р.П., Линник П.Н.,
Запорожец О.А. Методы исследования сосуществующих форм металлов в природных
водах (Обзор) // Методы и объекты химического анализа - 2006. - т. №1- с.4-26.
. Гурьева Р.Ф., Саввин С.Б.
Избирательное сорбционно спектроскопическое определение нанограммовых количеств
ванадия (IV) и ванадия
(V) // Журн. аналит.
химии. - 2001 - 56, №10. - с. 1032-1036.
24. Табенська Т.В.,
Запопрожець О.А., Боряк А.К., Возненко І.В.,
Жукова К.М. Сорбція кобальту (III)силікагелем
,модифікованим
1-нітрозо-2-нафтолом,
та її аналітичне застосування //
Укр.хим.журн.-2000.-66,№1.-с.41-44.
25. Teixeira L.S.G., Costra
A.S.C., Assis J.C.R., Ferreira S.L.C., Korn M. Solid phase spectrophotometry
for the determination of cobalt in pharmaceutical preparations // Microchim.
Acta. - 2001. -137. - p. 29-33
26. Иванов В.М., Кочелаева Г.А.
Сорбционно цветометрическое и тест-определение ртути // Вестн.Моск.ун-та. Сер.2
Химия.-2001-42,№1-с.17-19.
. Иванов В.М., Кочелаева Г.А.
Сорбционно цветометрическое и тест-определение меди в водах //
Вестн.Моск.ун-та. Сер.2 Химия.-2001-42,№2-с.103-105.
28. Bilba D., Paduraru C.,
Tofan L. Determination of trace amounts of palladium (II) by solid phase
spectrophotometry // Microchim. Acta. - 2004. - 144. - p 97-101.
29. Иванов В.М., Кузнецова
О.В. Химическая цветометрия: возможности метода, области применения и
перспективы // Успехи химии. - 2001. - Т. 70, № 5. - С. 411-428.
30. Кириллов Е.А.
Цветоведение. - М.: Легпромбытиздат., 1987. - 128
31. Джадд Д., Вышецки Г.
Цвет в науке и технике. -М.: Мир., 1978 .- 529 с
32. Луизов А.В. Цвет и
свет. -Ленинград.: Энергоатомиздат., 1989 .- 256 с
33. Rahman M., Fujinaga K.
A Simple in situ Visual and Tristimulus Colorimetric Method for the
Determination of Trace Arsenic in Environmental Water after Its Collection on a
Mercury (II) - Impregnated Paper // Analytical Science. - 2004. - Vol. 20. -
P. 865-873.
. Pitschmann V., Koblina
Z. A Simple in situ Visual and Tristimulus Colorimetric Method for the
Determination of Diphosgene in Air // J. Serb. Chem. Soc. - 2007. - Vol. 72,
№10. - P.
1031-1037.
35. Шишкин Ю.Л., Дмитриенко
С.Г., Медведева О.М., Бадакова С.А., Пяткова Л.Н. Применение сканера и
компьютерных программ цифровой обработки изображений для количественного
определения сорбированих веществ // ЖАХ. - 2004. - Т. 59, № 2. - С. 119-124.
36. Герасимов А.В.
Применение программной обработки сканированных изображений хроматограмм в
количественной планарной хроматографии // ЖАХ. - 2004. - Т. 59, № 4. - С.
392-397.
37. .
http://www.printer-publisher.ruprint.ru/stories/24/251_1.php
. Иванов
В. М., Морозко С. А., Сабри Массуд Тест-методы в аналитической химии. Реакция
на уран (VI) и его
определение методом спектроскопии диффузного отражения // ЖАХ. -
1995. - Т. 50, № 12. - С.1280-1287.
. Иванов
В. М., Морозко С. А Тест-методы в аналитической химии. Раздельное определение
меди и цинка методом цветометрии. // ЖАХ. - 1997. - Т. 52, № 8. -
С.858-865.
40. Унифицированные методы анализа вод. /Под
ред. Ю.Ю. Лурье.-2-е изд. перераб. и доп.-М.:Химия,1973.-440с.
41. Лурье Ю.Ю. Справочник по аналитической
химии.- 3-е изд. - М.: Химия,1967.-390с.
. Комарь
Н.П Особенности и возможности колориметрического и спектрофотометрического
анализа // В сб. Труды комиссии по аналитической химии. - М.: Изд-во АН СССР,
1958. -Т.VIII (XI). C. 21-51
. Бабко
А.К, Пилипенко А.Т. Фотометрический анализ. Общие сведения и аппаратура.-М.:
Химия, 1968. - 388 с.)
. Иванов
В.М., Морозко С.А., Качин С.В.. Тест-методы в аналитической химии. Обнаружение
и определение кобальта иммобилизированным 1-(2-пиридилазо)-2-нафтолом // журн.
Аналит. Химии.-1994. -49, №8.- с. 857-861
45. С.Г. Дмитриенко.
Пенополиуретаны в химическом анализе: сорбция различных веществ и её
аналитическое применение. Автореферат диссертации на соискание учёной степени
доктора химических наук. М., 2001.