|
Растворитель
|
254 нм
|
313 нм
|
436 нм
|
|
CHCl3
|
2.6
|
2.4
|
0.3
|
|
CHCl3-EtOH
(150: 1)
|
3.6
|
3.0
|
0.4
|
|
CHCl3-EtOH
(10: 1)
|
3.3
|
2.4
|
0.2
|
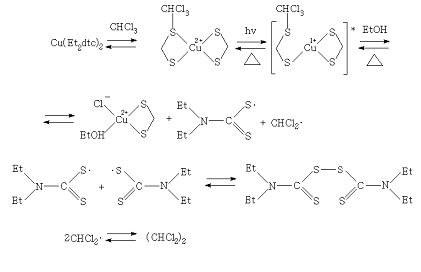
Схема 1
Авторы [6,7] объяснили механизм фотохимических реакций
следующим образом. Под действием излучения происходит перенос электрона с
экваториально связанного атома S лиганда на металл, с разрывом одной из связей Cu - S. Разрыв этой связи
облегчает разрыв второй связи лиганда с металлом. Внутримолекулярный перенос
электрона подтверждается независимостью квантового выхода от начальной
концентрации комплекса. Образовавшийся Cu (I) [Et2dtc] далее окисляется CHCl3 до Cu (II) [Et2dtc] Cl [5,8] (Схема 1).
Предполагается, что ввиду слабых акцепторных свойств, CHCl3 присоединяется к атому
серы лиганда [9] и первый акт фотохимической реакции протекает именно в этом
комплексе. Появление полосы поглощения на 284 нм, соответствующей
тетраметил-тиурамдисульфиду [10,11], позволяет предположить, что в ходе реакции
образуются дитиокарбаматные радикалы, которые в дальнейшем рекомбинируют с
образованием тиурамдисульфида.
Координация молекулы спирта к иону металла в комплексе Cu [Et2dtc] ClEtOH осуществляется в
экваториальной плоскости. В отсутствии этанола комплекс Cu [Et2dtc] Cl образует димер [12,13],
что подтверждается отсутствием ЭПР сигнала у продукта, имеющего полосу
поглощения на 350 нм.
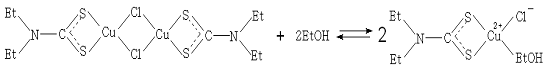
При добавлении небольших количеств этанола к раствору,
содержащему димер (после облучения), обнаружено появление полосы поглощения на
406 нм, принадлежащей комплексу Cu [Et2dtc] ClEtOH (схема ниже). Предполагается [14], что имеет
место реакция:
В данной работе для исследования механизма первичных
фотохимических процессов и природы промежуточных частиц использован метод
лазерного импульсного фотолиза с наносекундным временным разрешением.
фотолиз дитиокарбонатный медь антиоксидант
2.
Экспериментальная часть
В работе использовали оптическую спектроскопию и лазерный
импульсный фотолиз при комнатной температуре. Стационарное облучение проводили
импульсами неодимового лазера (355 нм, третья гармоника) или излучением ртутной
лампы высокого давления ДРШ-500. Для выделения отдельных линий использовали
наборы стеклянных фильтров. Оптические спектры регистрировали с помощью
спектрофотометра HP 8354 фирмы "Hewlett Packard" в кварцевой кювете с длиной оптического
пути 1 см.
Для изучения спектров и кинетики активных промежуточных
частиц использовали метод лазерного импульсного фотолиза. В качестве источника
возбуждающего излучения использовали импульсы третьей гармоники (355 нм)
неодимового лазера (YAG: Nd3+) с длительностью 6-7 нс и энергией около 30 мДж. Лазерное
излучение фокусировали на отверстие с площадью 0.03 см2, через
которое пропускали и зондирующий свет от ксеноновой лампы ДКСШ-150. На эту
лампу, горящую в режиме дежурной дуги, на время эксперимента накладывается
импульс тока (~150 A) длительностью около 1 мс, что увеличивает интенсивность
зондирующего света на два порядка.
Обработка полученных кинетических кривых осуществлялась с
помощью программ ANALISYS, SPAN и Microcal Origin 7.5 Каждая кинетическая кривая представляет собой
результат от 5 до 30 накоплений, что позволяло получать отклонение
экспериментальных результатов на уровне 10-20% от величины среднего.
Дитиокарбаматный комплекс меди был синтезирован, очищен и
проанализирован в лаборатории координационных соединений Института
неорганической химии СО РАН под руководством проф. С.В. Ларионова. В качестве
растворителей использовались CH3CN и CCl4, очищенные перегонкой, а также CCl4 (ос. ч.), очистка
которого не проводилась.
3. Результаты
и обсуждение
3.1
Стационарный фотолиз Cu [Et2dtc] 2 в CCl4
Стационарный фотолиз раствора комплекса Cu [Et2dtc] 2 в CCl4 представлен на Рис.3.1 и
Рис.3.2 В первом случае использовано лазерное излучение большой мощности (~1025
квантов/см2с), во втором - излучение ртутной лампы, мощность которого
примерно на 8 порядков меньше. Изменение спектров в обоих случаях одинаково,
что указывает на отсутствие двухквантовых процессов.
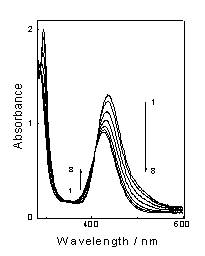
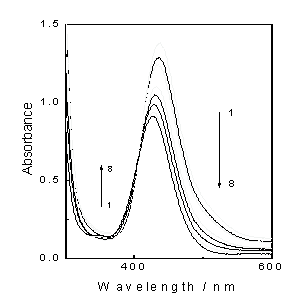
Рис.3.2 Изменение оптического спектра комплекса Cu [Et2dtc] 2 (1.1*10-4
М) в CCl4 при стационарном фотолизе в кювете 1 см излучением ртутной лампы
(365 нм).1-8 через 0, 10, 20, 40, 70,130, 250, 430 с после начала облучения.
При фотолизе наблюдается уменьшение интенсивности исходной
полосы поглощения комплекса с формированием новой менее интенсивной полосы с
максимумом на 425 нм с сохранением изобестической точки на 410 нм. Аналогичное
изменение спектра представлено в работе [5] при фотолизе комплекса Cu [Et2dtc] 2 в
хлороформе. Новая полоса на 425 нм по предположению авторов [5] принадлежит
комплексу Cu [Et2dtc] Cl. Можно отметить, что полоса димера на 350 нм, обнаруженная в
более поздней работе [6], в нашем случае не образуется. При более длительном
облучении изобестическая точка исчезает, однако полоса поглощения на 350 нм не
появляется (Рис.3.2).
На Рис.3.3 представлена зависимость относительного квантового
выхода от концентрации CCl4 при разбавлении раствора ацетонитрилом.
Уменьшение концентрации приводит к уменьшению квантового выхода, что указывает
на участие молекулы четыреххлористого углерода в первичных фотохимических
процессах.
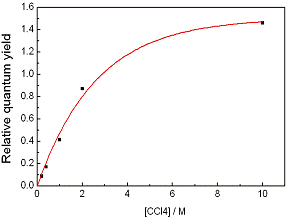
Рис.3.3 Зависимость относительного квантового выхода от
концентрации CCl4 для раствора Cu [Et2dtc] 2
При небольшом времени жизни возбужденного комплекса (t
<< R2/D ~ 1 нс) для определения характерного расстояния
переноса электрона на молекулу CCl4 (акцептор) можно использовать так называемую
модель "чёрной сферы", которая была предложена Перреном для
определения тушения фосфоресценции по обменному механизму. Отметим, что как при
переносе электрона, так и передаче энергии по обменному механизму требуется
перекрывание орбиталей партнеров, что обеспечивает экспоненциальную зависимость
константы скорости этих процессов от расстояния между донором и акцептором и
возможность замены такой зависимости ступенькой на радиусе "черной
сферы". Перреновская зависимость для тушения фосфоресценции определяется
формулой
φ = φ0*e-Ω*CA.
Использование модели черной сферы для реакции переноса
электрона требует модификации формулы Перрена в выражение
φ = φ0* (1-e-Ω*CA).
где φ0 - относительный
квантовый выход при бесконечно большой концентрации тушителя, CA - концентрация тушителя, Ω - объём "черной сферы", который равен Ω=4/3**R3. Обработка данных на Рис.3.3 по этой формуле методом наименьших
квадратов дает значение R = 5.3 Å. Если считать, что
молекула CCl4 локализована вдоль аксиальной оси комплекса во время переноса
электрона, суммарный радиус партнеров может быть оценен величиной 4.2 А
(ковалентные радиусы ионов Cu2+ и Cl - 0.71 и 1.82 А, соответственно, а длина связи С-Сl - 1.76 А). Таким
образом, расстояние переноса электрона близко к суммарному радиусу частиц, то
есть перенос происходит практически на контактном расстоянии.
3.2 Лазерный
импульсный фотолиз растворов комплекса Cu [Et2dtc] 2 в
CCl4

Рис.3.4 Промежуточные оптические спектры поглощения при
импульсном фотолизе раствора Cu [Et2dtc] 2 (4,8*10-5 М)
в CCl4.1-6 - спектры через 0,
4, 10, 20, 48 и 760 мкс после лазерного импульса; 7 - спектр исчезнувшего
исходного комплекса Cu (Et2dtc) 2.
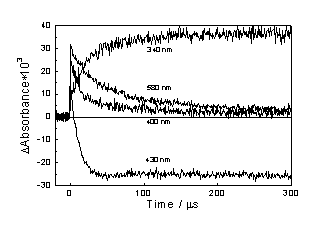
Рис.3.5 Кинетика изменения промежуточного поглощения на
570, 430, 350 нм после лазерного импульса для раствора Cu [Et2dtc] 2 (4.8*10-5
М) в CCl4.
Промежуточные оптические спектры с помощью лазерного
импульсного фотолиза были получены для растворов комплекса Cu [Et2dtc] 2 в чистом CCl4, где квантовый выход
имеет максимальную величину (Рис.3.3.). На Рис.3.4 показано, что сразу после
лазерного импульса появляются две полосы поглощения с максимумами на ~570
и ~400 нм. В области < 310 нм происходит просветление образца
(уменьшение оптической плотности) за счет исчезновения поглощения исходного
комплекса. Примерно за 100 мкс начальный промежуточный спектр трансформируется
в новый спектр, в котором появляется полоса с максимумом на 340 нм. Кинетика
изменения оптической плотности на некоторых длинах волн представлена на
Рис.3.5.
Во время трансформации спектра происходит формирование
провала на 435 нм, что соответствует исчезновению поглощения исходного
комплекса, и сохранение изобестической точки на 372 нм. В работах [5,6]
предполагается, что в хлороформе при фотолизе комплекса Cu [Et2dtc] 2 в качестве
промежуточных частиц образуются комплекс Cu (II) [Et2dtc] Cl и дитиокарбаматный
радикал Et2dtc·. Этот радикал в
ацетонитриле имеет широкую полосу поглощения с максимумом на 600 нм (e
= 3100 М-1см-1). По этой причине полоса с максимумом в
области 570 нм (Рис.3.4) могла принадлежать радикалу Et2dtc·. Для проверки этого предположения зарегистрированы оптические
спектры промежуточного поглощения при импульсном фотолизе раствора
тетраметилтиурамдисульфида (tds) в четыреххлористом углероде.
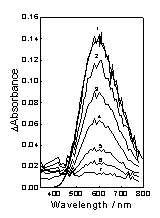
Рис.3.6 Промежуточные оптические спектры поглощения
раствора Me4tds в CCl4.1-7 - через 0, 0,8, 2, 4, 10, 20, 48,4 мкс после импульса.
На Рис.3.6 представлен спектр дитиокарбаматного радикала,
который в CCl4 имеет полосу поглощения с максимумом на 593 нм, что практически
совпадает с положением этой полосы в ацетонитриле. Исчезновение поглощения
радикала (Рис.3.7) определяется реакцией рекомбинации с наблюдаемой константой
скорости, линейно зависящей от начальной оптической плотности на 593 нм
(Рис.3.8). Если коэффициенты экстинкции полосы радикала в ацетонитриле и CCl4 равны, бимолекулярная
константа скорости рекомбинации 2krec = (6.8 ±
0.2) ´109 М-1с-1.
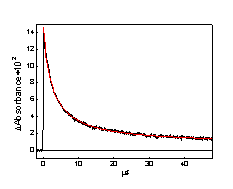
Рис.3.7 Кинетика изменения промежуточного поглощения на
590 нм после лазерного импульса для раствора Me4tds в CCl4. Сплошная кривая -
обработка по кинетическому закону второго порядка.
Полоса поглощения с максимумом на ~570 нм, возникающей при
импульсном фотолизе комплекса Cu [Et2dtc] 2, не совпадает по положению с
полосой Et2dtc· радикала, который
появляется при фотолизе тиурамдисульфида (593 нм). Кроме того, отличаются
линейные зависимости наблюдаемых констант скорости от начальной амплитуды
сигнала (Рис.3.7). Частица, которая возникает при фотолизе комплекса, исчезает
значительно медленнее (~3.8 раза).

Рис.3.8 Зависимость наблюдаемой константы скорости от
начальной амплитуды сигнала при импульсном фотолизе растворов Me4tds и Cu [Et2dtc] 2 в CCl4
Таким образом, спектральные и кинетические параметры
промежуточной частицы, возникающей после лазерного импульса при фотолизе
комплекса Cu [Et2dtc] 2 не совпадают с этими параметрами дитиокрбаматного
радикала.
3.3 Механизм
фотохимических превращений комплекса Cu [Et2dtc] 2 в CCl4
Возбуждение комплекса Cu [Et2dtc] 2 (355 нм)
приводит к появлению промежуточного поглощения с достаточно сложной кинетикой. Сразу
после лазерного импульса появляются две полосы с максимумами на 400 и 570 нм.
Если учесть исчезновение поглощения исходного комплекса (полоса на 435 нм),
можно определить реальный спектр первой промежуточной частицы. Так как примерно
к 40 мкс на 435 нм формируется просветление и на всех длинах волн поглощение
уже не изменяется, по величине просветления можно определить количество
исчезнувшего начального комплекса. На Рис.3.9 показан реальный спектр первой
промежуточной частицы с учетом исчезновения поглощения начального комплекса. В
ее спектре присутствуют две полосы с максимумами на 425 и 570 нм. Анализ
возможных процессов показывает, что, скорее всего, происходят следующие реакции
Cu (II) [dtc] 2 hn® (Cu (I) (dtc) (dtc·)) * (1)
Возбуждение комплекса с переносом электрона с
дитиокарбаматного лиганда на центральный ион, который становится ионом
одновалентной меди. Затем происходит разрыв одной из Cu-S связей для dtc· радикала, с образованием первой промежуточной частицы Cu (I) (dtc) (dtc·) (не возбужденного состояния), которая в результате переноса
электрона на CCl4 трансформируется во вторичную промежуточную частицу
Cu (I) (dtc) (dtc·) + CCl4 ® [Cu (II) (dtc) (dtc·)] + + CCl4-· (2)
Из радиационной химии известно, что анион радикал CCl4-· быстро (с диссоциативного терма) распадается на ион Cl - и нейтральный радикал CCl3·. Ион Cl - и комплекс [Cu (II) (dtc) (dtc·)] + находятся
в клетке (неполярный растворитель) и формируют третью промежуточную частицу [Cu (II) (dtc) (dtc·) Cla]
[Cu (II) (dtc) (dtc·)] + + CCl4-· ® [Cu (II) (dtc) (dtc·)] + + Cl - + CCl3· (3)
[Cu (II) (dtc) (dtc·)] + + Cl - ®
[Cu (II) (dtc) (dtc·) Cla] (4)
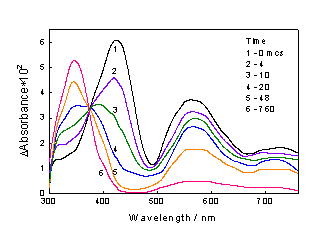
Рис. 3.9 Промежуточные спектры, появляющиеся при фотолизе
комплекса Cu (II) [dtc] 2 на разных временах, построенные с учетом
исчезновения поглощения исходного комплекса.
В комплексе [Cu (II) (dtc) (dtc·) Cla] ион хлора находится в
аксиальном положении (как и родительская молекула CCl4), что отмечено индексом а.
Реакции (1-4) являются быстрыми процессами и протекают, скорее всего, в субпико
- и пикосекундном диапазоне времени. Таким образом, к моменту регистрации с
наносекундным временным разрешением в растворе существует комплекс [Cu (II) (dtc) (dtc·) Cla]. Полоса поглощения с максимумом на 425 нм для
этого комплекса связана с переносом электрона с dtc - лиганда, а полоса в
районе 570 нм принадлежит радикалу dtc·, координированному одним
атомом серы с ионом Cu2+.
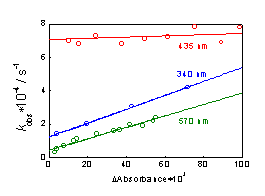
Рис.3.10. Зависимость наблюдаемой константы скорости от
амплитуды изменения оптической плотности при импульсном фотолизе Cu (Et2dtc) 2 в CCl4 на разных длинах волн.
Полосы 425 и 570 нм исчезают с разными скоростями и, более
того, по разным кинетическим законам. Измерение зависимости наблюдаемой
константы скорости от начальной оптической плотности (после лазерного импульса)
показали, что полоса на 425 нм исчезает в реакции первого порядка, а 570 нм -
второго (Рис.3.10). Для объяснения такого кинетического поведения необходима
схема дальнейших превращений комплекса [Cu (II) (dtc) (dtc·) Cla], в которой существуют реакции первого и второго
порядка. Такими реакциями могут быть процессы изомеризации комплекса [Cu (II) (dtc) (dtc·) Cla] и рекомбинации изомеризованной частицы в димер.
[Cu (II) (dtc) (dtc·) Cla] ®
[Cu (II) (dtc) (dtc·) Clэ] (5)
[Cu (II) (dtc) (dtc·) Clэ] ®
[Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ] (6)
При изомеризации ион хлора перемещается с аксиальной оси в
экваториальную плоскость, где одно координационное место свободно после разрыва
Cu-S связи. Этот процесс
является реакцией первого порядка и протекает в течении 10-15 мкс (kobs 7-8´104 c-1, Рис.3.10). Полоса на 425 нм за это время исчезает, так как
комплекс [Cu (II) (dtc) (dtc·) Clэ] с экваториальным
положением иона хлора имеет менее интенсивную полосу поглощения с максимумом в
области ~380 нм. Полоса на 570 нм в результате
изомеризации может практически не изменяться, так как в новом комплексе радикал
остается координированным одним атомом серы. Эта полоса будет исчезать только в
реакции рекомбинации комплексов [Cu (II) (dtc) (dtc·) Clэ] в димер, что объясняет
разную скорость и разные кинетические законы исчезновения полос с максимумами
на 425 и 570 нм.
Так как в реакции второго порядка исчезает полоса 570 нм,
можно предположить, что димеризация двух комплексов [Cu (II) (dtc) (dtc·) Clэ] происходит при рекомбинации радикалов dtc·, входящих в координационные сферы разных комплексов с
образованием дисульфида, который координирован свободными атомами серы с ионами
меди. Димеру [Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ] принадлежит новая полоса поглощения с максимумом на 345 нм
(Рис.3.4 и 3.9). Кинетика формирования этой полосы представлена на Рис.3.5
Время ее формирования близко к времени исчезновения полосы на 570 нм. Отметим,
что полоса димера [Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ] по положению практически совпадает с максимумом (350 нм) полосы
димера [ (dtc) Cu (II) Cl2Cu (II) (dtc)] в хлороформе, образование которого предполагается в работе [6].
При стационарном фотолизе формирование полосы с максимумом на
345 нм не обнаружено (Рис.3.1 и 3.2), поэтому можно предположить, что в
интервале времени 1 мс - 10 с (последняя величина - характерное время
регистрации стационарного оптического спектра) димер [Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ] диссоциирует на
конечные продукты.
[Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ] ® 2 [Cu (II) (dtc) Clэ] + tds (7)
Кинетика исчезновения поглощения в области 345 нм будет
изучена в следующем семестре. В соответствии предложенной схемой фотохимических
превращений (и в согласии с литературными данными [5]) полоса на 406 нм,
которая появляется при стационарном фотолизе (Рис.3.1 и 3.2), принадлежит
комплексу [Cu (II) (dtc) Clэ]. Формирование этого конечного комплекса будет исследовано также
с помощью метода ЭПР.
3.4
Спектральные и кинетические параметры фотохимических превращений комплекса Cu
[Et2dtc] 2 в CCl4
Выше уже упоминалось, что комплекс [Cu (II) (dtc) (dtc·) Cla], формирующийся после лазерного импульса
исчезает за 10-15 мкс в результате изомеризации. Его полоса поглощения с
максимумом на 425 нм имеет коэффициент экстинкции 20000 М-1см-1.
Эту величину можно рассчитать из отношения ее оптической плотности к оптической
плотности просветления на 435 нм к 400 мкс за счет исчезновения полосы
поглощения исходного комплекса, коэффициент экстинкции которой 13000 М-1см-1
[5]. Коэффициент экстинкции полосы на 570 нм комплекса [Cu (II) (dtc) (dtc·) Cla] из аналогичных измерений равен 15000 М-1см-1.
Линейная зависимость наблюдаемой константы скорости исчезновения поглощения на
570 нм от начальной оптической плотности позволяет оценить бимолекулярную
константу скорости рекомбинации комплексов [Cu (II) (dtc) (dtc·) Clэ] с образованием димера [Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ]. Угол наклона прямой на Рис.3.10 для этой
реакции (6) дает величину 2krec = 6´109 М-1с-1.
Выводы
1. Стационарный фотолиз комплекса Cu (II) [dtc] 2 показал,
что фотохимические процессы связаны с переносом электрона с возбужденного
комплекса на акцептор - молекулу четыреххлористого углерода. Образуется новая
полоса с максимумом на 406 нм, принадлежащая комплексу [Cu (II) (dtc) Clэ].
. После лазерного импульса образуется комплекс [Cu (II) (dtc) (dtc·) Cla], который за 13 мкс изомеризуется в комплекс [Cu (II) (dtc) (dtc·) Clэ] с переходом иона хлора из аксиального положения в экваториальную
плоскость.
. Комплекс [Cu (II) (dtc) (dtc·) Clэ] рекомбинирует с
образованием димера [Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ]. Константа скорости димеризации близка к
диффузионному пределу. Димер является долгоживущей частицей (t
>> 800 мкс).
. Конечным продуктом фотопревращений является комплекс [Cu (II) (dtc) Clэ].
План
работ на 2008 год
1. Изучение кинетики исчезновения димера [Cu (II) (dtc) ClэtdsCu (II) (dtc) Clэ], импульсный фотолиз.
. Исследование фотохимических превращений Cu (II) [dtc] 2 с помощью
метода ЭПР.
. Измерение температурных зависимостей кинетики превращений
промежуточных частиц.
. Исследование фотохимии Cu (II) [dtc] 2 при
использовании другого акцептора электрона (хлороформ, метилвиологен).
Литература
1. Ingold K.I., In advances in chemistry series 75, Oxidation of
organic compounds - I, Academic Press, New York, 1968.
. Bloch G. D., Organicheskie uskoritely vulkanizatchii kauchukov, Khimiya,
Leningrad, 1972.
. US Patent 3 041 311; 3 318 841; 2 965 605; 2 791 940; USSR
Patent 594 139; Ger. Offen 1 941 253; 1 223 134; Eng. Patent 1 203 442; 684
976; 677 733; Fr. Patent 1 235 590.
. Bonamico M., Dessyt M., Mugnolit A., Structural Studies of Metal
Dithiocarbamates. II. The Crystal and Molecular Structure of Copper
Diethyldithoacarbamate, Acta Cryst., 1965, V. 19, P.886.
. Jeliazkova B. G., Yordanov N. D., Charge transfer photochemistry
of bis (diethyldithiocarbamato) copper (II) and bis
(diisopropyldithiophosphato) copper (II) complexes, Inorganica Chimica Acta,
1993, V. 203, P. 201-204.
. Jeliazkova B. G., Ginka Chr. Sarova, Effect of alcohols on the
photochemical reaction of bis (N,N’-diethyldithiocarbamato) copper (II) in
CHCl3, Journal of Photochemistry and Photobiology A: Chemistry, 1996,
V.97, P.5-9.
. Jeliazkova B. G., Doicheva M. A., Charge-transfer photochemistry
of copper (II) dithiocarbamate mixed-ligand complexes, Polyhedron, 1996,
V.15, P.1277-1282.
. Iliev V.I., Yordanov N. D., Shpov D., Studies on the
intermolecular interactions of metal chelate complexes - 8, Polyhedron, 1984,
V.3, P.291.
. Yordanov N. D., Terziev V., Iliev V, Shopov D., Studies on the
intermolecular interactions of metal chelate complexes.4. EPR Study of the
interaction between the adducts of copper (II) chelate complexes and halogen
containing hydrocarbons, Inorganica Chimica Acta, 1982, V.60, P
21-24.
. Thorn G. D., Ludwig R. A., The dithiocarbamates and related
compounds, New York: Elsevier, 1962, P.148-149.
. Koch H. P., J. Chem. Soc., 1949, 401.
. Hendrickson A. R., Martin R. L., Tayllor D., J. Chem. Soc.,
Chem.commun., 1975, 843.
. Furneaux R. M., Sinn E., Antiferromagnetic binuclear
halogen-bridged dithiocarbamate complexes of copper (II), Inogr. Nucl. Chem.
Lett., 1976, V.12, P.501.