Новые кандидаты в лекарства и новые терапевтические цели в лечении туберкулёза
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
Белорусский
государственный университет
Химический
факультет
Курсовая
работа
Новые
кандидаты в лекарства и новые терапевтические цели
в
лечении туберкулёза
Минск
2010
Содержание
Введение
.
Общие сведения о заболевании и о методах борьбы с ним
.
Новые терапевтические цели в лечении туберкулёза и новые кандидаты на роль
противотуберкулёзных препаратов
Заключение
Список
литературы
Введение
Туберкулез сопровождает человека с
доисторических времен. Подтверждением этого являются археологические находки:
туберкулезное поражение позвонков было найдено у египетских мумий. Греки
называли это заболевание phtisis , что переводится как «истощение», «чахотка».
От этого слова происходит и современное название науки, изучающей туберкулез -
фтизиатрия; а специалисты, изучающие туберкулез, называются фтизиатрами.
Туберкулёз - это широко распространённое в мире
инфекционное заболевание. Возбудителем туберкулеза человека является
представитель обширной группы микобактерий Mycobacterium tuberculosis.
Достаточно, чтобы инфицированный закашлял, чихнул или просто заговорил - и
возбудитель может передаться окружающим.
В статистике причин смерти туберкулез занимает
первое место среди всех инфекционных заболеваний, причем лидирует с
внушительным отрывом. Из года в год Всемирная организация здравоохранения
регистрирует почти 10 миллионов новых случаев заболевания, ежегодно от этой
болезни умирают1,7 миллиона человек, большинство из которых можно было бы
спасти. Проблема заключается в том, что многие больные не имеют доступа к
медицинской помощи, а те кто лечится часто не выдерживают долговременного
приёма лекарственных средств.
Кроме того, туберкулез эволюционирует быстрее,
чем фармокология. В последние годы замечено увеличение числа случаев
резистентности возбудителя к нескольким наиболее эффективным лекарственным
средствам. Что еще более тревожно - появляются штаммы, невосприимчивые ни к
каким известным антибиотикам.
Несмотря на такую мрачную картину, у нас есть
основания надеяться на лучшее. Новейшие биомолекулярные технологии позволяют
детально исследовать сложные взаимоотношения между возбудителями заболевания и
организмом человека, чему способствуют успехи в изучении генетики бактерий, что
в свою очередь является точкой опоры в разработке новых технологических тестов.
Всё более широкое распространение заболевания,
появление штаммов, резистентных к существующим противотуберкулёзным препаратам,
- всё это заставляет ученых использовать новейшие стратегии поиска более эффективных
лекарственных средств, а также вести разработку новых методов лечения и
диагностики.
туберкулёз лекарство лечение
1. Общие сведения о заболевании и о методах
борьбы с ним
Возбудителем туберкулеза человека является
представитель обширной группы микобактерий Mycobacterium tuberculosis. Был
открыт в 1882 г. немецким физиологом Робертом Кохом. Имеет форму палочки (
палочка Коха). Может находится как в латентной, так и в активной форме. Если
находится в латентной форме, то иммунная система сдерживает размножение
бактерий, не позволяя им разрушать ткани. Инфицированные не обнаруживают ни
каких симптомов и не заразны. Многие месяцы, годы и даже десятилетия болезнь
может не проявлять себя. Активная форма развивается примерно у 10% носителей
инфекции. Очень часто это случается с людьми, имеющими ослабленный иммунитет -
детьми или больными СПИДом, и с теми, кто проходил курс химиотерапии.
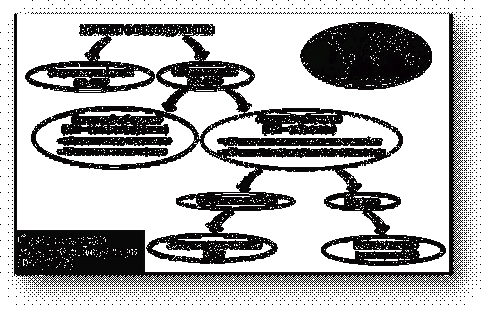
Рисунок 1. Схема течения туберкулёзной инфекции
Туберкулез может протекать в скрытой и активной
формах. Заразиться им можно, просто вдохнув воздух, в котором содержится всего
несколько бактерий - возбудителей инфекции. Они попадают в окружающую среду,
когда больной активной формой туберкулеза кашляет, чихает или разговаривает.
Mtb
обычно
скапливаются в альвеолах (воздушных мешочках) легких, поскольку предпочитают
богатую кислородом среду. В большинстве случаев иммунная система держит
размножение попавших в организм бактерий под контролем, направляя к месту их
расположения защитные клетки - макрофаги. Последние заключают туберкулезные
палочки в оболочку и тем самым обезвреживают их. Но у 10% инфицированных Mtb
прорывают оболочку, выходят наружу и начинают размножаться. Неподконтрольные
иммунной системе, частицы Mtb
разрушают ткань легких, что способствует появлению таких симптомов как
неудержимый кашель, боль в груди, кровохарканье. Некоторые из них попадают в
кровоток и поражают другие части тела - головной мозг, почки, кости скелета.
Так же инфекция может распространяться и на другие органы. У детей возбудитель
часто проникает в позвоночник, вызывая при этом лихорадку и кому - состояние,
известное как туберкулезный менингит. При отсутствии лечения больные погибают,
в основном вследствие разрушения легочной ткани.
Около века назад эффективных средств борьбы не
существовало. Больных изолировали - помещали в специальные медицинские
учреждения, для того чтобы предотвратить распространение заболевания.
Первые попытки в борьбе с туберкулезом были
осуществлены в 1919-1921 г., когда французские иммунологи Альбкрт Кальмет и
Камиль Герен создали противотуберкулезную вакцину на основе ослабленной
культуры микобактерии бычьего типа (БЦЖ). Введение вакцины новорожденным с
последующей ревакцинацией позволило резко снизить заболеваемость туберкулезом,
прежде всего у детей.
Спустя 22 года группа американских микробиологов
под руководством Селмана Ваксмана открыла стрептомицин, который стал первым
эффективным противотуберкулезным препаратом, хотя и обладал спектром побочных
действий. В 1950-х гг., были синтезированы сразу несколько антибиотиков,
лишенных недостатков свойственных стрептомицину.
Эти достижения положили конец тактике изоляции
больных туберкулезом и существенно снизили заболеваемость в странах, обладающих
достаточными финансовыми ресурсами и инфраструктурой, необходимой для лечения
больных. К началу 1970-х гг. у многих экспертов сложилось мнение, что
туберкулез в этих странах побежден. Но все оказалось не так просто. Процессы
глобализации, возможность путешествовать по всему миру способствовали
распространению инфекции из эндемичных регионов, и сейчас мы стоим на пороге
новой пандемии. Хуже всего приходится жителям беднейших стран, которые первыми
столкнулись с другим смертельно опасным заболеванием - СПИДом.
Таблица 1. Характеристика основных современных
средств терапии туберкулёза
|
Агент
|
Свойства
|
Начало
производства
|
Производитель
|
Механизм
антибактериальной активности
|
|
Рифампицин
(рифампин)
|
Антибиотик
широкого спектра
|
1963
|
CIBA
Ltd (в настоящее время - Novartis)
|
Ингибитор
синтеза нуклеиновых кислот
|
|
Изониазид
|
Гидразид
изоникотиновой кислоты, эффективен исключительно против микобактерий
|
1952
|
Roche
|
Ингибитор
синтеза клеточной стенки
|
|
Пиразинамид
|
Бактериостатическое
и бактерицидное действие
|
1954
|
Lederle
(в настоящее время - Wyeth_Pfizer)
|
Ингибитор
энергетического обмена
|
|
Этамбутол
|
Противомикобактериальный
агент бакикриостатического действия
|
1962
|
Lederle
(в настоящее время - Wyeth_Pfizer)
|
Ингибитор
синтеза клеточной стенки
|
|
Стрептомицин
|
Антибиотик
группы амино гликозидов
|
1948
|
Merck
|
Ингибитор
синтеза белка на уровне субъединиц 30S
рибосом
|
Сегодня, спустя полвека после появления
противотуберкулезных препаратов, по оценкам Всемирной организации
здравоохранения, палочкой Коха инфицировано более трети населения земного шара
- примерно 2 млрд человек. У 8 млн из числа носителей патогена в течение года
разовьется туберкулез в активной форме, а каждый инфицированный заразит за это
время еще 10-15 человек.
Картина становится еще более удручающей, если
учесть рост заболеваемости СПИДом. У ВИЧ-инфицированных переход из латентной
формы в активную происходит в 30-50 раз чаще, чем у ВИЧ-негативных пациентов,
поскольку СПИД выводит из строя иммунную систему. Туберкулез как причина смерти
занимает первое место среди больных СПИДом, унося жизни каждого из трех в
странах южнее Сахары, где уровень здравоохранения особенно низок. Даже в тех
случаях, когда ВИЧ-позитивные больные туберкулезом хорошо реагируют на
противотуберкулезную терапию, состояние их здоровья ухудшается, поскольку
чреватое осложнениями взаимодействие между препаратами против двух инфекций
часто заставляет временно отказаться от противоретровирусной терапии, пока
ситуация с туберкулезом не будет взята под контроль.
Пожалуй, наибольшие опасения вызывает рост числа
штаммов, устойчивых к антибиотикам. Для того чтобы проиллюстрировать, как может
возникнуть подобная резистентность, рассмотрим обычную практику борьбы с
туберкулезом. Схема, разработанная еще в 1960-е гг., предусматривает прием
четырех препаратов первого ряда, созданных в 1950-х и 1960-х гг.: изониазида.
этамбутола. пиразинамида и рифампина. За весь курс пациент должен принять 130
доз препаратов, лучше всего - под наблюдением врача. Такая комбинация крайне
эффективна против туберкулеза в активной форме, но только если весь курс
длительностью до девяти месяцев не прерывается.
Резистентные штаммы появляются, когда пациенты
не следуют назначенной схеме. Перерывы в лечении создают благоприятные условия
для размножения нечувствительных к терапии штаммов, которые передаются
окружающим. (По этой причине некоторые специалисты полагают, что лучше уж вовсе
не лечиться от туберкулеза, чем лечиться не до конца.)
По оценкам ВОЗ. примерно 5% из 9 млн ежегодно
инфицируемых несут штаммы, устойчивые к двум чаще всего применяемым препаратам
первого ряда: изониазиду и рифампииу. В большинстве случаев эти так называемые
мультирезистентные [MDR,
multydrugreststant] штаммы
все-таки отступают под натиском химиотерапии, но тогда необходимо в течение
двух лет принимать препараты второго ряда, дающие серьезные побочные эффекты.
Если учитывать, что резистентность встречается чаще всего в странах третьего
мира, то приходится признать, что лечение обычно неосуществимо. Несвоевременная
диагностика, мультирезистентность и высокая стоимость лечения приводят к тому,
что лишь 2% нуждающихся в помощи больных получают ее в полной мере.
Но еще хуже то, что недавно появился штамм,
невосприимчивый почти ко всем высокоэффективным препаратам второго ряда [XDR.
extensively
drug-resistant].
Он был основным виновником вспышки туберкулеза в 2006 г в провинции
Квазулу-Наталь. ЮАР. XDR-штамм
гораздо менее распространен, чем MDR.
но опасен тем, что может видоизменяться и стать устойчивым абсолютно ко веем
известным противотуберкулезным препаратам. По данным ВОЗ, этот штамм
зарегистрирован уже в 49 странах. Это минимальная оценка, поскольку далеко не
везде есть лаборатории, достаточно хорошо оснащенные для выявления XDR-штамма.
2. Новые терапевтические цели в лечении
туберкулёза и новые кандидаты на роль противотуберкулёзных агентов
Противотуберкулезные препараты первого ряда,
применяемые сейчас, были созданы в 1950-1960-х гг. Лечение занимает от шести до
девяти месяцев. Преждевременное его прекращение приводит к появлению
резистентных форм Mtb.
Сейчас, как никогда ранее, важно найти новые лекарственные средства -
недорогие, не требующие столь долговременного приема и направленные на другие
уязвимые места Mtb.
И все же в этом направлении кое-что делается.
Правительственные программы и частные пожертвования, например от фонда Билла и
Мелинды Гейтс, позволили начать поиски противотуберкулезных антибиотиков,
эффективных в отношении резистентных штаммов, и сократить время лечения
больных, инфицированных обычными штаммами.
Традиционным методом проб и ошибок найдено
несколько веществ - кандидатов на роль противотуберкулезных агентов.
Таблица 2.Перспективные препараты
|
Препарат
|
Механизм
действия
|
Фаза
клиничес-ких
испытаний
|
Преимущества
|
|
Класс
фторхинолоны 1.Гатифлоксацин 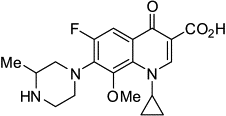 2.Моксифлоксацин 2.Моксифлоксацин
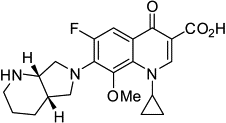
|
Подавляют
репликацию и транскрипцию ДНК
|
Фаза
III (масштабные
испытания на эффективность)
|
Сокращение
периода терапии до 4-х месяцев
|
|
Класс
Нитроимидазолы 1.РА-824 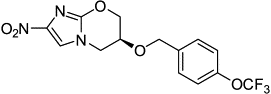
|
Подавляет
синтез клеточной стенки и клеточное дыхание
|
Фаза
II (на
эффективность)
|
Эффективность
при полимедикаментоз-ной резистентности, замена двум современным агентам
|
|
Класс
Диарилхинолоны 1.ТМС-207 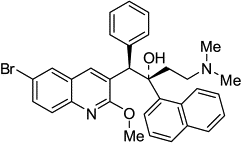
|
Подавляет
синтез АТФ
|
Фаза
II
|
Прием
1 раз в неделю, эффективность при ПМР, низкий потенциал медикаментозных
взаимодействий
|
|
Класс
Диамины 1. SQ-109
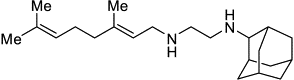
|
Подавляет
синтез клеточной стенки
|
Фаза
I (на
безопасность)
|
Сокращение
длительности терапии на 25%
|
В результате несколько обнадеживающих веществ
уже проходят клинические испытания. Среди них - агент SQ109,
который подавляет синтез клеточной стенки бактерий. Недавно завершилось его
тестирование на безопасность (фаза I). Еще один кандидат на роль
противотуберкулезного средства - вещество РА-824. Оно эффективно в отношении
как активно делящихся бактерий, так и бактерий в латентной фазе, что дает
надежду на уменьшение сроков лечения больных туберкулезом. РА-824 проходит фазу
II клинических
испытаний, в которой проверяется его эффективность.
К сожалению, есть обстоятельства, не
прибавляющие оптимизма.
Как показывает статистика, только 10%
антибиотиков, прошедших первые стадии испытаний, получают одобрение FDA.
В значительной мере это обусловлено применением устаревшей практики поиска
подобных лекарственных средств, согласно которой сначала идентифицируют
ферменты, жизненно важные для бактерии и не имеющие аналогов в организме
человека, затем проводят скрининг библиотек веществ, способных служить
ингибиторами данных ферментов, потом синтезируют производные ингибиторов и,
наконец, оптимизируют их свойства, например повышают способность проникать из
желудка в кровоток. Даже крупным фармацевтическим компаниям, мастерам своего
дела, не всегда удается достичь успеха на этом пути. Поле битвы с туберкулезом
сплошь усеяно отвергнутыми кандидатами на роль спасительных лекарственных
веществ, многие из которых представляют собой высокоспецифичные мощные
ингибиторы бактериальных белков. Некоторые, ловко расправляясь с изолированными
ферментами, оказались бессильны перед целыми клетками, другие успешно
уничтожали бактерий в пробирке, но не действовали в организме подопытных
животных. Вообще туберкулез - уникальное заболевание в смысле несоответствия
результатов воздействия на возбудителя in
vitro и in
vivo. В большинстве
случаев разработчики не могут высказать никаких предположений относительно
причин подобных различий. Суть проблемы в том. что туберкулезная палочка -
абсолютно автономная живая система, выработавшая в ходе эволюции способность
адаптироваться к любым условиям и противостоять любым угрозам. Подобно
современному самолету, она оснащена разнообразными системами страховки,
маневрирования, безопасности и быстрого реагирования. До тех пор пока мы не
разберемся во всех тонкостях взаимодействия этой изощренной бактерии с
организмом человека, создание новых эффективных средств борьбы с ней будет
обречено на неудачу. Обнадеживает то, что такая работа уже началась.
Поворотным пунктом в изучении туберкулеза стало
определение в 1998 г. нуклеотидной последовательности ДНК Mtb
(в этом проекте принимал участие один из авторов - Барри). Полученные
результаты позволили сделать ряд важных выводов. Так, обнаружилось, что из всех
ферментов и химических реакций, необходимых для выживания Mtb
в организме человека, ученые, проводя опыты in
vitro, учитывали лишь
треть. Например, они не знали, что значительная часть генома Mtb
кодирует ферменты, участвующие в синтезе и расщеплении липидов, а некоторые из
этих ферментов могли бы стать мишенью для лекарственных веществ. Анализ
геномной ДНК показал также, что вопреки общепринятому мнению бактерия способна
жить вообще без кислорода - это открытие сейчас проверяется. В таких условиях
ее метаболизм существенно замедляется, отчего снижается восприимчивость к
антибиотикам. Блокируя звенья метаболической сети, остающиеся в рабочем
состоянии в бескислородной среде, можно попытаться уменьшить срок лечения.
Однако генетические данные позволяют выработать
новые подходы
не только к лечению туберкулеза, но и к его
диагностике, которая бывает затруднена влиянием вакцинации в раннем детстве (ее
проходит половина детей по всему земному шару). Вакцина содержит один из
штаммов Mtb, утративший
вирулентность, но все еще способный вызывать ответ иммунной системы, с детства
подготовленной к встрече с патогенном. Традиционно используемый тест не
позволяет различить иммунные ответы на вирулентный штамм и штамм, на основе
которого сделана вакцина. Поэтому результат тестирования дезинфицированного в
точности совпадает с таковым здорового, но вакцинированного пациента.
В ходе изучения генома Mtb
генетики из Сиэтла обнаружили, что в ДНК штамма, используемого для создания
вакцины, отсутствует крупный сегмент. Вскоре генетики из Пастеровского
института, Медицинского колледжа Альберта Эйнштейна и Вашингтонского
университета выяснили, что «выпавшие» гены обеспечивали вирулентность
микроорганизма. Все это послужило основанием к повышению специфичности теста на
туберкулез. По соображениям исследователей, тест, в котором фиксируется только
иммунный ответ на факторы вирулентности, отсутствующие у штамма «основателя»
вакцины, позволил бы разграничить инфицированных и тех, кто когда-то был
вакцинирован. Именно такой тест получил в 2005 г. разрешение FDA;
его эффективность была подтверждена многократными проверками. К сожалению,
процедура остается дорогостоящей и используется только в развитых странах.
Геном Mtb
- не единственный источник данных, проливающий свет на уязвимые места патогена.
Сегодня биологи имеют возможность детально исследовать все его компоненты и все
внутриклеточные процессы - от синтезируемых Mtb
белков (иротеомика) до матричных РНК (транскриптомика) , промежуточных и
конечных продуктов метаболизма (метаболомика). Эти области биологии пока очень
молоды, но уже приносят плоды. В ноябре 2008 г. Барри в соавторстве с другими
учеными опубликовал статью в Science
с сообщением о том, что бактериальный транскриптом реагирует на РА-824 так, как
если бы Mtb была
«отравлена» цианистым калием. В ходе дальнейших исследований было обнаружено,
что в процессе метаболизма лекарственного препарата Mtb
высвобождает оксид азота, защитное соединение, в норме вырабатываемое иммунными
клетками человека. Теперь ученые пытаемся синтезировать вещество, стимулирующее
высвобождение оксида азота в большем количестве, чем это делает РА-824.
Специалисты в области структурной геномики ищут
также способы определения трехмерной конфигурации всех белков Mtb.
Это необходимо для выяснения их функций (для многих белков она остается
неизвестной) и для создания лекарственных веществ, мишенью которых был бы
определенный участок важной для Mtb
белковой молекулы. За решение задачи взялся коллектив ученых из 17 стран. Пока
определена структура примерно 10% белков туберкулезной палочки.
Еще одно направление, достойное упоминания. -
химическая геноми-ка. Ее отличительная черта - обратный общепринятому подход к
поиску лекарственных средств. Вместо того чтобы заниматься поисками веществ,
подавляющих активность бактериального белка с известной структурой,
исследователи начинают работу с вещества, обладающего тем или иным ценным
признаком, например способностью блокировать размножение Mtb
в культуре, и движутся в обратном направлении - пытаются идентифицировать
бактериальный фермент, на который данное вещество действует. Само вещество
может быть продуктом химического синтеза, иметь растительное происхождение,
вырабатываться микроорганизмами и даже животными.
Такой подход позволяет направить всю мощь естественного
отбора на сокрушение Mtb.
Прежде чем Mtb и другие
бактерии обосновались в организме человека, они занимали определенные ниши в
окружающей среде, где вынуждены были конкурировать с бессчетным числом других
микроорганизмов.
Бактериальные экосистемы проходили через пресс
естественного отбора по много раз, и в большинстве случаев другие бактерии
выработали механизмы контроля над микобактериями. Если бы удалось
идентифицировать этот арсенал, то ученые смогли бы проверить его компоненты па
способность атаковать Mtb,
найти те мишени, на которые они действуют и открыть целый класс новых
лекарственных веществ. В отличие от уже известных противотуберкулезных агентов
новые будут выводить из строя целые системы патогенов, а не отдельные
биохимические процессы.
Для того, чтобы использовать весь потенциал
новых биотехнологий, исследователям необходимо освоить приемы и инструменты
информационных технологий, которые позволят оперировать большими массивами
данных. Фактически это всё приведет к созданию новой научной дисциплины -
биоинформатики, и только будучи вооруженными новыми знаниями и навыками
существует возможность выработать другой подход к созданию новых средств борьбы
с туберкулезом. Этот подход будет основываться на предсказании поведения
биологических систем в целом, что невозможно сделать исходя из сведений об
основных биологических свойствах их компонентов.
Что касается поведения Mtb
in vitro,
то одно из неожиданных его проявлений состоит в образовании «связок» -
извивающихся цепочек бактериальных частиц. Свойства этих структур невозможно
предсказать исходя из свойств молекул, участвующих в их формировании. В
организме человека в результате их взаимодействия с клетками иммунной системы
образуется гранулема - крупный агрегат из клеток хозяина и бактериальных
частиц, в который лекарственным веществам проникнуть крайне трудно.
С помощью биоинформатики ученые надеются
установить, как ведут себя все 4 тыс. генов Mtb,
кодируемые ими белки и побочные продукты метаболизма в присутствии нового
лекарственного вещества in
vitro. За последние
десять лет они кое-что узнали об особенностях поведения возбудителя туберкулеза
в организме-хозяине в отличие от поведения в пробирке. А их конечная цель
создание - компьютерной модели Mtb,
которая будет обладать всеми свойствами реальной бактерии, обитающей в
организме человека. Значение такой работы трудно переоценить - ведь учёные
смогут с определенностью предсказывать, какие компоненты бактериальной частицы
будут наилучшей мишенью для лекарственных веществ и какие из этих веществ будут
наиболее эффективными.
Для этого необходимо детально изучить все
биохимические пути (последовательности химических превращений) и
идентифицировать ключевые свойства микроорганизма, которые ими определяются.
Впрочем, данная область стремительно развивается, что дает основания надеяться
на создание в ближайшие 20 лет компьютерной модели Mtb
точного аналога бактерии, выросшей в пробирке, а возможно - ив теле человека.
Общеизвестно, что болезнь легче предотвратить,
чем лечить. Ученые не отказываются от попыток создания противотуберкулезных
вакцин, более эффективных, чем БЦЖ. Но пока они действуют методом проб и
ошибок, нет возможности установить, почему созданный ими вариант не работает, и
предвидеть, какая вакцина будет успешной.
В отличие от других инфекционных заболеваний,
при которых успешно преодоленная первичная инфекция гарантирует от повторного
заражения, туберкулез может атаковать одну и ту же жертву по много раз. Таким
образом, вакцина на основе ослабленного штамма Mtb
долго работать не будет. И если для ускорения разработки новых лекарственных
средств достаточно компьютерной копии одной только бактерии, то для создания
вакцины необходима и модель человеческого организма.
Заключение
Никогда человечество не нуждалось в более точных
методах диагностики туберкулеза, новых лекарственных средствах и вакцинах так,
как сейчас.
Противотуберкулезные препараты, применяемые
сейчас, были созданы в 1950-1960-х гг. Лечение занимает от шести до девяти
месяцев, преждевременное его прекращение приводит к появлению резистентных форм
Mtb. Сейчас, как
никогда ранее, важно найти новые лекарственные средства - недорогие, не
требующие столь долговременного приема и направленные на другие уязвимые места Mtb.
Совсем недавно начались детальные исследования
свойств Mtb, основанные
на результатах анализа генетического материала и других компонентов бактерии.
Цель-изучение патологического процесса с момента заражения и выяснение причин
уязвимости человеческого организма. Предполагается найти гораздо более
эффективный способ подавления синтеза АТФ, вещества, снабжающего бактериальную
клетку энергией. Возможно, удастся идентифицировать вещества, которые будут
стимулировать бактерию к высвобождению больших количеств оксида азота -
ингибитора клеточного дыхания, чем это делают имеющиеся препараты.
Перспективным представляется и блокирование синтеза ниацина, основного
переносчика энергии в бактериальной клетке
В перспективе создание компьютерной копии Mtb,
имитирующей поведение реальной бактерии в организме человека. Это позволит
предугадать реакцию Mtb
на различные лекарственные вещества с гораздо большей точностью, чем раньше.
Список литературы
1.
Барри К. Новая тактика борьбы с туберкулезом / К. Барри, М. Чеун // В мире
науки. 2009. № 6. С.56-63
.
Борг И. В борьбе с туберкулезом - свыше 40 лет «застоя» и новые надежды… / И.
Борг // Новая медицина тысячелетия. 2009. № 2. С.16-19
3.
Кошечкин В.А. Туберкулёз / В.А. Кошечкин, З.А. Иванова. М., 2007