Фармацевтическая химия антибиотиков – производных бетта-лактамидов тиазолидина и дигидротиазина (пенициллинов и цефалоспоринов)
Вступление
антибиотик пенициллин цефалоспорин
Антибиотики - вещества природного или полусинтетического происхождения
(обычно производятся различными грибками), оказывающие сильное подавляющее
действие на рост и размножение бактерий и при этом относительно мало
повреждающие или вовсе не повреждающие клетки микроорганизма.
Антибиотики в отличие от антисептиков обладают антибактериальной
активностью не только при наружном применении, но и в биологических средах
организма при их системном (внутрь, внутримышечно или в вену и др.) применении.
Антибиотики используются для предотвращения и лечения воспалительных
процессов, вызванных бактериальной микрофлорой. По влиянию на бактериальные
организмы различают бактерицидные (убивающие бактерий, например, за счёт разрушения
их внешней мембраны) и бактериостатические (угнетающие размножение
микроорганизма) антибиотики.
Антибиотики природного происхождения чаще всего продуцируются
актиномицетами, реже - немицелиальными бактериями.
Некоторые антибиотики оказывают сильное подавляющее действие на рост и
размножение бактерий и при этом относительно мало повреждают или вовсе не
повреждают клетки макроорганизма, и поэтому применяются в качестве
лекарственных средств.
Некоторые антибиотики используются в качестве цитостатических (противоопухолевых)
препаратов при лечении онкологических заболеваний.
Антибиотики не воздействуют на вирусы, и поэтому бесполезны при лечении
заболеваний, вызываемых вирусами (например, грипп, гепатиты А, В, С, ветряная
оспа, герпес, краснуха, корь).
Полностью синтетические препараты, не имеющие природных аналогов и
оказывающие сходное с антибиотиками подавляющее влияние на рост бактерий,
традиционно было принято называть не антибиотиками, а антибактериальными
химиопрепаратами. В частности, когда из антибактериальных химиопрепаратов
известны были только сульфаниламиды, принято было говорить обо всём классе
антибактериальных препаратов как об «антибиотиках и сульфаниламидах». Однако в
последние десятилетия в связи с изобретением многих весьма сильных антибактериальных
химиопрепаратов, в частности фторхинолонов, приближающихся или превышающих по
активности «традиционные» антибиотики, понятие «антибиотик» стало размываться и
расширяться и теперь часто употребляется не только по отношению к природным и
полусинтетическим соединениям, но и к многим сильным антибактериальным
химиопрепаратам.
Изобретение антибиотиков можно назвать революцией в медицине. Множество
болезней, веками мучавших человечество и несших смерть, стали банальными, как
обычная простуда.
Разработка и производство антибиотиков активно началась в конце XIX века.
Первым антибиотиком, выпущенным в промышленное производство, стал сальварсан
(1910 год).
В начале 30-х годов двадцатого столетия в обиход хирургических отделений
широко вошли сульфаниламидные препараты (сульфидин, стрептоцид и др.). Эти
вещества задерживают развитие и размножение микроорганизмов
(бактериостатическое действие), в результате чего организм получает возможность
легче с ними справиться. Однако сульфаниламиды полностью не оправдали возложенных
на них надежд, главным образом при лечении ран. После припудривания раны
порошком сульфаниламидов в течение гнойного процесса наступало значительное
улучшение, но в ряде случаев заживление ран или не наступало, или крайне
затягивалось. Таким образом, эти препараты, действуя на бактерии, действовали и
на ткани в сторону снижения процессов заживления (регенерации). Это
обстоятельство резко снижало достоинства сульфаниламидов, и поиски новых
антисептических веществ настойчиво продолжались. Вскоре пришел большой успех в
виде открытия антибиотиков - пенициллинов.
В 1928 году Александр Флеминг проводил рядовой эксперимент в ходе
многолетнего исследования, посвященного изучению борьбы человеческого организма
с бактериальными инфекциями. Вырастив колонии культуры Staphylococcus, он
обнаружил, что некоторые из чашек для культивирования заражены обыкновенной
плесенью Penicillium - веществом, из-за которого хлеб при долгом лежании
становится зеленым. Вокруг каждого пятна плесени Флеминг заметил область, в которой
бактерий не было. Из этого он сделал вывод, что плесень вырабатывает вещество,
убивающее бактерии. Впоследствии он выделил молекулу, ныне известную как
«пенициллин». Это и был первый современный антибиотик.
Принцип работы антибиотика состоит в торможении или подавлении химической
реакции, необходимой для существования бактерии. Пенициллин блокирует молекулы,
участвующие в строительстве новых клеточных оболочек бактерий - похоже на то,
как наклеенная на ключ жевательная резинка не дает открыть замок. (Пенициллин
не оказывает влияния на человека или животных, потому что наружные оболочки
наших клеток коренным образом отличаются от клеток бактерий.)
В течение 1930-х годов предпринимались безуспешные попытки улучшить
качество пенициллина и других антибиотиков, научившись получать их в достаточно
чистом виде. Первые антибиотики напоминали большинство современных
противораковых препаратов - было неясно, убьет ли лекарство возбудителя болезни
до того, как оно убьет пациента. И только в 1938 году двум ученым Оксфордского
университета, Говарду Флори (Howard Florey, 1898-1968) и Эрнсту Чейну (Ernst
Chain, 1906-79), удалось выделить чистую форму пенициллина. В связи с большими
потребностями в медикаментах во время второй мировой войны массовое
производство этого лекарства началось уже в 1943 году. В 1945 году Флемингу,
Флори и Чейну за их работу была присуждена Нобелевская премия.
Благодаря пенициллину и другим антибиотикам было спасено бесчисленное
количество жизней. Кроме того, пенициллин стал первым лекарством, на примере
которого было замечено возникновение устойчивости микробов к антибиотикам.
Целью данной работы является изучение антибиотиков-производных β-лактамидов тиазолидина и
дигидротиазина (пенициллинов и цефалоспоринов), описание их свойств, методик
идентификации и количественного определения.
В практической части проведено исследование препарата бензилпенициллина
натриевой соли 1 млн. ЕД.
1. Описание антибиотиков
1.1 Характеристика антибиотиков
Термин «антибиотик» был впервые предложен С.А. Ваксманом (США). Под этим
термином он подразумевал вещества, образуемые микроорганизмами и обладающие
антимикробным действием (от лат. «анти»- противо и «биос» - жизнь), т. е.
действующие против основных жизненных свойств микробов. В дальнейшем вещества,
обладающие антибиотическими свойствами, были обнаружены в растениях - фитонциды
(В.П. Токин), крови человека и животных - эритрин (Л.А. Зильбер в Л.М. Якобсон)
и других природных источниках. В связи с этим понятие «антибиотик» расширилось,
и в настоящее время под антибиотиками следует понимать специфические продукты
жизнедеятельности, обладающие высокой физиологической активностью по отношению
к определенным группам микроорганизмов (вирусам, бактериям, актиномицетам,
грибам, водорослям, протозоа) или к злокачественным опухолям, избирательно
задерживая их рост или полностью подавляя развитие.
Начало развития науки об антибиотиках относится к 40-м годам нашего
столетия, когда было открыто сильное химиотерапевтическое средство против
бактериальных инфекций - пенициллин.
В результате большой работы советских ученых и медицинской промышленности
СССР в сравнительно короткое время было организовано производство всех
важнейших антибиотиков, имеющих значение для медицинской практики.
Работа по изысканию антибиотиков требует тесного сотрудничества
микробиологов (изыскание продуцентов новых антибиотиков), химиков (выделение
активно действующих веществ из культуральной жидкости продуцентов),
химиотерапевтов, фармакологов, гистологов, испытывающих лечебное действие новых
антибиотиков в опытах на животных.
В этом комплексе необходимо также участие инженеров и технологов,
располагающих специальным оборудованием, необходимым для получения образцов
новых антибиотиков в количествах, требуемых для дальнейшего изучения.
Для успешной работы в этом направлении в нашей стране были созданы
специализированные научные институты: НИИ по изысканию новых антибиотиков АМН
СССР, Ленинградский НИИ антибиотиков; Всесоюзный НИИ антибиотиков Министерства
медицинской промышленности СССР, и др.
Развитие отечественной науки об антибиотиках (изыскание, установление
строения, разработка производственных методов получения) связано с именами
крупнейших советских ученых: 3.В. Ермольевой, М.М. Шемякина, Г.Ф. Гаузе, М.Т.
Бражниковой, А.С. Хохлова, С.М. Навашина и многих других.
Известно уже около 3000 антибиотических веществ, из которых
химиотерапевтическим действием обладает около 300.
По своей химической природе антибиотики представляют органические
соединения, относящиеся к самым различным классам соединений.
Антибиотики, в отличие от других продуктов жизнедеятельности, имеют два
характерных свойства:
· проявляют высокую биологическую активность по отношению к
чувствительным к ним организмам. Даже в очень небольших концентрациях они
проявляют высокое физиологическое действие, например пенициллин оказывает
бактерицидное- действие в отношении чувствительных к нему бактерий в
концентрации 0,000001 г/мл;
· обладают избирательностью действия. Каждый антибиотик
проявляет свое действие лишь по отношению к отдельным», вполне определенным
организмам или к группам организмов, не проявляя при этом заметного действия на
другие формы микроорганизмов. Например, пенициллин задерживает развитие лишь
некоторых грамположительных бактерий (кокков, стрептококков и др.) и не
оказывает действия на грамотрицательные бактерии, грибы или другие группы
микроорганизмов. Таким образом, каждый антибиотик характеризуется своим
специфическим, антимикробным спектром действия.
.2 Производство антибиотиков
Производственное получение антибиотиков, как правило, осуществляется
путем биосинтеза и имеет много общих стадий, основными из которых являются:
подбор высокопроизводительных штаммов и питательных сред; процесс биосинтеза;
выделение антибиотика из культуральной жидкости и его очистка.
Интенсивность биосинтеза того или другого антибиотика зависит в первую
очередь от свойств штамма продуцента. Природные штаммы в большинстве своем
малоактивны и не могут использоваться для промышленных целей. Поэтому после
отбора наиболее активного природного штамма продуцента антибиотика для
повышения его продуктивности применяют различные приемы и методы, основанные на
законах генетики.
Большое значение для биосинтеза антибиотика имеет подбор рационального
состава питательных сред, которые определяются в соответствии со штаммом
продуцента. У каждого штамма потребность в источниках питания неодинакова,
поэтому состав питательных сред не может быть постоянным для всех продуцентов.
В настоящее время для промышленного получения всех антибиотиков применяют
исключительно «глубинный» метод. Эта значит, что мицелий растет во всей массе
среды, а не только на; ее поверхности, что достигается путем непрерывного
энергичного перемешивания и аэрации (продувания воздухом) всей массы среды.
Применяемый для аэрации воздух должен быть стерильным и раздробленным на очень
мелкие пузырьки, чтобы кислород мог хорошо растворяться в среде и усваиваться
микроорганизмами.
Методы выделения и очистки антибиотиков весьма разнообразны и
определяются химической природой антибиотика. В основном используются
ионообменная хроматография и другие современные физико-химические методы.
.3 Методы анализа антибиотиков
Для качественной идентификации антибиотиков, в отличие от ряда групп
природных соединений (алкалоиды, гликозиды), не существует общих, групповых реакций.
Различные антибиотики дают те или другие реакции, преимущественно цветные.
Для идентификации антибиотиков в настоящее время широко используется
спектральная характеристика.
Для количественного определения антибиотиков используются различные
методы: биологические, химические, физико-химические.
Биологические методы основаны на непосредственном биологическом действии
антибиотика на применяемый тест-микроорганизм, чувствительный к данному
антибиотику.
Из биологических методов количественного определения антибиотиков
наибольшее распространение получил метод диффузии в агар с турбидиметрическим
определением, основанным на измерении концентрации клеток тест-микроба,
образующих определенную оптическую плотность среды (мутность) в результате их
роста в присутствии небольшого количества антибиотиков.
Недостатками биологических методов контроля являются затраты большого
количества времени на анализ, а также зависимость точности результатов анализа
от многих внешних факторов.
В последние годы широкое распространение для количественного определения
антибиотиков получили химические и физико-химические методы, из которых
наибольшее применение имеют фотоколориметрический и спектрофотометрический
методы. Последние основаны на использовании определенных свойств антибиотиков:
цветные реакции, появление или исчезновение характерных полос в УФ- или
ИК-областях спектра под воздействием различных реагентов (кислот, щелочей и
др.).
.4 Основные классификации антибиотиков
В основу классификации антибиотиков положено несколько разных принципов.
По способу получения их делят:
· на природные;
· синтетические;
· полусинтетические (на начальном этапе получают естественным
путем, затем синтез ведут искусственно).
Продуценты антибиотиков:
· по преимуществу актиномицеты и плесневые грибы;
· бактерии (полимиксины);
· высшие растения (фитонциды);
· ткани животных и рыб (эритрин, эктерицид).
По направленности действия:
· антибактериальные;
· противогрибковые;
· противоопухолевые.
По спектру действия - числу видов микроорганизмов, на которые действуют
антибиотики:
· препараты широкого спектра действия (цефалоспорины 3-го
поколения, макролиды);
· препараты узкого спектра действия (циклосерин, линкомицин,
бензилпенициллин, клиндамицин). В некоторых случаях могут быть
предпочтительнее, так как не подавляют нормальную микрофлору.
1.5 Классификация по химическому строению
По химическому строению антибиотики делятся на:
· бета-лактамные антибиотики;
· аминогликозиды;
· тетрациклины;
· макролиды;
· линкозамиды;
· гликопептиды;
· полипептиды;
· полиены;
· антрациклиновые антибиотики.
Основу молекулы бета-лактамных антибиотиков составляет бета-лактамное
кольцо. К ним относятся:
· биосинтетические (пенициллин G - бензилпенициллин);
· аминопенициллины (амоксициллин, ампициллин, бекампи-циллин);
· полусинтетические "антистафилококковые" пенициллины
(оксациллин, метициллин, клоксациллин, диклоксациллин, флуклоксациллин),
основное преимущество которых - устойчивость к микробным бета-лактамазам, в
первую очередь стафилококковым;
. цефалоспорины - это природные и полусинтетические антибиотики,
полученные на основе 7-аминоцефалоспориновой кислоты и содержащие цефемовое
(также бета-лактамное) кольцо,
т. е. по структуре они близки к пенициллинам. Они делятся на
иефалоспорины:
· 1-го поколения - цепорин, цефалотин, цефалексин;
· 2-го поколения - цефазолин (кефзол), цефамезин, цефаман-дол
(мандол);
· 3-го поколения - цефуроксим (кетоцеф), цефотаксим
(кла-форан), цефуроксим аксетил (зиннат), цефтриаксон (лонга-цеф), цефтазидим
(фортум);
· 4-го поколения - цефепим, цефпиром (цефром, кейтен) и др.;
. монобактамы - азтреонам (азактам, небактам);
. карбопенемы - меропенем (меронем) и имипинем, применяемый только в
комбинации со специфическим ингибитором почечной дегидропептидазы циластатином
- имипинем/цилас-татин (тиенам).
Аминогликозиды содержат аминосахара, соединенные гликозидной связью с
остальной частью (агликоновым фрагментом) молекулы. К ним относятся:
· синтетические аминогликозиды - стрептомицин, гентамицин
(гарамицин), канамицин, неомицин, мономицин, сизомицин, тобрамицин (тобра);
· полусинтетические аминогликозиды - спектиномицин, амика-цин
(амикин), нетилмицин (нетиллин).
Основу молекулы тетрациклинов составляет полифункциональное
гидронафтаценовое соединение с родовым названием тетрациклин.Среди них имеются:
· природные тетрациклины - тетрациклин, окситетрациклин
(клинимицин);
· полусинтетические тетрациклины - метациклин, хлортетрин,
доксициклин (вибрамицин), миноциклин, ролитетрациклин.
Препараты группы макролидов содержат в своей молекуле мак-роциклическое
лактоновое кольцо, связанное с одним или несколькими углеводными остатками. К
ним относятся:
· эритромицин;
· олеандомицин;
· рокситромицин (рулид);
· азитромицин (сумамед);
· кларитромицин (клацид);
· спирамицин;
· диритромицин.
К линкозамидам относятся линкомицин и клиндамицин. Фармакологические и
биологические свойства этих антибиотиков очень близки к макролидам, и, хотя в
химическом отношении это совершенно иные препараты, некоторые медицинские
источники и фармацевтические фирмы - производители химиопрепаратов, например
делацина С, относят линкозамины к группе макролидов.
Препараты группы гликопептидов в своей молекуле содержат замещенные
пептидные соединения. К ним относятся:
· ванкомицин (ванкацин, диатрацин);
· тейкопланин (таргоцид);
· даптомицин.
Препараты группы полипептидов в своей молекуле содержат остатки
полипептидных соединений, к ним относятся:
· грамицидин;
· полимиксины М и В;
· бацитрацин;
· колистин.
Препараты группы полиенов в своей молекуле содержат несколько сопряженных
двойных связей. К ним относятся:
· амфотерицин В;
· нистатин;
· леворин;
· натамицин.
К антрациклиновым антибиотикам относятся противоопухолевые антибиотики:
· доксорубицин;
· карминомицин;
· рубомицин;
· акларубицин.
Есть еще несколько достаточно широко используемых в настоящее время в
практике антибиотиков, не относящихся ни к одной из перечисленных групп:
фосфомицин, фузидиевая кислота (фузидин), рифампицин.
.6 Классификация антибиотиков по механизму антимикробного
действия
По механизму антимикробного действия антибиотики можно разделить на
следующие группы:
· ингибиторы синтеза клеточной стенки (муреина);
· вызывающие повреждение цитоплазматической мембраны;
· подавляющие белковый синтез;
· ингибиторы синтеза нуклеиновых кислот.
К ингибиторам синтеза клеточной стенки относятся:
· бета-лактамные антибиотики - пенициллины, цефалоспорины,
монобактамы и карбопенемы;
· гликопептиды- ванкомицин, клиндамицин.
Механизм блокады синтеза бактериальной клеточной стенки ванкомицином.
отличается от такового у пенициллинов и цефалоспоринов и соответственно не
конкурирует с ними за места связывания. Поскольку пептидогликана нет в стенках
животных клеток, то эти антибиотики обладают очень низкой токсичностью для
макроорганизма, и их можно применять в высоких дозах (мегатерапия).
К антибиотикам, вызывающим повреждение цитоплазматической мембраны
(блокирование фосфолипидных или белковых компонентов, нарушение проницаемости
клеточных мембран, изменение мембранного потенциала и т. д.), относятся:
· полиеновые антибиотики - обладают ярко выраженной
противогрибковой активностью, изменяя проницаемость клеточной мембраны путем
взаимодействия (блокирования) со стероидными компонентами, входящими в ее
состав именно у грибов, а не у бактерий;
· полипептидные антибиотики.
Самая многочисленная группа антибиотиков - подавляющие белковый синтез.
Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса
считывания информации с ДНК и кончая взаимодействием с рибосомами -
блокирование связывания транспортной т-РНК с ЗОБ-субъединицами рибосом
(аминогликозиды), с 508-субъединицами рибосом (макролиды) или с информационной
и-РНК (на 308-субъединице рибосом - тетрациклины). В эту группу входят:
· аминогликозиды (например, аминогликозид гентамицин, угнетая
белковый синтез в бактериальной клетке, способен нарушать синтез белковой
оболочки вирусов и поэтому может обладать противовирусным действием);
· макролиды;
· тетрациклины;
· хлорамфеникол (левомицетин), нарушающий синтез белка
микробной клеткой на стадии переноса аминокислот на рибосомы.
Ингибиторы синтеза нуклеиновых кислот обладают не только антимикробной,
но и цитостатической активностью и поэтому используются как противоопухолевые
средства. Один из антибиотиков, относящихся к этой группе, - рифампицин -
ингибирует ДНК-зависимую РНК-полимеразу и тем самым блокирует синтез белка на
уровне транскрипции.
2. Пенициллины
2.1 Характеристика пенициллинов
В основе строения природных и синтетических пенициллинов лежит
6-аминопенициллановая кислота (6-АПК), в структуру которой входят два
конденсированных гетероцикла - азетидиновый и тиазолидиновый, имеющие общий
атом азота:
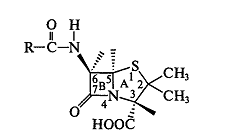
В молекуле пенициллина три асимметрических атома углерода - 3-, 5-, 6-й.
Механизм действия пенициллинов связан с ингибированием биосинтеза белков
клеточных стенок грамположительных бактерий (стрептококков, стафилококков,
пневмококков). При этом происходит дезактивация клеточной транспептидазы,
катализирующей поперечное сшивание белков. Фермент ошибочно принимает структуру
пенициллина за дипептиды, составленные из α-аминокислот - серина, цистеина и
валина:
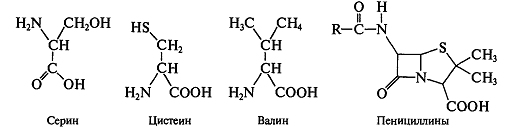
Развитие резистенции к пенициллинам связано с синтезом микроорганизмами
фермента пенициллиназы, катализирующей раскрытие лактамного цикла пенициллинов.
При этом пенициллины превращаются из производных 6-аминопенициллановой кислоты
в производные пенициллоиновой кислоты. Аналогичное раскрытие цикла происходит
под действием кислот, что делает невозможным пероральное применение
пенициллина:
Из природных пенициллинов наименьшую токсичность проявляет
бензилпенициллин. В настоящее время синтезированы и широко применяются
полусинтетические пенициллины, устойчивые к действию кислот и лактамаз. Среди
них в первую очередь следует упомянуть феноксиметилпенициллин, ампициллин, амоксициллин.
Некоторые бета-лактамные антибиотики, полученные полусинтетическим путем
(оксациллин, клоксациллин, диклоксациллин, метициллин, новые поколения
цефалоспоринов) устойчивы в отношении бета-лактамаз и действуют на штаммы
резистентных микроорганизмов.
В последнее время созданы специфические ингибиторы бета-лактамаз
(клавулановая кислота, сульбактам):
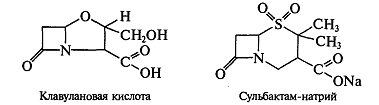
Эти соединения, подобно бета-лактамным антибиотикам, содержат лактамное
кольцо и способны необратимо ингибировать бета-лактамазы. При этом сами
ингибиторы бета-лактамаз обладают весьма слабой антимикробной активностью. Но
при сочетании их с антибиотиками создают условия для проявления антимикробных
свойств. Комбинированное применение их с антибиотиками повышает устойчивость и
активность последних. Применение ингибиторов бета-лактамаз позволило создать
ряд высокоэффективных комбинированных антибиотических препаратов (уназин,
аугметин, тазомицин и др.).
.2 Синтез и получение пенициллинов
Пенициллины могут быть выделены из природных материалов биосинтетически
или комбинацией методов биологического и химического синтеза.
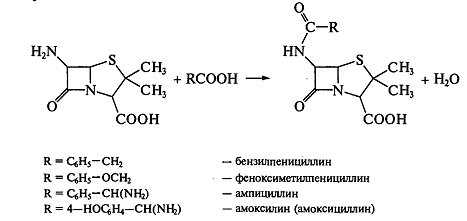
При промышленном производстве пенициллинов сначала получают
аминопенициллановую кислоту из культуры плесневого гриба Pénicillium
chrysogenum или Pénicillium
notatum, а затем
микробиологическим или химическим способом проводят ацилирование аминогруппы
карбоновой кислотой или ее хлорангидридом:
Отобранные для микробиологического синтеза в результате селекции
промышленные штаммы плесени позволяют получать более 3 мг/мл бензилпенициллина
за 90-120 ч ферментации, что в сотни раз больше, чем удавалось получать
пенициллина из природный штаммов. В состав питательной среды обычно входит 1-
4% кукурузного экстракта, 3-5% лактозы, 1-2% глюкозы, 0,2-0,5% животного или
растительного жира, небольшие количества минеральных солей.
При биосинтезе пенициллинов в питательную среду добавляют вещества -
«предшественники», которые используются плесневым грибом для замещения атома
водорода в аминогруппе молекул пенициллинов. В частности, при производстве
бензилпенициллина предшественником служит фенилуксусная кислота или ее
производные, для биосинтеза феноксиметилпенициллина - феноксиуксусная кислота и
т.д. Однако не любой радикал может быть введен в молекулу пенициллинов таким
способом.
Исследование биосинтеза пенициллина с помощью меченых атомов позволило
установить, что формирование молекулы осуществляется за счет содержащихся в
питательной среде аминокислот (цистеина, валина) и соответствующих веществ -
«предшественников».
Процесс биосинтеза пенициллинов происходит в асептических условиях при
непрерывной аэрации воздухом, температуре около 24°С, рН 6,0-6,5 и должен
сопровождаться постоянным перемешиванием. Наличие жира в питательной среде
оказывает пеногасящее действие и одновременно стимулирует процесс биосинтеза
пенициллинов.
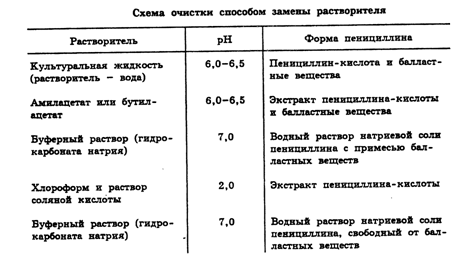
Выделение пенициллина из культуральной жидкости осуществляют
фильтрованием или центрифугированием. Вначале мицелий и нерастворимые
минеральные соли отделяют от культуральной жидкости. Очистку культуральной
жидкости и выделение из нее пенициллина последовательно проводят способом
замены растворителя (Табл. 1):
Таблица 1
Отделяют пенициллины друг от друга различными способами: адсорбционной
хроматографией (на активированном угле или оксиде алюминия); распределительной
хроматографией (на силикагеле) или противоточным распределением. Воду из
растворов удаляют при температуре от -20 до -30°С и глубоком вакууме
(лиофильная сушка) или пользуясь распылительной сушилкой, что позволяет
предотвратить разложение. Кристаллические соли высокой степени чистоты получают
перекристаллизацией из органических растворителей.
Особенно широко для очистки пенициллинов применяют ионообменную сорбцию.
Суть метода состоит в том, что водные растворы антибиотиков пропускают через
колонки с ионообменными смолами (катионитами или анионитами). В зависимости от
химических свойств антибиотика и вида смолы на ней будет сорбироваться либо
антибиотик, либо содержащиеся в растворе примеси. Подбирая соответствующие
условия сорбции, достигают высокой степени очистки.
Бензилпенициллин и созданные на его основе многочисленные лекарственные
формы отличаются наиболее высокой химиотерапевтической эффективностью и
наименьшей токсичностью. Однако бета-лактамный цикл бензилпенициллина легко
разрушается под действием фермента пенициллиназы (бета-лактамазы),
продуцируемой многими микроорганизмами. Эти обстоятельства послужили
предпосылкой создания полусинтетических пенициллинов. Решение такой сложной
проблемы стало возможным,после выделения в 1957 г. 6-аминопенициллановой
кислоты (6-АПК), являющейся "ядром" пенициллина. Получают 6-АПК из бензилпенициллина
(или других пенициллинов), воздействуя ферментом пенициллинацилазой,
продуцируемым бактериями. Реже используют химические методы расщепления
пенициллинов до 6-АПК. Процесс происходит по схеме:
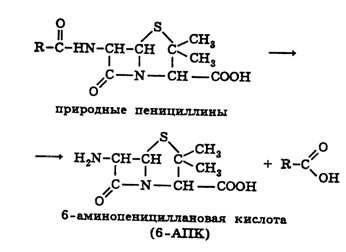
Извлекают 6-АПК из водного гидролизата экстракцией или с помощью
ионообменной хроматографии.
На основе 6-АПК синтезировано большое количество полусинтетических
пенициллинов, представляющих собой ацильные производные. В качестве ацилирующих
агентов используют хлорангидриды карбоновых кислот:
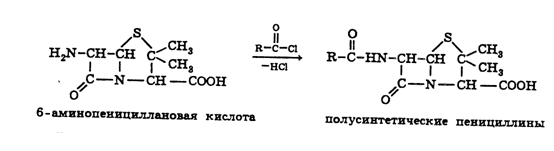
Некоторые из синтезированных полусинтетических пенициллинов, сохраняя
высокую эффективность и низкую токсичность бензилпенициллина, приобрели новые
качества, например, повышение устойчивости и расширение спектра действия. В
результате разработаны и внедрены в производство такие полусинтетические
пенициллины, как оксациллин, ампициллин» карбенициллин, диклоксациллин,
карфециллин и др.
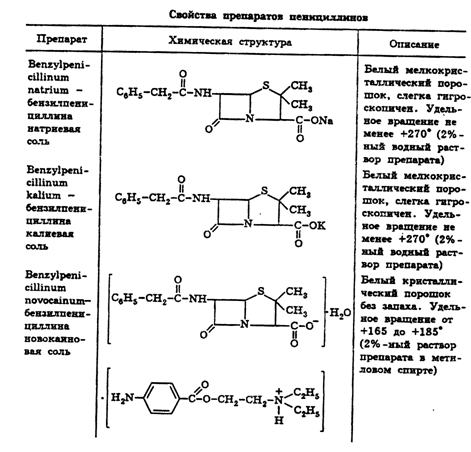
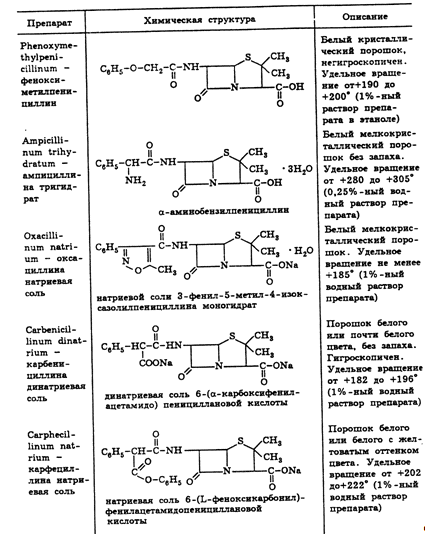
2.3 Свойства пенициллинов
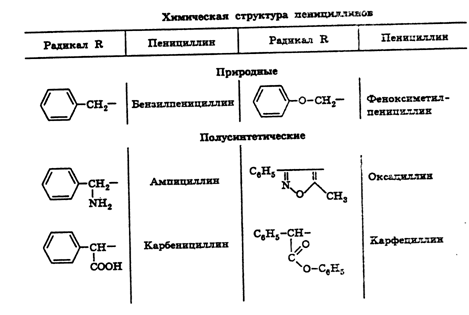
В настоящее время из многочисленных известных природных пенициллинов
медицинское применение имеет натриевая, калиевая, новокаиновая соли
бензилпенициллина и феноксиметилпенициллин. Полусинтетические пенициллины
характеризуются наличием в молекуле ароматического или гетероциклического радикала.
Из них наиболее широко применяют ампициллин, оксациллин, карбенициллина
динатриевую соль, карфециллина натриевую соль (табл. 2).
Таблица 2.
По физическим свойствам препараты природных пенициллинов и их синтетические
аналоги представляют собой белые или почти белые кристаллические порошки без
запаха. Натриевая и калиевая соли бензилпенициллина слегка гигроскопичны.
Карбенициллина динатриевая соль гигроскопична, а феноксиметилпенициллин
негигроскопичен (табл. 3).
Таблица 3.
Натриевая и калиевая соли бензилпенициллина, натриевые соли оксациллина и
карфециллина, динатриевая соль карбенициллина очень легко или легко растворимы
в воде. Новокаиновая соль бензилпенициллина, феноксиметилпенициллин и
ампициллин мало или очень мало растворимы в воде. Натриевая и калиевая соли
бензилпенициллина, феноксиметилпенициллин растворимы в этиловом и метиловом
спиртах, новоканновая соль бензилпенициллина мало в них растворима. В этаноле
натриевая соль карфециллина практически нерастворима, натриевая соль
оксациллина трудно растворима» а динатриевая соль карбенициллина медленно
растворима. Препараты, представляющие собой натриевые и калиевые соли
пенициллинов, а также ампициллин практически нерастворимы в хлороформе и эфире.
Феноксиметилпенициллин умеренно растворим в хлороформе, новокаиновая соль
бензилпенициллина трудно в нем растворима.
2.4 Определение подлинности
Подлинность препаратов пенициллинов подтверждают с помощью УФ- и
ИК-спектрофотометрии. НТД рекомендует устанавливать значения оптических
плотностей растворов солей бензилпенициллина при длинах волн 280 и 263 нм,
разность между которыми должна быть не менее 0,72. У феноксиметилпенициллина
при 268 и 274 нм имеются максимумы поглощения, а при 272 нм - минимум
поглощения, причем отношение оптических плотностей раствора препарата при
длинах волн 268 и 274 нм должно быть в пределах 1,21-1,24. Для растворов
ампициллина устанавливают значения оптических плотностей в максимумах (256,
261, 267 нм) и минимумах (255, 260, 266 нм) поглощения. ИК-спектры препаратов
пенициллина идентифицируют по совпадению с максимумами светопоглощения
соответствующих стандартных образцов в области 4000-400 см-1.
Важная физическая константа препаратов пенициллинов - удельное вращение
водных или спиртовых растворов. Все они вращают плоскость поляризованного луча
вправо (см. табл. 3).
Для испытания подлинности препаратов пенициллинов и их полусинтетических
аналогов используют цветную реакцию, основанную на разрыве бета-лактамного цикла
и образовании медной соли гидроксамовой кислоты (осадок зеленого цвета):
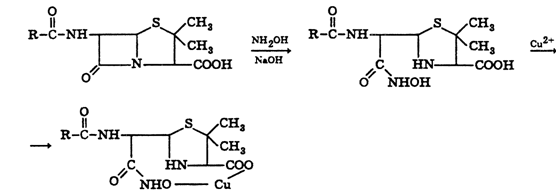
С солями железа (III) гидроксамовая
кислота образует внутри- комплексные соли красного цвета.
В препаратах пенициллинов можно обнаружить органически связанную серу
после превращения ее в сульфид-ион сплавлением с едкими щелочами.
Поскольку соли бензилпенициллина очень слабо диссоциируют в растворах,
для обнаружения ионов натрия или калия необходимо предварительно минерализовать
препарат путем сжигания в тигле. Затем остаток растворяют в воде и фильтруют.
Фильтрат испытывают на ион натрия или калия с помощью соответствующих реакций
(ГФ XI, вып.1, с. 161, 162). Новокаиновую соль бензилпенициллина подвергают
испытанию на первичные ароматические амины (ГФ XI, вып.1, с. 159).
Препараты пенициллина отличают друг от друга по различной окраске
продуктов реакции с хромотроповой кислотой в присутствии концентрированной
серной кислоты. Ампициллин, благодаря наличию в молекуле остатка
фениламиноуксусной кислоты, дает положительную реакцию с нингидрином подобно
аминокислотам, а при взаимодействии с реактивом Фелинга приобретает фиолетовое
окрашивание.
Феноксиметилпенициллин отличают от других пенициллинов по отрицательной
реакции с концентрированной серной кислотой. Раствор остается бесцветным и
после нагревания на водяной бане.
Реактив Марки (раствор формальдегида в концентрированной серной кислоте)
используют для идентификации феноксиметилпенициллина. Наличие в его молекуле
феноксиуксусной кислоты обусловливает образование красного окрашивания смеси
препарата с реактивом. При нагревании на водяной бане наблюдается усиление
интенсивности окраски. Другие пенициллины не образуют окрашенных продуктов при
комнатной температуре, а при нагревании приобретают желтое или желто-бурое
окрашивание (ампициллин), красно-коричневое окрашивание (соли
бензилпенициллина).
Соли бензилпенициллина дают положительную реакцию Витали-Морена подобно
производным тропана. При выпаривании их смеси с дымящей азотной кислой и
последующем гфибавлении спиртового раствора гидроксида калия и ацетона
появляется фиолетовое окрашивание. Если к раствору калиевой или натриевой соли
бензилпенициллина прибавлять по каплям 25%-ный раствор соляной кислоты, то в
осадок выпадает свободный бензилпенициллин, растворимый в избытке соляной
кислоты, а также в этаноле, хлороформе, эфире. Соли бензилпенициллина при
кипячении в 4%-ном растворе гидроксида натрия гидролизуются с образованием
натриевой соли фенилуксусной кислоты, которая после добавления избытка разбавленной
серной кислоты обнаруживается по характерному запаху.
Для идентификации и фотоколориметрического определения солей
бензилпенициллина, феноксиметилпенициллина, натриевой соли оксациллина
используют реакцию, основанную на образовании полиметиновых красителей.
Бензилпенициллин подвергают кислотному гидролизу до бензилпеницилленовой
кислоты, Она вступает в реакцию сочетания с производным глютаконового
альдегида, который образуется (рН 4,9) в результате расщепления пиридинового
цикла под действием тиоцианата хлора. Последний предварительно получают при
взаимодействии хлорамина Б и тиодианата аммония.
В соответствии с требованиями НТД препараты пенициллинов и их
полусинтетических аналогов подвергают испытаниям на токсичность, пирогенность,
стерильность (ГФ XI, вып.2, с. 182, 183, 187), а натриевую и калиевую соли
бензилпенициллина также на термостабильность.
Количественное определение по ГФ состоит из двух этапов: определения
суммы пенициллинов и установления содержания соответствующего препарата.
При анализе препаратов природных пенициллинов (натриевой, калиевой,
новокаиновой солей бензилпенициллина и феноксиметилпенициллина) сумму
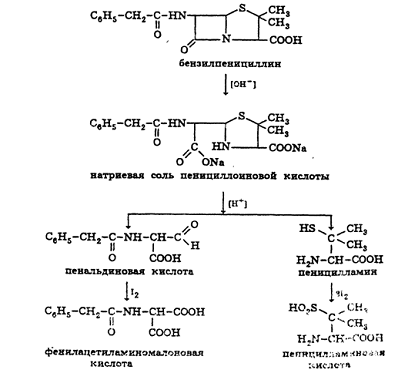
пенициллинов определяют иодометрическим методом. Сущность способа заключается в
том, что продукт инактивации пенициллина (1M раствором гидроксида натрия при комнатной температуре) - натриевую соль
пенициллоиновой кислоты - окисляют иодом. Процесс окисления необходимо
проводить при pH
4,5 (ацетатный буфер).
Схема инактивации и окисления на примере бензилпенициллина:
Определение суммы пенициллинов выполняют обратным йодометрическим
методом. Избыток 0,01 М раствора йода титруют раствором тиосульфата натрия той
же концентрации после 20 мин пребывания ее в темном месте (индикатор крахмал).
Одновременно проводят контрольный опыт с тем же количеством препарата, не
подвергнутого щелочному гидролизу, а также йодометрическое определение ГСО
соответствующего препарата. Все полученные результаты используют при проведении
расчета содержания препарата.
.5 Количественное определение
Количественное определение натриевой, калиевой и новокаиновой солей
бензилпенициллина выполняют гравиметрическим методом. Бензилпенициллин
извлекают амилацетатом и количественно осаждают в виде N-этилпиперидиновой
соли:
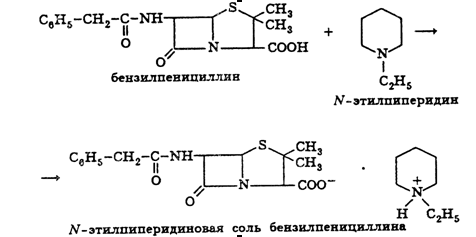
Осадок N-этилпиперидиновой соли бензилпенициллина промывают,
высушивают до постоянной массы и взвешивают. Затем делают пересчет на
соответствующую соль.
В новокаиновой соли бензилпенициллина определяют содержание новокаина,
который извлекают хлороформом в виде основания, тщательно промывают водой,
затем добавляют 0,01 М раствор серной кислоты, избыток которой оттитровывают
0,01 М раствором гидрокеида натрия. Содержание новокаина должно быть не менее
37,5 и не более 40,5% .
Сумму полусинтетических пенициллинов в натриевой соли оксациллина и
динатриевой соли карбенициллина определяют методом обратной нейтрализации. В
его основе лежит количественно происходящий при нагревании на водяной бане
процесс гидролиза 0,1 М раствором гидрокеида натрия до образования производных
пенициллоиновой кислоты:
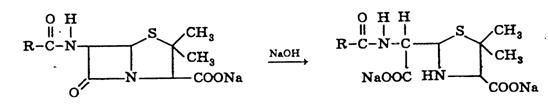
Избыток гидроксида натрия оттитровывают 0,1 М раствором соляной кислоты
(индикатор фенолфталеин).
Ампициллин количественно определяют методом формольного титрования, как
препараты аминокислот. Навеску препарата растворяют в воде, добавляют
разбавленный нейтрализованный раствор формальдегида и через 2 мин титруют
раствором гидроксида натрия (индикатор фенолфталеин). Известен
меркуриметрический метод определения ампициллина с использованием в качестве
титранта нитрата ртути (II) или хлорида ртути (II), а также метод титрования в
неводных растворителях.
Количественное определение карфециллина натриевой соли осуществляют
методом кислотно-основного титрования в сочетании с воздействием на препарат
фермента пенициллиназы. Контроль за значением рН (7,0±0,1) осуществляют
потенциометрически. Титруют навеску препарата 0,1 М раствором гидроксида натрия
при постоянном перемешивании с 1 мл раствора пенициллиназы до тех пор, пока
указанное значение рН будет оставаться неизменным в течение 3 мин.
Активность препаратов пенициллинов устанавливают микробиологическим
методом по антибактериальному действию на определенный штамм золотистого
стафилококка. Одна единица действия соответствует активности 0,5988 мкг
химически чистой натриевой соли бензилпенициллина (1670 ЕД в 1 мг).
Микробиологический метод определения пенициллинов дает воспроизводимость
результатов 5 -10% . Алкалиметрический метод определения суммы пенициллинов
имеет удовлетворительную воспроизводимость, но дает завышенные результаты, так
как одновременно титруются все примеси, взаимодействующие со щелочью.
Наиболее точные, сопоставимые с микробиологическим методом результаты
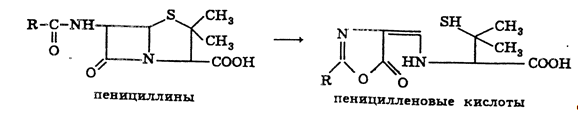
дает спектрофотометрическое определение пенициллинов, основанное на его
гидролизе в кислых буферных растворах до пеницилленовых кислот. Они имеют
максимум све- топоглощения при 322,5 нм. Присутствие ионов меди (II) повышает
чувствительность реакции и воспроизводимость результатов определения. Этот способ
определения рекомендован для количественной оценки полусинтетических
пенициллинов: ампициллина, оксациллина, карбенициллина, диклоксациллина и др.
Общая схема гидролиза пенициллинов в кислой среде с образованием пеницилленовых
кислот может быть представлена следующим образом:
Феноксиметилпенициллин определяют спектрофотометрическим методом при
длине волны 268 нм, используя в качестве растворителя раствор гидрокарбоната
натрия (4 мл 5%-ного раствора на 500 мл воды). Параллельно - в тех же условиях
определяют ГСО феноксиметилпенициллина.
Для определения бензилпенициллина натриевой и калиевой соли,
феноксиметилпенициллина, диклоксациллина натрия, ампициллина и его натриевой
соли МФ также рекомендовано спектрофотометрическое определение. Оно основано на
взаимодействии раствора препарата при нагревании на водяной бане с имидазолом и
хлоридом ртути (II). Светопоглощение полученного раствора измеряют при 325 нм
относительно смеси реактивов. Фотоколориметрические методы определения
природных пенициллинов основаны на реакциях образования окрашенных
гидроксаматов железа или меди.
2.6 Хранение и применение пенициллинов
Препараты пенициллинов хранят по списку Б, в сухом месте, при комнатной
температуре. Упаковывают соли бензилпенициллина во флаконы, герметически
закрытые резиновыми пробками, обжатыми алюминиевыми колпачками. Калиевая и
натриевая соли бензилпенициллина содержат в каждом флаконе по 125 000, 250 000,
500 000 и 1 000 000 ЕД; новокаиновая соль бензилпенициллина - по 300 000, 600
000, 1 200 000 ЕД. Ампициллин хранят в банках оранжевого стекла вместимостью по
0,5 кг, а феноксиметилпенициллин и оксациллина натриевую соль - в стеклянных
банках или полиэтиленовых пакетах. Карбенициллина динатриевую соль хранят при
температуре не выше 4-5 °С, карфециллина натриевую - не выше +10°С в сухом,
защищенном от света месте.
Препараты природных, пенициллинов применяют для лечения пневмонии,
гонореи, сифилиса, раневых и гнойных инфекций, перитонита, дифтерии,
скарлатины, ангин различной этиологии и инфекционных заболеваний, вызванных
чувствительными к пенициллину микроорганизмами. Полусинтетические аналоги имеют
более широкий спектр антибактериального действия.
Препараты отличаются друг от друга по продолжительности действия и по
эффективности при различных путях введения. Натриевую и калиевую соли
бензилпенициллина вводят главным образом внутримышечно и подкожно по 200 000-1
500 000 ЕД в сутки в 3-6 приемов. Новокаиновая соль бензилпенициллина при
внутримышечном введении обеспечивает пролонгированное действие в течение 12-18
ч. Поэтому препарат вводят 2-3 раза в сутки в количестве до 600000 ЕД в виде
суспензии. Устойчивость феноксиметилпенициллина, ампициллина и оксациллина в
кислой среде желудочного сока позволяет применять эти препараты перорально.
Феноксиметилпенициллин назначают по 0,2 г, ампициллин - по 0,25-0,5 г 4-6 раз в
сутки. Оксациллина натриевую соль вводят внутрь по 0,25-0,5 г (суточная доза
3,0 г) или внутримышечно до 2,0-4,0 г в сутки. Карбенициллина динатриевую соль
вводят внутримышечно по 4,0-8,0 г, а внутривенно (капельно) до 20-30 г в сутки.
Карфециллина натриевую соль назначают внутрь по 1,0 г (до 3,0 г в сутки).
Применяют препараты пенициллина пролонгированного действия, позволяющие
2-4 недели сохранять терапевтическую концентрацию в крови: бициллин-1,
бициллин-3, бициллин-5.
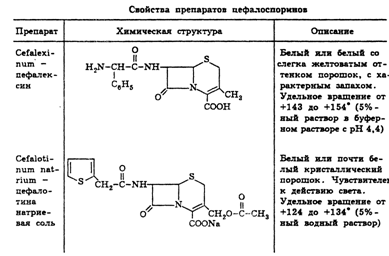
3. Цефалоспорины
.1 Характеристика цефалоспоринов
В молекуле цефалоспоринов бета-лактамное кольцо конденсировано с
шестчленным тиазиновым циклом:
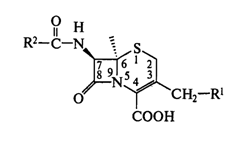
В зависимости от природы радикалов R1 и R2 меняется
структура, а значит, и биологическая активность антибиотика. Поскольку в
отличие от пенициллинов возможно варьирование заместителей не только по
7-аминогруппе, но и в положении С3, круг создаваемых ЛC этой группы оказывается значительно
шире.
Цефалоспорины, подобно пенициллинам, ингибируют транспептидазу белковой
молекулы, участвующей в формировании структуры клеточной мембраны патогенных
бактерий. Некоторые из них действуют как на грамположительные, так и на грамотрицательные
бактерии. Таким образом, спектр действия ряда цефалоспоринов существенно шире
по сравнению с пенициллинами. Эти препараты значительно более устойчивы к
бета-лактамазам, чем пенициллины.
1. Цефалоспорины первого поколения - цефалоридин, цефалотин,
цефалопирин, цефрадин, цефазолин, цефалоклор, цефадроксил. Основной
особенностью цефалоспоринов первого поколения является их высокая
антистафилококковая активность, в том числе против устойчивых к
бензилпенициллину штаммов, в отношении всех видов стрептококков (за исключением
энтерококков), гонококков.
2. Цефалоспорины второго поколения - цефуроксим, цефаклор, цефотиам,
цефсулодин, цефетамет и некоторые другие. Цефалоспорины второго поколения также
обладают высокой антистафилококковой активностью, в том числе в отношении
пенициллоустойчивых штаммов. Они высокоактивны также в отношении Е. coli, простейших.
. Цефалоспорины третьего поколения - цефотаксим, цефоперазон,
цефтриаксон, цефтазидим, цефодизим, цефамет и некоторые другие. Эти антибиотики
обладают более широким спектром действия, чем цефалоспорины первого и второго
поколений, и большей активностью в отношении грамотрица- тельных бактерий. Они
оказывают ингибирующее действие на продуцентов пенициллиназ и цефалоспориназ.
. Цефалоспорины четвертого поколения - цефпиром, цефепим - имеют
особые отличия. Подобно цефалоспоринам второго и третьего поколений, они
обладают устойчивостью к плазмидным бета-лактамазам грамотрицательных бактерий,
но кроме того, они устойчивы к действию хромосомных бета-лактамаз и, в отличие
от других цефалоспоринов, проявляют высокую активность практически в отношении
всех анаэробных бактерий, а также бактероидов. В отношении грамположительных
микроорганизмов они несколько менее активны, чем цефалоспорины первого
поколения, и не превышают по активности действие цефалоспоринов третьего
поколения на грамотрицательные микроорганизмы, но устойчивость по отношению к
инактивации бета-лактамазами и высокая эффективность в отношении анаэробов
является их уникальной особенностью.
Цефалоспорины значительно реже, чем пенициллины, вызывают побочное
действие аллергического характера, имеют низкую токсичность.
3.2 Синтез и получение цефалоспоринов
Цефалоспорин С получают ферментативным путем; его активность невелика и
практического применения он не нашел, однако является источником получения
аминоцефалоспорановой кислоты, используемой для последующего синтеза
полусинтетических цефалоспоринов.
Природные цефалоспорины являются продуктами метаболизма грибов Сephalosporinum salmosynnematum и Сephalosporinum acremonium. В настоящее время используется
большое число антибиотиков этой группы не только природных, но и полученных полусинтетическим
путем.
Цефалотин и цефалексин - полусинтетические цефалоспорины.
Схему получения цефалоспоринов рассмотрим на примере цефалотина.
Полученный ферментативным методом цефалоспорин С окисляют гипохлоритом натрия в
присутствии муравьиной кислоты:
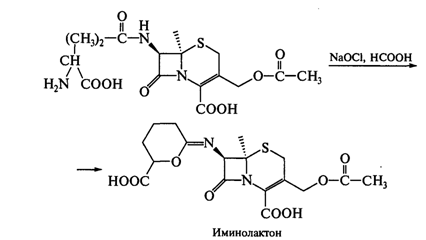
Иминолактон легко гидролизуется до 7-аминоцефалоспорановой кислоты (она
не может быть получена как аминопенициллановая кислота - ферментативно):
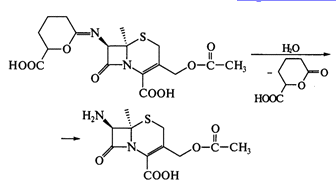
Далее проводят ацилирование кислоты по 7-аминогруппе:
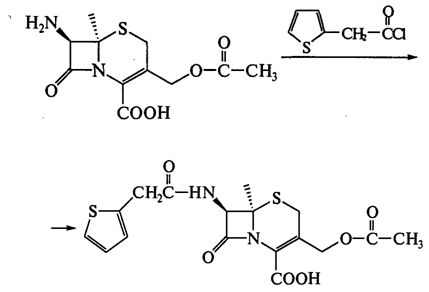
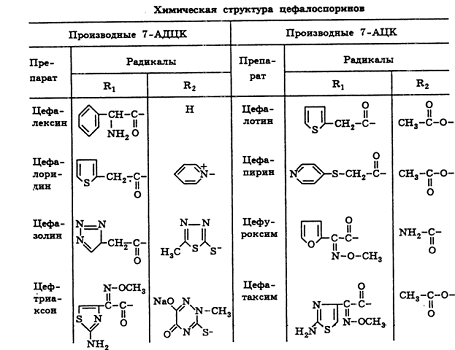
На основе 7-АДЦК были получены цефалексин, цефалоридин и др (табл. 4.).
Таблица 4.
.3 Свойства цефалоспоринов
Химические свойства цефалоспоринов обусловлены наличием карбоксильной
группы, поэтому они могут образовывать соли, в виде которых некоторые из них
применяют в медицинской практике.
По физическим свойствам препараты представляют собой белые порошки. Они
практически нерастворимы в хлороформе и эфире. Цефалотина натриевая соль легко
растворима в воде и мало растворима в этаноле, цефалексин трудно растворим в
воде и практически нерастворим в этаноле.
Наличие сопряженных двойных связей в молекулах цефалоспоринов
обусловливают характерную полосу поглощения в УФ-спектрах с максимумом
поглощения в области 260 нм. У цефалексина кроме этого имеется еще один
хромофор - фенильный радикал. Для испытания подлинности цефалотина натриевой
соли устанавливают наличие в УФ-спектре водного раствора максимума поглощения при
237 нм, а также «плеча» при 265 нм, наличие которого связано с циклической
системой 7-аминоцефалоспорановой кислоты. Согласно
требованиям ФС 0,002%-ный раствор цефалотина натриевой соли при длине волны 237
нм в кювете с рабочей длиной 10 мм должен иметь оптическую плотность не менее
0,65 и не более 0,72 (раствор сравнения вода) (табл. 5).
Таблица 5.
.4 Определение подлинности
Объективное заключение о подлинности цефалоспориновых антибиотиков
позволяют сделать ИК-спектры в области 4000- 400 см-1. С их помощью
можно установить наличие или отсутствие ацетоксигруппы в боковой цепи по С3
дигидротиазинового цикла и подтвердить отнесение испытуемого препарата к числу
производных 7-АДЦК (цефалексин, цефалоридин, цефазолин, цефтриаксон) или 7-АЦК
(цефалотин, цефапирин, цефатаксим, цефуроксим). Для всех цефалоспоринов общими
являются полосы в области колебаний карбонильных групп (1800-1500 см-1)
и карбоксильной группы (1620-1600 см-1). В другой области более
высоких частот (3500-2500 см-1), обусловленной валентными
колебаниями амино- и амидогрупп, ИК-спектры имеют существенные различия.
Наиболее специфические спектральные кривые цефалоспориновых антибиотиков
расположены в области "отпечатков пальцев" (1500-650 см-1).
Перспективным для идентификации оказался метод спектроскопии ЯМР 1Н
с использованием в качестве растворителя диметилсульфоксида. Выделены сигналы
протонов бета-лактамных и дигидротиазиновых циклов, по которым проведено
отнесение анализируемых соединений к цефалоспориновым антибиотикам. Кроме того,
метод позволяет по характерным сигналам протонов ацильных остатков в боковой
цепи бета-лактамного фрагмента и радикалов в положении 3 дигидротиазинового
цикла провести надежную идентификацию каждого из цефалоспориновых антибиотиков.
Подлинность препаратов цефалоспоринов можно установить, действуя смесью
80%-ного раствора серной кислоты и 1%-ного раствора азотной кислоты. Цефалексин
приобретает желтое окрашивание, а цефалотина натриевая соль - оливково-зеленое,
переходящее в красно-коричневое. Открывают также ион натрия в натриевой соли
цефалотина.
Наличие бета-лактамного цикла у препаратов цефалоспоринов, а у цефалотина
еще и сложноэфирной группы, обусловливает протекание гидроксамовой реакции.
Методика выполнения такая же, как и в случае анализа препаратов пенициллинов.
Образуются окрашенные гидроксаматы меди (II) и железа (III).
Цефалексин характеризуется наличием в молекуле остатка алифатической
аминокислоты, которую можно обнаружить с помощью нингидрина. Аминокислотный
остаток дает возможность идентифицировать цефалексин по реакции
комплексообразования с ионом меди (II) в среде уксусной кислоты. После
добавления раствора гидроксида натрия в нейтральной среде появляется
оливково-зеленое окрашивание.
Наличие специфических примесей в цефалотина натриевой соли (не более 5%)
устанавливают методом ГЖХ по сумме площадей всех пиков на хроматограмме, кроме
пика основного вещества. Этим же методом определяют содержание остаточных
растворителей (эфира и н-пропилового спирта).
3.5 Количественное определение
Количественное определение цефалексина и цефалотина натриевой соли
основано на предварительном щелочном гидролизе до образования производных
цефалоспориновой кислоты (соответственно 7-АДЦК и 7-АЦК). Продукты гидролиза
затем окисляют титрованным раствором иода. Параллельно в тех же условиях
анализируют стандартные образцы препаратов. Химический процесс, лежащий в
основе иодометрического определения препаратов цефалоспоринов, сходен с
химизмом инактивации и окисления природных пенициллинов.
Цефалексин проявляет в растворах амфотерные свойства, обусловленные
наличием в молекуле карбоксильной и алифатической аминогрупп. Поэтому
количественное определение может быть выполнено методом неводного титрования с
использованием в качестве растворителей муравьиной и ледяной уксусной кислот в
смеси с ацетоном. Это приводит к усилению основных свойств цефалексина и его
оттитровывают диоксановым раствором хлорной кислоты:
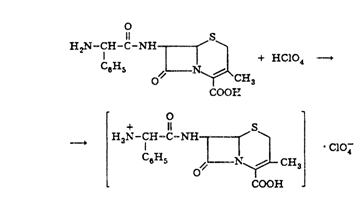
Точку эквивалентности устанавливают потенциометрическим методом.
Для количественного определения цефалоспориновых антибиотиков используют
меркуриметрический метод. Описана методика спектрофотометрического определения
цефалексина и других цефалоспоринов, основанная на образовании окрашенных
комплексов с ионом меди (II) и измерении светопоглощения при рН 6,55 в области
640-675 нм. Реактивом служит ацетат меди (II).
.6 Хранение и применение цефалоспоринов
Препараты цефалоспоринов хранят по списку Б, в сухом защищенном от света
месте при комнатной температуре. Цефалексин выпускают в капсулах по 0,25 г.
Цефалоспорины обладают более широким, чем пенициллины, спектром
антибактериального действия в отношении грам положительных и грамотрицательных кокковых микроорганизмов, спирохет,
сибиреязвенных палочек.
Натриевые соли цефалоспоринов применяют внутримышечно, реже внутривенно и
внутриплеврально при острых и хронических заболеваниях дыхательных органов,
мочевых путей, половых органов, при послеоперационных и других инфекциях. Ряд
цефалоспоринов (цефалоглицин, цефалексин) эффективны при пероральном
применении.
4. Экспериментальная часть
.1 Методика исследования
Бензилпенициллина натриевая сольNatricum16H17N2NaО4S
Бензилпенициллина натриевая соль является солью бензилпенициллиновой
кислоты, продуцируемой Pénicillium notatum или другими родственными организмами,
или получаемой другими методами и обладающей антимикробным действием.
Содержание C16H17N2NaО4S не менее 90% и содержание суммы пени- циллинов в препарате не
менее 96%.
При определении активности биологическим методом общая активность
препарата (сумма пенициллинов) не менее 96%. Теоретическая активность натриевой
соли бензилпенициллина 1670 ЕД/мг. 0,0005988 мг химически чистой натриевой соли
бензилпенициллина соответствует одной единице действия (ЕД).
Точность определения должна быть такова, чтобы доверительные пределы при
Р=95% отклонялись от среднего значения не более чем на ±5% .
Средняя величина найденной активности должна быть не менее 1600 EД/мг.
Описание. Белый мелкокристаллический порошок горького вкуса, слегка
гигроскопичен. Легко разрушается при действии кислот, щелочей и окислителей,
при нагревании в водных растворах, а также при действии пенициллиназы. Медленно
разрушается при хранении в раствора при комнатной температуре.
Растворимость. Очень легко растворим в воде, растворим в этиловом и
метиловом спиртах.
Подлинность. Несколько кристаллов препарата помещают на предметное стекло
или в фарфоровую чашку, прибавляют 1 каплю раствора, состоящего из 1 мл 1Н
раствора гидроксиламина гидрохлорида и 0,3 мл 1Н раствора едкого натра. Через
2-3 минуты к смеси прибавляют 1 каплю 1Н раствора уксусной кислоты, тщательно
перемешивают, затем прибавляют 1 каплю раствора нитрата меди; выпадает осадок
зеленого цвета.
мл раствора препарат подкисляют разведенной уксусной кислотой, если
необходимо, фильтруют, затем прибавляют 0,5 мл раствора цинк-уранил-ацетата;
образуется желтый кристаллический осадок.
Препарат, внесенный в бесцветное пламя, окрашивает его в желтый цвет
(реакция на натрий).
Прозрачность и цветность раствора. 3% раствор препарата в воде для
инъекций должен быть бесцветным и прозрачным в течение 24 часов при температуре
не выше 10°.
Удельное вращение не менее +270° (2% раствор препарата в свеже-
прокипяченной и охлажденной воде).
Показатель поглощения. Оптическая плотность 0,18% свежеприготовленного
раствора препарата в кювете с толщиной слоя 1 см при длине волны 280 нм не более
0,18. Разность между оптическими плотностями при длинах волн 263 нм и 280 нм не
менее 0,72.
Кислотность или щелочность. рН 5,5-7,5 (2% водный раствор,
потенциометрически).
Потеря в весе при высушивании. Около 2 г препарата (точная навеска) сушат
при 100-105° до постоянного веса. Потеря в весе не должна превышать 1%.
Испытание на токсичность. Тест-доза 5000 ЕД в объеме 0,5 мл воды,
внутривенно. Срок наблюдения 24 часа.
Испытание на пирогенность. Тест-доза 5000 ЕД в 1 мл воды на 1 кг,
внутривенно. Препарат, предназначенный для наружного применения, не
подвергается испытанию на пирогенность.
Испытание на стерильность. Препарат должен быть стерильным.
Количественное определение.
Сумма пенициллинов. Около 0,06 г препарата (точная навеска) растворяют в
воде в мерной колбе емкостью 100 мл, доводят объем раствора водой до метки и
перемешивают. 5 мл раствора переносят в коническую колбу с притертой пробкой
емкостью 250 мл, прибавляют 2 мл 1Н раствора едкого натра и оставляют на 20
минут. После этого к смеси прибавляют 2 мл 1Н раствора соляной кислоты, 5 мл
0,3М раствора ацетатного буфера (рН 4,50±0,05), 20 мл 0,01Н раствора йода и
оставляют на 20 минут в темном месте. Избыток йода титруют 0,01Н раствором
тиосульфата натрия до слабо желтого цвета, затем прибавляют раствор крахмала и
титруют до обесцвечивания.
В контрольную колбу переносят 5 мл раствора пенициллина, прибавляют 5 мл
0,3М раствора ацетатного буфера (рН 4,50±0,05), 20 мл 0,01Н раствора йода,
оставляют на 20 минут в темном месте, после чего избыток йода титруют 0,01 н.
раствором тиосульфата натрия, как описано выше.
Разность в объемах между титрованиями соответствует содержанию суммы
пенициллинов в препарате.
Один мг стандартного препарата натриевой соли бензилпенициллина
соответствует 1,045 мг суммы пенициллинов, в пересчете на бензилпенициллина
калиевую соль.
Бензилпенициллин. Около 0,06-0,12 г препарата (точная навеска) вносят в
центрифужную пробирку и растворяют в 2 мл воды.
К полученному раствору прибавляют 2 мл амилацетата (реактив №1) и 0,5 мл
раствора фосфорной кислоты. Пробирку закрывают и энергично встряхивают в
течение 15 секунд, после чего центрифугируют 20-25 секунд. Слой амилацетата
отбирают пастеровской пипеткой как можно полнее и фильтруют в сосалку-пробирку,
погруженную в ванну со льдом, через стеклянный фильтр №4, в который
предварительно добавляют 0,1 г измельченного в порошок безводного сульфата натрия.
В предварительно взвешенную плоскодонную колбу емкостью 5 мл вносят 1 мл
ацетона (реактив №2), 0,5 мл смеси N-этилпиперидина с амилацетатом (реактив №3)
и 1 мл амилацетатного фильтрата. Содержимое колбы тщательно перемешивают колбу
помещают в широкий бюкс, закрывают
крышкой и оставляют стоять в холодильнике 2 часа.
Выпавший осадок N-этилпиперидиновой соли бензилненициллина переносят во
взвешенный фильтр.
Колбочку с частично оставшимся осадком и осадок на фильтре промывают 1 мл
ацетона, затем высушивают в вакуум-эксикаторе при комнатной температуре в
течение 1-2 часов до постоянного веса. 1 г осадка соответствует 0,8322 г
калиевой соли бензилпенициллина.
Термостабильность. При нагревании препарата в течение 17 часов при 170°
допускается снижение содержания суммы пенициллинов не более чем на 10%.
Упаковка. Во флаконы, герметически закрытые резиновыми пробками, обжатыми
алюминиевыми колпачками, по 125 000 ЕД, 250 000 ЕД, 500 000 ЕД и 1 000 000 ЕД.
Каждый флакон должен содержать не менее 90% и не более 110% количества ЕД,
указанных на этикетке.
4.2 Результаты исследования
|
Название и лекарственная форма препарата
|
Показатель
|
№ п/п
|
Результат
|
|
Бензилпенициллина натриевая соль
|
Подлинность
|
1
|
Несколько кристаллов препарата помещают на предметное
стекло или в фарфоровую чашку, прибавляют 1 каплю раствора, состоящего из 1
мл 1Н раствора гидроксиламина гидрохлорида и 0,3 мл 1Н раствора едкого натра.
Через 2-3 минуты к смеси прибавляют 1 каплю 1Н раствора уксусной кислоты,
тщательно перемешивают, затем прибавляют 1 каплю раствора нитрата меди;
выпадает осадок зеленого цвета.
|
Соответствует
|
|
Бензилпенициллина натриевая соль
|
Подлинность
|
2
|
Препарат, внесенный в бесцветное пламя, окрашивает его в
желтый цвет (реакция на натрий).
|
Соответствует
|
|
Бензилпенициллина натриевая соль
|
Прозрачность и цветность
|
3
|
3% раствор препарата в воде для инъекций должен быть
бесцветным и прозрачным в течение 24 часов при температуре не выше 10°.
|
Соответствует
|
|
Бензилпенициллина натриевая соль
|
Оптическая плотность
|
4
|
Оптическая плотность 0,18% свежеприготовленного раствора
препарата в кювете с толщиной слоя 1 см при длине волны 280 нм не более 0,18.
Разность между оптическими плотностями при длинах волн 263 нм и 280 нм не
менее 0,72.
|
Соответствует
|
|
Бензилпенициллина натриевая соль
|
Потеря веса при высуши-вании
|
5
|
Около 2 г препарата (точная навеска) сушат при 100-105° до
постоянного веса. Потеря в весе не должна превышать 1%.
|
Соответствует
|
Выводы
В 1942 г. появился термин «антибиотик», которым стали обозначать
образуемые различными микроорганизмами химические вещества, способные подавлять
размножение и вызывать гибель определенных бактерий. Более полным является определение
антибиотиков как высокоактивных метаболических продуктов микроорганизмов,
избирательно подавляющих рост различных бактерий и некоторых опухолей. Наряду с
микроорганизмами некоторые растения (чеснок, лук и др.) также образуют
антибактериальные вещества, называемые фитонцидами.
Появление термина «антибиотик» было связано с получением и внедрением в
лечебную практику нового химиотерапевтического препарата пенициллина,
активность которого в отношении патогенных (гноеродных) кокков и некоторых
других бактерий значительно превосходила действие сульфаниламидов.
Антибиотики классифицируют и характеризуют по происхождению, химическому
составу, механизмам ингибирующего действия на микробные клетки, антимикробным
спектрам, частоте возникновения антибиотико-резистентных форм бактерий.
Антибиотические вещества образуют некоторые бактерии, многие актиномицеты и
грибы.
По химическому составу антибиотики подразделяют на несколько групп.
Бета-лактамные антибиотики, или бета-лактамы, азотсодержащие
гетероциклические соединения с бета-лактамным кольцом. К ним относится группа
пенициллина, включающая природный антибиотик бензилпенициллин и
полусинтетические пенициллины (метициллин, оксациллин, ампициллин,
карбенициллин и др.), и группа цефалоспорина (цефалоридин, цефалексин,
цефамандол, цефурексим, кефзол, мандал, кефлор и др.).
Тетрациклин и его полусинтетические производные: окситетрациклин,
хлортетрациклин, морфоциклин, метациклин, диоксициклин, вибромицин. Они состоят
из четырех конденсированных бензольных колец с разными радикалами.
Аминогликозиды, к которым относятся группа стрептомицина (стрептомицина
сульфат и его производные, состоящие из трех частей: стрептидина, стрептозы,
N-метилглюкозамина) и аминогликозидные антибиотики, содержащие
дезоксистрептамин: неомицин, моножицин, канамицин, амикацин, пентамицин,
тобрамицин и др.
Макролиды - соединения, содержащие макроциклическое лактонное кольцо
(эритромицин, олеандомицин).
Левомицетин, представляющий собой синтетическое вещество, «дентичное
природному антибиотику хлорамфениколу, в состав которого входит нитрофенил,
дихлорацетамин и пропандиол.
Рифамицины, к которым относятся природный антибиотик рифамицин и его
полусинтетическое производное рифампицин. Они имеют своеобразную сложную
химическую структуру, в которую входит макроциклическое кольцо.
Полиеновые антибиотики - нистатин, леворин, амфотерицин В, имеющие
несколько сопряженных двойных связей - (СН=СН)-.
Наряду с перечисленными, имеются антибиотики другого химического состава,
которые реже используются в лечебной практике. По механизму антимикробного
действия антибиотики в значительной мере отличаются друг от друга. «Мишенью»
для их ингибирующего действия служит одна или несколько биохимических реакций
необходимых для синтеза и функционирования определенных морфологических
компонентов или органелл микробной клетки: клеточной стенки, цитоплазматической
мембраны, рибосом, нуклеоида.
Антибиотики оказывают на микроорганизмы, главным образом на бактерии,
бактериостатическое или бактерицидное действие, которое определяется in vitro.
Большинство антибиотиков (бензилпенициллин и его полусинтетические производные,
все цефалоспорины, аминогликозиды, рифамицины) обладает бактерицидным
действием. Некоторые антибиотики (левомицетин, тетрациклин, макролиды) оказывают
на чувствительные к ним бактерии бактериостатическое действие.
По антимикробному спектру антибиотики подразделяют на две группы: узкого
и широкого спектра действия. К антибиотикам узкого спектра относится
бензилпенициллин, оказывающий губительное действие только на гноеродные кокки,
некоторые грамположительные бактерии и спирохеты. В эту же группу входят
полиеновые антибиотики нистатин, леворин, амфотерицин В, обладающие
антимикробным действием только в отношении некоторых грибов и простейших.
Антибиотики с широким спектром действия обладают антибактериальной
активностью в отношении многих грамположительных и грамотрицательных бактерий.
Некоторые из них эффективны в отношении риккетсий, хламидий, микоплазм и др. К
антибиотикам широкого спектра действия относятся цефалоспорины третьего
поколения, тетрациклины, левомицетин, аминогликозиды, макролиды, рифампицин.
Одной из реакций определения подлинности пенициллинов является щелочной
гидролиз в присутствии гидроксиламина с последующим образованием окрашенных гидроксаматов
меди или железа.
Подлинность отдельных препаратов пенициллинов устанавливают, используя
УФ- и ИК-спектрофотометрию.
Все препараты являются оптически активными, поэтому для определения их
подлинности можно использовать поляриметрию. Таким образом, пенициллины могут
быть идентифицированы по удельному вращению поляризованного света.
Отличить препараты пенициллинов можно по различной окраске ауриновых
красителей, образующихся при взаимодействии с хромотроповой кислотой продуктов
распада замещенной пенициллоиновой кислоты - замещенной пенальдиновой кислоты.
В зависимости от заместителя в молекуле пенициллина меняется окраска
красителя. Соли щелочных металлов бензилпенициллина дают коричневую окраску,
новокаиновая соль бензилпенициллина - красно-коричневую, а
феноксиметилпенициллин - сине-фиолетовую.
Для количественного определения суммы пенициллинов применяют обратное
йодометрическое титрование продуктов их щелочного гидролиза.
Количественное определение бензилпенициллина проводят гравиметрическим методом
по соли с N-этилпиперидином.
Присутствие бета-лактамного кольца в молекулах цефалоспоринов позволяет
использовать для идентификации окрашенные гидроксаматы ионов d-элементов.
Цефалексин может быть обнаружен аналогично алифатическим аминокислотам
реакцией с нингидрином или по реакции комплексообразования с ионами меди (II).
При действии смеси 80 % серной кислоты и 1 % азотной кислоты можно
наблюдать в случае цефалексина желтое окрашивание, а цефалотина (натриевой
соли) - оливково-зеленое, переходящее в красно-коричневое.
Присутствие примесей и остаточных количеств растворителей проводят
методом ГЖХ.
Для количественного определения продукты щелочного гидролиза
цефалоспоринов окисляют раствором йода.
Проанализированный препарат бензилпенициллина натриевой соли по
показателям идентификации соответствуют требованиям нормативно-технической
документации.
Список использованной литературы
1. Фармацевтична
хімія. Підручник
для студентів вищ. фармац. начальних закладів і фарм. фак. вищих мед.
навчальних закладів III-IV рівня акредитації / За заг. ред.
П.О. Безуглого. - Вінниця: Нова книга, 2008. - 560 с.
2. Арзамасцев
А.П. Фармакопейный анализ - М.: Медицина, 1971.
. Беликов
В.Г. Фармацевтическая химия. В 2 частях. Часть 1. Общая фармацевтическая химия:
Учеб. для фармац. ин-тов и фак. мед. ин-тов. - М.: Высш. шк., 1993. - 432 с.
. Глущенко
Н.Н. Фармацевтическая химия: Учебник для студ. сред. проф. учеб. заведений /
Н.Н. Глущенко, Т.В. Плетенева, В.А. Попков; Под ред. Т.В. Плетеневой. - М.:
Издательский центр «Академия», 2004. - 384 с.
. Драго
Р. Физические методы в химии - М.: Мир, 1981
. Кольтгоф
И.М., Стенгер В.А. Объемный анализ В 2 томах - М.: Государственное
научно-техническое издательство химической литературы, 1950
. Коренман
И.М. Фотометрический анализ - М.: Химия, 1970
. Коростелев
П.П, Фотометрический и комплексометрический анализ в металлургии - М.:
Металлургия, 1984, 272 с.
. Логинова
Н.В., Полозов Г.И. Введение в фармацевтическую химию: Учеб. пособие - Мн.: БГУ,
2003.-250 с.
10. Мелентьева
Г.А., Антонова Л.А. Фармацевтическая химия. - М.: Медицина, 1985.- 480 с.
11. Мискнджьян
С.П. Кравченюк Л.П. Полярография лекарственных
препаратов. - К.: Вища школа, 1976.
232 с
12. Фармацевтическая
химия: Учеб. пособие / Под ред. Л.П. Арзамасцева. - М.: ГЭОТАР-МЕД, 2004. - 640
с.
. Фармацевтический
анализ лекарственных средств / Под общей редакцией В.А. Шаповаловой - Харьков:
ИМП «Рубикон», 1995
. Фармацевтичний
аналіз: Навч. посіб. для студ. вищ. фармац. навч. закл. III-IV рівнів акредитації/П.О. Безуглий, В.О. Грудько,
С.Г. Леонова та ін.; За ред. П.О. Безуглого,- X.: Вид-во НФАУ; Золоті сторінки,
2001.- 240 с.
. Халецкий
A.M. Фармацевтическая химия - Ленинград: Медицина, 1966
. Эшворт
М.Р. Титриметрические методы анализа органических соединений кн.1,2 - М.:
Химия, 1972