Энантиоселективные синтезы конгидринов
Химический
факультет БГУ
«Энантиоселективные
синтезы конгидринов»
Работа
выполнена
Студенткой
3 курса 1 группы
Химического
факультета БГУ
Янушкевич
Надеждой
Минск 2010
Cодержание
. Общая характеристика конгидрина
. Синтезы конгидринов, основанные на промежуточном образовании
эпоксидов
. Синтезы конгидринов на основе рутениевых катализаторов
. Синтезы на основе хиральных дилитиевых лигандов
Заключение
Литература
1. Общая характеристика
конгидрина
Конгидрин - природный алкалоид, являющийся производным пиперидина;
кристаллическое вещество (т. пл. 120-121°, т. кип. 225-226°; [α]D + 10°), которое считается токсичным. Он
относится к группе кониина и содержится наряду с другими производными кониина
(Табл. 1) в болиголове пятнистом (Conium maculatum). Соединения этого растения
являются частыми причинами отравления
<#"528786.files/image001.gif"> Пиперидин
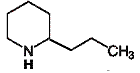 кониин 2-пропилпиперидин кониин 2-пропилпиперидин
|
конгидрин 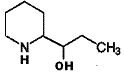 1-(пиперидинил-2) пропанол-1 1-(пиперидинил-2) пропанол-1
|
|
|
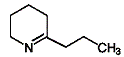 коницеин 2-пропилазациклогексен-2 коницеин 2-пропилазациклогексен-2
|
|
|
псевдоконгидрин 6-пропилпиперидинол-3
|
У молекулы конгидрина есть два хиральных центра и
соответственно четыре стереоизомера (Рис.1). Все эти изомеры являются
биологически активными, однако имеют разное действие на организм, поэтому
важной задачей является их разделение.
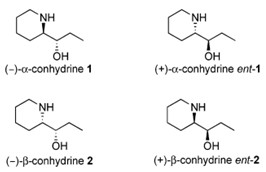
Рис. 1. Стереоизомеры α- и β-конгидринов.
Существует множество различных методик получения каждого из
этих изомеров. Впервые (+)-α-конгидрин был получен в
1948 году двумя химиками, Малиновским и Малли. В течении последующих
десятилетий было разработано множество энантиоселективных синтезов этого
соединения и его изомеров. Однако эти способы были довольно трудоёмки и не
отличались высоким выходом. В данной работе будут рассмотрены некоторые
современные методики синтеза этих изомеров. В одном из них на промежуточной
стадии образуется эпоксид с определенной конфигурацией ассиметрических атомов.
Во втором методе ключевой стадией является гидрирование кетона на
стереоселективных рутениевых катализаторах.
2.
Синтезы конгидринов, основанные на промежуточном образовании эпоксидов
Синтез (+)-α-конгидрина, разработанный
в Барселоне в 2008 году А. Пико, Д. Родригесом и А. Мойано, основан на
получении интермедиата с такой же конфигурацией ассиметрических атомов, как у
продукта реакции. Таким промежуточным соединением в данном случае является
2-(2'оксиранил)-пиперидин (Схема 1).
Схема 1. Ретросинтетический анализ.
Исходным веществом является аллиловый спирт 1 (Схема 2), который
получают из 4-гексин-1-ола. Каталитическое ассиметрическое эпоксидирование
спирта 1 проводится D-(-)-диизопропилтартратом (D-(-)-DIPT), являющимся хиральным
лигандом. Далее c раскрытием цикла образуется анти-азидодиол 3. Затем азидная
группа защищается карбоксибензилом (Cbz), что часто используется в органическом синтезе
для защиты амино-групп от электрофилов. Последующее десилилирование дает спирт
6, а образование гетероцикла дает желаемый интермедиат 7, который действием
литий диметилкупрата образует N- Cbz-α-(+) -конгидрин.
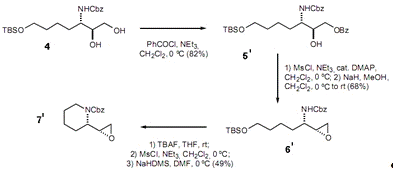
Модификация этого метода приводит к образованию β-(-)-конгидрина (Схема 3). Диол 4 селективно бензилируют, а
образовавшийся бензоат 5' превращают в син-эпоксид 6', который затем циклизуют
с образованием (2S, 2'R)-N-Cbz-2-(2'-оксиранил) пиперидина 7'. Дальше по схеме, приведенной выше
(стадии 7-9) получается β-(-)-конгидрин.
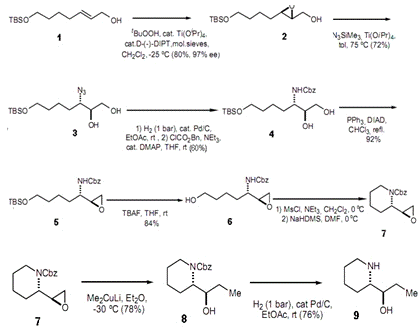
Схема 2. Энантиоселективный синтез α-(+)-конгидрина.
3.
Синтезы конгидринов на основе рутениевых катализаторов
Одним из эффективных методов, открытым в 2009 году в Китае,
является метод, на одной из стадий которого происходит ассиметрическое
гидрирование на рутениевом катализаторе. Схема ретросинтетического анализа
этого синтеза рассмотрена на рисунке 2.
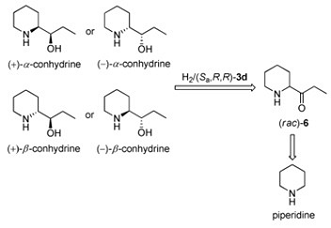
Рис. 2. Конгидрины и их ретросинтетический анализ.
Основной интермедиат гидрируется на хиральном рутениевом
катализаторе(Рис. 3) до α-(+) и α-(-)-конгидрина. Далее в ходе нескольких несложных стадий α-конгидрин превращают в β-конгидрин и таким образом
синтезируют все четыре изомера. Исходное вещество, пиперидин, в ходе реакций,
приведенных в схеме 4, образует необходимый интермедиат (α-амино кетон, вещество 6), который действием подобранного
катализатора дает продукт реакции с 97%-ным значением ее (энантиоселективынй
избыток).
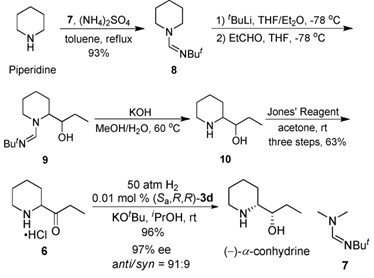
Схема 4. Энантиоселективный синтеза α-(-)-конгидрина.
При использовании на последней стадии 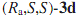 в качестве катализатора
получается (+)-α-конгидрин с
приблизительно 95%-ным выходом на этой стадии. Таким образом с помощью пяти стадий
были синтезированы (+)-α- и α-(-)-конгидрин с общим выходом приблизительно 56%.
в качестве катализатора
получается (+)-α-конгидрин с
приблизительно 95%-ным выходом на этой стадии. Таким образом с помощью пяти стадий
были синтезированы (+)-α- и α-(-)-конгидрин с общим выходом приблизительно 56%.
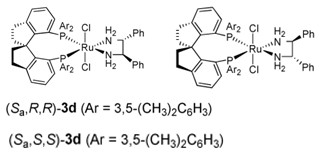
Рис. 3. Структура рутениевых катализаторов 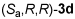 и
и 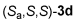 .
.
Далее полученные α-изомеры по схеме 5 можно
превратить в β-изомеры. Исходный α-конгидрин реагирует с сульфурилхлоридом с образованием
циклического сульфата 11. При действии ацетата натрия в диметилформамиде
образуется эфир с уже обратной конфигурацией 12, который гидролизуется
карбонатом калия и дает β-(+)-конгидрин. Выход на
этих стадиях составляет 76%.
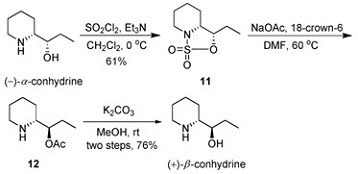
Схема 5. Превращение
α-(-)-конгидрина
в β-(+)-конгидрин.
Использование α-(+)-конгидрина дает по такой
схеме β-(-)-конгидрин с таким же выходом.
4.
Синтезы на основе хиральных дилитиевых лигандов
Данный способ был открыт в 2010 году в Арканзасе Т.К. Бенгом
и Р.Е. Гоулеем. В ходе исследований было установлено, что два дилитиевых
диастереоизомера (Рис. 4) при координировании с металлом хирального
литийорганического соединения вызывают инверсию образующейся рацемической смеси
в сторону образования одного из стереоизомеров.
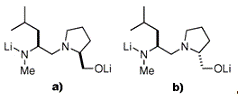
Рис. 4. Дилитиевые лиганды а) и b).
Это свойство было применено для синтеза различных алкалоидов,
в том числе и для конгидрина. Селективность процесса достигает более 99%-ов, а
количество стадий существенно меньше всех известных синтезов.
конгидрин синтез
(1) s-BuLi (1.2 eq), Et2O, TMEDA (4.0 eq), -78°C,
3 h.
(2) a), 10 mol %,-45°C,3 h.
(3) EtCHO, -78°C, 2 h.
(4) CF3CO2H, CH2Cl2.
Схема 6. Синтез β-(+)-конгидрина.
Использование лиганда b) дает α-(+)-конгидрин.
Заключение
В настоящее время для получения энантиомеров конгидрина
существует множество различных методик, существенно отличающихся друг от друга.
В данной работе были приведены только относительно недавно открытые синтезы.
Эти методы отличаются своей эффективностью и высокой стереоселективностью.
Таким образом, проблема синтеза стереоизомеров конгидрина, изучается уже давно
и имеет ряд успешных решений.
Литература
1. «Highly Enantioselective Synthesis
of Chiral Cyclic Amino Alcohols and Conhydrine by Ruthenium-Catalyzed
Asymmetric Hydrogenation.» S. Liu, J.-Н. Xie, W. Li, W.-L. Kong, L.-X. Wang, and Q.-L.
Zhou. State Key Laboratory and Institute of Elemento-organic Chemistry, Nankai
UniVersity, Tianjin 300071, China, August 10, 2009.
. «A highly stereocontrolled route
to 2-(2'-oxiranyl)piperidines and pyrrolidines: enantioselective synthesis of
(+)-a-conhydrine.» D. Rodríguez, A.
Picó, A. Moyano. Unitat de Recerca en Síntesi Asimètrica,
Departament de Química Orgànica, Universitat de Barcelona,
Facultat de Química, C. Martí i Franquès 1-11,
08028-Barcelona, Spain, July, 2008.
3. «Highly Enantioselective Catalytic
Dynamic Resolution of N-Boc-2-lithiopiperidine: Synthesis of (R)-(
)-N-Boc-Pipecolic Acid, (S)-( )-Coniine, (S)-( )-Pelletierine, ( )--Conhydrine,
and (S)-( )-Ropivacaine and Formal Synthesis of ( )-Lasubine II and (
)-Cermizine C.» T. K. Beng and R. E. Gawley. Department of Chemistry and
Biochemistry, Uni ersity of Arkansas, Fayette ille, Arkansas 72701, June 30,
2010.