Полиморфизм гена эндотелиальной NO-синтазы (eNOS) у детей с отягощенным семейным анамнезом по сердечно-сосудистой патологии
Санкт-Петербургский
государственный политехнический университет
Факультет
Медицинской физики и биоинжинерии
Кафедра
физико-химических основ медицины
ВЫПУСКНАЯ
РАБОТА БАКАЛАВРА
Тема
ПОЛИМОРФИЗМ
ГЕНА ЭНДОТЕЛИАЛЬНОЙ NO-СИНТЕТАЗЫ (eNOS) У ДЕТЕЙ С ОТЯГОЩЁННЫМ СЕМЕЙНЫМ
АНАМНЕЗОМ ПО СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ
Направление:
140400 - техническая физика
Выполнил
студент ( ) Скворцов Н.В.
Руководитель
( ) д.м.н., В.И.Ларионова
Куратор ( )
д.м.н., проф., В.В. Грызунов
Санкт-Петербург2008г.
ОГЛАВЛЕНИЕ
Список сокращений
Введение
Обзор литературысинтетаза и
атерогенез
Общая характеристика гена eNOS
Материалы и методы
Обследуемые группы
Использованные материалы, реактивы и
оборудование
Выделение ДНК из лейкоцитов
периферической крови
Полимеразно - цепная реакция (ПЦР)
Проведение ПЦР для 4a4b полиморфизма
гена эндотелиальной NO-синтазы (eNOS)
Электрофорез
Статистический анализ
Результаты и обсуждение
Выводы
СПИСОК ЛИТЕРАТУРЫ
Список
сокращений
Русскоязычные
ССП - сердечно-сосудистая патология
ИБС - ишемическая болезнь сердца
АГ - артериальная гипертензия
ИМ - инфаркт миокарда
ДНК - дезоксирибонуклеиновая кислота
п.н. - пар нуклеотидов
п.о. - пар оснований
ПЦР - полимеразная цепная реакция
СД2 - сахарный диабет тип 2
ЭДТА - этилендиаминтетрауксусная кислота
ЛПНП - липопротеиды низкой плотности
ЛПВП - липопротеиды высокой плотностиЗ - сердечно-сосудистые заболевания
ОР - относительный риск
ДИ - доверительный интервал
Англоязычные
- оксид азота - эндотелиальная NO-синтетаза
Введение
Эндотелиальные клетки первыми встречаются с реактивными свободными
радикалами, с окисленными липопротеинами низкой плотности, с
гиперхолестеринемией, с высоким гидростатическим давлением внутри выстилаемых
ими сосудов (при артериальной гипертонии), с гипергликемией (при сахарном
диабете). Все эти факторы приводят к повреждению эндотелия сосудов, к
дисфункции эндотелия, как эндокринного органа и к ускоренному развитию ССЗ.
Из всех факторов, синтезируемых эндотелием, роль "модератора"
основных функций эндотелия принадлежит эндотелиальному фактору релаксации или
оксиду азота (N0). Именно это соединение регулирует активность и
последовательность "запуска" всех остальных биологически-активных
веществ, продуцируемых эндотелием. Оксид азота не только вызывает расширение сосудов,
но и блокирует пролиферацию гладкомышечных клеток, препятствует адгезии клеток
крови и обладает антиагрегантными свойствами. Таким образом, оксид азота
является базовым фактором антиатерогенеза[1].
Ген эндотелиальной NO-синтетазы (eNOS), отвечает за синтез оксида азота
(NO) эндотелием и является ключевым ферментом в регуляции тонуса кровеносных
сосудов, в работе гладкомышечной мускулатуры сосудистой стенки и процессов
тромбообразования. Полиморфизм в гене eNOS может стать прогностически важным в
формировании группы риска сердечно-сосудистой патологии (ССП) среди детей с
отягощённой наследственностью по ССЗ. Поэтому целью нашего исследования стало
определение роли полиморфизма eNOS в формировании риска ССП у детей с
отягощённым анамнезом по ССЗ.
Для осуществления нашей цели были поставлены следующие задачи:
Провести анализ наследственной отягощенности у детей в группе риска по
ожирению, по сахарному диабету тип 2 (СД2) и по сердечно-сосудистой патологии.
Генотипировать банк ДНК всех детей по полиморфизму 4a/4b гена eNOS.
Сравнить частоты встречаемости аллелей и генотипов по данному гену между
группами и в зависимости от пола и типа отягощенной наследственности, а так же
в зависимости от количества у исследованных детей близких родственников с ССЗ,
ожирением и наличием СД2.
Работа проводилась в лаборатории молекулярной диагностики с расширенной
группой по экогенетике СПбГПМА под руководством д.м.н., проф., В.И. Ларионовой.
Обзор литературы
NO-синтетаза
и атерогенез
Основным триггерным фактором при атеросклерозе считается окисление
липопротеидов низкой плотности (ЛПНП) свободными радикалами. Окисленные липиды,
входящие в состав ЛПНП, активируют макрофаги. Макрофаги начинают продуцировать
цитокины и свободные радикалы. Свободные радикалы окисляют NO до нитратов, а цитокины
индуцируют экспрессию и синтез индуцибельной NO-синтетазы в гладкомышечных
эндотелиальных клетках. Индуцибельная NO-синтетаза создает относительный
дефицит субстрата, или аргинина, поскольку она оттягивает его как бы на себя и
уменьшает его доступность для эндотелиальной NO-синтетазы [2]. Известно, что у
больных атеросклерозом уровень аргинина в плазме крови снижен приблизительно на
30 %.
В настоящее время известно, что эндотелий регулирует сосудистый тонус
через освобождение сосудорасширяющих и сосудосуживающих факторов и модулирует
сократительную активность гладкомышечных клеток. К эндотелиальным факторам
дилатации относится и оксид азота. NO является основным вазодилататором, препятствующим тоническому сокращению
сосудов нейронального, эндокринного или локального происхождения.
В физиологических условиях NO
постоянно вовлечен в адаптацию сосудистой системы к повышенным метаболическим
потребностям, физическим нагрузкам. Избыток NO отвечает за увеличение периферической вазодилатации при
вазоплегическом шоке, а недостаток NO может приводить к тяжелым заболеваниям, включая артериальную гипертонию,
ишемическую болезнь сердца и атеросклероз [2]. синтетаза (NOS), принимая
участие в синтезе оксида азота (NO) эндотелием, является ключевым ферментом в
регуляции тонуса кровеносных сосудов, в работе гладкомышечной мускулатуры
сосудистой стенки и процессов тромбообразования [3]. NO-синтетаза существует в виде трех основных изоформ, которые
получили свое название по типу клеток, в которых они были впервые обнаружены:
нейрональная NO-синтетаза (nNOS или NOS I), эндотелиальная
NO-синтетаза (eNOS или NOS III) и NO-синтетаза макрофагов или
индуцибельная NO-синтетаза (iNOS или NOSII).
Нейрональная и эндотелиальная NO
синтетазы являются ферментами со стабильной активностью, в то время как
активность макрофагальной или индуцибельной NO- синтетазы в большей степени регулируется цитокинами.
Эндотелиальная NO- синтетаза
стабильно экспрессируется в эндотелиальных клетках [4].
Ингибирование NO-синтетазы
приводит ко всем органическим последствиям тяжелой и продолжительной
артериальной гипертензии, включая атеросклероз и сосудистые органные поражения.
Общая
характеристика гена eNOS
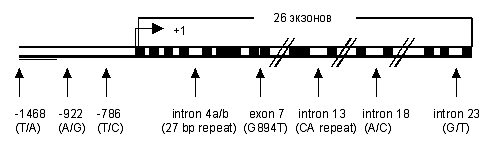
Ген еNOS расположен в локусе 7q36, имеет размер 21 т.п.н. и состоит
из 26 экзонов и кодирует белок с мол. массой 135 кД,, состоящий из 1203
аминокислот [5].
Известно, что мутации гена eNOS, приводящие к снижению уровня NO,
являются предрасполагающим фактором к развитию ССЗ. Например: точечная замена
гуанина на тимин в позиции 894 в 7 экзоне гена eNOS приводит к изменению
аминокислотной последовательности белка: глутамин в позиции 298 меняется на
аргинин (Glu298Asp)[6]. Как было показано, этот полиморфизм ассоциирован с
понижением базального уровня продукции NO. Поэтому G894T полиморфизм был широко
исследован у разных групп больных с ССЗ, но полученные результаты
противоречивы[7]. Другая точечная мутация находится в 5’фланкирующей области
гена eNOS: замена тимидина на цитозин -786 позиции (T-786C). Эта мутация
выражается в значительном уменьшении активности промотора гена eNOS.
Носительство С-аллеля было ассоциировано с повышенным риском коронарного спазма
в японской популяционной выборке[8].
Полиморфизм количества повторов участка, состоящего из 27 п.н. в 4
интроне гена eNOS (4a/4b) ассоциирован с уменьшением уровня NO в плазме крови
и, как было выяснено, является причиной изменения уровней нитритов и нитратов в
плазме крови [9,10]. Было показано, что этот полиморфизм является предиктором
зависимого от курения риска развития ИБС, однако, другие авторы не нашли
ассоциаций между 4а/4b полиморфизмом и риском CCЗ [6,11]. Изучение полиморфизма
гена еNOS показало, что у лиц, гомозиготных по
аллелю 4a, повышен уровень нитратов и нитритов
в крови , напрямую связанный со скоростью выработки оксида азота эндотелием
сосудов [9,10]. Это свидетельствует о потенциальной роли генотипа 4a/4a как фактора риска развития атеросклеротических ССЗ и
заболеваний, приводящих к нарушению нормальной выработки NO. Многие эпидемиологические
исследования заостряют внимание на возможности того, что полиморфизм может
функционально влиять на уровень NO-синтетазы [12,13].
В исследовании Britten M.B. было обнаружено, что у пациентов с
4a/4a и 4a/4b генотипом наблюдается повышенная
вазоконстрикция коронарных артерий в ответ на введение ацетилхолина и
пониженная вазодилятация, вызванная нитроглицерином, по сравнению с носителями
4b/4b генотипа [14]. В результате данной работы исследователи
пришли к выводу, что 4a/4b полиморфизм гена еNOS ассоциирован с эндотелиальной
дисфункцией коронарных артерий. Результаты ассоциативных исследований
свидетельствуют о том, что аллель 4а является независимым фактором риска
возникновения инфаркта миокарда (ИМ) в японской выборке [9] и развития
ишемического инсульта в китайской выборке [15]. В европейской выборке аллель 4b
гена eNOS встречается значительно чаще, чем аллель 4а.
Распределение частот генотипов в выборке составляет соответственно 4b/4b
- 0,41, 4b/4a - 0,46 и 4а/4a - 0,13.
В работе Д.А. Чистякова с соавторами показано достоверное увеличение
частоты встречаемости аллеля 4a и
генотипов 4a/4a и 4a/4b у пациентов с ИБС по сравнению со
здоровыми лицами [16]. В исследованиях Ю.В. Котовской и соавторов у жителей
Москвы была обнаружена ассоциация 4a/4b полиморфизма гена eNOS с развитием ИМ у больных с осложнённым
сахарным диабетом тип 2 (СД2), при этом маркерами риска являлись аллель 4a и генотипы, его содержащие [17].
Однако не во всех работах была найдена связь между 4a/4b полиморфизмом гена еNOS и риском развития ССЗ [18,19,20].
Как видно из представленных выше исследований по изучению 4a/4b полиморфизма гена еNOS, в ряде работ установлены ассоциации данного полиморфного локуса с
риском развития ССЗ. Наличие такой ассоциации свидетельствует о важной роли
оксида азота в патогенезе сердечнососудистых нарушений. Наличие ассоциации тем
более интересно ввиду имеющихся данных о связи данного полиморфного участка с
уровнем синтеза оксида азота в организме [10,21].
Варианты заключений:
b/4b - нормальный вариант полиморфизма в гомозиготной форме;
b/4a - гетерозиготная форма полиморфизма;
a/4a - мутантный вариант полиморфизма, связанный с увеличением риска
заболеваний, в гомозиготной форме
Рисунок 1. Генетическая карта полиморфизма гена eNOS человека.
Материалы и
методы
Обследуемые
группы
В исследование были включены 2 группы сравнения:
1) группа риска ССЗ из 101 ребенка и подростка в возрасте от 4-х до
17-ти лет из семей, имеющих наследственную отягощенность по сердечно-сосудистой
патологии у родственников первой и второй степеней родства;
2) контрольная группа из 144 практически здоровых детей и подростков
сопоставимого возраста, не имеющих наследственной отягощенности по ССЗ и
связанных с ними осложнений.
Использованные
материалы, реактивы и оборудование
При выполнении работы применялись следующие реактивы и ферменты:
персульфат аммония, ЭДТА, протеиназа К («Helicon», Россия), ТЕМЕД,
додецилсульфат натрия, трис-HCl («Serva», ФРГ), хлорид натрия, хлорид магния,
сульфат аммония («Сибэнзим», Россия), буфер для ДНК-полимеразы («Сибэнзим»,
Россия), олигонуклеотидные праймеры («Литех», Россия),
дезоксирибонуклеозидтрифосфаты, агароза; и оборудование: программируемый
термоциклер «Biometra» (США), центрифугу «Beckman» Великобритания), автоматический
анализатор «BioRad» (Италия).
Выделение ДНК
из лейкоцитов периферической крови
Для выделения ДНК из лимфоцитов периферической крови использовали
модифицированный метод фенольно-хлороформной экстракции (Blin N., Stafford D.W.
1976).
В пластиковую пробирку, содержащую Na2ЭДТА (pH=8,0) в качестве
антикоагулянта забирали кровь самотеком из локтевой вены в необходимом
количестве. Кровь перемешивали в пробирке для предотвращения образования
тромбов.
К 0.5 мл цельной крови, содержащей Na2ЭДТА (pH=8,0) в качестве
антикоагулянта, добавляли 1 мл стерильной дистиллированной воды, перемешивали и
центрифугировали 2 минуты при 10000 об/мин. Полученный осадок лейкоцитов еще
дважды ресуспендировали и отмывали в 1 мл стерильной дистиллированной воды.
Полученный осадок растворили в 0,2 мл буфера для протеиназы К (20 mM Tris-HCl;
pH=8.0; 10 mM ЭДТА, 150,0 mM NaCl, 1% SDS). После этого добавляли протеиназу К
до конечной концентрации 250 мг/мл в растворе. Смесь инкубировали в течение 16
часов при 560С. Экстракцию белков проводили, добавив равный объем
смеси фенол: хлороформ: изоамиловый спирт в соотношении 25:24:1 и
центрифугировали 10 минут при 10000 об/мин. Водную фазу отбирали в новую
пробирку. К полученной водной фазе добавляли 2-2.5 объема охлажденного 96%
этанола для осаждения ДНК. Полученный осадок ДНК промывали охлажденным 70%
этанолом, просушивали на воздухе, и растворяли в 100 мкл стерильного ТЕ буфера
(10 mM Tris-HCl; pH=8.0; 0,5 mM ЭДТА). Качество выделенной ДНК и ее приблизительную
концентрацию оценивали с помощью электрофореза в 0.7% агарозном геле.
Полимеразно -
цепная реакция (ПЦР)
Этот метод используется для преумножения необходимого фрагмента ДНК.
Создается реакционный раствор, содержащий реакционный буфер,
дезоксинуклеозидтрифосфаты, праймеры прямой и обратный (For и Rev), ДНК полимеразу и пробу выделенной ДНК в качестве
матрицы. Праймер - это олигонуклеотид (18-25 нуклеотидов), необходимый для
запуска полимеразной реакции. Необходимо наличие двух праймеров: по одному на
каждую цепь. Для PCR берется ДНК
полимераза бактерий, живущих в гейзерах и термальных источниках. Она устойчива
к высокой температуре. PCR
имеет три стадии:
) Денатурация. При 92-96 градусах цепи ДНК расходятся

) Отжиг праймеров на цепи ДНК. При определенной температуре, специально
подобранной для каждой пары праймеров, праймеры садятся на цепи ДНК по принципу
комплиментарности.

Проведение
ПЦР для 4a4b полиморфизма гена эндотелиальной NO синтазы (eNOS)
a/4b полиморфизм обусловлен разным количеством 27-нуклеотидных повторов в
четвертом интроне гена eNOS [22]. В норме их бывает четыре (4b-аллель), а при
мутации - пять (4a-аллель).
Для ПЦР анализируемого участка гена eNOS были выбраны следующие праймеры:
- 5'-AGG CCC TAT GGT AGT GCC TTT-3'- 5'-TCT CTT AGT GCT GTG GTC AC-3'
циклов амплификации проводились в конечном объеме 20 мкл реакционной смеси,
содержащей 1 мкг геномной ДНК, 250 пкмоль каждого праймера, 10мМ Tris-HCI pH
8.4, 1.2 mM, MgCI2, 50 mM KCI, 0,2 mМ каждого dNTP и одну единицу
Taq-полимеразы (см. Таблицу 1). ПЦР включала: 45 сек - денатурация при 92 С°,
45 сек - отжиг при 56 С° и 45 сек - синтез при 72 С° (см. Таблицу 2).
Для генотипирования eNOS, продукты ПЦР анализировались в 2% агарозном
геле. При комбинации аллелей формируются три генотипа: 4a4a (393 п.н.) ;
4a4b(393 п.н, 420 п.н.); 4b4b (420 п.н.).
Электрофорез
Это метод разделения смеси веществ (белков, нуклеиновых кислот) на ее
составляющие по массе в электрическом поле на носителе. В качестве носителя
используют гель из агарозы. Концентрация агарозы в геле варьируется в
зависимости от массы разделяемых фрагментов. В состав геля также входят вода и
реакционный буфер. Расплав агарозы хранится в термостате при 60 градусах. Гель
получается при заливке этого расплава на подложку, где он, при комнатной
температуре, застывает В застывшем геле делаются лунки. Такой гель помещается в
кювету между электродами. Сама кювета тоже заполнена буфером. Проба смешивается
с краской и наносится в лунки геля. Затем в электрическом поле происходит
разгонка пробы. Каждая фракция пробы с одинаковой массой формирует полосу. Эта
полоса светится красным в ультрафиолете, за счет красителя. Определение массы
этой фракции проводится относительно маркера. Маркер при разгонке в
электрическом поле дает полосы с известной массой.
Параметры электрофореза: 120В, 70мА, 90 минут
1 2 3 4 5 6 7 8 9
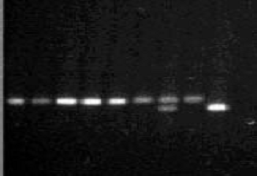
Рисунок
2
a4b
полиморфизм гена eNOS, электрофорез в 2% агарозе.
,
2, 3, 4, 5, 6, 8 - норма 4b/4b (420 п.н.)
-
гетерозигота 4а/4b (420, 393 п. н.)
-
мутация 4а/4а (393 п. н.)
Статистический
анализ
Статистическая обработка данных проводилась с помощью теста Хи-квадрат,
точного критерия Фишера и метода относительного риска (ОР). Различия между
сравниваемыми группами считались статистически значительными для доверительного
интервала (ДИ) 95% (p=0,05). Проверка
равновесия распределения генотипов в исследованных выборках, включая и случаи
множественных сравнений внутри выборок, с законом Харди-Вайнберга проводилась с
помощью теста Хи-квадрат.
Результаты и
обсуждение
Распределения частот встречаемости аллелей и генотипов eNOS 4a/4b в изученных
группах детей, представлены в таблице I. Частоты встречаемости аллелей и
генотипов в исследуемых выборках не отличались значимо от теоретически
ожидаемых в соответствии с законом Харди-Вайнберга.
Таблица I. Частоты встречаемости аллелей и генотипов eNOS 4a/4b в
исследуемых группах детей
|
мальчики
|
девочки
|
общее
|
|
Группа риска
|
Контрольная группа
|
Группа риска
|
Контрольная группа
|
Группа риска
|
Контрольная группа
|
|
4a/4b
|
12
|
17,14%
|
25
|
32,89%
|
10
|
32,26%
|
19
|
27,95%
|
22
|
44
|
|
4a/4a
|
1
|
1,43%
|
3
|
3,95%
|
2
|
6,45%
|
5
|
7,35%
|
3
|
8
|
|
4b/4b
|
57
|
81,43%
|
48
|
63,16%
|
19
|
61,29
|
44
|
64,70%
|
76
|
92
|
|
4a
|
14
|
10%
|
31
|
20,39%
|
14
|
22,58%
|
29
|
21,32%
|
28
|
60
|
126
|
90%
|
121
|
79,61%
|
48
|
77,42%
|
107
|
78,68%
|
174
|
228
|
На первом этапе мы провели сравнительный анализ распределения частот
генотипов eNOS 4a/4b между детьми группы риска и детьми контрольной группы. Мы
не обнаружили статистически значимых отличий в распределении генотипов
(Х2=3.697, р=0,157).
Затем мы провели сравнительный анализ распределения частот аллелей 4а и
4b в группе риска по сравнению с контрольной группой и также не нашли
статистически значимых различий между нашими исследуемыми группами (Х2=3.458,
р=0,063).
Затем мы провели сравнительный анализ распределений частот генотипов в
исследуемых группах отдельно для мальчиков и отдельно для девочек. При этом мы
объединили генотипы 4a/4a и 4a/4b в один класс, и сравнили частоты
распределения генотипа 4b/4b и носителей 4а аллеля в виде 4a/4a или 4a/4b
генотипов для корректного применения теста Хи-квадрат.
Сравнение распределений генотипов в группах мальчиков показало
статистически значимые различия между мальчиками из группы риска и мальчиками
из контрольной группы (Х2=5.152, р=0,023), которые выражались в том, что
количество носителей 4а аллеля мальчиков контрольной группы было примерно в 2
раза больше, чем у мальчиков группы риска (ОР=1,98 для 95% ДИ 1,12 - 3,51).
Также у мальчиков контрольной группы частота встречаемости аллеля 4а была
примерно в 2 раза выше, чем у мальчиков группы риска (ОР=2,04 для 95% ДИ 1,13 -
3,67). Между девочками групп сравнения статистически значимых различий в
частотах аллелей и генотипов обнаружено не было (Х2=0.010, р=0,918).
На последнем этапе мы провели статистический анализ распределения
генотипов внутри группы риска в зависимости от типа наследственной
отягощённости и встречаемости её в родословной семей обследуемых детей (таблицы
II-IV).
Для начала мы сравнили распределения генотипов в группе риска в
зависимости от количества у исследованных детей родственников с ожирением. Мы
ранжировали детей групп риска на три класса. Класс (1-3) включал детей, имевших
от 1 до 3х близких родственников с ожирением, класс (4-6)-соответственно 4-6
родственников с ожирением и класс (7-10) - от 7 до 10 родственников с ожирением
(см. таблицу II).
сердечный
полиморфизм ген наследственный дети
Таблица II. Частоты встречаемости генотипов eNOS 4a/4b в группе детей с
риском ССЗ в зависимости от количества родственников с ожирением
|
Количество родственников с
ожирением
|
Количество детей
|
4a/4a+4a/4b
|
4b/4b
|
|
Класс (1-3)
|
42
|
8
|
34
|
|
Класс (4-6)
|
37
|
13
|
24
|
|
Класс (7-10)
|
8
|
2
|
6
|
Сравнительный анализ между классами был проведен с использованием точного
критерия Фишера и не выявил статистически значимых различий в распределениях
генотипов между классами (р=0,653). То есть распределение генотипов eNOS 4a/4b в группе детей с
риском ССЗ не зависит от встречаемости в родословной родственников с ожирением.
Затем мы сравнили распределения генотипов в группе риска в зависимости от
того, имели ли близкие родственники СД2 или не имели (см. таблицу III).
Таблица III. Частоты встречаемости генотипов eNOS 4a/4b в группе детей с
риском ССЗ в зависимости от наличия родственников с СД2
|
Наличие СД2
|
Количество детей
|
4a/4a +
4a/4b
|
4b/4b
|
|
Нет родственников с СД2
|
48
|
12
|
36
|
|
Есть родственники с СД2
|
37
|
12
|
25
|
Сравнительный анализ также был проведен с использованием точного критерия
Фишера и не выявил статистически значимых различий в распределениях генотипов eNOS 4a/4b в группе детей с
риском ССЗ в зависимости от наличия у них родственников с СД2 (р=0,476).
Наконец, мы сравнили распределения генотипов в группе риска в зависимости
от количества у исследованных детей близких родственников с ССЗ. Мы ранжировали
детей группы риска на 4 класса в зависимости от количества родственников с ССЗ:
класс (1-3),класс (4-6), класс (7-9) и класс (10-17) (см. таблицу IV).
Таблица IV. Частоты встречаемости генотипов eNOS 4a/4b в группе детей с
риском ССЗ в зависимости от количества родственников с ССЗ
|
Количество родственников с
ССЗ
|
Количество детей
|
4a/4a +
4a/4b
|
4b/4b
|
|
Класс (1-3)
|
25
|
8
|
17
|
|
Класс (4-6)
|
30
|
9
|
21
|
|
Класс (7-10)
|
16
|
7
|
9
|
|
Класс (10-17)
|
12
|
10
|
Затем мы методом точного критерия Фишера провели сравнение распределений
генотипов между классами и также не обнаружили статистически значимых различий
в зависимости от количества родственников с ССЗ. Группы были генетически
однородны (р=0,223).
Таким образом, мы не обнаружили в исследованной выборке детей из группы
риска различий в распределении генотипов и частот аллелей 4a/4b полиморфизма
гена eNOS по сравнению с контрольной группой детей и в зависимости от типа
отягощённой наследственности и её встречаемости в родословной детей.
Присутствие аллеля 4а в генотипе детей из группы риска не было ассоциировано с
присутствием конституциональных факторов риска развития ССЗ, а именно с
отягощённой наследственностью по ожирению, СД2 и ССЗ. Более того, у мальчиков
из группы риска количество носителей 4а аллеля было даже меньше, чем у
мальчиков из контрольной группы. Наши результаты во многом согласуются с работами
других авторов, которые также показывают отсутствие ассоциативных связей между
4a/4b полиморфизмом в гене eNOS и риском ССЗ. Однако существуют работы, которые
обнаруживают ассоциативную связь полиморфизма гена eNOS с риском развития ССЗ,
так как роль гена eNOS в системе эндотелиальной функции является ключевой.
Поэтому в дальнейшем мы планируем изучить другие полиморфизмы в этом гене, в
первую очередь С-786Т и Glu298Asp.
Выводы
) Сравнительный анализ распределения частот генотипов eNOS 4a/4b
между детьми группы риска и детьми контрольной группы не выявил статистически
значимых отличий в распределении генотипов
) Сравнительный анализ распределения частот аллелей 4а и 4b в
группе риска по сравнению с контрольной группой также не выявил статистически
значимых различий между нашими исследуемыми группами
) Сравнение распределений генотипов в группах мальчиков показало
статистически значимые различия между мальчиками из группы риска и мальчиками
из контрольной группы. Также у мальчиков контрольной группы частота
встречаемости аллеля 4а была примерно в 2 раза выше, чем у мальчиков группы
риска. Между девочками групп сравнения статистически значимых различий в
частотах аллелей и генотипов обнаружено не было.
) Сравнение распределений генотипов eNOS 4a/4b в группе детей с
риском ССЗ в зависимости от количества родственников с ожирением не выявило
статистически значимых различий между нашими исследуемыми группами.
) Сравнение распределений генотипов eNOS 4a/4b в группе детей с
риском ССЗ в зависимости от наличия родственников с СД2 не выявило
статистически значимых различий между нашими исследуемыми группами.
) Сравнение распределений генотипов eNOS 4a/4b в группе детей с
риском ССЗ в зависимости от количества родственников с ССЗ не выявило
статистически значимых различий между нашими исследуемыми группами. Группы были
генетически однородны.
СПИСОК
ЛИТЕРАТУРЫ
1. М.В.
Шестакова Дисфункция эндотелия - причина или следствие метаболического синдрома
2001.
2. Манухина
Е. Б., Александров А. А. Оксид азота, дисфункция эндотелия и новые возможности
патогенетической терапии сердечно-сосудистых заболеваний 2001.
. Минушкина
Л., Затейщиков Д., Сидоренко Б. Генетические аспекты регуляции эндотелиальной
функции при артериальной гипертонии Кардиология. 2000, №3, С. 68-76
. Lowenstein
C.J., Glatt C.E., Bredt D.S., Snyder S.H. Cloned and expressed macrophage
nitric oxide synthase contasts with the brain enzyme // Proc. Natl. Acad. Sci.
USA. - 1992. - Vol. 89. - P. 6711-6715.
. Miyahara
K., Kawamoto T., Sase K., et al. Cloning and structural characterization of the
human endothelial nitric-oxide-synthase gene. Eur J Biochem. 1994 Aug
1;223(3):719-26
. Cai
H., Wilcken D.E., Wang X.L. The Glu298-->Asp (894G-->T) mutation at exon
7 of the endothelial nitric oxide synthase gene and coronary artery disease. J
Mol Med. 1999 Jun;77(6):511-4.
. Tomasz
J. Guzik,1 Edward Black., et al. Relationship Between the G894T Polymorphism
(Glu 298 Asp Variant) in Endothelial Nitric Oxide Synthase and Nitric
Oxide-Mediated Endothelial Function in Human Atherosclerosis
. Nakayama
M., Yasue H., Yoshimura M. et al. T-786®C mutation in the 5’-flanking region of
the endothelial nitric oxide synthase gene is associated with coronary spasm //
Circulation. - 1999. - Vol. 99. - P. 2864-2870.
9. Ichihara
S., Yamada Y., Fujimura T., et al. Association of a polymorphism of the endothelial constitutive
nitric oxide synthase gene with myocardial infarction in the Japanese
population. Am J Cardiol. 1998 Jan 1;81(1):83-6.
10. Ignarro
L.J. Biological actions and properties of endothelium-derived nitric oxide
formed and released from artery and vein. Circ Res. 1989 Jul;65(1):1-21.
11. Poirier
O., Mao C., Mallet C., et al. Polymorphisms of the endothelial nitric oxide synthase gene - no
consistent association with myocardial infarction in the ECTIM study. Eur J
Clin Invest. 1999 Apr;29(4):284-90.
12. Tsukada
T., Yokoyama K., Arai T., et al. Evidence of association of the ecNOS gene
polymorphism with plasma NO metabolite levels in humans. Biochem Biophys Res
Commun. 1998 Apr 7;245(1):190-3.
.
Wang H.U., Anderson D.J. Eph family transmembrane ligands can mediate repulsive
guidance of trunk neural
crest migration and motor axon outgrowth. Neuron. 1997;18:383-396.
.
Britten M.B., Schachinger V., Dimmeler S., et al. ecNOS-polymorphism is
associated with coronary endothelial disfunction. Eur Heart J 1999;20(144):907.
. Hou
L., Osei-Hyiaman D., Yu H., et al. Association of a 27-bp repeat polymorphism
in ecNOS gene with ischemic stroke in Chinese patients. Neurology. 2001 Feb
27;56(4):490-6.
. Чистяков
Д.А., Воронько О.Е., Савостьянов К.В. и др. Полиморфные маркеры генов
эндотелиальной NO-синтазы и сосудистого рецептора ангиотензиногена II и
предрасположенность к ишемической болезни сердца. Генетика. 1999
. Котовская
Ю.В., Кобалаева Ж.Д., Сергеева Т.В. и др. Полиморфизм генов
ренин-ангиотензиновой системы и гена эндотелиальной NO-синтазы и
макрососудистые осложнения при сахарном диабете типа 2. Артериальная
гипертензия. 2002. Т.8, *3. С.86-90.
. Nakagami
H., Ikeda U., Maeda Y., et al. Coronary artery disease and endothelial nitric
oxide synthase and angiotensin-converting enzyme gene polymorphisms. J Thromb
Thrombolysis. 1999 Oct;8(3):191-5.
. Granath
B., Taylor R.R., van Bockxmeer F.M., Mamotte C.D. Lack of evidence for
association between endothelial nitric oxide synthase gene polymorphisms and
coronary artery disease in the Australian Caucasian population. J Cardiovasc
Risk. 2001 Aug;8(4):235-41.
. Yahashi
Y., Kario K., Shimada K., Matsuo M. The 27-bp repeat polymorphism in intron 4
of the endothelial cell nitric oxide synthase gene and ischemic stroke in a
Japanese population. Blood Coagul Fibrinolysis. 1998 Jul;9(5):405-9.
.
Zhao Qi, SU Shao-yong, CHEN Shu-feng., et al. Association study of the
endothelial nitric oxide synthase gene polymorphisms with essential
hypertension in northern Han Chinese 2006.
. Taniwaki
H, Ishimura E, Matsumoto N, Emoto M, Inaba M, Nishizava Y Relations Between ACE
Gene and ecNOSGene Polymorphisms and Resistive Index in Type 2 Diabetic
Patients With Nephropathy //Diabets Care. 2001; 24: 1653-1660.