Химические реакции в растворах
Задача №13.
Избытком гидроксида калия подействовали на
растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III),
Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и
эквивалентные массы.
а) 2КОН + КН2РО4 = К3РО4
+ 2Н2О
fэ(КОН)
= 1 fэ(КН2РО4)
= 2 M(КН2РО4)
= 39 + 2∙1 + 31 + 16∙4 = 136г/моль
Э(КН2РО4) = 136/2 =
68г/моль
/2M(КН2РО4)
= Э(КН2РО4) б) КОН + Bi(OH)2NO3
=
Bi(OH)3
+ KNO3
fэ(КОН)
= 1 fэ(Bi(OH)2NO3)
= 1 M (Bi(OH)2NO3) = 209 + 2 x 17 + 62 = 305 г/моль
Э (Bi(OH)2NO3)
= M/f = 305: 1 = 305 г/моль
(Bi(OH)2NO3) = Э
(Bi(OH)2NO3)
Задача №33.
Напишите электронные формулы атомов элементов с
порядковыми номерами 21 и 23. Сколько свободных d-орбиталей
в атомах этих элементов?
21Sc
1s22s22p63s23p64s23d1;
4 свободные 3d-орбитали
23V
1s22s22p63s23p64s23d3;
2 свободные 3d-орбитали
Задача №53
Исходя из степени окисления атомов
соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух
гидроксидов является более сильным основанием: CuOH
или Cu(OH)2;
Fe(OH)2
или Fe(OH)3;
Sn(OH)2
или Sn(OH)4?
Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Чем ниже степень окисления элемента, тем сильнее
выражены основные свойства гидроксида. Соответственно, СuOH,
Fe(OH)2,
Sn(OH)2,
более сильные основания, чем Cu(OH)2,
Fe(OH)3,
Sn(OH)4.
Sn(OH)2
+ 2NaOH = Na2[Sn(OH)4]
Sn(OH)2
+ 2HCl = SnCl2
+ 2H2O
Задача №73.
Какую химическую связь называют ионной? Каков
механизм ее образования? Какие свойства ионной связи отличают ее от
ковалентной? Приведите два примера типичных ионных соединений. Напишите
уравнения превращения соответствующих ионов в нейтральные атомы.
Ионной называют сильно поляризованную (при
значительных различиях электроотрицательностей входящих в молекулу элементов)
связь, когда электронная плотность практически целиком сдвинута к одной
структурной единице. Ионная связь в отличии от ковалентной, характеризуется
ненаправленностью и ненасыщаемостью, а свойство поляризуемости теряет для неё
всякий смысл. Механизм образования ионной связи можно рассмотреть на примере
реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а
атом галогена - приобретает. В результате этого возникает катион натрия и
хлорид-анион. Они образуют соединение за счет электростатического притяжения
между ними. Типичные ионные соединения: NaCl, LiF. Уравнения превращения
соответствующих ионов в нейтральные атомы: Na+ + 1e → Na0
Cl- → Cl0 + 1e Li+ + 1e → Li0
F- → F0 + 1e
Задача №93.
Реакция горения метилового спирта выражается
термохимическим уравнением:
СН3ОН(ж) + 3/2О2(г) = СО2(г)
+ 2Н2О(ж); DН = ?
Вычислите тепловой эффект этой реакции, если
известно, что мольная теплота парообразования СН3ОН(ж) равна +37,4
кДж. Ответ: -726,62 кДж.
CH3OH(ж) + 3/2O2(г)
= CO2(г) + 2H2O(ж), ∆H = -726,62 кДж ∆Hх.р.
= 2∙(-285,84) - 393,51 + 238,57 = -726,62 кДж/моль
Задача №113.
Вычислите DНo,
DSo
и DGoT
реакции, протекающей по уравнению:
Fe2O3(к)
+ ЗН2(г) = 2Fe(к)
+ 3Н2О(г)
Возможна ли реакция
восстановления Fе2О3
водородом при температурах 500 и 2000 К? Ответ: +96,61 кДж; 138,83 Дж/К; 27,2
кДж; -181,05 кДж.
Fe2O3(к)
+ 3H2(г)
= 2Fe(к)
+ 3H2O(г)
|
|
∆H˚298
кДж/моль
|
∆G˚298
кДж/моль
|
∆S˚298
Дж/моль∙К
|
|
Fe2O3(к)
|
-821,32
|
-740,99
|
89,96
|
|
H2(г)
|
0
|
0
|
130,6
|
|
Fe(к)
|
0
|
0
|
27,15
|
|
H2O(г)
|
-241,84
|
-228,8
|
188,74
|
∆G˚х.р.
= 3∙(-228,8) - (-740,99) = 54,59 кДж/моль
∆H˚х.р.
= 3∙(-241,84) - (-821,32) = 95,8 кДж/моль
∆S˚х.р.
= 3∙188,74 + 2∙27,15 - 3∙130,6 - 89,96 = 138,76 Дж/моль∙К
∆G˚х.р.˃0,
значит реакция не идет самопроизвольно слева направо.
Задача №133.
Напишите выражение для константы
равновесия гетерогенной системы С + H2О(г)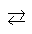 CO + Н2.
Как следует изменить концентрацию и давление, чтобы сместить равновесие в
сторону обратной реакции - образования водяных паров?
CO + Н2.
Как следует изменить концентрацию и давление, чтобы сместить равновесие в
сторону обратной реакции - образования водяных паров?
C + H2O(г) = CO + H2 Kравн. = [CO]∙[H2]/[H2O]
Чтобы сместить равновесие в сторону
обратной реакции необходимо увеличить давление и концентрацию концентрацию H2.
Задача №153.
Какой объем 0,3 н. раствора кислоты
требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
νэкв(NaOH)
= 0,32/40 = 0,008 моль-экв νэкв(HCl)
= νэкв(NaOH) = 0,008
моль-экв V(HCl) = 0,008/0,3 = 0,0267 л = 26,7 мл
молекулярный электронный химический
уравнение
Задача №173.
Вычислите температуру кристаллизации 2%-ного
раствора этилового спирта C2H5OH.
Криоскопическая константа воды 1,86°. Ответ: -0,82°С.
Пусть дан 1 кг воды в котором растворен этиловый
спирт, тогда: 2 = 100∙m(С2Н5ОН)/(m(С2Н5ОН)
+ 1000) m(С2Н5ОН) = 20,41 г Cm = 20,41/46 =
0,44 моль/кг Δt = 0,44∙1,86 =
0,82°С Tзам. = 0 - 0,82 = -0,82°С
Задача №193.
Составьте молекулярные и ионно-молекулярные
уравнения реакций взаимодействия в растворах между: a)
Na3PO4
и CaCl2;
б) К2СОз и ВаСl2;
в) Zn(OH)2
и КОН.
2Na3PO4
+ 3CaCl2
→ Ca3(PO4)2↓
+ 6NaCl 6Na+
+ 2PO43-
+ 3Ca2+
+ 6Cl-
→ Ca3(PO4)2↓
+ 6Na+
+ 6Cl-
3Ca2+
+ 2PO43-
→ Ca3(PO4)2↓
К2СО3 + BaCl2
→ BaCO3↓
+ 2KCl 2К+ +
СО32- + Ba2+
+ 2Cl-
→ BaCO3↓
+ 2K+
+ 2Cl-
Ba2+
+ СО32- → BaCO3↓
Zn(OH)2
+ 2КОН → K2[Zn(OH)4]
Zn(OH)2
+ 2К+ + 2ОН- → 2K+
+ [Zn(OH)4]2-
Zn(OH)2
+ 2ОН- → [Zn(OH)4]2-
Задача №213.
Какая из двух солей при равных
условиях в большей степени подвергается гидролизу: Na2СО3
или Na2SO3;
FеС13 или
FeCl2?
Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих
солей.
Na2CO3
в
большей степени подвергается гидролизу, т.к. соль образована более слабой
кислотой, чем в случае Na2SO3.
FeCl3
образована более слабым основанием чем FeCl2
и поэтому подвергается гидролизу в большей степени.
Na2CO3 + H2O
= NaHCO3 + NaOH3 + H2O = Na2CO3
+ NaOH32- + H2O = HCO3-
+ OH-3- + H2O = H2CO3
+ OH-, pH˃7, среда
щелочная3
+ H2O = FeOHCl2 + HCl2 + H2O =
Fe(OH)2Cl + HCl(OH)2Cl + H2O = Fe(OH)3
+ HCl3+ + H2O = FeOH2+ + H+
FeOH2+ + H2O =
Fe(OH)2+ + H+
Fe(OH)2+ + H2O
= Fe(OH)3 + H+, рН˂7,
среда
кислая
Задача №233.
Составьте электронные
уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции
укажите, какое вещество является окислителем, какое - восстановителем; какое
вещество окисляется, какое - восстанавливается.
HNO3 +
Zn ®
N2O + Zn(NO3)2 + H2O
FeSO4 +
KClO3 + H2SO4 ®
Fe2(SO4)3 + KCl + H2O
10HNO3 + 4Zn = 5N2O
+ 4Zn(NO3)2 + 2H2O
- 2e = Zn2+│4│2
окисляется (восстановитель)
N5+ +
4e = N1+│2│1
восстанавливается (окислитель)
6FeSO4 + KClO3
+ 3H2SO4 = 3Fe2(SO4)3 +
KCl + 3H2O
Fe2+
- 1e = Fe3+│6
окисляется (восстановитель)
ClO31-
+ 6H+
+ 6e = Cl1-
+
3H2O│1
восстанавливается (окислитель)
Задача №253.
Гальванический элемент в котором никель является
катодом.
А(-) Zn|Zn2+ || Ni2+|Ni
(+)К А: Zno → Zn2+ + 2e К: Ni2+ + 2e →
Nio
Суммарная реакция:
+ Ni2+ → Ni + Zn2+
Гальванический элемент в котором никель является
анодом.
А(-) Ni|Ni+2 || Cu+2|Cu
(+)К А: Nio → Ni+2 + 2e К: Cu+2 + 2e →
Cuo
Суммарная реакция:
+ Cu2+ → Cu + Ni2+
Задача №273.
Составьте электронные уравнения
процессов, происходящих на графитовых электродах при электролизе расплавов и
водных растворов NaCl
и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида
калия, если электролиз проводить в течение 30 мин при силе тока 0,5 А? Ответ:
0,052 л.
При электролизе NaCl:
K(-): 2H+
+ 2e = H2
A(+): 2Cl-
- 2e = Cl2
При электролизе KOH:
K(-): 2H+
+ 2e = H2
A(+): 4OH-
- 4e = O2
+ H2O
m = (56∙0,5∙30∙60)/96500
= 0,52г
M(KOH)
= 56г/моль
Задача №293.
Железная пластинка (E°= -0,44 В) в обоих случаях
будет являться анодом, т.к. у олова E°= -0,14 В, а у меди E° = -0,34 В. Поэтому
электрохимические процессы будут одинаковыми и будут идти по схеме: А: Feo
- 2e → Fe2+ К: 2H2O + O2 + 4e →
4OH- 2Fe + 2H2О + O2 → 2 Fe(OH)2
Далее происходит окисление гидроксида железа (II) 4Fe(OH)2 + 2H2О
+ O2 → 4Fe(OH)3 Быстрее образуется ржавчина на
пластинке покрытая медью, т.к. разность потенциалов в данном случае больше.
Задача №313.
Для диссоциации
<#"523925.files/image002.gif">