Малая ядерная РНК
Московский
Педагогический Государственный Университет
Биолого-химический
факультет
Курсовая
работа по биохимии на тему:
«Малая
ядерная РНК».
Выполнила студентка
курса, 4гр., 9 п/гр.,
Суходольская Евгения.
Москва, 2009
Содержание
Введение
РНК - фермент
«Разорванные гены». Созревание мРНК
Механизм сплайсинга. Роль мяРНК
Альтернативный регулируемый сплайсинг
Созревание рРНК. мяРНК
Созревание тРНК
Заключение
Список используемой литературы
Введение
Молекулы нуклеиновых кислот ДНК и РНК хранят в себе генетическую
информацию, необходимую для существования и размножения живой клетки. Белки же
выступают в роли действующего начала: молекулы белков-ферментов катализируют
тысячи химических реакций, протекающих в клетке. Еще недавно такое «разделение
труда» между информационными и действующими молекулами считалось одним из
основополагающих принципов биохимии. Однако в последние несколько лет эта схема
была пересмотрена в связи с открытием того, что РНК может выступать в качестве
фермента.
Долгое время считалось, что катализаторами всех реакций в живой клетке
служат только белки - ферменты. Открытие того, что РНК может катализировать
разрезание и сшивание самой себя, т. е. созревание, опровергает универсальность
этого принципа, а также проливает свет на ранние этапы эволюции. Изучение
компонентов процесса созревания РНК имеет очень важное значение, так как
активность генов может регулироваться не только в результате изменения
интенсивности образования РНК (транскрипции генов), но и благодаря контролю за
созреванием РНК (информационных, рибосомных, транспортных и др.),
претерпевающих в ядре сложные превращения. Становится очевидным, что странная
на первый взгляд прерывистая структура генов не только обеспечивает тонкую
регуляцию их активности, но и способствует экономному, эффективному
использованию информации, закодированной в нуклеотидной последовательности ДНК.
каталитическая
нуклеиновая кислота ядерная ген
РНК - фермент
Каталитическая активность РНК была открыта в 1981 - 1982 гг., когда Томас
Р. Чек и его коллеги изучали РНК из одноклеточного организма Tetrahymena
thermophila, относящегося к типу простейших. К своему изумлению, они
обнаружили, что эта РНК может катализировать разрезание и сплайсинг самой себя,
в результате чего из нее выщепляется небольшой фрагмент. Если забыть, что РНК
не белок, РНК тетрахимены удовлетворяет классическому определению фермента. От
«настоящих» ферментов она отличается только тем, что белки-ферменты
катализируют реакции, протекающие между другими молекулами, в то время как эта
РНК катализирует собственные метаморфозы. Поэтому для ферментоподобных молекул
РНК был предложен термин «рибозим» (от англ. RIBOnucleic enZYME).
Почему в биологических системах столь необходимы катализаторы?
Потребность в них проистекает в основном из свойств химических соединений,
составляющих живой организм. Молекулы, принимающие участие в клеточных
процессах, обычно относительно стабильны и без воздействия извне неохотно
вступают в химические реакции. Ферменты ускоряют эти реакции, так что они
осуществляются за времена, соизмеримые со временем жизни клетки. Заметим, что с
такой работой белки справляются превосходно. Обычно белковый фермент ускоряет
катализируемую им реакцию в 106 - 1012 раз; причем белки
являются истинными катализаторами: после завершения реакции белковый фермент
остается в той же форме, в какой вступил в нее.
В общем-то, понятно, почему представление о том, что любой фермент
является белком, прочно утвердилось в умах ученых, изучающих клетку. За
десятилетия, прошедшие после того, как в 1926 г. Дж. Самнер из Корнеллского
университета впервые выделил в чистом виде фермент - уреазу, участвующую в
расщеплении мочевины, сотни ферментов были получены в индивидуальном виде. И во
всех случаях фермент оказывался белком - цепочкой аминокислот, свернутой в
пространстве определенным образом. В ходе исследований ферментов многое стало
известно об их действии. Было обнаружено, что каждый фермент катализирует
только одну биохимическую реакцию или группу очень сходных реакции. Такая
исключительная специфичность обеспечивается пространственной укладкой
аминокислотной цепи, придающей белку трехмерную структуру, необходимую для
участия в данном химическом взаимодействии.
В 30 - 40-е годы активно изучалась «ферментативная» сторона жизни клетки,
а изучение информационного аспекта в то время сильно отставало. Первый успех в
этой области пришел в 1944 г., когда О. Эйвери и его коллегам из
Рокфеллеровского института медицинских исследований удалось показать, что ДНК
способна передавать генетическую информацию. Следующим большим достижением было
установление структуры ДНК (это сделали в 1953 г. Дж. Уотсон и Ф. Крик).
Вскоре после того, как стали понятны структура и значение ДНК,
выяснилось, что РНК выполняет ключевые функции в передаче генетической информации
от ДНК к белку. Сначала последовательность нуклеотидов ДНК копируется, что
осуществляется в процессе транскрипции; в результате этого синтезируется
матричная РНК (мРНК), последовательность нуклеотидов которой соответствует
исходной ДНК. Матричная РНК связывается с рибосомой, где на ней, как по
программе, собирается молекула белка.
Передача
генетической информации - только одна из функций РНК. В состав самой рибосомы
также входит несколько молекул РНК (рРНК). Другие небольшие молекулы РНК,
называемые транспортными (тРНК), участвуют в присоединении в нужном порядке
аминокислот к растущей цепи белка. В конце 70-х годов роль мРНК, рРНК и тРНК
была уже давно известна и казалось, что у РНК не осталось больше никаких тайн.
Но это лишь казалось.
«Разорванные
гены». Созревание мРНК
В 1977 г., к удивлению всего научного мира, да и к своему собственному,
две группы исследователей - Ф. Шарп с коллегами в Массачусетском
технологическом институте и группа сотрудников Колд-Спринг-Харборской
лаборатории - открыли, что у высших организмов гены «разорваны». Оказалось, что
кодирующие белок последовательности прерываются вставками, которые не кодируют
белок и при созревании молекулы удаляются из предшественника РНК. Эти участки
были названы интронами. Участки РНК, ковалентно соединяющиеся друг с другом и
сохраняющиеся в составе зрелой РНК, называют экзонами. Зрелая информационная
РНК, содержащая экзоны, транслируется в цитоплазме с участием рибосом.
Оказалось, что экзон-интронная структура генов эукариот является скорее
правилом, а гены без интронов - немногочисленными исключениями. Гены бактерий
обычно не содержат экзонов. Экзоны включают последовательность нуклеотидов,
содержащую следующие друг за другом кодоны (нуклеотидные триплеты),
определяющие положение аминокислот в белке. Молекулы РНК, как и комплементарные
нити двойной спирали ДНК, полярны, различают 5'- и 3'-концы молекулы. Участки
экзонов или даже отдельные целые экзоны, располагающиеся на 5'- и 3'-концах
молекулы информационной РНК, могут не использоваться при трансляции, они не
кодируют аминокислоты.
В
процессе созревания (процессинга) мРНК
<#"522429.files/image001.gif">
Рис.1.
Биогенез мРНК у эукариот.
В
осуществлении каждого из указанных процесов специфическое участие принимает ряд
белков <#"522429.files/image002.gif">
Рис.2.
Схема мяРНП и сплайсосомы.
Как
белки и РНК, осуществляющие сплайсинг, узнают какой фрагмент пре-мРНК нужно
вырезать? И у дрожжей и у высших эукариот есть консервативные
последовательности, определяющие границы интронов - GU на 5’- конце
и AG на 3’- конце (рис. 3). Выделяют три функционально
важных участка пре-мРНК, участвующие в сплайсинге: 5’-место сплайсинга (5’SS),
3’- место сплайсинга (3’SS) и место разветвления(BS), содержащее
в
нуклеотидной
последовательности A (аденин), который не образует пары с U и, следовательно,
не входит в состав двойной спирали в результате взаимодействия с мяРНК. Поэтому
этот А обладает особой реакционной способностью. На первой стадии 2’-гидроксил
аденозина места разветвления атакует фосфодиэфирную связь 5’SS. В
итоге этой атаки образуется структура “лассо” и свободный 3’-гидроксил
5’-концевого экзона. Во время второй стадии этот 3’-гидроксил атакует 3’SS. В
результате экзоны оказываются ковалентно соединенными обычной межнуклеотидной
связью, а интрон уходит в виде структуры “лассо”.
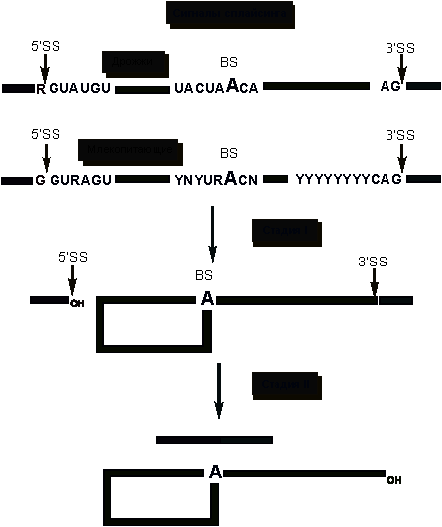
Рис. 3. Нуклеотидные последовательности, определяющие границы интронов.
Схема изменения ковалентных связей при вырезании интрона.
Как же и в какой последовательности узнаются места сплайсинга и
разветвления? Сначала U1 мяРНП
узнает 5’-место сплайсинга, а возможно и 3’-место сплайсинга (рис. 4). Место
разветвления узнается белком SF1
(на рисунках в скобках представлены названия соответствующих белков в дрожжах),
а полипиримидиновая последовательность, предшествующая 3'SS - гетеродимером U2AF. При этом образуется комплекс CC (commitment complex) - комплекс определяущий вырезание данного интрона.
На следующем этапе комплекс CC переходит в комплекс A
(рис. 5). Белок SF1 вытесняется с
помощью UAP56 и с местом разветвления связывается
U2 мяРНП. В самом U2 мяРНП фрагмент U2 мяРНК,
комплементарный BS, освобождается
от белка SAP61. Связыванию U2 РНП помогает белок U2AF.
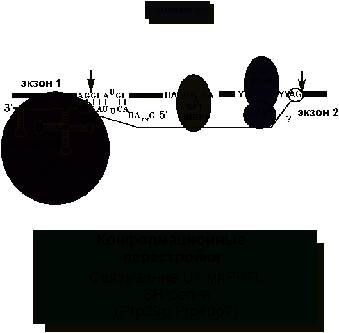
Рис.
4. Первичное узнавание интрона: образование комплекса CC.

Рис.
5. Образование комплекса A: присоединение U2 мяРНП.
После
связывания U2 мяРНП к сплайсосоме присоединяется крупный
рибонуклеопротеид, содержащий 3 мяРНК: U4,U5 и U6
(рис. 6). В результате образуется комплекс B1, содержащий 5
молекул мяРНК. U1 мяРНК в этом комплексе связана с 5’SS, U2 -
с местом разветвления, а U4 мяРНК связана с U6
многочисленными комплементарными взаимодействиями и тем самым до поры до
времени блокирует активность U6 мяРНК. Все мяРНК, кроме U6 синтезируются
РНК полимеразой II и имеют классические атрибуты мяРНП - связанные Sm
белки и триметилированный кеп. U6 мяРНК транскрибируется РНК полимеразой III и
не имеет кеп-структуры. Кроме того, вместо Sm белков с ней
связаны гомологичные им Lsm белки.
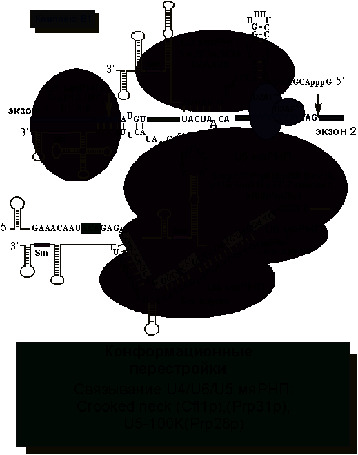
Рис.
6. Образование B1 комплекса: связывание U4/U5/U5
мяРНП.
После
образования B1 комплекса происходит самая драматическая
конформационная перестройка сплайсосомы (рис. 7). Во-первых, теряется связь U1
мяРНК с 5'SS. Во-вторых, расплетается дуплекс между U4 и U6
мяРНК. В-третьих, образуются дуплексы между U6 мяРНК и 5’SS, а
также U6 и U2 мяРНК. Самую активную роль в этих перестройках
играют белки, ассоциированные с U5 мяРНК. U5-200k расплетает
дуплекс между U4 и U6 мяРНК, а U5-100k помогает
образовать контакт между U6 и 5’SS. Другой белок, ассоциированный с U5 (U5-220k)
способствует тому, что консервативная шпилька U5 мяРНК связывает
5’SS и 3’SS. В результате оказывается, что дуплекс U2 и U6
связывает место разветвления и 5'-место сплайсинга. U5 мяРНК
дополнительно фиксирует 5’SS так, что оказывается возможным провести нуклеофильныю
атаку 2’-OH выпетливающегося аденозина на межнуклеотидную связь
5’SS.
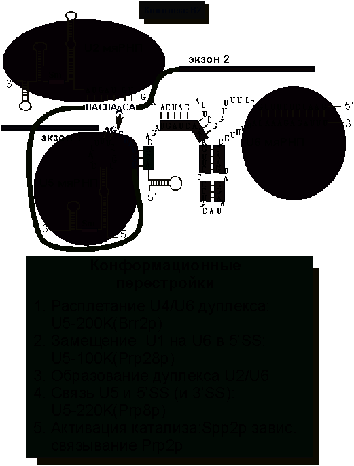
Рис.
7. Образование комплекса B2.
Переход
от B2 комплекса к C1 как раз
соответствует первой стадии сплайсинга, т.е. образованием лассообразной
структуры и освобождению 3’-гидроксила 5’-концевого экзона (рис.8). В самом
каталитическом акте сплайсосомы принимают участие белки Spp2p и Prp2p,
хотя основную роль в катализе играют не белки, а сплайсосомная РНК.
После
прохождения первой стадии сплайсинга необходимо подставить в активный центр
сплайсосомы 3’SS. За выбор 3’-места сплайсинга отвечает U5-220k белок.
Целый ряд белковых факторов играют роль в подстановке 3’-места сплайсинга в
активный центр. Кроме того, осуществляется контроль за правильностью проведения
первой стадии сплайсинга в котором принимает участие белок Prp16p.
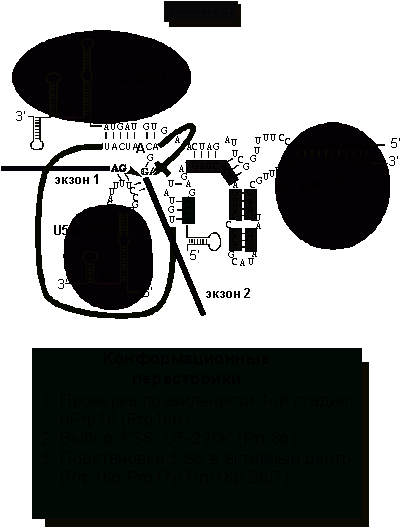
Рис.
8. Образование комплекса C1: подстановка 3’SS в активный
центр.
Особую
роль в позиционировании 5’-экзона и 3'-места сплайсинга играет U5
мяРНК. Молекула U5 мяРНК содержит петлю из неспаренных нуклеотидов на
ножке (стволике), где нуклеотиды образуют пары, создавая двойную РНК-спираль.
Нуклеотиды петли, взаимодействуя за счет водородных связей с экзонами,
удерживают их вблизи друг от друга. Кроме того, первый и последний нуклеотиды интрона
образуют неканонические взаимодействия двух G (гуанозинов).
Эти взаимодействия помогают стягивать экзоны и осуществлять сплайсинг. Характер
водородных связей функциональных групп гуанина отличается от классических,
наблюдаемых в паре G-C Уотсона и Крика. Так, аминогруппа G, участвующая в
установлении комплементарных взаимодействий с С, здесь остается вне игры.
Вторая стадия сплайсинга, катализируемая сплайсосомой заключается в атаке
3’-гидроксила первого экзона на межнуклеотидную связь между интроном и
3’-концевым экзоном. В результате экзоны оказываются соединенными, а интрон -
вырезанным в виде лассообразной структуры (рис.9).
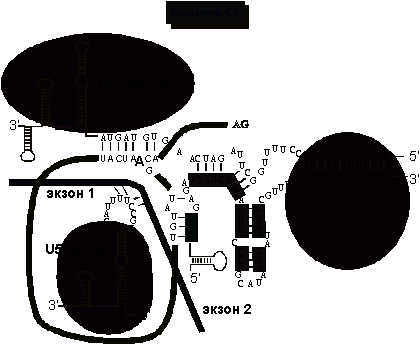
Рис.
9. Образование комплекса C2. Лигирование экзонов и полное выщепление интрона.
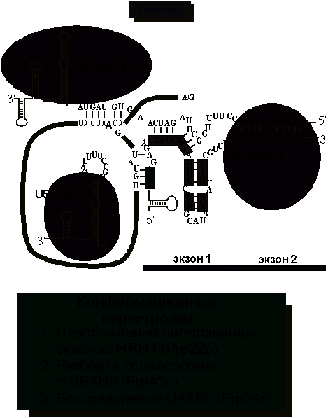
Рис.
10. Образование комплекса I. Высвобождение интрона и лигированных экзонов.
После
прохождения обеих стадий сплайсинга становится необходимо разобрать
сплайсосому, освободить лигированные экзоны, а также вырезанный интрон (рис
10). мРНК высвобождает HRH1 белок. Разборкой сплайсосомы занимается белок mDEAH9.
Дополнительный белковый фактор (Prp24p) нужен для воссоздания U4/U6
гетеродимера. Не все белки, входящие в состав сплайсосомы, покидают мРНК после
сплайсинга. Некоторые остаются связанными с мРНК в ядре и участвуют в экспорте
сплайсированной мРНК. Другие переносятся с мРНК в цитоплазму, где осуществляют
“контроль качества” мРНК при ее трансляции.
На
рисунке 11 схематично представлен весь цикл работы сплайсосомы.

Рис.
11. Цикл работы сплайсосомы.
Таким образом, сплайсинг протекает в несколько этапов: начинается с
взаимодействия пре-мРНК с U1
мяРНК, затем образуются лассо и сложная многокомпонентная структура.
Пространственная структура взаимодействующих участков молекул РНК обеспечивает
каталитические реакции разрыва одних межнуклеотидных связей и возникновение
новых. В основе катализа лежит способность РНК образовывать описанные
структуры, обеспечивающие высокую реакционную способность определенных
нуклеотидов, расположенных по длине молекул РНК. Возникновение таких структур
обеспечивает точность сплайсинга. В ряде случаев, например в транскриптах генов
клеточных органелл (митохондрий или хлоропластов), образование сложной
трехмерной структуры в районе интрона обеспечивает его вырезание и сшивание
экзонов без участия белков. Такой процесс, не зависящий от белков, называют
самосплайсингом или аутосплайсингом.
Обнаружение способности молекул РНК катализировать собственные химические
превращения или модификацию (созревание) других молекул РНК позволило назвать
их рибозимами по аналогии с ферментами (энзимами). Необходимо отметить, что
активность рибозимов сильно увеличивается, когда они находятся в комплексе с
белками. В обоих случаях успешный ход катализа обеспечивается трехмерными
структурами белка или РНК-РНК-комплекса. Повреждение этих структур
останавливает реакцию. В случае рибозимов первостепенную роль играют
комплементарные взаимодействия нуклеотидных пар. Заметим, однако, что белки ускоряют
взаимодействия мяРНК с пре-мРНК.
В сплайсинге принимают участие белки, обладающие ферментативной
активностью. Для сборки комплекса, катализирующего сплайсинг, необходимо
потребление энергии в виде расщепляемых молекул АТФ, поэтому в его составе обнаруживаются
белки, обладающие аденозинтрифосфатазной активностью. Кроме того, здесь
функционируют и РНК-хеликазы - ферменты, способные расплетать при потреблении
АТФ двойные спирали РНК-РНК. Эти ферменты подобны ДНК-хеликазам, расплетающим
двунитевую спираль ДНК при репликации молекулы ДНК. Хеликазы обеспечивают ход
сплайсинга. Они вовремя разрушают одни РНК-РНК взаимодействия (например, U4 мяРНК - U6 мяРНК ), способствуя тем самым возникновению новых
нековалентных связей между молекулами РНК. Таким образом, последовательность
событий, ведущих к сплайсингу экзонов, достаточно жестко определена, причем
каждая последующая стадия (или реакция) обусловлена предыдущей.
Многокомпонентность машины сплайсинга позволяет ускорять или тормозить процесс
созревания РНК, если изменять концентрацию отдельных компонентов или вызывать
их химическую модификацию. Например, наблюдали фосфорилирование белков
сплайсинга, сопровождающееся активацией одних и инактивацией других белков.
Альтернативный регулируемый сплайсинг.
Оказалось, что экзоны, если их несколько, могут сшиваться
(сплайсироваться) в разных комбинациях. Более того, нуклеотидная
последовательность, выступающая как экзон в одном случае, ведет себя как интрон
в другом. Эти возможности выбора путей сплайсинга молекулы РНК-предшественника
представлены на рис. 12.

Рис.
12. Схема альтернативного сплайсинга пре-мРНК.
Так,
например, участок экзона 1а может вести себя как интрон. Другой случай
демонстрирует образование двух разных РНК, несущих участки, кодирующие разные
белковые структуры. Так, если экзон 2 кодирует в молекуле белка элементы α-спирали, а экзон 3 - так называемой β-структуры, то РНК 1 будет кодировать белок, не
включающий указанный участок β-структуры,
а РНК 2, напротив, служит матрицей при образовании белка без участка α-спирали. В результате образуются так называемые
изоформы белка. Это наблюдаемое для многих генов явление выбора путей
созревания мРНК получило название альтернативного сплайсинга. Многие гены
содержат десяток и более экзонов. Поэтому число вариантов зрелых молекул мРНК,
содержащих разные экзоны, потенциально может быть достаточно большим,
приближаясь к величине 2n, где n - число экзонов. Таким образом,
экзон-интронная структура оказывается чрезвычайно экономичной, обеспечивая
большое разнообразие белков, кодируемых разными мРНК, которые, однако,
произошли из одного и того же РНК-предшественника в результате транскрипции
одного гена.
Случаи
альтернативного сплайсинга имеют место в мышечной ткани, приводя к образованию
функционально различающихся, но во многом сходных (содержат общие экзоны!)
белков. Рассмотрим конкретный пример - тропомиозин, белок, участвующий в
мышечном сокращении. В разных клетках с гена тропомиозина синтезируются разные
белки:
Это
же явление широко распространено в нервной ткани, где, как известно,
транскрибируется огромное множество генов, обеспечивая разнообразие белков.
Так, например, разнообразие белков оболочки нервных волокон обусловлено
альтернативным сплайсингом. Альтернативный сплайсинг нередко используется при
синтезе вариантов белков - "факторов транскрипции", необходимых для
включения (или выключения) гена и работы РНК-полимеразы. Наличие белка -
фактора транскрипции может определять судьбу клетки, ее дифференцировку в
клетку специализированной ткани: нервной, жировой, почечной и т.д.
Альтернативный сплайсинг выполняет свою роль и при образовании вариантов белков
клеточной адгезии, которые отвечают за передвижение клеток и структурирование
тканей. Бактерии, обладающие, как правило, генами без интронов, лишены этого
способа регуляции работы (экспрессии) генов.
Каким
образом осуществляется выбор пути альтернативного сплайсинга, являющегося
важным механизмом регуляции активности генов и клеточной дифференцировки?
Характер сплайсинга регулируется белками, способными связываться с молекулой
РНК в районах интронов или пограничных участках экзон-интрон. Такие белки могут
блокировать удаление одних интронов, в то же время активируя вырезание других.
РНК-предшественник складывается в сложную трехмерную структуру, взаимодействуя
с другими компонентами сплайсосомы. Поэтому нетрудно представить себе такие
пространственные изменения этой структуры при участии белков, регулирующих
сплайсинг, которые исключат катализ объединения одной пары интронов и,
напротив, будут эффективно способствовать сшиванию другой пары.
Направленная
регуляция путей сплайсинга может иметь громадные биологические последствия,
например определять пол организма. Случай определения пола, основанный на
регуляции сплайсинга, достаточно хорошо изучен у плодовой мушки дрозофилы
(рис.13). Успехи этих исследований основаны на работах генетиков, изучавших
мутации, нарушающие становление пола. Огромную роль здесь сыграли также работы,
в которых в экспериментах in vitro были использованы "клонированные
гены" (рекомбинантные ДНК).
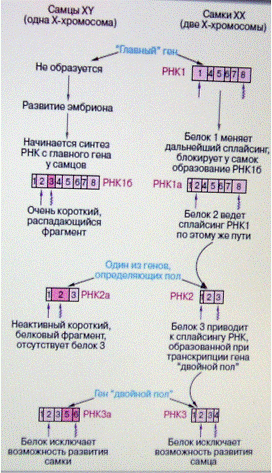
Рис.13.
Регулируемый каскад следующих друг за другом альтернативных путей сплайсинга
определяет становление пола на самых ранних стадиях развития дрозофилы. Прямая
и волнообразная стрелки обозначают соответственно начало и конец трансляции
(образование белка). Экзоны, специфичные для самцов, выделены розовым цветом.
У
дрозофилы (впрочем, как и у человека) есть две половые хромосомы (X и Y). Две
X-хромосомы имеют самки, тогда как самцы - единственную X-хромосому, а также
Y-хромосому. Наличие двух X-хромосом у самок достаточно для включения
"главного гена", заставляющего включиться "нижележащие"
гены, участвующие в определении пола. Главный ген (рис. 13) поначалу начинает
работать (транскрибироваться) только у самок с двумя Х- хромосомами. В клетке
срабатывают механизмы, подсчитывающие число Х-хромосом. Этот механизм основан
на том, что у самок с двумя Х-хромосомами образуется достаточное количество
белка, кодируемого генами Х-хромосомы, который активирует промотор главного
гена. Транскрипция главного гена начинается с промотора 1 (на рис. 13 не
показан). У самцов с одной Х-хромосомой количество белка недостаточно, чтобы
запустить главный ген. В результате сплайсинга транскрипта главного гена
образуется РНК 1, содержащая экзоны 1, 4, 5, 6, 7 и 8. В этом случае
потенциальные экзоны 2 и 3 не входят в состав мРНК. Эти события происходят на
самых ранних стадиях развития эмбриона. Немного позднее ген 1 начинает
транскрибироваться как у самок, так и у самцов с использованием другого
промотора 2, лежащего левее. В этом случае 5'-конец РНК-предшественника будет
удлинен, в результате чего экзон 1 сплайсируется иным путем и становится короче
в РНК 1а и 1б по сравнению с РНК 1. Белок 1, образующийся при трансляции РНК 1,
является регуляторным белком сплайсинга, отсутствующим у самцов. Этот белок
направляет сплайсинг у самок с образованием зрелой РНК 1а, содержащей фрагмент
экзона 1, к которому пришиваются последующие экзоны: 2-4-5-6-7-8. Белок,
определяющий такой характер альтернативного сплайсинга, отсутствует у самцов. В
результате в ядрах клеток развивающегося эмбриона, обладающего только одной
Х-хромосомой, предшественник РНК созревает с образованием РНК 1б, включающей
экзон 3.
Регуляторный
белок 1 сплайсинга, образовавшийся у самок на РНК1, позволяет машине сплайсинга
"узнавать" в клетках самок экзон 3 как интрон и удалять его с
образованием РНК1 и РНК1а. Оказывается, экзон 3 содержит так называемый
стоп-кодон, который не кодирует аминокислоты и останавливает рост полипептидной
цепи белковой молекулы. В результате синтез белка на РНК 1б если и начнется, то
быстро оборвется с образованием очень короткого, распадающегося белкового
фрагмента. Таким образом, "самцовый" тип сплайсинга приводит
фактически к инактивации гена, поскольку ген не способен кодировать образование
функционирующей белковой молекулы. Следовательно, результатом альтернативного
сплайсинга может быть не только образование изоформ белков, кодируемых одним
геном, но и инактивация гена ("главного гена" у самцов). Белок 2,
образующийся у самок, не только постоянно направляет ход сплайсинга с
образованием РНК 1а, но и регулирует созревание РНК 2, содержащей экзоны 1-2-3.
Эта РНК 2 образуется уже на другом гене, входящем в систему генов определения
пола у дрозофилы. У самцов образуется несколько иной вариант РНК 2 - РНК 2а,
включающая несколько увеличенный экзон 2. Этот фрагмент экзона у самок узнается
как интрон. Опять "самцовая" часть экзона 2 содержит стоп-кодон,
останавливающий трансляцию, тогда как у самок образуется активный белок 3,
приводящий к образованию РНК 3, включающей экзоны 1-2-3-4. При отсутствии белка
3 предшественник РНК 3 в ядрах клеток самцов "сплайсируется" таким
образом, что последовательность, соответствующая экзону 4 самок, выглядит как
интрон, а к экзону 3 пришиваются экзоны 5 и 6. На этот раз РНК 3а (экзоны
1-2-3-5-6) у самцов, кодируемая геном "двойной пол", не содержит
вредных стоп-кодонов, она кодирует функциональный белок. Мишенями действия
регуляторных белков, синтезированных на матричных РНК 3 и 3а, являются гены,
дальнейшая работа которых полностью исключает соответственно развитие самца или
самки (рис. 13). Отметим, что, несмотря на вариации в характере сплайсинга,
всегда по краям интронов должны находиться упомянутые выше канонические
нуклеотидные последовательности, используемые при катализе того или иного пути
сплайсинга. Мы проследили каскад регулируемых событий альтернативного
сплайсинга. У самцов он дважды приводил к образованию дефектной мРНК, не
способной кодировать достаточно длинный и функционирующий белок. У самок
наблюдается последовательное, поэтапное образование матриц РНК для кодирования
белка, регулирующего транскрипцию и/или ход событий альтернативного сплайсинга.
Примеры
альтернативного сплайсинга новообразованной РНК показывают, как в конечном
счете окупаются затраты, в том числе энергетические, идущие на синтез избытка
участков РНК, которые затем удаляются и не используются для синтеза белка.
Альтернативный сплайсинг обеспечивает регуляцию работы гена, дифференцировку
тканей и развитие организма. Однако биологическая роль прерывистой
экзон-интронной структуры генов и роль интронных последовательностей на этом не
заканчивается. Недавно было обнаружено, что вырезаемые интроны могут быть
предшественниками особых малых ядерных РНК, участвующих в созревании рРНК.
Созревание рРНК. мяРНК
Рибосомные РНК синтезируются в виде большого предшественника. Этот
предшественник нарезается на зрелые молекулы рРНК с помощью эндо- и
экзонуклеаз. Кроме того, отдельные нуклеотиды рРНК модифицируются.
Предшественник рРНК прокариот содержит фрагменты, соответствующие 16S, 23S и 5S
рРНК. Как правило, в этом транскрипте содержатся также несколько пре-тРНК.
Большие рибосомальные РНК образуют домены подобного транскрипта. Их 5’ и
3’-концы сближены за счет комплементарности прилегающих участков РНК. Такая
двухцепочечная структура разрезается РНКазой III, а оставшиеся несколько лишних нуклеотидов отрезаются
экзонуклеазами. Модификация оснований рРНК проводится набором ферментов, причем
один фермент может модифицировать от 1 до 3 нуклеотидных остатков.
У эукариот созревание также включает в себя разрезание предшественника
(рис. 14), причем кроме 18S, 28S, и 5S рРНК появляется еще и 5.8S рРНК. Кроме различных эндо- и экзонуклеаз, в созревании
принимают участие малые ядрышковые РНК (мяРНК). Эти РНК локализованы
преимущественно в ядрышке - участке ядра, где происходит транскрипция генов
рРНК и сборка пре-рибосом.
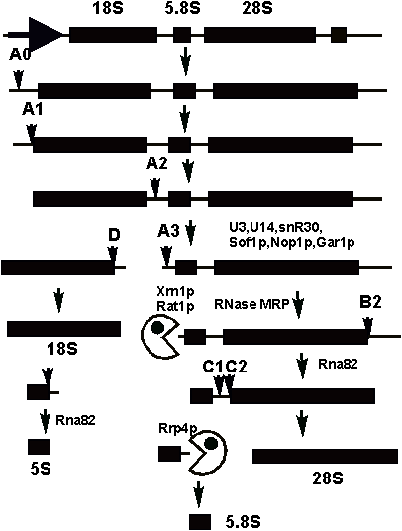
Рис.14.
Схема процесса разрезания предшественника рРНК эукариот.
Если
нарезание предшественника рРНК, в общем, сходно у про- и эукариот, то система
модификации оснований рРНК у эукариот уникальна. В отличии от прокариот, у
высших организмов модифицировано гораздо больше нуклеотидных остатков рРНК.
Среди модификаций подавляющее большинство это псевдоуридилирование и 2’-O-метилирование
рибозы. Невозможно представить, чтобы модификации всех этих остатков
осуществлялись каждая своим ферментом.
Оказалось,
что в ядрышке, помимо мяРНК, участвующих в разрезании пре-рРНК, существует
множество других мяРНК. Эти небольшие РНК можно разделить на 2 класса: C/D и H/ACA
(рис. 15).

Рис.
15. Свойства мяРНК различных классов.
МяРНК
обоих классов транскрибируются РНК пролимеразой II, но не как
самостоятельные гены, а в интронах других генов. Часто мяРНК входят в состав
интронов мРНК рибосомных белков. Есть случаи, когда единственной функцией
некоторых генов служит производство мяРНК, содержащихся в интронах. При этом
открытая рамка считывания зрелой мРНК прервана многочисленными стоп-кодонами и
не кодирует какого-либо белкового продукта.
Характерная
особенность мяРНК - короткие участки комплементарности различным областям рРНК.
У РНК C/D класса эта область комплементарности более 10
нуклеотидов, а у H/ACA - меньше. С каждым классом мяРНК связан свой набор
белков. мяоРНП C/D класса осуществляют 2’-O-метилирование,
а H/ACA - псевдоуридилирование рРНК.
Структура
мяРНК представлена на рисунке 17. 5’- и 3’-концы C/D
мяРНК спарены. Следом расположены две консервативные последовательности
нуклеотидов, из-за которых этот класс и получил свое название. Сразу за D
последовательностью идет участок комплементарности рРНК. Третий нуклеотид рРНК
от участка начала комплементарности 2’-O-метилируется.
У H/ACA мяРНК также имеется две консервативные
последовательности, давшие название этому классу. Нуклеотиды, комплементарные
рРНК располагаются в двух внутренних шпильках. Остаток уридина в положении,
отмеченном на рисунке 16, изомеризуется в псевдоуридин.
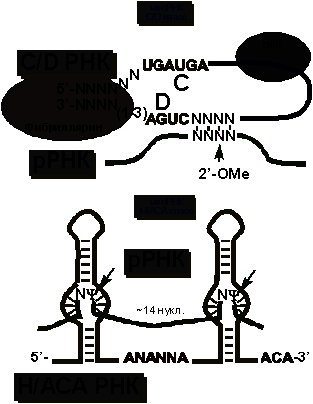
Рис.
16. Модель структуры комплексов мяРНК-рРНК, в которых происходит модификация нуклеотидов.
С
помощью мяРНК эукариотические организмы решают проблему специфичной модификации
остатков рРНК, без привлечения огромного числа специфичных ферментов. Кстати,
малые РНК, подобные мяРНК участвуют в модификации малых ядерных РНК.
Созревание тРНК
Предшественник тРНК содержит дополнительный фрагмент на 5’-конце (рис.
17). Этот фрагмент отрезается РНКазой P - рибонуклеопротеином, основную каталитическую роль в котором играет
РНК. РНК-компонент РНКазы P это
рибозим. Белок (или, в случае эукариот, белки) в РНКазе P играет лишь структурную роль. Также,
как и для других рибозимов, РНК РНКазы P имеет сильную вторичную структуру. В бактериальной РНКазе P есть участок, комплементарный CCA концу тРНК. Эукариотическая РНКаза P узнает другие элементы предшественника
тРНК.

Рис.
17. Модель вторичной и третичной структур бактериальной РНКазы P и
ее субстрат - предшественник тРНК.
Формированием
3’-конца молекулы тРНК занимаются несколько белков - РНКаз. Кроме того, особый
фермент - тРНК нуклеотидилтрансфераза достраивает CCA хвост тРНК,
если он был утрачен. У эукариот CCA последовательность вообще не кодируется в генах тРНК,
а добавляется пост-транскрипционно.
В
тРНК эукариот, например дрожжей, есть интроны. В отличии от интронов,
встречающихся в мРНК, они не ограничены какими-либо консервативными
последовательностями и встроены в строго определенный участок тРНК -
антикодоновую петлю (рис. 18).
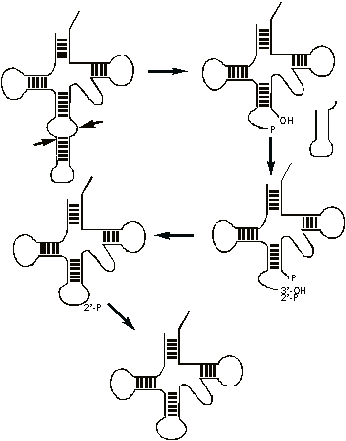
Рис.
18. Сплайсинг пре-тРНК дрожжей.
Предшественник
тРНК имеет в районе антикодоновой шпильки симметричную структуру, узнающуюся
димером специфической эндонуклеазы. Эта нуклеаза вырезает интрон, оставляя
фосфат на 3’-конце 5’-концевого фрагмента. Для успешного лигирования фрагментов
тРНК, необходим 3’-гидроксил и 5’-фосфат. Чтобы достичь этого, ферменты,
осуществляющие сплайсинг тРНК, сначала переносят фосфат с 3’-положения на 2’.
Затем проводится фосфорилирование 5’-гидроксила. После лигирования образуется
ковалентно замкнутая тРНК, содержащая дополнительный фосфат, присоединенный к
2’-OH. Он удаляется фосфатазой.
Заключение
В заключении хотелось бы выделить основные положения, которые показал
анализ литературных данных.
1. Главной функцией мяРНК является участие в процессе
"созревания" клеточных РНК.
2. Процесс "созревания" клеточных РНК сопровождается
химическими модификациями РНК-предшественника и укорочением его размеров.
Созревание представляет собой регулируемый многостадийный путь, по ходу
которого осуществляется взаимодействие новообразованного предшественника РНК с
белками и другими РНК, обеспечивающими в конце концов образование функционально
активной молекулы РНК. Регуляция процесса созревания РНК - это способ регуляции
активности гена, кодирующего данную молекулу РНК.
3. При созревании информационной РНК имеет место каталитический
процесс удаления из РНК интронов и объединения экзонов, кодирующих отдельные
участки белка. Совокупность этих химических реакций носит название сплайсинга.
Сплайсинг проходит в специальной внутриядерной многокомпонентной структуре -
сплайсосоме, включающей десятки белков и набор так называемых малых ядерных
РНК, обеспечивающих сплайсинг.
. Молекулярный механизм сплайсинга осуществляется благодаря
комплементарным взаимодействиям нуклеотидов РНК-предшественника и малых ядерных
РНК. Эти взаимодействия играют первостепенную роль в катализе сплайсинга.
Образующиеся сложные структуры определяют точность сплайсинга. Кроме того,
велика роль белков, способных специфично "узнавать" не только участки
РНК, но и друг друга. Сплайсинг определяется последовательными упорядоченными
взаимодействиями компонентов машины сплайсинга с предшественниками РНК.
Исследование молекулярных механизмов сплайсинга показывает, что каталитическая
активность, определяющая удаление интронов и объединение экзонов, может иметь
место и при отсутствии белков, то есть определяться взаимодействиями участков
РНК, приводящих как к разрыву, так и к воссоединению межнуклеотидных связей.
Нарушение точности сплайсинга при образовании информационных РНК, вызванное
мутацией, может препятствовать трансляции и образованию белка.
. Многокомпонентность машины сплайсинга позволяет регулировать
образование мРНК за счет изменения концентраций отдельных компонентов или
химической модификации, меняющей биологическую активность молекул, определяющих
сплайсинг.
. Изменение характера сплайсинга экзонов в разных тканях одного и
того же РНК-предшественника может приводить к образованию разных РНК,
содержащих разные наборы экзонов (альтернативный сплайсинг). В результате РНК,
транскрибируемые с одного гена, будут кодировать белки с разными свойствами.
Выбор путей сплайсинга РНК-предшественника - это способ регуляции активности
генов в разных клетках и тканях организма.
Список используемой литературы
1. Гвоздев
В.А. Механизмы регуляции активности генов в процессе транскрипции //
Соросовский Образовательный Журнал. 1996. № 2. С. 22-31.
2. Велц
Р., Шмидт К., Мюллер С. Моделирование и синтез рибозимов // Молекулярная
биология - 2000 - т.34 - вып.6 - с.1090-1095
. Зверева
М.Э., Шпанченко О.В. Структура и функции тмРНК (10Sa РНК) // Молекулярная биология - 2000 - т.34 - вып.6 - с.
1081-1088
. Кленов
М.С., Гвоздев В.А. Формирование гетерохроматина: ролькоротких РНК и
метилирования ДНК // Биохимия - 2005 - т.70 - вып.11 - с.1445
. Тайны
маленьких РНК // Вокруг света - 2007 - №3
. Лекции,
представленные на сайте кафедры химии природных соединений МГУ. Сергиев П.В.
Процессинг. 2002 г
http://nature.chem.msu.su/study_lectures_editing_lectureonline_ru.html
. Томас
Р. Чек РНК - фермент // В мире науки. 1987 №1