Дендритные клетки и их роль в иммунной защите
Министерство
Образования Азербайджанской Республики
Бакинский
Государственный Университет
Биологический
факультет, кафедра
биохимии и
биотехнологии
КУРСОВАЯ
РАБОТА
на тему:
«Дендритные клетки и их роль в иммунной защите».
студентки IV курса очного
отдела р/с,
группы №023
Сеидзаде Нармины.
Баку 2011
Введение
Согласно
современным представлениям, иммунная система млекопитающих описывается как
состоящая из звеньев врожденного и приобретенного иммунитета. Такое разделение
является достаточно обоснованным, но, тем не менее, в известной мере и
условным: например, дендритные клетки, нейтрофилы и эозинофилы, являющиеся
разными типами профессиональных антиген-презентирующих клеток, принадлежат к
врожденному иммунитету, т.к. не обладают свойствами "иммунологической
памяти". Как известно, гуморальный иммунный ответ (образование антител)
<#"520238.files/image001.gif">
К
ним относятся популяции отростчатых прилипающих клеток, обладающих высокой
антигенперерабатывающей способностью, сохраняющих и презентирующих антиген.
Дендритные клетки находятся в крови и различных органах, преимущественно
лимфоидных. Количество дендритных клеток периферической крови человека
составляет 0,1-0,5%. Дендритные клетки селезенки находятся в Т-зависимой зоне.
Они простирают свои отростки между Т-клетками. Особый вид дендритных
клеток,названных вуалевидными, обнаружен в лимфе и в паракортикальной области
лимфоидных узлов. Различают несколько путей их дифференциации и созревания.
Миелоидные предшественники дифференцируются в классические эпителиальные(CD1a)
и неэпителиальные (CD1a) тканевые дендритные клетки. Моноциты крови также могут
дифференцироваться в дендритные клетки (Мо-ДК) и таким образом усиливать
популяцию антигенпрезентирующих клеток.
Дендритные
клетки экспрессируют набор поверхностных молекул, характерных для других
антигенпредставляющих клеток:
· рецепторы для компонентов клеточной стенки и нуклеиновых
кислот микроорганизмов, в том числе рецепторы к компонентам комплемента и
toll-like рецепторы;
· молекулы II класса гистосовместимости;
· костимуляторные молекулы CD40, B7 1/2 (CD80, CD86), B7-DC,
B7-H1;
· молекулы межклеточной адгезии (ICAM-1)
Фенотип клеток (Thy-1+, Ly-5+, Lyt-2-,
L3T4-, асиало-GM1+) у мышей позволяет предположить, что
это естественные киллерные клетки (ЕКК), незрелые тимоциты или естественные
супрессорные клетки. До сих пор аналогичные клетки не выделены из кожи чело-
века.
Классификация: К дендритным АПК относятся:
1. -
клетки Лангерганса
<#"520238.files/image002.gif">
Клетки Лангерганса - внутриэпидермальные макрофаги, впервые были описаны
в 1868 году немецким гистологом известным всем Паулем Лангергансом. Для
выделения клеток был использован метод золочения. Он считал их нервными
элементами. В последующем клетки Лангерганса рассматривали как стареющие
меланоциты. Лишь в последние годы убедительно показано, что эти клетки имеют
костномозговое (моноцитарное) происхождение и являются разновидностью
макрофагов. Работами G.F. Murphy и соавт. (1986) была показана трансформация
дермальных активно фагоцитирующих макрофагов в эпидермальные клетки Лангерганса
через промежуточные формы, которые совмещали в себе как свойства
моноцитов-макрофагов, так и типичных клеток Лангерганса. Подобно меланоцитам,
клетки Лангерганса обладают большим количеством отростков и относительно
светлой цитоплазмой. Они обычно располагаются в пределах шиповатого слоя
средней части эпидермиса, хотя случайные клетки также могут встречаться и в
самых нижних слоях эпидермиса. Клетки Лангерганса имеют костномозговое
происхождение, это, так называемые, мо-нонуклеарные клетки которые находятся в
эпидермисе. Они предназначены для приема, обработки и представления информации
об антигенах окружающей среды (и, возможно, также об эндогенных антигенах)
Т-лимфоци-там в коже и в лимфатических узлах, дренирующих кожу. Соответственно,
они являются важными медиаторами таких столь разнообразных состояний, как
контактные дерматиты и, потенциально, опухолевая регрессия. Резидентная
популяция клеток Лангерганса и ассоциированные с ними иммунологически активные
лимфоциты и мононуклеары были названы ассоциированной с кожей лимфоидной тканью
- SALT (skin-associated lymphoid tissue).Клетки Лангерганса выявляются в
эпидермисе всех млекопитающих, включая человека. Кроме эпидермиса, они
встречаются в многослойных эпителиях эктодермального происхождения: полости
рта, пищевода, роговицы и конъюнктивы глаза, влагалища и шейки матки. Эти
клетки обнаружены также в лимфоузлах, селезенке, мозговом веществе тимуса.
В многорядном реснитчатом эпителии воздухоносных путей эти клетки в норме
отсутствуют, однако при метаплазии его в многослойный эпителий (например, у
курильщиков) появляются там. Подобная же ситуация наблюдается и при метаплазии
переходного эпителия мочевого пузыря в многослойный плоский неороговевающий.В
последнее время доказано наличие клеток Лангерганса в многорядном эпителии
воздухоносных путей в условиях нормы.При обычной световой микроскопии клетки
Лангерганса трудно различимы. Электронно-микроскопически в них выявляются
характерные цитоплазматические структуры, которые формируют перепончатые диски,
часто с внутренней периодичностью и маленькой перепончатой везикулой на
поверхности (гранулы Birbeck). Эти гранулы клеток Лангерганса напоминают
теннисные ракетки, когда срез исследуется в двумерном плане. Подобно
меланоцитам, клетки Лангерганса обладают положительной иммуногистохимической
реакцией на наличие протеина S-100. В замороженных срезах или в ткани,
сохраненной в растворе Митчела, на их поверхности при иммуногистохимической
реакции экспрессируется GDI-антиген. Было показано, что этот гликопротеин
является высокоспецифичным маркером для клеток Лангерганса и их пролиферирующих
форм, клеток гистиоцитоза X.
Элективными методами выявления клеток Лангерганса являются методы с
солями тяжелых металлов (хлориды золота и серебра), солями кобальта, ртути,
никеля, хрома. Эти клетки содержат такие ферменты, как маннозидаза, АТФаза,
гистохимическое исследование которых широко (особенно АТФазы) также
используется для их визуализации. Наиболее точными являются методы
иммуногистохимической идентификации клеток Лангерганса, связанные с выявлением
специфических антигенов на поверхности клеток при помощи флуоресцирующих
моноклональных антител. Такими антигенами у мышей являются la-антигены, а у
человека - HLA-Dr и Т6. Надежным способом идентификации внутриэпидермальных
макрофагов является электронная микроскопия благодаря характерной их
ультраструктуре. Количество клеток Лангерганса в эпидермисе, по данным разных
авторов, сильно колеблется от нескольких десятков (30-40) до 1500 на 1 мм2
площади поверхности кожи. Такие различия могут быть связаны с различными
методами выявления, возрастом животных или человека, областью исследования и т.
д. Известно, что в толстом эпидермисе ладоней и подошв человека количество
клеток Лангерганса в 2 раза меньше их числа в коже туловища и конечностей. По
данным Мяделыда О.Д. (1985); Полчаниновой В.В.(1996), содержание клеток
Лангерганса в коже спины половозрелых крыс составляет 1220 клеток/мм2,
а в коже спины и живота человека - соответственно 330 и 340 клеток/мм2.В
зависимости от возраста число клеток Лангерганса сильно варьирует.
Так, у новорожденных животных они не выявлялись, а появлялись в
эпидермисе впервые у 3-суточных крысят (10 кл/мм2). Затем в течение первого
месяца жизни их число постепенно возрастало и достигало 1000-1100 кл/мм2,
что было характерно и для половозрелых животных. У старых животных число клеток
уменьшалось почти в 3 раза по сравнению с уровнем половозрелых крыс. Нами
отмечено также снижение числа клеток Лангерганса и у пожилых людей. Имеются
половые различия в числе клеток Лангерганса у человека и животных, причем в
коже самцов их численность обычно меньше. Количество клеток Лангерганса может
существенно изменяться под действием различных факторов внешней среды и
факторов, используемых в физиотерапии. Ультрафиолетовое облучение вызывает
стойкое снижение численности этих клеток. Таким же эффектом обладает лазерное
облучение.
Работами Мядельца О.Д. показано существенное снижение содержания клеток
Лангерганса при действии на организм общего глубокого охлаждения. При этом,
наряду со снижением содержания клеток, существенно изменялась форма оставшихся
в эпидермисе клеток: они теряли характерную отростчатость, уменьшались в
размерах, активность АТФазы в клетках снижалась. Эти реактивные изменения
зависели от возраста животных и продолжительности холодового воздействия.Как
отмечалось, клетки Лангерганса являются внутриэпидермальными макрофагами.Однако
они, наряду со сходством (наличие активности неспецифической эстеразы и кислой
фосфатазы; наличие на рецепторов к Fc-фрагменту IgG и СЗ-компоненту комлемента;
способность к активной миграции; способность к секреции интерлейкина-1;
способность к фагоцитозу; экспрессия антигенов гистосовместимости класса
II;способность презентировать антиген и стимулировать лимфоциты), имеют и
существенные отличия от типичных макрофагов. Эти отличия следующие. Клетки
Лангерганса обладают меньшей фагоцитарной активностью и способностью прилипать
к стеклянным поверхностям, чем типичные макрофаги. Они не могут поглощать целые
клетки или их фрагменты, а фагоцитируют лишь растворимые и мелкозернистые
вещества. У них отсутствует активность типичных для макрофагов ферментов, таких
как глюкуронидаза, пероксидаза, 5-нуклеотидаза, лизоцим, а-1-антитрипсин и
а-1-антихимотрипсин.
Клетки Лангерганса несут на своей поверхности отличающийся от макрофагов
антигенный набор. Они в 50 раз сильнее экспрессируют на своей поверхности
HLA-DR-антиген, чем моноциты крови. В дополнение к классическим антигенам
макрофагов они несут некоторые маркеры Т-лимфоцитов (Т6 и Т4).У них выявляется
белок S-100, характерный для нервной ткани и обычно отсутствующий у макрофагов.
Имеются и ультраструктурные отличия клеток Лангерганса от макрофагов: меньшее
содержание лизосом, отсутствие фаголизосом и наличие гранул Бирбека. Все эти
различия до сих пор вызывают споры в отношении природы клеток Лангерганса.
Однако все возрастающее количество фактов подтверждает моноцитарную природу
клеток и заставляет противников этой точки зрения превращаться в ее адептов.
Как отмечалось, выявлены промежуточные клетки, имеющие свойства и типичных
макрофагов, и клеток Лангерганса. Было показано, что некоторые макрофаги также
несут белок S-100, который, таким образом, не является абсолютным маркером
нервной ткани.
В эпидермисе клетки Лангерганса располагаются в базальном слое или
супрабазально. При выявлении АТФазным методом они окрашиваются в черный или
коричневый цвет. Иногда можно видеть, что ядро клеток не окрашивается или
окрашивается слабее, чем перикарионы и отростки.Эти отростки могут уходить в
дерму и заканчиваться там либо слепо, либо контактировать с гемокапиллярами.
Эта связь отростков клеток Лангерганса с гемокапиллярным руслом может являться
либо проявлением миграционного процесса, либо отражением какой-то эндокринной
функции клеток.
Вопросы происхождения гранул клеток Лангерганса, их функций и содержимого
до конца не разрешены. Ряд исследователей полагают, что они формируются в
комплексе Гольджи и отражают процесс секреции.По другим предположениям гранулы
формируются в результате пиноцитоза/ фагоцитоза. Авторы этой гипотезы
рассматривают гранулы Бирбека как транспортные органеллы, несущие антигены к
месту внутриклеточной переработки или разрушения.
Роль
в инициации иммунитета. Особое место в формировании иммунного ответа принадлежит
клеткам Лангерганса <#"520238.files/image003.gif">
|
Антигенраспознающий
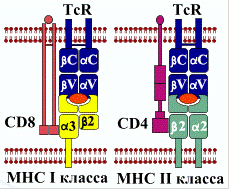
Т-клеточный рецептор Т-лиифоцитов (TcR - англ. Т-се11 Receptor) имеет две
формы - αβ
и γδ, которые соединены в мембране клетки с комплексом
CD3. Димеры αβ
и γδ также как молекулы иммуноглобулина, имеют V- и
С-домены. TcR совместно с корецепторами CD8 или CD4 распознает комплекс
пептид-антиген + МНС первого (I) или второго (II) класса.
|
|
Антигенпрезентирующая, или антигенпредставляющая, клетка (АПК)
захватывает антиген путем эндоцитоза и расщепляет его до пептидных фрагментов,
которые связываются внутри клетки с молекулами МНС I или II класса и
выставляются на поверхность клетки. Профессиональными АПК для лимфоцитов
являются дендритные клетки (DC), В-лимфоциты, макрофаги. Роль АПК могут также
выполнять эндотелиальные клетки, фибробласты, кератиноциты и некоторые другие
клетки, способные при активации экспрессировать МНС и цитокины.
дентдритный клетка лангерганс иммунитет
Разновидности антигенпрезентирующих клеток
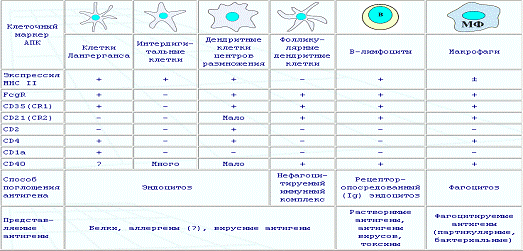
Т-лимфоциты (тимусзависимые лимфоциты) дифференцируются в тимусе -
лимфоциты Тαβ. Другие - лимфоциты Тγδ возможно дифференцируются в
слизистых оболочках ЖКТ. Имеют антигенраспознающий рецептор - TcR (T-клеточный
рецептор), состоящий из двух форм - αβ или γδ. Антигенраспознающий рецептор - TcR
распознает антигенный пептид, связанный с МНС антигенпрезентирующих клеток
(АПК). В результате, при действии костимулирующих факторов, клетки
дифференцируются в Т-хелперы или цитотоксические Т-лимфоциты.
|
Цитотоксические Т-лимфоциты
(ЦТЛ, CTL, или Т-киллеры) имеют - Т-клеточный рецептор (TcR) и корецептор
CDS, которые участвуют в распознавании комплекса антигенный пептид + МНС I
класса. Активированные, дифференцированные цитотокеические Т-лимфоциты
<#"520238.files/image006.gif">
|
|
NК-клетки (normal killers, или natural killers - нормальные киллеры) в
кооперации с цитокинами оказывают неспецифическую цитотоксичность против
инфицированных вирусом клеток, стареющих и опухолевых клеток. NK-клетки убивают
клетки-мишени на основе лектинового распознавания или антителозависимои
клеточной цитотоксичности.
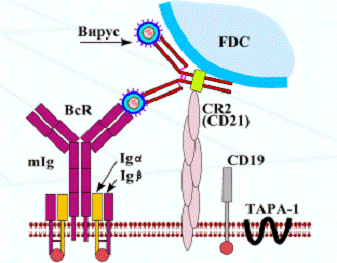
В-лимфоциты
дифференцируются в костном мозге (или в бурсе - фабрициевой сумке, находящейся
в клоаке птиц). Выполняют роль антигенпрезентирующей клетки (АПК) и, после
преобразований (в результате связывания антигена) В-лимфоциты
<#"520238.files/image007.gif">
|

Презентация
антигена T-клеткам <http://medbiol.ru/medbiol/immunology/0007c621.htm> -
это придание проникшему антигену иммуностимулирующих свойств вследствие
образования комплексов этого антигена с молекулами MHC
<http://medbiol.ru/medbiol/immunology/imm-gal/0007256e.htm>. Презентации
антигена часто предшествует его процессинг
<http://medbiol.ru/medbiol/immunology/imm-gal/000e8527.htm>.
Проникшие
в организм антигены подвергаются внутриклеточному расщеплению, в результате
которого образовавшиеся пептиды связываются с молекулами MHC класса I или II в
полости этих молекул. Рецепторы T-клеток (ТКР)
<http://medbiol.ru/medbiol/immunology/imm-gal/0004497c.htm> распознают
аминокислотные последовательности этих фрагментов (в отличие от этого антитела
распознают конформационные детерминанты).Презентировать антигены могут самые
разнообразные антигенпрезентирующие клетки (АПК)
<http://medbiol.ru/medbiol/immunology/imm-gal/0003fe0c.htm> в зависимости
от того, где и как происходит первичное взаимодействие антигена с иммунной
системой.Т-клеточный ответ примируется
<http://medbiol.ru/medbiol/immunology/imm-gal/000e65ab.htm> тремя типами
антигенпрезентирующих клеток (АПК)
<http://medbiol.ru/medbiol/immunology/imm-gal/0003fe0c.htm>,каждый из
которых адаптирован к обработке определенного класса антигенов
<http://medbiol.ru/medbiol/immunology/imm-gal/00045fb3.htm> :
· -
макрофагами <http://medbiol.ru/medbiol/immunology/imm-gal/000bd465.htm>,
захватывающими и перерабатывающими до иммуногенной формы в основном бактерии и
другие корпускулярные антигены;
· -
дендритными клетками
<http://medbiol.ru/medbiol/immunology/imm-gal/00078368.htm>, которые
поглощают самые разнообразные вирусные частицы, и
· - В-клетками
<http://medbiol.ru/medbiol/immunology/imm-gal/000099be.htm>, активность
которых направлена на белковые антигены, включая бактериальные токсины.
При
этом, чтобы наивная T-клетка
<http://medbiol.ru/medbiol/immunology/imm-gal/000cd0eb.htm> вышла в
процесс своего развития до форм зрелых эффекторов, необходимы два сигнала от
клеточной поверхности к геному.Связывание антигенраспознающего T-клеточного
рецептора <http://medbiol.ru/medbiol/immunology/imm-gal/0004497c.htm> с
комплексом антигенный пептид:молекулы I или II класса МНС <http://medbiol.ru/medbiol/immunology/imm-gal/0007256e.htm>
и включение в комплексообразование корецепторов CD8
<http://medbiol.ru/medbiol/immunology/imm-gal/00017890.htm> или CD4
<http://medbiol.ru/medbiol/immunology/imm-gal/0000f0f1.htm> обеспечивает
формирование первого сигнала к пролиферации и дифференцировке T-клеток
<http://medbiol.ru/medbiol/immunology/imm-gal/000decba.htm>.Для
полноценного развития специфического ответа необходим второй сигнал
<http://medbiol.ru/medbiol/immunology/imm-gal/000decba.htm> от клеточной
поверхности к геному.Костимулятором в данном случае выступает молекула В7
<http://medbiol.ru/medbiol/immunology/imm-gal/0015513b.htm>,
экспрессирующаяся на поверхности антигенпрезентирующей клетки
<http://medbiol.ru/medbiol/immunology/imm-gal/0003fe0c.htm>.Рецептором
для В7 на поверхности наивной Т-клетки является белок CD28
<http://medbiol.ru/medbiol/immunology/imm-gal/0000ef6c.htm>.
Взаимодействие CD28:В7 обеспечивает формирование второго сигнала.Помимо CD28
активированные наивные Т-клетки синтезируют и экспрессируют еще один белок с
костимулирующей активностью - СTLA-4
<http://medbiol.ru/medbiol/immunology/imm-gal/00011aac.htm>, обладающей
большей афинностью <file:///d:\inetpub\humbio\immunology\00063de9.htm> в
сравнении с В7.Совместное костимулирующее действие этих молекул оказывает
больший эффект на развитие Т-клеток.Наиболее эффективно начальную активацию
покоящихся CD4 T-клеток
<http://medbiol.ru/medbiol/immunology/imm-gal/0015b9d3.htm> обеспечивают
дендритные клетки <http://medbiol.ru/medbiol/immunology/imm-gal/00078368.htm>,
для которых характерен высокий уровень экспрессии молекул MHC класса II.Однако
макрофаги <http://medbiol.ru/medbiol/immunology/imm-gal/000bd465.htm> и
B-клетки <http://medbiol.ru/medbiol/immunology/imm-gal/000099be.htm> также
могут экспрессировать молекулы MHC класса II.В случае очень низкой концентрации
антигена B-клетки с высокоаффинными антигенными рецепторами ( IgM
<http://medbiol.ru/medbiol/immunology/imm-gal/0008d2d8.htm> или IgD
<http://medbiol.ru/medbiol/immunology/imm-gal/0008bc24.htm> ) становятся
основными АПК, поскольку другие типы клеток не могут захватить достаточного
количества антигенного материала.При вторичном иммунном ответе (протекающем с
участием большого количества антигенспецифичных B-клеток).B-клетки также могут
играть основную роль в презентации антигена. В презентации антигена помимо
комплекса ТКР с антигенным пептидом, находящегося в полости молекулы MHC,
участвует множество костимулирующих молекул клеточной поверхности: ICAM-1
<http://medbiol.ru/medbiol/immunology/imm-gal/000c9eb1.htm>, B7-1 (CD80)
<http://medbiol.ru/medbiol/immunology/imm-gal/0000baae.htm>, B7-2 (CD86)
<http://medbiol.ru/medbiol/immunology/imm-gal/0000baae.htm>, CD2
<http://medbiol.ru/medbiol/immunology/imm-gal/0000ecc7.htm>. Наиболее
эфективны из них B7-1 (CD80) и B7-2 (CD86).
MHC антигены
Антигены
главного комплекса гистосовместимости (MHC) - это группа поверхностных белков
различных клеток организма, играющих ключевую роль в опосредованных клетками
иммунных реакциях. Антигены MHC кодируются комплексом генов, обозначаемым HLA
<http://humbio.ru/humbio/immunology/imm-gal/00010478.htm> у человека и
H-2 <http://humbio.ru/humbio/immunology/00012ed3.htm> у мыши.
Первоначально молекулы MHC ( антигены MHC ) идентифицировали по их способности
вызывать сильные трансплантационные реакции. Выяснилось, что у каждого вида
позвоночных существует одна группа тесно сцепленных генетических локусов,
имеющая решающее значение при трансплантации ткани от одной особи другой особи
внутри одного и того же вида ( аллотрансплантация
<http://humbio.ru/humbio/immunology/0001260a.htm> ).Поверхностные
рецепторы T-лимфоцитов
<http://humbio.ru/humbio/immunology/imm-gal/0004497c.htm> узнают антиген
<http://humbio.ru/humbio/immunology/imm-gal/00045fb3.htm> лишь в том
случае, если он находится на поверхности клетки в комплексе с антигенами MHC,
этот процесс носит название " представление антигена
<http://humbio.ru/humbio/immunology/imm-gal/000e5c44.htm> ".
Аналогичную роль молекулы MHC выполняют и в B-клеточном ответе. Таким образом,
помимо того, что эта группа сцепленных генетических локусов (MHC) контролирует
иммунный ответ на аллотрансплантаты, данная группа локусов играет важнейшую
роль в контроле клеточных взаимодействий, лежащих в основе физиологических
иммунных реакций: молекулы, кодируемые MHC, связываются с пептидными
антигенами, вследствие чего эти антигены узнаются специфичными рецепторами T- и
B-лимфоцитов.
Отдельный
кластер генов MHC обозначается как " гаплотип
<http://humbio.ru/humbio/allerg/000d01e8.htm> " и обычно наследуется
весь целиком как отдельный менделевский признак; гены, входящие в его состав,
выявляются при кроссинговере.Благодаря работам Р.Цинкернагеля и П.Доэрти и
многим десяткам последующих исследователей стало известно, что именно антигены MHC
обеспечивают взаимодействие иммунокомпетентных клеток, участвующих в развитии
иммуного ответа.Обнаружено две группы антигенов MHC (антигенов MHC класса I
<http://humbio.ru/humbio/immunology/imm-gal/0001813d.htm> и антигенов MHC
класса II <http://humbio.ru/humbio/immunology/imm-gal/00018b5c.htm> ),
участвующих в регуляции иммунного ответа. Эти группы антигенов по-разному
экспрессируются на клетках организма и, хотя они выполняют однотипную функцию,
между ними имеется "распределение обязанностей". Антигены MHC класса
I <http://humbio.ru/humbio/immunology/imm-gal/0001813d.htm> представляют
собой антигены, синтезируемые самой клеткой (вирусные, опухолевые, собственные
мутированные), в то время как антигены MHC класса II
<http://humbio.ru/humbio/immunology/imm-gal/00018b5c.htm> - это
экзогенные (пришедшие извне) антигены. Иммунный ответ против антигенов, которые
представляются антигенпрезентирующими клетками
<http://humbio.ru/humbio/immunology/x008ace8.htm> Т-хелперам
<http://humbio.ru/humbio/immunology/imm-gal/0015b9d3.htm>, в результате
феномена генетической рестрикции
<http://humbio.ru/humbio/immunology/000d0494.htm> развивается только при
наличии у антигенпрезентирующих клеток антигенов гистосовместимости класса II
собственного генотипа.
Цитотоксические
T-лимфоциты <http://humbio.ru/humbio/immunology/imm-gal/0001d726.htm>
(Т-киллеры) распознают клетки-мишени лишь при наличии на их поверхности
антигенов MHC класса I собственного генотипа. В том случае, когда
взаимодействующие в иммунном ответе клетки несут различные аллели MHC, иммунный
ответ развивается не против представляемого чужеродного антигена (например,
вирусного или бактериального), а против отличающихся антигенов MHC. Данный
феномен лежит в основе того, что антигены MHC обеспечивают распознавание в организме
"своего" и "чужого"-белок
Связывание
антигенраспознающего T-клеточного рецептора
<http://medbiol.ru/medbiol/immunology/imm-gal/0004497c.htm> с комплексом
антигенный пептид:молекулы I или II класса МНС
<http://medbiol.ru/medbiol/immunology/imm-gal/0007256e.htm> и включение в
комплексообразование корецепторов CD8
<http://medbiol.ru/medbiol/immunology/imm-gal/00017890.htm> или CD4
<http://medbiol.ru/medbiol/immunology/imm-gal/0000f0f1.htm> обеспечивает
первый сигнал к пролиферации и дифференцировке T-клеток
<http://medbiol.ru/medbiol/immunology/imm-gal/000decba.htm>. Чтобы
специфически подготовленная клетка вышла в процесс дальнейшего развития,
необходим второй сигнал
<http://medbiol.ru/medbiol/immunology/imm-gal/000decba.htm> от клеточной
поверхности к геному. Костимулятором в данном случае выступает молекула В7
<http://medbiol.ru/medbiol/immunology/imm-gal/0015513b.htm>. Молекулы B7
экспрессируются на мембране антигенпрезентирующих клеток
<http://medbiol.ru/medbiol/immunology/imm-gal/0003fe0c.htm>; это
гомодимер из суперсемейства иммуноглобулинов
<http://medbiol.ru/medbiol/immunology/imm-gal/00120cc3.htm>. Рецептором
для В7 на поверхности наивной Т-клетки
<http://medbiol.ru/medbiol/immunology/imm-gal/000cd0eb.htm> является
белок CD28 <http://medbiol.ru/medbiol/immunology/imm-gal/0000ef6c.htm>,
также относящийся к суперсемейству иммуноглобулинов
<http://medbiol.ru/medbiol/immunology/imm-gal/00120cc3.htm>.В процессе
внутриклеточного переваривания корпускулярого антигена макрофагами <http://medbiol.ru/medbiol/immunology/imm-gal/000bd465.htm>
происходит индукция синтеза и экспрессии на клеточной поверхности молекул MHC
класса II и костимулятора В7. Факторами индукции, возможно, являются рецепторы
клеточной поверхности, взаимодействующие с микроорганизмами, поскольку синтез
В7 можно индуцировать простой инкубацией макрофагов с отдельными компонентами (
углеводами <http://medbiol.ru/medbiol/immunology/imm-gal/0012f0f4.htm>,
липополисахаридами <http://medbiol.ru/medbiol/feb2000/no/x00068af.htm> )
бактериальной стенки.B7-1(CD80) и B7-2
<http://medbiol.ru/medbiol/immunology/imm-gal/00013fab.htm>( CD86
<http://medbiol.ru/medbiol/immunology/imm-gal/000103c2.htm> ) являются
наиболее эффективными костимулирующими (из числа известных) молекулами при
презентации <http://medbiol.ru/medbiol/immunology/imm-gal/000e5c44.htm>
антигена <http://medbiol.ru/medbiol/immunology/imm-gal/00045fb3.htm>
T-клеткам <http://medbiol.ru/medbiol/immunology/0007c621.htm>. Они
конститутивно экспрессируются интердигитатными клетками <http://medbiol.ru/medbiol/immunology/imm-gal/00078368.htm>,
но возможна также их стимуляция на моноцитах
<http://medbiol.ru/medbiol/immunology/imm-gal/000cb56f.htm>, B-клетках
<http://medbiol.ru/medbiol/immunology/imm-gal/000099be.htm> и, вероятно, других
антигенпрезентирующих клетках
<http://medbiol.ru/medbiol/immunology/imm-gal/0003fe0c.htm>. Обе молекулы
служат лигандами для CD28
<http://medbiol.ru/medbiol/immunology/imm-gal/0000ef6c.htm> и его
гомолога CTLA-4 <http://medbiol.ru/medbiol/immunology/imm-gal/00011aac.htm>.гликопротеин,
молекулярная масса которого равна 90 кДа.Гомодимер. Полипептидная цепь состоит
из 54 аминокислот.Член суперсемейства иммуноглобулинов
<http://medbiol.ru/medbiol/immunology/imm-gal/00120da9.htm>. Внеклеточная
часть включает фрагмент, гомологичный V- домену Ig. Экспрессируется на мембране
клетки, как дисульфидносвязанный гомодимер.Экспрессирован на большинстве
Т-лимфоцитов <http://medbiol.ru/medbiol/immunology/0007c621.htm> и на
плазматических клетках <http://medbiol.ru/medbiol/immunology/imm-gal/000e1279.htm>.Активация
Т-клеток <http://medbiol.ru/medbiol/immunology/0006b8e3.htm> приводит к
увеличению его экспрессии. CD28 относится к адгезивным
<http://medbiol.ru/medbiol/har/000233b6.htm> молекулам.Его естественным
лигандом является, в частности, мембранный активационный белок В- лимфоцитов
<http://medbiol.ru/medbiol/immunology/imm-gal/000099be.htm> B7/BB-1
<http://medbiol.ru/medbiol/immunology/imm-gal/0015513b.htm>,также
являющийся адгезивным белком.
. Роль дендритных клеток и клеток Лангенгарса в физиологии и медицине
За последние 10 лет представления о дендритных клетках, их происхождении
и функциях значительно уточнились. Доказано костномозговое происхождение
дендритных клеток.
Возможны два пути дифференцировки: из отдельной клетки-предшественника
дендритной клетки или из общего предшественника миело-моноцитарной серии,
который дифференцируется до стадии моноцита, а моноцит может дифференцироваться
либо в тканевой макрофаг, либо в дендритную клетку.
Возможно, что предшественники дендритных клеток из костного мозга через
кровяное русло заселяют различные нелимфоидные ткани: эпидермис кожи, слизистые
оболочки,интерстициальные ткани сердца, почек и других органов.Заселение
нелимфоидных тканей дендритными клетками стимулирует ростовой фактор -
GM-CSF.Усиленная продукция GM-CSF в легочной ткани при воспалении ведет к
рекрутированию в легочную ткань клеток типа Лангерганса.Самые ранние иммигранты
в очаг бактериального воспаления в легких - это дендритные
клетки-предшественники, экспрессирующие антигены МНС 2 класса. Прибывшие клетки
остаются в связи с эпителиальными и дифференцируются в типичные дендритные
клетки.
Дендритные клетки рекрутируются в эпителий дыхательных путей в ответ на
аэрозольное введение бактериального ЛПС.
В эпителии воздухоносных путей (в частности, трахеи и бронхов) человека
обнаружена сеть дендритных клеток, экспрессирующих антигены МНС 2 класса и
сходных с клетками Лангерганса. Этот пул дендритных клеток постоянно истощается
миграцией зрелых клеток в дренирующие лимфоузлы и постоянно обновляется за счет
притока предшественников из костного мозга. Быстрый круговорот дендритных
клеток слизистых отражает их адаптацию к постоянной экспозиции попадающих с
вдыхаемым воздухом чужеродных антигенов, которые необходимо презентировать распознающим
Т-лимфоцитам в регионарных лимфоузлах. Популяция дендритных клеток
воздухоносных путей увеличивается под влиянием бактериальных компонентов и
продуктов.
Дендритные клетки при саркоидозе.
Саркоидоз - системная гранулематозная болезнь.
При саркоидозе формируются структуры, состоящие из эпителиоидных клеток,
фибробластов и нескольких типов иммунных клеток.В иммунной системе, дендритные
клетки (DCs) являются специализированными антиген-презентирующими клетками
(APCs).В периферической крови человека было идентифицировано две основных
субпопуляции предшественников DCs: субпопуляция CD11c+ имеет
миелоидное происхождение, в то время как CD11c- плазмацитоидная
субпопуляция, также называемая интерферон альфа /бета продуцирующими клетками,
имеет лимфоидное происхождение. Субпопуляции DCs могут мигрировать к различным
тканям, включая лимфоидную ткань, поэтому они расцениваются как циркулирующий
пул тканевых DCs.Недавнее исследование DCs предположило, что различные
субпопуляции по-разному DCs регулируют T-клеточный ответ. CD11c+
способны к поляризации нативных CD4+ T-клеток к Th1 клеткам,
производящим IFN-g, в ответ на интерлейкин-12, в то время как CD11c-
стимулируют Th2 клетки, производящие IL-4, в ответ на IL-3.Появляются
свидетельства, что DCs играют важную роль в различных состояниях.Двадцать
четыре пациента с саркоидозом (8 мужчин и 16 женщин) которые поступили в
клинику между маем 2000 г. и февралем 2002 г., были привлечены в исследование.
У всех пациентов саркоидоз был диагностирован клинически и гистологически.Во
премя исследования, у четырех пациентов проводилось лечение
кортикостероидами;остальные 20 пациентов не получали кортикостероиды в течение
исследования.
Было выполнено окрашивание эозин-гематоксилином и иммуногистохимическое
окрашивание биоптатов кожи двух пациентов с саркоидозом и лимфатического узла
двух других пациентов.Были получены подобные результаты для всех четырех
пациентов. Гистологическая экспертиза показала паттерн, типичный для саркоидной
гранулемы, эпителиоидное ядро, окруженное слоем лимфоцитов, с большим
количеством CD4+ клеток и меньшим числом CD8+ клеток.
Множество фасцин-положительных (специфический маркер зрелых DCs) мононуклеарных
клеток также было найдено в этом слое, также как LAMP-положительных (другой
специфический маркер DCs) клеток и HLA-DR положительных клеток. Двойное
окрашивание анти-фасцин и анти-HLA-DR антителами показало, что
фасцин-положительные клетки в основном были HLA-DR положительными. Однако,
также были обнаружены HLA-DR положительные и фасцин-отрицательные клетки. С
другой стороны, двойное окрашивание анти-фасцин и анти-CD3 антителами показало,
что многие CD3+ клетки контактировали с фасцин-положительными
мононуклеарными клетками, предполагая, что DCs функционально взаимодействуют с
T-клетками в гранулематозных повреждениях при саркоидозе. Также обнаружили, что
многие клетки в окружении ядра гранулемы производили IFN-g. Существенное число
клеток, производящих IL-4, также были обнаружены не только в окружении, но и
внутри эпителиоидного ядра гранулемы. Двойное окрашивание для IL-4 и CD3
показало существование трех типов клеток: IL-4+ CD3+
клетки, IL-4+ CD3- клетки и IL-4- CD3+
клетки.В последнее время накоплены свидетельства, что при воспалительных
состояниях, подобных инфекциям, в ответ на сигналы опасности в виде цитокинов и
хемокинов, происходит инфильтрация тканей дендритными клетками. Поэтому
выдвинули гипотезу, что при саркоидозе, DCs мигрируют из периферической крови к
гранулематозным повреждениям, где они накапливаются, таким образом уменьшая
число DCs в периферической крови. В поддержку этой гипотезы обнаружили, что у
пациентов с саркоидозом число DCs в периферической крови было значительно
уменьшено. Это уменьшение было результатом существенного уменьшения и миелоидой
субпопуляции CD11c+ и лимфоидной субпопуляции CD11c-.
Гистологически, множество фасцин-положительных и HLA-DR-положительных клеток и
фасцин-положительных и LAMP-положительных клеток было найдено в лимфоцитарном
окружении гранулемы, но не в эпителиоидном ядре. На основании этих результатов
заключили, что множество зрелых DCs проникло только в лимфоцитарное окружение
саркоидной гранулемы.
Уменьшение числа незрелых DCs в крови и накопление зрелых DCs в гранулеме
предлагает, что процесс созревания DCs происходит в течение их движения из
крови к гранулеме, или по достижении гранулемы.
Предыдущие исследования предположили присутствие DCs в саркоидных
гранулематозных повреждениях из-за обнаружения S-100-положительных клеток.
Однако, белок S-100 не является высоко специфическим маркером DCs.
Исследование показало, что DCs проникают в саркоидные гранулемы человека.
DCs играют существенную роль в индукции антиген-специфического T-клеточного
ответа. рамках парадигмы DC1/DC2, DC1 (миелоидые DCs) дифференцируют нативные
T-клетки в Th1 клетки, в то время как DC2 (лимфоидные DCs) дифференцируют
нативные T-клетки в Th2 клетки.
Гистиоцитоз
из клеток Лангерганса.(прежние термины: гистиоцитоз Х, болезнь
Хенда-Шюллера-Крисчена, эозинофильная гранулема, болезнь Таратынова, болезнь
Леттерера-Сиве) - исключительно разнообразное по клиническим проявлениям и
течению заболевание, характеризующееся накоплением и пролиферацией в очагах
поражения клеток с характеристиками эпидермальных гистиоцитов - клеток
Лангерганса. В начале 20 века различные варианты этого заболевания были
охарактеризованы как самостоятельные нозологические. В 1953 г. L. Lichtenstein
объединил ранее описанные варианты под общим названием «Гистиоцитоз Х». В 1973
г. С. Nezelof с соавт. идентифицировал гистиоциты из очагов поражения как
клетки, несущие структурно-функциональные маркеры эпидермальных клеток
Лангерганса. В 1987 г. историческое название “Гистиоцитоз Х” было предложено
заменить термином “Гистиоцитоз из клеток Лангерганса”, так как последний
отражает гистогенетическое происхождение клеток. Классификация.Выделяют
моносистемную и полисистемную формы заболевания. Моносистемное заболевание
может протекать с одним очагом поражения или двумя и более очагами,с нарушением
и без нарушения функции жизненно важных органов.
Этиология и патогенез.
Этиология и патогенез не известны. Обсуждаются иммунопатологическая и
опухолевая природа заболевания. В пользу иммунопатологической природы
свидетельствует высокая частота спонтанных ремиссий, низкая летальность,
отсутствие хромосомных аномалий в клетках из очагов поражения. В пользу
опухолевой природы - клональный характер пролиферации клеток Лангерганса в
очагах поражения. В патогенезе разнообразных клинических и морфологических
проявлений ГКЛ ведущая роль отводится цитокинам, которые продуцируются
Т-лимфоцитами и клетками Лангерганса в очагах поражения.
Диагностика. Основой морфологического диагноза ГКЛ служит выявление в
очагах поражения крупных клеток, диаметром 15-25 мкм с овальным, почковидным
или изрезанным ядром с нежным, равномерно распределенным хроматином и 1-2
обычно маленькими ядрышками. Диагноз ГКЛ считается доказанным при идентификации
на этих клетках специфического маркера клеток Лангерганса - поверхностного CD1a
антигена или выявлении при электронномикроскопическом исследовании уникальных
цитоплазматических органелл - гранул Бирбека.Если диагностика основывается
только на морфологических критериях, диагноз рассматривается как
вероятный.Помимо клеток Лангерганса в очагах поражения присутствует различное
количество эозинофилов, нейтрофилов, лимфоцитов, фагоцитирующих макрофагов, а
также гигантские многоядерные клетки, очаги некроза и фиброз.
Гистологическая картина тесно связана со стадией эволюции патологического
процесса. На ранних стадиях в очагах поражений накапливается большое количество
клеток Лангерганса, характерно формирование гранулем.
Лечение При одиночных очагах поражения рекомендуется,инфильтрация очагов
кортикостероидами (метилпреднизолон) или локальное облучение в низких дозах 5-6
Гр в случаях болевого синдрома, при угрозе нарушения функции жизненно важного
органа.
Прививка против рака. В последее время прививка против рака приобретает
все большее значение.Исследования университетских клиник в Германии и успехи в
лечении на практике показывают, что многим раковым пациента удалось
восстановить здоровье.Несмотря на злокачественность раковых клеток, они мало
отличаются от нормальных клеток и защитная система организма не распознает их
как чужеродные или опасные.Благодаря прививке собственными раковыми клетками в
систему защиты поступает информация: «Так выглядит раковая клетка, нападайте на
неё!».
Похожее происходит при прививках против вирусных заболеваний, когда
иммунная система человека «ознакомлена» с возбудителем и может усилить защитную
реакцию.Прививка проводится раковыми клетками самого больного организма. Они
изготавливаются из материала, который извлечен при операции или путем взятия у
пациента его ракового материала. Есть два основных способа применнеия:активная
специфическая иммунотерапия и прививка дендритными клетками.Для прививки
дендритными клетками достаточно всего несколько раковых клеток пациента так же
из первичной опухоли в первой операции. Для прививочного материала дендритные
клетки обогащаются антигенами. Когда материал введен в организим пациента
дендритные клетки находят быстро путь в лимфатические узлы и к находящимся в
крови иммуннологическим защитным клеткам.Во время производства дендритных
клеток используются цитокины.Цитокины, как и интерферон, усиливают защитную
реакцию, и таким образом дендритные клетки надёжно разрушают опухоль.
Дендритные
клетки в борьбе с вирусной инфекцией
<http://www.viferon.su/dendritnye-kletki-mogut-pomoch-v-borbe-s-virusnoj-infekciej/>.
Доктор медицины Кеннет Мерфи с коллегами из Вашингтонского университета в
Сент-Луисе провел исследование, в ходе которого были установлены новые механизмы
защиты от вирусных заболеваний.Эксперты обнаружили новые свойства дендритных
клеток, известных как CD8 альфа (CD8a + DC). CD8a составляют около
10% всех дендритных клеток в организме. Изучая основные функции этих клеток,
ученые закладывают основу для их использования против вирусных и бактериальных
инфекций. Ранее было выяснено, как эти клетки можно использовать против
листериоза и токсоплазмоза.Оказалось, что в отношении вирусов они могут
действовать таким же образом, в частности способствуют их уничтожению. Вирусы
часто пытаются замаскировать себя, чтобы уклониться от иммунных клеток, но CD8a
могут извлекать характерные части вирусов и отображать их на поверхности
возбудителя. Таким образом макрофаги, естественные киллеры и другие элементы
иммунной системы находят вирусы, распознают и уничтожают их.
Причем
данные клетки способствуют антителам поиску уже созданных вирусом копий. CD8a
испускает сигнал, который стимулирует образование иммунных клеток и привлекает
их в зону активности вирусов.Кроме того, выяснилось, что эти дендритные клетки
могут пригодиться в профилактике некоторых раковых заболеваний, в том числе в
создании противоопухолевых вакцин.
Роль
дендритных клеток в функциях сосудов и сердечных клапанов.В 1973 году Ральф М.
Штайнман (Ralph M. Steinman) заложил основы нового направления в иммунологии,
опубликовав свою работу об открытии дендритных клеток.Теперь стало понятно, что
они также необходимы для нормального функционирования сосудов и сердечных
клапанов.
Предыдущие
исследования косвенно указывали на то, что дендритные клетки в большом
количестве присутствуют в артериях как мышей, так и человека. Однако сегодня
это предположение получило доказательства благодаря работе исследователей из
Лаборатории Клеточной Физиологии и Иммунологии в Университете Рокфеллера- по
крайней мере, это было показано на мышах. Ученые определили точное расположение
дендритных клеток в сосудах - те находятся непосредственно под слоем эндотелия,
покрывающего внутреннюю поверхность аорты, а их отростки выступают прямо в
кровоток, захватывая оттуда чужеродные частицы.
Такое
расположение дендритных клеток было ранее показано для внутренней выстилки
кишечника и воздухоносных путей, но никогда - для крупных артерий.В своих
экспериментах ученые использовали генетически модифицированных мышей. Основной
маркер дендритных клеток - молекула СD11с, был связан у этих мышей с
флуоресцентным белком.Обнаружив в аорте мышей дендритные клетки, исследователи
выделили эти клетки и уже в экспериментах in vitro показали, что клетки эти так
же высоко эффективны в стимуляции Т-лимфоцитов и NK-клеток в ответ на
чужеродные белки, как и дендритные клетки, выделенные из таких органов иммунной
системы, как селезенка.При этом все равно оставался вопрос, насколько
эффективно обнаруженные дендритные клетки выполняют свои функции в интактном
сердце.Чтобы выяснить это, мышам был инъецирован в кровоток модельный
чужеродный белок.Спустя 20 часов из клапанов сердца и аорты были выделены
дендритные клетки и помещены в культуру.Оказалось, что эти клетки эффективно
стимулируют активацию Т-лимфоцитов, ответственных за уничтожение патогенов, а,
значит, они захватили и распознали инъецированный белок как нечто чужеродное.
Дендритные клетки и инсулин. Группа исследователей из Медицинского центра
Питтсбургского университета успешно испытала на животных новый метод.
Методика, разработанная Массимо Трукко и Ником Гианнукакисом, основана на
модификации дендритных клеток иммунной системы организма больного.При
определенных условиях дендритные клетки могут заставить Т-лимфоциты
воспринимать бета-клетки поджелудочной железы, производящие инсулин как
чужеродные субстанции и уничтожать их.Этот патологический аутоиммунный процесс
является причиной диабета первого типа.По новой методике, выделенные из крови
больного дендритные клетки подвергают обработке специальными веществами,
блокирующими их взаимодействие с Т-лимфоцитами.
Затем модифицированные дендритные клетки вводят в лимфатические узлы,
расположенные в районе поджелудочной железы.Встречаясь с Т-лимфоцитами, они
"перепрограммиру ют" их, предотвращая таким образом уничтожение
бета-клеток, производящих инсулин. По словам доктора Трукко, в ходе
эксперимента инъекции модифицированных дендритных клеток привели к регенерации
бета-клеток поджелудочной железы и возобновлению выработки собственного
инсулина в организме лабораторных мышей.
Дендритные
клетки на защите мозга. Головной мозг окружен целым рядом защитных оболочек.
Доступ к нему затруднен как для повреждающих факторов, так и для защитных
клеток иммунной системы, и долгое время считалось, что в норме он находится вне
зоны действия иммунной системы.Однако исследование ученых из Университета
Рокфеллера показало, что мозг может обладать собственной специализированной
иммунной защитой. В 2008 г. эти исследователи установили, что в мозге
присутствует собственная популяция так называемых дендритных клеток. Клетки
такого типа участвуют в развитии иммунных реакций в других частях тела, проводя
предварительную переработку вредных веществ (антигенов) и передавая их
Т-лимфоцитам, которые затем размножаются и атакуют антигены. В новом
исследовании, результаты которого были опубликованы в журналах Proceedings of
the National Academy of Sciences и Brain Behavior and Immunity, исследователи
Университета Рокфеллера доказали, что дендритные клетки мозга также способны
участвовать в иммунных реакциях. Исследователи, возглавляемые выпускником
Университета Рокфеллера Андресом Готфрид-Блэкмором (Andres
Gottfried-Blackmore), который в настоящее время учится в медицинском колледже
Weill Cornell, ввели в мозг мыши гамма-интерферон - вещество, вырабатывающееся
при развитии воспалительных процессов.Это привело к увеличению числа мозговых
дендритных клеток, но не за счет дендритных клеток, находящихся вне
мозга.Далее, исследователи ввели дендритные клетки мозга в контакт с модельным
антигеном, и это привело к размножению Т-лимфоцитов, специфических к этому
антигену.Наконец, дендритные клетки мозга оказались значительно более
эффективными стимуляторами Т-лимфоцитов, чем широко распространенные в мозге микроглиальные
клетки, возможное участие которых в иммунных реакциях уже было показано
раньше.Таким образом, была показана способность дендритных клеток активно
участвовать в защите мозга.
Заключение
Дендритные
клетки были впервые описаны Полом Лангергансом (клетки Лангерганса) в конце
девятнадцатого века.Дендритные клетки, которые также называют «древовидными», -
один из видов иммунокомпетентных клеток крови, ответственных за нормальную
работу защитных систем организма. Незрелые дендритные клетки называются также
вуалевыми клетками. Дендритные клетки находятся в крови и различных органах,
преимущественно лимфоидных.Этот тип антигенпрезентирующих клеток
<http://humbio.ru/humbio/immunology/imm-gal/0003fe0c.htm> обладает
выраженной и, что очень важно, постоянной экспрессией костимулятора В7
<http://humbio.ru/humbio/immunology/imm-gal/0015513b.htm>, молекул I и II
классов МНС <http://humbio.ru/humbio/immunology/imm-gal/0007256e.htm>, а
также адгезинов <http://humbio.ru/humbio/immunology/imm-gal/00030c61.htm>
ICAM-1 <http://humbio.ru/humbio/immunology/imm-gal/000c9eb1.htm>, ICAM-3
<http://humbio.ru/humbio/immunology/imm-gal/0001e93c.htm>, LFA-3
<http://humbio.ru/humbio/immunology/000e1065.htm>.Эти клетки осуществляют
поиск, захват и первичное разрушение патогенных организмов. Фрагменты
разрушенных патогенов, захваченные отростками («дендритами») этих клеток,
активируют так называемые Т-клетки, которые и «добивают» патогены, останавливая
развитие патологии. Кроме того, дендритные клетки препятствуют развитию таких
аутоиммунных заболеваний, как диабет типа 1. Эти заболевания возникают из-за
ошибочной реакции иммунной системы, атакующей собственные белки. Поскольку
дендритные клетки играют главную роль в развитии многих защитных реакций
организма, можно будет создавать на их основе новые средства иммунной терапии.
Индукторами созревания дендритных клеток являются продукты жизнедеятельности
бактерий - ЛПС, РНК и ДНК вирусов Дендритные клетки развиваются из стволовых
клеток костного мозга, что было выяснено еще в 1975 году. На основании
результатов недавнего исследования ученые выявили, какие именно типы
предшественников дают начало все новым и новым поколениям дендритных клеток.
Кроме того, выяснилось, что эти клетки более специализированы, чем считалось
ранее, - вся их совокупность эффективно организована в специальные «отряды»,
каждый из которых отвечает за борьбу со специфическим патогенным фактором. За
последние 10 лет наши представления о дендритных клетках, их происхождении и
функциях значительно уточнились.
Например,
гистиоцитоз из клеток Лангерганса- заболевание, характеризующееся накоплением
и/или пролиферацией в очагах поражения клеток с характеристиками эпидермальных
гистиоцитов - клеток Лангерганса. Число клеток Лангенгарса в эпидермисе с
возрастом снижается. Эксперты обнаружили новые свойства дендритных клеток,
известных как CD8 альфа (CD8a + DC). CD8a составляют около 10% всех дендритных
клеток в организме. Изучая основные функции этих клеток, ученые закладывают
основу для их использования против вирусных и бактериальных инфекций.
Они
также необходимы для нормального функционирования сосудов и сердечных клапанов.
В 2008 г. эти исследователи установили, что в мозге присутствует собственная
популяция так называемых дендритных клеток. Клетки такого типа участвуют в
развитии иммунных реакций в других частях тела, проводя предварительную
переработку вредных веществ (антигенов) и передавая их Т-лимфоцитам, которые
затем размножаются и атакуют антигены.
Итак,
дендритные клетки играют основную роль в формировании и клеточного, и
гуморального антивирусного иммунитета.
Список литературы
1. <http://ru.wikipedia.org/wiki/%D0%94%D0%B5%D0%BD%D0%B4%D1%80%D0%B8%D1%82%D0%BD%D1%8B%D0%B5_%D0%BA%D0%BB%D0%B5%D1%82%D0%BA%D0%B8>
2. <http://humbio.ru/humbio/immunology/imm-gal/00078368.htm>
3. <http://www.biochemmack.ru/product/citometry/reagent/dendrit/>
4. <http://medbiol.ru/medbiol/immunology/imm-gal/00047838.htm>
5. <http://meduniver.com/Medical/pulmonologia/99.html>
6. <http://www.cnews.ru/news/line/index.shtml?2006/05/12/201091>
7. <http://www.touti.ru/index.php?option=com_content&task=view&id=97&Itemid=99999999>
8. <http://allimmunology.org/immunologicheskij-slovar/k/kletki-dendritnye>
9. <http://sarcoidosis.chat.ru/may/dcs.htm>
10. <http://medbiol.ru/medbiol/immunology/imm-gal/0004f32e.htm>
11. <http://www.news-medical.net/health/Types-of-Dendritic-Cells-%28Russian%29.aspx>
12. <http://www.nsau.edu.ru/images/vetfac/images/ebooks/microbiology/stu/immun/prez_ag.htm>
13. <http://www.viferon.su/dendritnye-kletki-mogut-pomoch-v-borbe-s-virusnoj-infekciej/>
14. <http://www.rusmedserv.com/v-block-medserv/b1.htm>
15. <http://www.cbio.ru/modules/news/print.php?storyid=3331>
16. <http://www.eurolab.ua/microbiology-virology-immunology/3662/3675/31024/>
17. <http://www.medinfo.ru/mednews/9473.html>
18. <http://neurooncologia.ru/content/dendritnaya-vaktsina>
19. <http://trv-science.ru/2010/02/02/dendritnye-kletki-na-zashhite-mozga/>
20. <http://meduniver.com/Medical/Dermat/17.html>
21. <http://www.granulema.ru/histiocytosis-langerhans/>
22. <http://medkarta.com/?cat=article&id=26500>
23. <http://medstrana.com/news/3201/>
24. <http://humbio.ru/humbio/immunology/imm-gal/0003fe0c.htm>
25. <http://www.vrach.uz/354-med.html>
26. <http://medicalplanet.su/dermatology/18.html>
27. <http://medbiol.ru/medbiol/immunology/imm-gal/0000ef6c.htm>
28. <http://humbio.ru/humbio/immunology/imm-gal/0015513b.htm>
29. <http://medbiol.ru/medbiol/immunology/imm-gal/000aabfa.htm>
30. <http://meduniver.com/Medical/Microbiology/929.html>