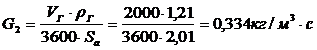Адсорбционная очистка газов
Адсорбционная очистка газов
Метод основан на способности некоторых твердых
тел избирательно поглощать газообразные компоненты из газовых смесей.
Присутствующие в газовой смеси молекулы загрязненного газа или пара собираются
на поверхности или в порах твердого материала. Поглощаемое из газовой фазы
вещество - называется адсорбтивом, а твердое вещество, на поверхности
или порах которого происходит адсорбция поглощаемого вещества - адсорбентом.
Газовая фаза, в которой находится извлекаемый компонент - газ - носитель, а
после того, как извлеченный компонент перешел в адсорбированное состояние, его
называют адсорбатом.
Применяют в этом случае:
1) когда другие методы оказываются
неэффективны;
2) концентрация загрязняющих веществ очень
мала и требуется гарантированная рекуперация извлекаемой примеси из-за ее
значительной стоимости или опасности. Методом адсорбции из отходящих газов
удаляют SO2
,углеводороды,
хлор, сероводород, сероуглерод, и другие.
Явление адсорбции обусловлено наличием сил
притяжения между молекулами адсорбента и адсорбтива на границе раздела
соприкасающихся фаз. Переход молекул загрязняющих веществ из газа - носителя на
поверхностный слой адсорбента происходит в том случае, если силы притяжения
адсорбента больше сил притяжения действующих на адсорбтив со стороны молекул
газа - носителя. Молекулы адсорбированного вещества, переходя на поверхность
адсорбента, уменьшают его энергию, в результате чего происходит выделение
теплоты, примерно 60 кДж/моль (небольшая). Силы притяжения имеют разную - физическую
или химическую и, следовательно, различают:
Физическую адсорбцию - при которой
взаимодействия молекул загрязняющих веществ с поверхностью адсорбента
определяется слабыми дисперсными, индукционными силами (силы Ван - дер -
Вальса). При этом адсорбированные молекулы не вступают в химическое
взаимодействие с молекулами адсорбента и сохраняют свою индивидуальность.
Для физической адсорбции характерна высокая
скорость процесса, малая прочность связи и малая теплота. С повышением
температуры количество физически адсорбированного вещества уменьшается, а
увеличение давления к возрастанию величины адсорбции. Преимущество - легкая
обратимость процесса путем:
а) уменьшения давления
б) увеличения температуры. Адсорбированные
молекулы легко десорбируются без изменения химического состава, а
регенерированный адсорбент может использоваться многократно. Процесс можно
вести циклично, чередуя стадию поглощения и выделения извлекаемого компонента.
Химическая адсорбция - в основе лежит химическое
взаимодействие между адсорбентом и адсорбируемым веществом. Действующие при
этом силы значительно больше, а высвобождающееся тепло совпадает с теплом
химической реакции и составляет 20 - 400 кДж/моль.
Главные отличия:
)молекулы адсорбтива, легко вступив в химическое
взаимодействие, прочно удерживаются на поверхности и в порах адсорбента;
)скорость реакции, при низких температурах мала,
но возрастает с ростом температуры.
Оба вида адсорбции сопутствуют друг другу,
однако, наибольшее значение для очистки газов имеет физическая адсорбция.
Промышленные адсорбенты
Любое твердое тело обладает поверхностью и,
следовательно, потенциально является адсорбентом.
В технике используют адсорбенты с сильно
развитой внутренней поверхностью, полученной в результате (спекания), синтеза и
специальной обработки.
Адсорбенты должны обладать:
− большой динамической емкостью (временем
защитного действия);
− большой удельной поверхностью;
− избирательностью;
− термической и механической
устойчивостью;
− способностью к регенерации;
− простотой изготовления;
− дешевизной;
Это - активные угли, селикагели, цеолиты,
глинистые минералы, пористые стекла и другие.
Адсорбционная емкость адсорбентов
(активность)
По ней определяют размеры аппаратов и
эффективность очистки газов.
Различают статическую и динамическую емкость
адсорбента. Размерность [грамм поглощенного вещества/на 100г. адсорбента или
моль/г.]
Статическая емкость показывает, какое количество
вещества способен адсорбировать способен адсорбировать адсорбент в условиях
равновесия.
Динамическая емкость соответствует поглощенного
вещества слоем адсорбента от начала процесса до начала «проскока» адсорбтива,
т.е. когда в выходящем из слоя адсорбента газе - носителе появляются следы
адсорбтива.
Адсорбционная емкость зависит: от природы
вещества она возрастает с увеличением поверхности, пористости, снижения
размеров пор. Она возрастает: с повышением концентрации загрязняющих веществ
газе - носителе; давления в системе. С увеличением температуры и влажности
адсорбционная емкость уменьшается, поэтому перед использованием их высушивают.
Хороший адсорбент не теряет активности при выполнении сотен и тысяч циклов.
Адсорбционная очистка газов наиболее эффективна
при обработке больших объемов газов с малым содержанием примесей, например, для
тонкой очистки технологических газов от сернистых соединений и диоксида
углерода, а также при удалении паров ядовитых веществ и канцерогенов. Наиболее
целесообразно применение при необходимости уменьшения содержания примесей до
нескольких миллионных долей и даже ниже, например, загрязняющие вещества с
сильным запахом можно обнаружить при содержании их в воздухе порядка 100 млрд-1,
поэтому требуется понижать концентрацию еще ниже.
Эффективность адсорбционных систем определяется,
главным образом, свойствами адсорбента, который должен:
−иметь высокую адсорбционную способность;
−обладать высокой селективностью;
−иметь высокую механическую прочность;
−хорошо регенерироваться;
−иметь низкую стоимость.
Адсорбенты подразделяют на три группы:
) неполярные твердые вещества, на поверхности
которых происходит физическая адсорбция.
) полярные - происходит химическая адсорбция без
изменения структуры молекул газа и поверхности адсорбента.
) вещества, на поверхности которых протекает
чисто химическая адсорбция и которые десорбируют молекулы газа после химической
реакции, при этом требуется их замещение.
Самый распространенный неполярный адсорбент -
активированный уголь, состоящий из нейтральных атомов одного вида и имеющий
поверхность с равномерным распределением зарядов на молекулярном уровне.
Выпускают:
) для отечественных вентиляций АГ, КАУ, СКТ.
Размер гранул 1 - 6 мм, ρн=380
- 600 кг/м3.
рекуперационные угли АР, АРТ, СКТ - 3.
) молекулярно - ситовые угли МSС.
Количество газа адсорбированного 1 г. адсорбента
в равновесном состоянии зависит от природы адсорбента и адсорбата, а также от
температуры и давления. Зависимость массы (m)
адсорбированных загрязняющих веществ на адсорбате (активированный уголь) при t=const.
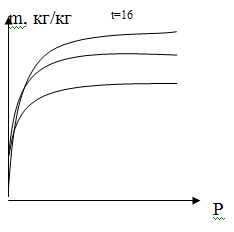
Изотерма адсорбции показывает, что поскольку
адсорбция - процесс экзотермический, то количество вещества, адсорбированного в
состоянии равновесия, уменьшается с повышением температуры.
Регенерация адсорбента включает в себя:
десорбция, сушка, охлаждение
а) термическая (160 ÷
170°)
б) при высоких температурах (300 - 400°)
в) вытеснительная (холодная)
Расчет адсорберов
Основные определяемые величины: диаметр аппарата
и высота слова слоя сорбента при заданном времени процесса.
)допустимая фиктивная скорость газа (скорость в
свободном сечении)
ω0 =
(0,016 · r · ρнас
· dэ
· g / ρг
)0,5
dэ
- эквивалентный диаметр гранул, м,
ρг
- плотность газа, кг/м3,
ω0
≤ 0,3 м/с.
Пористая структура адсорбентов
Пористая структура оказывает значительное
влияние на адсорбционные свойства сорбента.
Поверхность сорбента включает в себя:
внешнюю поверхность, зависящую от количества
макропор и составляет 0,5 ÷
2,0 м2/ч, т.е. 2,0 ÷
0,5 % от общей поверхности;
внутреннюю поверхность, образующуюся за счет
стенок микропор. Она может быть равна 500 ÷
1000 м2/ч.
Поверхность пористого тела:
NA
- число
Авагадро,
aм -
величина адсорбции, соответствующая покрытию поверхности сплошным монослоем
адсорбированных молекул,
Sм -
площадка, занимаемая одной адсорбированной молекулой,
Sм =
1,53 · V2/3,
V - мольный объем
адсорбированного вещества.
Sм N2
= 1,62
м2.
Суммарную пористость твердого тела можно
определить по его плотности.
Различают истинную (ρист),
кажущуюся (ρкаж)
и насыпную (ρнас)
плотность пористых тел.
Истинная - масса единицы объема
плотноупакованного тела (не содержащего пор).
Кажущаяся - масса единицы объема пористого тела,
включающая объемы пор, но без учета объема пустот между зернами.
Насыпная - масса единицы объема пористого тела,
включающая объем плотного вещества, объем пор и объем пустот между зернами.
Суммарный объем пор:
V∑
= 1∕ρкаж
= - 1∕ρист,
г∕см3.
Активный уголь ρист,
=
1750 ÷
2100 ρкаж
=
500 ÷
1000 ρнас
= 200 ÷
600
Мягко зернистый селикогель ρист
= 2100 ÷
2300 ρкаж
=
1300 ÷
1400 ρнас
= 800÷
850
Крупно зернистый селикогель ρист
= 2100 ÷
2300 ρкаж
=
750 ÷
850 ρнас
=
500 ÷
600
Цеолиты ρист
=
2100÷
2300 ρкаж
=
1200 ÷
1400 ρнас
= 600 ÷
800
Характеристика адсорбента
Активные угли
- сорбенты органического происхождения (из угля, торфа, древесных материалов,
отходов бумажного производства, кости животных, скорлупа орехов, косточки
плодов и т.д.).
Вначале исходный материал подвергают термической
обработке при t = 600 ÷
900°С, из углей улетучивается влага и смолы, а затем для придания пористости
его активируют - обрабатывают паром, газами или химическими реагентами ( СО, СО2,
NH3,
водяной пар) при t = 800 ÷
900°С. Измеряя температуру, скорость подачи активатора и время активации,
получают с разными адсорбционно - структурными свойствами марки активных углей
: БАУ, ДАК, АР - А, АР - Б, КАД, СКТ - 1,2.3,4. Основная характеристика - ρнас,
и фракционный состав. Выпускают в виде гранул, диаметром 2 ÷
5 мм, Н › диаметра. Иногда их дробят на более мелкие фракции 0,15 ÷
2,5 мм, применяют для газоочистки со стационарным движением и слоем адсорбента.
Порошкообразные угли dфр
<
0,15 мм - для очистки веществ в жидкой фазе. БАУ - Березовский активный уголь,
АГ - гранулированный активный уголь, АР - активный уголь рекуперационный. КАУ -
косточковый, СКТ - уголь сернистокалиевой активации.
Для очистки газовых выбросов (вентиляционных)
применяют марки АГ, КАУ. СКТ, а также угли из полимерных материалов и
молекулярно - ситовые угли (MSC)
- обладают высокой адсорбционной активностью в области малых концентраций
загрязняющих веществ, отличающихся повышенной прочностью, так САУ - (изготавливают
из полимера урана).
Отрицательные свойства -горючесть, окисляются
при t = 250°С, чтобы
уменьшить пожароопасность, к углю добавляют селикагели.
Селикагели - гидратированный аморфный,
получаемый путем взаимодействия жидкого стекла и серной кислоты. Это
минеральный адсорбент, продукт реакции (SiO2
· n H2O)
dфр
= 0,2 ÷
7 мм в виде зерен,
ρнас =
0,2 ÷
7г∕см3.
Дешевый сорбент, имеет высокую механическую
прочность к истиранию, низкую температуру регенерации (110-120°С), применяют
для осушки газов и улавливания органических загрязняющих веществ.
Селикагель, полученный в кислой среде и промытый
подкисленной водой - обладает мелкими порами. В щелочной среде -
крупнопористые.
В зависимости от формы зерна:
− кусковый селикагель (зерна неправильной
формы);
− гранулированный (зерна сферической или
овальной формы).
Рекомендуемый гранулометрический состав
селикагелей для различных способов очистки газов
― для процессов с
кипящим слоем - 0,1 ÷ 0,25 мм
― с движущимся слоем
- 0,5 ÷
2,0мм
― со стационарным
слоем - 2,0 ÷ 7,0мм
Недостаток - разрушение зерен под воздействием
капельной влаги
Алюмогели - Al2O
· n · H2O
- активные оксиды алюминия, как и селикагели являются гидрофильными
адсорбентами, они обладают развитой структурой, большой поверхностью и
приемлемы для осушки газов, улавливания углеводородов и фтора. Они более стойки
к действию воды. Они способны поглощать от 4 до 10 % водяных паров от
собственной массы.
Цеолиты (с
греч. кипящие камни). Все выше рассмотренные адсорбенты имеют нерегулярную
структуру, поэтому в их поры могут проникать и удерживаться самые различные по
размерам молекулы, т.е. они не обладают избирательной адсорбцией - это их
недостаток.
Избирательно адсорбировать одинаковые по размеру
молекулы могут адсорбенты со строго регулярной пористой структурой - это
природные минералы сидерит, фожазит, эрионит, глабазит, морденит и др. Путем
термической обработки их превращают адсорбент, обладающий высокой пористостью,
большой поверхностью и одинаковыми размерами пор. Природных цеолитов в природе
мало, они загрязнены примесями, поэтому для промышленного применения
синтезированы примерно 100 наименований цеолитов.
Наиболее применимы цеолиты марок КА, NaA,
СаА, NаХ, СаХ. Первая
буква соответствует катиону, компенсирующему заряд решетки (К+, Nа+,
Са+), вторая - тип кристаллической решетки.
Цеолиты - уникальные адсорбенты, извлекающие
аммиак, SO2,
ацетилен, H2S,
CO2
и т.д.
Регенерация адсорбентов
Регенерация заключается в удалении из его пор
адсорбированного вещества. Эффективность процесса очистки зависит от качества и
скорости выделения адсорбированного вещества из адсорбента.
Методы адсорбции:
― термическая
(повышение температуры слоя адсорбента до 110 - 130 °С - при обычных и 300 -
400 - повышенных температурах);
― вытеснительная
десорбция (при 30 - 80°С);
― в настоящее время
более распространена десорбция с полем острого водяного пара.
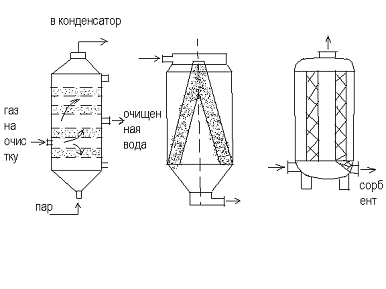
Конструкции адсорбционных установок
) Адсорбенты периодического действия с
неподвижным (стационарным) слоем поглотителя.
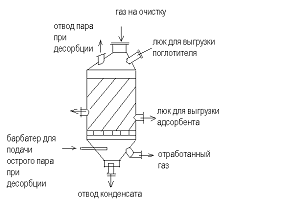
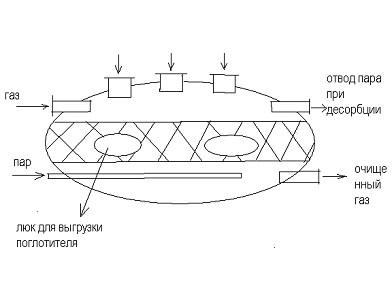
Подача газа сверху - вниз (можно наоборот). При
необходимо адсорбент располагают на полках слоями, с кольцевым слоем
адсорбента.
Для осуществления непрерывного процесса
устанавливают не менее двух аппаратов.
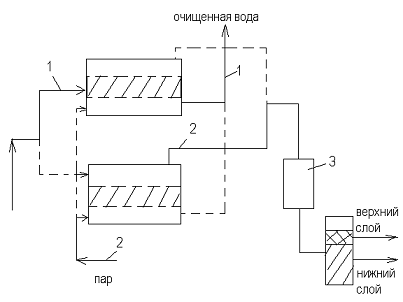
) Первая стадия - адсорбция
) Десорбция - подачу газа прекращают и подают
пар. В результате нагрева адсорбента происходит десорбция поглощенных
компонентов, которые вместе с паром удаляются из аппарата для разделения
) Сушка адсорбента - прекращают подачу пара и
подают горячий воздух
) Охлаждение - подают холодный воздух.
адсорбент газ очистка
Расчет адсорбционных установок
Заключается в определении конструктивных
размеров (диаметр, высоту), объема адсорбента, времени защитного действия
гидравлического сопротивления и некоторых других величин.
1) Да =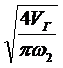
Где VГ
-
объемный расход пороговой смеси м3∕с,
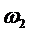 - скорость, отнесенная к свободному
сечению аппарата, м ∕с.
- скорость, отнесенная к свободному
сечению аппарата, м ∕с.
Для аппаратов с неподвижным слоем 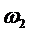 = 0,25 ÷ 0,3 м ∕с.
= 0,25 ÷ 0,3 м ∕с.
)Объем адсорбента для разовой
загрузки в аппарат
 Vад =
Vад =
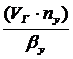
nу - число
единиц переноса;
ßу - объемный
коэффициент масоопереноса, кг ∕м3·с.
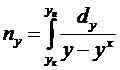 или
или 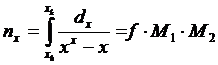
ун, ук -
начальная и конечная концентрация адсорбтива в парогазовой смеси,
х, у - текущие концентрации
адсорбата в твердой и адсорбтива в парогазовой фазе, кг ∕м3,
хх, ух -
равновесные концентрации адсорбата, кг∕м3.
Уравнение можно решить методом
графического интегрирования. Задавшись рядом значений «у» строим график в
координатах 1∕(у - у*) ― у, а затем, измерив площадь
криволинейной трапеции находим величину искомого интеграла с учетом масштабов:
М1= l1 ∕h1 и М2
= l2 ∕h2,
l1 - значение
ординаты 1∕(у - у*),
h1 - значение
этой же ординаты в мм,
l2 - значение
абсциссы на графике у,
h2 - значение
этой же абсциссы в мм.
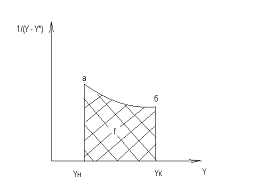
Для построения графика, используемого для
получения числа единиц переноса, необходимо определить значение ух (хх).
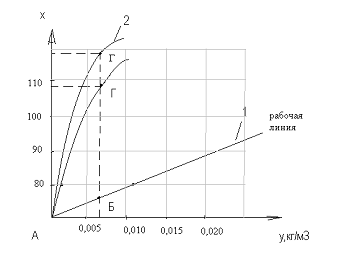
Для этого требуется построить изотермы адсорбции (линия 2) и рабочей линии
процесса (линия 1). Изотерма адсорбции (кривая равновесия0 при t
= const служит основной
характеристикой процесса а0 = f(p),
а0 - статическая активность,
р - парциальное давление.
Между концентрацией адсорбируемого вещества в
газовой фазе и его существует уравнение Клапейрона:
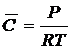 , кг∕м3.
, кг∕м3.
Изотерму адсорбции строят на
основании экспериментальных (либо справочных) данных. Для построения рабочей
линии необходимо знать координаты минимум двух точек, отвечающих рабочим
условиям процесса.
Например, если заданы ун,
ук и хн (начальные концентрации извлекаемого компонента в
твердой фазе), то конечную концентрацию адсорбента в твердой фазе хк
определяем из уравнения:
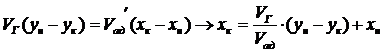
 - объем адсорбента, насыщаемый
адсорбтивом в единицу времени (величина работающего слоя).
- объем адсорбента, насыщаемый
адсорбтивом в единицу времени (величина работающего слоя).
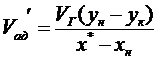 ,м3∕с,
,м3∕с,
Значение х* (равновесная концентрация адсорбата
в твердой фазе), соответствующее заданному значению «у», определяют по изотерме
адсорбции. Зная координаты (·)А (хн;ук) и (∙)Б (хк;
ун) наносим их на график и соединяем прямой линией.
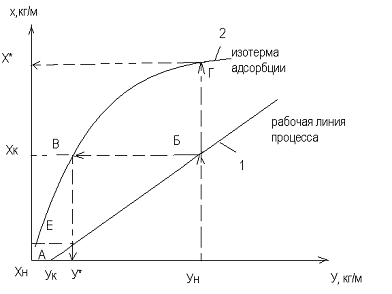
Для определения х*, у*
задаемся значениями «у» в интервале ун - ук. Если
перпендикуляр из начальной (∙)ун продолжить до пересечения с
равновесной линией 2 до (∙)Г и спроектировать ее на ось х, то получим
равновесное соединение адсорбата в твердой фазе х* при заданном
значении ун. Если изотерма адсорбции неизвестна, то ее можно
построить по изотерме адсорбции стандартного вещества. Значение величин
адсорбции пересчитывают по формуле:
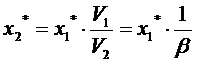 ,
,
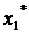 - ордината изотермы стандартного
вещества(обычно бензола),кг/кг,
- ордината изотермы стандартного
вещества(обычно бензола),кг/кг,
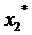 - ордината определяемой изотермы,
кг/кг,
- ордината определяемой изотермы,
кг/кг,
V1, V2 - мольные
объемы стандартного и исследуемого вещества в жидком состоянии,
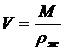 ,
,
М - мольная масса вещества, кг/моль,
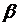 - коэффициент аффиктивности,
- коэффициент аффиктивности,
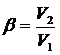 ,
, 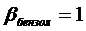 ,
,
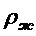 - плотность вещества в жидком
состоянии, кг/м3.
- плотность вещества в жидком
состоянии, кг/м3.
Пример - рассчитать адсорбер для
улавливания паров диэтилового эфира из воздуха: VГ = 2000м3∕ч
= 0,555м3∕ч, tв = 20°С, Р =
760мм рт ст, ун = 0,006кг∕м3, ук = 3 ∙
10-5кг/м3.
В качестве адсорбента выбираем
активный уголь марки АР - А, dэ = 1,3 ∙
10-3м.
Принимаем 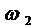 = 0,28м/с,
тогда
= 0,28м/с,
тогда 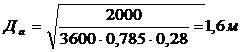 ,
,
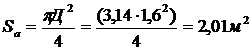 .
.
Для построения изотермы адсорбции
используем монограмму для определения давления насыщенного пара некоторых
веществ, по которой определяем парциальное давление веществ по формуле:
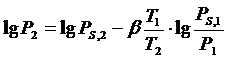 (1)
(1)
где Р1,Р2 -
парциальное давление стандартного и исследуемого вещества, мм рт ст (Па),
РS,1 - давление
насыщенного пара стандартного вещества при абсолютной температуре (мм рт ст),
РS,2 - давление
насыщенного пара исследуемого вещества.
При расчете точек изотермы
исследуемого вещества координаты 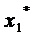 и
и 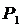 берутся по кривой стандартного
вещества, значения РS,1, РS,2 - из таблиц
давления насыщенного пара. Р2 - вычисляют по формуле (1).
берутся по кривой стандартного
вещества, значения РS,1, РS,2 - из таблиц
давления насыщенного пара. Р2 - вычисляют по формуле (1).
Выразив парциальное давление через
соответствующие концентрации, получим:
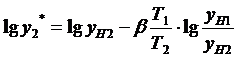 (2)
(2)
Коэффициент аффиктивности для
диэтилового эфира (таблица 36, Кузнецов) 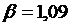 .
.
)по таблице 25(равновесные данные по
адсорбции паров бензола и их смеси с воздухом на активных углях 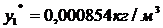 ,
, 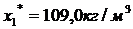 ,
,
)по данным диаграммы (стр. 115)
определяем координаты точек изотермы адсорбции диэтилового эфира, РS,1 - для
бензола - 75 мм рт ст (9997,5 Па), РS,2 - для
диэтилового эфира - 442 мм рт ст (58918,6 Па).
)Объемный коэффициент массопередачи:
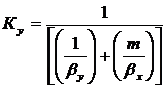
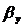 ,
, 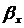 - объемный коэффициент массопередачи
в газовой и твердой фазе соответственно,с-1,
- объемный коэффициент массопередачи
в газовой и твердой фазе соответственно,с-1,
m -
коэффициент распределения (средний 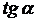 наклона линии равновесия).
наклона линии равновесия).
Поскольку 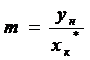 - обычно
очень мал, то величиной
- обычно
очень мал, то величиной 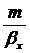 пренебрегаем.
пренебрегаем.
На основании этого 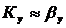 и зависит от
гидродинамической обстановки в аппарате, физических свойств потока.
и зависит от
гидродинамической обстановки в аппарате, физических свойств потока.
Для ориентированных расчетов Ку
используют критериальные уравнения:
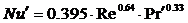 при Re > 30
при Re > 30
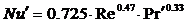 при Re = 2 - 30
при Re = 2 - 30
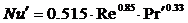 при Re < 2
при Re < 2
где 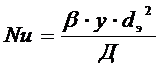 - диффузионный критерий Нуссельта.
- диффузионный критерий Нуссельта.
Dэ -
эквивалентный диаметр зерен адсорбента, м
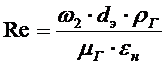 ,
,
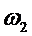 - скорость газового потока,м/с
- скорость газового потока,м/с
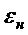 - порозность неподвижного слоя
адсорбента,
- порозность неподвижного слоя
адсорбента,
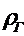 - плотность, кг/м3
- плотность, кг/м3
 - динамическая вязкость, Па·с
- динамическая вязкость, Па·с
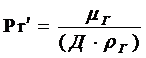 - диффузионный критерий Прандтля.
- диффузионный критерий Прандтля.
)Высота неподвижного слоя адсорбента
в аппарате
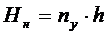 ,
,
h - высота
единицы переноса,
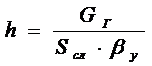
где Gг −массовый
расход газа, кг∕с
Sсл- сечение
слоя, м2
•уравнения баланса поглощенного
вещества;
•уравнения кинетики адсорбции;
•уравнение изотермы адсорбцию.
: 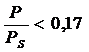 (по бензолу),
(по бензолу),
: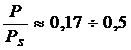
: 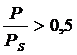
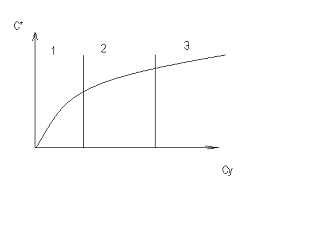
Изотерма адсорбции для решения
уравнений делится на три области:
область - линейная зависимость между
концентрацией газа и количеством поглощенного вещества и условно принимается,
что изотерма адсорбции подчиняется закону Генри.
Тогда продолжительность адсорбции:
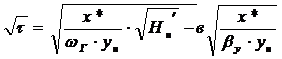 ;
;
где ун - начальная
концентрация адсорбированного вещества, кг∕м3
х* - равновесное количество
адсорбированного вещества, кг∕кг (принимается по изотерме адсорбции и
умножается на насыпную плотность адсорбента ).
|
ук
∕ун
|
0,005
|
0,01
|
0,03
|
0,05
|
0,10
|
0,2
|
0,3
|
0,4
|
0,5
|
0,6
|
0,7
|
0,8
|
0,9
|
|
в
|
1,84
|
1,67
|
1,35
|
1,19
|
0,97
|
0,67
|
0,42
|
0,23
|
0,07
|
-0,10
|
-0,27
|
-0,46
|
-0,68
|
область - криволинейная
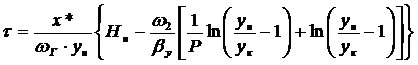 ;
;
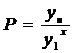
где 
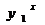 - содержание вещества в газовом
потоке, равновесное с количеством, равным половине вещества, максимально
поглощаемого адсорбентом при данной температуре, кг/м3.
- содержание вещества в газовом
потоке, равновесное с количеством, равным половине вещества, максимально
поглощаемого адсорбентом при данной температуре, кг/м3.
область- количество вещества,
поглощаемого адсорбентом, достигает предела и остается постоянной
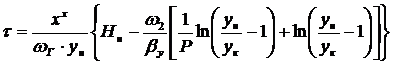 ,
, 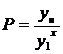
) Высоту зоны массопередачи (высота
рабочего слоя)
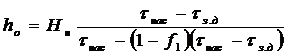 ,
,
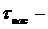 время до равновесного насыщения, сек
время до равновесного насыщения, сек
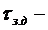 время защитного действия при
минимальной проскоковой концентрации,
время защитного действия при
минимальной проскоковой концентрации,
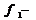 неиспользованная адсорбционная
емкость,
неиспользованная адсорбционная
емкость, 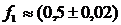
)Перепад давления в слое (формула
применима, если порозность слоя Е=0,4)
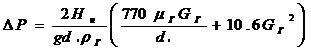
∆Р - перепад давления в слое, кг/м3
g - 9,81 м/с2
dэ
- эквивалентный диаметр зерен, м
G - массовая
скорость газа, кг/(м2∙с)
Другие формулы (автор Дубинин)
1)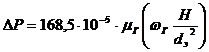 - при
- при 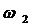 <0,25м/с,
ламинарный режим
<0,25м/с,
ламинарный режим
)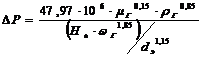 - переходная область
- переходная область
)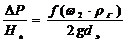 - в слое цеолитов
- в слое цеолитов
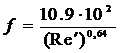 - для шаров,
- для шаров, 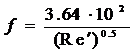 - для
цилиндров
- для
цилиндров
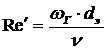
Подставив полученные значения в
уравнение
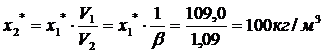
Выразим парциальные давления через
объемные концентрации по уравнению
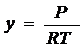
для бензола: 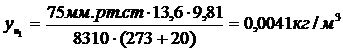
для диэтилового
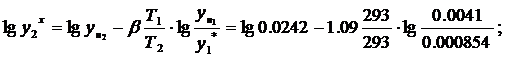
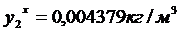
Для других точек составляем таблицу
и по координатам точек строим график - изотерму адсорбции (линия 2)
Исходные данные:
|
точки
|
Бензол
|
Диэтиловый
эфир
|
|
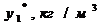
|
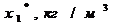  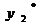 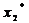
|
|
|
|
1
|
0,000854
|
109,0
|
0,004379
|
100,0
|
|
2
|
0,00256
|
134,3
|
0,0148
|
123,11
|
|
3
|
0,005125
|
139,8
|
0,0308
|
128,2
|
|
4
|
0,00939
|
143,0
|
0,0597
|
132,19
|
|
5
|
0,017060
|
147,3
|
0,1145
|
135,1
|
|
6
|
0,025610
|
151,2
|
0,01786
|
138,71
|
Объем адсорбента:
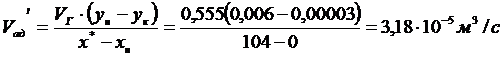
Здесь х*=хк,
т.е. на выходе адсорбент будет полностью насыщен поглощаемым компонентам
(предполагаем!)
при ун=0,006 кг/м3
по графику хх=104кг/м3.
Фактическое количество адсорбента
принимаем на 30% больше
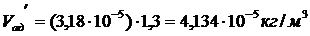
. Для определения  предварительно
найдем
предварительно
найдем
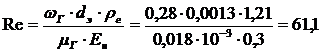 ,
,
т.к. Re>30,то 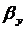 по уравнению
по уравнению
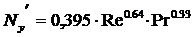 .
.
Изотерма адсорбции
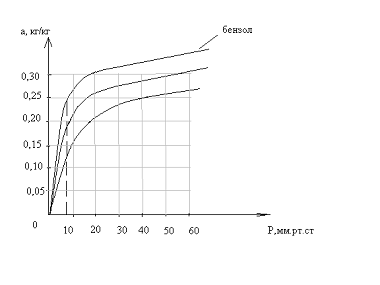
По Павлову:
(.)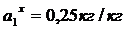 , ей соответствует Р1=8
мм.рт.ст. Вычислим координаты соответствующих точкам на изотерме диэтилового
эфира
, ей соответствует Р1=8
мм.рт.ст. Вычислим координаты соответствующих точкам на изотерме диэтилового
эфира
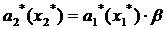 ;
;
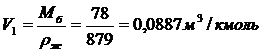
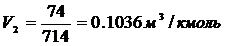
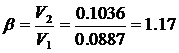
=> 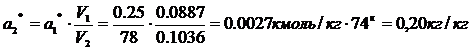
Диффузионный критерий Прандтля.
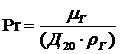 ,
,
Д20, До -
коэффициенты диффузии
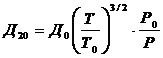 - для температуры 20°С,
- для температуры 20°С,
а До- при t=0°C равен 0,028
м2/ч=0,0778∙10-4 м2/сек
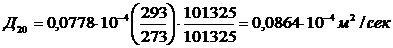 - для диэтилового спирта
- для диэтилового спирта
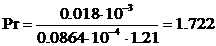
 , а Nu' в свою
очередь равен:
, а Nu' в свою
очередь равен:
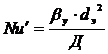 , тогда
, тогда
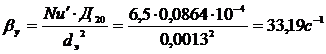
.Высота единиц переноса.
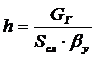 ;
;
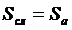
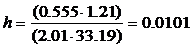
.Число единиц переноса определяем
методом графического интегрирования. Для построения рабочей линии переноса (1
линия) находим из уравнения материального баланса:
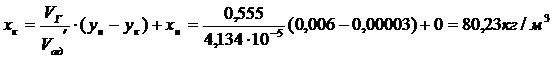
По координатам точек хн=0,
хк=80,23 и ук=3∙10-5, ун=0,006
строим рабочую линию процесса. С помощью построенной диаграммы определяем
величины для графического интегрирования. Задаемся рядом значений «у» в
интервале ун ―ук и
для каждого значения «у» находим значения х* на рабочей линии и значение у* на
равновесной линии.
|
у,
кг/кг
|
х*,
кг/м3
|
у,
кг/м3
|
у-у*
|
1∕(у-у*)
|
|
0,006
|
80,23
|
0,00133
|
0,00467
|
214,133
|
|
0,005
|
78,0
|
0,00125
|
0,00375
|
266,666
|
|
0,004
|
75,2
|
0,00110
|
0,00290
|
344,827
|
|
0,003
|
74,0
|
0,00095
|
0,00205
|
487,804
|
|
0,002
|
73,2
|
0,00085
|
0,00115
|
869,56
|
|
0,001
|
71,5
|
0,0006
|
0,0004
|
2500
|
|
0,00003
|
70,0
|
0
|
0,00003
|
3333,33
|
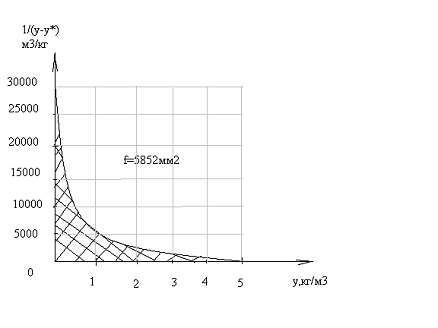
Масштабы определяются:
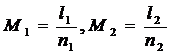
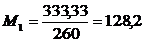
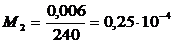
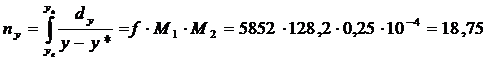
Высота адсорбента:
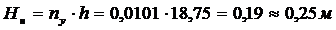
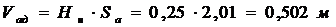
.Продолжительность процесса
адсорбции определяется по закону Генри, т.к. (∙) ун на графике
находящиеся в области прямой линии
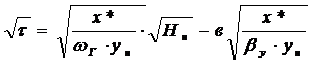
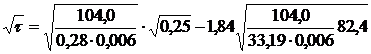
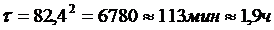
.Количество газо-воздушной смеси,
проходящей через адсорбент за время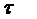
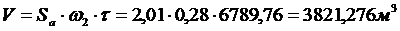
или 3821,276 м3 ∙
1,9ч =2011,19 м3/ч
.Перепад давления в слое
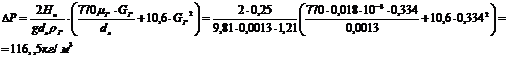
где