Исследование качества питьевой воды после различной обработки
ЕЖЕГОДНЫЙ
ВСЕРОССИЙСКИЙ КОНКУРС ДОСТИЖЕНИЙ ТАЛАНТЛИВОЙ МОЛОДЁЖИ
"НАЦИОНАЛЬНОЕ
ДОСТОЯНИЕ РОССИИ"
Бюджетное
образовательное учреждение Омской области начального профессионального
образования "Профессиональное училище №20"
Секция:
Технический анализ
Тема:
"Анализ качества питьевой воды после различной обработки"
Автор: Криштафович Екатерина
Борисовна
Киселева Екатерина Александровна
Научный руководитель:
Влюшина Людмила Александровна
Змейкова Екатерина Александровна
Оглавление
Введение
Отбор проб
Методика проведения определений
Результаты определения
Влияние показателей качества воды на
здоровье человека
Выводы - рекомендации
Список литературы
Введение
Вода стоит особняком в истории нашей
планеты. Нет природного тела,
которое могло бы с ней сравниться по
влиянию на ход основных, самых
грандиозных, геологических
процессов.
Не только земная поверхность, но
и глубокие
-
в масштабе биосферы
части планеты определяются, в самых
существенных своих проявлениях, ее
существованием и ее свойствами.
В.И.
Вернадский
Вода играет исключительно важную роль в природе,
в жизнедеятельности растений, животных и человека, которые в основном состоят
из воды и без нее существовать не может.
Все люди хорошо знают текущие по суше водотоки -
ручейки, речушки, реки. Иногда они низвергаются с высоты десятков и сотен
метров водопадами, на многие сотни метров наполняя воздух мельчайшей алмазной
пылью, переливающейся в лучах солнца всеми цветами радуги. Иногда образуют
мощные пенящиеся стремнины, вытачивающие в скалах причудливые формы. Крупные
водотоки на сотни километров пропиливают даже в плотных породах широкие, до
десятка километров, и глубокие, до многих сотен метров, долины. Все это делает
сила природной воды.
Большая часть поверхности нашей планеты, около
71%, покрыта Мировым океаном, составляющим 97% всех поверхностных вод Земли и
около половины всех вод литосферы. Глубина Мирового океана достигает 11 км.
Если срезать сушу и заполнить ею дно океанической чаши, то вся планета
покроется слоем воды глубиной около 3 км.
Важным обстоятельством в природе является то,
что максимальная плотность воды, наблюдается при 4 °С, а лед оказывается легче
жидкой воды и поэтому плавает на ее поверхности. Если бы этого не было, то
водоемы и водотоки промерзали бы зимой до самого дна, что было бы настоящей
катастрофой для всего живого в них.
Что касается температуры кипения, то она
находится в прямой зависимости от давления: с увеличением давления она
возрастает. Это свойство воды раньше использовалось для определения высоты
местности в горах. Температура кипения повышается также с увеличением
содержания в воде растворенных веществ.
Вода в силу популярности ее молекул способствует
разложению контактирующих с ней молекул солей на ионы, но сама вода проявляет
большую устойчивость и в химически чистой воде содержится очень мало ионов по Н+
и НО-
Вода - инертный растворитель, химически не
изменяется под действием большинства технических соединений, которые она
растворяет.
В природных условиях вода не может схоронить
"химическую чистоту" постоянно соприкасаясь со всевозможными
веществами, она фактически всегда представляет собой раствор различного,
зачастую очень сложного свойства. В пресной воде содержание растворенных
веществ обычно превышает 1 г/л. От нескольких единиц до десятков граммов на
литр колеблются содержание солей в морской воде.
В большинстве случаев люди могут узнать, какая
вода течет у них из крана - жесткая или мягкая - по эффектам, производимым ею в
доме. В жесткой воде для получения пены требуется большее количество мыла, чем в
мягкой, а кроме того, жесткая вода вызывает образование налета на внутренней
поверхности деталей водопровода и металлических чайников. Этот налет в основном
представляет собой карбонат кальция (СаСО3). Жесткость воды определяется
значением концентрации некоторых растворенных минеральных веществ, главным
образом солей кальция (Са) и магния (Mg). В природе они попадают в воду, когда
она течет сквозь горные породы и почву, содержащие соответствующие минералы.
Точно так же аквариумная вода может стать более жесткой, если при оформлении
используются известняки и другие декоративные элементы, содержащие
соответствующие растворимые минеральные соли. Вода, содержащая малое количество
таких солей или вообще не содержащая их, называется мягкой.
Вода обладает исключительно высокой
теплоемкостью. Теплоемкость воды принята за единицу. Теплоемкость писка,
например, составляет 0,2, а железо- лишь 0,107 теплоемкости воды. Способность
воды накапливать большие запасы тепловой энергии позволяет сглаживать резкие
температурные колебания на прибрежных участках Земли в различные времена года и
в различную пору суток: вода выступает как бы регулятором температуры на всей
нашей планете.
Следует отметить особое свойство воды - ее
высокое поверхностное натяжения - 72,7 эрг/см2 (при 200 с). В этом
отношение из всех видов жидкостей вода уступает только ртути. Подобное свойство
воды во многом обусловлено водородными связями между отдельными молекулами Н2О.
Особенно наглядно проявляется поверхностное
натяжения в прилипании воды ко многим поверхностям - смачивании.
Установлено, что вещества - глина, песок,
стекло, ткани, бумага и многие другие, легко смачиваемые водой, непременно
имеют в своем составе атомы кислорода. Такой факт казался ключевым при
объяснении природы смачивания: энергетически не уравновешенные молекулы
поверхностного слоя воды получают возможность образовать дополнительные связи с
"чужими" атомами кислорода.
Огромная роль воды в жизни человека и природы
послужила причиной того, что она была одним из первых соединений, привлекших
внимание ученых. Тем не менее, изучение воды еще далеко не закончено.
Актуальность
Актуальность темы исследования заключается в
том, что вода - это важнейшая составляющая среды нашего обитания. После
воздуха, вода второй по значению компонент, необходимый для жизни человека.
Вода присутствует во всех тканях нашего организма, хотя распределена
неравномерно.
Сегодня как никогда нашему организму очень важно
получать чистую питьевую воду со сбалансированным минеральным составом. Чистая
питьевая вода повышает защиту организма от стресса, обеспечивает работу
внутренних органов. Вода необходима для поддержания всех обменных процессов,
она принимает участие в усвоении питательных веществ клетками. Вода является
теплоносителем и терморегулятором.
При таком большом значении воды для человека,
вода должна быть соответствующего качества.
Поэтому мы решили провести анализы питьевой воды
после различных методов отчистки и выяснить, какая из них наиболее полезна.
Характеристика воды как важнейшей составляющей
среды нашего обитания. Определение ее карбонатной жесткости и окисляемости
методом нейтрализации и перманганатометрии соответственно.
Сравнение качества воды, подаваемой системами
водоснабжения и колодезной.
Цель исследования
Определить химический состав воды, подаваемой
системами водоснабжения и предназначенной для потребления населением для
питьевых и бытовых целей после различной обработки, а так же колодезную воду.
Задачи исследования
1. Определить водородный показатель с
помощью РН метра в пробе воды.
2. Определить карбонатную жесткость воды
методом нейтрализации.
. Определить окисляемость воды методом
перманганатометрии.
. Определить содержание остаточного хлора
в воде методом йодометрии.
. Определить содержание общей жесткости
воды методом комплексонометрии.
. Сравнить качество исследуемых проб
воды.
Отбор проб
1. Из под крана проба отбиралась после 5
минутного слива в 5 литровую емкость;
. Часть пробы отстаивали в течение 24
часов;
. Часть пробы кипятили в течение 10
минут;
. Из фильтра "Аквафор" была
отобрана проба в объеме 1,5 дм3;
. Бутылированная вода компании
"чистая вода" в объеме 1,5 дм3;
. Проба отбиралась в Павлодарской области
Иртышском районе из колодца. Из колодца вначале вычерпываем воду 2-3 раза и
отбираем пробу в объеме 3 дм3;
. Часть пробы была освещена в церкви
праздник.
Основной операций данной работы является
титрование.
Титрование
- это медленное прибавление по каплям рабочего раствора к пробе до точки
эквивалентности.
Рабочий раствор -
(стандартный раствор, титрованный раствор) - это раствор с точно известной
концентрацией, с помощью которого определяем концентрацию пробы.
Проба - (анализируемый
раствор) - это вещество, концентрацию которого необходимо определить.
Точка эквивалентности - это
момент окончания реакции, когда количество рабочего раствора эквивалентно
количеству анализируемого раствора; определяется по изменению окраски
индикатора.
Индикатор - это
вещество, не участвующие в реакции, но показывающие точку эквивалентности
(появление, исчезновение, изменение окраски индикатора, выпадение осадка,
появление пузырьков газа, запаха).
Определение карбонатной жёсткости
воды
I. Сущность метода
Временная или карбонатная жёсткость воды
обусловлена присутствием растворимых солей гидрокарбонатов кальция и магния.
Карбонатная жёсткость воды устраняется
кипячением.
Ca(HCO3)2
→ CaCO3
+ CO2
+H2O
Жёсткость воды
определяют, чтобы выяснить ее пригодность для растениеводства, животноводства,
для питания, для технических целей (охлаждение двигателей машин).
Карбонатная жёсткость определяют методом
нейтрализации. Рабочим раствором является HCI.
Ca(HCO3)2
+ 2HCI
→
CaCI2
+ 2CO2
+ 2H2O
Mg(HCO3)2 +
2HCI → MgCI2 + 2CO2 + 2H2O
II. Средства измерения
Бюретка, мерная колба, колба для титрования,
раствор HCI 0,1моль/дм3,
метилоранж.
III. Подготовка к выполнению
измерений.
Приготовление HCI
0,1моль/дм3
Мерную колбу - дозатор - 2 раза ополоснуть
пробой.
VI.
Выполнение измерений.
В колбу для титрования внести 100см3
пробы (мерной колбой-дозатором), прилить 3 капли метилоранжа оттитровать
раствором HCI до розовой
окраски.
V.
Обработка результатов.
Расчет карбонатной жесткости.
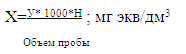
V- объем HCI
0,1моль/дм3, израсходованный на титрование, см3
H- нормальность
рабочего раствора г-экв./ дм3;
Vпр.- объемы пробы,
взятой на анализ, см3;
- перевод г в мг.
VI.
Сходимость результатов.
За результат определения принимают среднее
арифметическое двух параллельных определений, расхождение между которыми не
превышает 0,01 г-экв./ дм3
Определение общей жёсткости воды
I. Сущность метода
Комплексонометрический метод определения
жёсткости воды основан на способности ионов кальция магния образовывать прочные
внутрикомплексные соединения с динатриевой солью этилендиаминтетрауксусной
кислоты (Трилон Б)
Рабочим раствором является Трилон Б. Индикатор -
хром тёмно-синий, который образует с катионами кальция и магния растворимые в
воде окрашенные комплексные соединения. При добавлении в пробу Трилона Б,
катионы кальция и магния переходят в Трилон Б и индикатор в свободном виде.
II. Средства измерения
Колба для титрования, мерная колба на 50 см3
, бюретка, пипетка, воронка лабораторная, стаканчик.
Раствор Трилона Б 0,1моль/дм3 (0,01H),
индикатор хром тёмно-синий, аммиачно-буферный раствор, дистиллированная вода.
III. Подготовка к выполнению
измерения
1) Собирают титровальную установку ;
2) Тщательно перемешивают пробу.
IV. Выполнения измерения.
1) В колбу для титрования вносят 50см3
пробы мерной колбы;
2) Прибавляют градуированной пипеткой 2,5
см3 аммиачно-буферный раствора;
) Прибавляют 4 капли индикатора хром
темно-синий, энергично взбалтываем;
) Оттитровать 0,01H
раствором Трилоном Б по каплям, хорошо перемешивая до перехода сиреневого цвета
в синевато - сиреневый;
) Снимают показания объёма по бюретке и
проверяют правильность точки эквивалентности, добавив в колбу для титрования
контрольную каплю Трилона Б. Если раствор окрасится в синий цвет, то титрование
заканчивают.
V. Обработка результатов.
Расчет общей жесткости воды проводится по
формуле:
Жёсткость
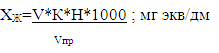
V- объем Трилона Б,
пошедший на титрование без контрольной капли, см3; Vпр-
объем пробы, взятой на анализ (50см3); К- поправка к концентрации
Трилона Б 0,01моль/ см3; Н- концентрация Трилона Б 0,01моль/ см3;
1000 - пересчет см3 в дм3.
VI.
Сходимость результатов.
За результат измерения принимают среднее
арифметическое двух параллельных определений, расхождение между которыми не
превышает 2% относительных.
Определение окисляемости воды
І. Сущность метода
Окисляемость воды вычисляют по количеству
кислорода, расходуемого на окисление органических и легкоокисляющихся продуктах
(сульфитов, нитритов, железа (II))
пробы в определенных условиях.
Метод основан на окислительно -
восстановительной реакции между перманганатом калия (сильным окислителем) и
органическими веществами. Рабочим раствором служит перманганат калия KMnO4
0,01
моль/дм3
1 этап - получение кислорода на окисления
органики и окисления её.
2KMnO4 + 3H2SO4
= K2SO4 + 2MnSO4 + H2O + 50
2 этап - определение количества перманганата
калия, израсходованного на окисление.
2MnO4 + 5H2C2O4
+ 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4
+8H2O
вода жесткость окисляемость
йодометрия
Окисляемость воды выражают числом миллиграммов
кислорода, израсходованного на окисление 1 дм3 воды.
Вода считается пригодной для хозяйственно -
питьевых нужд, если её окисляемость не превышает 3мг О2/дм3.
II.
Средства измерения.
Электроплитка, колбы для титрования, штатив,
воронки, пипетки, бюретка, "кипелки" - пористый материал, KMnO4
0,01 моль/дм3 , H2C2O4
0,01
моль/дм3, серная кислота
(1:3), соляная кислота концентрированная.
III.
Подготовка для выполнения измерения.
Предварительная обработка колб для титрования:
налить в колбу до половины объема концентрированного KMnO4
+
1 см3 H2SO4
(1:3),
закрыть воронкой, прокипятить 3-5 минут, смесь вылить, осадок на стенках колбы
растворить в 5 см3 концентрированной соляной кислоты.
Колбу ополоснуть дистиллированной водой.
В подготовленную по п. 3 колбу для титрования
вносят 2,5 см3 H2SO4
(1:3),
точно 10 см3 перманганата калия 0,01 моль/дм3 из заранее
подготовленной бюретки и 50 см3 пробы воды (мерной колбой). В колбу
положить "кипелки", зарыть воронкой и смесь прокипятить в течении 10
минут (с момента закипания). Колбу снимают с электроплитки и сразу вносят в неё
10 см3.
моль/дм3 щавелевой кислоты,
перемешивают до обесцвечивания. Горячий обесцвеченный раствор титруют раствором
KMnO4 0,01
моль/дм3 до появления слабо розовой окраски, неисчезающей 2-3
минуты.
V.
Обработка результатов
Окисляемость воды в мг/дм3 рассчитывают
по формуле:
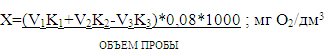
V1-
объем KMnO4
введенный
в пробу, см3;
V2-
объем KMnO4
пошедший
на титрование, см3;
V3 -
объем раствора щавелевой кислоты, см3;
К1 и К2 - коэффициент
поправки и концентрации перманганата калия и щавелевой кислоты соответственно;
,08 - количество грамм кислорода,
соответствующее 1 см3
KMnO4
0,01
моль/дм3 ;
- перевод граммов в миллиграммы.
VI.
Сходимость результатов.
За результат определения принимают среднее
арифметическое двух параллельных определений, расхождение между которыми не
превышает 0,30 мг О2/дм3
Определение остаточного хлора в воде
I.
Сущность метода.
Обеззараживания воды для хозяйственно - питьевых
нужд проводят методом хлорирования. Часть хлора расходуется, а другая часть
остается в воде.
Для определения содержания остаточного хлора
применяется йодометрический метод анализа.
Рабочим раствором служит тиосульфат натрия
вспомогательным раствором - калий йодистый, индикатор - крахмал.
Хлор является сильным окислителем и может
вступить в реакцию с тиосульфатом натрия, но мы не можем определить точку
эквивалентности в результате отсутствия изменения цвета. В нашем случае
применяется заместительное титрование - в пробу вводится вспомогательный
раствор калий йод. С1 + 2КI
= I2
+ 2KC1. В результате
получается третье вещество I2
(раствор
окрашивается в желтый цвет) который далее взаимодействует с тиосульфатом натрия
до обесцвечивания I2
+ 2Na2S2O3
= 2NaI + Na2S4O8
II.
Средства измерения.
Колбы для титрования, мерная колба на 50 см3
, пипетки, бюретка, стаканчик, воронка, штатив, тиосульфат натрия 0,005
моль/дм3, калий йодистый, 10% аммиачно - буферной раствор, крахмал
0,5%.
III.
Подготовка к выполнению измерения
Колбы для титрования вымыть с хромовой смесью,
тщательно промыть водой и ополоснуть дистиллированной водой.
IV.
Выполнения измерения.
Колбы для титрования, подготовленную по пункту 3
вносят 50 см3 пробы воды (мерной колбы) добавляют 2,5 см3 аммиачно
- буферного раствора, затем 2,5 см3 йодистого калия 10%. Колбу
закрыть пробкой и поставить в темное место на 10 минут. По истечении времени
оттитровать тиосульфатом натрия 0,005 моль/дм3 до соломенно-желтого
цвета, добавить 6-7 капель индикатора - крахмала и дотировать до
обесцвечивания.
V.
Обработка результатов
Содержание остаточного хлора рассчитывают по
формуле:
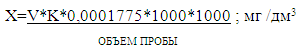
V - объем Na2S2O3
0,005
моль/дм3, пошедший на титрование;
К - коэффициент поправки к концентрации ;
,0001775 - количество грамм хлора,
соответствующее 1 см3 тиосульфата натрия 0,005 моль/дм3;
- перевод граммов в миллиграммы;
- перевод см3 в дм3;
Определение рН растворов
I. Сущность метода.
Физико - химический метод анализа основан на
измерении различных свойств, соединений или же смесей с использованием
соответствующих приборов.
Метод потенциометрии - это электрохимический
метод анализа, основан на измерении потенциала электрода погруженного в
анализируемый раствор и нахождения зависимости между его величиной и
концентрации определяемого компонента в растворе.
рН- это отрицательный десятичный логарифм
концентрации ионов водорода в растворе.
рН = -lg
(н+)
рН >7 - кислая
рН =7 - нейтральная
рН < 7 - щелочная
II. Средства измерения
pH - метр
S-20-K Mettler toledo
III. Выполнение измерения
1. Налить в химический стакан анализируемой
пробы.
2. Погрузить электрод в исследуемый
раствор.
3. Нажать на клавишу Peood.
4. Наблюдать показания на дисплее.
5. Записать результат рН раствора.
6. Провести параллельный анализ.
Безвредность питьевой воды по химическому
составу определяется ее соответствием следующим нормативам:
|
Показатели
|
Единицы
измерения
|
Нормативы
(предельно допустимые концентрации (ПДК), не более
|
|
Обобщенные
показатели
|
|
Водородный
показатель
|
Единицы
Рн
|
В
пределах 6-9
|
|
Жесткость
общая
|
Мг-экв./л
|
7,0
(10)**
|
|
Окисляемость
перманганатная
|
Мг/л
|
5,0
|
Результаты исследования
Отстоявшаяся
|
Кипяченая
|
"Аквафор"
|
"Чистая
вода"
|
Колодезная
|
Церковная
|
|
Определение
рН среды
|
|
рН
1=8,4 рН 2=8,38 рНср=8,39
|
рН1=7,98
рН2=7,98 рНср=7,98
|
рН1=8,47
рН2=8,49 рНср=8,48
|
рН
1=6,24 рН 2=6,24 рНср=6,24
|
рН1=7
рН2=6,99 рНср= 6,995
|
рН
1=7,58 рН 2=7,58 рНср=7,58
|
рН
1=7,52 рН 2=7,52 рНср=7,52
|
|
Определение
карбонатной жесткости
|
|
V1=0,75 см3
V2=0,85 см3
Vср=0,8 см3
|
V1=0,7 см3
V2=0,7 см3
Vср=0,7 см3
|
V1=0,7 см3
V2=0,6 см3
Vср=0,65 см3
|
V1=0,6 см3
V2=0,7 см3
Vср=0,65 см3
|
V1=0,25 см3
V2=0,25 см3
Vср=0,25 см3
|
V1=2,7 см3
V2=2,7 см3
Vср=2,7 см3
|
V1=2,1 см3
V2=2,1 см3
Vср=2,1 см3
|
|
Х=V* 1000*Н ; мг
экв/дм3 Vпробы
|
|
1,6
|
1,4
|
1,3
|
1,3
|
0,5
|
5,4
|
4,2
|
|
Общая
жесткость
|
|
V1= 14,1 см3
V2= 14,1 см3
Vср=14,1 см3
|
V1= 13,6 см3
V2= 14 см3
Vср=13,8 см3
|
V1= 13,1см3
V2= 13 см3
Vср=13,05 см3
|
V1= 5,9 см3
V2= 5,9 см3
Vср=5,9 см3
|
V1= 12 см3
V2= 11,9 см3
Vср=11,95 см3
|
V1= 32,5 см3
V2= 32,5 см3
Vср=32,5 см3
|
V1= 28 см3
V2= 28 см3
Vср=28 см3
|
|
Х=V*К*Н*1000 ; мг
экв/дм Vпробы
|
|
2,82
|
2,76
|
2,61
|
1,18
|
2,39
|
6,5
|
5,6
|
|
Окисляемость
|
|
V1= 1,8 см3
V2= 1,9 см3
Vср=1,85 см3
|
V1= 1,4 см3
V2= 1,4 см3
Vср=1,4 см3
|
V1= 0,6 см3
V2= 0,6 см3
Vср=0,6 см3
|
V1= 1,3 см3
V2= 1,2 см3
Vср=1,25 см3
|
V1= 0,6 см3
V2= 0,6 см3
Vср=0,6 см3
|
V1= 2,0 см3
V2= 1,8 см3
Vср=1,9 см3
|
V1= 1,9 см3
V2= 1,9 см3
Vср=1,9 см3
|
|
X=(V1K1+V2K1-V3K2)*0,08*1000 ;МГ О2/ДМ3
Vпроб
|
|
2,96
|
2,24
|
0,96
|
2
|
0,96
|
3,04
|
3,04
|
Влияния показателей качества воды на
здоровье человека
Кальций
Кальций принимает активное участие в построение
костного скелета и в обмене веществ. Ионы кальция участвуют в процессе
кроветворения (повышают свертываемость крови)
Главным источником поступления кальция в
поверхностные воды являются процессы химического выветривания и растворение
минералов. Ионная форма характерна только для маломинерализованных природных
вод.
ПДК кальция в поверхностных водах составляет 180
мг/дм3
Магний
Активизирует многие ферменты, проявляет
антисептическое действие, понижает давление и содержание холестерина в крови,
стимулирует деятельность желудочно-кишечного тракта.
ПДК ионов магния в поверхностных водах
составляет 40 мг/дм3
Гидрокарбонаты
Основным источником гидрокарбонатных ионов в
поверхностных водах являются процессы выветривания и растворения карбонатных
пород.
Содержание гидрокарбонатных ионов в подземных
водах колеблется от 150 до 900 мг/дм3
рH
раствор
Высокая кислотность разрушает наиважнейшие
системы в организме и он становится беззащитен перед болезнями. Сбалансированная
рН-среда обеспечивает нормальное протекание метаболических процессов в
организме, помогая ему бороться с заболеваниями. Здоровый организм имеет запас
щелочных веществ, которые он использует в случае необходимости.
Дисбаланс рН организма у большинства людей
проявляется в виде повышенной кислотности (состояние Ацидоз). В этом состоянии
организм плохо усваивает минералы, такие как кальций, натрий, калий и магний,
которые, благодаря избыточной кислотности, выводятся из организма. От
недостатка минералов страдают жизненно важные органы. Не выявленный вовремя
ацидоз может вредить организму незаметно, но постоянно в течение нескольких
месяцев и даже лет. Злоупотребление алкоголем часто приводит к ацидозу. Ацидоз
может возникать, как осложнение диабета.
Выводы и рекомендации
1. В ходе проведенной работы наша цель
определение химического состава воды, подаваемой системами водоснабжения и
предназначенной для потребления населением для питьевых и бытовых целях, а
также колодезная вода после различной обработки была достигнута.
2. Мы определили рН для питьевой и
хозяйственно-бытовой воды. Оптимальным считается уровень рН в диапазоне от 6 до
9. Вся анализируемая вода соответствует данным требованиям. Наиболее лучшие
результаты получила чистая вода, она оказалась близкой к дистиллированной воде.
. Следующей задачей было определить
карбонатную жесткость воды методом нейтрализации. Большая жесткость ухудшает
органолептические качества воды, придает ей горьковатый вкус и оказывает
отрицательное действие на органы пищеварения. Хотя
очень мягкая вода не менее опасная, чем излишне жесткая. Самая активная - это
мягкая вода. Мягкая вода способна вымывать из костей кальций. У человека может
развиться рахит, если пить такую воду с детства, у взрослого человека становятся
ломкие кости. Есть еще одно отрицательное свойство мягкой воды. Она, проходя
через пищеварительный тракт, не только вымывает минеральные вещества, но и
полезные органические вещества, в том числе и полезные бактерии.
С этой точки зрения лучшей является вода
компании "чистая вода", а также кипяченая и после отчистки фильтром
марки "Аквафор". А колодезная и церковная обладает большой
карбонатной жесткостью. Уменьшить ее можно путем кипячения или пропускания
через фильтр.
. Также мы определили окисляемость воды методом
перманганатометрии. Норматив 3 мг О2/л. - это общая концентрация кислорода,
соответствующая количеству иона перманганата (МnО4-), потребляемому при
обработке данным окислителем пробы воды), который характеризует меру наличия в
воде органических (бензин, керосин, фенолы, пестициды, гербициды, ксилолы,
бензол, толуол) и окисляемых неорганических веществ. Органические вещества,
обусловливающие повышенное значение перманганатной окисляемости, отрицательно
влияют на печень, почки, репродуктивную функцию, а также на центральную нервную
и иммунную системы человека. По данным исследования вся вода соответствует
нормативу.
5. Остаточный хлор в воде отсутствует.
. Наилучшие показатели имеют вода
компании "Чистая вода" и вода, прошедшая отчистку фильтром "Аквафор".
Выгоднее, на наш взгляд, приобрести фильтр. Так как время его действия около
трех месяцев при цене 120 рублей. А 20 литров бутылированной воды компании
"Чистая вода" стоит 50 рублей.
. При сравнении проб колодезной и
освещенной воды мы столкнулись с интересным фактом. По исследуемым показателям
церковная вода имеет меньшие результаты, чем колодезная. С чем это связано мы
объяснить не можем.
Список литературы
1. "Курс общей
химии" под редакцией Н.В. Коровина,1998 год;
2. "Неорганическая
химия" М.А. Тамаров, 1993 год;
. Методика выполнения
измерения 2-23-99;
. Методика выполнения
измерения 2-24-99;
. Методика выполнения
измерения 2-38-2000;
. Методика выполнения
измерения 2-48-00;
. Методика выполнения
измерения 2-55-01;
. "Большая энциклопедия
эрудита" "Махаон" Москва, 2004 год;
. И.В. Сименова
"Промышленная экология" Москва, 2009год;
. Л.К. Садовникова, Д.С.
Арлов, И.Н. Лозановская "Экология и охрана окружающей среды" Москва,
2008год.