Современные методы хирургического лечения доброкачественной гиперплазии предстательной железы
Курсовая работа
по оперативной хирургии и
топографической анатомии по теме:
"Современные методы
хирургического лечения доброкачественной гиперплазии предстательной
железы"
Содержание
1. Введение
2. Тема, цели и задачи выполненной работы
3. Хирургическая анатомия предстательной железы
4. Традиционные методы хирургического лечения ГППЖ
4.1 Чреспузырная аденомэктомия “вслепую”
4.2 Чреспузырная аденомэктомия “на глаз”
4.3 Промежностная аденомэктомия
5. Современные методы хирургического лечения доброкачественной
гиперплазии предстательной железы
5.1 Основы электрохирургии простаты
5.2 Оборудование и инструменты
6. Общая техника трансуретральной резекции (тур) при
оброкачественной гиперплазии простаты (ДГП)
6.1 Общие положения
6.2 Варианты ТУР
6.3 Проведение инструмента по уретре. Эндоскопическая анатомия ДГП
6.4 Резекция ткани (техника срезов)
6.5 Коагуляция кровеносных сосудов (техника гемостаза)
6.6 Основные правила техники трансуретральной резекции ДГП
7. Специальная техника трансуретральнои резекции при
доброкачественной гиперплазии простаты
7.1 Удаление ДГП небольших размеров
7.2 Удаление ДГП средних и больших размеров
8. Интраоперационные осложнения
9. Новые методы трансуретральнои электрохирургии доброкачественной
гиперплазии простаты
9.1 Инцизия простаты
9.2 Электровапоризация простаты
9.3 ТУР-вапоризация простаты
10. Вывод
Литература
Приложения
1.
Введение
Доброкачественная гиперплазия (“аденома”) простаты (ДГП) -
одно из самых распространенных урологических заболеваний мужчин пожилого и
старческого возраста. По данным эпидемиологических исследований
симптоматическая ДГП наблюдается у 40 % мужчин в возрасте от 50 до 60 лет, у 50
% - после 60 лет, и у 90 % - после 80 лет.
Причины развития ДГП окончательно не установлены. Важное
значение в патогенезе заболевания придается изменению метаболизма андрогенов и
накоплению дигидротестостерона в клетках простаты, увеличению количества
цитоплазматических рецепторов, повышающих функциональную активность
простатической клетки, а также соотношению андрогенов и эстрогенов в организме
к другим факторам.
ДГП характеризуется увеличением количества клеток переходной
зоны и периуретрального отдела предстательной железы (т. н. стромальной части
простаты - см. приложение № 1), что приводит к механическим и функциональным
расстройствам мочеиспускания, вплоть до полного его прекращения. Пациенты с
начальными стадиями ДГП предъявляют жалобы на затруднение и задержку
мочеиспускания, вялую струю мочи, чувство неполного опорожнения мочевого
пузыря, примесь крови в моче, учащение ночного мочеиспускания, а также
императивные позывы к мочеиспусканию и неудержание мочи. В более поздних
стадиях присоединяются симптомы парадоксальной задержки мочеиспускания (ishuria
paradoxa) и хронической обструктивной уропатии с азотемической интоксикацией.
В настоящее время основным методом лечения ДГП остается
оперативный, среди многочисленных способов которого наиболее эффективным и
популярным является трансуретральная резекция (ТУР) простаты. Так, по
материалам Американской урологической ассоциации (AUA) за 1992-1996 гг. из всех
хирургических и инвазивных вмешательств по поводу ДГП, ТУР выполнялась у
69,2-93,3 % больных.
Успешно развивающиеся новые методы лечения ДГП, такие как
современная лекарственная терапия, гипертермия, различные варианты
термотерапии, криотерапия, лазерная и ультразвуковая аблация, использование
простатических стентов, баллонная дилатация простаты и др. находятся в стадии
изучения и, несмотря на ряд преимуществ (меньшая инвазивность, отсутствие
кровотечения, простая техника и др.), имеют свои недостатки, ограниченные
показания и уступают по эффективности и радикальности лечения трансуретральной
электрохирургии простаты. Таким образом, ТУР простаты в настоящее время
общепризнанно является “золотым стандартом” в лечении ДГП.
ТУР - это разновидность эндоскопической электрохирургической
операции, при которой удаление тканей (резекция) и коагуляция сосудов
осуществляется электрическим током высокой частоты при помощи специального
эндоскопического инструмента - резектоскопа, проведенного по просвету уретры.
История трансуретральной электрохирургии насчитывает немногим
более 100 лет. Прообраз современного резектоскопа был создан М. Stern и J.
McCarthy в 1926-1930 гг., и с этого времени ТУР стала широко применяться в
лечении заболеваний уретры, простаты и мочевого пузыря. Большой вклад в
развитие трансуретральной: электрохирургии внесли ученые и врачи Н.А. Лопаткин,
В.Я. Симонов, A. M. Няньковский, Л.И. Дунаевский, Н. Young, J. Blandy, R.
Barnes, R. Nesbit, H. Hopkins, H. Reuter, J. Iglesias, W. Mauermayer, R.
Hartung, E. Matoushek и др.
В Научно-исследовательском институте урологии МЗ России
(директор - академик РАМН Н.А. Лопаткин) с 1982 г. выполнено более 14000
трансуретральных эндоскопических вмешательств по поводу различных заболеваний
нижних и верхних мочевых путей, в том числе и ДГП. Опыт подтверждает ряд
несомненных преимуществ ТУР перед традиционной открытой простатэктомией (а
декомэктомией): снижение травматичности вмешательства и количества осложнений,
сокращение сроков пребывания больного в стационаре и реабилитационного периода,
возможность восстановления мочеиспускания у больных с выраженными
интеркуррентными заболеваниями, возможность повторения вмешательств без
повышения риска для больного, снижение инвалидизации больных, косметический
эффект и др.
Следует, однако, подчеркнуть, что ТУР простаты - это одна из
самых сложных и ювелирных операций во всем спектре трансуретральной
эндохирургии, требующая хороших знаний “прикладной" эндоскопической
анатомии и навыков выполнения инструментальных эндоскопических манипуляций.
Пассивным наблюдением научиться трансуретральной эндохирургии невозможно -
ученик должен иметь в руках резектоскоп, а обучающий - специальное
приспособление для наблюдения за операцией (оптический “шпион” или видеокамеру
с видеомонитором). Не вызывает сомнений, "что к самостоятельному
выполнению подобных операций можно приступать только после прохождения
специального курса обучения, при этом, среди специалистов принято считать, что
научиться правильно делать ТУР простаты можно только после самостоятельного
выполнения 100-200 подобных вмешательств.
В данном руководстве основное внимание уделяется практическим
аспектам эндоскопической электрохирургии ДГП, и лишь кратко рассматриваются
вопросы, связанные с возможностями трансуретрального лечения сопутствующих
заболеваний - стриктур уретры, камней мочевого пузыря и др. [3, с.123 - 145]
доброкачественная гиперплазия предстательная
железа
2.
Тема, цели и задачи выполненной работы
Тема:
Современные
методы хирургического лечения доброкачественной гиперплазии предстательной
железы
Цель:
Оценить
эффективность трансуретрального метода резекции предстательной железы в
сравнении с традиционными методиками
Задачи:
.
Изучить анатомические особенности области предстательной железы
.
Рассмотреть существующие традиционные методы хирургического лечения данной
патологии
.
Изучить современные методы хирургического лечения доброкачественной гиперплазии
предстательной железы
4. Провести сравнительный анализ эффективности и безопасности
различных видов хирургического лечения доброкачественной гиперплазии
предстательной железы
3.
Хирургическая анатомия предстательной железы
Предстательная железа (prostata) (см. приложение № 25) -
непарный железисто-мышечный орган, расположенный между мочевым пузырем и
мочеполовой диафрагмой. Со всех сторон железа охватывает простатическую часть
мочеиспускательного канала. Форма ее напоминает каштан. Длина железы 4-4,5 см,
ширина 2,5-3 см, толщина 1,4-2 см. Вес железы в среднем равен 20 г. У мужчин
пожилого возраста нередко развивается аденома предстательной железы, в
результате чего ее размеры и вес значительно увеличиваются.
В предстательной железе различают: основание (basis
prostatae), обращенное кверху, верхушку (apex prostatae), обращенную кверху, и,
кроме того, переднюю, заднюю и боковые поверхности. Передняя поверхность
направлена к задней поверхности лобкового сочленения и фиксирована к нему
лобково-предстательной связкой (lig. puboprostaticum). Здесь же к
предстательной железе примыкает венозное сплетение (plexus venosus vesicalis).
Задняя поверхность ее прилежит к передней стенке прямой кишки. Между ними
расположен тонкий слой клетчатки и пузырнопрямокишечная фасция (septum recto
vesicale). По средней линии задней поверхности предстательной железы имеется
бороздка, которая делит ее на правую и левую доли. Между ними находится
перешеек или средняя доля. Своим основанием железа тесно сращена с шейкой
мочевого пузыря. К заднему участку основания предстательной железы примыкают
нижние отделы семенных пузырьков и семявыносящих протоков. Последние вступают в
предстательную железу на ее основании позади уретры в углубление, получившее
название воронки предстательной железы (infundibulum prostatae). Предстательная
железа со всех сторон окружена соединительнотканной капсулой (capsula
prostatae), которая является производной прямокишечной перегородки и наиболее
выражена позади, где она отделяет железу от прямой кишки. Снизу в образовании
капсулы принимает участие и диафрагмальная фасция (fascia diaphragmatis pelvis
superior).
Паренхима простаты состоит из альвеол, которые, группируясь,
образуют 30-50 отдельных долек, окруженных фиброзно-мышечными перегородками.
Каждая долька переходит в проток (ductus prostaticus), который точечными
отверстиями открывается в простатическом отделе уретры на боковых поверхностях
семенного бугорка. Так как некоторые протоки объединяются, общее их количество
меньше количества долек. Последние концентрируются в основном в заднем и
боковых отделах железы, кпереди от уретры их почти не бывает. Здесь сильно
развита гладкая мышечная ткань, от которой и отходят междолевые перегородки,
собираясь вокруг уретры. Вся эта мышечная ткань получила название
предстательной мышцы (substantia muscularis), которая образует внутренний
непроизвольный сфинктер пузыря.
Кровоснабжение предстательной железы происходит из нижних
пузырных артерий (аа. vesicales inferiores), средних геморроидальных (аа.
rectales medii), а также предстательной артерии (a. prostatica), которая
отходит от a. pudenda interim. В области железы все эти артерии между собой
широко анастомозируют. Вены предстательной железы довольно многочисленны,
широко анастомозируют между собой, образуя мощное венозное сплетение (plexus
venosus prostaticus), располагающееся над предстательной железой. Указанное
сплетение принимает кровь из предстательной железы, мочевого пузыря, семенных
пузырьков и семявыносящих протоков plexus hypogastricus.
Лимфоотток от предстательной железы осуществляется в
трех направлениях:
) вдоль семявыносящих протоков к подвздошным лимфатическим
узлам;
) к подчревным лимфатическим узлам;
) к нижним поясничным лимфатическим узлам.
Иннервация предстательной железы осуществляется волокнами
plexus prostaticus, являющимися непосредственным продолжением plexus
hypogastricus inferior, и иннервируют преимущественно мышечную часть
предстательной железы. Секреторные волокна идут от n. hypogastricus. [5, с.56 -
79]
4.
Традиционные методы хирургического лечения ГППЖ
.1
Чреспузырная аденомэктомия “вслепую”
Больного укладывают на стол в горизонтальное положение с
несколько приподнятым тазом. Устанавливают постоянный катетер. Мочевой пузырь
промывают и заполняют кислородом. Разрезом длиной до 10 см строго по средней
линии от лобка по направлению к пупку рассекают кожу, подкожную клетчатку, поверхностную
фасцию, как при высоком сечении мочевого пузыря. Мышцы тупо раздвигают
крючками. Обнажают поперечную фасцию, предбрюшинную клетчатку и жировой слой,
которые тупо отслаивают кверху. Переходную складку брюшины также отслаивают
кверху. Стенку мочевого пузыря берут на держалки и между ними вскрывают его на
протяжении 2-3 см в продольном направлении. Указательный палец левой руки,
одетой в резиновую перчатку, вводят в прямую кишку и поддают им железу кверху.
Указательный палец правой руки, без перчатки, вводят в рану мочевого пузыря и
нащупывают железу. На 0,5-1 см от мочеиспускательного канала надсекают
слизистую и кончиком пальца проникают в слой между хирургической капсулой и
аденомой. Железу со всех сторон вылущивают и удаляют. Для остановки кровотечения
простатическое ложе тщательно тампонируют длинными марлевыми тампонами, концы
которых выводят из пузыря. В мочевой пузырь вводят дренажную трубку и рану
послойно ушивают до трубки и тампонов. Для предупреждения послеоперационных
стриктур в мочевом пузыре оставляют постоянный катетер. В предпузырное
пространство вводят полудренажную трубку. А.А. Померанцев и Foley рекомендуют
вводить в простатическое ложе специальный катетер-компрессор (см. приложения №
26-28).
4.2
Чреспузырная аденомэктомия “на глаз”
После вскрытия мочевого пузыря рану широко расширяют
зеркалами, благодаря чему получается широкий доступ к его шейке (см. приложение
№ 29). Циркулярным разрезом рассекают слизистую мочевого пузыря и капсулу
простаты. Указательным пальцем левой руки, введенным в прямую кишку, поддают
предстательную железу в полость мочевого пузыря, а указательным пальцем правой
руки, введенным в слой между аденомой и хирургической капсулой, тупо вылущивают
аденоматозные узлы. Через уретру вводят резиновый катетер и ложе предстательной
железы ушивают. Рану передней стенки мочевого пузыря закрывают двурядным швом
наглухо. В предпузырное пространство на сутки вводят дренажную трубку.
Для упрощения и ускорения проведения этой операции В.В. Гольдберг
предлагает применять следующие инструменты: два двулопастных самодержащих
расширителя раны брюшной стенки (см. приложение № 30, 1); двулопастный
ранорасширитель пузыря
(<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>);
мелкозубчатые зажимы для захватывания стенки пузыря
(<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>);
троакар-щипцы в комбинации с аспирационной трубкой для атравматического
вскрытия наполненного жидкостью пузыря
(<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>);
электронож с длинной рукояткой для слизистой оболочки вокруг внутреннего
отверстия уретры
(<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>);
металлическую дугу-проводник со съемной головкой для проведения уретральной
дренажной трубки
(<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>);
резиновую трубку диаметром 7-8 мм
(<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>);
зажим для тупого вскрытия мочевого пузыря
(<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>).
Операция Гринчака. По средней линии от лобка по направлению к пупку проводят разрез
кожи, подкожной клетчатки и апоневроза прямых мышц живота. Обнажают мочевой
пузырь и тупым зажимом вскрывают его по средней линии между двумя временно
наложенными лигатурами (см. приложение № 31). Рану расширяют в поперечном
направлении. Аденому вылущивают обычным приемом и приступают к ушиванию
простатического ложа. В мочевой пузырь вводят резиновый катетер и с каждой
стороны на задней полуокружности ложа накладывают два шва в виде буквы X. На
края раны простатического ложа накладывают глубокие поперечные швы. Рану
мочевого пузыря закрывают двумя кисетными швами. На брюшную стенку и кожу
накладывают глухой шов.
Из-за апоневротических образований прямых мышц живота не всегда
удается широко развести края раны и сделать аденомэктомию “на глаз”. В связи с
этим К.Т. Овнатанян предложил производить надлобковый дугообразный внебрюшинный
разрез. Для борьбы с кровотечением он рекомендует перевязывать внутренние
подвздошные артерии.
Операция К.Т. Овнатаняна. Надлобковым дугообразным разрезом с выпуклостью книзу на
протяжении 16-18 см рассекают кожу, подкожную клетчатку и апоневроз прямой
мышцы живота на 4 см выше лонного сочленения. Верхний лоскут апоневроза
отслаивают кверху (см. приложение № 32
<file:///D:\Мои%20документы\Зеркала%20медицинских%20сайтов\Атлас%20операций%20на%20мочеполовой%20системе\www.uroweb.ru\catalog\med_lib\ur_atl\prostata_04.htm>).
Тупо раздвигают прямые и пирамидальные мышцы и крючками широко разводят в
стороны. Брюшину отслаивают от левой боковой стенки таза, обнажают внутреннюю
подвздошную артерию и перевязывают. Затем проводят аналогичную манипуляцию с
другой стороны. После этого отслаивают кверху переходную складку брюшины и в
продольном направлении рассекают стенку мочевого пузыря между наложенными на
нее держалками. Рану мочевого пузыря широко расширяют и вылущивают аденому.
Специальным бужом через уретру в мочевой пузырь вводят хлорвиниловую трубку и
оставляют ее в виде постоянного катетера. Ложе предстательной железы ушивают.
Рану мочевого пузыря и передней брюшной стенки зашивают наглухо. В предпузырном
пространстве оставляют дренажную трубку на 24 часа.
4.3
Промежностная аденомэктомия
Техника операции. В уретру предварительно
вводят до шейки мочевого пузыря металлический катетер или буж. Больного
помещают на столе в гинекологическом положении и производят дугообразный
параректальный разрез или разрез в виде перевернутой буквы V (см. приложение №
33). Рассекают кожу, подкожную клетчатку и мышечную связку, соединяющую
передний конец наружного жома заднего прохода с задним концом
луковично-пещеристых мышц. Рану широко разводят, луковицу подтягивают кпереди,
обнажают и пересекают прямокишечно-уретральную мышцу. При этом ориентируются
при помощи бужа, введенного в уретру, в положении мочеиспускательного канала,
чтобы избежать его ранения.
Тупо отделив и отодвинув кзади прямую кишку, обнажают заднюю
поверхность предстательной железы (см. приложение № 34). Капсулу рассекают
боковым разрезом и тупо отделяют от аденоматозных узлов. Для удобства железу
захватывают окончатым зажимом или щипцами Мюзо. Буж из мочеиспускательного
канала удаляют, а канал в перепончатой его части пересекают. Аденому вылущивают
и удаляют из ложа. Через уретру в мочевой пузырь вводят катетер, на котором
соединяют края слизистой шейки мочевого пузыря и уретры. К простатическому ложу
на 48 часов подводят тампон, а через разрез уретры в мочевой пузырь - дренаж на
8-10 суток. После удаления дренажа в мочевой пузырь вводят постоянный катетер,
который извлекают по заживлении промежностной раны. [6, с.101 - 168]
5.
Современные методы хирургического лечения доброкачественной гиперплазии
предстательной железы
5.1 Основы
электрохирургии простаты
Ткань простаты, как большинство биологических тканей,
содержит электролиты и является электропроводной, что дает возможность
применять электрохирургию для лечения ее заболеваний. При ТУР простаты
используются два электрохирургических эффекта: резание и коагуляция.
Резание тканей (электротомия) происходит за счет сильного
термического воздействия, создаваемого электрохирургическим источником. Это
приводит к вапоризации (взрыву) клеточной жидкости, гибели клетки и диссекции
ткани в области электрической дуги (петли резектоскопа). Подобные физические
эффекты происходят в очень ограниченном объеме ткани, что обусловлено
конструкцией петли, разработанной специально для резания (в отличие от
электровапоризации - см. ниже). Для коагуляции индуцируется меньшая
температура, вызывающая более медленное “осушение" клетки, сжатие,
скручивание и, тем самым, закрытие рассеченных кровеносных сосудов, что
приводит к остановке кровотечения.
В основе резания и коагуляции лежат разные режимы работы
электрохирургического источника. Значение имеют мощность, большая при резании
(140-200 Вт - при резании и 60 - 100 Вт - при коагуляции) и форма электрической
волны, (постоянная синусоидальная при резании и прерывистая при коагуляции, см.
приложение № 2). Однако, важно знать, что электротомия сопровождается лишь
незначительным нагреванием окружающих тканей (поэтому рассеченные сосуды не
коагулируются, и остановки кровотечения не происходит), а коагуляция, наоборот,
вызывает значительное нагревание большого объема ткани, что может
сопровождаться повреждением более глубоких структур (например, прямой кишки,
“внутреннего” и “наружного” сфинктера мочевого пузыря и др.).
ТУР простаты - это разновидность радиочастотной
электрохирургии, так как применяемые источники энергии (диатермические
установки - радиотомы) работают на частоте выше 100 кГц (на практике 300 кГц -
5 мГц). Это обусловлено тем, что меньшая частота воздействия вызывает выраженный
электролиз в клетках мышц и нервных окончаний, что проявляется в их стимуляции
и непроизвольных сокращениях. Подобные эффекты крайне нежелательны и опасны при
электрохирургических вмешательствах, особенно на полых органах.
Пациент при ТУР простаты является частью закрытой
электрической цепи. Энергия от генератора (диатермической установки) поступает
на активный электрод (петля резектоскопа), проходит через ткань простаты и
уходит на пассивный электрод (металлическая или силиконовая пластина) и обратно
в генератор (см. приложение № 3). Для ТУР простаты используется мовополярная
техника радиочастотной электрохирургии, так как активный электрод (петля
резектоскопа) имеет меньшую площадь поверхности, чем пассивный (нейтральный)
электрод. Во избежание термических повреждений площадь поверхности пассивного
электрода должна быть значительно большей, чем активного (высчитывается в
зависимости от мощности генератора и проводимости материала, из которого сделан
пассивный электрод).
5.2
Оборудование и инструменты
Операционная
ТУР простаты, как и другие эндохирургические вмешательства,
можно выполнять в обычной урологической операционной. Однако, состояние
современной урологической эндоскопии диктует необходимость создания специальной
эндоскопической операционной. Это обусловлено:
значительным увеличением количества больных, которым
производятся эндоскопические вмешательства, в том числе и комбинированные
(например: цистолитотрипсия и ТУР простаты и др.),
созданием большого количества нового инструментария и оборудования,
применяемого для эндоурологических вмешательств. Разнообразные инструменты и
аппараты должны быть под рукой хирурга, т.е. располагаться в этом же помещении,
что требует дополнительных площадей, условий хранения, а также условий для
мытья, дезинфекции и стерилизации оборудования.
Оптимальным для размещения эндоскопической операционной
является отдельное помещение, площадью не менее 20 м2, в котором
предусмотрено затемнение окон и учтены все стандарты оперблока (вентиляция,
свет, покрытие пола и стен, центральный контур заземления и др.). Все
электрооборудование в операционной должно быть заземлено!
Учитывая, что радиочастотное оборудование (радистом) при
работе генерирует электромагнитное поле, другое электронное оборудование
целесообразно размещать на расстоянии не менее 1-2 метров от него.
Основное
оборудование эндоскопической урологической операционной:
Управляемый операционный стол (основные движения: вверх-вниз,
опущенный головной конец - опущенный ножной конец), с подставками для ног и рук
и дренажной системой. Удобнее использовать стол на педальном электроприводе с
дренажной системой, связанной с канализацией;
Стул для хирурга на колесах с возможностью регулировки
высоты;
Диатермический аппарат (радистом) с двойной педалью для
резекции и коагуляции и “пассивным” электродом (см. приложение № 3 и № 4);
Источник “холодного” света с фиброволоконным световодом (см.
приложение № 5). Мощность источника не менее 150 Вт, длина световода 180-250
см;
Стерилизуемый подвесной (на электроприводе) или закрепленный
на штативе резервуар для подачи ирригационной жидкости. В специализированных
эндоскопических операционных нередко монтируется стационарная система
водоподготовки, обеспечивающая достаточное количество ирригационного раствора,
получаемого путем фильтрации (механические и биологические фильтры) из обычной
водопроводной воды (см. приложение № 6);
Наркозный аппарат и другое анестезиологическое оборудование,
в том числе и противошоковый набор;
Подвижные столики для инструментов (размер не менее 60 X 80
см) и для дополнительного оборудования (литотрипторы, аспираторы, катетеры и
др.);
Шкафы для хранения (стерилизации) инструментов; - Мойка для
чистки инструментов, а также разноразмерные емкости для жидкостной дезинфекции
и стерилизации.
Дополнительное
оборудование:
Подвижный рентгеновский аппарат или стационарный
рентген-урологический стол;
Контактные литотрипторы (ультразвуковой, пневматический,
электрогидравлический, лазерный);
Эндоскопический лазер (неодимовый: ИАГ, гольмиевый: ИАГ и
др.);
Жидкостные (роликовые) аспираторы;
Телевизионный монитор с видеокамерой и видеомагнитофоном -
эндоскопическая стойка;
Ультразвуковой сканер и др.
Ирригационные
растворы
Для ТУР простаты применяют стерильные изотонические растворы,
не содержащие большого количества электролитов (неэлектропроводные): 5 %
раствор глюкозы, 0,9 % раствор мочевины, 1,5 % раствор глицина, а также
официнальные апирогенные растворы для эндоскопии в упаковках по 3, 5, 7, 10
литров: “Purisol” (смесь), “Travenol" (1,5 % раствор глицина), “Cytal” (0,54%
раствор маннитола), “Sorbitol" (2,7% раствор сорбитола) и др.
Радиотом
(электрохирургический генератор)
Радиотом - диатермическая установка для электрохирургических
операций, в том числе и для ТУР простаты. Стандартный комплект одного из самых
распространенных в нашей стране радитомов “AUTOCON-TUR 27810" (“К. Storz”,
Германия), разработанный специально для трансуретральной электрохирургии,
включает:
генератор энергии,
силиконовый “пассивный” электрод (присоединяется к бедру
больного),
сетевой соединительный кабель (присоединяется к
соответствующему разъёму радиотома и электросети),
радиочастотный соединительный кабель (присоединяется к
соответствующему разъёму радиотома и резектоскопу),
заземляющий соединительный кабель (присоединяется к
соответствующему разъёму радиотома и центральному контуру заземления
операционной),
двойную педаль для резекции и коагуляции (присоединяется к
соответствующему разъёму радиотома).
В качестве примера типичного современного радиохирургического
аппарата, широко использующегося для ТУР простаты, приводим описание радиотома
“AUTOCON-TUR 27810" (рабочая частота 425 кГц), который имеет:
пятиступенчатое увеличение мощности на каждый из режимов
резания и коагуляции;
автоматический контроль подаваемой мощности, обеспечивающий
качественное выполнение функции резания (электротомии) и коагуляции на всех
пяти ступенях ее повышения. При этом для каждой ступени в аппарате используется
минимальная мощность энергии, расчитанная с учетом геометрии и размеров режущих
петель и коагуляторов, консистенции тканей, электропроводности стандартных
ирригационных растворов, глубины проникновения в ткани электродов, средней
скорости движения режущей петли и др.;
тестовую систему и систему безопасности, определяющую контакт
всех звеньев электрической цепи. Отсутствие какого-либо соединения
сопровождается световой и звуковой индикацией и автоматическим прерыванием
подачи энергии на электрод;
контрольный световой и звуковой сигнал в реэкиме резания и
коагуляции и др.
Большое значение в электрохирургии простаты придается
качеству функций резания (электротомии) и коагуляции, которое обеспечивается
работой радиотома. Это означает:
тонкую и ровную поверхность среза при любой скорости движения
и глубине проникновения в ткань режущей петли,
возможность дифференцировки тканей во время операции, -
возможность коагуляции глубоко расположенных зон, и, в то же время -
отсутствие поверхностных и глубоких некротических
повреждений,
возможность последующего гистологического исследования
срезанных тканей,
длительный срок эксплуатации петель и коагуляторов.
Радистом должен быть заземлен, находиться на расстоянии не
менее 1-2 метров от другого электронного оборудования и не применяться во
взрывоопасной среде.
Более современные и комплексные радиотомы, например
“AUTOCON-350”, могут применяться как для монополярной (например, ТУР простаты),
так и для биполярной электрохирургии (общая хирургия, гинекология и др.).
Отличительной их особенностью является более совершенная, контролируемая
микропроцессором, автоматическая подача минимальной мощности на каждую ступень
ее повышения, а также наличие трёх режимов коагуляции: “стандартной”,
“мягкой" и “распыленной”. В современных радиотомах предусмотрена также
цифровая индикация мощности отдельно на резекцию и коагуляцию, повышение выходной
мощности в режиме резания (обычно до 300 Вт), а также наличие нескольких
режимов резания: “чистое резание”, “резание в сочетании с коагуляцией" и
др.
Резектоскопы
Резектоскоп - основной эндоскопический инструмент для
выполнения ТУР простаты. Существует большое количество разнообразных
конструкций резектоскопов, имеющих свои преимущества и недостатки.
Все многообразие инструментов можно подразделить на:
стандартные (простые) резектоскопы (см. приложение № 7),
состоящие из:
тубуса с изолирующим наконечником (клювом),
обтуратора,
рабочего элемента,
оптики (телескопа),
петель, коагуляторов, кюреток;
резектоскопы с постоянным промыванием (см. приложение
№ 7), обеспечивающие низкое давление ирригационной жидкости (типа Iglesias),
состоящие из:
наружного тубуса, перфорированного на дистальном конце,
внутреннего тубуса с изолирующим наконечником,
обтуратора,
рабочего элемента,
оптики (телескопа),
петель, коагуляторов, кюреток.
Гораздо реже применяются специально разработанные ротационные
резектоскопы, ретро-резектоскопы и резектоскопы с увеличенной длиной
(видео-ТУР, чрезмерно длинная уретра и другие клинические ситуации).
Тубусы резектоскопов обычно изготовлены из металла и имеют на
дистальном конце неэлектропроводный изолирующий наконечник из тефлона или
керамики, предотвращающий замыкание электродов на контур резектоскопа. Чаще для
ТУР простаты применяют тубусы резектоскопов с “косым” и “коротким" клювом
(см. приложение № 8), реже - с “прямым" (резектоскоп типа Mauermayer). На
проксимальном конце тубусов имеется стандартный замок для жесткого соединения с
обтуратором или рабочим элементом, а также кран для жидкости (Люер-тип) или
ирригационный механизм с центральным клапаном, обеспечивающий приток и отток
ирригационной жидкости.
Обтураторы применяются для проведения тубусов резектоскопов
по уретре в мочевой пузырь. Различают:
неоптические обтураторы, подразделяющиеся на “стандартные”,
“отклоняемые” (управляемые) и “атравматичные” (см. приложение № 9). В
“отклоняемых” обтураторах имеется приспособление для управляемого отклонения
дистальной части обтуратора, что позволяет более легко преодолевать
фиксированный изгиб уретры при проведении резектоскопа в мочевой пузырь. У
“атравматичного" обтуратора предусмотрен расширяющий механизм диета льного
конца, что в соединении с тубусом резектоскопа создает “телескопичность”
системы и нивелирует зазор меясду тубусом и обтуратором;
оптические обтураторы, имеющие атравматичный дистальный конец
и прямую оптическую систему (телескоп 0°), что позволяет провести инструмент по
уретре “на глаз” с минимальной травмой (см. приложение № 9). Подобные
обтураторы бывают с мостиком для проведения направителя (мочеточникового
катетера, струны-проводника) или без него.
Рабочие элементы резектоскопов разнообразной конструкции (см.
приложение № 10) обеспечивают механическое и электрическое подсоединение
электродов (петель, коагуляторов) и их продольные движения, а также фиксацию
оптической системы. Радиочастотный кабель, несущий энергию от радиотома,
присоединяется к специальному разъёму рабочего элемента, который может быть
либо внутри, либо снаружи. Конструкция разъёма рабочего элемента долж: на
соответствовать конструкции разъёма радиочастотного кабеля и конструкции
электродных контактов, что находит свое отражение в маркировке резектоскопа.
Оптическая система резектоскопа (см. приложение № 11)
обеспечивает эндоскопическую видимость тканей и электродов, а также
освещенность объекта. В резектоскопах обычно применяется ригидная оптика, в
металлическом корпусе которой находится как система переноса изображения,
построенная из стержневидных линз (Hopkins), так и система передачи света,
образованная пучком фиброволоконных световодов. Освещенность объекта в подобных
оптических системах во многом зависит от мощности ламп источника “холодного”
света. К основным характеристикам оптической системы относятся: угол
направления наблюдения, угол поля зрения, разрешающая способность и увеличение.
Увеличение оптики позволяет составить истинное представление
об объекте, и в урологии задается в пределах 1-2 крат.
Стандартная длина и диаметр оптических систем обычно
позволяет использовать их для различных эндоскопических инструментов (одной
фирмы) - резектоскопов, цистоскопов, уретротомов и др. Совместимость телескопов
с различными светопередающими устройствами (разных фирм) обеспечивается
съемными металлическими переходниками-соединителями, расположенными на окуляре
оптики.
Петли, коагуляторы, кюретки (см. приложение № 12).
Стандартные режущие петли изготовлены из термостойкой металлической проволоки,
диаметром 0,35 мм (возможны варианты 0,30 ммс и 0,40 мм) и маркированы, как и
коагуляторы, по цвету в соответствии с конструкцией рабочего элемента и
диаметром используемого резектоскопа (например, у фирмы “К. Storz”:
одноконтактные - двухконтактные; желтые - 24/26 Fr, коричневые - 27/28 Fr и
др.). Для ТУР простаты применяются в основном угловые петли, и лишь иногда, для
удаления апикальных частей ДГП - прямые петли.
Для коагуляции кровоточащих сосудов и тканей применяют
точечный коагулирующий электрод, конический коагулирующий электрод и шариковый
коагулирующий электрод с диаметром шарика 3-5 мм.
Для рассечения тканей простаты и шейки мочевого пузыря
применяют электрод в виде крючка (Hook) или точечный коагулирующий электрод.
Для удаления крупных фрагментов срезанной ткани, сгустков
крови, а также фрагментов камней, оставшихся после цистолитотрипсии, и
инородных тел, нередко применяют плоские и круглые металлические кюретки. Их
используют для того, чтобы не испортить гораздо менее прочную режущую петлю.
Для электровапоризации - одного из новых способов
электрохирургического лечения ДГП, использующего техническую и инструментальную
базу ТУР (см. главу 10.2), разработаны вапоризирующие петли и электроды
разнообразной конструкции (см. приложение № 13). Их маркировка также зависит от
конструкции рабочего элемента и диаметра резектоскопа. [4, с.34 - 89]
6. Общая
техника трансуретральной резекции (тур) при оброкачественной гиперплазии
простаты (ДГП)
6.1 Общие
положения
ТУР простаты - это оперативное пособие, которое должно
проводиться в условиях урологической (эндоскопической) операционной.
В трансуретральной хирургии принято условное разделение
гиперплазированных желез по размерам (объему) или массе:
ДГП небольших размеров: объем ДГП до 40 см3,
около 40 г.;
ДГП больших размеров: объем ДГП более 80 см3,
более 80 г.
Выбор метода обезболивания определяется конкретной
клинической ситуацией и зависит от возраста пациента, состояния его органов и
систем, размера ДГП, предположительной длительности и вида трансуретральной
операции и др. Обычно применяют эпидуральную или спинномозговую анестезию, и
лишь по особым показаниям - внутривенный или эндотрахеальный наркоз. С
профилактической целью нередко парэнтерально вводят антибиотики широкого спектра
действия.
Положение больного на операционном столе для выполнения ТУР
простаты называется “литотомическим" (цистоскопическим) - лежа на спине с
приподнятыми и согнутыми в коленях ногами. Поверхность операционного стола
должна иметь неэлектропроводную (“изолирующую”) прокладку. Обе голени больного
фиксируют к подставкам для ног. На дистальную треть бедра больного (выбритую
при значительном оволосении) закрепляют “пассивный” электрод, обращая внимание
на то, чтобы вся его поверхность плотно прилегала к коже. При необходимости
проводят дополнительное крепление “пассивного" электрода резиновым бинтом.
Хирург выполняет ТУР простаты в положении сидя, располагаясь
на подвижном стуле между ног горизонтально лежащего больного. Положение
больного на столе с опущенным ножным концом облегчает трансуретральное удаление
дорсальной (задней) части ДГП, положение больного с опущенным головным концом -
вентральной (передней) части ДГП. В строго горизонтальное положение больного
нередко приводят при резекции боковых долей и апикальной части ДГП.
Помимо хирурга в операционную бригаду входят:
операционная сестра, санитарка, анестезиолог и анестезистка. Обработка
операционного поля (половые органы, промежность, живот от пупка и ниже,
проксимальная часть бедер) производится по обычным правилам. Стерильными
простынями укрывают ноги и живот пациента таким образом, чтобы при случайном
намокании они не касались металлических поверхностей стола. По показаниям
(возраст, анамнез, инфекция мочевых путей, эпицистостома, камни мочевого пузыря
и др.) проводят вазорезекцию.
6.2 Варианты
ТУР
Термин “трансуретральная резекция простаты” - это
универсальное и, на наш взгляд, чрезмерно общее название определенного способа
лечения. Необходимо различать варианты ТУР (см. приложение № 14), более точно
отражающие суть предпринятой операции:
“псевдо-ТУР”: удаляется лишь небольшая часть
гиперплазированной ткани (10-20% объёма, не более 10-15 г) преимущественно из
области шейки мочевого пузыря, или часть средней доли ДГП (создание “мочевой
дорожки”);
“парциальная ТУР”, удаляется 30-80%
гиперплазированной ткани с образованием более или менее выраженного
конусовидного канала в простатической части уретры. Гиперплазированная ткань
обычно остается по периферии боковых долей, в апикальной и вентральной зоне. В
зависимости от объёма резекции “парциальную ТУР" подразделяют на
“паллиативную ТУР" и “субтоталъную ТУР”;
“тотальная ТУР" (трансуретралъная
простатэктомия): удаляется практически 90 - 100% объёма гиперплазированной
ткани, что соответствует открытой операции.
“радикальная (субрадикальная) ТУР”: в лечении ДГП не
применяется, а используется лишь для лечения начальных стадий рака простаты,
предполагая удаление всех простатических тканей вместе с капсулой.
Принципиально важным является соблюдение определенного
принципа: при прочих равных условиях и отсутствии противопоказаний ТУР
должна означать транс уретральную простатэктомию. Такое положение имеет
научное обоснование (анатомия и кровоснабжение простаты, процессы раневого
заживления, рецидивы и “ложные" рецидивы заболевания) и, как показывает
практика, при ее выполнении достигаются наилучшие результаты лечения. Конечно
же, по показаниям (пожилой возраст, интраоперационные осложнения,
сердечно-сосудистые заболевания и др.), могут быть предприняты любые варианты
ТУР.
6.3
Проведение инструмента по уретре. Эндоскопическая анатомия ДГП
Уретра содержит физиологические сужения и изгибы, которые
могут препятствовать проведению тубуса резектоскопа в полость мочевого пузыря.
В ряде случаев встречаются также патологические изменения мочеиспускательного
канала - стриктуры уретры различной протяженности и локализации. К историческим
методам, применявшимся ранее, относится повторная катетеризация
мочеиспускательного канала за несколько дней до трансуретральной операции.
В настоящее время широко применяется бужирование
мочеиспускательного канала изогнутыми металлическими бужами до 30 Fr (по шкале
Шаррьера) непосредственно перед проведением резектоскопа. Однако, подобная
манипуляция может вызвать множественные надрывы слизистой оболочки и
подслизистого слоя по окружности мочеиспускательного канала, что в последующем
приводит к рубцеванию и возможному образованию стриктур.
Альтернативной методикой является проведение
“превентивной" уретротомии по методике Otis. В том случае, если достаточно
обработанный хирургическим гелем (Instillagel, Cathejell, Лигентен) тубус
резектоскопа с обтуратором под действием собственной тяжести встречает
препятствие при прохождении по уретре (в которую также вводится гель),
инструмент извлекается, вводится уретротом Otis и производится продольное
рассечение уретры до размера, большего на 5 Fr, чем размер применяемого тубуса
- в большинстве случаев до 30 Fr. Рассечение производится исключительно в
области передней уретры и по передней (вентральной) ее поверхности. Мы редко
применяем подобные методики и используем, в основном, металлический
конусовидный буж для дилатации передней уретры.
Исключительно важным моментом является атравматичное
проведение тубуса резектоскопа в мочевой пузырь (см. приложение № 15). Отказ от
применения силы, дополнительное бужирование уретры или уретротомия, а также
использование оптического обтуратора позволяют избежать таких начальных
интраоперационных осложнений, как перфорация уретры, простаты и мочевого
пузыря, образование ложных ходов, кровотечение и др. Это же служит
профилактикой образования стриктур уретры в отдаленные сроки после ТУР.
После проведения тубуса резектоскопа в мочевой пузырь
обтуратор извлекается, и к нему подсоединяется заранее собранный рабочий
элемент с оптикой и электродом (например, петлей). К инструменту подключают
радиочастотный кабель, фиброволоконный световод и ирригационную систему.
Осмотром задней уретры и шейки мочевого пузыря заканчивается
диагностический этап, принимается окончательное решение о выборе оптимального
метода лечения (открытая простатэктомия, трансуретральная резекция, инцизия
простаты и др.), и в случае проведения ТУР составляется точный план
эндоскопической операции (см. приложение № 16).
6.4 Резекция
ткани (техника срезов)
Электрохирургическое удаление ткани простаты при ТУР
производится по всей окружности задней уретры. Когда удаляется дорсальная
(задняя) часть ДГП, основная рабочая рука хирурга, располагаясь в рабочем
элементе находится ниже оси резектоскопа. Для удаления вентральной (передней)
части ДГП инструмент поворачивается на 180° вокруг своей оси, что нередко
требует смены положения пальцев в рабочем элементе, и тогда рука хирурга
располагается выше оси резектоскопа.
Для резекции ткани обычно применяют антеградные срезы,
направленные от мочевого пузыря к семенному бугорку:
срезы с предопределенной конечной точкой резекции
предполагают удаление ткани, располагающейся между петлей и “режущей” кромкой
(изолированным наконечником) тубуса резектоскопа. При неподвижном инструменте
такой срез (возврат выдвинутой петли в тубус резектоскопа) осуществляется
только за счет движения петли в рабочем элементе и заканчивается в определенной
(“предопределенной”) конечной точке, располагающейся у видимой на глаз “режущей
кромки” неподвижного резектоскопа. Техника срезов с предопределенной конечной
точкой резекции является самой безопасной и поэтому используется чаще всего,
особенно при ТУР ДГП небольших размеров и при удалении апикальной части
простаты;
продленный срез предполагает удаление ткани не только за счет
движения петли в рабочем элементе, но и за счет продольного обратного движения
всего резектоскопа, что позволяет увеличить длину удаляемого фрагмента ткани и
сократить время операции. Подобные срезы считаются наименее контролируемыми и
применяются в основном при ТУР ДГП средних и больших размеров. При небольших
железах прямые продленные срезы обычно не применяют, так как весьма вероятна
травма “наружного сфинктера" мочевого пузыря. Ряд хирургов при резекции
ткани не используют “режущую кромку” резегстоскопа, осуществляя срезы только за
счет продольных и угловых движений всего инструмента при практически
неподвижном рабочем элементе в котором создается всегда выдвинутое вперед (за
пределы тубуса) положение режущей петли. Несомненно, что подобная техника
срезов хороша только в руках опытного хирурга.
Ретроградные срезы (“проградные” срезы) применяют нечасто, в
основном для выравнивания поверхности ложа удаленной железы и при работе в
области шейки мочевого пузыря и апикальной части ДГП.
В зависимости от глубины погружения режущей петли в ткань,
срезы могут быть поверхностными, промежуточными и глубокими. Различают также
короткие и длинные срезы. Для удаления ткани в области шейки мочевого пузыря и
семенного бугорка чаще применяют короткие и поверхностные срезы, для удаления
основной массы ткани в “безопасных" зонах - длинные и глубокие срезы.
Правильно осуществленный срез образует фрагмент ткани, имеющий форму лодки.
Современная техника ТУР предполагает и правильное
пространственное расположение срезов ткани. Принимая во внимание, что
макроскопически “аденома” имеет форму сферы (каштана) с более или менее
центрально проходящим через нее каналом (уретра), вполне понятно, что для
удаления ткани и высвобождения капсулы требуются срезы, направленные под углом
к оси уретры. В целом, чем меньше этот угол, тем более длинные срезы можно
совершить, используя всю длину выдвинутой за пределы тубуса петли, а значит
затратить меньше времени на удаление ткани. Практика показывает, что
косо-продольное пространственное расположение срезов при удалении основной
массы передней и боковых долей ДГП позволяет легче ориентироваться во время
операции, создает лучшие гидродинамические условия для ирригационной жидкости
(улучшение эндоскопической видимости) и позволяет более радикально удалить
гиперплазированную ткань. При этом, учитывая геометрический фактор, опытные
хирурги применяют закругленные (конвексные) срезы. Ось движения резектоскопа
проходит в области мембранозного отдела уретры: короткая часть такого рычага
располагается в простатическом отделе уретры, а длинная - в висячем отделе и
вне тела пациента. При выполнении конвексных срезов хирург увеличивает наружные
движения резектоскопа, отклоняющие его от оси уретры, и, тем самым, создает
условия для обнажения капсулы простаты по всей ее окружности. Обычно конвексные
срезы бывают продленными.
6.5
Коагуляция кровеносных сосудов (техника гемостаза)
При любой операции резекция и гемостаз идут рука об руку -
любые пересеченные кровеносные (особенно артериальные) сосуды должны быть
незамедлительно коагулированы. Тщательный гемостаз является одним из тех
фундаментальных факторов, на которых основывается весь подход к
трансуретральной резекции.
Основные правила гемостаза:
. Операционное поле должно осматриваться при
минимальном ирригационном давлении.
2. Сгустки, перекрывающие поле зрения, должны быть
эвакуированы.
. Для достижения оптимальной видимости необходимо
тщательно обработать зону резекции путем поверхностных, сглаживающих срезов.
. Коагуляция венозных сосудов должна предприниматься
после коагуляции всех артериальных стволов. При этом коагулироваться должны
преимущественно крупные венозные сосуды для уменьшения площади некроза.
. В конце вмешательства целесообразно проведение
окончательного осмотра дистальных и проксимальных границ операционного поля при
минимальном ирригационном давлении (15 - 20 мм води, ст.), чтобы не остались
просмотренными никакие сосуды.
. При пересечении венозных синусов необходимо
произвести более тщательный осмотр оставшихся артериальных кровоточащих
сосудов, т.к. качество артериального гемостаза уже не может быть оценено по
цвету промывной жидкости.
. Никогда не следует рассчитывать на спонтанный или
фармакологический гемостаз.
6.6 Основные
правила техники трансуретральной резекции ДГП
Вся операция ТУР, не смотря на различные варианты техники (о
которых будет сказано ниже), всегда должна быть условно разделена на три
основные стадии (см. приложение № 17):. Удаление ткани в виде конуса. Основная
масса гиперплазированной ткани резецируется в форме конуса, верхушка которого
лежит у семенного бугорка, а основание составляет окружность в области
“внутреннего сфинктера" мочевого пузыря. На данной стадии операции
удаляется приблизительно две трети от общей массы резецируемой ткани посредством
относительно быстрого проведения срезов без большого риска случайной травмы..
Высвобождение капсулы. Эта стадия операции обычно выполняется медленнее, чем
первая. “Воронка”, образованная в результате выполнения предыдущей стадии,
расширяется в дистальном направлении, На всем ее протяжении гиперплазированная
ткань удаляется до обнажения капсулы простаты и пересечения основных
кровеносных сосудов, которые должны быть незамедлительно коагулированы..
Удаление апикальной ткани (высвобождение параколликулярной области). В конце II
стадии операции остается лишь апикальная ткань, которая удаляется во время
заключительной, III стадии ТУР. Этот этап требует крайне осторожной и наиболее
точной техники выполнения и имеет большое значение для окончательного результата
ТУР. Превышение необходимого объема резекции будет означать недержание мочи,
недостаточный объем - нарушение мочеиспускания.
Хирург, выполняющий трансуретральное удаление простаты,
должен хорошо ориентироваться в эндоскопической анатомии ДГП и соблюдать границы
резекции. Проксимальной границей ТУР является так называемый “внутренний"
сфинктер мочевого пузыря, дистальной - область семенного бугорка и “наружного
сфинктера" мочевого пузыря. [5, с.58 - 104]
7.
Специальная техника трансуретральнои резекции при доброкачественной гиперплазии
простаты
За всю историю эндоскопической хирургии предложено большое
количество разнообразных вариантов техники трансуретральной резекции ДГП. В
своей основе все они имеют общие принципы удаления гиперплазированной ткани в
три стадии и, помимо этого, нередко совмещают отдельные технические элементы
других вариантов. В этой главе мы даем описание фундаментальных и наиболее
распространенных вариантов техники ТУР для удаления ДГП небольших, средних и
больших размеров, элементы которых присутствуют в любой операции подобного
типа. Следует учесть, что при наличии камней мочевого пузыря цистолитотрипсия
должна предшествовать ТУР.
7.1 Удаление
ДГП небольших размеров
этап. Создание борозды на 6 часах условного циферблата.
Резекция ткани начинается в положении на 6 часах условного
циферблата. В тех случаях, когда ретропростатическое пространство неглубокое,
из соображений безопасности срезы производятся по методике с предопределенной
конечной точкой резекции. Образуемая таким образом дорожка должна быть
расположена достаточно проксимально от уровня семенного бугорка. Для этого
производят серию коротких срезов от “внутреннего сфинктера" мочевого
пузыря по направлению к семенному бугорку при неглубоком погружении петли в
ткань. При ДГП небольших размеров (до 40 см3) уже первый срез может
обнажать волокна “внутреннего сфинктера" мочевого пузыря, которые имеют
циркулярное направление. Если этого не происходит, срезы производятся глубже,
до тех пор, пока волокна “внутреннего сфинктера" не станут видимыми на 6
часах условного циферблата.
этап: Расширение борозды в боковые стороны. В зависимости от
того, насколько ткань боковых долей выступает в просвет полости резекции,
борозда расширяется в боковые стороны, до тех пор, пока не образуется хорошо
видимый желоб циркулярных волокон в области “внутреннего сфинктера"
мочевого пузыря (от 5 до 7 часов).
этап: Углубление борозды до капсулы простаты. Этот этап
заключается в углублении зоны резекции от “внутреннего сфинктера" мочевого
пузыря до семенного бугорка продольно на всем протяжении. В ряде случаев, для
определения глубины простатической полости, полезным является поднятие ткани
вентрально пальцем, введенным в прямую кишку. В заключении 3 этапа полное
продольное обнажение дорсальной (задней) части капсулы простаты дает ориентир
для удаления боковых долей.
этап: Удаление основания боковых долей. Начало этапа
аналогично первоначальным 5-6-7 часовым срезам, только резекция ткани
производится слева или справа на 3-5 или 7-9 часах до тех пор, пока не обнажатся
волокна “внутреннего сфинктера" мочевого пузыря. В последующем зона
резекции распространяется дистально до уровня семенного бугорка. При этом
остается достаточный “защитный" слой апикальной ткани. Этап заканчивается
удалением ткани на противоположной стороне.
этап: Удаление вентральной ткани. Этот этап требует поворота
инструмента на 180° градусов на позицию 3-12-9 часов. Наиболее простым способом
является высвобождение волокон “внутреннего сфинктера" на одной из
вентральных сторон простатической полости (на 1-3 часах или 9-11 часах) как это
было отмечено в отношении предыдущих этапов резекции. В конце этапа
гиперплазированная ткань остается лишь в области верхушки простатической
полости от 11 до 1 часа.
этап: Резекция в области верхушки простатической полости
(вентральной части ДГП). Ткань простаты в этой области свободно свешивается в
просвет резецируемой полости и легко удаляется. По завершении резекции
полностью открываются волокна “внутреннего сфинктера" мочевого пузыря по
всей окружности. Также, как и после предыдущих этапов, остается небольшой объем
ткани в апикальной части ДГП.
этап: Резекция апикальной (параколликулярной) ткани. Удаление
ткани начинается по дорсальной поверхности задней уретры в непосредственной
близости от семенного бугорка на 3-5 или 7-9 часах условного циферблата. Срезы
в этой области должны быть преимущественно продольными, короткими и
поверхностными для того, чтобы не повредить “наружный сфинктер” мочевого
пузыря. Для безопасности и лучшей визуализации тканей нередко приходится
опускать инструмент глубоко в простатическую полость (что позволяет проводить
срезы, направленные по касательной к плоскости капсулы предстательной железы)
или поднимать ткань посредством пальца, введенного в прямую кишку.
Во избежание возможных ошибок при резекции ткани в
параколликулярной области следует учитывать ряд эндоскопических параметров:
а) Конфигурацию простатического отдела уретры. Даже на
последних этапах резекции боковые доли простаты сохраняют определенную
выпуклость, т.е. более или менее выражение выступают в просвет простатического
отдела уретры. При этом, они больше выступают в просвет резецированной полости
при опорожненное мочевом пузыре, чем при наполненном. Следовательно,
первоначальные срезы для удаления апикальной ткани ДГП должны выполняться при
опорожненном мочевом пузыре. Каждые несколько произведенных срезов должны
заканчиваться опорожнением мочевого пузыря до начала следующей серии срезов;
б) Эндоскопический вид поверхности ткани. До тех пор пока
ткань ДГП ясно распознаваема (мягкая, однородная, железистая структура
серо-желтого цвета), нет опасности повреждения замыкательного механизма
мочевого пузыря. Поскольку гиперплазированная ткань снаружи полностью
ограничена капсулой простаты, появление в поле зрения поперечной исчерченности
свидетельствует об обнажении капсулы и является сигналом к прекращению
резекции. При удалении гиперплазированной ткани в дорсальной части
параколликулярной области нередко обнаруживаются конкременты в выводных
протоках предстательной железы, что является важной границей для ориентировки.
До тех пор, пока конкременты определяются в поле зрения, можно быть совершенно
уверенным, что резекция производится в пределах “хирургической” капсулы.
В последующем зона резекции с дорсальной части
параколликулярной области распространяется на боковые и вентральную стороны.
При этом дистальная и проксимальная граница каждого среза не должна превышать
границ, образованных при предыдущих срезах.
Следует учитывать также тот факт, что просвет уретры
становится уже, так как меньшее количество “аденоматозной” ткани держит его в
раскрытом состоянии и капсула простаты в этой области может сокращаться до
размеров мембранозного отдела уретры.
7.2 Удаление
ДГП средних и больших размеров
Основной отправной точкой многочисленных способов
трансуретрального удаления средних и больших объемов ткани при ДГП является
прерывание кровоснабжения гиперплазированной простаты до начала удаления
основной массы ткани железы. Таким образом уменьшается кровопотеря во время
выполнения эндоскопической операции.
Все методики в своей основе также имеют общие принципы
удаления ткани в три стадии. Первоначально удаляется ткань в форме конуса с
основанием в области “внутреннего сфинктера" мочевого пузыря и верхушкой у
семенного бугорка. Во второй стадии резекции подобная “воронка” расширяется в
дистальном направлении с высвобождением капсулы, и в третьей стадии удаляется
апикальная ткань. Отличия касаются тактических деталей каждой из методик.
Подход определяется не только общей схемой, но и в значительной степени
конфигурацией “аденомы”. Так, при большой средней доле ДГП план действия будет
отличаться от такового при выраженной гиперплазии боковых долей железы. В
зависимости от опыта хирурга используют как срезы с предопределенной точкой
резекции, так и продленные срезы.
Методика NESBIT
Первое описание методики трансуретральной резекции при ДГП
больших размеров было сделано Nesbit в его книге “Трансуретральная
простатэктомия” в 1943 г. Метод состоит в создании глубокой борозды между
боковой стенкой простатической капсулы и гиперпластической тканью боковых долей
ДГП для отделения основной массы ткани железы от кровоснабжающих ее сосудов.
Далее эта ткань быстро удаляется с минимальной кровопотерей (см. приложение №
18).
Основным необходимым условием для применения подобной
методики являются достаточно большие размеры ДГП (более 60 - 80 см3),
которые позволяют создать подобную борозду. Незначительное увеличение боковых
долей или преобладание средней доли при гиперплазии простаты делают подобную
технику неподходящей.
Методика BARNES
В основе методики Barnes лежит подолевое удаление ДГП. Тем не
менее, как и другие методики, она включает в себя три основные стадии ТУР
простаты. Основным отличием данной методики является начало резекции в
дорсальной части ДГП - удаление средней доли. Помимо удаления ДГП средних и
больших размеров данная методика вполне применима и для ТУР небольших
гиперплазированных желез.
Оригинальная техника Barnes (1959 г.) была описана не так
полно, как это сделано Nesbit. Вкладом Barnes в общую технику трансуретральной
резекции было описание и оригинальные иллюстрации послойного удаления
простатических тканей. Методика Barnes имеет то преимущество, что операция
может быть завершена на любом этапе и в любое время, если этого требует
интраоперационная ситуация (вскрытие венозного синуса, перфорация, нарушения
системного кровообращения, анестезиологические проблемы и др.) (см. приложение
№ 19).
Методика ALCOCK И FLOCKS (см. приложение № 20).
Отличительной чертой метода Alcock и Flocks является горизонтальное
разделение боковых долей ДГП в их срединной точке, т.е. приблизительно на 3 и 9
часах условного циферблата. При ДГП больших размеров могут быть созданы
несколько горизонтальных дорожек с последующим удалением железы по частям, что
облегчает выполнение резекции. [2, с.78 - 90]
8.
Интраоперационные осложнения
Повреждение уретры в виде слущивания её слизистого (а иногда
и подслизистого) слоя возникает вследствие насильственного проведения
резектоскопа чрезмерно большого диаметра. Травмирует уретру изолирующий
наконечник тубуса резектоскопа, имеющий больший диаметр, чем обтуратор.
Предварительное бужирование уретры или уретротомия по Otis, а также применение
атравматичного или лучше оптического обтуратора в сочетании с достаточной
обработкой уретры и тубуса гелем являются профилактикой данного осложнения.
Перфорация уретры возникает также вследствие насильственного
проведения тубуса резектоскопа и несоблюдении правила “о выпрямлении уретры”
при проведении через нее ригидного инструмента (опускание полового члена при
прохождении проксимальных отделов уретры). Дистально от семенного бугорка
подобные перфорации обычно возникают в бульбозном отделе уретры на 6 часах
условного циферблата; проксимальнее от семенного бугорка перфорация уретры
часто сочетается с перфорацией простаты и может располагаться дорсально,
вентрально и латерально от оси уретры (см. приложение № 21). При дистолъной
перфорации возможны несколько вариантов ведения больного:
а) обнаружение “на глаз” просвета истинной уретры, проведение
резектоскопа в мочевой пузырь (под контролем пальца в rectum) и выполнение ТУР
простаты;
б) проведение в мочевой пузырь катетера Tiemann (с клювом) и
отсрочка операции;
в) при невозможности проведения вышеперечисленных мероприятий
- троакарная или открытая эпицистостомия.
При проксимальной перфорации необходимо найти “на глаз”
просвет истинной уретры и выполнить ТУР простаты, при этом перфорации простаты
должны быть ликвидированы в процессе ТУР. Отказ от выполнения вмешательства
даже при дренированном мочевом пузыре чреват развитием кровотечения из
перфорированной простаты. Профилактика перфораций такая же, как и профилактика
поверхностных повреждений уретры.
Перфорация капсулы простаты может быть закрытой и открытой и
возникает при чрезмерно глубоком погружении режущей петли в ткань и
недостаточной ориентации хирурга в процессе ТУР.
Закрытая перфорация капсулы характеризуется появлением в поле
зрения островков жировой клетчатки между отдельными пучками рассеченных
мышечных волокон малинового цвета. Подобные перфорации чаще всего встречаются у
начинающих хирургов в области шейки мочевого пузыря и в проксимальном отделе
простатической уретры (5-7 часов условного циферблата). Необходимо знать, что в
области закрытой перфорации дальнейшая резекция запрещена.
Если ТУР проводится на фоне низкого давления ирригационной
жидкости (цистостома, троакар Reuter, резектоскоп Iglesias или их сочетание),
то опытный хирург может продолжить ТУР. В других ситуациях, во избежании
значительных экстравазаций, операцию необходимо отложить.
Открытая перфорация имеет большее клиническое значение, так
как открывается прямой доступ ирригационной жидкости в парапростатическое или
паравезикальное пространство с развитием (при несвоевременном выявлении)
“водной интоксикации организма" (т. н. “ТУР - синдрома”). Чаще всего
открытая перфорация встречается в латеральных зонах пузырно-простатического
соединения (см. приложение № 22). В поле зрения видно отверстие, образованное
мышцами мочевого пузыря и капсулой (тканями) простаты. Клинически открытая
перфорация проявляется увеличением нижней половины живота и симптомами
раздражения брюшины. Подобные осложнения чаще всего требуют открытой
хирургической ревизии и коррекции в сочетании с профилактическим лечением “ТУР
- синдрома”.
Эрекция полового члена - довольно частое явление при
трансуретральных манипуляциях, которое в ряде случаев можно расценивать как
интраоперационное осложнение. Во-первых, эрегированный член препятствует
необходимому свободному круговому движению резектоскопа и, во-вторых, длины
обычного инструмента может не хватить для удаления проксимальных отделов ДГП. В
подобных ситуациях целесообразно выпустить жидкость из мочевого пузыря,
обернуть половой член салфетками, смоченными холодным раствором,
инфильтрировать корень полового члена местными анестетиками или использовать
резектоскоп с увеличенной длиной. Если это не помогает, то, по показаниям,
интракавернозно вводят адреналин (0,05-0,1 мл 0,1% раствора адреналина,
разведенного в 20 мл физиологического раствора). Возможно также выполнение
резекции простаты через промежностную уретростомию.
К редко встречающимся во время ТУР простаты осложнениям относят
перфорацию мочевого пузыря, брюшной полости и прямой кишки. Обычно такие
осложнения требуют оперативной ревизии и коррекции. В ряде случаев, при
небольшом отверстии в прямой кишке и надежно дренированном мочевом пузыре
(эпицистостома и уретральный катетер) возможно консервативное лечение путем
ректальной интубации на фоне массивной антибактериальной терапии и, нередко,
парентерального питания. При внебрюшинной перфорации мочевого пузыря без явных
признаков скопления большого количества жидкости в паравезикальной клетчатке
выполнение троакарной цистостомии и установка уретрального катетера в
большинстве случаев ликвидирует данное осложнение.
Профилактикой подобных осложнений является аккуратное и
технически грамотное выполнение операции. Ряд интраоперационных осложнений
(массивная кровопотеря, экстравазация, повреждение “наружного сфинктера"
мочевого пузыря, электроожоги и др.) обычно проявляются в послеоперационном
периоде. [7, с.111 - 205]
9. Новые
методы трансуретральнои электрохирургии доброкачественной гиперплазии простаты
На сегодняшний день ТУР остается “золотым стандартом” в
комплексном лечении ДГП. Однако, изучение ближайших и отдаленных результатов
показывает, что и этот метод лечения имеет свои осложнения и неудачи. В связи с
этим ведется активный поиск новых малоинвазивных, в том числе и
электрохирургических, методов лечения этого заболевания. Наряду с
совершенствованием методик традиционной ТУР, все большее значение в
повседневной урологической практике приобретают инцизия простаты, электровапоризация
простаты и ТУР-вапоризация простаты.
9.1 Инцизия
простаты
Рассечение (инцизия) простаты, хотя и относится к новым
методам трансуретральной электрохирургии ДГП, на самом деле была предложена в
конце 19-го века Bottini, который применял гальваноакустический инцизор для
рассечения гипертрофированной простаты. Операция проводилась вслепую и имела
множество осложнений, среди которых самым опасным было кровотечение из
простаты.
Предложенная Beer в 1930 г. трансуретралъная эндоскопическая
инцизия простаты получила распространение лишь в конце 70-х начале 80-х годов
этого столетия, когда стала относительно широко применяться вместо ТУР у
больных с обструкцией шейки мочевого пузыря и ДГП небольших размеров.
Показанием к рассечению простаты при доброкачественной
гиперплазии являются ее небольшие размеры (объем не более 30 см3) и
отсутствие “средней доли” - именно при этой ситуации инцизия простаты при ДГП
является наиболее эффективной и может считаться прямой альтернативой ТУР.
Следует также учитывать тот факт, что из-за незначительной продолжительности и
простоты выполнения, а также более легкого послеоперационного периода и
небольшого количества осложнений (отсутствие кровопотери, “ТУР - синдрома” и
др.), инцизия простаты является предпочтительным оперативным пособием у больных
пожилого и старческого возраста, имеющих высокую степень операционного риска, а
также у больных с выраженными интеркуррентными заболеваниями. Снижение
послеоперационной ретроградной эякуляции (до 7-15 %) выводит инцизию простаты в
разряд предпочтительных оперативных пособий и у относительно молодых больных с
ДГП небольших размеров, которым необходимо сохранение фертильности.
Основным и окончательным методом диагностики, позволяющим
принять решение в пользу выполнения инцизии простаты при ДГП, является
уретроцистоскопия, выполняемая непосредственно перед оперативным
вмешательством. Следует помнить о том, что “чистое" рассечение не
предполагает забора материала на гистологическое исследование и поэтому для
исключения возможного злокачественного поражения простаты необходимо включить в
план комплексного обследования больного исследование простатоспецифического
антигена (PSA).
Техника. В отличии от ТУР, при которой осуществляется
электрохирургическое удаление ткани с помощью петли резектоскопа по окружности
шейки мочевого пузыря и простаты (задней уретры), рассечение обычно
производится электродом в виде крючка (Hook) на 5, 7 и, реже, 12 часах
условного циферблата (см. приложение № 23). Практика показывает, что инцизия
простаты именно в этих плоскостях является наиболее эффективной и безопасной,
так как приводит к широкому раскрытию шейки мочевого пузыря и, проходя между
анатомическими границами долей ДГП, где также проецируются и основные
артериальные стволы, позволяет выполнить тщательный гемостаз. Несмотря на это,
в литературе имеются указания на проведение инцизии в одной плоскости или в
нескольких других плоскостях условного циферблата.
Электротомию обычно начинают из точки, расположенной на 1-1,5
см дистальнее устья мочеточника, проводят через шейку мочевого пузыря, простату
и заканчивают в зоне семенного бугорка. Первичный разрез углубляют до капсулы
простаты на всем протяжении, добиваясь при этом раскрытия шейки мочевого пузыря
по крайней мере на 1-2 поля зрения резектоскопа. Если после инцизии не
отмечается достаточного раскрытия шейки мочевого пузыря, нависают боковые доли
или искусственно образуется флотирующая средняя доля ДГП, то при прочих равных
условиях (цель операции, состояние больного и др.) необходимо выполнить ТУР.
После гемостаза операцию заканчивают установкой уретрального катетера Foley
20-22 Fr на 24-36 часов.
9.2
Электровапоризация простаты
Эндоскопическая электровапоризация простаты также является
разновидностью трансуретральной монополярной электрохирургии и, по литературным
данным, не уступает по эффективности ТУР. Для лечения используются стандартные
резектоскопы в сочетании со специальными роликовыми электродами (т. н.
“вапортродами”) различных модификаций, а также электрохирургические генераторы
(радиотомы) высокой мощности (не менее 200 Вт). Суть метода заключается в
выпаривании тканей железы мощными токами высокой частоты (200-300 Вт, 250-400
кГц) с одновременной коагуляцией подлежащих слоев, что делает операцию
практически бескровной. Впервые электровапоризация ДГП была представлена на
Всемирном конгрессе Ассоциации эндоурологов в декабре 1994 г. в Сент-Луисе,
США.
При электровапоризации в зоне контакта электрода с тканью
простаты возникает сразу несколько физических явлений. За счет сильного и
мощного термического воздействия, создаваемого электрогенератором, в
относительно большом, по сравнению с электрорезекцией, объеме ткани возникает
мгновенная дегидратация и взрыв клеточной жидкости (вапоризация). При этом
высокая мощность воздействия, особая форма электрической волны и специальная
конструкция электрода приводят к одновременной коагуляции подлежащих слоев
ткани в зоне, по глубине практически в 8-10 раз превосходящей аналогичную,
возникающую при стандартной петлевой электрорезекции (см. приложение № 24).
Подобный феномен и объясняет почти полное отсутствие кровотечения во время
операции и связанные с этим основные преимущества метода: идеальную видимость
во время вмешательства, отсутствие кровопотери, “водной интоксикации
организма" и др.
Вместе с тем следует учесть тот факт, что при стандартной
электрорезекции за единицу времени удаляется значительно большее количество
ткани, чем выпаривается при электровапоризации, что в определенной степени
ограничивает применение “чистой" вапоризации для лечения ДГП средних и
больших размеров (более 40 см3). Другое дело - комбинация
электровапоризации и традиционной ТУР - подобное сочетание, с учетом
преимуществ того и другого метода (быстрое удаление ткани, минимальная
кровопотеря и др.), имеет большие перспективы в трансуретральной хирургии ДГП
любых размеров.
Выполнение “чистой" электровапоризации ДГП не
предполагает забора ткани на гистологическое исследование, что определяет
необходимость исследования простатоспецифического антигена (PSA) в
предоперационном комплексном обследовании больного.
Техника электровапоризации простаты несколько отличается от
техники традиционной ТУР, т.к. она должна учитывать необходимость регидратации
тканей в зоне их контакта с “вапортродом”. В противном случае слой
карбонизированной (обугленной) ткани снижает эффективность дальнейшего
воздействия. Поэтому, по нашему мнению, вапоризацию целесообразно выполнять
путем послойного выпаривания ткани по всей окружности простаты, в то время как
техника традиционной ТУР основана, в целом, на сегментарном (долевом) удалении
ткани. Особую осторожность следует соблюдать при выпаривании тканей в
апикальной части ДГП (около семенного бугорка), т.к. визуально неконтролируемый
глубокий коагулирующий эффект может повредить зону “наружного сфинктера"
мочевого пузыря и привести к временному или постоянному недержанию мочи. Для
выпаривания основного объема ткани ДГП (средней и боковых долей) целесообразно
применять “вапортроды" большого диаметра с рельефной или зубчатой
поверхностью, а для работы в апикальной части ДГП - гладкие или с малым
диаметром и др. При этом мощность воздействия в каждом конкретном случае (режим
“резание” генератора) должна подбираться индивидуально и предельно снижаться
при выпаривании тканей у капсулы простаты и в ее апикальной части.
Обычно мощность генератора для электровапоризации ДГП
составляет: в режиме “резание” - 210-280 Вт, в режиме “коагуляция" -
60-100 Вт (для коагуляции используется та же мощность, что и при традиционной
ТУР). Если при выпаривании тканей в режиме “резание” коагулирующий эффект
недостаточен, то выполняют обычную коагуляцию тем же электродом, нажимая на
соответствующую педаль радиотома.
Послеоперационное ведение больного такое же, как и после
традиционной резекции с той лишь разницей, что после электровапоризации ДГП практически
не применяется натяжение уретрального катетера, отмечается значительно меньшая
степень гематурии и катетер можно удалять уже через 24-36 часов после операции.
За исключением геморрагических осложнений и “ТУР - синдрома”
осложнения электровапоризации практически такие же, как и при ТУР простаты.
9.3
ТУР-вапоризация простаты
В основе ТУР-вапоризации ДГП лежит одновременное
комбинированное применение двух электрохирургических способов удаления ткани,
резекции и вапоризации, Это стало возможным в результате разработки
“вапоризирующих петель” специальной конструкции, позволяющих удалять такой же
объем ткани, как и при обычной электрорезекции и, в то же время, за счет
вапоризирующего эффекта, одновременно добиваться той степени гемостаза, который
достигается при коагуляции или электровапоризации. Подобные петли имеют форму
обычной резекционной петли, режущая кромка которой составляет от 0,3 до 1 мм, и
вместе с этим, значительно большую поверхность соприкосновения с тканью за счет
уплощения всей петли или ее основания (“ленточная" петля, “клиновидная”
петля), размещения на ней небольших шариковых электродов или других
конструктивных особенностей. При ТУР-вапоризации, как и при вапоризации ДГП,
применяются диатермические установки (радиотомы) высокой мощности, позволяющие
в режиме “резание” развивать мощность воздействия в 210-300 Вт.
План обследования больного, техника операции и показания к
ней такие же, как и при традиционной ТУР, а вот течение послеоперационного
периода, частота и характер осложнений больше соответствуют вапоризации:
минимум геморрагических осложнений, снижение потенциальной опасности “ТУР -
синдрома”, более легкое течение послеоперационного периода и т.д. При этом,
вполне понятно, что в результате ТУР-вапоризации в единицу времени удаляется
значительно большее количество ткани, чем при “чистой" вапоризации, что,
по нашему мнению, выводит данный метод на первый план в эндоскопическом лечении
“аденомы” больших размеров и расширяет показания для трансуретральной хирургии
ДГП в целом. [7, 111 - 205]
10. Вывод
Сегодня позадилонная, а тем более чреспузырная, аденомэктомия
выполняются крайне редко. Открытая (чреспузырная и позадилонная) аденомэктомия
выполняется: при больших (более 100 см3) объемах гиперплазированной простаты;
камне или камнях мочевого пузыря и невозможности цистолитотрипсии; значительном
дивертикуле мочевого пузыря; наличии полуригидных фалло-эндопротезов. И хотя
открытая операция дает наилучшие результаты в отношении параметров
мочеиспускания и жалоб пациентов, значительное количество - до 21% ранних и
поздних послеоперационных осложнений заставляет все чаще пересматривать
показания к ее выполнению. Важнейшая роль в этом принадлежит совершенствованию
эндоскопического электрохирургического оборудования, росту мастерства урологов
и разработке новых методик трансуретральных операций. Уже не является редкостью
трансуретральная резекция (ТУР) при объеме гиперплазированной предстательной
железы более 100 см3. Накопленный опыт показывает, что трансуретральная
аденомэктомия (ТУА) показана вне зависимости от объема гиперплазированной
простаты, при планируемой продолжительности операции не более 90 мин. Очевидно,
что это время определяется как объемом удаляемой ткани, так и мастерством
уролога.
Однако даже самый "золотой стандарт" - трансуретральная
аденомэктомия не лишена осложнений. Наиболее грозным из них является
кровотечение. В 8% при ТУА возникает необходимость в переливании крови. Эта
величина может возрастать до 20% при объемах гиперплазированной п ростаты более
100 см3 (Н.А. Лопаткин, 1999). Новая техника ("слоеного пирога")
последовательного сочетанного применения вапоризирующих электродов,
выпаривающих и стандартных петель позволяет значительно улучшить качество
выполнения ТУА, особенно при больших объемах гиперплазии (А.А. Камалов, 1999,
А.Г. Мартов, 1999, Д.Г. Цариченко, 1999). В последние годы с целью профилактики
кровотечения, особенно при больших объемах гиперплазии, А.А. Камалов и соавт.
(2001) и А.З. Винаров и соавт. (2001) стали применять финастерид. Ингибируя
васкулогенный эндотелиальный фактор роста, финастерид препятствует
неоангиогенезу в ткани простаты и вызывает ее ишемизацию. Его прием в дозе 5 мг
на протяжении 3-4 месяцев до операции позволяет уменьшить выраженность
кровотечения во время ее проведения и раннем послеоперационном периоде.
Среди поздних осложнений ТУА наиболее серьезными являются:
рубцовая деформация шейки мочевого пузыря - до 10%; недержание мочи - до 2% и
ретроградное семяизвержение - до 80%. Риск повторной операции составляет 18 -
20% на протяжении 8 лет наблюдения. Разнообразные модификации ТУА:
электровапоризация; роторезекция; биполярная электровапоризация с помощью
аппарата Gyrus; лазерная резекция-вапоризация гольмиевым лазером - позволяют
добиться результатов, аналогичных ТУР, но уменьшить выраженность и частоту
возникновения кровотечения.
Поиск малотравматичных, но эффективных методик привел к
применению так называемых малоинвазивных технологий в лечении больных
гиперплазией предстательной железы. Трансуретральная инцизия простаты может
быть рекомендована: больным с объемом гиперплазированной простаты менее 20 см3;
при отсутствии "средней" доли; при отсутствии подозрения на рак
предстательной железы; также пациентам, желающим сохранить семяизвержение. При
небольших аденомах эта операция по эффективности близка к ТУР, однако риск
кровотечения и ретроградной эякуляции значительно меньше.
Среди других малоинвазивных методов заслуживают внимания
трансуретральные (микроволновая термотерапия; интерстициальная лазерная
коагуляция; игольчатая радиочастотная абляция; химическая абляция простаты
этанолом) и трансректальный (высокочастотное ультразвуковое воздействие). Они
создают в глубине гиперплазированной простаты очаги асептического некроза, с
последующей их резорбцией, развитием склероза и сморщивания предстательной
железы. Они менее травматичны по сравнению с ТУР простаты. Многие из них могут
применяться амбулаторно. Но эффективность их, безусловно, ниже по сравнению с
ТУР. В настоящее время они не рекомендуются как методики первого ряда и могут
быть применены лишь у больных с высокой степенью операционного риска.
У пациентов с крайне тяжелыми интеркуррентными заболеваниями,
для которых даже малоинвазивная операция представляет опасность, применение
временных (Memokath, Prostacoil, Prostakath, SpiroFlo, Spanner) или постоянных
(Wallstent, нитиноловый стент МИТ лтд.) простатических стентов позволяет
восстановить мочеиспускание, избежать цистостомии или избавить от уже
имеющейся, улучшить "качество жизни".
Таким образом, арсенал уролога в терапии больных гиперплазией
предстательной железы, безусловно, обширен. Выбор необходимого, наиболее
эффективного и наименее травматичного метода лечения должен осуществляться
индивидуально. Разработка критериев выбора вида лечения является наиболее
сложной и актуальной проблемой. При отсутствии показаний к операции у
большинства пациентов на первом этапе должна проводиться патогенетически
обоснованная консервативная терапия. При наличии эффекта медикаментозное
лечение осуществляется постоянно или курсами на протяжении всей жизни больного.
Необходим тщательный ежегодный контроль урологом эффективности терапии, что
позволяет своевременно определить необходимость в операции.
Оперативное вмешательство - аденомэктомия является
единственным методом удаления гиперплазированной простаты. Предпочтение в
большинстве случаев целесообразно отдавать трансуретральной аденомэктомии и ее
модификациям. Совершенствование опыта урологов страны в выполнении этих
операций значительно уменьшит частоту "открытых" оперативных
вмешательств и улучшит результаты оперативного лечения больных гиперплазией
предстательной железы.
Малоинвазивные методики лечения больных гиперплазией простаты
менее эффективны по сравнению с трансуретральной аденомэктомией. В настоящее
время они не должны применяться как методики первого ряда и могут быть
рекомендованы лишь пациентам с высокой степенью операционного риска. В
настоящее время в проблеме изучения и лечения больных гиперплазией
предстательной железы наступил период затишья, связанный с накоплением знаний и
анализом отдаленных результатов применения новых методов терапии. Мы вправе
вскоре ожидать новейших достижений, которые, в первую очередь, будут
основываться на успехах молекулярной и клеточной медицины в познании патогенеза
гиперплазии простаты и разработке программы профилактики этого тяжелого
страдания.
Литература
1.
Няньковский A. M. Электрорезекция при опухолях предстательной железы.М.,
“Медицина”, 1972, 104 с.
.
Эндоскопическая хирургия и дистанционная литотрипсия (под ред. В.Я. Симонова).,
М., 1992, 160 с.
3. Blandy J. P. Transurethral Resection, London, “Pitman Medical”,
1971, 184 pp.
. Contemporary BPH Management (Ed. by P. Puppo)., Bologna,
“Monduzzi Editore”, 1993, 170 pp.
. Matouschek E. Urologic Endoscopic Surgery, Toronto,
Philadelphia, “B. C. Decker”, 1989, 274 pp.
. Mauermayer W. Transurethral Surgery, Berlin, Heidelberg, New
York, “Springer-Verlag”, 1983, 474 pp.
. Renter H. J. Atlas of Urologic Endoscopic Surgery, Stuttgart,
New York, “Georg Thieme Verlag”, 1982, 252 pp.
Приложения
Приложение №
1

Рис.1. Схема строения предстательной железы
Приложение №
2
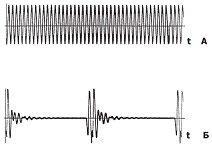
Рис.2. Форма электрической волны при резании (А) и коагуляции (Б)
Приложение №
3
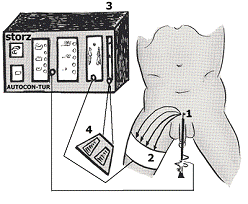
Рис.3. Схема электрической цепи при трансуретральной
электрорезекции:
- активный электрод (петля резектоскопа);
- пассивный (нейтральный) электрод;
- генератор энергии (радистом);
- двойная педаль для резекции и коагуляции
Приложение №
4

Рис.4. Генератор энергии (диатермический аппарат, радистом):
A. AUTOCON-TUR 27810
Б.
AUTOCON 350
Приложение
№ 5

Рис.5. Источник “холодного” света (А) с фиброволоконным световодом
(Б)
Приложение №
6

Рис.6. Стационарная система для водоподготовки с подвесным,
подвижным (на электроприводе) резервуаром для подачи ирригационного раствора
Приложение №
7
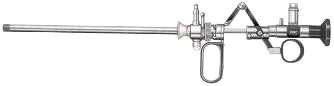
Рис.7.1 Стандартный резектоскоп

Приложение №
8

Рис.8. Тубусы резектоскопов: А - тубус с “косым” клювом, краном
для жидкости (Люер-тип) и стандартным замком в соединении со стандартным
обтуратором. Б - тубус с “коротким" клювом. В - тубус с “прямым"
клювом и ирригационным механизмом с центральным клапаном. Г - центральный
клапан тубуса резектоскопа
Приложение №
9

Рис.9.1 Обтураторы неоптические: А - стандартный, Б - отклоняемый,
В - атравматичный

Рис.9.2 Обтураторы оптические: А - стандартный, Б - с мостиком для
проведения катетера
Приложение №
10


Рис.10. Разнообразные конструкции рабочих элементов резектоскопов
Приложение №
11
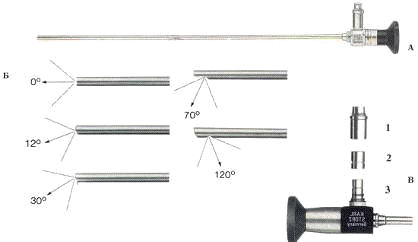
Рис.11. Оптическая система резектоскопа: А - ригидный телескоп, Б
- углы направления наблюдения ригидных телескопов, В - совместимость телескопа
со светопередающими устройствами:
1. OLYMPUS,
. R. WOLF,
. ACMI-CIRCON.
Приложение
№ 12
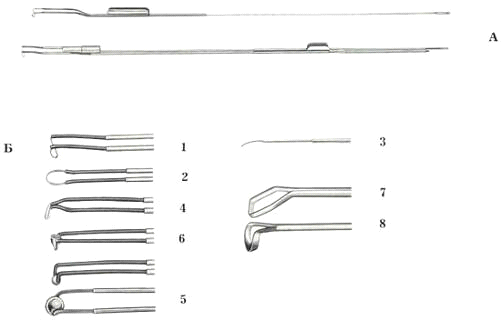
Рис.12. Петли, коагуляторы, кюретки. А - одно - и двухконтактные
петли для резекции, В - стандартные инструменты для ТУР: 1 - угловые петли, 2 -
прямые петли, 3 - игольчатый электрод, 4 - точечный коагулирующий электрод (Hook),
5 - шариковый коагулирующий электрод, 6 - конический коагулирующий электрод, 7
- плоская кюретка, 8 - круглая кюретка
Приложение №
13

Рис.13. Электроды для вапоризации: 1 - режущая петля, диаметром
0,8 мм, 2 - “шиповатый” (Spike) электрод (диаметр 3 мм и 5 мм), 3 - “роликовый”
(Roller) электрод (диаметр 3 мм и 5 мм), 4 - “вапоризирующая" режущая
петля, 5 - “роликовая” режущая петля, 6 - “вапоризирующий" режущий (Vapor
Cut) электрод.
Приложение №
14

Рис.14.1 Варианты ТУР: А. “Псевдо-ТУР”, Б. Вариант “парциальной
ТУР" - “паллиативная ТУР”
Рис.14.2 В. Вариант “парциальной ТУР" - “субтотальная ТУР”,
Г. “Тотальная ТУР”
Приложение №
15
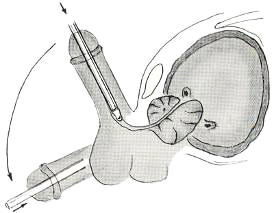
Рис.15. Схема проведения тубуса резектоскопа в мочевой пузырь.
Половой член поднимают кверху, перпендикулярно поверхности тела,
слегка натягивают и в просвет уретры вводят обработанный гелем тубус
резектоскопа с обтуратором. Легким надавливанием (или под действием собственной
силы тяжести) тубус резектоскопа проводят через переднюю уретру, до
препятствия, после которого половой член опускают книзу, создавая единую ось
для передней и задней уретры. После этого инструмент проводят в мочевой пузырь
избегая форсированных движений
Приложение №
16
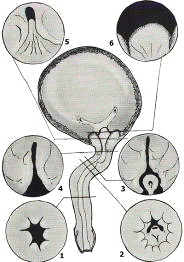
Рис.16. Схема эндоскопической анатомии уретры и доброкачественной
гиперплазии предстательной железы в зависимости от местоположения эндоскопа.1.
Эндоскоп в переднем (висячем) отделе уретры. Просвет уретры звездчатой формы.2.
Эндоскоп в бульбозном отделе уретры. “Наружный сфинктер” мочевого пузыря и
семенной бугорок.3. Эндоскоп в мембранозном отделе уретры. Семенной бугорок и
эндоуретральные части боковых долей ДГП.4. Эндоскоп в задней уретре. Нависающие
эндоуретральные части боковых долей ДГП, соединяющиеся в области передней
комиссуры.5. Эндоскоп в задней уретре. Эндоуретральные части средней доли
ДГП.6. Эндоскоп в области шейки мочевого пузыря. Эндовезикальные части боковых
и средней доли ДГП
Приложение №
17
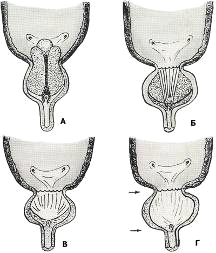
Рис.17. Основные правила техники трансуретральной резекции ДГП:
А - Типичная 3-х долевая гиперплазия простаты на горизонтальном
срезе.
Б - I стадия ТУР - удаление ткани в виде конуса (после удаления
внутрипузырных частей ДГП).
В - II стадия ТУР - высвобождение капсулы.
Г - III стадия ТУР - удаление апикальной ткани. Стрелками
обозначены проксимальная и дистальная границы резекции
Приложение №
18
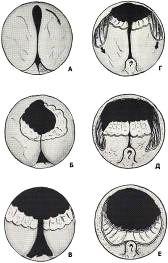
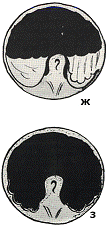
Рис.18. Методика Nesbit (схема) А - Эндоскопический вид ДГП
больших размеров (с эндоуретральным типом роста) с позиции дистальной части
задней уретры. Крупные боковые доли свешиваются в просвет задней уретры и
соединяются вентрально в области передней комиссуры. Стрелкой обозначено
направление формирования основной (боковой) борозды. Б, В - Создание плато на
вентральной поверхности. Г - Создание основной борозды - боковой борозды.
Стрелками обозначено направление формирования и углубления борозды. Д -
Резекция основной массы ткани до основания (дна) боковых борозд. Е - Удаление
ткани книзу до дна простатической полости путем углубления плато в дорсальном
направлении и резекции боковых долей с обнажением волокон “внутреннего
сфинктера" мочевого пузыря. Ж, 3 - Резекция апикальной ткани.
Окончательный вид параколликулярной области с позиции мембранозного отдела
уретры - картина “рыбьего зева”
Приложение №
19
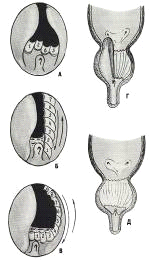
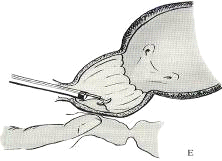
Рис. 19. Методика Barnes (схема) А - Резекция дна простатической
полости - удаление средней доли (цифры обозначают последовательность
горизонтальных послойных срезов). Б, В - Резекция левой боковой доли (цифрами
обозначены последовательность, а стрелками направление послойных срезов). Г -
Средняя и левая боковые доли ДГП резецированы. Сохраняются правая боковая доля
и “защитный" слой апикальной части ДГП. Д - Правая боковая доля удалена.
Капсула простаты обнажена по всей окружности задней уретры с оставлением
апикальной ткани. Е - Удаление апикальной ткани ДГП путем выведения ее в зону
резекции с помощью пальца, введенного в прямую кишку
Приложение №
20
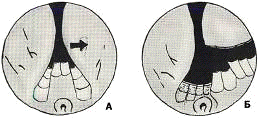
Рис. 20. Методика Alcock и Flocks (схема). А - Создание продольных
дорожек между боковыми и средней долями с последующей резекцией средней доли.
Стрелкой обозначено направление горизонтального разделения боковых долей ДГП, Б
- Создание радиальной (горизонтальной) борозды с последующей резекцией левой
боковой доли ДГП
Приложение №
21
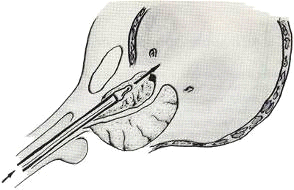
Рис.21. Вентральная перфорация простаты при форсированном
проведении инструмента в мочевой пузырь
Приложение №
22
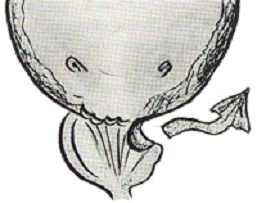
Рис.22. Открытая перфорация простаты. Путь распространения
ирригационной жидкости (стрелка) в парапростатическое (паравезикальное)
пространство.
Приложение №
23
Рис.23. Инцизия простаты. А - Рубцово-склеротическое сужение шейки
мочевого пузыря, обусловленное ДГП небольших размеров. В - Инцизия простаты
крючковидным электродом на 7 часах условного циферблата. В - Вид задней уретры
после инцизии простаты на 5, 7 и 12 часах условного циферблата. Широкое
раскрытие шейки мочевого пузыря
Приложение №
24
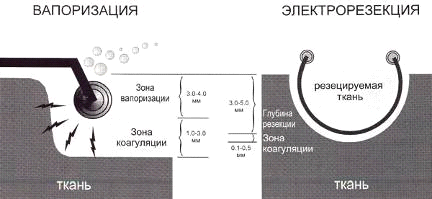
Рис.24. Тканевые эффекты, возникающие при стандартной
электрорезекции и электровапоризации ДГП
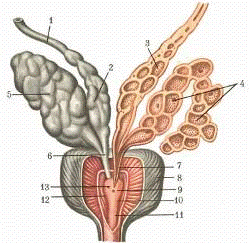
Рис.25. Предстательная железа и семенные пузырьки.
- ductus deferens; 2, 3 - ampulla ductus deferentis; 4 - vesicula
seminalis; 5 - corpus vesiculae seminalis; 6 - ductus excretorius vesiculae
seminalis; 7 - prostata; 8 - utriculus prostaticus; 9 - colliculus seminalis;
10 - crista urethralis; 11 - sinus prostaticus; 12 - ostium ductus
ejaculatorius.
Приложение №
26
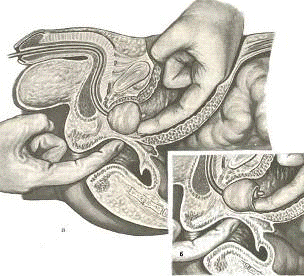
Рис.26. Чреспузырная аденомэктомия “вслепую”.
а - положение пальцев рук при аденомэктомии; б -
хирургическая капсула надсечена, выделение железы.
Приложение №
27
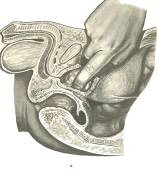
Рис.27. Чреспузырная аденомэктомия “вслепую”.
а - удаление вылущенной железы; б - рана ушита, в
предпузырное пространство введены дренажные трубки.
Приложение №
28
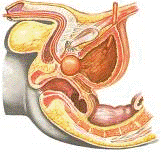
Рис.28. Катетер-компрессор Померанцева - Фолея, вставленный в
простатическое ложе.
Приложение №
29
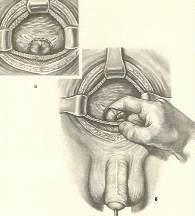
Рис.29.1 Аденомэктомия “на глаз”.
а - рана мочевого пузыря расширена; пунктиром показан разрез
слизистой мочевого пузыря; б - кончик указательного пальца введен в слой между
аденомой и хирургической капсулой;
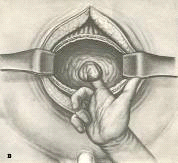
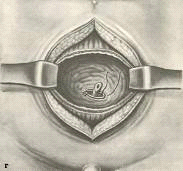
Рис.29.2 Аденомэктомия “на глаз”.
в - вылущение аденомы; г - швы на ложе простаты.
Приложение №
30
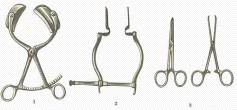
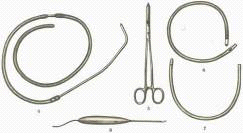
Рис.30. Набор специальных инструментов В.В. Гольдберга,
облегчающих проведение аденомэктомии.
Приложение №
31
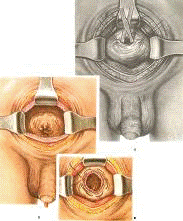
Рис.31. Операция Гринчака.
а - вскрытие мочевого пузыря тупо по средней линии и расширение
его раны в поперечном направлении; б - ушивание простатического ложа; в -
наложение кисетного шва на мочевой пузырь.
Приложение №
32
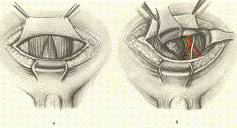
Рис.32. Перевязка внутренней подвздошной артерии.
а - надлобковый дугообразный разрез; обнажена прямая мышца живота;
б - перевязка левой внутренней подвздошной артерии.
Приложение №
33
Рис.33. Линии промежностных разрезов при простатэктомии.
Приложение №
34

Рис.34.1 Промежностная аденомэктомия.
а - обнажение задней поверхности аденомы; б - отделение
капсулы от аденоматозных узлов;
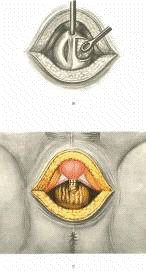
Рис.34.2 Промежностная аденомэктомия.
в-пересечение уретры в перепончатой ее части; удаление
железы; г - соединение слизистой шейки мочевого пузыря с уретрой.