Синтез моногидрата хлорида (мю-61549;-гидроксо) бис (пентааммин) - хрома(III) [(NH3)5Cr(OH)Cr(NH3)5]Cl5*H2O
Синтез
моногидрата хлорида (m-гидроксо) бис (пентааммин) - хрома(III) [(NH3)5Cr(OH)Cr(NH3)5]Cl5*H2O.
Оглавление
Введение
Литературный
обзор
Общие
сведения о многоядерных комплексах
Cr3+ как комплексообразователь
Cr3+ в многоядерных комплексах
Применение
многоядерных комплексов Cr3+
Экспериментальная
часть
Реактивы,
использованные в синтезе
Оборудование,
использованное в синтезе
Ход работы.
Этапы проведения синтеза
Приготовление
компонентов реакционной смеси
Получение
соли Cr3
Получение
соли Cr2
Получение
аммиачного комплекса Cr2+
Получение
требуемого биядерного аммиачного комплекса Cr3+
Фильтрование,
очистка и сушка полученного вещества
Уравнения
реакций, проходивших в ходе работы
Расчет выхода
вещества
Изучение
свойств полученного вещества
Физические
свойства
Строение
кристаллов
Отношение к
нагреванию
ИК-спектр в
области 4000-400 см-1
Химические
свойства
Выводы
Список
литературы
Приложение
Введение
Соединения хрома чрезвычайно интересны с точки зрения химии
координационных соединений. Особый интерес представляют многоядерные
комплексные соединения хрома в степени окисления 3+. Именно они являются
типичными многоядерными комплексами, то есть они образуют довольно большой
класс многоядерных комплексов. Синтез же этих комплексов также представляет
очень большой интерес, так как на основе них можно проследить многие свойства
многоядерных соединений.
Все лабораторные работы по получению комплексных соединений хрома в
степени окисления 3+ сложны тем, что эти соединения получают не прямым путем.
Данный комплекс получают одним их методов, сказанных в литературном обзоре, -
окислением хрома (II).
Цель работы
Синтезировать в лабораторных условиях с соблюдением всех правил
безопасности биядерный комплекс хрома (III) - моногидрат хлорида (m-гидроксо) бис (пентааммин) - хрома(III) [(NH3)5Cr(OH)Cr(NH3)5]Cl5*H2O, изучить физические и химические
свойства получаемого вещества, сделать выводы о проделанной работе.
Литературный обзор
Общие сведения о многоядерных комплексах
Под термином многоядерных объединяются разнообразные группы комплексных
соединений, характеризующихся тем, что в них имеется несколько координационных
сфер, центральные атомы которых связаны в одно целое с помощью определенных
атомов или групп атомов, называемых мостиками. Роль этих мостиков могут играть
разные группы: OH, NH2, O, O2, CH3COO и так далее. Число мостиков,
связывающих два центральных иона, не может превышать трех.
Лучше всего изучены многоядерные аммиакаты и аммиакаты металлов. Далее
следует упомянуть многоядерные галогениды, а также многоядерные комплексы с
органическими кислотными остатками. Эти две последние группы соединений изучены
в значительно меньшей степени, чем многоядерные аммиакаты.
К многоядерным комплексам близко примыкают изо - и гетеро - поликислоты.
Наконец, к многоядерным комплексам, по-видимому, относятся некоторые
соединения, структура которых еще не может считаться в достаточной степени
выясненной.
К многоядерным комплексам должны быть причислены также продукты сочетания
двух или нескольких комплексных ионов при посредстве заместителей, обладающих
повышенным значением координационной емкости (один мостик, в основном
органического происхождения, может связывать три или более
комплексообразователей).
Большую группу многоядерных комплексов образуют производные хрома,
железа, а также некоторых других металлов, содержащие органические кислотные
остатки. Удалось также получить комплексы, в ядре которых заключаются и атомы
хрома, и атомы железа. Но вопрос о внутренней структуре комплексов этого типа
еще не может считаться полностью разрешенным. То же самое относиться и к
вопросу об их пространственном строении.
Cr3+ как комплексообразователь
аммиачный
многоядерный реактив синтез
Хром (III) - это наиболее устойчивая и
наиболее изученная окисленная форма хрома. Известны тысячи соединений,
большинство которых получают из водных растворов. Хром (III) образует устойчивые соли со всеми
обычными анионами и дает комплексы практически с любыми частицами, способными
отдавать электронную пару. Эти комплексы могут быть анионами, катионами или
нейтральными молекулами, и практически все они имеют октаэдрическую структуру
(КЧ=6). Существует также множество комплексов с двумя или более различными
лигандами. Многие из таких комплексов, например пентааммины, активно
используются в кинетических исследованиях в виду их кинетической инертности.
Большинство комплексов хрома (III)
не всегда получают прямым путем. Такие соли, как гидратированные сульфат и
галогениды, которые должны были бы служить исходными веществами, содержат
координированную воду ил анионы, не всегда легко замещаемые. Поэтому обычно не
применяют простое добавление соответствующего лиганда к водному раствору соли
хрома (III). Альтернативные способы,
позволяющие избежать образования инертных промежуточных комплексов:
. Безводные методы;
. Окисление Cr (II);
. Восстановление Cr (VI).
Cr3+ в многоядерных комплексах
Один из самых типичных свойств Cr3+ - его склонность к образованию многоядерных комплексов, содержащих
мостики OH-. Предполагают, что это происходит при потере протона
из координированной молекулы воды, после чего происходит координация
полученного таким образом OH- со вторым катионом. О легкости
удаления протона можно судить по тому факту, что гексааква-ион (pKa≈4) является практически такой
по силе кислотой, как муравьиная. Могут происходить дальнейшие депротонирование
и полимеризация, и при увеличении pH конечным продуктом становится гидратированный оксид хрома (III) или «гидроксид хрома». Его
образование объясняет, почему аминокомплексы не получают простым добавлением
амина к водному раствору Cr3+. Методами, обычно начинающимися с Cr2+,
получают биядерные соединения, например
[(en)2Cr(m2-OH)Cr(en)2] и [(NH3)5Cr(m-OH)Cr(NH3)5]X5.
Известны также другие многоядерные комплексные соединения хрома (III):
. С линейным мостиком Cr - O - Cr: синий [(NH3)5Cr-O-Cr(NH3)5]4+, голубой
[LCr(m2-O)*(m2-O2CMe)2CrL] (L =
1,4,7 - триметил - 1,4,7 - триазациклононан) и др.;
. Трехъядерные соединения: (PPh4)2Na[Cr3(SCH2CH2O)6], «основные» карбоксилаты с общей формулой [Cr3O(RCOO)6L3]+.
Применение многоядерных комплексов Cr3+
Гидролизованные многоядерные комплексы Cr3+ имеют большое
значение в промышленном получении красителей и дубильных веществ. В первом
случае они служат протравкой для красителя. В производстве кожи необходимо
обрабатывать шкуры животных для предотвращения гниения, чтобы они были мягкими
после высушивания. Традиционно в этих целях использовался танин, но к концу XIX века он был вытеснен растворами
сульфатами хрома (III). После
смачивания в серной кислоте шкуры насыщаются раствором, содержащим Cr3+. Раствор постепенно делают щелочным,
при этом образуются многоядерные комплексы и связывают мостиками соседние
цепочки белков, в основном координируясь к их карбоксильным группам.
Экспериментальная часть
Реактивы, использованные в синтезе
|
Реактив:
|
Количество:
|
|
Дихромат калия K2Cr2O7
|
10 гр.
|
|
Этанол C2H5OH
|
25 мл.
|
|
Хлороводородная кислота HCl
(конц. раствор)
|
100 мл
|
|
Металлический цинк Zn
|
100 гранул
|
|
Хлорид аммония NH4Cl
|
85 гр.
|
|
Аммиак NH3
(конц. раствор)
|
125 мл.
|
|
Хлорид натрия NaCl
(для охлаждения)
|
-
|
|
Кислород O2 (из
баллона)
|
-
|
|
Хлороводородная кислота HCl
(20% раствор)
|
10 мл.
|
Оборудование, использованное в синтезе
|
Оборудование:
|
Количество:
|
|
Ступка с пестиком
|
|
Мерная колба
|
1
|
|
Стакан на 200 мл.
|
2
|
|
Магнитная мешалка с нагревом
|
1
|
|
Коническая колба на 250 мл.
|
3
|
|
Резиновая пробка для
конической колбы с двумя отверстиями
|
1
|
|
Стеклянные трубки разной
длины
|
2
|
|
Изогнутая трубка
|
1
|
|
Зажим
|
2
|
|
Резиновые трубки разной
длины
|
2
|
|
Кристаллизатор
|
2
|
|
Лед
|
-
|
|
Воронка Бюхнера
|
1
|
|
Колба Бунзена
|
1
|
|
Фильтровальная бумага
|
-
|
|
Чашка Петри
|
1
|
Ход работы. Этапы проведения синтеза
Приготовление компонентов реакционной смеси
Взвесил на весах 10 грамм дихромата калия, растертого в порошок в ступке.
Отмерил на мерной колбе 15 мл этанола. Налил в стакан 100 мл концентрированного
раствора хлороводородной кислоты.
Получение соли Cr3+
Положил дихромат калия в коническую колбу и прилил к нему этанол. Получил
смесь морковно-оранжевого цвета. Постепенно прилил к полученной смеси
хлороводородной кислоты, при этом пошла бурная экзотермическая реакция с
выделением газа (с явными признаками хлора):
K2Cr2O7 + 12HCl
(конц.) + C2H5OH= 2CrCl3 + 2KCl +
2Cl2 + CH3COH +
7H2O.
После прекращения активного выделения газа поставил колбу с раствором на
магнитную мешалку. Цвет образовавшегося раствора в первоначальный момент был
грязно-зеленым. Затем установил скорость перемешивания на мешалке - 150
оборотов в минуту. Через 15 минут снял колбу с магнитной мешалки, цвет раствора
к тому времени стал глубоко-зеленым, что свидетельствует об образовании соли Cr3+.
Выделение газа прекратилось.
Получение соли Cr2+
Рисунок 1.Установка для получения моногидрат хлорида (m-гидроксо) бис (пентааммин) -
хрома(III) [(NH3)5Cr(OH)Cr(NH3)5]Cl5*H2O.
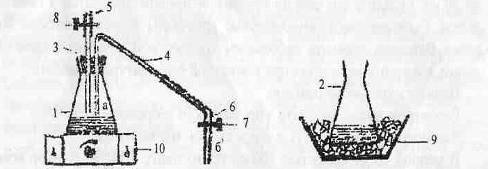
. Колба 1 (с реакционной смесью)
. Колба 2 (со смесью аммиака и хлорида аммония)
. Резиновая пробка с двумя отверстиями
. Коленчатая трубка (изогнутая трубка, соединенная резиновой
трубкой с трубкой с зажимом): а) конец, находящийся в колбе 1, б) конец,
находящийся в колбе 2
. Трубка (с зажимом)
. Трубка с зажимом, соединенная с изогнутой трубкой
. Зажим коленчатой трубки 4
. Зажим трубки 5
. Кристаллизатор с охлаждающей смесью
. Магнитная мешалка с нагревом
Полученный на предыдущем этапе раствор глубоко-зеленого цвета поставил на
плитку (магнитную мешалку с нагревом) нагреваться (при температуре 500С
для того, чтобы на всём объеме раствора поддерживалась температура не меньше 450С).
Добавил к подогретому раствору 100 гранул металлического цинка Zn. При этом
пошла бурная реакция с выделением газа:
Zn + 2HCl (конц.) = ZnCl2 + H2.
Затем быстро собрал установку, изображенную на рис. 1, для восстановления
хрома (III) до хрома (II) водородом в момент выделения. Для того, чтобы обеспечить
полную изоляцию установки от воздуха, плотно закрыл пробкой 3 коническую колбу
1, заполнил две трубки 4 и 5 бурно выделяющимся водородом. Затем закрыл зажим
7, водород стал выходить через трубку 5, которая осталась открытой. Опустил
конец «а» трубки 4 до дна колбы 1. Постепенно раствор поменял окраску с
глубоко-зеленого на сине-голубой цвет:
CrCl3 + H0 = CrCl2 + HCl (при t),
что свидетельствует об образовании соли Cr2+. Бурное выделение
газа прекратилось. Раствор восстанавливал примерно 30 минут. По истечении 30
минут получил раствор сине-голубого цвета, наблюдалось слабое выделение газа.
Получение аммиачного комплекса Cr2+
Заранее приготовил в конической колбе 2 (см. рис.1) на 250 мл смесь из 85
грамм хлорида аммония и примерно 125 мл концентрированного раствора аммиака.
При перемешивании смеси колба охладилась. Большая часть хлорида аммония не
растворилась! Поместил колбу в кристаллизатор 9 с охлаждающей смесью льда и
хлорида натрия, постоянно бросал в колбу со смесью кусочки льда.
После того, как раствор в колбе 1 стал сине-голубого цвета, опустил конец
«б» трубки 4 в смесь аммиака и хлорида аммония так, чтобы конец трубки
находился в растворе, а не в осадке. Затем закрыл зажим 8 и открыл зажим 7.
Сине-голубой раствор в колбе 1 начал постепенно вытесняться в колбу 2, при этом
вытесненный сине-голубой раствор в смеси аммиака и хлорида аммония становился
сиреневым:
CrCl2 + 4NH3 (конц.) = [Cr(NH3)4]Cl2,
что свидетельствует об образовании аммиачного комплекса Cr2+.
Большая часть вытесненного раствора попало в осевший хлорид аммония, образуя
осадок темно-сиреневого цвета! После того, как весь раствор из колбы 1 перешел
в колбу 2, снял колбу 2 из кристаллизатора и декантировал образовавшийся
сиреневый раствор в другую колбу. Также большое количество сиреневого раствора
осталось на поверхности осадка (там окраска раствора была наиболее интенсивной,
что свидетельствует о большей концентрации соли хрома (II) в нем), который декантировать не удалось! Цвет полученного
сиреневого раствора менее интенсивен, чем цвет раствора, оставшегося на поверхности
осадка хлорида аммония!
Получение требуемого биядерного аммиачного комплекса Cr3+
Взял декантированный на предыдущем этапе сиреневый раствор комплекса Cr2+,
Стал пропускать через него ток газообразного кислорода (из баллона). В
первоначальный момент времени цвет раствора моментально поменялся на
темно-красный. Со временем стал образовываться розовый осадок (в довольно малых
количествах!):
[Cr(NH3)4]Cl2 + O2 (газ) + 2NH3 (конц.) + 2NH4Cl
(насыщ.) =
2[(NH3)5Cr(OH)Cr(NH3)5]Cl5¯ (при t).
Пропускал кислород в течение 30 минут. Затем поставил колбу в
кристаллизатор со льдом для полного осаждения комплекса.
Фильтрование, очистка и сушка полученного вещества
Осадок, полученный на предыдущем этапе, отфильтровал на воронке Бюхнера,
затем промыл 10 мл 20%-го раствора хлороводородной кислоты и 10 мл этанола.
Дополнительную очистку не стал проводить ввиду малого выхода полученного
вещества! Перенес полученное вещество на чашку Петри и оставил сушиться на
воздухе.
Уравнения реакций, проходивших в ходе работы
1. K2Cr2O7 + 12HCl
(конц.) + C2H5OH= 2CrCl3 + 2KCl +
2Cl2 + CH3COH +
7H2O (при t).
2. CrCl3 + Zn + HCl (конц.) = CrCl2 + ZnCl2
+ ½H2 (при t).
. CrCl2 + 4NH3 (конц.) = [Cr(NH3)4]Cl2.
. 4[Cr(NH3)4]Cl2 + O2
(газ) + 2NH3 (конц.) + 2NH4Cl (насыщ.) = 2[(NH3)5Cr(OH)Cr(NH3)5]Cl5¯ (при t).
Расчет выхода вещества
Масса высушенного вещества составила 0,1 грамм.
Количество вещества (практическое) ν =m (вещества) ⁄ M (вещества) = (0,1⁄486,5) моль
= 0,0002 моль.
Количество вещества (теоретическое) ν = ν (K2Cr2O7) = (10⁄294) моль = 0,034 моль.
Следовательно, выход вещества в процентах от теоретического:
ω = (ν (практическое) / ν
(теоретическое))*100% =
(0,0002/0,034) * 100% ≈ 0,6%.
. На стадии получения аммиачного комплекса хрома (II) большое количество раствора соли
хрома (II) попало в осадок хлорида аммония,
образуя осадок темно-сиреневого цвета. Следовательно, выделить из него
аммиачный комплекс хрома (II) не
удалось.
. Также на стадии получения аммиачного комплекса хрома (II) большое количество сиреневого
раствора осталось на поверхности осевшего хлорида аммония. Следовательно,
декантировать этот раствор с поверхности не удалось.
Изучение свойств полученного вещества
Физические свойства. Строение кристаллов
Кристаллы вещества представляют собой очень мелкие игольчатые бесцветные
кристаллы, в основном все они однородны.
Отношение к нагреванию
При легком нагревании (до 800С) вещество устойчиво, но при
нагревании выше 800С бесцветные кристаллы (мелкие из кристаллов)
становятся зелеными и начинают терять форму, что свидетельствует о термическом
разложении комплекса, как и всех других аммиачных комплексов хрома (III).
ИК-спектр в области 4000-400 см-1
Смотрите ИК-спектр поглощения комплекса на следующей странице (приложение
1). Также смотрите приложение 2.
Характеристическая таблица полос поглощения.
|
Полоса поглощения
(полученного вещества), см-1
|
Полоса поглощения (чистого
вещества), см-1
|
Характерная связь
|
|
570
|
578
|
|
|
759
|
759
|
ρr (NH3)
|
|
1302
|
1199
|
δ (Cr-O-H)
|
|
1404
|
1313
|
δs (NH3)
|
|
1616
|
1614
|
δα (NH3), δ (H2O)
|
|
1759
|
|
Колебания аппарата
|
|
2010
|
|
Колебания аппарата
|
|
2284
|
|
Колебания аппарата
|
|
2812
|
3145
|
ν (NH), ν (OH)
|
|
3045
|
3217
|
|
|
3140
|
3277
|
|
|
3756
|
|
Колебания аппарата
|
Химические свойства
Взаимодействие с нитратом серебра AgNO3:
[(NH3)5Cr(OH)Cr(NH3)5]Cl5
+ AgNO3 = AgCl¯ + [(NH3)5Cr(OH)Cr(NH3)5]NO3.
Выпадает белый осадок хлорида серебра, никаких других изменений не
происходило, что свидетельствует о достаточно устойчивой внутренней сфере
комплекса.
Выводы
Получение многоядерных комплексов хрома в степени окисления 3+
представляют собой очень сложные и интересные лабораторные работы. Выполнение
работы требует четкости, аккуратности, знания всего процесса получения
комплекса от начала до конца. Так, допущенная ошибка в процессе декантации
аммиачного комплекса хрома (II) из
смеси аммиака и хлорида аммония привел к провалу работы и к ее переделыванию.
При повторном проведении работы были учтены допущенные ошибки, и работа в целом
прошла успешно: комплекс был получен, но в малых количествах! При проведении
синтеза следует заострить внимание на следующем:
. При приготовлении реакционной смеси следует осторожно,
постепенно приливать концентрированный раствор хлороводородной кислоты, иначе
последующая за этим бурная реакция с выделением газа может выйти за границы
реакционной колбы.
. При добавлении металлического цинка в раствор с солью хрома (III) необходимо учесть, что в колбе
также находится концентрированный раствор хлороводородной кислоты. И, чтобы
избежать бурной реакции цинка с кислотой с выделением газа, цинк необходимо
добавлять постепенно.
. Надо следить, чтобы конец трубки, с которой стекает раствор соли
хрома (II) в смесь аммиака и хлорида аммония,
находился в растворе, а не в осадке хлорида аммония.
. Ни в коем случае не размешивать смесь в колбе 2 после того, как
вы получили сиреневый раствор аммиачного комплекса хрома (II)!
Если учесть эти моменты, можно с успехом провести данную работу. К
сожалению, мной была снова допущена ошибка (пункт 3), когда я во второй раз
проводил синтез. Поэтому выход полученного мною вещества составил 0,6%.
Список литературы
1. Н.
Гринвуд, А. Эрншо, «Химия элементов», Том 2, Москва: Издательство «БИНОМ.
Лаборатория знаний», 2008 год.
. А.А.
Гринберг, «Введение в химию комплексных соединений», Москва-Ленинград:
Издательство «Химия», 1966 год.
. М.С.
Новаковский, «Лабораторные работы по химии комплексных соединений», Харьков:
Издательство Харьковского Университета, 1972 год.
. Р.А.
Лидин, В.А. Молочко, Л.Л. Андреева, «Химические свойства неорганических
веществ», Москва: Издательство «КолосС», 2003 год.
. Ю.Д.
Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе, «Неорганическая
химия. Химия элементов», Том 1, Москва: Издательство Московского Университета и
ИКЦ «Академкнига», 2007 год.
. М.Ф.
Могилевкина, В.А. Максаков, «Практикум по неорганической химии», Выпуск 2,
Новосибирск: Издательство Новосибирского Государственного Университета, 2003
год.
Приложение
. ИК-спектр полученного [(NH3)5Cr(OH)Cr(NH3)5]Cl5*H2O
в области 4000-400 см-1.
. ИК-спектр чистого [(NH3)5Cr(OH)Cr(NH3)5]Cl5*H2O
в области 4000-400 см-1.