Беспламенное сжигание метана на палладиевых и оксидных катализаторах
Содержание
Введение
Обзор литературы
Сжигание метана на нанесенных Pd и Pt катализаторах
Окисление метана на оксидных катализаторах
Заключение по обзору литературы
Методика эксперимента
Список литературы
Введение
Интерес к изучению каталитического (беспламенного) сжигания
метана возник сравнительно недавно. Первые систематические исследования в этой
области были выполнены в начале 80-х годов. Постановка этих работ была
обусловлена необходимостью решения ряда проблем экологической направленности. К
ним в частности относятся:
создание экологически безопасных энергоустановок,
базирующихся на сжигании метана;
разработка систем для каталитического окисления метана,
содержащегося в газах, удаляемых при вентиляции шахтных угольных разрезов;
дожигание метана, присутствующего в газовых выбросах
стационарных генераторов электрической энергии на основе водородных топливных
элементов, использующих природный газ в качестве первичного энергоносителя.
Первая из обозначенных проблем связана с поиском методов
снижения концентрации оксидов азота, образующихся в результате конверсии азота
кислородом воздуха при пламенном сжигании метана в условиях, когда температура
в топочном пространстве может достигать 1700˚C. В этом случае
содержание NOx в отходящем газовом потоке составляет 30-50 ppm и значительно превышает
санитарно допустимые нормы.
Традиционные приемы очистки газовых выбросов энергоустановок
предполагают связывание оксидов азота при каталитическом взаимодействии их с
инжектируемым в газовый поток газами восстановителями: аммиаком или метаном.
Такое решение сопряжено со значительными экономическими затратами.
Альтернативным вариантом является снижение температуры
пламени до 1300-1400°С, что обеспечивает десятикратное уменьшение содержание NOx и позволяет вообще
отказаться от использования дорогостоящего оборудования для очистки отходящих
газов. Реализация этого решения базируется на использовании каталитических
систем сжигания метана [1-16]. В литературе этот процесс предлагают проводить в
две последовательные стадии, а именно стадию поджигания газовой смеси
(Т=600-900˚С) и стадию полного сжигания метана (1300-1400˚С).
Новыми сферами практического применения метана является
использование его в стационарных генераторах электрической энергии на основе
водородных топливных элементов, а также в качестве топлива для большегрузных
автомобилей. Актуальность этих направлений была подчеркнута в ряде
международных соглашений.
Привлекательность природного газа, как топлива, обусловлена
не только его большими запасами, но также тем, что данное природное сырье:
содержит серу, как правило, в значительно меньших
концентрациях, чем нефть;
обеспечивает почти двух кратное снижение концентрации СО2
в газовых выбросах, только за счет того, что отношение С/H в метане почти в два
раза меньше, чем в жидком углеводородном топливе;
исключает возможность загрязнения атмосферы оксидами азота,
поскольку в дизельном двигателе воспламенение топлива осуществляется при
гораздо более низких температурах, чем в двигателях Отто;
содержит смолистые вещества, в значительно меньших
концентрациях, чем жидкое топливо.
В совокупности все это приводит к выводу, что замена жидкого
дизельного топлива на метан позволит даже без дополнительной очистки газовых
выбросов придти к уровню, предусмотренному стандартом EURO IV, действующим до 2008г
[17].
Однако практическая реализация этого проекта, а также
проекта, связанного с использованием стационарных энергетических установок,
основанных на водородных топливных элементах, должна базироваться на
использовании систем каталитического дожигания метана, концентрация которого в
газовых выбросах может достигать 0,2-0,5%.
Сходную задачу приходится решать при сжигании метана,
содержащегося в газах, удаляемых при вентиляции на угольных разрезах.
Обобщая изложенное, можно отметить, что проблема
каталитического сжигания метана имеет важное практическое значение, как
применительно к газовым смесям с высоким содержанием метана, так и к газовым
потокам с содержанием метана в небольших концентрациях (<2%) (lean burn gas mixture).
При сжигании метана наиболее эффективными являются
палладиевые катализаторы, нанесенные на поверхность различных оксидных
носителей (Al2O3 ZrO2, ZrO2-Y2O3). Однако в последние годы внимание разработчиков привлекают также
ячеисто-каркасные металлические носители, представляющие интерес по той
причине, что в этом случае процедура приготовления нанесенного катализатора
существенно проще, чем традиционная технология, включающая стадии пропитки,
сушки, термообработки и активирования. Эти катализаторы обладают также рядом других
конструктивных и эксплуатационных преимуществ. Однако в литературе отсутствуют
данные о характеристиках палладиевых катализаторов нанесенных на металлические
носители, что осложняет решение вопроса о возможности практического
использования каталитических систем подобного типа.
Наряду с нанесенными палладиевыми катализаторами значительный
интерес представляют оксидные катализаторы со структурой перовскита и флюорита.
К числу их относятся композиции: La0,9Ce0,1CoO3-x, Cu0.2Zr0.8Ox, Cu0.08 [Ce (La)] 0.92Ox. По эффективности они
несколько уступают палладиевым катализаторам, но значительно дешевле последних
и в течении длительного времени сохраняют высокий уровень активности при
эксплуатации до 1100ºС.
беспламенное
сжигание метан катализатор
К группе оксидных катализаторов относятся также промышленные
цемент-содержащие катализаторы, применяемые для полного окисления газообразных
органических веществ. Примером, в частности, может служить катализатор
НТК-10-7Ф. Окислительный процесс в этом случае происходит на оксидах меди и
марганца. Анализ литературных данных показывает, что катализаторы подобного
типа при дополнительной обработке в определенных условиях (модифицировании)
могут быть преобразованы к композициям, которые включают фрагменты, обладающие
структурой флюорита. Этот эффект может быть достигнут при модифицировании
промышленного катализатора диоксидом церия. При положительном результате
открывается возможность практического использования промышленных катализаторов
данного типа для каталитического низкотемпературного окисления метана.
Целью данной работы явилось определение условий приготовления
и исследование физико-химических характеристик палладиевого катализатора,
нанесенного на ячеисто-каркасный металлический носитель, а также промышленного
катализатора (НТК-10-7Ф), модифицированного диоксидом церия.
Обзор
литературы
В обзоре литературы будут рассмотрены вопросы, связанные с
условиями приготовления и характеристиками катализаторов на основе благородных
металлов, оксидов переходных металлов (активность, энергия активации, порядки
реакции по реагентам), а также изложены существующие представления о механизме
из действия.
Сжигание
метана на нанесенных Pd и Pt катализаторах
Анализ данных о полном сжигании метана на благородных
металлах при низких температурах был предметом обстоятельного обзора,
опубликованного Желин и Приме [17], а также в статьях тематического номера
журнала Catalysis Today [1, 18-23].
Принципы
подхода к экспериментальному изучению свойств катализаторов данного типа и
характеристики их активности
Прежде чем приступить к обсуждению результатов этих работ,
следует обратить внимание, что в последние годы тестирование катализаторов
основывается на изучении зависимости степени превращения метана от температуры
при фиксированной скорости газового потока. Эта зависимость (рис.1)
имеет вид сложной кривой, которую можно рассматривать, как сочетание начального
экспоненциального участка и параболической кривой при высоких температурах.
Вид кривой (ее кривизна и положение относительно оси
температур) зависит от скорости газового потока (времени контакта) и активности
катализатора. Таким образом, регистрируемая кривая является характеристикой,
отражающей, с одной стороны возрастание скорости процесса с температурой и, с
другой стороны, связанной с уменьшением скорости процесса вследствие снижения
концентрации реагента и проявления ингибирующего действия продукта реакции. Чем
более полого регистрируемая кривая приближается к координате 100% -го
превращения, тем сильнее выражено действие тормозящих факторов. На практике,
эту кривую принято использовать для нахождения так называемой температурой
зажигания процесса (light off temperature - LOT).
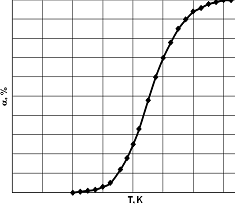
Рис.1. Типичный вид зависимости степени превращения метана от
температуры
Чаще всего при этом указывают значение температуры,
соответствующей 50% конверсии метана, например, эта величина составляет 300°С
для нанесенных палладиевых катализаторов на поверхность частиц SiO2, 253°С для Pd/ZrO2, 370°C для Pd/SnO2, 360°C для Pd/Al2O3 [17].
Абсолютной характеристикой активности катализаторов является либо
мольное число оборотов МЧО (количество моль превращенного продукта к количеству
моль катализатора), либо величина числа оборотов катализатора, в которой моль
превращенного продукта относится к молю активных центров на поверхности
катализатора АЧО. Обе величины (МЧО, АЧО) имеют размерность с-1.
Концентрация активных центров на поверхности катализатора определяется с
помощью метода хемосорбционного титрования. С этой целью в качестве газообразных
титрантов используют: СО, Н2, или О2. Несмотря на то, что
взаимосвязь между концентрациями каталитически активных центров и центров
адсорбции указанных газов является предметом дискуссии, авторы ряда работ [1,
17, 19] при характеристике активности катализатора отдают предпочтение
величине, отнесенной к концентрации активных центров. В иностранной литературе
эту величину принято обозначать TOF - turnover frequency.
Мольное число оборотов, разумеется, значительно меньше указанных
величин, поскольку число активных центров, по крайней мере, в десятки раз
меньше общего числа атомов палладия или платины в катализаторе. Это различие
обусловлено, во первых, тем, что часть катализатора, в случае палладия,
существует в виде оксида и, во вторых, тем, что активными в каталитическом
процессе являются только те атомы, которые находятся на поверхности. Последний
фактор учитывают введением параметра дисперсии активных частиц (dispersion, в русской литературе дисперсность),
который определяют, как отношение числа атомов на поверхности к общему числу
атомов, составляющих металлические частицы. Хикс, при обсуждении полученных им
результатов, приходит к заключению [24], что в зависимости от природы носителя
и условий приготовления катализатора на его поверхности могут формироваться
частицы с малой и высокой дисперсностью. Маленькие кристаллиты образуются в
случае введения малых количеств (<0.5%) активной фазы методом ионного
обмена, тогда как крупные возникают при осаждении больших количеств активной
фазы (>2.3%) методом импрегнирования (пропитка).
В случае платиновых катализаторов TOF может изменяться от 0,0001 сек-1 до 0,08 сек-1,
а для палладиевых - от 0,0001 до 1,3 сек-1. Эта величина также
зависит от типа катализатора и природы носителя [19].
Зависимость
активности нанесенных катализаторов от природы носителя и концентрации палладия
и платины
В качестве носителей для катализаторов указанного типа
используют различные материалы: Al2O3, ZrO2, CeO2, Y2O3, ZSM5, SiO2, TiO2 и др. [17, 25]. Традиционный способ
приготовления нанесенных катализаторов заключается в пропитке пористого
носителя растворами солей Pt и Pd или растворами комплексных соединений (H2PtCl6, PdCl2, Pd (NO3) 2, Pd (NH3) 4 (NO3) 2, Pt (NH3) 4 (NO3) 2, Pd (NH3) 2 (NO3) 2, Pt (NH3) 2 (NO3) 2).
Концентрация палладия или платины в случае нанесенных катализаторов изменяется
от 0,1 до 8-10%. На рис 2-3 показано, как изменяется активность катализатора
при вариации количества палладия, нанесенного на поверхности ZrO2 (рис.2) и Al2O3 (рис.3).
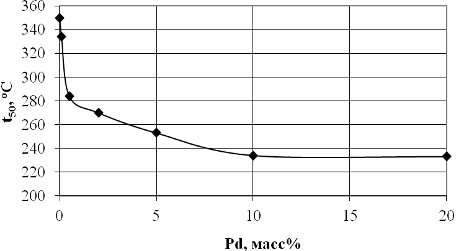
Рис.2. Зависимость температуры 50% конверсии от концентрации Pd на ZrO2
[17]
Как видно, система Pd/ZrO2 проявляет более высокую активность, чем Pd/Al2O3, что
выражается в более низких значениях температуры 50% превращения метана. Однако
в обоих случаях увеличение концентрации палладия сопровождается резким
возрастанием каталитической активности при концентрациях палладия до 5%.
Дальнейшее увеличение концентрации палладия до 20% не приводит к значимым
изменениям каталитической активности: t50 составляет 240°С для Pd/ZrO2 и 380°С для Pd/Al2O3.
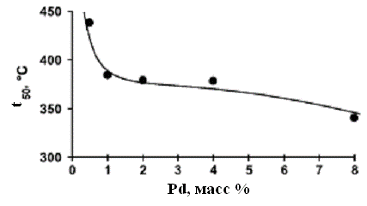
Рис.3. Зависимость температуры 50% конверсии от концентрации Pd на Al2O3 [18]
По общему мнению, авторов [17, 19, 26, 27], исследовавших
катализаторы данного типа, активность палладиевых систем более чем на порядок
превосходит характеристики платиновых катализаторов. На рис.4 дано
сравнение кинетических характеристик указанных катализаторов в реакции полного
сжигания метана по данным Желина [19].
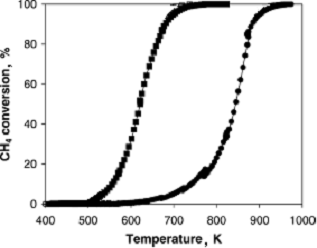
Рис.4. Сравнение зависимостей степени превращения метана на Pd/Al2O3 (■) и Pt/Al2O3 ()
катализаторах от температуры (0,2% CH4; 5% O2, He - баланс; 200мг катализатора, скорость
потока 6л/час, объемная скорость газа 20000 ч-1)
Активность катализаторов зависит от вида химического соединения Pd или Pt, которое используется для пропитки, природы и поверхности
носителя, а также дисперсности металлических частиц. По мнению Желин [17],
использование хлоридсодержащих соединений приводит к получению образцов с
меньшей активностью. Однако при высоких температурах и длительной эксплуатации
эти различия уменьшаются.
В литературе неоднократно рассматривалось влияние природы носителя
на активность катализатора [1, 17, 21, 24]. Обобщая эти данные, авторы приходят
к заключению, что наиболее высокую активность обнаруживают катализаторы Pd/ZrO2, Pd/Y2O3.
Широко распространенное мнение о непосредственной связи между
активностью катализатора и поверхностью носителя в ряде случаев не согласуются
с экспериментальными данными. Например, по данным Хикса [25] катализаторы Pt/ZrO2 с одинаковым содержанием платины,
нанесенные на носитель с поверхностью 83м2, характеризовались
величиной TOF, равной 0,05, тогда как при поверхности
носителя в 42м2 TOF составляла
0,06, и, наконец, при поверхности в 3м2 TOF была равна 0,11. Для сравнения можно указать, что катализатор,
нанесенный на Al2O3 с
поверхностью 160м2, характеризуется значением TOF равным, всего 0,01 (см. табл.1,2).
По всей видимости, доминирующую роль играет не сама по себе
поверхность носителя, а его природа и участие носителя в формировании
каталитически активных центров.
При анализе литературных данных нам не удалось обнаружить сведений
о характеристиках палладиевых или платиновых катализаторах, нанесенных на
металлические носители. Имеются ссылки о применении металловолоконных
материалов для палладиевых катализаторов [28], однако активный компонент был
нанесен не на металлический носитель, а на промежуточный слой Al2O3,
распределенный на поверхности металловолокна.
Таблица 1
Состав платиновых катализаторов и влияние природы носителя на
их активность в реакции окисления метана
|
Состав носителя
|
Температура
обжига носителя (48 ч. в потоке воздуха), (°C)
|
Удельная
поверхность носителя, (м2/г)
|
Источник фазы
платины
|
Температура
обжига катализатора,°C
|
Количество
нанесенной активной фазы, (%)
|
Состав
катализатора
|
Начальная
дисперсия, (%)
|
Число оборотов,
(с-1) при 335°C
|
Энергия
активации, (кДж/моль)
|
|
|
|
|
|
|
|
|
|
Начальноее
|
Конечное
|
|
|
α-AlOOH
(A) a
|
No
|
160
|
H2PtCl6g
|
500
|
0,80
|
0,8% Pt/Al2O3
|
67
|
0,001
|
0,001
|
164
|
|
α-AlOOH
(A)
|
1050
|
60
|
Pt (NH3)
4Cl2i
|
500
|
0,50
|
0,5% Pt/Al2O3
|
31
|
0,10
|
0,10
|
121
|
|
Al2O3
(D) c
|
1000
|
83
|
H2PtCl6g
|
500
|
0,84
|
0,84% Pt/Al2O3
|
90
|
0,001
|
0,005
|
140
|
|
ZrO2
(D)
|
1000
|
83
|
H2PtCl6g
|
700
|
0,78
|
0,78% Pt/Al2O3
|
6
|
0,02
|
0,01
|
138d
|
|
ZrO2
(Z) d
|
No
|
42
|
Pt (NH3)
4Cl2g
|
500
|
0,30
|
0,3% Pt/ZrO2
|
100
|
0,07
|
0,05
|
135
|
|
12% Y2O3/ZrO2
(Z)
|
1050
|
3
|
H2PtCl6i
|
500
|
0,50
|
0,5% Pt/ZrO2
|
40
|
0,09
|
0,06
|
115
|
|
12% Y2O3/ZrO2
(Z)
|
1050
|
3
|
H2PtCl6i
|
500
|
0,50
|
0,5% Pt/YZr2
|
30
|
0,06
|
0,06
|
111
|
|
α-AlOOH
(A)
|
1050
|
3
|
Pt (NH3)
4Cl2i
|
500
|
0,50
|
0,5% Pt/YZrO2
|
20
|
0,11
|
0,11
|
111
|
a A - α - AlOOH дегидрируется до Al2O3 при температуре выше 450˚C;
c D - Оксиды металлов,
синтезированные в пламени (Degusse);
d Z - Осажденные оксиды
металлов (Zircar);
е Значения полученные с помощью линейной интерполяции
к нулевому времени данных в интервале от 2 до 17 часов;
f Предполагаемые значения энергии активации,
измеренные для других образцов;
g Активная фаза нанесена методом ионообмена;
i Активная фаза нанесена методом пропитки.
Таблица 2
Состав палладиевых катализаторов и влияние природы носителя
на их активность в реакции окисления метана
|
Состав носителя
|
Температура
обжига носителя (48ч. в потоке воздуха), (°C)
|
Удельная
поверхность носителя, (м2/г)
|
Источник фазы
платины
|
Температура
обжига кат. (2ч., в потоке воздухе), (°C)
|
Количество
нанесенной активной фазы, (%)
|
Средняя
температура реакции, (˚C)
|
Число оборотов,
(с-1) при 300˚Ca (после 4ч)
|
|
α-AlOOH
(A)
|
1050
|
60
|
H2PdCl4e
|
500
|
0,50
|
280
|
0,470
|
|
α-AlOOH
(A)
|
1200c
|
4
|
Pd (NH3)
4Cl2e
|
500
|
0,50
|
300
|
0,210
|
|
Al2O3
(D)
|
1200c
|
4
|
Pd (NH3)
4Cl2e
|
500
|
2,00
|
280
|
1,330
|
|
Al2O3
(D)
|
1000
|
83
|
H2PdCl4d
|
700
|
0, 20
|
350
|
0,005
|
|
Al2O3
(D)
|
1000
|
83
|
H2PdCl4d
|
500
|
0,46
|
310
|
0,010
|
|
Al2O3
(D)
|
1000
|
83
|
H2PdCl4d
|
700
|
0,46
|
300
|
0,012
|
|
12%Y2O3/ZrO2
(Z)
|
1000
|
83
|
H2PdCl4d
|
700
|
2,30
|
300
|
0,860
|
a Приведено к 300˚C, используя измеренные
энергии активации;
c Термообработка только на воздухе в течении 2-х
часов;
d Активная фаза нанесена методом ионообмена;
e Активная фаза нанесена методом пропитки.
Кинетические
характеристики окисления метана на нанесенных палладиевых и платиновых
катализаторах
Данные о кинетике окисления метана были получены в работах
[29-34]. Результаты выполненных исследований показали, что окисление метана на
палладиевых катализаторах характеризовалось первым порядком по метану и равным
или близким к нулю - по кислороду. Это означает, что вся поверхность
катализатора покрыта слоем адсорбированного кислорода, и скорость реакции
зависит только от парциального давления метана. Ряд авторов отмечает
возможность ингибирования процесса продуктами реакции: парами воды и СО2.
Масштабы этого воздействия зависят от природы носителя, парциальных давлений
воды и CO2 в газовых потоках и температуры.
Ребейро и Гроппи [35-38] сообщили, что скорость реакции
каталитического окисления метана на палладии, нанесенном на Al2O3, не изменяется в
присутствии CO2 вплоть до концентрации 0,5% по объему (порядок реакции по СО2
в этом случае равен нулю), тогда как при более высоких концентрациях порядок
реакции уменьшается до значения равного −2.
По данным работ [34, 37, 39] порядок реакции по воде был
отрицательным и изменялся от (−0,4) до (−1).
Для палладиевого катализатора, нанесенного на ZrO2, Форцатти предложил [21]
выражение для скорости реакции в виде
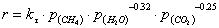
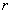 - скорость реакции;
- скорость реакции;
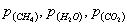 - парциальные
давление участников реакции, а показатели степени равны порядкам реакции по
каждому из компонентов.
- парциальные
давление участников реакции, а показатели степени равны порядкам реакции по
каждому из компонентов.
Из приведенного уравнения следует, что ингибирующее действие воды
выражено не так сильно [35, 36, 38], однако не исключено, что это связано с
природой носителя. В работах, опубликованных в последние годы, эффект влияния
воды обнаруживался только при t>550°С [21],
а по данным [40, 41] даже выше 600°С. Ингибирующее действие воды, как полагают
авторы работ [21, 37, 42], обусловлено гидратацией частиц PdO, ответственных за каталитическое
действие:
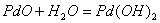
Важнейшей кинетической характеристикой процесса является кажущаяся
энергия активации. В последние годы величина этого параметра в большинстве
работ определяется по зависимости степени превращения метана от температуры (рис.1).
В этом случае экспериментальные данные о скорости процесса при каждой
температуре представляют в координатах
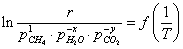
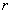 - скорость реакции;
- скорость реакции;
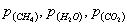 - парциальные давление участников реакции;
- парциальные давление участников реакции;
показатели степени равны порядкам реакции по каждому из
компонентов (порядок реакции по кислороду, воде и СО2 при
температурах ниже 550°С равен нулю);
Т-температура.
Обобщение данных о приводимых в литературе значениях кажущейся
энергии активации было сделано Форцатти [1]
Таблица 3
Сравнение числа оборотов для окисления метана на нанесенных Pd катализаторах [1, 37]
|
Число оборотов
(TOF), с-1
|
Размер частиц,
нм
|
Ea,
кДж/моль
|
Литературный
источник
|
|
0.007 - 0.1
|
1,4-5,6
|
71-84
|
[43]
|
|
0.0001 - 0.002
|
1-30
|
110-125
|
[24]
|
|
0.003
|
3
|
-
|
[26]
|
|
0.03
|
16
|
-
|
[44]
|
|
0.0001 - 0.02
|
2-80
|
80-160
|
[45]
|
|
0.02 - 0.8
|
2-110
|
75-90
|
[37]
|
Эту информацию можно дополнить результатами, приводимыми в
работе Желина [19], табл.4.
Таблица 4
Энергия активации и температуры 10, 30 и 50% степени
конверсии метана в реакции окисления метана на Pd и Pt катализаторах
|
Катализатор
|
T10,
K
|
T30,
K
|
T50,
K
|
Ea,
кДж/моль
|
|
Свежий
|
Pd/Al2O3
|
531
|
571
|
593
|
85
|
|
Состаренный
|
Pd/Al2O3
|
553 (+22)
|
593 (+22)
|
622 (+29)
|
103
|
|
Свежий
|
Pt/Al2O3
|
596
|
653
|
698
|
85
|
|
Состаренный
|
Pt/Al2O3
|
743 (+147)
|
813 (+160)
|
843 (+145)
|
90
|
Катализаторы, приготовленные в работе Желина, были разделены
на две группы: свежие (окисленные) - прогретые в кислороде при Т=771К, затем
охлажденные в гелии до 433К, и состаренные - прокаленные в смеси 5% кислорода в
гелии 1 час при 873К с последующим охлаждением в гелии до 400К.
В случае палладиевых катализаторов активность свежих и
состаренных катализаторов отличалась незначительно, Δt50 = 30°С, тогда как в случае платины эта величина составляла 145°С.
Следует также отметить, что уровень активности палладиевых катализаторов был
достаточно высок, и t50 составляла 320°С. Числа оборотов имели соответственно значения
11,9 и 7,7 ч-1. Найденные значения кажущейся энергии активации
составили 85 кДж/моль для свежего и 103 кДж/моль для состаренного
катализаторов.
Рассмотрение приведенных данных позволяет прийти к
заключению, что значения кажущейся энергии активации на палладии и платине
практически совпадают и сравнительно слабо зависят от природы носителя.
Например, в работе Хикса исследовались платиновые катализаторы, нанесенные на Al2O3, ZrO2, Y2O3, и, вариации значений
кажущейся энергии активации не превосходили 15%. Вместе с этим можно
констатировать, что "старение" катализаторов при длительной
эксплуатации обусловлено вероятнее всего ингибированием парами воды, что в свою
очередь приводит к увеличению кажущейся энергии активации.
Механизм
действия палладиевых катализаторов в реакции окисления метана
В настоящее время твердо установлено, что в нанесенных
палладиевых катализаторах палладий после активирования существует в двух состояниях,
а именно в виде частиц оксида палладия (PdO) и металлического
палладия (Pd), имеющих различную степень дисперсности. Термином дисперсность
обозначают отношение числа атомов, образующих поверхность активной частицы к
общему числу атомов (молекул) в ее объеме.
С помощью измерений термопрограммируемого окисления палладия
было установлено, что его окисление с образованием PdO происходит при
температурах выше 370°С [1], а диссоциация оксида имеет место при температурах
выше 600°С. Дополнительная информация о разложении PdO была получена с помощью
высокотемпературной дифракции рентгеновского и синхротронного излучения
[46-50]. Следовательно, каталитическое действие палладия в катализаторах
данного типа может быть связанно либо с присутствием металлического палладия,
либо с присутствием оксида палладия. Не исключено также, что реакция
развивается на поверхности, разделяющей обе указанные фазы.
В выяснении этого вопроса решающую роль сыграли данные о
температурно-программируемой реакции окисления метана на палладии,
распределенном на поверхности поверхности La2O3. На рис.5
показано, как изменяется степень превращения метана в зависимости от
температуры в режиме нагревания катализатора и его последующего охлаждения от
максимальной температуры до 200°С. Как видно, степень превращения постепенно
возрастает с повышением температуры, но не достигает 100% и выше 630°С начинает
вначале уменьшаться, затем проходит через минимум при температуре 730°С и вновь
возрастает до 100% при 840°С. Охлаждение не воспроизводит кривую, наблюдаемую
при повышении температуры. При обратном ходе наблюдается наличие глубокого
минимума при 600°С, с последующем возрастанием активности почти до 70%, при
480°С, и дальнейшим спадом до нуля.
Для интерпретации эффектов наблюдаемых при нагревании
катализатора было высказано предположение, что падение активности выше 630°С
обусловлено термической диссоциацией оксида палладия до палладия. При более
высоких температурах (730°С) спад каталитической активности компенсируется
окислением метана на поверхности палладия, образовавшегося в результате
термического разложения оксида.
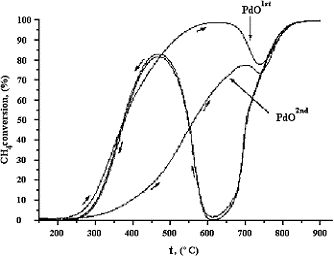
Рис.5. Эффекты, наблюдаемые в цикле
"нагревание-охлаждение" катализатора Pd/La2O3 [1]
Эффекты, имеющие место при охлаждении катализатора были объяснены
следующим образом. Первый глубокий спад при охлаждении обусловлен резким
уменьшением активности металлического палладия. Увеличение активности
катализатора в интервале температур от 600°С до 450°С связанно с окислением
металлического палладия до оксида. Дальнейший спад обусловлен снижением
скорости процесса за счет понижения температуры. Исходя из этого, было сделано
заключение о том, что, каталитический процесс протекает с участием PdO, тогда как активность металлического
палладия, по крайней мере, на порядок меньше, чем у оксида.
Отсутствие однозначно установленной корреляции между дисперсностью
металлического палладия и активностью катализаторов ставят под сомнения
предположения о развитии процесса на межфазной границе PdO-Pd.
Вместе с этим условия разложения PdO могут зависеть от природы носителя и, следовательно, наличие
гистерезиса, отмеченного для системы Pd/La2O3, может
не наблюдаться. По литературным данным диссоциация PdO происходит на Al2O3 - ≥800°C, на диоксиде
циркония - >700°C, на TiO2 и
CeO2 - ≥700°C. В любом
случае, катализаторы, содержащие 2-4% PdO в
форме термодинамически стабильной фазы, были активны при t>300°C [46, 48, 51].
Платиновые катализаторы принципиально отличаются по природе
каталитически активных центров. В противоположность оксиду палладия оксид
платины неустойчив и летуч. Поэтому в данном случае активность катализатора
связывают с присутствием частиц металлической платины и их дисперсностью. Чем
выше дисперсность частиц, тем выше активность платинового катализатора.
В последние годы интерес исследователей концентрируется на
изучении поведения новых типов носителей и, прежде всего, стабилизированного ZrO2, SnO2, SnO2/NiO. Это вполне объяснимо, поскольку данные
носители приводят к получению наиболее активных каталитических систем [52-59].
Высокая активность этих катализаторов также связывают с корреляцией между
восстанавливаемостью частиц PdO и природой
носителя [60]. Существенное преимущество палладиевого катализатора, нанесенного
на ZrO2 (t50=234°C), по сравнению
с Al2O3, состоит
не только в более высокой активности, но и в высокой стабильности [61].
Значительное внимание в литературе уделено вопросам, связанным с
отравлением платиновых и палладиевых катализаторов. Наиболее сильным
отравляющим действием обладают SO2 и H2S. Механизм отравления связан с
образованием на поверхности носителя устойчивых сульфатов. Возникновение
последних всегда отмечается в случае оксидных носителей, обнаруживающих
основные свойства, например, на основе Al2O3. Тогда как в случае пассивных подложек (TiO2, ZrO2) этот эффект выражен в значительно меньшей степени. В связи с
этим, исследования окисления метана на палладиевых катализаторах должны
проводится в условиях глубокой очистки метана от серосодержащих примесей. Сравнительная
характеристика различных Pt и Pd содержащих катализаторов (методы
приготовления, удельная поверхность, температура активирования, масса
катализаторов), а также информация относящаяся к условиям тестирования
(скорости газовых потоков, температуры, составы газовых смесей) приведены в
таблице 5. Все эти сведения были приняты во внимание при определении условий
тестирования приготовленных катализаторов, а также учтены при обработке
полученных результатов.
Таблица 5
Характеристика различных Pt и Pd содержащих катализаторов
|
Катализатор, Me
(%) /Носитель
|
Метод
приготовления
|
Sуд,
м2/г
|
Активация,
реактор
|
mкат,
гр
|
Скорость
газового потока
|
СН4,
%
|
О2,
%
|
Балансные газы
|
t50,°C
|
t90,°C
|
t100,°C
|
Ea,
кДж/моль
|
Литературный
источник.
|
|
Pd (5) /La -
doped Al2O3
|
Пропитка Pd (NO3)
2,Обжиг 1000°С
|
|
|
|
1100000 см3/
/ (гр·ч)
|
5000ppm
|
He
|
380
|
520
|
610
|
|
[51]
|
|
Co3O4
Au (0.18) /Co3O4 Au (1.91) /Co3O4
Pt/Co3O4 (0.21) Pt/Co3O4 (1.96)
Pt/Co3O4 (0.19) Pt/Co3O4 (1.92)
Au-Pt (0.38) /Co3O4 (0.23) Au-Pt (1.9) /Co3O4
(0.19) Au-Pt (1.92) /Co3O4 (1.63) Au-Pt (4.76) /Co3O4
(1.67) Au-Pd (1.9) /Co3O4 (1.48) Pd (-) /Al2O3
(1.58) Pd (-) /Al2O3 (3.7)
|
Соосожд.
|
51.7 55.3 52.2
64.5 72.6 62.3 66.2 59.2 59.8 61. 64.1 48.5 139.8 132.5
|
1ч при 400°С в
потоке воздуха
|
0,1; 60-80 mesh
|
10000ч-1
|
1
|
5
|
N2
|
325 317 314 312
308 307 304 305 303 295 296 317 338 313
|
376 370 369 358
348 350 338 340 338 332 336 363 367 339
|
420 420 418 400
385 392 376 379 368 360 364 388 387 358
|
|
[62]
|
|
Pd
(1%) / Al2O3 Pd (1%) /ZrO2 Pd (1%) /ZrO2-SiO2
(SiO2=3.5%)
|
Пропитка, Обжиг
4 ч при Т=700С
|
Уд пов подложки
Al2O3=379 ZrO2=20 ZrO/SiO2=75
|
Восстановление
в H2 - 2часа при 500С Реактор U образный
|
0,1
|
50 мл/мин
|
5
|
20
|
N2
|
370 310 305
|
427 382 342
|
595 567 547
|
|
[63]
|
|
Pd
(2.2%) /γ - Al2O3 (свежий) Pt (1.92%) /γ - Al2O3 (свежий) Pd (2.2%) /γ - Al2O3
(состарен.) Pt (1.92%) /γ - Al2O3
(состарен.)
|
Пропитка и
обжиг 600 С в течении часа (свежий)
|
137 139 119 120
|
U-образный
реактор 16 мм
|
200мг
|
108мл/мин
|
2000 об ppm
|
5
|
He
|
320 425 350 570
|
377 552 407 612
|
457 677 477 687
|
85 85 103 90
|
[19]
|
|
Pt (0.26%) / γ - Al2O3
|
H2PtCl6·6H2O
Т (обж) =500°С H2PtCl6·6H2O Т (обж) =575°С H2PtCl6·6H2O
Т (обж) =632°С
|
Al2O3=180
|
d (реактора)
=8мм
|
0.4
|
|
2
|
10
|
N2
|
487 500 510
|
507 520 528
|
542 557 565
|
|
[64]
|
|
Pd
(1%) / SnO2 Pd (1%) /SnO2 - Al2O3
Pd (1%) /SnO2-CeO2 Pd (1%) /SnO2-Fe2O3
Pd (1%) /SnO2-MnO Pd (1%) /SnO2-NiO Pd (1%) /SnO2-ZrO2
|
|
6.4 55.3 13.1
1.8 1.4 4 11.3
|
|
|
48000ч-1
|
1
|
20
|
N2
|
350 430 400 580
670 430 380
|
440 630 585 825
855 540 490
|
490 770 680 930
900 600 540
|
|
[65]
|
|
Pd/
Al2O3 Pd/HY Pd/ H-SAPO-5 Pd/ Na-SAPO-5
|
Пропитка, обжиг
800°С
|
109 411 107 166
|
|
|
1·105
ч-1
|
1
|
20
|
N2
|
435 395 430 410
|
665 475 480 570
|
800 545 510 670
|
|
[66]
|
|
Pd
(1%) /Al2O3 Pd (1%) /Mn3O4 Pd
(1%) /Cr2O3 Pd (1%) /Fe2O3 Pd
(1%) /PbO Pd (1%) /CoO Pd (1%) /CeO2 Pd (1%) /Ag2O Pd
(1%) /PtO Pd (1%) /SnO2 Pd (1%) /NiO Pd (1%) /CuO Pd (1%) /RhO
|
Сопропитка
хлоридом Pd и нитратом металлов, затем наненесение на Al2O3 Мольное отнош.
Pd/Me=9 Обжиг 800 С
|
|
|
|
1·105
ч-1
|
1
|
20
|
N2
|
533 450 445 460
460 435 430 410 425 430 380 465
|
|
|
|
[67]
|
Окисление
метана на оксидных катализаторах
Для каталитического окисления метана используют оксидные
композиции различного состава. Для низкотемпературного окисления (<700°C) применяют
индивидуальные оксиды в элементов, а также оксидные композиции со структурой
перовскита и флюорита. При высоких температурах (>1000°C) используют катализаторы
со структурой флюорита CeO2-La2O3, CeO2-ThO2, UO2-ThO2 [68-71], и пирохлора La2Ce2O7 [9].
Учитывая направленность данной работы, основное внимание в
данном разделе будет уделено рассмотрению свойств низкотемпературных
катализаторов. К числу их, как уже отмечалось ранее, относятся
перовскитоподобные катализаторы и катализаторы, содержащие СeO2.
К перовскитоподобным принято относить класс соединений,
имеющих структуру, сходную с минералом перовскитом СаТiO3. Схема элементарной
ячейки идеального перовскита вида АВХ3 приведена на рис.6.
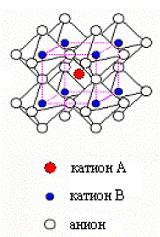
Рис.6. Элементарная ячейка структур перовскитного типа (АВХ3)
А - катион большего радиуса (координационное число 12);
В - катион меньшего радиуса (координационное число 6);
Х - анион
В роли А-катиона выступают ионы редкоземельных или
щелочноземельных металлов, а в роли В-катиона - ионы переходных металлов. В
качестве аниона перовскитная структура может включать ион кислорода, фтора, а в
некоторых случаях также хлора, брома, йода и сульфидный ион S2-.
Перовскитные типы соединений охватывают очень широкую область
композиций. Так, например, Гудинаф и Лонго приводят список, включающий около
300 подобных соединений, с информацией о кристаллографических и магнитных
свойствах [72].
Первые сведения о каталитической активности композиций,
обладающих структурой, родственной дефектному перовскиту, были получены
Парравано в 1952 году [73]. В 1970 году Медоукрофт показал, что соединение La0.8Sr0.2СоО3 в
некоторых окислительно-восстановительных процессах проявляет активность,
сопоставимую с платиновыми катализаторами [74], а вскоре Либби [75] и Педерсен
[76] открыли возможность использования перовскитов в качестве катализаторов для
реакции окисления углеводородов.
Значительный шаг вперед в подборе высокоактивных
катализаторов был сделан Ямазое и Тераокой, которые, обобщив имеющиеся в
литературе сведения, так сформулировали основные эмпирические подходы к поиску
эффективных катализаторов с перовскитоподобной структурой [77]:
) В классе соединений, обладающих перовскитоподобной
структурой вида АВО3 или А2ВО4, замещение
позиции занятых в кристаллической решетке обоими катионами (А и В) воздействует
на каталитическую активность.
) Выбор правильного сочетания катионов А и В, а также
частичное замещение одного или обоих катионов, позволяет добиться изменения
валентного состояния иона в положении В и изменить дефектную структуру
вещества.
) Изменение дефектной структуры вызывает изменение химических
и транспортных свойств оксидных композиций, что оказывает прямое или косвенное
влияние на каталитическую активность.
Ферри и Форни показали, что замещения позиции А в семействе La1-xАxВО3 (B = Co, Fe, Ni) оказывает очень сильное
воздействие на скорость окисления метана [78]. Замещение La3+ на Sr2+ и Ce4+ приводит соответственно
к уменьшению или увеличению активности катализатора в отношении окисления
метана. Этот эффект был связан с частичным изменением зарядового состояния Co на Co4+ и Co2+ соответственно и, как
следствие, изменением концентрации кислорода и его подвижности в
кристаллической решетке.
Такая схема, однако, не исчерпывает возможного многообразия
факторов, влияющих на каталитическую активность, и на сегодняшний день не
существует чёткой теории, позволяющей точно предсказать возможную активность
перовскитоподобных соединений исходя из их элементарного состава.
Наиболее распространенная на сегодня гипотеза о механизме
каталитического действия смешанных оксидных композиций была сформулирована
Воорхове [79, 80]. Согласно Воорхове, каталитическое окисление на комплексных
оксидных катализаторах протекает с участием атомов кислорода, принадлежащих
поверхности или объему перовскита. Роль окисляющего агента состоит в
восполнении этих кислородных атомов. В зависимости от того, способен ли
кислород из объема катализатора принимать участие в процессе, были выделены два
варианта реализации названного механизма - поверхностный (suprafacial) и объемный (intrafacial).
Поверхностный катализ реализуется благодаря наличию атомных
орбиталей соответствующей симметрии и энергии для адсорбции реагентов и
промежуточных продуктов на поверхности катализатора. В реакцию вовлекаются
адсорбированные и/или поверхностные ионы кислорода.
Объемный катализ, в основном, превалирует при сравнительно
высоких температурах. При таком механизме во множестве повторных циклов
окисления-восстановления участвуют не только поверхность, но и объем
катализатора. В реакцию вовлекаются ионы кислорода, входящие в кристаллическую решетку.
Рассмотрим каждый из этих механизмов более подробно на
примере реакции окисления метана.
В формализованном виде при сравнительно низких температурах
(Т<400-450°C)
механизм реакции можно представить следующим образом [81]:
) Адсорбция газообразного кислорода на поверхности
катализатора, за которой следует образование активных частиц кислорода

) Реакция между газообразным СН4 и О*, протекающая
через промежуточный комплекс
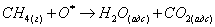
3) Десорбция продуктов
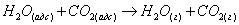
Согласно данным Араи с соавторами [82], скорость лимитирующей
стадии является реакция между активными частицами кислорода и газообразным
метаном, и весь процесс описывается механизмом Или-Ридеала (Eley-Rideal):
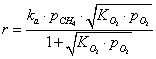
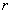 - скорость реакции;
- скорость реакции;
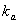 - константа скорости реакции;
- константа скорости реакции;
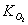 - константа адсорбции кислорода на поверхности катализатора;
- константа адсорбции кислорода на поверхности катализатора;
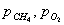 - парциальные давление метана и кислорода.
- парциальные давление метана и кислорода.
Принято считать, что роль поверхности катализатора при таком
механизме сводится к предоставлению орбиталей соответствующей энергии и формы
для адсорбции реагентов. Как показал Фиерро [83], для соединений вида АВО3
в ряду В=V, Сr, Мn, Fе, Со, Ni оптимальной электронной конфигурацией,
позволяющей добиться максимальной каталитической активности в реакциях,
протекающих по поверхностному механизму, обладают ионы Ni3+ и Со3+.
По мере увеличения температуры возрастает подвижность кислорода в
кристаллической решетке и при сравнительно высоких температурах решеточный
кислород начинает участвовать в реакции окисления метана. Об этом, в частности,
свидетельствует резкий излом на Аррениусовой кривой и изобарах адсорбции,
обнаруженный авторами [82] при изучении активности образцов La0,8Sr0,2MnO3 в данной реакции. Таким образом, с
повышением температуры происходит смена поверхностного механизма на объемный.
При этом, благодаря очень быстрой миграции кислорода из кристаллической решётки
к поверхности, скорость реакции становится нечувствительной к изменению давления
кислорода и может быть выражена следующим уравнением:
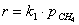
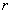 - скорость реакции;
- скорость реакции;
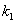 - константа скорости реакции;
- константа скорости реакции;
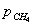 - парциальное давление метана.
- парциальное давление метана.
Однако деление механизмов на поверхностный и объемный и попытки
классифицировать реакции по этому критерию, являются достаточно условными и
нужно говорить в первую очередь о преобладании одного механизма над другим.
Принимая во внимание изложенное, общее уравнение, описывающее
скорость реакции окисления метана на перовскитоподобных катализаторах во всём
интервале температур принимает вид:
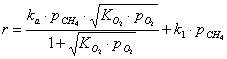
Как видно данное уравнение не учитывает адсорбцию на поверхности
катализаторов СО2 и воды.
В этом приближении кинетическое уравнение может быть представлено
в упрощенном виде выражением
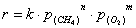
Для большинства перовскитоподобных оксидов показатель n у давления метана равен единице. Однако Чамбелли [84]
наблюдал слабовыраженную нелинейность зависимости скорости реакции от давления
метана для катализатора LaFeO3 и принял значение n = 0.77, т.е. допустил, что скорость реакции имеет порядок,
отличающийся от единицы по метану. Этот эффект, по мнению авторов, может быть
связан с адсорбцией CO2 и воды на поверхности катализатора. В условиях, когда окисления
метана проводится в присутствии значительного избытка кислорода давление
кислорода можно считать неизменным в ходе реакции и, уравнение можно привести к
виду
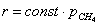
Таким образом, можно заключить, что в рамках сложившихся
представлений основным фактором, определяющим активность перовскитов в
поверхностных процессах, принято считать природу d или f-элемента, а при объемном катализе
дефектную структуру кристаллов, которая определяет подвижность кислорода в
кристаллической решётке.
Исследования каталитической активности перовскитов было проведено
на различных объектах в различных каталитических центрах США, Италии, Японии.
Наибольшее внимание при этом уделялось изучению свойств перовскитов с участием La, а также смешанных оксидов со структурой
флюорита. Следует отметить также, что к группе каталитически активных оксидных
композиций могут быть отнесены CoOx,
CoMnOx, CoMn2Ox, MnOx и композиции включающие оксид олова и, в частности SnCrOx. В таблице 6 приведена информация о
составе, условиях тестирования и каталитической активности t50, t90, t100.
Таблица 6
Приготовление перовскитных катализаторов и влияние их
структуры на их активность в реакции окисления метана
|
Катализатор,
формула
|
Метод
приготовления
|
Sуд,
м2/г
|
Активация,
реактор
|
Масса
катализатора, гр.
|
Масса балласта,
гр.
|
Скорость
газового потока
|
СН4,
%
|
О2,
%
|
Балл. газы
|
t50,°C
|
t90,°C
|
t100,°C
|
Ea,
кДж/моль
|
Литературный
источник
|
|
LaCoO3
La0.95Ce0.05CoO3 La0.9Ce0.1CoO3
La0.8Ce0.2CoO3 La0.95Eu0.05CoO3
La0.9Eu0.1CoO3 La0.9Ce0.1CoO3
La0.9Ce0.1CoO3
|
FH CM SGC
|
17.9 19.4 24
20.6 20.6 18.3 4.6 22
|
1 ч. - 650 оС,
Ø р-ра
- 7мм
|
0,2
(0,15-0,25мм)
|
1,3 (0,15-0,25
мм)
|
20 мл/мин
|
0,52
|
10
|
He, N2
|
466 459 438 468
450 462 540 520
|
|
>600 580 560
600 580 580 >600 >600
|
|
[85]
|
|
La0.9Sr0.1CoO3
|
SGC
|
|
1 ч. - 650 оС,
Ø р-ра
- 7мм
|
0,2
(0,15-0,25мм)
|
1,3 (0,15-0,25
мм)
|
20 мл/мин
|
0,52
|
10
|
He, N2
|
530
|
|
|
|
[86]
|
|
LaCoO3
LaMnO3 LaFeO3 LaCuO3 LaNiO3 LaCrO3
Pt (1wt%) /Al2O3
Холостой опыт
|
Разложение
ацетатов и нитратов. Обжиг - 850оС Метод осаждения. Обжиг - 500оС
|
3 4 3.1 0.6 4.8
1.9 146.5
|
|
|
|
5·104
ч-1
|
2
|
20
|
N2
|
525 579 571 672
702 780 518 834
|
|
840 700 900
|
92 91 76 99 81
120 115 257
|
[82]
|
|
LaFeO3
|
Метод осаждения.
Обжиг - 750оС
|
|
|
0,1
|
0,9г. Al2O3
(22-30 mesh)
|
85 мл/мин,
51000 см3/ (г·ч)
|
4
|
20
|
N2
|
610
|
700
|
900
|
|
[87]
|
|
La0.96Co0.7Fe0.34O3
|
Reactive
grinding. Обжиг - 600оС
|
37.8
|
|
0,1
|
|
5625ч-1
11250ч-1 16875ч-1 22500ч-1 30000ч-1
|
0,3
|
98,7
|
Ne
|
395 415 430 440
450
|
|
480 490 >500
>500 >500
|
165 178
|
[88]
|
|
La0.9Sr0.1NiO3
|
SGC
|
1,0
|
Ø р-ра
- 9мм
|
0,1
|
0,2 SiO2
(0,125-0,25мм)
|
240 мл/мин
|
2
|
4
|
N2
|
725
|
|
|
|
[89]
|
|
Cu0.2Zr0.8Ox
Cu0.08 [Ce (La)] 0.92Ox Cu0.5 [Ce
(La)] 0.5Ox Cu0.5Zr0.5Ox
Ce (La) O2 CeO2
|
Метод
соосаждения. Обжиг - 650оС
|
17.8 43 27.8 50
30 28
|
Ø р-ра
- 6мм
|
0,15
|
|
100 мл/мин
42000ч-1
|
2
|
16
|
N2,
He
|
440 480 500 510
540 650
|
530 580 590 610
630 690
|
600 610 610 700
700 730
|
|
[90]
|
|
LaMnO3
La0.9Sr0.1MnO3 La0.8Sr0.2MnO3
La0.7Sr0.3MnO3 La0.6Sr0.4MnO3
La0.5Sr0.5MnO3
|
SGC
|
8.8 5.3 5.1 8.4
10.4 12.2
|
1ч. - 700оС.
Ø р-ра
- 9мм
|
0.1
|
0.2 SiC
(0.59-0.84мм)
|
240 мл/мин
45000ч-1
|
2
|
4
|
N2
|
600 600 610 570
700 600
|
850 800 800 750
700
|
>800 >800
>800 >800 >800 800
|
62 56 49
|
[91]
|
|
LaMnO3
La0.7Ag0.3MnO3 La0.7Ce0.3MnO3
La0.7Sr0.3MnO3
|
Соосождение
|
|
Ø р-ра
- 15мм
|
2,5
|
|
10000ч-1
|
1
|
20
|
N2
|
467 397 477 437
|
527 497 552 520
|
577 547 617 570
|
|
[92]
|
|
CoOx
CoMnOx CoMn2Ox MnOx
|
SGC
|
|
Ø р-ра
- 10мм
|
0.1
|
|
100 мл/мин
|
0,5
|
1,5
|
Ar
|
410 485 450 500
|
510 600 600
|
610 750 710
|
85 156
|
[93]
|
|
LaMnO3
NdMnO3 SmMnO3 Sm0.9Sr0.1MnO3
Sm0.7Sr0.3MnO3 Sm0.5Sr0.5MnO3
|
SGC Обжиг - 800оС
|
20 20 19 20 14
13
|
|
1доля
|
10долей SiO2
(180-250мм)
|
40000ч-1
|
0,4
|
10
|
N2
|
507 587 527 547
532 527
|
577 687 632 642
637 637
|
647 >800 727
727 727 727
|
|
[94]
|
|
Sm2Zr2O7
|
Гидролиз Обжиг
- 1000°С
|
3,1
|
|
|
|
20000ч-1
|
1
|
20
|
N2
|
590
|
660
|
680
|
|
[95]
|
|
LaMnO3
LaCo0.3Mn0.7O3 LaCo0.5Mn0.5O3
LaCo0.7Mn0.3O3 LaCoO3 La0.9Ce0.1MnO3
La0.9Ce0.1Co0.3Mn0.7O3
La0.9Ce0.1Co0.5Mn0.5O3
La0.9Ce0.1Co0.7Mn0.3O3
La0.9Ce0.1CoO3 La0.8Ce0.2MnO3
La0.8Ce0.2Co0.3Mn0.7O3 La0.8Ce0.2Co0.5Mn0.5O3
La0.8Ce0.2Co0.7Mn0.3O3
La0.8Ce0.2CoO3 La0.7Ce0.3MnO3
La0.7Ce0.3Co0.3Mn0.7O3 La0.7Ce0.3Co0.5Mn0.5O3
La0.7Ce0.3Co0.7Mn0.3O3
La0.7Ce0.3CoO3 La0.6Ce0.4MnO3
La0.6Ce0.4CoO3 La0.5Ce0.5MnO3
La0.5Ce0.5CoO3
|
SGC
|
16.5 17.7 18
17.2 11.3 32.3 31.4 16 10.2 10 32.6 28.6 20.8 16.1 14.2 27.7 31 24 16 14.3
|
|
0.1
|
|
75 мл/мин 45000
см3/ (г·ч)
|
1
|
20
|
N2
|
514 507 612 627
597 487 547 517 522 514 529 567 502 512 520 542 557 507 517 508 557 527 552
622
|
595 582 675 720
698 572 640 600 616 605 638 668 580 604 620 647 665 608 618 588
|
|
|
[96]
|
|
Cr2O3
SnCrOx SnCr2Ox SnCr3Ox SnCr4Ox
SnCr5Ox SnCr6Ox SnCr7Ox
SnO2
|
Метод
соосождения, обжиг 600оС (6 часов)
|
10 20 46 50 71
70 68 90 29
|
Ø р-ра
- 6мм
|
0,2
|
1 SiO2
(40-60mesh)
|
70 мл/мин
21000ч-1
|
1,5
|
18
|
N2
|
500 420 420 400
385 385 430 450 440
|
600 445 490
|
>600 560 550
540 470 490 500 510 520
|
89 163 141
|
[97]
|
|
LaMnO3
La0.8Sr0.2MnO3 La0.6Sr0.4MnO3
La0.9Eu0.1MnO3 La0.9Ce0.1MnO3
|
SGC Обжиг -
700-750оС
|
20 45.4 18.7
26.4 32
|
1ч - 650°С, Ø р-ра - 9мм
|
0,2
|
1,3 SiO2
|
40 мл/мин
|
0,5
|
10
|
N2
|
440 470 430 450
|
495 540 480 515
|
540 600 550 570
|
|
[98]
|
|
Co0.05Mg0.95Ox
Co0.1Mg0.9Ox Co0.15Mg0.85Ox
Co0.2Mg0.8Ox MgO
|
Метод
осаждения, обжиг - 650-850°С
|
42,5 31,2 27,4
21,8
|
Ø р-ра
- 7мм
|
0,2
|
|
40000ч-1
|
1
|
20
|
N2
|
550 550 580 580
690
|
580 600 615 615
750
|
|
[99]
|
FH - пламенный гидролиз; CM - прокалка с последующим
размолом; SGC - золь - гель технология
Сопоставление данных приведенных в таблице 6 осложнено
различными условиями тестирования катализаторов: массы навески, объемной
скорости газового потока, начального количество метана. Однако, если
ориентироваться только на температуры 50% окисления метана, то можно выделить
катализаторы со структурой, обладающие высокой активностью. К ним следует
отнести смешанные оксидные композиции с перовскитоподобной структурой и
катализаторы со структурой флюорита. Характеристики первой группы объектов
приведенны в таблице 7.
Таблица 7
Температуры 50% и 100% степени превращения метана на наиболее
активных катализаторах
|
Катализатор
|
Удельная
поверхность, м2/гр
|
t50,°C
|
t100,°C
|
Литературный
источник
|
|
La0.9Ce0.1CoO3
|
24.0
|
438
|
560
|
[85]
|
|
La0.96Co0.7Fe0.34O3
|
37.8
|
395
|
480
|
[88]
|
|
LaCo0.3Mn0.7O3
|
17.7
|
507
|
-
|
[96]
|
|
La0.8Ce0.2Co0.5Mn0.5O3
|
20.8
|
502
|
-
|
|
|
La0.7Ce0.3CoO3
|
14.3
|
508
|
-
|
|
|
LaMnO3
|
-
|
500
|
650
|
[2]
|
|
LaMnO3
|
20.0
|
507
|
647
|
[94]
|
|
LnMnO3
|
20.0
|
440
|
540
|
[98]
|
|
La0.7Ag0.3MnO3
|
-
|
397
|
547
|
[92]
|
|
La0.7Sr0.3MnO3
|
-
|
437
|
570
|
|
|
LaCoO3
|
48.8
|
405
|
500
|
В печати
|
|
Sr0.9Ag0.1TiO3
|
25.0
|
410
|
510
|
В печати
|
|
La0.9Ce0.1CoO3
|
59.1
|
400
|
495
|
В печати
|
Анализируя представленные данные можно придти к заключению,
что для смешанных оксидных композиций со структурой перовскита, существенное
значение имеет не только подбор сочетания элементов, но и нахождение оптимума в
соотношении катионов, образующих оксидные композиции.
В качестве примера на рис.7 приведены кривые окисления
метана на наиболее активных катализаторах.
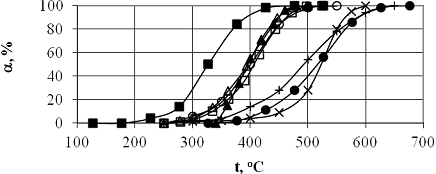
Рис.7. Зависимость степени превращения метана от температуры на
катализаторах (V=20мл/мин, 0,2гр кат-1,3SiO2, 0.5%CH4, 10%O2):
|
(□)
LaCoO3;
|
(▲) La0.96Co0.7Fe0.34O3;
|
() LaFeO3;
|
|
(×) SiTiO3;
|
(Δ) La0.9Ce0.1CoO3;
|
(■)
Pd/Al2O3;
|
|
(+) LaMnO3;
|
(○) Sr0.9Ag0.1TiO3;
|
|
В таблице 8 представлены данные о кажущейся энергии активации
для различных катализаторов перовскитного типа.
Таблица 8
Значения кажущейся энергии активации при сжигании метана на
катализаторах перовскитного типа
|
Катализатор
|
Еа,
кДж/моль
|
Литературный
источник
|
|
LaFeO3
|
88
|
[84]
|
|
La1-xCaxFeO3
x=0, 0.1.0.5
|
94-89
|
|
|
LaMnO3
|
79
|
[2]
|
|
LaAlO3
|
107
|
[100]
|
|
LaAl1-xFexO3
x=0.1, 0.2.0.8
|
101-110
|
|
|
LaFeO3
|
88
|
|
|
NdFeO3
|
92
|
[101]
|
|
SmFeO3
|
99
|
|
Вполне сопоставимыми по активности с перовскитными
катализаторами являются различные двухфазные композиции, включающие фазу CuO и оксидные катализаторы,
имеющие флюоритную структуру (CeO2, ZrO2). Наиболее активными из них является композиция Cu0.2Zr0.8Ox, t50 = 440°C, t100=600°C (рис.8).
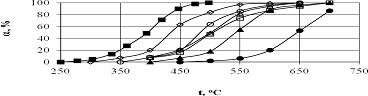
Рис.8. Данные об окислении метана на различных катализаторах со
структурой флюорита [90]
(◊) Cu0.2Zr0.8Ox Sуд. =17,8м2/г (150мг, 2% СН4,
16%О2);
(Δ) Cu0,5 [Ce (La)] 0.5Ox
Sуд. =27,8м2/г - (150мг, 2% СН4, 16%О2);
(▲) [Ce (La)] O2 Sуд. =30,0м2/г - (150мг, 2% СН4, 16%О2);
(○) Cu0.08 [Ce (La)] 0.92Ox
Sуд. =43,0м2/г - (150мг, 2% СН4, 16%О2);
(□) Cu0.5Zr0.5Ox Sуд. =50,0м2/г - (150мг, 2% СН4,
16%О2);
() CeO2 Sуд. =28,0м2/г - (150мг, 2% СН4, 16%О2);
(■) La0.9Ce0.1CoO3 Sуд. =59,1 м2/г (200мг, 0,5%СН4)
Заслуживает внимания тот факт, что, если исключить из внимания La0.9Ce0.1CoO3, то самой высокой активностью обладает
катализатор с наименьшей поверхностью Cu0.2Zr0.8Ox.
Несмотря на особенности поведения катализатора CuO-ZrO2, нет оснований игнорировать тот факт, что
активность катализаторов в сильной степени зависит не только от состава, но и
от дисперсности. Недостатком катализаторов с развитой поверхностью является
эффект старения т.е. уменьшение активности в процессе эксплуатации. Этот эффект
иллюстрирует рис.9.
Испытания термической стабильности включали две стадии. На первой
из них катализатор эксплуатировали в режиме сжигания метана при t=515°С (t100%) в течении 50-ти часов. На второй стадии
проводили термическую обработку катализатора при 800°С в течении часа, также в
режиме окисления метана. После этого возвращались к исходной температуре
(515°С) и сравнивали первоначальную активность катализатора с уровнем,
достигаемым после термической обработке при высокой температуре (рис.9).
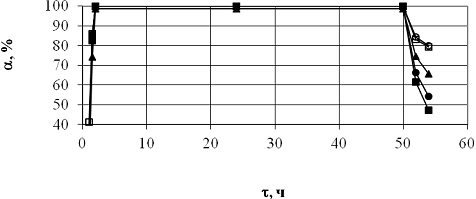
Рис.9. Влияние термической обработки на стабильность наноразмерных
перовскитных катализаторов окисления метана (200мг., 0,5%СН4/10%О2,
20мл/мин):
|
(■) La0,9Tb0,1CoO3;
|
(○)
LaCoO3;
|
|
(□) La0,9Ce0,1CoO3;
|
(▲) La0,9Sm0,1CoO3;
|
|
() La0,9Pr0,1CoO3.
|
|
Как видно, каталитическая активность всех образцов не
меняется после 50-ти часов непрерывной реакции окисления метана. Но после
высокотемпературной термической обработки заметно уменьшалась, что было
обусловлено спеканием катализатора. Авторы работы полагают, что скорость
спекания связана с ионными радиусами катионов (табл.9) располагающейся в
позиции А перовскитной структуры АВО3.
Таблица 9
Ионный радиусы допируемых элементов
|
Элемент
|
Ионный радиус
элемента, Å
|
Элемент
|
Ионный радиус
элемента, Å
|
|
La+3
|
1,3
|
Sm+2
|
1,41
|
|
Ce+3
|
1,283
|
Sm+3
|
121,9
|
|
Ce+4
|
1,11
|
Tb+3
|
1,18
|
|
Pr+3
|
1,266
|
Tb+4
|
1,02
|
|
Pr+4
|
1,1
|
|
|
Активность наиболее эффективно действующих катализаторов,
приготовленных методом пламенного пиролиза, превосходит активность платиновых
катализаторов и приближается к активности, которую имеют палладиевые
катализаторы.
Кинетическое уравнение для реакции окисления метана на
катализаторе Cu0.15 [Ce (La)] 0,85Ox было установлено авторами работы [102] в виде
сложной функции:
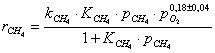
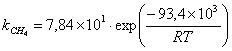
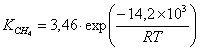
где 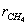 - скорость окисления метана;
- скорость окисления метана;
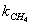 - константа скорости окисления метана;
- константа скорости окисления метана;
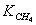 - константа адсорбции метана на поверхности катализатора;
- константа адсорбции метана на поверхности катализатора;
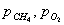 - парциальное давление метана, кислорода.
- парциальное давление метана, кислорода.
порядок по метану был равен единице, по кислороду 0,18. Кажущаяся
энергия активации для Cu0.15 [Ce (La)] 0.85Ox оказалась равной 93,4 кДж/моль [102].
Обсуждая данные о кинетике окисления метана, автор высказывает предположение,
что механизм реакции, основываясь на кинетических данных, может быть
представлен в виде
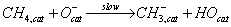
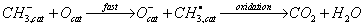
где cat означает поверхность катализатора.
Кислород из газовой фазы быстро приходит в равновесие с
образованием различных частиц
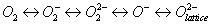
Лимитирующая стадия процесса включает реакцию адсорбции метана с
поверхностными основными группами (ионы кислорода) c образованием метильного радикала и гидроксила:
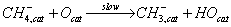
Первый из них при взаимодействии с адсорбированным кислородом
окисляется до СО2 и воды
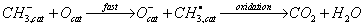
Заслуживает внимания тот факт, что в работах по исследованию оксидных
катализаторов в отличии от платиновых и палладиевых авторы избегают
использовать такую характеристику как числа оборотов, отнесенные к активным
зонам поверхности. Поэтому достаточно трудно на количественной основе
сравнивать активности катализаторов относящихся к разным классам соединений. На
качественном уровне такое сравнение приводится на рис.7. Есть все
основания считать, что катализаторы с перовскитной структурой в ряде случаев,
даже если не принимать во внимание стоимостные характеристики, способны
заменить нанесенные палладиевые катализаторы. И совершенно неслучайно, что в
настоящее время рассматривается вопрос о промышленном применении катализаторов
данного типа, нанесенных на сотовые носители в промышленных газотурбинных
установках [103].
Если говорить о промышленных катализаторах окисления метана, то в
настоящее время в России не существует композиций, ориентированных на целевое
применение в реакции низкотемпературного окисления метана. В этом отношении
можно отметить, что потенциально наиболее интересным среди оксидных систем
является катализатор НТК предназначенный для глубокого окисления органических
примесей (ксилол, толуол, бензол, стирол, кумол, ацетон, этилацетат, бутанол,
бутилацетат, нитрил акриловой кислоты, циклогексан, циклогексанол, крезольные и
бензольные лаки и др.), входящих в состав отходящих газов и оксида углерода на
заводах ОРГсинтеза. Данный катализатор выпускается в виде гранул цилиндрической
формы. Катализатор включает фазы CuO, MnO2 в количествах 31.6%, 12.5%, соответственно. Поскольку разработка
новых промышленных катализаторов сопряжена со значительными трудностями, весьма
привлекательно найти способ модифицирования известных катализаторов, который
позволил бы найти новые области их практического применения. Напомним в этом
отношении, что одним из эффективных катализаторов окисления метана является
композиция CuO - CeO2.
В связи с этим представляет интерес исследовать активность промышленного
катализатора НТК в реакции окисления метана, после модифицирования его оксидом
церия, что должно приводить к возникновению зон включающих композиции CuO - CeO2.
Заключение по
обзору литературы
Рассмотрение литературных данных показывает, что наибольшую
активность в реакции полного окисления метана в бедных по данному компоненту
смесях проявляют нанесенные палладиевые катализаторы. Уже в настоящее время эти
катализаторы находят практическое применение в системах дожигания отходных
газов газотурбинных электростанциях. Вместе с этим анализ литературных данных
показал, что ни в одной из известных публикаций не рассматривалось поведение
палладиевых катализаторов, нанесенных на поверхность металлических носителей.
Подобные системы могут иметь ряд преимуществ по сравнению с катализаторами,
нанесенными на керамические носители. Учитывая это, в данной работы были
поставлены задачи:
разработать технологию рельефного травления ячеистокасных
структур (патенты РФ №2184794, №2213645) из нержавеющей стали;
определить условия контактного осаждения;
провести тестирования приготовленных катализаторов и сопоставить
результаты с литературными данными об активности палладиевых катализаторов,
нанесенных на оксидные носители.
В качестве альтернативы палладиевым катализаторам
рассматривают смешанные оксидные композиции, включающие d и f элементы, имеющие структуру
перовскита, а также двухфазные системы, включающие фазу оксида с флюоритной
структурой.
Анализ литературных данных показывает, что активности лучших
образцов сопоставимы с палладиевыми катализаторами, нанесенными на оксидные
носители. В сравнении с палладиевыми катализаторами они обладают меньшей
спекаемостью и более высокой устойчивостью в эксплуатации при повышенных
температурах. Композиции, родственные этим структурам, могут быть получены при
модифицировании некоторых промышленных катализаторов окисления органических
веществ и СО. Поскольку разработка и практическое внедрение новых катализаторов
всегда сопряжена с проведением обстоятельных исследований при постановке данной
работы была поставлена задача исследовать возможность модифицирование известного
промышленного катализатора марки НТК-10-7Ф. Основываясь на данных о составе
данного катализатора и сведений имеющихся в литературе о характеристиках
активности оксидных катализаторов, включающих диоксид церия [90, 104, 105]
можно было предполагать, что наиболее эффективным модификатором свойств НТК
будет являться диоксид церия. В связи с этим, вторым направлением работы стало
разработка технологии модифицирования и изучение характеристик катализаторов,
приготовленных на основе промышленного НТК, в реакции низкотемпературного
окисления метана.
Методика
эксперимента
Характеристика использованных веществ
Для синтеза образцов, проведения анализов и исследования
каталитической активности были использованы следующие вещества:
Таблица 10
Характеристика использованных веществ
|
Реагент
|
Химическая
формула
|
Чистота, %
|
Изготовитель
|
|
Нержавеющая
проволока
|
сталь марки
Х17Н10Т или 12Х18Н10Т
|
|
|
|
Палладий
металлический
|
Pd
|
>99%
|
|
|
Азотная
кислота, концентрированная (ГОСТ 4461-48)
|
HNO3
(к)
|
>99%
|
РОСХИМ
|
|
Соляная
кислота, концентрированная (ГОСТ 3118-46)
|
HCl
|
>99%
|
РОСХИМ
|
|
Хлорид калия
(ГОСТ 4234-47)
|
KCl
|
>99%
|
ЛАБТЕХ
|
|
Промышленный
катализатор НТК-10-7Ф
|
Характеристики
промышленного катализатора: не прокаленный. Состав CuO = 31.6%; ZnO = 22.9%;
Al2O3 = 23.7%; Mn3O4 = 12.5%; CaO
= 10.2%; Sуд=86м2/г; потери массы при прокаливании-28,05%; Пористость=33%. Mn3O4,
CaCO3, ГА, А, CuO, гиббсит, Р, СА2, арагонит Рср=3,88
кг/мм  гран.; Pmin=2.76 кг/мм гран.; Pmin=2.76 кг/мм  гран. % НИАП гран. % НИАП
|
|
|
|
Нитрат церия Ч.
д. а. (ТУ 6-09-2081-75)
|
Се (NО3)
3·6Н2О
|
>99.8%
|
РЕАХИМ
|
|
Газовая смесь:
Метан-2,5% (об.), Воздух-97,5% (об.).
|
|
|
НПО МОНИТОРИНГ
|
Нанесенные палладиевые катализаторы
Характеристика
ячеисто-каркасных металлических носителей и процедура подготовки поверхности
методом химического травления.
В качестве носителей в данной работе использовались
ячеисто-каркасные металлические структуры. Впервые они были разработаны на
кафедре физической химии РХТУ им.Д.И. Менделеева (патенты РФ №2184794,
№2213645). Носитель такого типа представляет собой структуру, образованную
дискретными проволочными элементами в виде спиралевидных (объемных много - или
маловитковых) тел вращения, многократное соединение которых в контактных зонах
приводит к получению материала с плотностью от 0,4 до 1,5 г/см3 и с
полностью доступной внутренней поверхностью, геометрическая площадь которой
может изменяться от 10 до 200 см2/см3. Контур витка
проволочного элемента может иметь форму круга, эллипса, n-угольника с n≥3 и в том числе
спирали Архимеда. Диаметр дискретного проволочного элемента в 10-100 раз
превышает диаметр проволоки. Шаг спирали при этом варьируется от 1,5 до 10
диаметров проволоки, а количество витков - от 2-3 до 20. Многократное
контактирование элементов приводит к созданию пространственной структуры, газо
- и гидродинамическое сопротивление которой, а также прочность и геометрическая
поверхность (отнесенная к единице объема), определяются формой и размерами
дискретных элементов. Структуру предлагаемого материала поясняет рис.10.
Как видно, основным конструктивным фрагментом предлагаемого
материала является спиралевидный проволочный элемент, для которого характерно
малое заполнение объема каркаса - образующим металлом при этом величина
свободного пространства зависит от:
диаметра проволоки;
формы дискретного проволочного элемента;
геометрических размеров элемента и, в частности, от отношения
условного диаметра к высоте;
расстояния между витками (условный шаг навивки).

Рис.10. Внешний вид проволочного ячеисто-каркасного
металлического носителя
Разработанные ячеисто-каркасные металлические носители
обладают по сравнению с известными, следующими преимуществами:
простотой монтажа в каталитических конвертерах с помощью
фиксирующих зажимных колец;
более высокой, в сравнении с керамическими носителями,
механической прочностью;
более развитой, в сравнении с керамическими носителями,
поверхностью, выраженной, как отношение поверхности к величине занимаемого
объема;
полностью открытой пористостью и низким газодинамическим
сопротивлением;
способностью к выравниванию радиального профиля скоростей
газового потока;
высокой устойчивостью при эксплуатации в условиях резких
перепадов температур.
Используемые для изготовления структуры проволочных элементов
имеют неразвитую поверхность (рис.11). Как видно, на поверхности
проволочных элементов отсутствуют шероховатости, которые могли бы обеспечить
удержание функциональных покрытий на носителе.
Рис.11. Поверхность исходного образца спиралевидного элемента
ячеисто каркасной структуры при различном увеличении
С целью развития поверхности металлических носителей
использовалось рельефное ("глубокое") химическое травление.
В качестве материалов металлических каркасов использовали
сталь типа Х17Н10Т (или нихром), для химического травления которых предложен
раствор на основе HNO3 с присадками NaF или NaCl [106]. Однако, никаких сведений в указанной
литературе о составе раствора и характере травления поверхности не указано.
Целью данной части работы являлось исследование влияния
режимов травления стали Х17Н10Т на кинетические зависимости и морфологию
поверхности.
В качестве объектов исследования использовали спиралевидные
элементы выполненные из проволоки диаметром 125мкм и свитую в спираль с
внутренним диаметром 3-3,5мм, шагом 0,5мм, высотой 5-6 мм ("буса").
Травлению подвергали предварительно взвешенную гирлянду из 15
штук "бус", насаженных на капроновую нить.
Травящий раствор состоял из: HNO3
(74%масс.), KCl и, H2O. Их соотношение в растворе варьировали,
изменяя мольное отношение 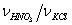 и молярную долю H2O
и молярную долю H2O 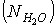 .
.
За скорость травления 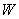 , %/мин принимали величину
, %/мин принимали величину 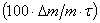 , где
, где 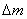 - уменьшение массы "бус" в
результате травления, г.;
- уменьшение массы "бус" в
результате травления, г.; 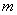 - начальная масса "бус", г.;
- начальная масса "бус", г.; 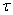 - время травления, мин.
- время травления, мин.
Было замечено, что при приготовлении раствора его окраска с
течением времени приобретает насыщенный желтый цвет. Для нахождения времени
"созревания" раствора, при помощи датчика фирмы Vernier, была измерена зависимость коэффициента
пропускания раствора от продолжительности выдержки при комнатной температуре с
начала растворения KCl. Результаты (рис.12) показывают,
что время "созревания" составляет величину 5-6 минут с начала
растворения KCl.

Рис.12. Зависимость степени пропускания (%) света (λ= 625 нм)
от времени "созревания" раствора
Далее была исследована зависимость потери массы (Dm/m, %) от
продолжительности травления для различных составов травящего раствора. В
качестве примера на рис.13 приведена одна из таких зависимостей, из
которой следует, что в пределах воспроизводимости результатов ±15%, ее линейный характер. Примечательным
также явилось то, что скорость травления, равная тангенсу угла наклона прямой, не
зависела от перемешивания раствора. Этот факт позволяет сделать вывод, что
лимитирующей стадией процесса травления является химическая реакция,
протекающая на поверхности образцов.
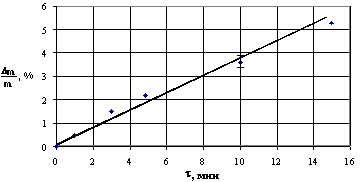
Рис.13. Зависимость потери массы проволочных элементов от времени
травления в растворе HNO3-KCl-H2O (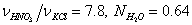 )
)
Зависимость скорости травления от 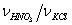 , приведенная на рис.14, носит экстремальный характер.
, приведенная на рис.14, носит экстремальный характер.
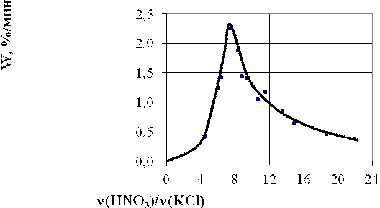
Рис.14. Зависимость скорости травления проволочных элементов от
молярного отношения 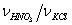 , при постоянной мольной доле
, при постоянной мольной доле 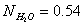
Аналогичный характер имеет зависимость скорости травления кремния
от соотношения азотной и плавиковой кислот [107], что свидетельствует об
одинаковом механизме химического травления обоих материалов. Последнее,
по-видимому, обусловлено тем, что травящие растворы в обоих случаях содержат
окислитель HNO3 и галогенсодержащее соединение (KCl, HF), в результате взаимодействия которых
может образовываться хлористый (фтористый) нитрозил [108].
Разведение раствора водой приводит к снижению скорости травления. Эта зависимость показана на рис.15.

Рис.15. Зависимость скорости травления от мольной доли воды в
растворе HNO3-KCl-H2O, при постоянном мольном отношении 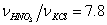
При проведении процедуры травления концентрация реагентов
изменяется со временем, что также приводит к уменьшению скорости травления.
Однако для концентрированных растворов в некотором диапазоне времени эти
изменения могут быть выражены слабо, и, следовательно, внутри этого диапазона
скорость должна изменятся незначительно. Такая зависимость для одного из
растворов приведена на рис.16. Из рис.16 следует, что по
истечении определенного времени скорость травления начинает уменьшаться.
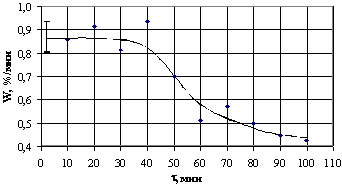
Рис.16. Зависимость скорости травления от времени, для травящего
раствора HNO3/KCl (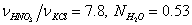 , навески "бус" 0,14гр.)
, навески "бус" 0,14гр.)
На рис.17-19 приведены структуры поверхности после
травления. Видно, что травление приводит к образованию четко выраженного
поверхностного рельефа, наблюдаются также отдельные кратеры, обусловленные
возможно наличием макродефектов в сплаве.

Рис.17. Морфология поверхности "бус" после травления в
режиме: 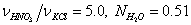 ,
, 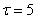 мин,
мин, 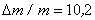 %.
%.

Рис.18. Морфология поверхности "бус" после травления в
режиме: 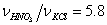 ,
, 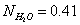 ,
, 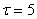 мин,
мин, 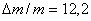 %.
%.

Рис. 19. Морфология поверхности "бус" после травления в
режиме: 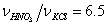 ,
, 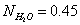
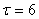 мин,
мин, 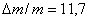 %.
%.
Нанесение
палладия на ячеисто-каркасные металлические носители
Для контактного нанесения палладия использовали раствор Pd (NO3) 2 с
концентрацией 0,02г/мл. Химическое осаждение палладия осуществлялось по
реакции
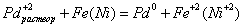
Спиралевидные элементы помещали в раствор азотнокислого палладия и
нагревали до температуры 80°С, после этого к раствору добавляли
концентрированную соляную кислоту, количество которой определяло характеристики
осажденного слоя палладия. Для установления оптимума мольных соотношений Pd/HCl была
выполнена серия опытов, в которых изменялось соотношение Pd/HCl в
исходных растворах нитрата Pd.
Критерием качества нанесенного Pd слоя служила информация о зависимости температуры 50% степени
превращения метана от мольного отношения Pd/HCl. Результаты этих опытов показаны на рис.
20.
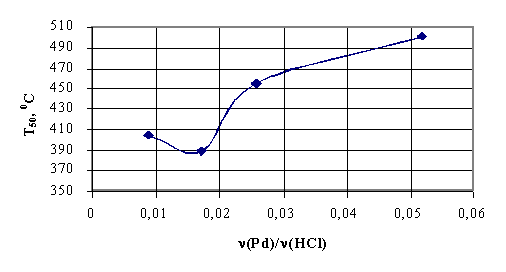
Рис. 20. Зависимость температуры 50% конверсии метана от мольного
отношения Pd/HCl
Как видно из рис. 20, оптимальным является мольное
отношение Pd/HCl =
0,017. В дальнейших опытах нанесенные палладиевые катализаторы были
приготовлены, когда мольное отношение Pd/HCl соответствовало оптимальному.
Процедура нанесения палладия продолжалась до полного осаждения
металла из раствора. Протекание реакции сопровождалось изменением цвета
раствора, от темно-оранжевого до желто-зеленого цвета. Конечная окраска была
обусловлена частичным растворением никеля и железа из подложки. Спиралевидные
элементы поле этого извлекали из раствора, промывали дистиллированной водой, и
сушили при 100°С в сушильном шкафу. Количество осажденного палладия определяли
исходя из данных о содержании палладия в исходном растворе.
Оптимизация по содержанию палладия проводилась по результатам
тестирования катализаторов в стандартных режимах окисления метана (см раздел
3.1). Результаты этих опытов показали, что катализатор обладает наибольшей
активность при содержании Pd/Me = 4.18 масс. %.
Морфология осажденного палладия показана на приведенных
электронно-микроскопических фотографиях (рис.21).
Рис.21. Морфология слоя нанесенного палладия на металлические
ячеисто-каркасные структуры при различном увеличении
Как видно, осажденные слои имели развитую дендритную
структуру, образованную наноразмерными фрагментами. Таким образом,
последовательность операций для приготовления нанесенного палладиевого
катализатора можно отобразить схемой представленной на рис.22.
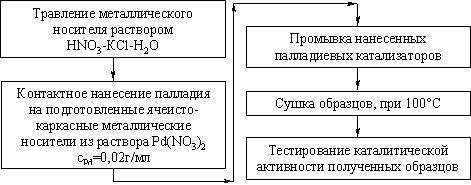
Рис.22. Последовательность операций при приготовлении нанесенного
палладиевого катализатора
Конструкция установки для изучения каталитической активности Pd нанесенных и НТК-10-7Ф катализаторов
Для изучения каталитической активности была изготовлена
установка, включающая: газовую схему, реактор, систему анализа реагентов и
продуктов реакции. Схема установки представлены на рис.23.
Рис.23. Схема установки тестирования катализаторов (Me-Pd;
НТК-10-7Ф) окисления метана:
- баллон с газовой смесью (2,5% метана в воздухе (синтетический);
2 - редуктор; 3 - игольчатый натекатель; 4 - ротаметр по СН4; 5 -
воздушная помпа; 6 - вентиль; 7 - ротаметр по воздуху; 8 - реактор; 9 -
электронагреватель; 10 - термопара; 11 - измеритель-регулятор температуры типа
2TPM1 фирмы ОВЕН с компенсацией холодного
спая; 12 - холодильник; 13 - водоприемник; 14 - пленочный измеритель объемной
скорости газового потока; 15 - пеносборник; 16 - INFRALIGTH 11P инфракрасный
анализатор СН4, СО, СО2.
В реактор, который представлял собой кварцевую трубку с внутренним
диаметром 11 мм и длиной 450 мм, загружали катализатор. В средней части
кварцевой трубки впаяна кварцевая сетка, на которой на кварцевой ткани
размещался катализатор. Для предотвращения уноса катализатора газовым потоком
из реактора, его тампонировали кварцевой тканью.
Для обогрева использовали трубчатую печь. Кварцевую трубку с
помещенным в ней катализатором размещали соосно с печью, в зоне с постоянной
температурой. Реактор закреплялся вертикально. Перед исследованием
каталитической активности катализатор активировали в потоке воздуха (50мл/с) в
течение одного часа при температуре 500°С для палладиевых катализаторов и 750°С
для катализатора НТК-10-7Ф. Затем температуру печи снижали до 100-150°С, поток
воздуха заменяли на рабочую газовую смесь (1-4). Для проведения экспериментов
использовали газовую смесь метан-воздух, с содержанием метана 2,5%. Скорость
газовой смеси (1,35мл/с) регулировали игольчатым натекателем (3). После
продувки системы рабочей газовой смесью задавали температуру нагрева печи на
регуляторе температур (11). При достижении заданной температуры выжидали 15-20
минут до постоянства состава газовой смеси после реактора. Затем задавали
следующую температуру (11) и так далее, с шагом 30-50°С.
Для предотвращения засорения кювет анализатора на выходе из
реактора располагался холодильник, в котором конденсировались пары воды,
образующиеся в результате реакции. Далее газовая смесь поступала в пленочный
измеритель объемной скорости газового потока (14), посредством которого
измерялась скорость газового потока. Для предотвращения попадания пены в
газовый анализатор после пенника был установлен пеносборник (15).
Состав газовой смеси по содержанию метана, СО и СО2
регистрировали с помощью газового инфракрасного анализатора (16). Измерения
проводили в реальном масштабе времени, промежуток считывания сигнала при этом
составлял 1-5 сек. Пределы обнаружения составляли по: метану - 0,01%, СО -
0,001% и СО2 - 0,01%. Процедура обработки включала следующие этапы:
Представление в графической форме (рис.24) первичной
информации об изменении концентрации СН4 и СО2 во времени.
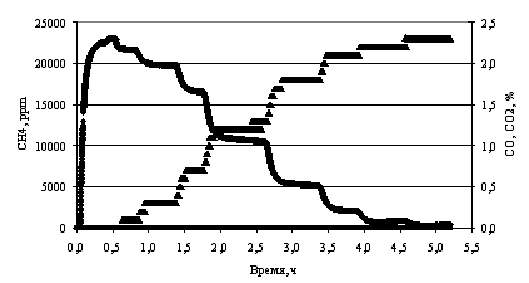
Рис.24. Первичная информация о составе газовой смеси () СН4, (▲)
СО2 (■) СО
Обработка первичного массива данных с преобразованием к степени
превращения метана от времени (рис.25).
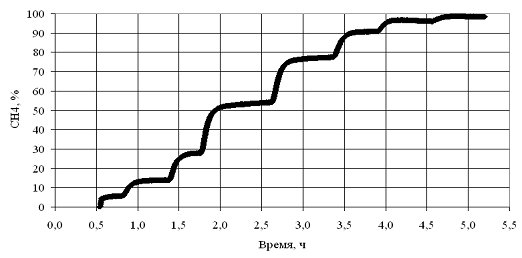
Рис.25. Зависимость степени превращения метана при ступенчатом
нагревании реактора
Представление данных в форме температурной зависимости степени
превращения, основываясь на значениях 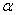 , характеризующих стационарное состояние при каждой температурной
паузе (рис.26).
, характеризующих стационарное состояние при каждой температурной
паузе (рис.26).
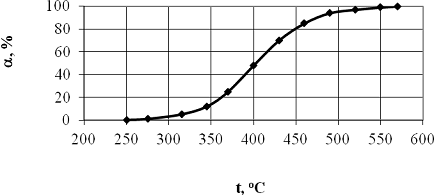
Рис.26. Вид зависимости степени превращения метана от температуры
после обработки первичной информации
Степень превращения (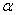 ) метана вычисляли по уравнению:
) метана вычисляли по уравнению:
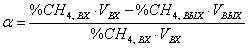
где - 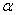 -степень превращения метана;
-степень превращения метана;
 - процентное содержание метана на входе и на выходе;
- процентное содержание метана на входе и на выходе;
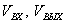 - скорости газового потока на входе и на выходе соответственно.
- скорости газового потока на входе и на выходе соответственно.
Поскольку объем газовой смеси в результате реакции изменялся
незначительно (СН4=2,5%) то, выражение для степени превращения
приобретало вид:
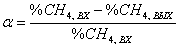
Модифицирование промышленного катализатора НТК-10-7Ф
Промышленный катализатор НТК-10-7Ф разработан в
Новомосковском институте азотной промышленности (НИАП). Катализатор
предназначен для очистки отходящих газов от органических примесей (ксилол,
толуол, бензол, стирол, кумол, ацетон, этилацетат, бутанол, бутилацетат, нитрил
акриловой кислоты, циклогексан, циклогексанол, циклогексанон, крезольные и
бескрезольные лаки и др.) и оксида углерода методом глубокого окисления.
[информация взята из каталога НИАП]
Выпускаются следующие модификации катализатора: НИАП-10-04
(НТК-10-7Ф) и НИАП-15-06 в не прокаленном виде и НИАП-15-05 и НИАП-15-07 в
прокаленном виде.
Таблица 11
Технические характеристики
|
Техническая
характеристика (ТУ 113-03-00209510-76-95)
|
НТК-10-7Ф
(НИАП-15-04)
|
|
Внешний вид
|
Гранулы
цилиндрической формы серого и серо-зеленого цвета
|
|
Размеры, мм
Диаметр Длинна
|
5,0±0,5 или
6,0±0,5 4,0~15,0
|
|
Насыпная
плотность, кг/л
|
1,15~1,45
|
|
Механическая
прочность: Индекс прочности на раскалывание, кг/мм диаметра гранулы не менее
|
1,7 1,0
|
|
Химический
состав
|
CuO,
Mn2O4, ZnO, Al2O3, CaO
|
Эксплутационные показатели катализатора НТК-10-7Ф:
возможность достижения высокой степени очистки (91~99,9%) при
относительно низких температурах (250~450°С);
высокая термостабильность;
высокая стойкость к истиранию;
высокая активность при очистке газовых выбросов от
органических соединений различного состава.
Выпуск катализаторов осуществляет ОАО "НИАП" в виде
гранул, таблеток или колец.
В товарном продукте гранулы катализатора представляют собой
углекислые соли металлов, поэтому, предварительно катализатор разлагали в
муфельной печи при температуре 400°С, в течении часа.
Для модифицирования промышленного катализатора проводили
пропитку гранул катализатора раствором нитрата церия с различной концентрацией.
Последовательность операций при проведении процедуры модифицирования показана в
виде схемы на рис.27.
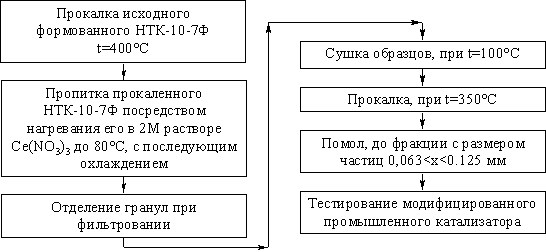
Рис.27. Последовательность операций при приготовлении
модифицированного катализатора НТК-10-7Ф
Использовались 0,5, 1,0, 2,0-х молярные растворы церия. Для
обеспечения равномерного распределения раствора церия по пористой структуре
НТК-10-7Ф пропитку проводили при нагревании до 80°С, с последующим охлаждением
катализатора в растворе.
После охлаждения катализатор сушили и прокаливали в печи при
350°С в течении часа для удаления молекулярно связанной воды.
Концентрацию нитрата церия, фиксированного в пористой
структуре катализатора, определяли по разности масс. Например, для
одно-молярного раствора увеличение массы катализатора составило порядка 4,74
масс. %.
Для тестирования гранулы катализатора размалывали, просеивали
и отбирали фракцию с размером частиц 0,063<x<0.125 мм.
Для выравнивания температуры по слою катализатора и для
улучшения теплообмена при тестировании использовали смесь катализатор-балласт (Al2O3) в массовом соотношении
1/10. Для обеспечения равномерного смешивания размер частиц балласта
варьировался в тех же пределах что и размер частиц катализатора. После этого
проводили исследования каталитической активности на установке (рис.23).
Список
литературы
1. Forzatti
P. /Catalysis Today.83 (2003) 3.
2. Cimino
S. et al. /Catalysis Today.83 (2003).33.
. Carroni
R. et al. /Catalysis Today.83 (2003) 157.
. Di
B. A. et al. /Catalysis Today.83 (2003) 171.
5. Lyubovsky
M. et al. /Catalysis Today.83 (2003) 183.
. Yasushi
O. et al. /Catalysis Today.83 (2003) 247.
7. Ersson
A. et al. /Catalysis Today.83 (2003) 265.
8. Shinichi
K., Dalla Betta R. /Catalysis Today.83 (2003) 279.
. Sohn
J. M., Kim M. R. and Woo S.I. /Catalysis Today.83 (2003) 289.
. Spivey
J. J. /Industrial and Engineering Chemistry Research.26 (1987) 2165.
. Trimm
D. L. /Applied Catalysis.7 (1983) 249.
. Prasad
R., Kennedy L. A., Ruckenstein E. /Catalysis Reviews-Science and Engineering.26
(1984) 1.
. Pfefferle
L. D., Pfefferle W. C. /Catalysis Reviews-Science and Engineering.29 (1987)
219.
. Ismagilov
Z. R., Kerzhenzev M. A. /Catalysis Reviews-Science and Engineering.32 (1990)
51.
. Caronni
R., Schmidt V., Griffin T. /Catalysis Today.75 (2002) 287.
. Gelin
P., Primet M. /Applied Catalysis B: Environmental.39 (2002) 1.
18. Cerri
I. et al. /Catalysis Today.83 (2003) 19.
19. Gelin
P. et al. /Catalysis Today.83 (2003) 45.
. Lyubovsky
M. et al. /Catalysis Today.83 (2003) 71.
. Ibashi
W., Groppi G., Forzatti P. /Catalysis Today.83 (2003) 115.
. Robbins
F. A., H. Zhu, Jackson G. S. /Catalysis Today.83 (2003) 141.
23. Ersson
A. et al. /Catalysis Today.83 (2003) 265.
24. Hicks
R. F. et al. /Journal of Catalysis.122 (1990) 295.
. Hicks
R. F. et al. /Journal of Catalysis.122 (1990) 280.
. Oh
S. E., Mitchell P. J., Siewert R. M. /Journal of Catalysis.132 (1991).287.
. Burch
R., Loader P. K. /Applied Catalysis B: Environmental.5 (1994) 149.
. Tonkovich
et al. /United States Patent 6.440.895. August 27 (2002).
. Cullis
C. F., Willatt B. M. /Journal Catalysis.83 (1983) 267.
. Niwa
M., Awano K., Murakami Y. /Applied Catalysis A: General.7 (1983) 317.
. Muto
K., Katada N., Niwa M. /Applied Catalysis A: General.134 (1996) 203.
. Ma
L., Trimm D. L., Jiang C. /Applied Catalysis A: General.138 (1996) 275.
. Ahlstrom-Silversand
A. F., Odenbrand C. U.I. /Applied Catalysis A: General.153 (1997) 157.
. van
Giezen J. C. et al. /Catalysis Today.47 (1999) 287.
. Groppi
G. et al. / Chemical Engineering Science.56 (2001) 831.
. Groppi
G. et al. /Chemical Engineering Journal.82 (2001) 57.
. Ribeiro
F., Chow M., Dalla Betta R. A. /Journal of Catalysis.146 (1994) 537.
. Fujimoto
K. et al. /Journal of Catalysis.179 (1998) 431.
. Burch
R., Urbano F. J., Loader P. K. /Applied Catalysis A: General.123 (1995) 173.
. Ciuparu
D., Katsikis N., Pfefferle L. /Applied of Catalysis A: General.216 (2001) 209.
. Ciuparu
D., Pfefferle L. /Applied of Catalysis A: General. A 209 (2001) 415.
. Cullis
C. F., Nevell T. G., Trimm D. L. /Journal of the American Chemical Society.1
(1972).
. Yao
Y. Y. /Industrial Engineering Chemical Production. Research and Development. 19
(1980) 293.
. Briot
P., Primet M. /Applied of Catalysis.68 (1991) 301.
. Baldwin
T. R., Burch R. /Applied of Catalysis.66 (1990) 337.
. Farrauto
R. J. et al. /Applied of Catalysis A: General.81 (1992) 227.
. Farrauto
R. J. et al. /Applied Catalysis B: Environmental.6 (1995) 263.
. McCarty
J. G. /Catalysis Today.26 (1995) 283.
. Groppi
G. /Studies in Surface Science and Catalysis.136 (2001) 345.
. Cho
S. J., Kang S. K. /Journal of Physical Chemistry.104 (2000) 8124.
. Groppi
G. et al. /Studies in Surface Science and Catalysis.130D (2000) 3801.
. Imai
T., Tsukuda I., Yasutake S. /Japanese Patent 05269381 (1993).
. Tsukuda
I., Imai T., Yasutake S. /Japanese Patent 06226097 (1994).
. Imai
T., Tsukuda I., Yasutake S. /Japanese Patent 06331112 (1994).
. Imai
T., Yasutake S., Tsukuda I. /Japanese Patent 07293833 (1995).
. Imai
T. /Japanese Patent 07293834 (1995).
. Imai
T. /Japanese Patent 07293835 (1995).
58. Pivot
J. - C. /DE 19612430 (1996) to Application des Gaz S. A.
59. Wang
Y., Sun Y., Gao Y. /S. Chen, Cn 1224047 (1999).
60. Muller
C. A. et al. /Catalysis Today.47 (1999) 245.
. Nomura
K. et al. /Chemistry Letters.58 (1999) 127.
62. Miao
S., Deng Y. /Applied Catalysis B: Environmental.31 (2001) L1.
63. Yang
S. et al. /Applied Catalysis B: Environmental.28 (2000) 223.
64. Garetto
T. F., Apestegu C. R. /Catalysis Today.62 (2000) 189.
. Widjaja
H., Sekizawa K., Eguchi K. /Bulletin of the Chemical Society of Japan.72 (1999)
313.
. Ishihara
T., Sumi H., Takita Y. /Chemical Letters. (1994) 1499.
67. Ishihara
T. et al. / Chemical Letters. (1993) 407.
. Acker
R., Anorg G. Z. /Allgemeine Chemie.259 (1949) 280.
69. Acker
R., et al. /Allgemeine Chemie.315 (1962) 121.
. Acker
R., et al. /Allgemeine Chemie.262 (1950) 81.
71. Claudel
B. M. and Brau G. G. /Journal of Catalysis.14 (1969) 322.
. Goodenough
J. B. et al. /Zahlenwerte und Funktionen aus Naturwissenschaften und Technik,
New Series, Group III, 4 Part A (1970).126.
. Parravano
G. /Journal of Chemical Physics,20 (1952) 342.
. Meadowcroft
D. B. /Nature.226 (1970).847.
. Libby
W. F. /Science.171 (1975) 499.
. Pedersen
L. A., Libby W. F. /Science (Washington, DC, United States).176 (1978).1355.
. Yamazoe
N., Teraoka Y. /Catalysis Today.8 (1990) 175.
. Ferri
D., Forni L. /Applied Catalysis B: Environmental.16 (1988) 119.
. Voorhoeve
R. J. H., Remeika J. P., Johnson D. W. /Science, 180 (1973) 62.
. Voorhoeve
R. J. H. et al. /Journal of Solid State Chemistry.14 (1975) 395.
. Auer
R., Thyrion F. C. /Industrial Engineering Chemistry Research, 41 (2002) 680.
82. Arai
H. et al. /Applied Catalysis.26 (1986) 265.
83. Fierro
J. L. G. /Catalysis Today.8 (1990) 153.
84. Ciambelli
P. et al. /Applied Catalysis B: Environmental.33 (2001) 193.
85. Leanza
R. et al. /Applied Catalysis B: Environmental.28 (2000) 55.
. Oliva
С. Forni L. Vishniakov A. / Spectrochimica Acta. Part A 56 (2000) 301.
. Choudhary
V. R. Uphade B. S. Pataskar S. G. /Fuel 78 (1999) 919.
88. Szabo
V. et al. /Applied Catalysis B: Environmental.43 (2003) 81.
. Garcia
R. M. de la Cruz. /Applied Catalysis B: Environmental.33 (2001) 45.
90. Liu
W., Flytzani-Stephanopoulos M. /Journal of Catalysis.153 (1995) 304.
. Ponce
S. Peña M. A. Fierro J. L. G. /Applied Catalysis B:
Environmental.24 (2000) 193.
92. Song
K. S. et al. /Catalysis Today.47 (1999) 155.
93. Li
W., Lin Y., Zhang Y. /Catalysis Today.83 (2003) 239.
94. Ciambelli
P. et al. /Applied Catalysis B: Environmental.24 (2000) 243.
95. Min
Sohn J., Woo S.I. /Chemistry Letters.79 (2002) 45.
96. Alifanti
M. et al. /Applied Catalysis B: Environmental. B 41 (2003) 71.
. Wang
X., Xie Y. - C. /Applied Catalysis B: Environmental.35 (2001) 85.
. Marchetti
L. Forni L. /Applied Catalysis B: Environmental.15 (1998) 179.
. Ji
S. - F., Xiao T. - C., Wang H. - T. /Chemistry Letters.75 (2001) 65.
100. Ciambelli
P. et al. /Applied Catalysis B: Environmental.37 (2002) 231.
101. Ciambelli
P. et al. /Applied Catalysis B: Environmental.29 Issue 4. (2001) 239.
. Liu
W. and Flytzani-Stephanopoulos M. /Journal of Catalysis.153 (1995) 317.
103. Cimino
S. et. al. / Catalysis Today.83 (2003) 33.
104. Alessandro
Trovarelli / Catalysis by Ceria and Related. Imperial College Press, London,
2002, c.528
105. Avgouropoulos
G. et al. /Catalysis Today.75 (2002) 157.
106. Эспе.В.
/Технология электровакуумных материалов. Том-1.М. - Л., Госэнергоиздат, 1962,
с.584.
. Курносов.А.И.
/Материалы для полупроводниковых приборов и интегральных микросхем.М.,
"Высшая школа", 1980, с.86.
. Некрасов.
Б.В. /Курс общей химии, издание 10-е, Госхимиздат, М.; Л.;. 1953, с.365.
109. Cimino
S., Pirone R., Lisi L. /Applied Catalysis B: Environmental.35 (2002) 243.