Определение теплоты сгорания углеродных нанотрубок методом бомбовой калориметрии
Определение
теплоты сгорания углеродных нанотрубок методом бомбовой калориметрии
Содержание
1.Введение
.Обзор
литературы
.1 Структура
и модификации углеродных нанотрубок
2.2
Способы получения УНТ
2.2.1
Синтез в дуговом разряде
.2.2
Синтез лазерным испарением графита
.2.3
Пиролитическое разложение органических соединений
2.3.
Модель формирования УНТ
.4.
Методы исследования УНТ
2.4.1.
Электронная микроскопия
.4.2
Спектроскопия комбинационного рассеяния
.4.3.Термический
анализ
.4.4
Рентгеновская дифракция
2.5.Термодинамические
свойства углеродных материалов
3.Экспериментальная
часть
3.1 Исходные
реагенты
.2 Методы
исследования
3.2.1
Термогравиметрический анализ
3.2.2
Рентгеновская дифракция
.2.3
Спектроскопия комбинационного рассеяния
.2.4 Бомбовая
калориметрия
.2.5
Сканирующая электронная микроскопия
.Обсуждение
результатов
.Выводы
.Список
литературы
1.
Введение
Конец ХХ века ознаменовался открытием новых форм углерода, представляющие
собой замкнутые структуры, поверхности которых построены из углеродных
шестиугольников и пятиугольников, аналогично структуре графита. Наиболее
интересными разновидностями этих углеродных структур являются фуллерены и
нанотрубки.
В последние годы наблюдается подлинный бум исследований направленных на
получение и изучение свойств этих материалов, связанный с уникальными
физико-химическими свойствами данных структур. Разработка любого нового
материала проходит ряд стадий от постановки конкретной задачи, проведения
экспериментов, изучения фундаментальных свойств до широкого применения в
конечном целевом продукте. На начальных этапах особенно важно изучить
физико-химические свойства и характеристики материала, на основе которых можно
будет проводить дальнейшие теоретические расчеты и моделирование, высказывать
научные предположения, и желательно это сделать распространенным и дешевым
методом, который можно применять систематически для характеристики образцов.
В данной работе определяются теплоты сгорания углеродных наноматериалов.
Кроме того проводится ряд экспериментов по результатам которых оцениваются
структурные характеристики материала.
2.Обзор литературы
.1 Структура и модификации углеродных нанотрубок
У углерода существует множество аллотропных модификаций с очень
разнообразными свойствами. На рис. 1 приведены некоторые из них.
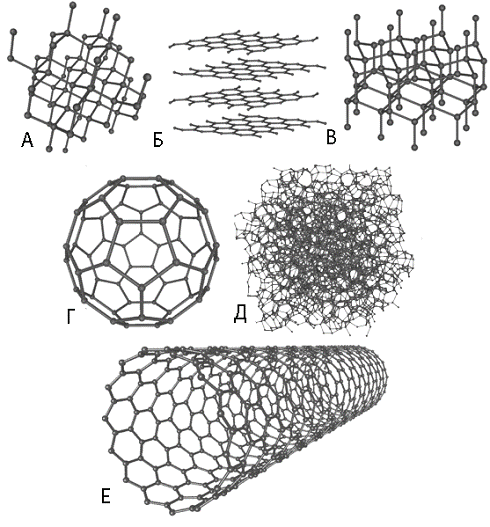
Рис. 1. Основные модификации углерода: А - алмаз, Б - графит, В -
лонсдейлит, Г-фуллерен, Д - аморфный углерод, Е - нанотрубка.
Наиболее интересным в последнее время материалом на основе углерода
являются углеродные нанотрубки, которые обычно подразделяют на одностенные
(ОУНТ) и многостенные (МУНТ), а также выделяют близкие по свойствам и структуре
к ним углеродные нановолокна (УНВ). Одностенные углеродные трубки представляют
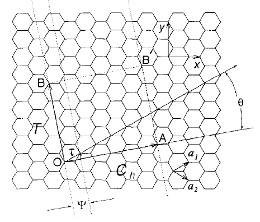
собой цилиндры, “свёрнутые” из графеновых слоев, причём направление этого
“сворачивания” может быть разным. Его принято обозначать парой целых
неотрицательных чисел (n,m) таких, что Ch=na1+ma2 (рис. 2.). Таким образом, данная
трубка (n,m) будет образована таким образом, что точки O и A на рис. 2. совместятся, а вектор трансляции T будет направлен параллельно оси
трубки. Эта пара индексов однозначно задаёт диаметр, угол θ (называемый хиральным углом) и
вектор одномерной трансляции T.
Обычно также на концах трубки в процессе синтеза образуются полусферы,
представляющие собой половину, соответствующего диаметру трубки, фуллерена [1],
[2], [3] (рис. 3).
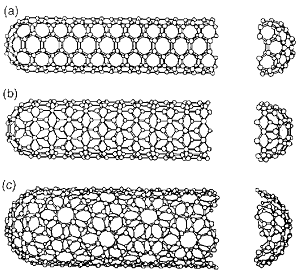
Из всего многообразия трубок в зависимости от угла хиральности θ выделяют два вида (рис. 3): (а) θ=30o - “кресло”, (b) θ=0o - “зигзаг”, в противном случае (с) УНТ называют просто
“хиральной”. Свойства одностенных УНТ, отвечающих разным парам индексов (n,m), могут очень сильно отличаться. Так, например, нанотрубка
обладает металлической проводимостью, если выполнено условие m-n=3q, где q - целое число или является
полупроводником при невыполнении этого условия. Таким образом, все УНТ вида
“кресло” обладают металлической проводимостью, а другие - могут быть как
проводниками, так и полупроводниками. Подобные свойства одностенных УНТ
обуславливают перспективы их использования в электронике.
Многостенные нанотрубки обладают значительно бóльшим разнообразием форм и
конфигураций. Существует, по крайней мере, два их принципиально различающихся
вида: несколько вложенных друг в друга одностенных трубок или же свиток из
графитового слоя (рис. 4) [4]. Расстояние между соседними слоями в УНТ почти во
всех случаях имеет тот же порядок, что и расстояние между слоями углерода в
графите - 0,344 нм. Обе структуры реализуются на практике, о чём
свидетельствуют эксперименты, например, по их окислению, в результате чего
окисляются лишь концевые фрагменты - в случае модели свитка реакция происходила
бы и по краю слоя [5].
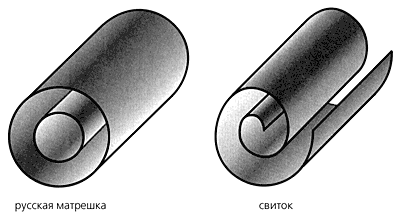
Рис. 4. Схематическое изображение наиболее распространенных структур
многослойных нанотрубок.
Также существуют предположения, что структура УНТ может изменяться в
зависимости от способа получения. Например, если их получают при высоких
температурах (более ~2000К) образуются “свитки”, а при низких температурах -
“матрёшки”.
Чёткого разграничения понятий “нанотрубка” и “нановолокно” не существует.
Большинство авторов называют многостенной углеродной трубкой совокупность
одностенных УНТ, как бы вдетых одна в другую; то есть множество строго
коаксиальных углеродных цилиндров с последовательно увеличивающимся диаметром.
Также почти все авторы называют углеродным нановолокном очень дефектные трубки,
графитовые слои которых не упорядочены или же трубки с большим диаметром (более
80 - 100 нм), в которых внутренняя упорядоченность не наблюдается. На рис. 5
представлены электронные микрофотографии высокого разрешения классической УНТ
(А) и нановолокна (Б). Видно, что в классической УНТ графитовые слои идут
параллельно друг другу и стенкам трубки, а в нановолокне они мало упорядочены и
изгибаются, проходя через центр.

Рис. 5. Структуры классической УНТ (А) и нановолокна (Б).
.2 Способы получения УНТ
В настоящее время существует два основных принципиально разных способа
получения углеродных наноматериалов [6]:
а) сублимация графита с последующим его осаждением;
б) пиролиз органических соединений.
Сублимацию углерода проводят в дуговым разрядом, либо лазером, нагревая
графитовую мишень до температуры ~4000oК. Для увеличения выхода УНТ обычно используют
катализаторы - металлы, их соли или сплавы. Самыми эффективными катализаторами
являются на основе Fe, Ni, Co.
Пиролиз органических соединений проводится также на металлических
катализаторах при температуре 600-1500оС на вольфрамовой нити или в
печи. В качестве источника углерода обычно используют достаточно
термоустойчивые углеводороды (бензол, ацетилен, метан), благодаря чему в
условиях эксперимента некаталитическое разложение, приводящее к образованию
сажи или графита, сводится к минимуму.
.2.1 Синтез в дуговом разряде
Именно с помощью дугового разряда впервые были получены УНТ,
охарактеризованные структурно. Принципиальная схема установки для дугового получения
УНТ приведена на рис. 6: в герметичной камере в атмосфере обычно инертного газа
удерживаются на заданном расстоянии два электрода, с которых с помощью дуги
осуществляется испарение материала электрода и его последующее осаждение на
охлаждаемых стенках камеры. Чаще всего в качестве материала электродов
используют графит, или даже уголь. Для увеличения выхода УНТ обычно используют
катализаторы: в аноде высверливают отверстие, которое заполняют соединениями
металлов. Обычно в качестве катализаторов используют соединения Fe, Co, Ni, иногда
легированные Cr, Mo, Y и другими
элементами; реже - вообще без катализаторов [7].
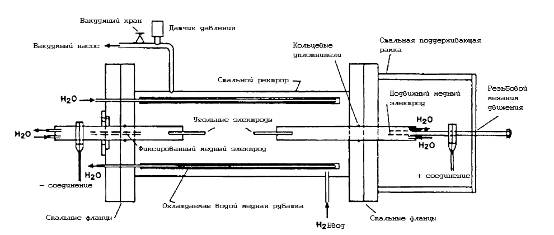
Рис. 6. Схема установки для получения УНТ в дуговом разряде.
Обычно выход максимален при давлении около 13 кПа, при этом получаются
довольно похожие результаты: сильно загрязнённые сажей многостенные и
одностенные УНТ.
Таким образом, несмотря на то, что с помощью дугового разряда можно
получать довольно большие количества материала, их ещё необходимо тщательно
очищать для удаления графита и аморфного углерода, что делает этот метод не
слишком эффективным. Также, из-за большой температуры дуги довольно сложно
контролировать морфологию получающихся трубок.
.2.2 Синтез лазерным испарением графита
Другой способ сублимации углерода - облучение лазером графитовой мишени,
содержащей катализатор. Типичная установка, используемая в подобных случаях,
представлена на рис.7 [8]. Мишень (спрессованная и прокалённая в инертном газе
смесь порошка графита и смеси оксидов переходных металлов или самих металлов),
находящуюся в печи в токе инертного газа, облучают обычно Nd:YAG лазером. При облучении происходит испарение графита и
катализатора, реакция между ними и в конечном итоге УНТ осаждаются на
охлаждаемом коллекторе. В результате получаются преимущественно одностенные УНТ
или МУНТ с малым (до 10) числом стенок, загрязнённых аморфным углеродом. В
оптимальных условиях можно достигнуть до 90% чистоты одностенных УНТ.
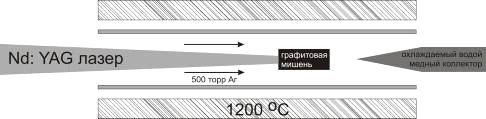
Рис. 7. Схема установки
получения УНТ лазерным облучением.
К достоинством метода относится лёгкость контроля и изменения условий
синтеза, в результате чего возможно получение УНТ с узким распределением по
диаметру, однако главный недостаток - крайне сложное масштабирование, связанное
с дороговизной лазеров, сводит почти на нет практическое применение метода для
получения УНТ в больших количествах.
.2.3 Пиролитическое разложение органических соединений
Установка, используемая для пиролиза углеродсодержащего сырья (обычно относительно
термоустойчивых углеводородов, таких как ацетилен, метан или бензол), является
куда более простой, по сравнению с описанными в п. 2.2.1 и п. 2.2.2. Основной
её элемент - печь, нагревающаяся до температуры не выше 1000оС, а
также находящийся в ней реактор - обычно кварцевая трубка, в которой и
происходит каталитическое разложение.
Обычно используют два основных способа ввода катализатора в реакционный
объём: использование подложки, на которой каким-либо методом (например,
золь-гель) нанесён катализатор, либо получение катализатора одновременно с
синтезом УНТ.
Самый распространённый из перечисленных методов - использование
предварительно приготовленной подложки, материал которой должен обладать целым
рядом свойств, таких как инертность к образуемым УНТ, большая удельная
поверхность с возможностью лёгкого нанесения и стабилизации частиц катализатора
определённого размера, термостойкость, а также возможность его несложного
растворения для получения чистых УНТ. Подложек, удовлетворяющих хотя бы этим требованиям,
немного, поэтому обычно используют оксид магния, который образует твёрдые
растворы с оксидами кобальта и никеля, восстановление которых водородом
приводит к получению равномерно распределённых частиц кобальта и никеля в
матрице оксида магния.
Таким образом, синтез УНТ пиролизом органических соединений
представляется наиболее перспективным, поскольку он легко масштабируем,
позволяет получать значительные количества материала и при его использовании,
можно контролировать морфологию получаемых продуктов. При этом получение
катализатора в момент реакции позволяет не только упростить сам процесс синтеза
(нет необходимости готовить катализатор и впоследствии отделять УНТ от него),
но и контролировать размер образующих частиц металла.
.3 Модель формирования УНТ
На данный момент предложено несколько возможных механизмов
каталитического образования УНТ. Большинство наблюдаемых закономерностей
качественно объясняет несложная схема, предложенная в работе [9]. При пиролизе
органических соединений образующийся углерод адсорбируется на
металле-катализаторе и затем растворяется в нём. Углерод диффундирует и
высаживается на участках частицы металла с бóльшим радиусом кривизны поверхности.
То есть, в случае грушевидной формы металлических частиц углерод образуется и
растворяется в округлой её части, диффундирует к заострённой, на поверхности
которой, но не на её вершине, происходит образование УНТ.
В качестве катализаторов наибольшей эффективностью обладают Fe, Co и Ni,
поскольку, во-первых, они растворяют заметные количества углерода, образуя
метастабильные карбиды; во-вторых, в них происходит анизотропная диффузия
растворённого углерода, способствующая образованию графита на отдельных гранях.
Лишь элементы семейства железа, образуя метастабильные карбиды, обеспечивают
направленную диффузию углерода к отдельным граням частицы.
В случае нанесённых на подложку катализаторов возможны 2 способа роста
УНТ - от основания или с вершины (рис. 8). В первом случае частица металла,
прочно удерживаясь на подложке, осуществляет образование УНТ “снизу вверх”; во
втором случае - частица металла, первоначально находившаяся на подложке,
“уносится” с неё, находясь в вершине образуемой УНТ. Таким образом, полученные
наноматериалы могут содержать частицы металла как у самой подложки, так вдали
от неё - на концах УНТ в зависимости от реализуемого механизма. Какой тип
механизма будет реализован в данном случае, зависит главным образом от силы
взаимодействия катализатора с подложкой и от размера частиц катализатора.
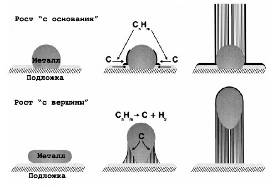
Рис 8. Схематическое изображения двух моделей образования УНТ на
нанесённом катализаторе.
В обоих случаях происходит каталитическое разложение углеводорода или
другого углеродсодержащего соединения на частице металла с образованием
углерода, который частично растворяется в частице-катализаторе. Поскольку
пиролиз большинства углеводородов экзотермичен, в частице появляется небольшой
температурный градиент и ввиду зависимости растворимости углерода в металле от
температуры, происходит его отложение на холодной части частицы, в результате
чего и происходит рост трубки .
Таким образом, размер частицы металла, в первую очередь, определяет
размер образуемых УНТ, то есть для получения углеродных наноматериалов с
заданными свойствами необходимо, прежде всего, использовать катализатор с легко
регулируемым и очень узким распределением наночастиц по размерам.
Температура пиролиза оказывает существенное влияние на рост углеродных
наноструктур определенного типа и диаметра. Так, при 500ºC образуются преимущественно волокна,
сложенные в виде плоскопараллельных графеновых слоев (“стопка”) или вложенных
друг в друга конусов (“елка”) (рис. 9а, 9б). Характерным отличием таких волокон
является большой диаметр, который находится в интервале 100 - 200 нм и может достигать
400 нм и более. Другой особенностью является наличие канала у конусных волокон
типа “елка”, диаметр которого составляет 2 - 5 нм. У волокон типа “стопка”
канал отсутствует. При 700ºC образуются преимущественно конусные
волокна в виде вложенных друг в друга усеченных пирамид (“рыбий хребет”) (рис.
9в, 9г). Отличительной чертой этих волокон является то, что их диаметр
существенно меньше (20 - 40 нм), а ширина канала может достигать 10 - 15 нм. На
концах многих из них находятся металлические частицы, которые, как правило,
совпадают с диаметром волокон. Внутри каналов некоторых волокон находятся
перемычки.
При 750ºС в образцах сажи наблюдаются нановолокна, закрученные в виде
пространственных спиралей (рис. 9д), появление которых можно объяснить тем, что
диффузия углерода в объеме металлической частицы катализатора носит
неизотропный характер. Анизотропия частицы катализатора приводит к тому, что
скорость диффузии углерода зависит от выбранного направления, что вызывает
разницу в скоростях осаждения углерода на различных гранях каталитической
частицы.
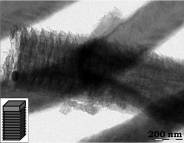
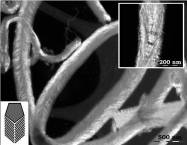


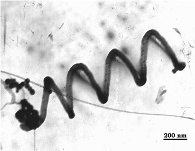
Рис. 9. Микрофотографии углеродных наноструктур, полученных при разных
температурах синтеза: а) 500ºC − “стопка”; б) 500ºC − “елка”; в, г) 700ºC − “рыбий хребет”; д) 750ºC − “спираль”[12].
.4 Методы исследования УНТ
.4.1 Электронная микроскопия
Поскольку диаметры УНТ имеют порядок 10 нм, оптическая микроскопия для
исследования их структуры неприменима, поэтому чаще всего используют
электронную микроскопию. Являясь локальным методом анализа (позволяет судить о
свойствах очень малого фрагмента исследуемого образца), метод позволяет
непосредственно получать данные о морфологии материалов и их размерах (длина,
ширина, распределение по диаметрам). В материаловедении чаще всего используются
сканирующая и просвечивающая микроскопия. Просвечивающая электронная
микроскопия высокого разрешения позволяет исследовать очень детально отдельные
трубки - с её помощью возможно определения даже числа графитовых слоёв,
образующих трубку, расстояния между ними, расположение и дефектность.
2.4.2 Спектроскопия комбинационного рассеяния
Другой часто используемый метод исследования УНТ - спектроскопия
комбинационного рассеяния, позволяет получать информацию, как об отдельных
трубках, так и об их агломератах. Спектр столь непростого объекта как углеродная
трубка сложно интерпретировать. В них обычно выделяют несколько линий:
радиальные колебания (между 120 и 250 см-1), G-линию (около 1600 см-1),
менее интенсивные D- (около 1350 см-1)
и M- (около 1750см-1) линии,
а также промежуточные колебания (в интервале частот между радиальными
колебаниями и D-линией) - рис. 10.
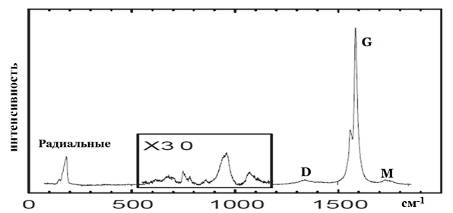
Рис. 10. Типичный КР спектр одностенных УНТ.
Наиболее просто представить себе радиальные колебания и колебания,
проявляющие в G -линии. В первом случае происходящие
колебания сужают и растягивают углеродную трубку, а во втором - происходят
колебания графитовых слоёв в плоскости[10][11] (рис. 11).
Рис. 11. Радиальные колебания и колебания G-линии одностенной УНТ.
Радиальные колебания, обнаруживаемые в рамановском спектре в интервале от
120 до 250 см-1, позволяют не только судить о том, что в исследуемом
углеродном образце присутствуют одностенные трубки (так как ни графит, ни
другие формы углерода не имеют подобных колебаний), но и определить их диаметр.
Также в условиях резонансной спектроскопии, подобрав длину волны лазера,
соответствующую энергии перехода между энергетическими уровнями одностенной
трубки, можно снять спектр единичной трубки и определить её диаметр по частоте
радиальных колебаний, которая обратно пропорциональна диаметру одностенной
трубки.
Также немало информации об одностенных трубках дают колебания G-линии (около 1600см-1). В
случае достаточно узких трубок (диаметром менее ~ 2нм) единственная линия,
которая была бы в случае графита или трубки большого диаметра, разбивается на
две линии G- и G+ с меньшей и большей энергией
соответственно, частоты которых также зависят от диаметра, но и от их
проводимости (“металлические” трубки имеют широкие пики G- и G+ сопоставимой интенсивности, а
полупроводниковые - узкий пик G+ и узкую линию небольшой
интенсивности G- - рис. 12).
Другие линии в случае одностенных трубок имеют куда меньшую
интенсивность, но с их помощью можно также извлечь информацию о трубках.
Например, интенсивность D-линии
зависит от дефектности и с её помощью можно обнаружить присутствие аморфного
углерода, а её частота зависит от хиральности трубок.
Многостенные трубки являются куда более сложными объектами для анализа,
которые, хоть и можно представить как совокупность одностенных трубок,
вставленных друг в друга, имеют ряд особенностей. Так, например, их диаметры на
порядок превосходят диаметр одностенных трубок, а в их структуре обычно
присутствует немало дефектов. Из-за этого принципиально меняются и их
рамановские спектры: радиальные колебания, наблюдаемые для небольших трубок,
отсутствуют в спектрах УНТ; расщепление G-линии и зависимость её частоты от диаметра, обусловленная
искривлением графитового слоя, пропадают (рис. 12). Благодаря, подчас,
дефектной структуре интенсивность D-линии существенно увеличивается, что делает затруднительным определение
аморфного углерода в образце.
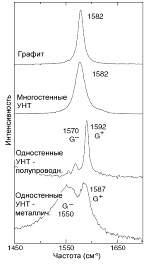
Рис. 12. Спектры КР разных типов углеродных материалов.
.4.3 Термический анализ
Куда более простым методом исследования, позволяющим оценить количество
примесного аморфного углерода в образце, а также количество присутствующего в
нем металла, является термогравиметрия (термопрограммируемое окисление
материала на воздухе). Углеродные трубки, являясь более упорядоченными
структурами, по сравнению с аморфным углеродом, окисляются на воздухе медленнее
и при более высокой температуре, поэтому при постепенном повышении температуры
первым выгорает аморфный углерод, затем - УНТ, а оставшаяся масса соответствует
оксиду металла-катализатора (рис. 13). Видно, что присутствующие в больших
количествах аморфные углеродные образования окисляются при температурах около
398oC, а УНТ - 474оС[12],[13].
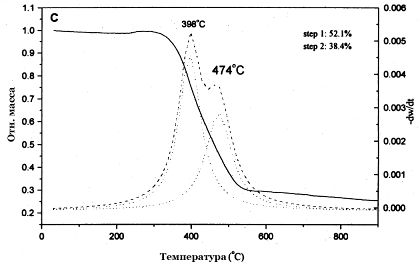
Рис. 13. Результаты ТГ анализа образца УНТ, загрязнённого аморфным
углеродом и металлом.
.4.4 Рентгеновская дифракция
Также материалы, содержащие УНТ, часто исследуются с помощью
рентгеновской дифракции. Одним из наиболее важных параметров, характеризующих
свойство слоистых материалов, является межсплоскостное расстояние. Известно,
что расстояние между слоями в идеальном кристалле графита составляет 0.3354 нм.
В случае углеродных нанотрубок расстояние между соседними слоями заметно
больше. Принято считать, что оно близко к 0.34 нм. Существует, однако, целый
ряд факторов, которые могут искажать идеальную цилиндрическую структуру
многослойных нанотрубок. К таким факторам относятся дефекты в пределах слоя
(пяти- и семичленные циклы), наличие атомов (ионов) между слоями,
взаимодействие трубок друг с другом, что может проявиться при их объединении в
пучки, и т.д. Естественно также думать, что при увеличении диаметра, а точнее
площади поперечного сечения, расстояние между слоями уменьшается, приближаясь к
таковому в графите [14],[15].
Таблица 1. Межплоскостные расстояния d002; значение синдексом м определяли по положению максимума
пика, а с индексом цт - по положению центра тяжести.
|
Образец
|
d002м нм
|
d002цт нм
|
|
1
|
0,3392
|
0,3401
|
|
2
|
0,3413
|
0,3414
|
|
3
|
0,3434
|
0,3422
|
|
4
|
0,3366
|
0,3365
|
|
графит
|
0,3358
|
0,336
|
C его
помощью часто доказывают полноту растворения подложки при получении УНТ на ее
поверхности (рис. 14), либо фазовое состояние частиц катализатора.
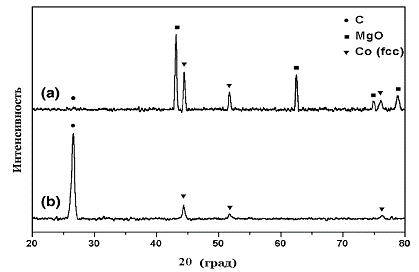
Рис. 14. Дифрактограммы УНТ на подложке MgO-Co до
(a) и после (b) обработки HCl.
.5 Термодинамические свойства углеродных материалов
Алмаз - одна из самых известных аллотропных
модификаций углерода. Поэтому его термодинамические характеристики на
сегодняшний день изучены и табулированы. Для алмаза Df Н0 =1, 83 кДж/моль, S0T=2,348 Дж/К*моль Ср0=6,12
Дж/моль*К.
Энтальпии сгорания графита (Dс Н) являются табулированными
значениями и составляют -393,51 кДж/мол. Теплоемкость графита ниже теплоемкости
алмаза. Это связано с переходом от трехмерной структуры к двумерной. Опыты по
определению калориметрических данных графита, как правило, проводят для
сравнения при определении энтальпий других углеродных материалов. Энтальпия образования
графита Df Н0 =0 (простое вещество).
Расчеты энтальпий образования Df Н0, а также энтропий DfS0 и функций Гиббса DfG0 для трех различных образцов карбина из простого
вещества графита при 298,15 К и стандартном давлении на основе данных по
энергиям сгорания Dс U0 были опубликованы в работе [16]. Для
измерения энергий сгорания использовали калориметрическую установку, полноту
сгорания веществ контролировали с помощью анализа газообразных продуктов.
Получены следующие значения энергий сгорания: DcU= -353,7, -356,5 и -371,5 кДж/моль.
Таким образом, установили, что энергия сгорания сильно зависит от строения
углеродного материала, и даже для одного вещества может различаться в
зависимости от количества угольной фракции в составе образцов карбина, количества
поперечных сшивок между цепочками и др.
В работе [17] калориметрическим методом изучена температурная зависимость
теплоемкости фуллерена С60 в области 5-340 К; измерены температуры
энтальпии физических превращений. По полученным экспериментальным данным
вычислены термодинамические функции c0p, H0(T), S0(T), G0(T) - H0(0) для области 0-340 К.
Энтальпию H0(T) -H0(0), энтропию S0(T) и функцию Гиббса G0(T)-H0(T) вычисляли
согласно уравнениям (1)- (3) по методике, описанной ранее этими же авторами:
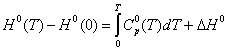 (3)
(3)
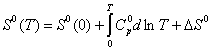 (4)
(4)
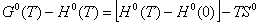 (5)
(5)
Значения
энтальпий сгорания (Dс Н0,
кДж/моль) и образования (DfН0,
кДж/моль) фуллерена С60 при 298,15 К и стандартном давлении, а также
энтропии (DfS0, Дж/моль*К), энергии Гиббса (DfG0,
кДж/моль) реакции образования фуллерена С60 из графита при тех же
условиях приведены в табл.2:
Таблица
2. Термодинамические данные образования фуллерена С60.
|
DсН0 кДж/моль
|
DfН0 кДж/моль
|
DfS0 кДж/моль*К
|
DfG0 кДж/моль
|
|
-25937±16
|
2327±17
|
420.8±1.2
|
2202±17
|
Как видно, DfG0 - большая положительная величина, что означает полный
термодинамический запрет самопроизвольного протекания процесса 60С(gr)→C60 (cryst), где С(gr) и C(cryst)- углерод в
форме графита и кристалла соответственно. Возможен лишь несамопроизвольный
процесс, что находится в полном согласии с экспериментальными данными.
Таблица 3. Энтальпии сгорания (Dс Н0), энтальпии (Df Н0), энтропии (DfS0) и функции Гиббса (DfG0) образования аллотропных модификаций углерода при 298,15 К и
стандартном давлении.
|
Аллотропная модификация
|
-DсН0,
кДж/моль
|
DfН0, кДж/моль
|
DfS0, Дж/моль*К
|
DfG0, кДж/моль
|
|
Карбин
|
353,7
|
-39,8
|
5,3
|
-38,3
|
|
Фуллерен С60
|
432,8
|
39,25
|
1,54
|
38,79
|
|
Фуллерен С70
|
36,50
|
0,959
|
36,21
|
|
Графит
|
393,51
|
0
|
0
|
0
|
|
Алмаз
|
395,34
|
1,83
|
-3,372
|
2,83
|
Таким образом, термодинамически наиболее устойчивой
модификацией углерода при 298,15 К и стандартном давлении является карбин.
Повышенная термодинамическая стабильность карбина обусловлена в основном двумя
причинами: большей энергией сопряжения углерод - углеродных кратных связей в
карбине по сравнению с графитом (~42 кДж/моль) и большей энергией межцепного взаимодействия в
карбине по сравнению с энергией взаимодействия слоев в графите (~111кДж/моль).
Экспериментальных данных по энтальпиям образования
нанотрубок не имеется. В работе [18] рассчитаны значения энтальпий образования
для нанотрубок в зависимости от числа слоев. Для случая с графитом расчет
ведется по следующей схеме:
C(gas)→C(solid graphite), ΔHv(gr) = -710,51 кДж/моль
где ΔHv(gr) энтальпия испарения, и допустимо написать
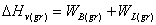
где
WB(gr) это полная энергия связей С-С, а WL(gr) это полная энергия когезии. Для того, чтобы подобные
расчеты применить к нанотрубкам (и, соответственно, рассчитать энтальпии
образования), необходимо воспользоваться эмпирическими энергетическими
функциями, самая простая из которых- потенциал Леннардра-Джонса:
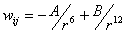 ,
,
где
wij это энергия взаимодействия частиц i и j,
находящихся на расстоянии r, A и B это константы, которые могут быть использованы для
вычисления всех С-С взаимодействий и слой-слой взаимодействий, но со
специфическими значениями для каждого случая. После соответствующих
математических преобразований получена следующая зависимость для энтальпии
образования нанотрубок (с учетом энтальпии испарения графита) :
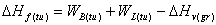
Для
нанотрубок расчет производится для идеализированных симметричных и
цилиндрических трубок. Все симметричные многостенные нанотрубки, рассмотренные
в этом исследовании, метастабильны, то есть ΔHf(tu)>0. В отличие от
графита, где слои лежат параллельно друг другу, в трубках они (слои)
искривляются. Вследствие этого в них присутствуют набольшие количества sp3-гибридного углерода, что и обуславливает
нестабильность. В результате расчетов получены следующие данные (табл.4):
Таблица
4. Расчетные энтальпии образования нанотрубок.
|
Нанотрубка, число слоев, n
|
ΔHf , кДж/моль
|
|
R=0.339 нм
|
|
2
|
4.40
|
|
8
|
6.47
|
|
32
|
6.49
|
|
R=1.695 нм
|
|
2
|
8.60
|
|
8
|
6.93
|
|
32
|
6.53
|
3.Экспериментальная часть
.1 Исходные реагенты
В качестве исходных веществ при проведении экспериментов использовались:
бензойная кислота(³99,9%, Merck), углеродные нанотрубки, полученные
в лаборатории КГЭ, и углеродные нановолокна, синтезированные во ФГУП
«Исследовательский центр имени М.В. Келдыша».
.2 Методы исследования
.2.1Термогравиметрический анализ
ТГ-МС анализ проводили на приборе NETZSCH STA 409 PC с
подключенным квадрупольным масс-спектрометром Netzsch QMS 403C. Для
проведения измерения навеска образца (10 мг) в платиновом тигле помещалась в
печь в атмосфере кислорода или инертного газа аргона. Объемная скорость потока
газа поддерживалась равной 20 мл/мин для аргона и 40 мл/мин кислорода, при этом
блок весов был защищен инертным газом (аргоном) с потоком 20 мл/мин. Измерение
проводили в интервале температур от 20 до 1000°С. Скорость нагрева составляла 10°С/мин. Измерение массы образца
относительно массы пустого тигля измерялась с точностью 10-6 г.
Результаты измерения обрабатывали с помощью программного обеспечения «NETZSCH-analysis».
.2.2 Рентгеновская дифракция
Спектры рентгеновской дифракции регистрировали c использованием автоматического порошкового дифрактометра
Дифрактометр «РАДИАН» ДР-01 фирмы “Экспертцентр” (геометрия θ-2θ,
излучение СuKα1, λ=1.54051Å). Рентгенограммы анализировали с
помощью базы порошковых данных PDF-2.
.2.3 Спектроскопия комбинационного рассеяния
Спектры комбинационного рассеяния регистрировались на Рамановском
микроскопе-спектрометре “Jobbin-Yvon LabRaman HR80” производства HORIBA (япония), оснащенной системой микро-Раман с детектором, охлаждаемым
жидким азотом, ф также монохроматором с тюрелью дифракционных решеток. Спектры
возбуждали аргоновым лазером при длине волны λ=488 нм. Регистрацию чпектров образцов
проводили с использованием дифракционной решетки 2400 штрихов/мм и штатного
100Х объектива.
.2.4 Бомбовая калориметрия
Определение теплот сгорания углеродных нанотрубок проводили с помощью
бомбового калориметра “e2K” производства “Digital Data Systems”
в идентичных условиях в атмосфере кислорода. Предварительно прибор калибровали
по теплоте сгоряния бензойной кислоты в тех же условиях, в которых проводился
эксперимент.
.2.5 Сканирующая электронная микроскопия
Исследование образцов методом сканирующей электронной микроскопии
проводили на микроскопе Joel JSM 6490 LV, оснащенным катодом из вольфрама.
Для анализа небольшое количество образца (менее 1 мг) наносили на
токопроводящий скотч, находящийся на полированной меднеой подложке, и помещали
в камеру микроскопа. Камеру откачивали до остаточного давления 10-6 мм.
рт. ст. Образцы подвергались воздействию электронного пучка с энергией
первичных электронов, составляющей 25 кВ.
4.Обсуждение результатов
Целью данной работы являлось определение энтальпии образования углеродных
нанотрубок из графита в зависимости от типа полученного углеродного материала.
По мере выполнения работы были проведены эксперименты по определению
энтальпии сгорания материалов. Состав образцов определяли при помощи метода
рентгеновской дифракции, сопоставляя полученные спектры со спектрами металлов,
входящих в состав катализаторов при получении соответствующих наноматериалов.
По дифрактограммам образцов было установлено наличие соответствующих
металлов-катализаторов; значения углов представлены в таблице 5:
углеродная нанотрубка энтальпия
Таблица 5. Характерные пики Fe, Co, Ni.
|
Металл
|
2θ град
|
|
Ni
|
44,53
|
|
|
51,89
|
|
Co
|
44,52
|
|
|
47,46
|
|
Fe
|
|
|
49,56
|
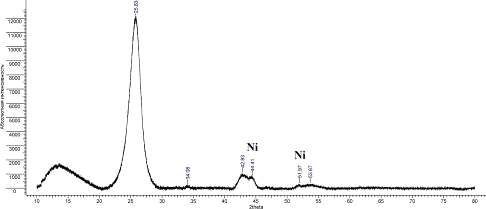
Рис. 15. Дифрактограмма УНТ 5,10,09 Ni
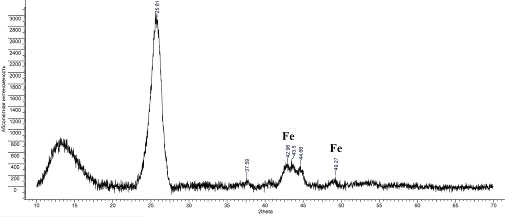
Рис.16. Дифрактограмма УНТ 5,10,09 Fe
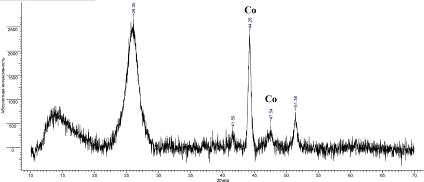
Рис.17. Дифрактограмма УНТ 8,10,09 Co
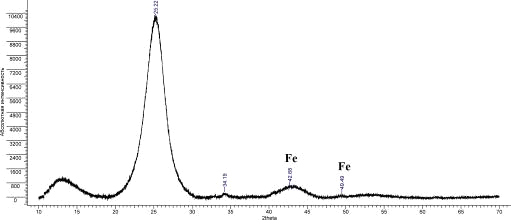
Рис.18. Дифрактограмма УНТ 10,07,09 Fe
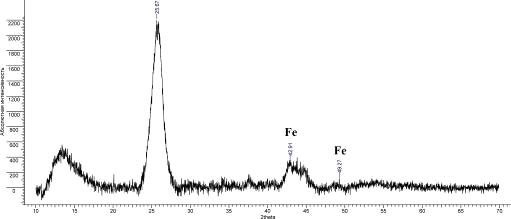
Рис.19. Дифрактограмма УНТ 10,09,09 Fe
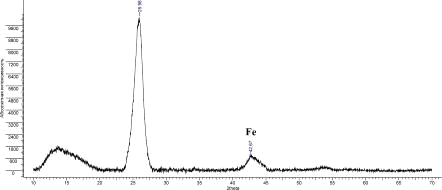
Рис.20. Дифрактограмма УНВ Fe
Было рассчитано межплоскостное расстояние d002:
d=λ/2/sin(θ)
Сu Kα1 λ= 1,54051Å
Таблица 6. Межплоскостные расстояния, рассчитанные по дифрактограммам.
|
Образец
|
2θ град
|
d Å
|
|
УНТ 5,10,09 Ni
|
25,83
|
3,446
|
|
УНТ 5,10,09 Fe
|
25,82
|
3,448
|
|
УНТ 8,10,09 Co
|
26,06
|
3,416
|
|
УНТ 10,07,09 Fe
|
25,22
|
3,528
|
|
УНТ 10,09,09 Fe
|
25,68
|
3,466
|
|
УНВ Fe
|
25,99
|
3,425
|
Также сделаны фотографии образцов с помощью сканирующего электронного
микроскопа. По снимкам был оценен диаметр нанотрубок: d(УНТ5,10,09Fe)=20-50нм, d(УНТ10,09,09Fe)=10-30нм. И в соответствии найдены КР спектры
на сайте [19] похожих материалов для сравнения соотношения G’/G(таблица 7).

Рис.21. Фотография УНТ 5,10,09 Ni

Рис.22. Фотография УНТ 5,10,09 Fe

Рис.23. Фотография УНТ 8,10,09 Co

Рис.24. Фотография УНТ 10,07,09 Fe

Рис.25. Фотография УНТ 10,09,09 Fe

Рис.26. Фотография УНВ Fe
По результатам ТГ анализа было оценено количество металла-катализатора в
каждом образце для дальнейшего расчета энергии сгорания углеродного
наноматериала. Также температурные промежутки: сгоранию аморфного углерода
соответствует интервал от 300 до 450°С, наноматериал сгорает при температуре от 450-500 до 950°С.
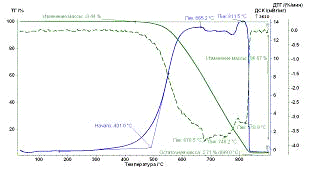
Рис. 27.
Результаты ТГ анализа образца УНТ 5,10,09 Ni
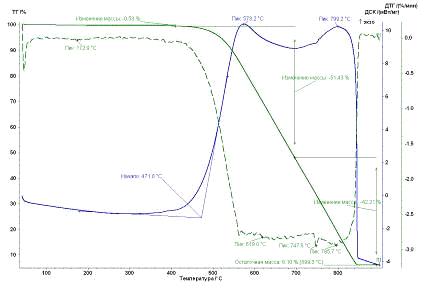
Рис. 28.
Результаты ТГ анализа образца УНТ 5,10,09 Fe
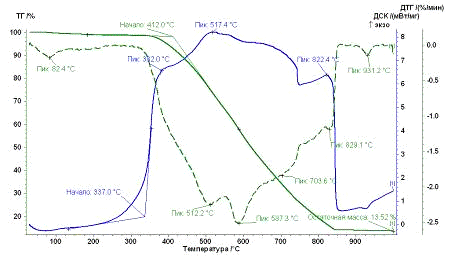
Рис. 29.
Результаты ТГ анализа образца УНТ8,10,09 Co
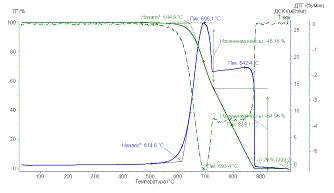
Рис. 30. Результаты
ТГ анализа образца УНТ10,07,09 Fe
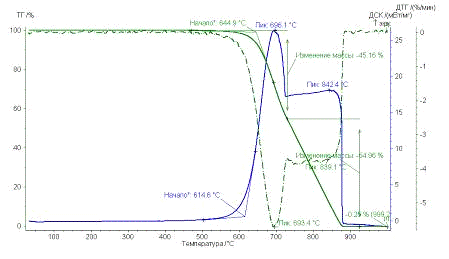
Рис. 31.
Результаты ТГ анализа образца УНТ 10,09,09 Fe
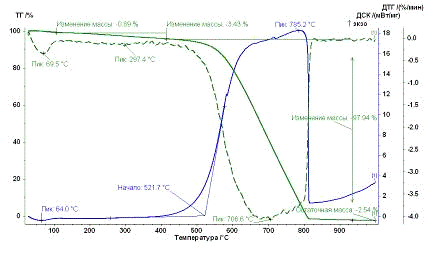
Рис. 32.
Результаты ТГ анализа образца УНВ Fe.
В спектрах КР углеродных материалов традиционно наблюдаются две основные
полосы: G, которая связана с тангенциальными колебаниями С-С связей и
характеризует упорядоченную составляющую углеродной фазы, и D, обусловленную
двойным резонансным рамановским эффектом, характеризующую неупорядоченную
составляющую, в частности, дефекты в графитовых слоях. Как оказалось,
соотношение интенсивностей линий D/G, позволяющее оценить количество дефектов в
материале, больше у углеродных волокон (1,280), что обусловлено наличием
большого количества sp3-гибридизованных углеродных атомов на концах графитовых
слоев. УНТ 8,10,09 Co также дефектны (D/G = 0,937), поскольку их структура
претерпевает нарушение sp2-гибридизации атомов углерода из-за присутствия
атомов азота. Остальные образцы мене дефектны (D/G = 0,6). Соотношение G’/G позволяет оценить взаимодействия дальнего порядка между
графитовыми слоями (таблица7). Полученные данные подтверждают структуру
наноматериаллов: «рожки», волокна и азотосодержащие УНТ имеют наименьшие
значения G’/G, так как они обладают менее регулярной структурой; для
цилиндрических трубок значения выше в несколько раз.
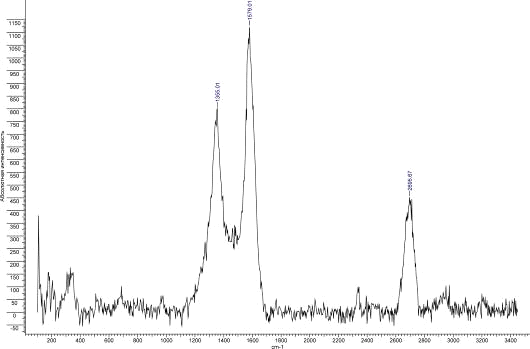
Рис.33. КР спектр УНТ 5,10,09 Fe
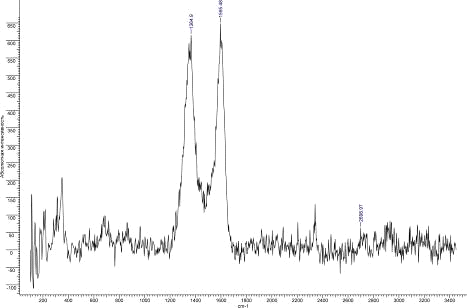
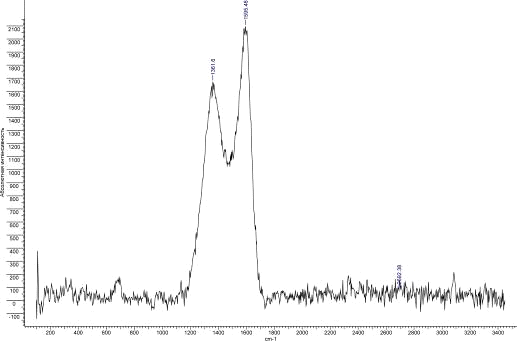
Рис.35. КР спектр УНТ 10,07,09 Fe
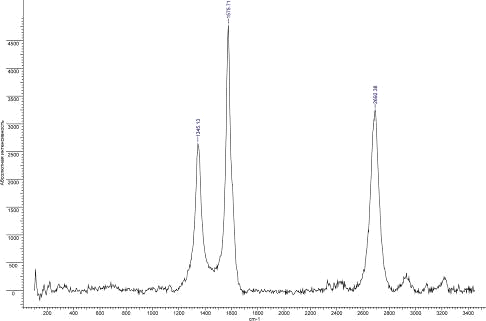
Рис.36. КР спектр УНТ 10,09,09 Fe
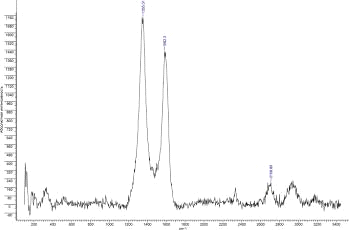
Рис.37. КР спектр УНВ Fe.
Таблица 7.Соотношение D/G и G’/G пиков КР
спектров.
|
Образец
|
D/G
|
G'/G
|
G'/G*
|
|
УНТ 5,10,09 Fe
|
0,648
|
0,467
|
0,833
|
|
УНТ 8,10,09 Co
|
0,937
|
0,145
|
-
|
|
УНТ 10,07,09 Fe
|
0,775
|
0,101
|
-
|
|
УНТ 10,09,09 Fe
|
0,530
|
0,702
|
0,761
|
|
УНВ Fe
|
1,280
|
0,153
|
-
|
*-для получения данных использовались материаллы [19].
Энтальпии образования УНТ рассчитывали согласно энтальпийной диаграмме по
разности энтальпии сгорания графита и УНТ.

Рис. 38. Энтальпийная диаграмма.
Сжигание образцов в калориметрической бомбе проводится не при стандартных
условиях(давление в бомбе 30 атм).
Реакцию взаимодействия УНТ с кислородом можно записать в следующем виде:
Cx+xO2=xCO2
Мольная энергия сгорания ∆cUm равна произведению удельной энергии
сгорания на молярную массу вещества (М=12), тогда мольная энтальпия сгорания
равна:
∆cHm=∆cUm+∆(pV)=∆cUm+∆nRT
∆cUm - мольна энергия сгорания вещества
[кДж/моль];
∆n - измерение количества газа в ходе
реакции сгорания [моль];
R -
универсальная газовая постоянная (8,314Дж/моль/К);
T -
температура (298,15 К).
Изменение количества газа в результате реакции связано лишь с
образованием оксидов металлов-катализаторов, что составляет ∆n=0,005 моль:
∆cHm=∆cUm+0,005RT=∆cUm+12,4Дж
Что составляет порядка 0,1% от общей теплоты, выделившейся при сгорании
образца, что ниже погрешности эксперимента. Также необходимо удостоверится в
том, что вклад энтальпии окисления металл в общую энтальпию также невелик:
Обе величины вписываются в рамки погрешности измерений. Поэтому в
дальнейшем изменением давления будем пренебрегать, полагая, что
∆cHm=∆cUm.
Итак, теплоту сгорания в калориметрической бомбе можно целиком отнести к
теплоте сгорания УНТ.
Образцы наноматериала перед сжиганием спрессовывались в таблетки с
бензойной кислотой в соотношении 1 к 2 по массе, полученные данные
корректировали по теплоте сгорания бензойной кислоты (∆cUo=26434Дж/г).
Энтальпию образования УНТ рассчитывали согласно энтальпийной диаграмме по
разности сгорания УНТ и графита. Теплота сгорания графита ∆cUo=-32762±11Дж/г.
Таблица 7 .Энергия сгорания образцов наноматериала.
|
Образец
|
∆cU
Дж/г
|
∆cH
кДж/г*
|
|
УНТ 5,10,09 Ni
|
34050,46±123,38
|
1,288±0,123
|
|
УНТ 5,10,09 Fe
|
32975,61±127,85
|
0,2136±0,128
|
|
УНТ 8,10,09 Co
|
30791,76±40,36
|
-1,97±0,0436
|
|
УНТ 10,07,09 Fe
|
34374,05±188,88
|
1,612±0,188
|
|
УНТ 10,09,09 Fe
|
32958,15±173,65
|
|
УНВ Fe
|
32380,61±72,44
|
-0,381±0,0724
|
*-энтальпия образования рассчитана относительно энтальпии образования
графита.
5.Выводы
С помощью методов синхронного термического анализа, сканирующей электронной
микроскопии, ренгеновской дифракции и спектроскопии комбинационного рассеяния
изучены многостенные углеродные нанотрубки, азотосодержащие многостенные
углеродные нанотрубки, углеродные нановолокна и нанорожки. На основании
полученных данных рассчитано количество примесей металлов-катализаторов в
данных материалах. Методом адиабатической бомбовой калориметрии определены
теплоты сгорания указанных материалов, рассчитаны энтальпии их образования.
Впервые показано, что для углеродных нановолокон и азотосодержащих многостенных
углеродных нанотрубок эти величины имеют отрицательные значения, что, вероятно,
свидетельствует о наличии в их структуре окисленных атомов углерода.
На основе данных спектроскопии комбинационного рассеяния проведена оценка
дефектности структур всех типов материалов: количество sp3-гибридизованных атомов углерода увеличивается в ряду:
многостенные углеродные нанотрубки, углеродные нанорожки, азотосодержащие
многостенные углеродные нанотрубки, углеродные нановолокна.
6.Список литературы
1. P.
Delhaes, J.P. Issi, S. Bonnamy and P. Launois, Polymorphism and Structure of
Carbons (p.11-13).
. S.
Reich, L. Li, and J. Robertson, Structure and formation energy of carbon
nanotube caps.
. M.S.
Dresselhaus, G. Dresselhaus, and R. Saito, Physics of carbon nanotubes.
. Sumio
lijima Helical microtubules of graphitic carbon.
. Zhao
X., Ando Y., Qin L.-C., Kataura H., Maniwa Y., Saito R., Radial breathing modes
of multiwalled carbon nanotubes. // Chem. Phys. Lett. 2002. V. 361. P. 169-174.
6. Елецкий
А.В., Углеродные нанотрубки и их эмиссионные свойства. // Успехи физич. наук. 2002. Т. 172. №4. C. 401-438.
7. А.А.
Новакова, Е.Ю. киселева, Ю.В.
Ильина, Б.П. Тарасов, В.Е. Мурадян, Углеродные наноструктуры, полученные на Fe-Ni катализаторе.
8. Guo
T., Nickolaev P., Thess A., Colbert D.T., Smalley R.E., Catalytic growth of
single-walled nanotubes by laser vaporization. // Chem. Phys. Lett. 1995. V.
243. P. 49-54.
. Stephen
D. Tse Department of Mechanical and Aerospace Engineering, Rutgers University
ENCAPSULATING REACTIVE NANOPARTICLES IN CARBON NANOTUBES USING FLAME-BASED
SYNTHESIS.
. Jorio
A., Pimenta M.A, Souza Filho A.G., Saito R., Dresselhaus G., Dresselhaus M. S.,
Characterizing carbon nanotube samples with resonance Raman scattering. // New
J. Phys. 2003. V.5. P. 139.1-139.
. Andr
e Zaoui, Olivier Chauvet, Philippe Lambin, Remy Dendievel, JinBo Bai,
Comportement mecanique etelectrique des enchevetrements dnanotubes de carbone.
12. Володин
А.А., УГЛЕРОДНЫЕ НАНОВОЛОКНА И НАНОТРУБКИ: КАТАЛИТИЧЕСКИЙ СИНТЕЗ, СТРОЕНИЕ,
СВОЙСТВА.
13. H.Yu,
C.Lu ,T.Xi, L.Luo, J.Ning, C.Xiang, THERMAL DECOMPOSITION OF THE CARBON
NANOTUBE/SiO2 PRECURSOR POWDERS.
14. Ю.М.
Шульга, И.А. Домашнев, Б.П. Тарасов, А.М. Колесникова, Е.П. Криничная, В.Е.
Мурадян, Н.Ю. Шульга, Межслоевые расстояния в многослойных углеродных
нанотрубках.
. Осипова
И.В., ПОЛУЧЕНИЕ И СВОЙСТВА НАНОДИСПЕРСНЫХ ФОРМ УГЛЕРОДА В ПЛАЗМЕ ВЧ ДУГИ С НЧ
МОДУЛЯЦИЕЙ.
16. Касаточкин
В.И., Сладков А.М., Кудрявцев Ю.П., Коршак В.В., Структурная химия углерода.
Наука. Москва. 1969. С. 17.
17. Tetsu Kiyobayashi, Microbomb combustion calorimetry
of non-planar aromatic hydrocarbons.
18. R.Setton,
Carbon nanotubes II. Cohesion and fjrmation energy of cylindrical nanotubes.
. NanoAmor.com