Спектр атома гелия
Министерство
образования Республики Беларусь.
Учреждение
образования “Брестский государственный университет им. А.С. Пушкина”
КАФЕДРА ОБЩЕЙ
ФИЗИКИ
СПЕКТР АТОМА
ГЕЛИЯ
Брест
2011
Введение
Исследование линейчатого спектра вещества позволяет
определить, из каких химических элементов оно состоит и в каком количестве
содержится каждый элемент в данном веществе.
Количественное содержание элемента в исследуемом образце
определяется путем сравнения интенсивности отдельных линий спектра этого
элемента с интенсивностью линий другого химического элемента, количественное
содержание которого в образце известно.
Метод определения качественного и количественного состава
вещества по его спектру называется спектральным анализом. Спектральный анализ
широко применяется при поисках полезных ископаемых для определения химического
состава образцов руды. В промышленности спектральный анализ позволяет
контролировать составы сплавов и примесей, вводимых в металлы для получения
материалов с заданными свойствами.
Достоинствами спектрального анализа являются высокая
чувствительность и быстрота получения результатов. С помощью спектрального
анализа можно обнаружить в пробе массой 6·10-7 г присутствие золота
при его массе всего 10-8 г. Определение марки стали методом
спектрального анализа может быть выполнено за несколько десятков секунд.
Спектральный анализ позволяет определить химический состав
небесных тел, удаленных от Земли на расстояния в миллиарды световых лет.
Химический состав атмосфер планет и звезд, холодного газа в межзвездном
пространстве определяется по спектрам поглощения.
Изучая спектры, ученые смогли определить не только химический
состав небесных тел, но и их температуру. По смещению спектральных линий можно
определять скорость движения небесного тела.
ГЛАВА 1. СПЕКТРАЛЬНЫЙ АНАЛИЗ И ЕГО ПРИМЕНЕНИЕ
Линейчатые спектры играют особо важную роль, потому что их структура
прямо связана со строением атома. Ведь эти спектры создаются атомами, не
испытывающими внешних воздействий. Поэтому, знакомясь с линейчатыми спектрами,
мы тем самым делаем первый шаг к изучению строения атомов. Наблюдая эти
спектры, ученые получили возможность "заглянуть" внутрь атома. Здесь
оптика вплотную соприкасается с атомной физикой.
Главное свойство линейчатых спектров состоит в том, что длины волн (или
частоты) линейчатого спектра какого-либо вещества зависят только от свойств
атомов этого вещества, но совершенно не зависят от способа возбуждения свечения
атомов. Атомы любого химического элемента дают спектр, не похожий на спектры
всех других элементов: они способны излучать строго-определенный набор длин
волн.
На этом основан спектральный анализ - метод определения химического
состава вещества по его спектру. Подобно отпечаткам пальцев у людей линейчатые
спектры имеют неповторимую индивидуальность. Неповторимость узоров на коже
пальца помогает часто найти преступника. Точно так же благодаря
индивидуальности спектров имеется возможность определить химический состав
тела. С помощью спектрального анализа можно обнаружить данный элемент в составе
сложного вещества, если даже его масса не превышает 10-10кг. Это
очень чувствительный метод.
Количественный анализ состава вещества по его спектру затруднен, так как
яркость спектральных линий зависит не только от массы вещества, но и от способа
возбуждения свечения. Так, при низких температурах многие спектральные линии
вообще не появляются. Однако при соблюдении стандартных условий возбуждения
свечения можно проводить и количественный спектральный анализ.
В настоящее время определены спектры всех атомов и составлены таблицы
спектров. С помощью спектрального анализа были открыты многие новые элементы:
рубидий, цезий и др. Элементам часто давали названия в соответствии с цветом
наиболее интенсивных линий спектра. Рубидий дает темно-красные, рубиновые
линии. Слово цезий означает «небесно-голубой». Это цвет основных линий спектра
цезия.
Именно с помощью спектрального анализа узнали химический состав Солнца и
звезд. Другие методы анализа здесь вообще невозможны. Оказалось, что звезды
состоят из тех же самых химических элементов, которые имеются и на Земле.
Любопытно, что гелий первоначально открыли на Солнце и лишь затем нашли в
атмосфере Земли. Название этого элемента напоминает об истории его открытия:
слово гелий означает в переводе «солнечный».
Благодаря сравнительной простоте и универсальности спектральный анализ
является основным методом контроля состава вещества в металлургии,
машиностроении, атомной индустрии. С помощью спектрального анализа определяют
химический состав руд и минералов. Состав сложных, главным образом
органических, смесей анализируется по их молекулярным спектрам.
Спектральный анализ можно производить не только по спектрам испускания,
но и по спектрам поглощения. Именно линии поглощения в спектре Солнца и звезд
позволяют исследовать химический состав этих небесных тел. Ярко светящаяся
поверхность Солнца - фотосфера - дает непрерывный спектр. Солнечная атмосфера
поглощает избирательно свет от фотосферы, что приводит к появлению линий
поглощения на фоне непрерывного спектра фотосферы.
Но и сама атмосфера Солнца излучает свет. Во время солнечных затмений,
когда солнечный диск закрыт Луной, происходит обращение линий спектра. На месте
линий поглощения в солнечном спектре вспыхивают линии излучения.
В астрофизике под спектральным анализом понимают не только определение
химического состава звезд, газовых облаков и т. д., но и нахождение по спектрам
многих других физических характеристик этих объектов: температуры, давления,
скорости движения, магнитной индукции.
Кроме астрофизики спектральный анализ широко применяют в криминалистике,
для расследования улик, найденных на месте преступления. Также спектральный
анализ в криминалистике хорошо помогает определять орудие убийства и вообще
раскрывать некоторые частности преступления.
Еще шире спектральный анализ используют в медицине. Здесь его применение
весьма велико. Его можно использовать для диагностирования, а также для того,
чтобы определять инородные вещества в организме человека.
Спектральный анализ прогрессирует не только науку, но и общественную
сферу человеческой деятельности.
Для спектрального анализа необходимы специальные спектральные приборы.
.1 Распределение энергии в спектре
Ни один из источников не дает монохроматического света, т. е. света
строго определенной длины волны. В этом нас убеждают опыты по разложению света
в спектр с помощью призмы, а также опыты по интерференции и дифракции.
Та энергия, которую несет с собой свет от источника, определенным образом
распределена по волнам всех длин, входящим в состав светового пучка. Можно
также сказать, что энергия распределена по частотам, так как между длиной волны
и частотой существует простая связь: hυ = c.
Плотность потока электромагнитного излучения, или интенсивность,
определяется энергией ΔW, приходящейся на все частоты. Для характеристики
распределения излучения по частотам нужно ввести новую величину: интенсивность,
приходящуюся на единичный интервал частот. Эту величину называют спектральной
плотностью интенсивности излучения.
Спектральную плотность потока излучения можно найти экспериментально. Для
этого надо с помощью призмы получить спектр излучения, например, электрической
дуги, и измерить плотность потока излучения, приходящегося на небольшие
спектральные интервалы шириной Aυ.
Полагаться на глаз при оценке распределения энергии нельзя. Глаз обладает
избирательной чувствительностью к свету: максимум его чувствительности лежит в
желто-зеленой области спектра. Лучше всего воспользоваться свойством черного
тела почти полностью поглощать свет всех длин волн. При этом энергия излучения
(т. е. света) вызывает нагревание тела. Поэтому достаточно измерить температуру
тела и по ней судить о количестве поглощенной в единицу времени энергии.
Обычный термометр имеет слишком малую чувствительность для того, чтобы
его можно было с успехом использовать в таких опытах. Нужны более
чувствительные приборы для измерения температуры. Можно взять электрический
термометр, в котором чувствительный элемент выполнен в виде тонкой
металлической пластины. Эту пластину надо покрыть тонким слоем сажи, почти
полностью поглощающей свет любой длины волны.
Чувствительную к нагреванию пластину прибора следует поместить в то или
иное место спектра. Всему видимому спектру длиной l от красных лучей до фиолетовых соответствует интервал частот
от υкр до υф. Ширине соответствует малый интервал Aυ.
По нагреванию черной
пластины прибора можно судить о плотности потока излучения, приходящегося на
интервал частот Aυ. Перемещая пластину вдоль спектра, мы обнаружим, что
большая часть энергии приходится на красную часть спектра, а не на
желто-зеленую, как кажется на глаз.
По результатам этих опытов можно построить кривую зависимости
спектральной плотности интенсивности излучения от частоты. Спектральная
плотность интенсивности излучения определяется по температуре пластины, а
частоту нетрудно найти, если используемый для разложения света прибор
проградуирован, т. е. если известно, какой частоте соответствует данный участок
спектра.
Откладывая по оси абсцисс значения частот, соответствующих серединам
интервалов Aυ, а по оси ординат спектральную плотность интенсивности
излучения, мы получим ряд точек, через которые можно провести плавную кривую.
Эта кривая дает наглядное представление о распределении энергии и видимой части
спектра электрической дуги.
ГЛАВА 2. АНАЛИЗ СТРУКТУРЫ СПЕКТРА АТОМА ГЕЛИЯ НА ОСНОВЕ
ПРИНЦИПА ПАУЛИ
Гелий - (лат . Helium), Не, химический элемент VIII
группы периодической системы, атомный номер 2, атомная масса 4,002602,
относится к благородным газам; без цвета и запаха, плотность 0,178 г/л.
Сжижается труднее всех известных газов (при -268,93 °С); единственное вещество,
которое не отвердевает при нормальном давлении, как бы глубоко его ни
охлаждали. Жидкий гелий - квантовая жидкость, обладающая сверхтекучестью ниже
2,17 К (-270,98 °С). В небольшом количестве гелий содержится в воздухе и земной
коре, где он постоянно образуется при распаде урана и других радиоактивных
элементов (частицы - это ядра атомов гелия). Значительно более распространен
гелий во Вселенной, напр., на Солнце, где он впервые был открыт (отсюда
название: от греч. helios - Солнце). Получают гелий из природных газов.
Применяют в криогенной технике, для создания инертных сред, в аэронавтике (для
заполнения стратостатов, воздушных шаров и др.). Разбор серий, возникающих при
переходах между триплетными термами, показывает, что только для главной и
второй побочной серий внешний вид линий оправдывает название «триплетный
спектр», линии остальных серий образуют более сложные группы из шести линий.
Триплетными являются только термы. На рис. 1 приведена схема уровней гелия и
указано возникновение отдельных спектральных линий. У гелия расщепление
триплетных уровней весьма незначительно. Наиболее глубоким состоянием атома
гелия является одиночное состояние Is Is'So. Нормально атом гелия находится в
этом состоянии. Следующим является состояние ls2s3Sb Ему соответствует уровень, лежащий
много выше. Чтобы перевести атом гелия из нормального состояния Is Is'So в состояние ls2s3Si,
нужно затратить работу в 19,77 эВ. Состояние lsls3Si отсутствует, хотя оно и возможно. Как мы увидим в
дальнейшем, это обстоятельство имеет весьма большое значение для теории
атомов.[4]
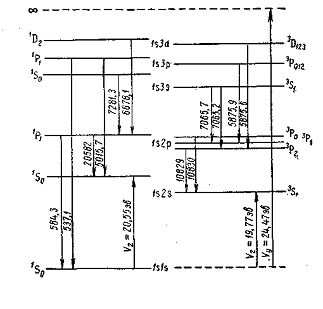
Парагелий Ортогелий
Рис. 1. Схема уровней гелия (He).
Анализируем общую структуру спектра атома гелия. Для этого произведём
некоторые расчёты.
Исходя из принципа Паули для системы фермионов получим антисимметричную
функцию, которую можно записать в виде определителя Слэтера (J. Slater, 1929):
|
Ψ1(ξ1) Ψ1(ξ2)…. Ψ1(ξn)
Ψ2(ξ1) Ψ2(ξ2)….. Ψ2(ξn)
….. ……. ……… Ψn(ξ1) Ψn(ξ2)…. Ψn(ξn)
|
ΨА(ξ1,ξ2,…..,ξn)=1/√n!·
Здесь нормировочный коэффициент включает N! - число перестановок среди
частиц N. Интерпретация функций ψн и ψа такова. Функция ψн ("неправильная") описывает состояние
системы, в котором 1-я частица находится в одночастичном состоянии ψ1, 2-я частица - в ψ2 состоянии и т. д. Правильная функция ψа отвечает состоянию, в котором N частиц заполняют N
одночастичных состояний, причем нельзя указать, какая частица в каком именно
состоянии находится, что согласуется с принципиальной неразличимостью
тождественных частиц (им невозможно приписать номера). Если среди одночастичных
функций ψн есть одинаковые, то ψа=0 в силу известного свойства определителя,
содержащего одинаковые строки. Это означает неосуществимость такого состояния и
приводит к принципу Паули (W. Pauli, 1924-25), сформулированном им
первоначально для электронов: в одном и том же одночастичном состоянии не может
находиться более одного фермиона.[1] Подчеркнем, что принцип Паули - следствие
антисимметричности волновой функции, и поэтому он справедлив только для
фермионов.
.1 Система двух электронов
Волновая функция двухэлектронной системы удовлетворяет условию
антисимметрии:
Ψ(ξ1,ξ2)=-
Ψ(ξ1,ξ2)
Определим сначала оператор спина системы:
Ŝ= Ŝ{1}+ Ŝ{2}, Ŝ{n}=h/2σ{n}
Здесь индексы (1) и (2) нумеруют спиновые подпространства отдельных
электронов в спиновом пространстве системы C4= C2 · C2. В каждом из подпространств C2 имеем базисные
векторы:
U{n}=(1,0){n} , d=(0,1){n}
которые являются собственными векторами операторов Ŝ (n)2и Ŝ2(n). В пространстве C4 в качестве базиса можно
выбрать 4 вектора
(1)u(2), d(1)d(2), u(1)d(2),
d(1)u(2).
Удобно выбрать новый базис, состоящий из собственных векторов операторов
квадрата полного спина и его проекции на ось z:
Ŝ2=h2/4(σ{1}+ σ{1})2= h2/2(3·I+ σ{1}· σ{2}), Ŝ2= h2/2(σ3{1}+ σ3{2}).
Замечание. Мы используем здесь сокращенную запись операторов
двухчастичной системы. Точная запись, например, оператора проекции спина
такова:
Ŝ2=h2/2(σ3·I+I· σ3)
Легко проверить, что указанный базис имеет вид:
Χ1,1=d{1} ·d{2} , Χ1,0=(1/√2)·(u{1} ·d{2}), Χ1,1= u{1} · u{2}
Χ0,0==(1/√2)·(u{1} ·d{2} - u{2} ·d{1}).
Смысл индексов векторов X Ŝξтаков:
Ŝ2 1χŜξ=ћ2 ·Ŝ·(Ŝ+1)χŜξ,
Прямая проверка проводится с помощью формул:
σ3u=u,
σ3 d=-d; σ1u=d,
σ1d=u, σ2u=id,
σ2d=-iu.
Например,
Ŝ2 χ1,1=ħ2/2·(3I+
σ1(1) σ1(2) +
σ2(1) σ2(2) +
σ3(1) σ3(2))·u(1) u(2)= ħ2/2/2·(
3u(1) u(2) + d(1) d(2) + id(1) id(2) + u(1) u(2)=
2ħ2 χ1,1;
Ŝ 2χ1,1= ħ2/2·(
σ3(1) +
σ3(2)) ·u(1) u(2)=
ħ2/2·(1+1) ·u(1) u(2)= ħ
χ1,1
Следовательно, s=1,ξ=1. С точки зрения теории групп мы
доказали, что
D½· D½ = D0+D1.
Это частный случай теоремы о разложении прямого (тензорного) произведения
неприводимых представлений Dj группы SO(3) в прямую сумму
неприводимых представлений:
Dj1·
Dj2=D|j1-j2|+ D|j1-j2|+1+…..+ Dj1+j2=J=|j1-j2|Σ j1+j2 DJ.
Базисные векторы в пространстве представления DJ размерности
2J+1 имеют вид:
Они являются собственными векторами операторов момента ĵ2и
ĵ2. Коэффициенты разложения C(j1j2JM|j1j2m1m2)
называются коэффициентами Клебша-Гордана. Мы нашли их явный вид для частного
случая j1=j2=1/2. Введя дискретные спиновые переменные
для электронов ξ1=±½ и ξ2 =±½,
запишем найденные
базисные векторы χsξ в виде функций двух переменных:
Χ1,-1(ξ1, ξ2)=d(ξ1)·d(ξ2)= Χ1,-1(ξ2, ξ1)
Χ1,0(ξ1, ξ2)=1/√2(u(ξ1)·d(ξ2)+ d(ξ1)·u(ξ2))= Χ1,0(ξ2, ξ1)
Χ1,1(ξ1, ξ2)=u(ξ1)·u(ξ2)= Χ1,1(ξ2, ξ1)
Χ0,0(ξ1, ξ2)=1/√2(u(ξ1)·d(ξ2)-d(ξ1)·u(ξ2))=- Χ0,0(ξ2, ξ1)
При этом три симметричные функции χ1ξ (ξ1, ξ2) образуют базис в пространстве D1, а
антисимметричная функция χ0,0 (ξ1, ξ2)- в D0.
2.2 Атом гелия
Применим полученные выше результаты для анализа общей структуры спектра
атома гелия 42He - системы, состоящей из положительно
заряженного ядра с Z=2 и двух электронов. В приближении бесконечно тяжелого
ядра гамильтониан атома гелия сводится к системе двух электронов,
взаимодействующих между собой и с неподвижным кулоновским центром с зарядом
-2e:
Ĥ=(-ħ/2me )·(▼12 +▼22)-2e2(1/r1+1/r2)+e2/ r12 ,
где r12=|r1-r2| - расстояние между
электронами. Подчеркнем, что спиновые взаимодействия в нерелятивистском
приближении не учитываются. Решение стационарного уравнения Шредингера
(Ĥ-E)·ψ(ξ1, ξ2)=0
можно искать в виде разложения по базисным спиновым функциям, найденным в
предыдущем разделе:
ψ(r1,ξ1, r2,ξ2)=sξ Σ φ sξ (r1,r2)·χ sξ (ξ1,ξ2)
спектр атом
гелий
Из антисимметричности полной функции ψ и свойств симметрии спиновых функций χ
следует, что
координатные функции обладают определенной симметрией:
φ1,ξ(r1,r2)=-
φ1,ξ(r2,r1),
φ0,0(r1,r2)=
φ0,0(r2,r1),
т. е. принадлежат подпространству HA(HS)
пространства L2(R6) при S=1 (S=0). Эти функции
удовлетворяют тому же уравнению Шредингера, что и ψ:
(Ĥ-E)·
φsξ(r1,r2)=0,
причем симметричная и антисимметричная функции принадлежат, очевидно,
разным собственным значениям. Таким образом, уровни энергии атома гелия зависят
от полного спина S даже в пренебрежении спиновыми взаимодействиями в
гамильтониане. Эта зависимость - следствие принципа тождественности и
обусловлена свойствами симметрии координатных волновых функций. Можно доказать,
что основному состоянию атома гелия отвечает симметричная функция φ1,0(r1, r2), и спин S=0. Переходы между
состояниями с различными спинами с испусканием или поглощением фотонов
оказываются маловероятными. В дипольном приближении вероятность перехода
обращается в нуль, так как равен нулю матричный элемент оператора дипольного
момента между состояниями различной симметрии:
(φA, (r1+ r2)
φS)=∫ d3x1∙ d3x2
∙φA*(r1,r2) ∙ (r1+ r2) ∙φS(r1,r2)=0
Поэтому спектр излучения атома гелия таков, как если бы существовали две
разновидности гелия - парагелий (S=0) и ортогелий (S=1). Уровни энергии
ортогелия имеют трехкратное вырождение по спиновому числу ξ-
проекции полного спина Sz
(2S+1=3). Замечание. Спиновые взаимодействия расщепляют триплетные уровни
ортогелия (в отличие от синглетных уровней парагелия) на три близких подуровня
(за исключением уровней, отвечающих нулевому полному орбитальному моменту
системы двух электронов: L=0).[3]
Особенность спектра He и аналогичных с ним атомов и ионов (два электрона
на верхней подоболочке) состоит в разделении всех состояний на синглетные (S
=0, парагелий) и триплетные (S =1, ортогелий). Поскольку разрешены переходы
только при Δ S =0, То между синглетными и триплетными состояниями нет дипольных
переходов.[2]
Нижнее состояние 2S3ортогелия (конфигурация 1s1 2s1)
называют метастабильным. Его энергия связи (4,77 эВ) мала по сравнению с
энергией связи нижнего состояния парагелия (24,59 эВ) (конфигурация 1s2 ).
Переход атома He из триплетного состояния в синглетное возможен
безизлучательно, например, при столкновении с другой частицей. При этом
наиболее вероятны переходы 2S1-2S3, обладающие
минимальным различием энергии. В принципе возможен переход 2S 3 -1S 1
с излучением (или поглощением) фотона. Однако вероятность его мала. Она
может быть описана квадрупольным приближением при расчете матричного элемента.
В атоме He наблюдается самая большая разность между основным и первым
возбужденным состояниями (19,82 эВ), которая объясняется сильной связью
электронов в первой замкнутой оболочке. По этой же причине He имеет самую
большую энергию ионизации атома (24,59 эВ).[3]
спектр атом
гелий
ЗАКЛЮЧЕНИЕ
Задача определения собственных значений энергии системы из двух
электронов, движущихся в центрально-симметричном поле атомного ядра не может
быть решена с помощью теории Бора, решается она на основе квантово-механической
теории.
Особенность спектра He и аналогичных с ним атомов и ионов (два электрона
на верхней подоболочке) состоит в разделении всех состояний на синглетные (S
=0, парагелий) и триплетные ( S =1, ортогелий). Поскольку разрешены переходы
только при Δ S =0, то между синглетными и триплетными состояниями нет дипольных
переходов.
СПИСОК ЛИТЕРАТУРЫ
1. Давыдов
А.С. Квантовая механика − М. Наука 1973г.
2. Д.В.
Сивухин Общий курс физики. Атомная и ядерная физика. Атомная физика.
Издательство «Наука», Москва - 1986г. ( Часть 1)
. Фриш
С.Э. Тиморева А.В. Курс общей физики −М. 1962г.
. Шпольский
Э.В. Атомная физика − М. 1974г. (том 2).