Создание оксигемометра
Введение
А.Л. Мясников еще в 1953 году
сказал: «Вся жизнь человека проходит в игре сосудов». Поэтому чрезвычайно важно
научиться контролировать деятельность сердечнососудистой системы человека.
В медицинской практике имеется целый
ряд ситуаций, когда требуется срочное и достаточно точное определение
содержания кислорода в крови. Для этих целей используют оксигемометры. Эти
приборы могут применяться в анестезиологии для контроля содержания
оксигемоглобина при подаче наркоза, в хирургии, реанимации, а также в
кардиологии при лечении легочной и сердечной недостаточности, в педиатрии и
гинекологии для предотвращения асфиксии у новорожденных, для коррегирования
нарушений периферического кровотока и т.д. Также при использовании оксиметрии
можно судить о качества работы анестезиолога.
Практика показывает, что для
снижения риска хирургического лечения под общим обезболиванием, работу
анестезиолога должны сопровождать приборы, гарантирующие точность выдачи команд
наркозному аппарату и респиратору и фиксирующие динамику показателей
газообмена. Список сведений, нужных анестезиологу конкретен: объемы вентиляции
легких (ДО, МОД), давление в дыхательных путях, концентрации кислорода, закиси
азота, летучих анестетиков на вдохе и выдохе, концентрация углекислого газа в
течение дыхательного цикла, в том числе и в конце выдоха, данные о насыщении
кислородом гемоглобина крови. Перечисленные сведения должны поступать в
мониторном режиме с применением предпочтительно неинвазивных методик.
Фотооксигемометрия - это
фотометрический метод непрерывного измерения степени насыщения крови
кислородом, основанный на спектральных особенностях гемоглобина.
Также необходимо отметить, что
весьма перспективным направлением является ‘отражательная’ оксиметрия.
Родоначальники этого метода R. Brinkman и W.G. Ziljstra (1949 год) показали,
что, регистрируя отраженное от кожи излучение различных длин волн, в видимом и
ближнем инфракрасном диапазонах, можно определять, и в течение длительного
времени отслеживать, насыщение крови кислородом, а также решать ряд
специфических задач, связанных с исследованием параметров локального кровотока.
Эта методика исключает необходимость
взятия у пациента проб крови и позволяет проводить измерения практически на
любом участке кожи. Последний факт дает существенные преимущества этой методики
перед традиционными измерениями ‘на просвет’, где установка оптического датчика
возможна только на участках тела относительно небольшой толщины (это либо
пальцы рук, либо ушная раковина).
Следующим шагом усовершенствования
приборов стало использование двухлучевого метода фотометрических исследований,
основанного на использовании двух каналов в первичном измерительном
преобразователе с совмещенными потоками излучения. Выходной сигнал устройства
первичной обработки будет характеризовать оптическое свойство исследуемой среды
и этот сигнал не зависит от исходного потока, а определяется отношением
коэффициентов (отражения, пропускания или рассеяния), которое отражает
оптическое свойство среды на участке между фотоприемниками.
Данная оптическая структура
преобразователя дает возможность сформировать по электрическим сигналам
фотоприемников на каждой длине волны два уравнения, позволяющих вычислить
искомое оптическое свойство без привязки к пульсовым колебаниям. Соответственно
это позволяет экономить мощности, так как отпадает необходимость в больших
статистических вычислениях.
Однако эффективность применения
фотометрических методов зависит не только от уровня технической оснащенности.
Большое значение здесь имеет разработка методического обеспечения, включающая
характеристику методик фотометрических исследований и специфических
особенностей их выполнения, способов подготовки объекта исследований к
эксперименту, методов интерпретации получаемых результатов.
При интерпретации результатов
исследований необходимо учитывать, что живой организм необычайно сложен.
Состояние биологического объекта характеризуется параметрами физиологических
процессов и медико-биологических показателей, число которых окончательно не
установлено. Эти параметры и показатели неоднозначно определяют состояние БО, а
большое число затрудняет (чаще исключает) возможность их одновременного
фиксирования. Поэтому, выполнив процедуру измерения, можно оценить лишь
вероятность того или иного состояния. Невозможно также однозначно предсказать
результат внешних управляющих воздействий. Неоднозначность реакции на одни и те
же внешние воздействия указывает на нестационарность самих объектов.
Фотометрические приборы и системы
предназначены для определения фотометрических параметров (ФП) и медико-биологических
показателей, связанных с ФП функциональными (часто нелинейными) зависимостями,
в итоге характеризующих жизнедеятельность организма. Поэтому при оценке
информативности измеряемых параметров приходится считаться с непрерывно
изменяющимся комплексом множества факторов, активно воздействующих на
биообъект.
Полный и точный учет самих факторов
и результатов их воздействия не представляется возможным. Особую роль при
исследовании высших биологических объектов играют психофизиологические факторы,
значительно искажающие результаты исследований. Затруднено также получение
точных математических зависимостей между регистрируемыми параметрами и
соответствующими им медико-биологическими показателями, так как еще
недостаточно изучены сами системы и не разработан адекватный математический
аппарат, пригодный для их описания.
В данной работе ставится задача
построения модели получения комплексного показателя двухволнового оксигемометра
m1=H(l1)/H(l2), в качестве которого используется отношение двух характеристических
параметров H(li)=U1 (li)/U2 (li), которые характеризуют оптические свойства среды в каждом i-м спектральном диапазоне, с
возможностью наложения и снятия шумов.
двухволновой оксигемометр оптический
шум
1. Физиологические и
медицинские аспекты объясняющие необходимость создания оксиметров
1.1 Кислород в крови
Одной из важнейших функций крови в
организме является дыхательная функция, которая заключается в обеспечении
кислородного обмена. Как известно, кислород находится в крови в двух состояниях,
в особой лабильной непрочной связи с гемоглобином, т.е. в виде оксигемоглобина,
и в свободном растворенном виде в плазме крови. Свободный и связанный кислород
находится между собой в состоянии равновесия. С изменением количества
свободного, соответственно меняется количество связанного кислорода, которого,
в принципе, в 80 -100 раз больше, чем свободного.
Свободный растворенный кислород, как
всякий растворенный в жидкости газ, развивает определенное напряжение.
Содержание растворенного кислорода прямо пропорционально его напряжению и
зависит от растворимости газа (т.е. коэффициента его абсорбции) и от
температуры. Коэффициент абсорбции кислорода a в плазме при температуре 37 равен 0,023 (для СО2 a = 0,510), а напряжение кислорода в артериальной крови равно 90
мм. рт. ст.
Зная коэффициент абсорбции и
напряжение газа, легко рассчитать объем физически растворенного газа. В 100 мл
плазмы при парциальном напряжении О2 в артериальной крови, равном 90
мм, должно содержаться в растворе 90*0,023*100/760 = 0,27 мл или 0,27 объемных
процента кислорода. В цельной артериальной крови количества кислорода в
растворе меньше - около 0,21 объемных процента. Чем выше напряжение свободного
кислорода, тем большее количество молекул гемоглобина превращается в
оксигемоглобин, тем выше степень насыщения крови кислородом.
Кислородные диссоциационные кривые
для растворов гемоглобина отличаются от кривых для цельной крови (Рис. 1)
S - образностью хода кривой диссоциации оксигемоглобина в цельной крови
имеет большое физиологическое значение, так как такой ход обеспечивает высокое,
близкое к полному, насыщение гемоглобина кислородом в легком и большую
свободную отдачу кислорода уже при незначительном падении его напряжения в
тканях.
Хилль дал математическое выражение
зависимости между напряжением кислорода и степенью насыщения молекул
гемоглобина
где: y - процент
насыщения гемоглобина кислородом,- напряжение кислорода в плазме крови,- число
молекул кислорода вступающее в соединение с одним молекулярным агрегатом
гемоглобина,
k
Константа равновесия реакции n = 2,2 для цельной крови человека.
Как известно, гемоглобин
представляет собой сложный белок с молекулярным весом 68000, состоящий из белка
- глобина и простатической группы - гема. Одна молекула гемоглобина содержит 4
молекулы гема. Кислород присоединяется к атому закисного железа гема (что
обозначается символом HbO2), но при этом не происходит потери электрона атомом
железа. Оно остается двухвалентным.
Таким образом, переход гемоглобина в
оксигемоглобин является не окислением, а своеобразным связыванием кислорода,
которое, в отличие от истинного окисления (оксидации), называют оксигенацией.
При настоящем окислении гемоглобина, например, превращения его в метгемоглобин,
происходит переход двухвалентного железа в трехвалентное.
При максимальном насыщении
гемоглобина кислородом, 4 молекулы кислорода приходятся на 1 молекулу белка.
Один грамм гемоглобина при полном насыщении всех его групп, связывающих
кислород, присоединяет 1,34-1,36 мл кислорода. Кровь человека в норме содержит
около 15 г. гемоглобина на 100 мл. Таким образом, полностью насыщенная
артериальная кровь содержит в химической связи около 20 мл кислорода в 100 мл
крови. Количество кислорода, находящегося в связи с гемоглобином в 100 мл
полностью артериализованной крови, является мерой кислородной емкости крови.
Кислородная емкость крови зависит от
количества активного гемоглобина в крови. Она уменьшается при анемиях, а также
при отравлении ядами, лишающими гемоглобин способности связывать кислород.
Обычная артериальная кровь насыщена
кислородом не полностью, а на 95-97%, т.е. имеется небольшое недонасыщение.
Поэтому за нормальное содержание кислорода в артериальной крови обычно
принимают не 20, а 19 объемных процентов. При вдыхании чистого кислорода в
течение 2 - 3 минут насыщение крови кислородом повышается, доходит практически
до 100%, т.е. до полного насыщения.
Таким образом, в отношение кислорода
в крови различают следующие понятие: напряжение кислорода (выражаемое в мм
ртутного столба), содержание кислорода - общего, связанного и свободного
(выражаемое обычно в объемных процентах), кислородную емкость крови (выражаемую
в объемных процентах), содержание гемоглобина (в граммах на 100 мл крови или в
единицах Сали), степень насыщения крови кислородом или степень артериализации (выражаемую
в процентах к полному насыщению кислородом).
Понятие насыщения крови кислородом
можно определить как выраженное в процентах отношение количества связанного
кислорода к кислородной емкость крови - (связанный кислород / кислородная
емкость) * 100%.
В частности, нередко смешивают
понятие степень или процент насыщения (т.е. процент оксигемоглобина по
отношению ко всему гемоглобину) с процентным содержанием гемоглобина в крови.
Цифра содержания гемоглобина в крови (например, 14 г. на 100 мл или 80%, по Сали)
говорит лишь о кислородной емкости крови, но не о степени насыщения ее
кислородом.
Проблема кислородного голодания
организма, проблема гипоксии, имеет огромное значение и в клинике и в
практической физиологии человека. Развитие совершенных методов изучения степени
насыщения крови кислородом является важным вкладом в изучение кислородного
голодания организма и в разработку способов борьбы с ним.
Формы кислородного голодания
многообразны. Понятие гипоксии шире, чем понятие гипоксемии. Под гипоксемией надо
понимать снижение содержания кислорода, или напряжения кислорода, или того и
другого вместе, в крови.
На конференции по проблеме
кислородной недостаточности проходившей в 1948 г. в Киеве, была принята
следующая классификация форм кислородного голодания, и которая почти совпадает
с современной классификации.
. Гипоксическая гипоксия: а) от
понижения парциального давления кислорода во вдыхаемом воздухе; б) в результате
затруднения проникновения кислорода в кровь через дыхательные пути; в)
вследствие расстройства дыхания.
. Гемическая гипоксия: а)
анемический тип, возникающий в результате уменьшения содержания гемоглобина в
крови; б) гипоксия при инактивации гемоглобина.
. Циркуляторная гипоксия: а)
застойная форма, б) ишемическая форма. Особой формой циркуляторной гипоксии
является гипоксия при некоторых врожденных пороках сердца, при которых венозная
кровь примешивается к артериальной.
. Тканевая (гистотоксическая)
гипоксия. Это форма гипоксии возникает в результате нарушения окислительных
ферментов ядами, как цианиды, наркотики и т.п.
Снижение насыщения кислородом
артериальной крови типично для видов гипоксической гипоксии и для многих форм
циркуляторной гипоксии, при которых нарушается тонкая координация между
кровообращением и вентиляцией альвеол, а также при таких пороках сердца, при
которых венозная кровь примешивается к артериальной. В изучении всех этих форм
кислородного голодания наличие метода бескровного и непрерывного измерения
насыщения крови кислородом приобретает огромное значение. Таким методом
является метод оксигемометрии. [1]
1.2 Спектральные
характеристики крови
Изучение спектральных характеристик
крови показало, что при длинах волн 600-700 нм (красная область) наблюдается
наибольшая разница между оптической плотностью почти полностью окисленной крови
и крови с пониженным содержанием оксигемоглобина. Причем окисление крови
снижает оптическую плотность крови, в то же время в диапазоне длин волн
810 - 960 нм (ближайшая инфракрасная область) оптическая плотность крови
повышается от насыщения ее кислородом (рис. 3). Поэтому спектральную область с
длиной волны около 600 нм обычно используют для первого диапазона (красный
канал), а более 810 нм - для второго диапазона (инфракрасный канал). На этой
основе и построена аппаратура, применяемая для фотооксигемометрии.
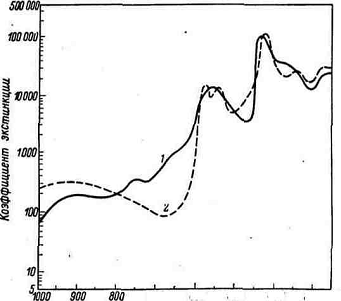
Рис. 1. Кривые поглощения света для
восстановленного гемоглобина (1) и оксигемоглобина (2)
По оси абсцисс - длина волны
излучения l: по оси ординат - коэффициент экстинкции Е.
В качестве количественной оценки
поглощения света используется значение экстинкции Е:
E = ln(I0 / I) = ecd, где
0 - интенсивность падающего света; - интенсивность
e - молярный коэффициент поглощения;- концентрация растворенного
вещества;- толщина слоя.
1.3 Запасы кислорода,
его транспорт - эффекты анестезии
Несмотря на огромную важность
кислорода, его запасы в организме человека невелики и недостаточны для
поддержания жизни более, чем несколько минут. При отсутствии дыхания запасы
кислорода ограничены его наличием в легких и крови. Количество кислорода в
крови зависит от объема циркулирующей крови и концентрации Hb. Количество в
легких - от величины функциональной остаточной емкости (ФОЕ) и альвеолярной
концентрации кислорода. ФОЕ это объем воздуха (около 3 литров у взрослых), который
остается в легких в конце выдоха, когда эластические силы легких находятся в
равновесии с диафрагмой и расслабленной грудной клеткой. При дыхании общий
запас кислорода (кислород крови и легких) невелик и так как в основном он
связан с гемоглобином только небольшая его часть высвобождается при отсутствии
недопустимого падения РО2 (когда насыщение - сатурация гемоглобина 50% и РО2
снижено до 26 мм Hg).
Во время анестезии гиповентиляция
может возникать вследствие обструкции дыхательных путей, действия ингаляционных
анестетиков, опиоидов и гипнотиков. Альвеолярное РО2 сбалансировано
поступлением кислорода при дыхании и его потреблением в метаболических
процессах организма. Гиповентиляция и сниженная вдыхаемая концентрация
кислорода приведет к падению альвеолярного РАО2.
Повышенное потребление кислорода при растущих метаболических потребностях,
например, при послеоперационном ознобе или злокачественной гипертермии также
приводит к снижению РaО2.
При падении РаО2 ниже 60
мм Hg хеморецепторы каротидного синуса и дуги аорты вызывают гипервентиляцию и
повышение сердечного выброса через стимуляцию симпатической нервной системы.
Эту нормальную протективную реакцию на гипоксию подавляют анестетики в интра- и
послеоперационном периоде.
После индукции в наркоз наблюдается
быстрое снижение ФОЕ, приводящее к закрытию мелких бронхиол, особенно в
зависимых частях легких, которые спадают и находятся в закрытом состоянии в
течение всего респираторного цикла. Некоторые альвеолы при этом не
вентилируются и возникает шунт.
Нарастают V/Q нарушения, что
приводит к снижению сатурации крови в легочных венах ниже, чем в капиллярах
вентилируемых альвеол. Ситуация усугубляется во время индукции в наркоз, когда
примесь неоксигенированной крови может составлять не 1%, а 10%. За исключением
пациентов с сохраненным спонтанным дыханием на фоне анестезии кетамином
подобная картина возникает вне зависимости от использованного анестетика и от
того, вводились ли пациенту миорелаксанты. Это следует рассматривать как
неизбежный побочный эффект анестезии. Ингаляционные анестетики подавляют
легочную гипоксическую вазоконстрикцию и кровоток по невентилируемым альвеолам
не снижается. Многие анестетики снижают сердечный выброс и соответственно
доставку кислорода. При анестезии на 15% падает уровень метаболизма и,
следовательно, потребность в кислороде. Искусственная вентиляция снижает
потребности в кислороде на 6% вследствие отсутствия работы дыхательной
мускулатуры. Анестетики не влияют на кислородотранспортные свойства
гемоглобина.
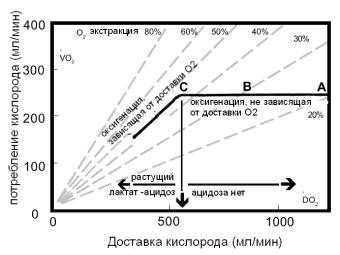
Рис. 2. Горизонтальной
линией показан лимит, до которого снижение доставки О2 не вызовет
снижение его потребления
Ниже указанного
критического значения доставки О2 потребление становится зависимым
от доставки и возникают признаки гипоксии. Положение точки С зависит от
значения максимально возможной экстракции кислорода.
1.4 Значение информации
о дыхании и газообмене во время общей анестезии
По материалам статьи
анестезиолога, профессора кафедры анестезиологии и реаниматолигии ММСИ, доктора
медицинских наук Левитэ Е.М.
Практика показывает, что
для снижения риска хирургического лечения под общим обезболиванием, работу
анестезиолога должны сопровождать приборы, гарантирующие точность выдачи команд
наркозному аппарату и респиратору и фиксирующие динамику показателей
газообмена. Список сведений, нужных анестезиологу конкретен: объемы вентиляции
легких (ДО, МОД), давление в дыхательных путях, концентрации кислорода, закиси
азота, летучих анестетиков на вдохе и выдохе, концентрация углекислого газа в
течение дыхательного цикла, в том числе и в конце выдоха, данные о насыщении
кислородом гемоглобина крови. Перечисленные сведения должны поступать в
мониторном режиме с применением предпочтительно неинвазивных методик. Дискретно
может быть использована информация о газах артериальной крови. Этот перечень мы
считаем достаточным для больных, оперируемых в клинике общей хирургии.
Необходимо отметить, что излишняя информация также нежелательна во время
наркоза, как и ее недостаток, поскольку невостребованные сведения
дискредитируют идею необходимости мониторирования и приводят к формальному
отношению как к информации, так и к ее интерпретации.
Пульсоксиметрия наряду с
капнометрией (дает сведения об изменении концентрации углекислого газа в
дыхательных путях) является важнейшей методикой контроля эффективности дыхания
и газообмена. Ее использование не только радикально снижает вероятность
дыхательных осложнений, но и оказывает существенное влияние на алгоритм работы
анестезиолога. В самом деле, без пульсоксиметра процедура интубации трахеи и
предварительная оксигенация больного не имеют критериев качества. Иначе говоря,
предварительная оксигенация проводится без контроля эффективности этой
процедуры, а длительность интубации трахеи при встречающихся трудностях
ограничивается наступившим цианозом, что соответствует падению HbO2 до 75% и
совершенно четко обнаруживается пульсоксиметрией. Здесь снижение HbO2 до 90-88%
является показателем к прекращению очередной попытки интубации и проведению
кислородной компенсации. Особенно важен пульсоксиметрический мониторинг у
больных с сердечной и легочной патологией, с малым резервом кислородного
обеспечения тканей. Отлично выполненная процедура интубации трахеи не должна
сопровождаться падением уровня HbO2 и появлением тахикардии. Именно поэтому мы
говорим об пульсоксиметрии и как о критерии качества работы анестезиолога.
Пульсоксиметр вносит изменения и в ведение посленаркозного периода. Практика
использования пульсоксиметра показала, что у большинства больных период перехода
от ИВЛ смесью с повышенным содержанием кислорода к самостоятельному дыханию
воздухом часто сопровождается гипоксемией. Чаще подобное осложнение наблюдается
после полостных операций. Насыщение гемоглобина кислородом может при этом
снизится до 80% и ниже. Такая гипоксемия еще не сопровождается цианозом и
поэтому без объективного контроля за уровнем насыщения кислородом гемоглобина
такие больные расценивались как благополучные и, если глубина вдоха больного
удовлетворяла анестезиолога, такой больной мог быть переведен из операционной в
палату клинического отделения, где, как правило, ингаляции кислорода не
получал. Таким образом, создавалась база для развития осложнений, связанных с
гипоксемией. Пульсоксиметр дает возможность исключить такую практику. Для этого
при адекватном дыхательном объеме нужно обеспечить больного ингаляцией
кислородом как во время транспортировки в палату, так и в палате. Длительность
такого обогащения кислородом воздуха должна составлять 20-40 минут и
контролироваться пульсоксиметром. На протяжении операции и обезболивания данные
пульсоксиметра позволяют поддерживать необходимый уровень HbO2 за счет выбора
FiO2 и объема минутной вентиляции легких. Но снижение этих параметров не
является главной причиной гипоксемии, чаще она развивается при нарушении
вентиляционно-перфузионных отношений в легких, например, при неправильном
стоянии интубационной трубки в дыхательных путях больного или при развитии
обтурационных процессов. К сожалению, пульсоксиметр имеет определенные
ограничения в использовании. Мы имеем ввиду периоды нарушения периферического
кровообращения, которые имеют место при недостаточном обезболивании, при
снижении температуры тела больного, при неадекватном кровозамещении (коррекции
гиповолемии) и при гипервентиляции. Все эти факторы приводят к вазоспазму,
уменьшению периферического кровотока и снижению амплитуды пульсовой волны,
регистрируемой пульсоксиметром. В этих условиях показания прибора о насыщении
гемоглобина кислородом могут быть неверными. Особенно обидно, что именно в такие
моменты крайне нужна точная информация о HbO2. Выход здесь пока только один:
восстановить периферическое кровообращение, устранив причину вазоспазма. Чаще
всего приходится заботиться об устранении гиповолемии и поддержании адекватного
обезболивания. Если терапия выбрана верно, амплитуда пульсовой волны
увеличится, а показания прибора станут более надежными. Таким образом,
пульсоксиметр дает сведения не только о HBO2, но и позволяет корригировать
нарушения периферического кровотока. [3]
2. История развития
фотооксигемометрии
2.1 С чего все
начиналось…
Одним из первых, кто
полностью оценил значение изучения газов крови, был И.М. Сеченов. Еще в 60-х
годах прошлого столетия. Позднее, в 1898 г., английский физиолог Холден
разработал принцип химического вытеснения кислорода из его соединения с
гемоглобином при помощи красной кровяной соли (железосинеродистого калия). Этот
принцип был с успехом использован Баркрофтом (1913) в его дифференциальном
манометре для изучения газового состава крови.
Американский биохимик
Ван Слайк (1917) соединил оба принципа - сеченовский принцип химического
вытеснения кислорода красной кровяной солью в своем приборе для анализа газа
крови. Более поздняя, манометрическая модель аппарата Ван Слайка и Нейлля
(1922) получила очень широкое распространение и стала обычным прибором в
экспериментальных лабораториях и клиниках.
Методика артериальной
пункции помогла установить основные факты в области физиологии и патофизиологии
крови, прежде всего ее дыхательной функции, получить первоначальные общие
сведения о величине артериального насыщения крови кислородом.
О рефлекторном изменении
дыхания во время артериальной пункции писали Книппинг и Рона (1928), Помплюн
(1928) и др. не только сам укол, но и связанные с ним условно-рефлекторные раздражения
(подготовка к уколу, протирание кожи спиртом, нащупывание артерии и т.п., даже
само ожидание пункции) существенно изменяют дыхание (Т.С. Истаманова 1950, А.Г.
Дембо 1957). А всякое изменение дыхания, задержка его или усиление, неизбежно
влияют на высоту артериального насыщения крови кислородом. Это были первые шаги
на пути к неинвазивным методам измерения.
Потом вопрос об изучении
прижизненного напряжения кислорода в тканях, сдвинулся с мертвой точки,
благодаря разработке методики кислородных микроэлектродов, позволяющих измерять
напряжения кислорода в очень ограниченных участках ткани.
2.2 Современные
неинвазивные гемодинамические исследования
·
сфигмография (графическая регистрация механических перемещений
ограниченного участка артерии, возникающих под воздействием пульсовой волны).
·
флебография (регистрация изменений объема югулярных вен, т.е.
кривых центрального венного пульса).
·
плетизмография (метод регистрации изменений объема органа или
части тела, связанных с изменениями его кровенаполнения).
·
объемная сфигмография (занимает промежуточное положение между
сфигмографией и плетизмографией).
·
артериальная осциллография (регистрация изменений объема
(кровенаполнения) тканей в условиях компрессии или декомпрессии).
·
окклюзионная плетизмография (сочетание плетизмографии с элементами
осциллографии).
·
ангиотензиотонография (объединяет принцип окклюзионной
плетизмографии, артериальной осциллографии и волюметрических способов
определения артериального и венозного давления).
·
тахоосциллография (определение параметров артериального давления).
·
фонотахоосциллография (модификация предыдущего метода).
·
фотоэлектроплетизмография (основана на просвечивании тканей
монохроматическим светом, попадающим на фотодатчик).
·
реовазография (основана на регистрации изменений электрического
тока высокой частоты во время его прохождения через ткани).
·
поликардиография (синхронная регистрация ряда кривых, связанных с
электрофизиологическими и механическими явлениями, которые происходят в
процессе сердечной деятельности).
·
и т.д. [4]
Оксигемометрией называется
фотометрический метод непрерывного измерения степени насыщения крови
кислородом, основанный на спектральных особенностях гемоглобина [1].
Впервые фотоэлектрический метод для
наблюдения за оксигенацией и восстановлением гемоглобина в живом организме был
применен в начале 30-х годов в Германии. В 1932 году Николаи применил
фотометрию для наблюдения за ходом и химической кинетикой восстановления
оксигемоглобина. Спустя два года Крамер описал фотоэлектрическое устройство, с
помощью которого он измерял содержание кислорода в растворах гемоглобина и в
гемолизированной крови.
Зависимость между пропусканием
монохроматического света и концентрацией поглощающего свет вещества выражается
законом Бугера - Ламберта - Бера, согласно которому числовое значение логарифма
поглощения света пропорционально концентрации с растворенного вещества.
Ф1(l) = Ф0(l) * exp [-k(l) * c * l], где
Ф0(l) - световой поток, падающий на
объект;
k(l) -
константа поглощения веществом излучения с длиной волны l (или удельный показатель
поглощения);
l - расстояние, пройденное излучением. [6]
В 1935 году Крамер показал, что
закон Бэра применим и к растворам гемоглобина, даже в случае высокой
концентрации последнего, близкой к уровню гемоглобина в крови. В ходе
исследований было установлено, что пропускание света цельной кровью также в
общем подчиняется закону Бэра, т.е. существует практически линейная зависимость
между содержанием оксигемоглобина в крови и значением логарифма поглощения
света при разном насыщении крови кислородом. Однако в приборной реализации
полное подчинение закону Бэра не могло иметь место, так как светофильтры
пропускают не монохроматический свет, а цельная кровь представляет собой не
истинный раствор. Реальные измерения показывают, что цельная кровь поглощает
свет в гораздо большей степени, чем прозрачные раствор гемоглобина или
гемолизированная кровь при одинаковой общей концентрации гемоглобина.
Непрозрачность цельной крови можно объяснить двумя причинами:
1
рассеиванием света эритроцитами;
2
большим поглощением света внутриклеточным гемоглобином вследствие
преломления и отражения света как между эритроцитами, так и внутри них;
Многократное преломление света ведет
к удлинению пути светового луча, и, следовательно, к увеличению величины общего
поглощения света вследствие повторного поглощения его одними и теми же
частицами гемоглобина. Поэтому абсорбция света цельной кровью почти в 5 раз
превышает поглощение гемолизированной кровью, что имеет первостепенное значение
для оксигемометрических измерений. [1]
2.3 Методические основы
разделения фотоплетизмографии и оксигемометрии
Светопроницаемость различных частей
тела определяется светопроницаемостью мягких тканей и светопроницаемостью
крови, заполняющей кровеносные сосуды. Если первая величина является
практически неизменной на протяжении небольших отрезков времени, то вторая
весьма изменчива. Она зависит как от общего количества крови, находящегося в
данный момент в сосудах исследуемой части тела, так и от ее физических свойств,
определяемых преимущественно концентрацией форменных элементов и химическим
составом. Регистрация общей светопроницаемости органа не дает возможности
определить относительное участие в ее изменениях того или иного фактора.
Некоторыми из них можно, однако, пренебречь, учитывая незначительность вносимых
ими ошибок (к таким факторам относятся, химический состав плазмы, химический
состав и количество лейкоцитов). Другие факторы, например содержание
эритроцитов, существенно влияют на удельную светопроницаемость крови, но при
определенных условиях остаются неизменными и могут быть учтены. Очень большое
влияние на удельную светопроницаемость крови оказывает гемоглобин. Общая его
концентрация в периферической крови на протяжении небольших отрезков времени
также является величиной достаточно постоянной, но соотношение восстановленного
и окисленного гемоглобина при тех же условиях подвержено большим колебаниям.
Окраска крови при отсутствии патологических дериватов (СОНв, метгемоглобин)
зависит исключительно от насыщенности ее кислородом.
Таким образом, причины изменений
проницаемости белого света через ткани органа можно свести к двум основным
переменным факторам: объему крови в данном участке тела и степени насыщенности
ее кислородом. Если исключить влияние первого из них, то регистрация
светопроницаемости может служить показателем степени насыщенности крови
кислородом. Этот принцип положен в основу создания различных моделей
оксигемометров (Крепс, 1959). В настоящее время на базе этого принципа созданы
пульсовые оксиметры.
Если же исключить влияние второго
фактора, то регистрация изменений светопроницаемости будет отражать изменения
кровенаполнения органа. Этот принцип положен в основу фотоплетизмографии.
Методически оказалось возможным
разграничить указанные два фактора благодаря особенностям спектральных свойств
окисленного и восстановленного гемоглобина. Если для просвечивания органа
использовать свет с длиной волны от 650 до 750 нм, то разница в светопоглощении
между окисленным и восстановленным гемоглобином оказывается очень большой и
малейшие изменения соотношения этих веществ в крови в значительной степени
сказываются на светопроницаемости органа. Если же для просвечивания применять
свет с длиной волны от 750 до 900 нм, то разница становится настолько
ничтожной, что увеличение или уменьшение насыщенности крови кислородом не
оказывает сколько-нибудь выраженного влияния на светопроницаемость органа.
Таким образом, при фотоплетизмографии необходимо использовать свет инфракрасной
части спектра, чтобы единственным переменным фактором, определяющим
светопроницаемость органа, являлась степень его кровенаполнения. [7]
2.4 Методика фотооксигемометрии
Предложенная в 70-х годах методика
фотооксигемометрии основана на использовании принципов фотоплетизмографии,
позволяющих выделить артериальную составляющую абсорбции света для определения
оксигенации артериальной крови. Измерение этой составляющей дает возможность
использовать спектрофотометрию для неинвазивного мониторинга сатурации
артериальной крови кислородом. Согласно закону Бугера - Ламберта - Бера:
интенсивность I0 падающего света при
распространении в среде уменьшается по закону
I = I0 exp (- ecl),
где l - толщина слоя, e - показатель поглощения (на единицу концентрации c вещества), величина абсорбции света
пропорциональна толщине слоя поглощающего вещества, т.е. при исследовании
кровотока определяется размером сосуда или объемом крови, проходящим через
исследуемый участок тканей. Сужение и расширение сосуда под действием
артериальной пульсации кровотока вызывают соответствующее изменение амплитуды
сигнала, получаемого с выхода фотоприемника. Фотоплетизмограмма (ФПГ)
получаемая после усиления и обработки сигнала фотоприемника (рис. 4)
характеризует состояние кровотока в месте расположения датчика.
Рис. 3. Фотоплетизмограмма
периферического пульса
В частности, когда давление крови
повышается или возникает вазодилятация сосудов, амплитуда ФПГ возрастает, при
снижении давления или вазоконстрикции сосудов амплитуда падает.
Для неинвазивного определения
оксигенации крови в «поле зрения «фотоплетизмографического датчика помещается
участок тканей, содержащий артериальные сосуды. В этом случае сигнал с выхода
датчика, пропорциональный абсорбции света, проходящего через ткани, включает
две составляющие: пульсирующую компоненту, обусловленную изменением объема
артериальной крови при каждом сердечном сокращении, и постоянную «базовую»
составляющую, определяемую оптическими свойствами кожи, венозной и капиллярной
крови и других тканей исследуемого участка (рис. 5).
Рис. 4. Распределение абсорбции
света в тканях
Путем анализа формы сигнала ФПГ
можно выделить его фрагменты, соответствующие моментам систолического выброса.
Именно в эти короткие промежутки времени на вершине систолы удается наиболее
точно определить сатурацию артериальной крови кислородом. Для определения
сатурации используется методика двухлучевой спектрофотометрии. Измерение
абсорбции света производится в моменты систолического выброса, то есть в
моменты максимума амплитуда сигнала датчика (рис. 5) для двух длин волн
излучения. [8] Для этой цели в датчике используются два источника излучения с
различными спектральными характеристиками.
Для получения наибольшей
чувствительности определения сатурации кислорода длины волн излучения
источников необходимо выбирать в участках спектра с наибольшей разницей в
поглощении света оксигемоглобином. Этому условию удовлетворяют красная и
ближняя инфракрасная области спектра излучения. При длине волны излучения 660
нм (красная область) гемоглобин поглощает примерно в 10 раз больше света, чем
оксигемоглобин, а на волне 940 нм (инфракрасная область) - поглощение
оксигемоглобина больше, чем гемоглобина.
Для повышения точности определения
сатурации методом фотооксигемометрии используется нормирование сигналов
поглощения света, для чего измеряется постоянная составляющая в моменты
диастолы А= и находится отношение амплитуды пульсирующей
составляющей А~ к величине А= (рис. 5):
Aнорм=A~/A=
Эта процедура выполняется для каждой
длины волны излучения. Нормированная величина поглощения не зависит от
интенсивности излучения светодиодов, а определяется только оптическими
свойствами живой ткани. Для получения значений сатурации рассчитывают отношение
нормированных величин поглощения света для двух выбранных длин волн:
R=(A~/A=)кр/(A~/A=)инф,
кр - относится к абсорбции в красной области спектра, инф
- в инфракрасной области спектра. [9]
2.5 Особенности
построения фотооксигемометров (помехи)
Фотоплетизмографический датчик
пульсоксиметра содержит два светоизлучающих диода, работающих один в «красной
«, другой - в «инфракрасной» области спектра, а также широкополосный
фотоприемник. Конструктивно датчик выполняется таким образом, что при его
расположении на поверхности тела человека на фотоприемник поступает свет
излучателей, ослабленный участком тканей, содержащим артериальный сосуд.
На практике используются два типа
датчиков, первый, анализирующий излучение светодиодов, проходящих через ткани,
и второй - излучение, отраженное от исследуемых тканей. Датчики проходящего
излучения укрепляются на кончике пальца руки или ноги, мочке уха пациентов, у
детей датчик часто закрепляется на стопе в области большого пальца или на
ладони.
Высокая крутизна спектральной
абсорбции Hb и HbO2 в области красного и
инфракрасного излучения требует малого разброса центральной длины волны
излучения светодиодов, используемых в датчике. Для красного диапазона длина
волны излучения должна находиться в пределах 660±10 нм.
В качестве светоприемников в
датчиках фотооксигемометров используются кремниевые фотодиоды, обладающие
высокой чувствительностью в области «красного» и «инфракрасного» диапазонов
излучения, быстродействием и низким уровнем шума.
Структурная схема фотооксигемометра
показана на рис. 6. Фотоприемник преобразует интенсивность ослабленного тканями
«красного» и «инфракрасного» излучения в электрический сигнал, поступающий в
тракт усиления. Излучатели датчика включаются поочередно, т.е. коммутируются с
частотой порядка 1000 Гц, что позволяет использовать для регистрации излучения один
коммутируемый фотоприемник.
Далее в усиленном тракте сигналы
«красного» и «инфракрасного» излучения разделяются на два канала с помощью
импульсов управления коммутатора, переключающих светодиоды. В каждом канале
производится измерение двух составляющих ФПГ сигнала, обусловленных постоянной
и пульсирующей составляющими абсорбции, необходимых для вычисления величины R и определения сатурации по
калибровочной кривой.
Особенностью усилительного тракта
является необходимость усиления сигналов фотоприемника в достаточно большом
динамическом диапазоне сигналов (более 60 дБ). Это требование обусловлено
значительным разбросом оптических характеристик кожи, подлежащих тканей,
выраженности пульсаций кровотока в месте расположения датчика у различных
пациентов.
Рис. 5. Структурная схема
фотооксигемометра
Реализация требуемого динамического
диапазона достигается использованием цифровой АРУ, охватывающей каскады
усиления ФПГ сигнала и источника тока, питающего светодиоды. Система АРУ
поддерживает выходные сигналы усиленного тракта на уровне номинального
напряжения входа АЦП вычислителя с целью уменьшения шума квантования.
Вычислитель фотооксигемометра содержит программное обеспечение, реализующее
первичную обработку ФПГ сигнала, алгоритмы выделения артериальных пульсаций по
«красному» и «инфракрасному» каналам, вычисления отношения R и определения величины SpO2 по занесенной в памяти вычислителя калибровочной зависимости.
Сложность алгоритмов, используемых при обработке сигналов в фотооксигемометрах,
объясняется высоким уровнем помех, сопровождающих регистрацию ФПГ, а также
требованиями высокой точности и быстродействия измерений. Требования стандартов
по фотооксигемометрии устанавливают основную погрешность измерения сатурации в
диапазоне (80…90)% равную ±2%, (50…79)%
- ±3%, для сатурации ниже 50%
погрешность обычно не нормируется.
Высокая точность фотооксигемометрии
для значений сатурации более 80% необходима для надежной дифференциации
развития состояния гипоксемии и гипоксии. В этом диапазоне кривая диссоциации
гемоглобина имеет малую крутизну (рис. 7) и небольшое уменьшение сатурации
означает сильное изменение напряжения кислорода в крови, что является
предвестником гипоксии.
Рис. 6 Кривые диссоциации
оксигемоглобина
Увеличение допустимой погрешности при
низких уровнях оксигенации (менее 80%) является клинически обоснованным, так
как в этом диапазоне наибольшей ценностью обладает не абсолютное значение
сатурации, а оценка динамики процесса, т.е. изменение сатурации в течение
определенного времени. Реальным требованием анестезиологической практики
является длительность процесса измерения и оценки сатурации, составляющая не
более 6…10 с. Основные помехи, влияющие на точность измерения сатурации, имеют
электрическую, оптическую и физиологическую природу.
Электрические помехи (наводки) возникают в усиленном тракте фотооксигемометра в
результате влияния внешних электромагнитных поле, создаваемых, в частности,
питающей сетью 50Гц, электрохирургическим инструментом, физиотерапевтической
аппаратурой. Подавление помех осуществляется путем частотной фильтрации
сигналов, так как полезная информация в ФПГ сигнале сосредоточена, в основном,
в диапазоне до 10Гц, т.е. значительно ниже частотного диапазона помех. Для этой
цели используют аналоговые фильтры нижних частот в усилительном тракте, а также
цифровая фильтрация.
Помехи оптического
происхождения возникают в случае
попадания света от посторонних источников излучения (от хирургических ламп,
ламп дневного света и т.п.) на фотоприемник датчика. Под действием данных помех
уровень сигнала, снимаемого с фотоприемника, может изменяться, искажая сигнал,
обусловленной абсорбцией излучения светодиодов в тканях. Для подавления
оптических помех используют метод трехфазной коммутации светодиодов датчика. В
первые две фазы коммутации поочередно включается либо «красный», либо
«инфракрасный» светодиод датчика, в третьей фазе оба светодиода включаются и
фотоприемник регистрирует фоновую засветку датчика, включающую оптические
помехи. Напряжение фоновой засветки запоминается и вычитается из сигналов
«красного» и «инфракрасного» каналов, получаемых в первые две фазы коммутации.
Таким образом, действие фоновой засветки датчика на полезный сигнал
ослабляется. Сильная фоновая засветка датчика может стать причиной
возникновения искажений в усиленном тракте, поэтому фотоприемник и первые
каскады усиления должны обладать линейностью характеристики в большом
динамическом диапазоне входных сигналов. Ослабление фоновых засветок
достигается также конструктивным построением датчика с использованием
экранирования.
Помехи физиологической природы оказывают наиболее сильное влияние на показания пульсоксиметров.
К таким помехам можно отнести влияние двигательных артефактов, в том числе и
дыхания, непостоянство формы пульсовой волны и снижение её амплитуды у
различных пациентов. Движение конечности с закрепленным на ней датчиком
вызывает перераспределение объема крови, находящегося в поле зрения датчика,
что дает на выходе фотоприемника помеховый сигнал. Ослабление этих помех
особенно важно при выделении максимумов артериальных пульсаций
фотоплетизмографических сигналов обоих каналов. Спектральный подход
основывается на том, что частотные компоненты артериальных пульсаций лежат в
диапазоне 0,5…4 Гц, а двигательные артефакты находятся в более высокочастотной
области (около 7Гц) и носят случайный характер. Для вычисления отношения R используются первые гармоники
разложения Фурье сигналов красного и инфракрасного каналов, что дает более
точную оценку аргумента калибровочной зависимости. Влияние двигательного артефакта
на регистрацию ФПГ сигнал может быть оценено с помощью встроенной экспертной
системы, работающей на основе анализа соотношения амплитуд первой и второй
гармоник Фурье сигнала артериальных пульсаций. Снижение этого
соотношения говорит о росте влияния помех и снижения достоверности показаний
прибора.
Точность измерения сатурации в фотооксигемометрах определяется
калибровочной зависимостью, устанавливаемой при градуировке приборов. «Золотым»
стандартом градуировки считается проведение одновременных измерений сатурации
исследуемым фотооксигемометром и эталонным прибором у добровольцев, вдыхающих
газовую смесь заданного состава.
В качестве эталонов используются кюветные многоволновые оксиметры,
анализирующие пробу артериальной крови. Трудность получения клинических данных
для низких значений сатурации (менее 80%) в экспериментах in-vivo заставляет
экстраполировать калибровочную зависимость в этой области и снижать требования
к точности измерений. Достаточно сложная система градуировки пульсоксиметров,
описанная в [10], полностью имитирует процесс газообмена в организме человека.
Система содержит мембранный оксигенатор (рис. 8), источник гидравлических
пульсаций, имитирующий артериальный кровоток и модель пальца, на который
надевается датчик испытуемого пульсоксиметра. Система имеет пробоотборник крови
для анализа с помощью кюветного оксиметра.
Рис. 7. Система in-vivo градуировки
фотооксигемометров
Данная система позволяет проводить точную градуировку прибора при
значениях сатурации менее 50%. При производстве фотооксигемометров для
обеспечения точности измерения сатурации используются оптико-электронные
имитаторы, имеющие заданные метрологические характеристики.
Имитатор имеет оптическую головку,
помещаемую в поле зрения датчика фотооксигемометра вместо участка тела
пациента. Головка имитатора содержит фотоприемник, располагаемый напротив
светодиодов датчика. С помощью оптической головки происходит переизлучение
световых потоков от светодиодов датчика к его фотоприемнику, причем передача
сигналов фотоприемника головки к светодиодам имитирует абсорбцию света в
тканях, включая формирование артериальной пульсации. Способы отображения
информации, используемые в фотооксигемометрах, дают наглядное представлениях об
измеряемых физиологических показателях. Вычисленные значения сатурации крови
кислородом и ЧСС отображаются в виде соответствующих цифровых значений на
дисплее прибора.
В большинстве случаев
предполагается, что фракция дисгемоглобинов (MetHb и COHb) не превышают 2% и её
долей в определении сатурации можно пренебречь. Однако при колебаниях этой
фракции показания пульсоксиметра могут отличаться от величин по которым
производилась градуировка прибора. Поэтому для более корректного обозначения
показаний фотооксигемометров используется термин SpO2, применяемый большинством изготовителей аппаратуры, который
подчеркивает возможность ошибок определения сатурации при возрастании фракций
дисгемоглобинов. Ошибки могут возникать при низкой тканевой перфузии или
выраженной вазоконструкции вследствие слабости пульсации в месте расположения
датчика прибора. При выраженной гемоделюции, анемии и кровопотере высокие
показатели SpO2 не гарантируют
безопасный уровень доставки кислорода к тканям, т.к. общая кислородная емкость
крови при этом может оказаться недостаточной.
Фотоплетизмограмма может быть
представлена в виде кривой на графическом дисплее или в виде пульсирующего
«столбика», следящего за изменением объема артериальной крови в поле зрения
датчика. Для оценки абсолютного значения артериальных пульсаций вводится
специальный масштабный индикатор амплитуды пульсаций. [11, 12]
2.6 Принцип работы
фотооксигемометра
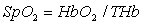 , (1)
, (1)
где HbO2 -
концентрация оксигемоглобина, THb
- общее содержание гемоглобина.
Составляющая THb включает в себя HbR, HbO2, а также такие
компоненты, как COHb - карбоксигемоглобин, MetHb - метгемоглобин, и
другие составляющие, которые относятся к дисфункциональным фракциям гемоглобина
и не участвуют в процессе переноса кислорода. Насыщение артериальной крови
кислородом, определяемое (1), называется фракционным насыщением. Содержание
дисфункциональных фракций составляет в крови примерно 1-3%, но может доходить
до 20% при различных патологиях. Учитывая, что применяемый двухспектральный
метод не различает по спектральным характеристикам HbO2, COHb и MetHb, введено понятие функционального насыщения, определяемого как:
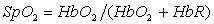 .
.
Различие при этом состоит в
примененном методе градуировки прибора: по функциональному или фракционному
насыщению.
Важным фактором, влияющим на
насыщение гемоглобина кислородом, то есть определяющим сродство Hb к O2, является напряжение
кислорода в крови. На смещение кривой диссоциации влияют pH, температура и другие
параметры, изменение которых может привести к дополнительным погрешностям и,
следовательно, величины этих параметров необходимо учитывать при градуировке оксиметров.
Основой метода оксиметрии является
закон Бугера-Ламберта-Бера и спектры поглощения различных компонент
гемоглобина. Этот закон определяет количественную оценку поглощения света.
Такой оценкой является оптическая плотность
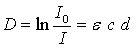 ,
,
где 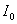 -
интенсивность падающего света;
-
интенсивность падающего света; 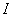 - интенсивность
прошедшего света;
- интенсивность
прошедшего света; 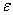 -
коэффициент экстинкции (поглощения);
-
коэффициент экстинкции (поглощения); 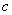 - концентрация
растворенного вещества;
- концентрация
растворенного вещества; 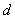 -
толщина слоя.
-
толщина слоя.
Следует отметить, что
этот закон строго справедлив только для монохроматического света и растворов.
Поэтому в реальном объекте неточное выполнение закона приводит к дополнительным
погрешностям. Уменьшить суммарную погрешность можно за счет специальной
градуировки прибора.
Суммарное поглощение
смеси веществ определяется как сумма поглощений компонент. Это позволило
применить следующую модель объекта исследования при измерении насыщения крови
методом пульсовой оксиметрии. Суммарное поглощение света каждой длины волны
определяется компонентами HbR,
HbO2
и тканями. Используя пульсовую составляющую крови, можно записать дополнительно
два уравнения для различных моментов времени. При этом система уравнений для
пульсовой оксиметрии будет выглядеть следующим образом:
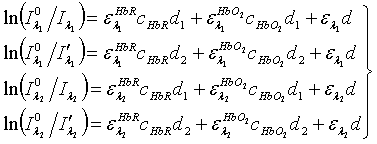 , (2)
, (2)
где 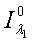 ,
,
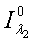 -
интенсивность падающего красного и инфракрасного света;
-
интенсивность падающего красного и инфракрасного света; 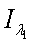 ,
,
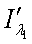 ,
,
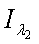 ,
,
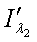 -
интенсивность прошедшего света для красного (λ1)
и инфракрасного (λ2) света для двух различных моментов времени, например, в точках
минимального и максимального значения плетизмограммы соответственно;
-
интенсивность прошедшего света для красного (λ1)
и инфракрасного (λ2) света для двух различных моментов времени, например, в точках
минимального и максимального значения плетизмограммы соответственно; 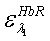 ,
,
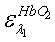 ,
,
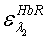 ,
,
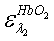 -
коэффициенты экстинкции для HbR,
HbO2 и
для двух длин волн λ1=660 нм и λ2=800 нм;
-
коэффициенты экстинкции для HbR,
HbO2 и
для двух длин волн λ1=660 нм и λ2=800 нм; 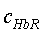 ,
,
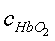 -
концентрация соответственно HbR,
HbO2;
d1,
d2,
d - толщина слоя HbR и HbO2
при максимуме и минимуме пульсовой и для всех остальных тканей (без учета
крови).
-
концентрация соответственно HbR,
HbO2;
d1,
d2,
d - толщина слоя HbR и HbO2
при максимуме и минимуме пульсовой и для всех остальных тканей (без учета
крови).
Необходимо решить систему
уравнений (2) для нахождения зависимости
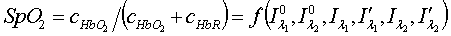 .
.
Система уравнений (2),
как показано в [], однозначно разрешима относительно SpO2
с учетом того, что величины Δ=d1-d2
для красного и инфракрасного света одинаковы:
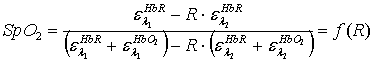 , (3)
, (3)
где 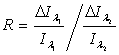 ,
,
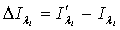 ,
i=1,2.
,
i=1,2.
Выражение (3) и есть
главная функциональная зависимость, которая лежит в основе работы всех
пульсовых оксиметров. Пульсовой оксиметр измеряет с возможно большей точностью
величину R, затем ставит в соответствие измеренному значению R величину SpO2
по градуировочной характеристике, заложенной в память прибора в виде функции
или таблицы. Точность измерения пульсовым оксиметром SpO2
и частоты пульса зависит от качества разработки и изготовления усилительного
тракта, включающего первичный измерительный преобразователь, от алгоритма
обработки сигнала и от градуировочной характеристики.
Пульсовая оксигемометрия
имеет ряд недостатков, главным из которых является невозможность определения
абсолютных значений оксигенации, особенно при использовании окклюзионных
методов.
Решить эти сложности
можно с помощью двухлучевого метода фотометрических исследований, основанного
на использовании двух каналов в первичном измерительном преобразователе с
совмещенными потоками излучения (пульсовой оксиметр относится к однолучевым
фотометрическим приборам).
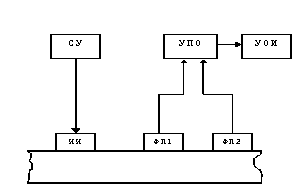
Рис. 8. Структурная
схема двухлучевого ОЭИП с совмещенными потоками
Лучистый поток от
источника излучения ИИ падает на объект исследования и после взаимодействия с
ним одна часть отраженного потока поступает на первый фотоприемник ФП1, а
другая часть потока попадает на второй фотоприемник ФП2, дальний от источника
излучения, причем поток, падающий на второй фотоприемник, будет ослаблен
больше, чем поток, падающий на первый фотоприемник, поскольку второй
фотоприемник расположен на большем расстоянии от источника излучения, чем
первый.
Для двухлучевого
оксиметра можно составить четыре уравнения, подобные уравнениям пульсового
оксиметра:
 , (4)
, (4)
где 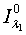 ,
,
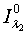 -
интенсивность падающего красного и инфракрасного света;
-
интенсивность падающего красного и инфракрасного света; 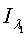 ,
,
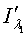 ,
,
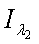 ,
,
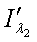 -
интенсивность прошедшего света для красного (λ1)
и инфракрасного (λ2) спектральных диапазонов, который поступает на два фотоприемника
- компенсационного 1 и аналитического 2 каналов; l1,
l2
- расстояние между излучателем и фотоприемниками 1 и 2; остальные обозначения
те же, что и в системе уравнений (3) для пульсового оксиметра.
-
интенсивность прошедшего света для красного (λ1)
и инфракрасного (λ2) спектральных диапазонов, который поступает на два фотоприемника
- компенсационного 1 и аналитического 2 каналов; l1,
l2
- расстояние между излучателем и фотоприемниками 1 и 2; остальные обозначения
те же, что и в системе уравнений (3) для пульсового оксиметра.
Полученная система
уравнений (4) позволяет без привязки к пульсовым колебаниям уровня
кровенаполнения сосудов получить величину SaO2
по традиционному соотношению [13]:
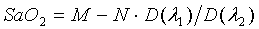 ,
,
где 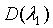 ,
,
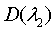 -
оптические плотности на двух длинах волн, а M,
N - постоянные коэффициенты для выбранных длин волн.
-
оптические плотности на двух длинах волн, а M,
N - постоянные коэффициенты для выбранных длин волн.
Выходной сигнал устройства первичной
обработки будет характеризовать оптическое свойство исследуемой среды и этот
сигнал не зависит от исходного потока, а определяется отношением коэффициентов
экстинкции, которое отражает оптическое свойство среды на участке между
фотоприемниками. Такая оптическая структура преобразователя дает возможность
сформировать по электрическим сигналам фотоприемников на каждой длине волны два
уравнения, позволяющих вычислить искомое оптическое свойство без привязки к
пульсовым колебаниям, хотя пульсовые колебания могут быть получены по анализу
частотных характеристик сигналов. Постоянство расстояния между фотоприемниками
служит основой метрологического обеспечения измерений оптических свойств и,
следовательно, степени насыщения гемоглобина крови кислородом.
«Двухцветные» оксигемометры
обеспечивают проведение одного измерения в одной из изобестических точек
гемоглобина (чаще всего около 805 нм), в которой поглощение (отражение)
окисленной и восстановленной форм одинаково, а другого - в точке максимальной
разницы между поглощением (отражением) гемоглобина и оксигемоглобина. Благодаря
этому точность определения степени оксигенации гемоглобина с помощью «двухцветных»
приборов выше, чем в случае «одноцветных». При регистрации прошедшего через
кровь излучения используется соотношение
Впр = а - в τ λ, 1,2
где а и в-постоянные
коэффициенты; τ λ,1,2 =Фпр(λ2)/Фпр(λ1) - относительный
коэффициент пропускания; Фпр(λ1), Фпр(λ2)-
интенсивности пропущенных кровью
потоков на длинах волн λ1 и λ2. Для рассеянного кровью излучения степень насыщения определяется с
помощью другого соотношения:
Вр = а’ - в’ρ τ λ,1,2,
где ρ λ,1,2
= Фот(λ2)/Фот(λ1) - относительный
коэффициент отражения; Фот(λ2), Фот(λ1) - интенсивности
отражённых кровью потоков на длинах волн λ1 и λ2
Методы исследования оптических
свойств биологических тканей разделяют по виду регистрируемого после
взаимодействия лучистого потока (в проходящем, отраженном потоках), по числу
спектральных диапазонов (одноволновые, двухволновые, колориметрические,
спектральные), по способу канализации лучистой энергии от источника к
исследуемому участку ткани и от него к ФЭП, по числу потоков энергии
(однолучевые и двухлучевые). Выбор схемы измерений определяется исследуемым
оптическим свойством ткани и расположением исследуемого участка. [9]
3. Задача моделирования
оксигемометрического комплекса
3.1 Что такое LabVIEW
В моей выпускной квалификационной
работе поставлена задача моделирования фотооксигемометрического комплекса,
которую было решено реализовать с использованием программного пакета
графического программирования LabVIEW (Laboratory Virtual Instrument
Engineering Workbench). Выбор был сделан в пользу данного программного
продукта, в связи с тем, что при своей подобности средам языков C и BASIC, он
выгодно отличается наглядностью создаваемых программ, а также наличием обширной
библиотеки функций и процедур, универсальных для большинства прикладных задач
управления средствами измерения, сбора и обработки данных. Кроме того, LabVIEW
включает традиционные средства разработки и отладки программ, облегчающие их
разработку: введение точки останова, «оживление» выполнения для просмотра
движения данных, пошаговый режим отладки. А также используются наиболее
перспективные технологии автоматизации проектирования и сопровождения
программных систем: объектно-ориентированный подход и потоковое
программирование, принципы модульности и иерархии, использование языка
визуального (графического) программирования, что позволяет создавать программы
в виде наглядных диаграмм.
В основе создания языка LabVIEW
положена концепция виртуального инструмента, которая является перспективным
направлением в области автоматизации научного, промышленного эксперимента и
управления технологическими процессами.
Виртуальный инструмент (ВИ) - это
набор аппаратных и программных средств, добавленных к обычному компьютеру таким
образом, что пользователь получает возможность взаимодействовать с компьютером
как со специально для него разработанным обычным электронным прибором.
ВИ имеет три основные особенности:
1)
ВИ имеет интерактивный интерфейс пользователя, названный передняя
панель, поскольку он имитирует панель физического инструмента. Передняя панель
может содержать графические изображения кнопок, клавиш, графических устройств,
регуляторов и других органов управления и индикации. Возможен ввод данных мышью
и с помощью клавиатуры и наблюдение за результатом на экране компьютера.
2)
ВИ получает инструкции из блок-диаграммы, которая создается на
языке графического программирования. Блок-диаграмма представляет графическое
решение задачи программирования, являясь при этом исходным «текстом» для ВИ.
3)
ВИ имеет иерархическую и модульную структуру. Это позволяет
использовать любой ВИ как программу верхнего уровня, или как подпрограмму
внутри других программ или подпрограмм. ВИ, функционирующий внутри другого ВИ,
называется субВИ.
3.2 Описание полученной
модели
Нами на данном этапе разработан
программный продукт, с помощью которого путем нахождения отношения сигналов,
которыми являются смоделированные пульсовые кривые, это отношение моделирует
вышеописанные фотометрические параметры H(l), характеризующие оптическое свойство исследуемой среды, а в
результате второго деления находится комплексный показатель m1=H(l1)/H(l2).
Дополнительно в модели произведен
учет помехи, которой в реальности соответствует так называемая - фоновая
засветка. Помеха сформирована в виде синусоиды с меняющейся от периода к
периоду амплитудой, ее изменения происходят случайным образом в задаваемом
диапазоне, который можно варьировать на усмотрение пользователя. Таким образом,
можно набирать статистику, с помощью которой возможно выяснить пределы
измерения с определенной погрешностью… установить сигнал при помехе превышающей
допустимый уровень и многое другое…
Результатом работы программы на
данный момент является формирование таблицы данных показателя m и вывод семейства графиков:
1)
графики 4 генерируемы сигналов
(signal1, signal2, signal3, signal4);
2)
график моделируемой прибавляемой помехи (noise+);
3)
график моделируемой вычитаемой помехи (noise -);
4)
график сигнал + помеха (signal + noise);
5)
график сигнал + помеха - помеха (signal + noise - noise)
6)
график комплексного показателя m;
В будущем возможна организация
подсоединения датчиков непосредственно к компьютеру, т.е. вместо моделированных
сигналов можно будет обрабатывать реальные, тем самым можно будет выйти на
решение проблем настройки, а возможно и калибровки прибора.
Заключение
При интерпретации результатов
исследований необходимо учитывать, что живой организм необычайно сложен.
Состояние биологического объекта характеризуется параметрами физиологических
процессов и медико-биологических показателей, число которых окончательно не
установлено. Эти параметры и показатели неоднозначно определяют состояние, а
большое число затрудняет (чаще исключает) возможность их одновременного
фиксирования. Поэтому, выполнив процедуру измерения, можно оценить лишь
вероятность того или иного состояния. Невозможно также однозначно предсказать
результат внешних управляющих воздействий. Неоднозначность реакции на одни и те
же внешние воздействия указывает на нестационарность самих объектов.
Интерпретация получаемых результатов затрудняется еще и потому, что разного
рода патологические явления, возникающие в тех или иных системах организма
(например, в органах и тканях человека), могут рефлекторно влиять на другие
процессы, в которых патология отсутствует, и искажать результат измерения.
Фотометрические приборы и системы
предназначены для определения фотометрических параметров (ФП) и
медико-биологических показателей, связанных с ФП функциональными (часто
нелинейными) зависимостями, в итоге характеризующих жизнедеятельность
организма. Поэтому при оценке информативности измеряемых параметров приходится
считаться с непрерывно изменяющимся комплексом множества факторов, активно
воздействующих на биообъект.
Полный и точный учет самих факторов
и результатов их воздействия не представляется возможным. Особую роль при
исследовании высших биологических объектов играют психофизиологические факторы,
значительно искажающие результаты исследований. Затруднено также получение
точных математических зависимостей между регистрируемыми параметрами и
соответствующими им медико-биологическими показателями, так как еще
недостаточно изучены сами системы и не разработан адекватный математический
аппарат, пригодный для их описания.
Индивидуальный разброс
фотометрических параметров, их внутригрупповая изменчивость приводят к
необходимости фиксировать и оговаривать группу исследуемых объектов, учет
генетических эффектов - вводить возрастные группы для исследований одних и тех
же проявлений, а наличие большого числа механизмов регуляции с разными
постоянными времени регулирования - контролировать продолжительность
экспериментов. Для получения достоверных результатов требуется собирать и
обрабатывать огромный статистический материал, получение которого связано со
значительными затратами времени и труда на исследования и обработку
результатов.
Фотометрические исследования
биологических объектов целесообразно проводить в условиях их реального
существования, без ограничения подвижности. Закон поведения организма в
большинстве случаев заранее неизвестен;
Сложность проведения фотометрических
исследований связана и с тем, что измерительная информация в общем случае
заключена в различных потоках излучения (отраженном, рассеянном, поглощенном,
люминесцентном и т.д.) разных спектральных диапазонов; диапазон изменения
интенсивности регистрируемых потоков, как и диапазон возможных значений
фотометрических параметров, очень широк при относительно высоком уровне шумов
как за счет работы других подсистем организма (внутренние шумы), так и за счет
наводимых из внешней среды (внешние шумы); частотный спектр выходных сигналов
обычно достаточно широк: от области инфранизких частот до сотен герц и более.
Роль аппаратных средств при
выполнении клинико-диагностических исследований трудно переоценить. От
клинико-физиологических и клинико-лабораторных анализов в большой мере зависят
правильность постановки диагноза заболевания и успех лечебных воздействий,
своевременное проведение профилактических мероприятий и сокращение времени
реабилитации, качество курортных и бальнеологических процедур, своевременность
санитарно-эпидемиологического контроля и т.д. Среди разнообразных физических и
физико-химических методов исследования, широко используемых в клинической
практике, фотометрические методы занимают одно из ведущих мест.
За последние несколько лет во всех
высокоразвитых странах были приняты «Стандарты интраоперационного мониторинга»,
обязательные для выполнения при любом виде анестезиологического пособия.
Основным прибором «Стандартов» стал пульсовой оксиметр (ПО) - прибор для
неинвазивного непрерывного определения насыщения гемоглобина артериальной крови
кислородом (SaO2) и частоты сердечных
сокращений (ЧСС) с возможностью визуальной оценки величины и формы
периферической плетизмограммы. Популярность ПО в основном связана с тем, что
они просты и удобны в обращении, портативны, безопасны для больного и врача, не
требуют предварительной калибровки, быстро после подключения начинают измерение
и информация, получаемая с их помощью, достаточна для быстрой оценки изменений
вентиляции и гемодинамики. Наличие у большинства ПО звуковой и световой
сигнализации, срабатывающей при выходе значений за установленные вручную или
автоматически пределы, повышает безопасность пациента, а возможность
запоминания информации позволяет оценить динамику сатурации частоты пульса и
амплитуды плетизмограммы.
Список литературы
1.
Крепс Е.М. Оксигемометрия Л. 1959 г. С. 222
2.
(http://rhl.mega.ru/doc001.htm) (Левитэ Е.М. (анестезиолога
профессор кафедры анестезиологии и реаниматолигии ММСИ, доктор медицинских
наук) ГКБ №33 (гл. врач к.м.н. Колобов С.В.), Москва)
4.
Инструментальные методы исследования сердечно - сосудистой системы
(справочник). Под ред. Т.С.
Виноградовой. - М.: Медицина, 1986. - 416 с.
5.
Чигирев Б.И. Методы медико-биологических исследований, Ленинград, РИО ЛЭТИ,
1982.
6.
Мошкевич Виктор Семенович. Фотоплетизмография. (Аппаратура и
методы исследования). М.
Медицина, 1970. - 208 с.
7.
Орлов В.В. Плетизмография. (Методы и применение в
экспериментальных и клинических исследованиях). М-Л., АН СССР, 1961, 254 с.
(Ин-т физиологии им. И.П. Павлова).
8.
Е.П. Попечителев, Б.И. Чигирев. Двухлучевые фотометрические
системы для клинико-физиологических исследований: Учеб. пособие. Л.:
Издательство Ленинградского университета, 1991. - 224 с.
9.
«Ackerman S., Weith P. Knowing Your Pulse Oximetry Monitors // Med. Elektrik. - 1995. -
№1.-Р.82-86.»
10. Волков В.Я., Иванов В.П., Стерлин Ю.Г. Пульсовая оксиметрия:
достижения и перспективы // Мед. Техника, 1993, №4, стр. 27-31.
11. Волков В.Я., Гладков Ю.М., Завадский В.К., Иванов В.П. Принципы и
алгоритмы определения оксигенации крови по изменениям пульсоксиметра. // Мед.
Техника, 1993, №1, стр. 16-21.
12.Кузнецова С.Н., Чигирев
Б.И. Неивазивный метод пульсовой и традиционной фотооксиметрии // Известия
ГЭТУ, 1996, вып. 491, стр. 55-58.
13.Кузьмич В.В., Жаров В.П.
Основные принципы и особенности транскутанной «отражательной’’ оксиметрии //
Мед. Техника, 1993, №3, стр. 36-42.
14.Леонов Г.Н.,
Филипповский В.В., Мусийчук Ю.И., Свидлер В.Н., Карпов А.В., Баркан М.В.
Неинвазивное определение оксигемоглобина в артериальной крови. // Мед. Техника,
1992, №5, стр. 12-14.
15.Перов С.Н., Коротков
Н.П., Куземко В.В., Захаров С.Д., Симанов В.А. Принципы оптической
оксигемометрии в системах экстракорпорального кровообращения // Мед. Техника,
1992, №5, стр. 18-21.
16.Стерлин Ю.Г.
Специфические проблемы разработки пульсовых оксиметров // Мед. Техника, 1993,
№6, стр. 26-30.