Экзотермический эффект при восстановительном пиролизе хлорорганических соединений
ВВЕДЕНИЕ
Проблема
ликвидации и переработки отходов производства - одна из важных задач
современной промышленности. Значительная часть отходов приходится на долю
химической промышленности, в том числе и ее хлоридной подотрасли. Отходы
хлорорганических производств - винилхлорида, эпихлоргидрида, дихлорэтана и
других продуктов - представляют собой трудноразделимую, а иногда и неразделимую
смесь токсичных коррозионно-активных веществ.
В настоящее
время известны следующие основные направления утилизации хлорорганических
отходов: сжигание с получением хлористого водорода или соляной кислоты, пиролиз
и исчерпывающее деструктивное хлорирование с получением трихлорэтилена, перхлорэтилена
и четыреххлористого углерода 1 .
В последнее
время все большее внимание уделяется исследованию пиролиза хлорорганических
отходов, позволяющего получать безводный хлористый водород, хлорорганические и
некоторые другие продукты 2 .
Глава 1. ПЕРЕРАБОТКА
ПРОМЫШЛЕННЫХ ХЛООРГАНИЧЕСКИХ ОТХОДОВ МЕТОДОМ КАТАЛИТИЧЕСКОГО ЖИДКОФАЗНОГО
ГИДРОДЕХЛОРИРОВАНИЯ
Основными
проблемами производства хлорорганических продуктов являются обезвреживание и
переработка хлорорганических отходов, которые в настоящее время подлежат
сжиганию [1, 2]. Часть таких отходов подвергается высокотемпературной
окислительной деструкции в среде хлора (хлоринолизу) с получением хлорорганического
растворителя-1,1,2,2-тетрахлорэтилена [3, 4].
Метод
переработки хлорорганических отходов, основанный на термическом сжигании,
приводит к образованию таких высокотоксичных продуктов, как хлор, оксиды азота,
фосген и диоксины. Кроме того, он требует большого расхода топлива,
характеризуется необратимой потерей углеводородного сырья, выделением в окружающую
среду диоксида углерода и быстрым изнашиванием оборудования в результате
воздействия высокой температуры и коррозионно-агрессивных сред. Метод
каталитического окисления значительно менее энергоемок, позволяет
перерабатывать любые хлорорганические отходы и отличается высокой
производительностью. При использовании метода каталитического окисления, как и
в случае сжигания, безвозвратно теряется углеродная составляющая отходов. Ввиду
нестабильного состава отходов, а также возможных отклонений в режиме процесса
образование опасных токсичных продуктов исключить нельзя [5].
Наиболее
универсальным и перспективным способом переработки и обезвреживания хлорорганических
отходов с точки зрения предотвращения ущерба окружающей среде и здоровью
населения без угрозы получения побочных токсичных веществ является метод
каталитического гидродехлорирования или гидрогенолиза с использованием молекулярного
водорода. Гидрогенолиз характеризуется мягкими условиями проведения процесса и
свойственным ему ресурсосберегающим потенциалом.
Процессы
гидрогенолиза можно представить как замещение атома хлора на водород в
молекулах хлорорганических соединений:
отходы хлорорганический переработка гидрогенолиз
RC1 + Н2
-> RH + НО. (1)
Из
уравнения видно, что при гидрогенолизе можно перерабатывать экологически
опасные хлорорганические соединения в ценные углеводороды или их хлорированные
производные. Продукты исчерпывающего гидрогенолиза могут быть использованы как
компоненты топлива. Хлористый водород также представляет определенную
коммерческую ценность.
Трудность промышленного
внедрения метода каталитического гидродехлорирования хлорорганических отходов
связана с быстрой дезактивацией катализаторов [5, 6]. В процессе
каталитического гидродехлорирования отходы могут быть использованы только в
осветленном виде. Использование реальных неосветленных отходов, содержащих
неорганические примеси и смолистые вещества, практически невозможно из-за
дезактивации катализаторов. В газофазных процессах гидрогенолиза дезактивация
может быть вызвана ингибирующим действием хлористого водорода, являющегося
побочным продуктом реакции, который, сорбируясь на поверхности катализатора,
блокирует активные центры [4] образованием углеродных отложений вследствие
олигомеризации на поверхности катализаторов, спеканием активной фазы. С целью
нейтрализации отравляющего действия НС1 гидрогенолиз ведут в жидкой фазе,
используя акцепторы хлористого водорода - щелочи, амины или соли карбоновых
кислот. Смыв активного компонента под действием реакционной среды и частичное
разрушение катализатора являются основными причинами дезактивации катализаторов
в жидкой фазе [7].
Ранее
была показана возможность переработки хлорорганических отходов методом каталитического
жидкофазного гидродехлорирования в присутствии гетерогенных катализаторов,
содержащих палладий, при 250 — 330 "С в среде трансформаторного масла
АМТ-300 (Пат. 2175313 РФ). В результате гидрогенолиза хлорорганических отходов
получают смесь углеводородов или их низкохлорированных производных и хлористого
водорода, утилизация которых не вызывает затруднений.
Рассмотрим
процесс переработки и обезвреживания реальных неосветленных промышленных
хлорорганических отходов методом каталитического жидкофазного
гидродехлорирования в присутствии водорода в качестве гидрирующего агента.
При
утилизации хлорорганических отходов каталитическим гидродехлорированием
использовались отходы ОАО "Каустик" производств винилхлорида,
эпихлоргидрина и перхлорэтилена. При производстве одной тонны винилхлорида
образуется около 30 кг хлорорганических отходов, представляющих многокомпонентную
смесь хлорпроизводных этана и этилена и смолистых веществ (состава А). Основные
компоненты состава А, % по массе: 40 — 43 1,2-дихлорэ-тана; 30 — 35
1,1,2-трихлорэ-тана; 23—15 перхлорэтилена, 1,1,2,2- и 1,1,1,2-тетрахлорэта-нов
и 7 смолистых. В процессе получения одной тонны эпихлоргидрина образуется до 450 кг отходов (состав Б), включающих хлорпроизводные пропана и пропилена и смолистые соединения.
Основными компонентами состава Б являются, % по массе: 2,32 монохлорпропеновая
фракция; 61,58 дихлорпропан-дихлор-пропеновая фракция; 30,5
1,2,3-трихлорпропан; 5,6 высококипя-щие (смолы). Отходы производства
1,1,2,2-тетрахлорэтилена (состав В) представляют собой смесь полихлоридов, % по
массе: 36,07 гексахлорэтан; 0,54 перхло-рэтилен; 24,47 гексахлорбутадиен; 0,16
трихлорбензол; 0,34 тет-рахлорбензол; 3,9 пентахлорбензол; 34,52
гексахлорбензол.
Жидкофазное
каталитическое гидродехлорирование хлорорганических отходов проводили в проточном
кварцевом реакторе со стационарным слоем катализатора. В качестве
высокотемпературного инертного растворителя применяли дешевый и легко доступный
вакуумный газойль (7U = 350 500 °С) или так называемый тяжелый
газойль (Гкш, = 360 500 °С), полученный при гидрокрекинге и
каталитическом крекинге вакуумного газойля, а также при термическом крекинге
мазута.
В
качестве катализаторов использовали каталитические системы на основе палладия,
нанесенные на активированные угли и оксид алюминия с содержанием 0,5 — 2,0 %
палладия. Были испытаны промышленные палладийсодержащие катализаторы: МА-15,
ФПК-1, ИК-53-1- катализатор Pd/сибунит (содержание Pd — 2 % по массе) и никельсиликатные катализаторы,
получаемые осаждением основного карбоната никеля на кизельгуре с последующей
фильтрацией, отмывкой, сушкой, таблетированием и восстановительным разложением,
содержащие 25 — 50 % по массе никеля, выпускаемые ОАО "Синтез
Каучук" (г. Стерлитамак). С целью подготовки катализаторов к работе в
условиях реакции гидродехлорирования хлоруглеводородов проводилась активация
катализаторов. Катализатор помещался в реактор, затем включался обогрев
реактора с одновременной подачей азота. В течение 6 ч температура
реактора постепенно повышалась до 250 °С. В течение следующих 6 ч
температура реактора повышалась до 400 "С. Продувка азотом велась
до полного прекращения выделения воды. Затем подача азота отключалась, и в
реактор вводили водород, подача которого велась до прекращения выделения воды и
хлористого водорода.
Водород
и раствор или водород и тонкодисперсная суспензия твердого хлорорганического
отхода в 5 — 10-кратном избытке высококипящего растворителя по отношению
к массе хлорорганического отхода и при соотношении водород: хлорорганический
отход 20^-40:1 параллельными потоками подаются в нижнюю часть реактора.
Температура проведения процесса 250 — 350 °С, время контакта составляет
15 — 20 с. Продукты реакции представляют собой смесь углеводородов и
низкохлорированных хлоруглеводородов. Непрореагировавший водород и выделившийся
хлористый водород выводят из верхней части реактора и подвергают разделению
известными методами. Высоко-кипящий углеводородный растворитель с
непрореагировавшими отходами возвращают в процесс. Гидрогенолиз отходов
производства винилхлорида (состав А), включающих хлоруглеводороды С2
при 350 °С с конверсией 98 %, приводит к получению этана и этилена — 89 %,
хлористого этила и хлористого винила — 11 %. Гидрогенолиз отходов производства
эпихлоргидрина (состав Б) с конверсией 90 % ведет к получению пропана и
пропилена (88 %), хлорпропенов (2 %), дихлорпропенов (10 %). Особое место
занимает проблема утилизации отходов производства перхлорэтилена, получаемого
методом высокотемпературного хлорирования. Эти отходы представляют собой смесь
негорючих и легко кристаллизующихся перхлоруглеродов. Для достижения высокой
конверсии перхлоруглеродов гидрогенолиз ведется при большом избытке водорода по
отношению к хлорорганическому отходу 40:1. В результате гидрогенолиза твердых
отходов производства 1,1,2,2 -тетрахлорэтилена (состав В) с конверсией 95 %
получены этан, этилен, бутан, бутилены, моно — и дихлорпроизводные бутиленов,
смесь бензола и хлорбензолов с различным содержанием хлора.
Используя
палладиевые катализаторы проводят вышеописанные реакции гидродехлорирования с
преимущественным образованием этана и пропана.
Срок
стабильной работы палладиевых катализаторов не более 80 ч.
Негативное
действие хлористого водорода на активность катализаторов нейтрализуется в
процессе жидкофазного гидродехлорирования хлорорганических отходов при
использовании сплавного Ni-Al-Ti катализатора, обладающего повышенной прочностью и высокой
активностью в интервале температур 100 — 400 °С. Традиционно используемые
никелевые катализаторы обладают низкой механической прочностью. Оксид алюминия
или активированный уголь, пропитанный солями палладия (Pd/ALOj и Pd/C) являются достаточно дорогими катализаторами и относительно
быстро теряют свою активность за счет блокирования активных центров поверхности
катализатора смолистыми и коксообразными побочными продуктами, присутствующими
в реальных отходах.
Процесс
гидродехлорирования хлорорганических отходов в присутствии сплавного Ni-Al-Ti катализатора
осуществляется в две стадии. На первой стадии проводят выщелачивание сплавного
катализатора, на второй выполняют гидродехлорирование хлорорганических отходов.
Активным
элементом в катализаторе является никель, алюминий исполняет роль защитного
слоя. Свежий катализатор подвергают активации выщелачиванием части алюминия по
реакции
2Н20
+ 2А1 + 2NaOH -> -> 2NaA102 + ЗН2 (2)
При
этом открываются активные слои никеля.
Гидродехлорирование
хлорорганических отходов в присутствии сплавного Ni-Al-Ti катализатора протекает по реакции
С„Н2„С12
+ Н2 -> СЛН2„ + + 2НС1, (3)
СЛН2„-2С12
+ 2Н2 -» СЛН2„ + + 2НС1. (4)
Конверсия
исходного хлоруглеводородного сырья составляет 96 - 99%.
На
рисунке представлена принципиальная схема установки по переработке реальных неосветленных
промышленных отходов методом каталитического гидродехлорирования. Процесс
жидкофазного каталитического гидродехлорирования хлорорганических отходов
осуществляется в реакторе со стационарным слоем катализатора и циркуляционным
контуром.
В
процессе гидрогенолиза активация отработанного катализатора осуществляется за
счет частичного хлорирования алюминия хлороводородом, образующимся в качестве
побочного продукта в ходе гидродехлорирования хлорорганических отходов:
2А1 + 6НС1 -» 2А1С13
+ ЗН2. (5
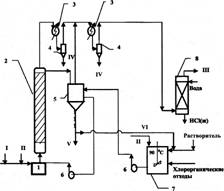
Температура проведения
процесса 250 — 350 "С при времени контакта 25 — 30 с и мольном соотношении
водород борорганический отход равном (20*40): 1. Продукты реакции,
представляющие собой смесь непредельных и предельных углеводородов (этилен,
этан, пропилен, пропан, бензол), хлоруглеводородов, непрореагировавший водород
и выделившийся хлористый водород, выводят из верхней части реактора и
подвергают разделению известными методами. Циркуляция высоко-кипящего
углеводородного растворителя с не прореагировавшими отходами и хлоридом
алюминия осуществляется по следующей схеме: буферная ёмкость — циркуляционный
насос — реактор — буферная ёмкость. Вследствие этого катализатор будет
непрерывно регенерироваться за счет смывания с поверхности смолообразных и
коксообразных побочных продуктов, отравляющих катализатор. По мере накопления
хлорид алюминия выводят из реакционной массы фильтрацией, растворитель с
непрореагировавшими отходами возвращают в процесс. Растворением хлорида
алюминия в воде и его частичной нейтрализацией получают низкоосновный оксихлорид
алюминия марки ОХА-Н, который может быть использован при очистке
хозяйственно-бытовых и сточных вод, а также при обезвоживании осадков сточных
вод.
Гидродехлорирование
отходов производства винилхлорида (состав А) проходит при 280 — 310 °С с
высокой конверсией (98 %). Продуктами каталитического гидрирования отходов
являются этан и этилен (92 %) с преимущественным получением этилена, хлористый
этил и хлористый винил (8 %). Гидрогенолиз отходов производства эпихлоргидрина
(состав Б) с конверсией 94 % ведет к получению пропилена и пропана (93,4 %) с
преимущественным получением пропилена, монохлорпропенов (4 %), дихлорпропенов
(2,6 %). В результате гидрогенолиза твердых отходов производства перхлоруглеводородов
(состав В) при 300—- 330 °С и конверсии 95 % получены этан, этилен, бутан,
бутилены, моно- и дихлорпроизводные бутиленов, смесь бензола и монохлорбензола.
Активность
Ni-Al-Ti катализатора
при эксплуатации на лабораторной установке в течение 250 ч оставалась высокой.
Продукты каталитического гидродехлорирования отходов после абсорбции хлористого
водорода водой могут быть использованы как ценные углеводороды или как
компоненты топлива.
Таким
образом, гидрогенолиз в среде инертного высококипящего углеводородного
растворителя может быть организован в промышленном масштабе для реальных
хлорорганических отходов в широком диапазоне как по составу, так и по
физическому состоянию (от жидких до твердых). Очевидным достоинством
предлагаемого метода переработки хлорорганических отходов является вариант
превращения их в смесь продуктов, утилизация которых не вызывает затруднений.
В
результате осуществления жидкофазного процесса гидродехлорирования хлорорганические
отходы производств винилхлорида, эпихлоргидрина и перхлоруглерода с высоким
выходом конвертируют в углеводороды и хлористый водород. Благодаря внедрению
процесса переработки отходов методом гидродехлорирования производство
винилхлорида и эпихлоргидрина становится практически безотходным. Кроме того,
внедрение технологии гидродехлорирования в производстве перхлорэтилена позволит
избежать получения полихлорированных углеродов.
Глава
2. ЭКЗОТЕРМИЧЕСКИЙ ЭФФЕКТ ПРИ ВОССТАНОВИТЕЛЬНОМ ПИРОЛИЗЕ ХЛОРОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Проблема
ликвидации и переработки отходов производства - одна из важных задач
современной промышленности. Значительная часть отходов приходится на долю
химической промышленности, в том числе и ее хлоридной подотрасли. Отходы
хлорорганических производств - винилхлорида, эпихлоргидрида, дихлорэтана и
других продуктов - представляют собой трудноразделимую, а иногда и неразделимую
смесь токсичных коррозионно-активных веществ.
В настоящее
время известны следующие основные направления утилизации хлорорганических
отходов: сжигание с получением хлористого водорода или соляной кислоты, пиролиз
и исчерпывающее деструктивное хлорирование с получением трихлорэтилена,
перхлорэтилена и четыреххлористого углерода 1 .
В последнее
время все большее внимание уделяется исследованию пиролиза хлорорганических
отходов, позволяющего получать безводный хлористый водород, хлорорганические и
некоторые другие продукты 2 .
Восстановительный
пиролиз также используется для уничтожения накопленных галогеносодержащих
соединений, таких как озоноразрушающие хладоны. Известно, что хладоны не
рекомендуется сжигать в воздухе, так как в этом случае образуются опасные
кислородсодержащие вещества - диоксины и фосгены 3 . При
переработке веществ, не содержащих кислород, желательно использовать
бескислородные методы, к которым и относится восстановительный пиролиз
4 .
Многие из
хлорорганических соединений термодинамически нестабильны и при их пиролизе
выделяется энергия, т.е. наблюдается экзотермический эффект. Этот эффект
известен и применяется на практике, при этом процесс идет автотермично
2,5 , способствуя инициированию пиролиза, начинающегося при 400-600оС
[2,6].
Проведены
теоретические исследования термических характеристик равновесия
хлорорганических соединений при восстановительном пиролизе. Для анализа были
взяты все вещества, для которых в [7,8] приведена энтальпия образования, их
комбинационные смеси с водородом, углеводородом и друг с другом. В таблице 1
приведены смеси, соединения и чистые вещества, конечными продуктами которых при
полном разложении в стандартных условиях (Т=298К, р=0,1 МПа)
являются конденсированный углерод (C*) и хлористый водород (HCl).
Для оценки экзотермического эффекта использовалась адиабатическая температура Тад,
которая получается при протекании пиролиза в закрытой системе. Эта температура
рассчитывалась по программе ASTRA-4/pc 9 , которая позволяет
найти температуру равновесия данной реакции по заданным теплоте образования
вещества и давлению. Расчеты проводились без учета образования ионов при
давлении 0,1 МПа и энтальпии образования газообразных веществ, взятой при
температуре 298 К по литературным данным 7,8 . При анализе
использовались не только вещества, существующие при стандартных условиях (Т=298
К), но и радикалы, которые образуются в экстремальных условиях. Рис.1. Зависимость
адиабатической температуры от теплоты реакции на один моль исходного вещества.
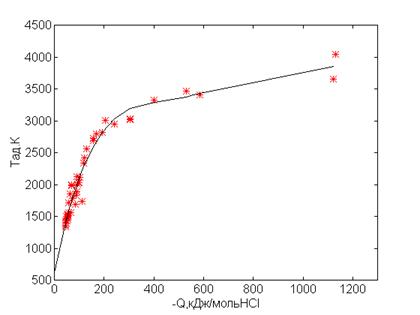
Рис.2.
Адиабатическая температура как функция теплоты реакции к одному молю HCl
Для выбранных
химических реакций рассчитан тепловой эффект реакции Q, который согласно
следствию закона Гесса равен сумме теплот образования получившихся продуктов за
вычетом суммы теплот образования исходных веществ. Значения Тад для
различных Q на один моль исходного вещества приведены в
табл.1 и на рис.1. Из рисунка видно, что точки расположены хаотично и не могут
быть описаны определенной функциональной зависимостью.
Так как
основное выделение тепла в рассматриваемых реакциях происходит при образовании
хлористого водорода, то тепловой эффект был отнесен к одному молю HCl. Как
видно из рис.2, в этом случае точки удовлетворительно укладывается на одну
кривую. Полученный график может быть использован на практике для расчета
адиабатической температуры по известным значениям теплового эффекта реакции.
Из анализа
следует, что благодаря достаточно высокой адиабатической температуре можно
ожидать автотермичности процесса переработки хлорорганических веществ при
восстановительном пиролизе. При этом для инициирования начала процесса
используется плазма (водородная или аргоновая) при малых энергетических
затратах на ее генерацию.
Глава 3.
СПОСОБ ПЕРЕРАБОТКИ ХЛОРОРГАНИЧЕСКИХ ОТХОДОВ МЕТОДОМ ГИДРОГЕНОЛИЗА
Наиболее
универсальным и перспективным методом переработки хлорорганических отходов
считается гидрогенолиз, так как этот метод наиболее полно удовлетворяет
требованиям, предъявляемым к способам переработки отходов, таким как:
-
возобновляемость углеродсодержащего сырья или коммерческая ценность
образующихся продуктов;
-
экономичность переработки;
-
высокая степень превращения; универсальность способа;
-
отсутствие среди продуктов, образующихся в результате переработки отходов,
высокотоксичных веществ.
При
осуществлении изобретения может быть получен технический результат, который выражается
в возможности:
-
организации переработки хлорорганических отходов в промышленном масштабе;
-
переработки широкого спектра хлорорганических продуктов;
- получения целевых продуктов, которые могут быть возвращены в технологический
цикл.
Указанный
выше технический результат достигается особенностью способа переработки
хлорорганических отходов, заключающейся в том, что гидрогенолиз осуществляют в
среде инертного высококипящего углеводородного растворителя при 10-20-кратном
его избытке по отношению к массе хлорорганических отходов и при мольном
соотношении водорода и хлорорганических отходов, равном 20-40: 1, с дальнейшим
отделением газообразных продуктов реакции известными методами и рециклом
непрореагировавших отходов в растворителе. В качестве инертного высококипящего
углеводородного растворителя используют жидкие смеси алефатических,
ароматических и циклических углеводородов с температурой кипения 250-350oC
(трансформаторное масло АМТ-300, вазелиновое масло).
Переработка хлорорганических отходов гидрогенолизом в среде инертного
высококипящего углеводородного растворителя обеспечивает возможность
организации этого процесса в промышленном масштабе, т.к. растворитель
регенерирует катализатор за счет смывания с поверхности носителя катализатора
смолообразных и коксообразных побочных продуктов.
Способ гидрогенолиза реальных хлорорганических отходов производства
эпихлоргидрина, перхлоруглеводородов и винилхлорида в жидкой фазе
осуществляется в реакторе проточного типа со стационарным слоем катализатора,
проактивированного по известной методике. В качестве катализатора используют
окись алюминия и активированный уголь, пропитанный солями палладия и с
содержанием палладия 0,4-1,8 мас.% соответственно.
Водород
и раствор или раствор и тонкодисперсная суспензия хлорорганического отхода в
10-20-кратном избытке высококипящего растворителя по отношению к массе
хлорорганического отхода при мольном соотношении водород: хлорорганический
отход 20-40:1 параллельными потоками подают в верхнюю часть реактора.
Температура проведения процесса 250-350oC.
Продукты
реакции, представляющие собой смесь хлоруглеводородов в растворителе,
непрореагировавший водород и выделевшийся хлористый водород выводят из нижней
части реактора и подвергают разделению известными методами.
Высококипящий
углеводородный растворитель с непрореагировавшими отходами возвращают в
процесс.
Ввиду
получения удовлетворительных результатов и большой доступности для опытной
проверки была использована каталитическая система на основе палладия и окиси
алюминия или активированного угля.
ЛИТЕРАТУРА
1. Бернардинер М.Н.,
Шургин А.П. Огневая переработка и обезвреживание промышленных отходов. М.:
Химия, 1990.
2. Абрамова В.И.,
Крашенинникова А.А. Переработка, использование и уничтожение отходов в
производстве хлорорганических продуктов: Обзор. М.: НИИТЭХИМ, 1977.
3. Карташов Л.М.,
Занавескин Л.Н., Трегер Ю.А. и др. Научные труды НИИ "Синтез". М.,
1996.
4. Занавескин Л.Н.,
Аверьянов В.А., Трегер Ю.А. Перспективы развития методов переработки
галогенорганических отходов. Закономерности каталитического гидрогенолиза
галогенсодержащих соединений // Успехи химии. 1996. Т. 65. № 7.
6. Мишаков И.В., Буянов
Р.А., Чесноков В.В. Способ утилизации хлоруглеводородов на никель- и
кобальтсодержащих катализаторах. // Катализ в промышленности. 2002. № 4.
7. Генцлер А.Г., Симапша В.И.,
Нецкина О.В., Комова О.В., Цыбуля СВ., Абросимов О.Г. Исследование
закономерностей каталитического гидродехлорирования на палладийсодержащих
катализаторах // Кинетика и катализ. 2007. Т. 48. № 1.
Литература
1. Дубовой Л.И., Адитайс Э.Р., Берлин
Э.Р., Трегер Ю.А. // Химическая промышленность. 1982. №11. С.18-19.
2. Мазанко А.Ф., Антонов В.Н., Рожков
В.И., Заликин А.А. // Химическая промышленность. 1986. №5. С.272-275.
3. Федоров Л.А. Диоксины как
экологическая опасность: ретроспектива и перспективы. М.: Наука.1993.- 266с.
4. Мальцева А.С., Фролов Ю.Е., Жарова
Н.Н., Розловский А.И. // Химическая промышленность. 1984. №1. С.19-22.
5. Антонов В.Н., Рожков В.И., Заликин
А.А. // Журнал прикладной химии. 1987. №6. С.1347-1352.
6. Шмыков Ю.И., Шорин С.Н., Сурис
А.Л. // Химия высоких энергий. 1977. Т.11. №4. С.371-375.
7. Сталл Д., Вестрам Э., Зинке Г.
Химическая термодинамика органических соединений. М.: Мир, 1971.- 807с.
8. Гурвич Л.В., Вейтс И.В., Медведев
В.А. и др. Термодинамические свойства индивидуальных веществ. М.: Наука, 1979.
Т.2, кн.2.- 344с.
9. Трусов Б.Г. Моделирование
химических и фазовых равновесий при высоких температурах (АСТРА-4/рс). М.: МГТУ
им. Н.Э. Баумана, 1994.- 50с.
Задачей
заявляемого изобретения является разработка промышленного способа переработки
хлорорганических отходов методом каталитического гидрогенолиза.
Одной из
наиболее острых проблем создания и организации малоотходных, экологически
безопасных производств галогеноорганических продуктов является переработка и
обезвреживание отходов таких производств.
Неприятная
особенность хлорорганических отходов заключается в том, что все они являются
ксенобиотиками и у природы нет естественных средств борьбы с ними. В то же
время не всякий способ превращения галогенорганических соединений может быть
использован для их утилизации, что было рассмотрено выше.
Наиболее
универсальным и перспективным методом переработки хлорорганических отходов
считается гидрогенолиз, так как этот метод наиболее полно удовлетворяет
требованиям, предъявляемым к способам переработки отходов, таким как:
-
возобновляемость углеродсодержащего сырья или коммерческая ценность
образующихся продуктов;
-
экономичность переработки;
- высокая
степень превращения; универсальность способа;
- отсутствие
среди продуктов, образующихся в результате переработки отходов, высокотоксичных
веществ.
При
осуществлении изобретения может быть получен технический результат, который
выражается в возможности:
- организации
переработки хлорорганических отходов в промышленном масштабе;
- переработки
широкого спектра хлорорганических продуктов;
- получения
целевых продуктов, которые могут быть возвращены в технологический цикл.
Указанный
выше технический результат достигается особенностью способа переработки
хлорорганических отходов, заключающейся в том, что гидрогенолиз осуществляют в
среде инертного высококипящего углеводородного растворителя при 10-20-кратном
его избытке по отношению к массе хлорорганических отходов и при мольном
соотношении водорода и хлорорганических отходов, равном 20-40: 1, с дальнейшим
отделением газообразных продуктов реакции известными методами и рециклом
непрореагировавших отходов в растворителе. В качестве инертного высококипящего
углеводородного растворителя используют жидкие смеси алефатических,
ароматических и циклических углеводородов с температурой кипения 250-350oC
(трансформаторное масло АМТ-300, вазелиновое масло).
Переработка
хлорорганических отходов гидрогенолизом в среде инертного высококипящего
углеводородного растворителя обеспечивает возможность организации этого
процесса в промышленном масштабе, т.к. растворитель регенерирует катализатор за
счет смывания с поверхности носителя катализатора смолообразных и коксообразных
побочных продуктов.
Способ
гидрогенолиза реальных хлорорганических отходов производства эпихлоргидрина,
перхлоруглеводородов и винилхлорида в жидкой фазе осуществляется в реакторе
проточного типа со стационарным слоем катализатора, проактивированного по
известной методике. В качестве катализатора используют окись алюминия и
активированный уголь, пропитанный солями палладия и с содержанием палладия
0,4-1,8 мас.% соответственно.
Водород и
раствор или раствор и тонкодисперсная суспензия хлорорганического отхода в
10-20-кратном избытке высококипящего растворителя по отношению к массе
хлорорганического отхода при мольном соотношении водород: хлорорганический
отход 20-40:1 параллельными потоками подают в верхнюю часть реактора.
Температура проведения процесса 250-350oC.
Продукты
реакции, представляющие собой смесь хлоруглеводородов в растворителе, непрореагировавший
водород и выделевшийся хлористый водород выводят из нижней части реактора и
подвергают разделению известными методами.
Высококипящий
углеводородный растворитель с непрореагировавшими отходами возвращают в
процесс.
Ввиду
получения удовлетворительных результатов и большой доступности для опытной
проверки была использована каталитическая система на основе палладия и окиси
алюминия или активированного угля.
Способ
подтверждается примерами.
Пример 1. В
реактор проточного типа со стационарным слоем катализатора, содержащего 0,4%
палладия на оксиде алюминия подают хлорорганический отход в количестве 2,5 г/ч
(0,0187 мол/ч) в инертном высококипящем растворителе в соотношении
хлорорганический отход:растворитель, равном 1:10.
В качестве
хлорорганического отхода используют отходы производства винилхлорида следующего
состава: 1,2-дихлорэтан - 12,2%; высококипящие - 72,9%, в том числе
1,1,2-трихлорэтан - 42,4%, перхлорэтилен - 14,4%, 1,1,2,2- и
1,1,1,2-трихлорэтан-14,9% (Состав А).
В качестве
инертного высококипящего растворителя используют трансформаторное масло
АМТ-300.
Водород
подают в реактор прямотоком в мольном соотношении к хлорорганическому отходу,
равном 1: 40. Гидрогенолиз осуществляют при температуре 295-300oС.
Конверсия
исходных хлоруглеводородов составляет 88,7%.
Состав
полученных продуктов: этан и этилен - 0,35 г/ч (0,012 мол/ч); хлористый этил и
хлористый винил - 0,28 г/ч (0,0045 мол/ч); хлористый водород - 1,67 г/ч (0,045
мол/ч); непрореагировавшие отходы - 0,20 (0,0015 мол/ч).
Пример 2.
Аналогично примеру 1, гидрогенолиз осуществляют при температуре 250oC.
Пример 3.
Аналогично примеру 1, гидрогенолиз осуществляют при температуре 330oC.
Пример 4.
Аналогично примеру 1, в процессе используют в качестве катализатора
активированный уголь с содержанием 1,8% палладия.
Пример 5.
Аналогично примеру 1, гидрогенолиз осуществляют при 20-кратном избытке
водорода.
Пример 6.
Аналогично примеру 1, гидрогенолизу подвергают хлорорганические отходы
производства эпихлоргидрина следующего состава (Состав Б): дихлорпропан -
36,4%, дихлорпропены - 13,5%, монохлорпропены - 18,5%, трихлорпропан - 26,0%,
высококипящие (осмолы) - 5,6%.
Пример 7.
Аналогично примеру 1, гидрогенолизу подвергают отходы производства
перхлоруглеводородов следующего состава (Состав В): гексахлорбензол - 35,5%,
гексахлорбутадиен - 36,3%, гексахлорэтан - 24,1%, осмолы - 4,1%.
Результаты
примеров даны в таблице.
Использование
предлагаемого способа переработки хлорорганических отходов методом
гидрогенолиза дает возможность организации ее в промышленном масштабе.
В отличии от
метода обезвреживания отходов хлорорганических производств (по прототипу), где
в процессе использовались отходы предварительно осветленные, рекомендуемый
способ предполагает переработку реальных отходов в широком диапазоне как по составу,
так и по физическому состоянию (от жидких до твердых).
Очевидным
достоинством предлагаемого метода переработки хлорорганических отходов является
вариант превращения их в смесь продуктов, утилизация которых не вызывает
затруднений.
http://www..ru/