Уравнение химической реакции
Федеральное агентство связи
Сибирский Государственный Университет Телекоммуникаций и Информатики
Межрегиональный центр переподготовки
специалистов
Контрольная
работа
По дисциплине:
Химия
Выполнил:
Шестаков Е. И.
Группа: РДТ -
92
Вариант: 1
Проверил:
___________________
Новосибирск, 2009 г.
Задача 1. Рассчитайте
количество вещества: а) азота массой 14 г.;
б) кислорода массой 48 г.; в) железа массой 112 г.; г) фосфора массой 31 г.
Решение:
Количество вещества
находится по формуле:
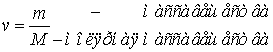
а) 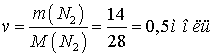 ;
;
б) 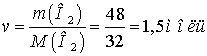 ;
;
в) 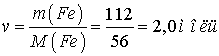 ;
;
г) 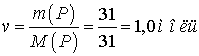 .
.
Ответ: а) 0,5 моль; б)
1,5 моль; в) 2,0 моль; г) 1,0 моль.
Задача 2. Напишите
электронные формулы атомов элементов с порядковыми номерами 9 и 28. Распределите
электроны этих атомов по квантовым ячейкам. К какому электронному семейству
относится каждый из этих элементов?
Решение:
Электронные формулы
атомов:
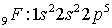
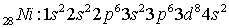
Распределение электронов
по квантовым ячейкам:
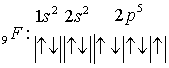
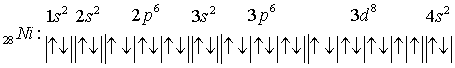
Т.к. у фтора происходит
заполнение электронами p –
подуровня, он относится к семейству р – элементов .
Т.к. у никеля происходит
заполнение электронами d – подуровня , он относится к семейству d – элементов .
Задача 3. Вычислить
тепловой эффект реакции восстановления 1 моль
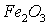 металлическим алюминием.
металлическим алюминием.
Решение:
Уравнение реакции:
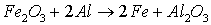
Тепловой эффект реакции
равен разности между суммой теплоты образования продуктов реакции и суммой
теплоты образования исходных веществ:
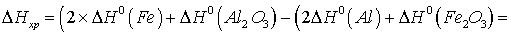
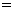
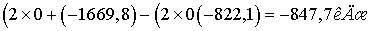 .
.
Т.е. в результате этой
реакции выделилось 847,7 кДж теплоты при восстановлении 1 моль 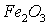 .
.
Ответ: 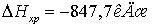 .
.
Задача 4. Теплоты
образования 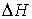 оксида
оксида 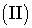 и оксида
и оксида 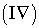 азота соответственно равны +90,37 кДж и +33,85 кДж.
Определите
азота соответственно равны +90,37 кДж и +33,85 кДж.
Определите 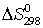 и
и 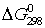
для реакций получения NO и 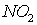 из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему?
из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему?
Решение:
Уравнение реакций
образования NO и 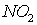 из простых веществ:
из простых веществ:
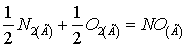
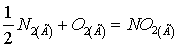 .
.
Находим  для этих реакций:
для этих реакций:
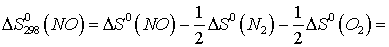
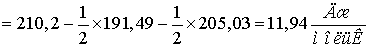
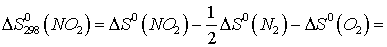
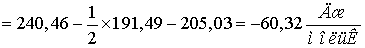
Находим  для этих реакций:
для этих реакций:
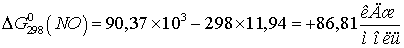
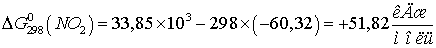
Т.к. 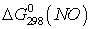 и
и 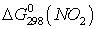 больше ноля, то при стандартных
условиях эти оксиды получить не возможно.
больше ноля, то при стандартных
условиях эти оксиды получить не возможно.
При высокой температуре
образуется NO, т.к. при увеличении T значение 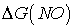 станет меньше ноля и реакция
образования NO станет возможной.
станет меньше ноля и реакция
образования NO станет возможной.
Ответ:  ;
; 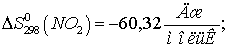
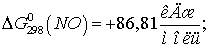
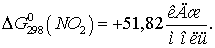
Задача 5. Окисление серы
и её диоксида протекает в уравнениях:
a) 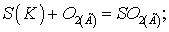 б)
б) 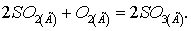 Как изменятся скорости этих реакций,
если объёмы каждой из систем уменьшить в четыре раза.
Как изменятся скорости этих реакций,
если объёмы каждой из систем уменьшить в четыре раза.
Решение:
а) Согласно закону
действия масс скорость прямой реакции до изменения объёма: 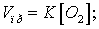
После уменьшения объёма
системы в 4 раза концентрация 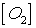 увеличится в 4 раза:
увеличится в 4 раза: 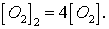 Сера находится в кристаллическом состоянии, поэтому она на
скорость реакции не влияет.
Сера находится в кристаллическом состоянии, поэтому она на
скорость реакции не влияет.
При новой концентрации
скорости прямой реакции равна:
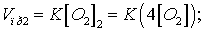
Отсюда: 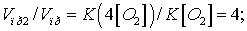
Следовательно, скорость
прямой реакции увеличилась в 4 раза.
б) Согласно закону
действия масс скорости прямой реакции до изменения объёма: 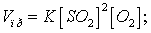
После уменьшения объёма
гомогенной системы в 4 раза концентрация каждого из реагирующих веществ
увеличится в 4 раза:
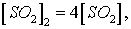
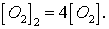
При новых концентрациях
скорость прямой реакции равна:
Отсюда: 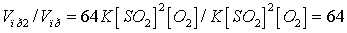 .
.
Следовательно, скорость
прямой реакции увеличилась в 64 раза.
Ответ: а) скорость прямой
реакции увеличилась в 4 раза.
б) скорость прямой
реакции увеличилась в 64 раза.
Задача 6. Вычислите
молярную и эквивалентную концентрации 20% - ог раствора хлорида кальция,
плотность которого 1,178 г/см3.
Решение:
Возьмём раствор объёмом
V=1 литр = 1000 см3.
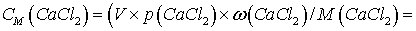 =
=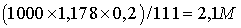 .
.
Т.к. 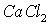 это соль двухвалентного металла и одноосновной кислоты, то
это соль двухвалентного металла и одноосновной кислоты, то 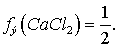
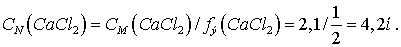
Ответ: 2,1М; 4,2н.
Задача 7. Вычислите
процентную концентрацию водного раствора сахара 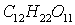 , зная температуру кристаллизации
раствора
, зная температуру кристаллизации
раствора 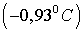 . Криоскопическая константа воды 1,86 град.
. Криоскопическая константа воды 1,86 град.
Решение:
Температура
кристаллизации чистой воды 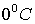 , следовательно,
, следовательно,
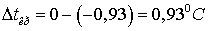 .
.
Зная, что молярная масса
сахара 342г/моль, находим массу m (г) растворенного вещества, приходящуюся на 1000 г ( 1 кг ) воды из уравнения:
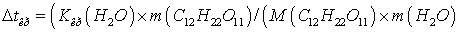
Откуда: 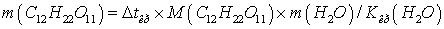
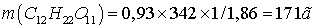 .
.
Общая масса раствора: m (
раствора ) = =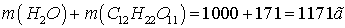 .
.
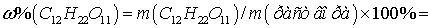
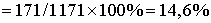 .
.
Ответ: 14,6%.
Задача 8. Реакции
выражаются схемами:
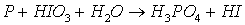
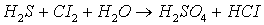
7. Составьте электронные
уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции
укажите, какое вещество является окислителем, какое – восстановителем; какое
вещество окисляется, какое – восстанавливается.
Решение:
1) 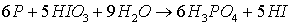
Электронные уравнения:
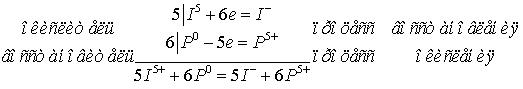
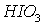 - окислитель, восстанавливается; Р – восстановитель,
окисляется.
- окислитель, восстанавливается; Р – восстановитель,
окисляется.
2) 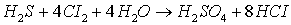 ;
;
Электронные уравнения:
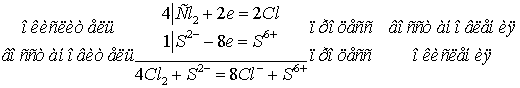
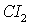 - окислитель, восстанавливается;
- окислитель, восстанавливается; 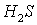 - восстановитель, окисляется.
- восстановитель, окисляется.