Влияние растворителя на качество, стабильность и биофармацевтические характеристики жидких лекарственных форм
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО
ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОУ ВПО ТВЕРСКАЯ
ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ РОСЗДРАВА
Кафедра управления и
экономики фармации, с курсами ботаники и фармакогнозии, фармацевтической
технологии, фармацевтической и токсикологической химии
Тема
«Влияние растворителя на
качество, стабильность и биофармацевтические характеристики жидких
лекарственных форм»
Студентка
фармацевтического факультета
401группы
Волкова А.С
Научный
руководитель
Кутлярова
Н.А
Заведующая
кафедрой
Д.м.н.,
проф. Демидова М.А
Тверь 2009
Содержание
Введение
1.
Жидкие
лекарственные формы (ЖЛФ)
1.1.
Преимущества и
недостатки ЖЛФ
2.
Виды растворов. Растворение
3.
Растворители,
используемые в технологии жидких лекарственных форм
3.1.
Требования предъявляемые
к растворителям
3.2.
Классификация
растворителей
4. Неводные растворители
4.1 Летучие растворители
Пропиленгликоль (Propylenglycolum)
4.5.
Полиэтиленоксид-400 (Polyaethylenoxydum-400)
4.6
Эсилон-4 и эсилон-5 (Aesilonum)
4.7 Бензилбензоат
(Benzylii benzoas)
4.8 Диметилсульфоксид,
димексид, ДМСО (Dimethyl sulfo-xidum, Dimexidum, DMSO)
4.9 Масло вазелиновое,
жидкий парафин (Oleum vaselini, Paraffinum liquidum)
4.10 Глицерин
(Glycerinum)
4.11 Масла жирные (Olea
pinguia)
4.12 Эфир медицинский
(Aethes medicinalis)
4.13 Хлороформ (
Chloroformium)
4.14 Этиловый спирт (Spiritus aethylicis, Spiritus vini)
4.15 Деминерализованная вода (Aqua demineralisata)
4.16 Вода для инъекций (Aqua pro injectionibus)
4.17 Дистиллированная
вода (Aqua destillata)
4.18 Другие растворители
5. Растворение
6.
Стабилизация растворов
7. Биофармацевтические
характеристики
8. Оценка качества и
оформление к отпуску
Заключение
Список литературы
Введение
Ключевые слова - раствор, растворитель, растворимость -
встречаются в профессиональном языке многих специальностей. Действительно,
растворы широко используются в промышленности, сельском хозяйстве, медицине и
научных лабораториях различного профиля. В производстве многих цветных и редких
металлов, полимерных и лакокрасочных материалов, минеральных удобрений
используют растворы. Воды Мирового океана представляют собой растворы. С
растворами связаны все физиологические и биохимические процессы, так как
внутренней средой всех живых организмов на Земле являются водные растворы.
Многие специалисты считают, что жизнь на нашей планете (образование
белковоподобных соединений из неорганических веществ) зародилась в водном
растворе. Уместно напомнить, что ранние христиане сделали эмблемой Христа, а
также эмблемой христиан вообще изображение рыбы. Это связано с тем, что
идеологи христианства также считали, что жизнь произошла из воды и потому рыба
была взята в качестве символа зарождения жизни. Вода как вещество и
растворитель давно привлекла внимание людей. Уже древние философы, в частности
Аристотель (384-322 гг. до н.э.), считали воду одной из основ (элементов)
природных веществ. Алхимики придавали большое значение любым жидкостям и
растворам. Они рано осознали, что многие химические превращения легче протекают
в растворах, чем в твердом состоянии. Древние химики часто называли водой почти
все жидкое, включая и растворы. Исключение составляла ртуть, которая в широких
интервалах температур сохраняет жидкое состояние и характеризуется способностью
растворять многие металлы, в том числе и золото. Понимая важное значение
растворов в превращениях веществ, алхимики усиленно занимались поисками
растворителя, который мог бы растворять любое твердое тело. Они называли
вожделенный растворитель универсальным (menstruum universale) или алькаэстом
(alcahest). Усилия в этом направлении привели к обнаружению многих новых
растворителей, большинство из которых мы теперь называем органическими. Под
растворением алхимики понимали все операции, приводящие к образованию
жидкостей. Потребовалось много времени, чтобы осознать превращение веществ,
происходящее при взаимодействии с растворителем (например, растворение металла
в кислоте), и отличить его от растворения, которое не связано с химическим
превращением растворяемого вещества. Последнее при испарении растворителя
позволяет выделить исходное вещество в неизменном виде. Растворившийся в
кислоте металл испарением растворителя невозможно вернуть в исходное состояние.
Лекарственное лечение неразрывно связано с вопросом выбора рациональной формы,
в которой лекарственное вещество или комплекс веществ должны дать лечебный (или
профилактический) эффект. Очевидно, что одновременно с расширением и изменением
каталога лекарственных веществ и совершенствованием методов лечения расширялась
номенклатура лекарственных форм и совершенствовалась их технология. Очевидно,
что чем большими преимуществами обладает та или иная лекарственная форма, тем
большую ценность она представляет как структурная единица фармакотерапии и как
промышленная единица. Лекарственная форма - это материальная форма проявления
диалектического единства действующих и вспомогательных веществ и
соответствующих технологических операций. Биофармация, обосновав научную
трактовку лекарственной формы, требует тщательного исследования соответствия
указанных компонентов (действующие и вспомогательные вещества, методы приготовления)
в лекарственной форме для обеспечения оптимального действия препарата, иными
словами, получения для нужд клиник наиболее рациональных лекарственных форм. В
настоящее время не подлежит сомнению, что оптимальная активность лекарственного
вещества достигается только назначением его в рациональной, научно обоснованной
лекарственной форме.
1.
Жидкие лекарственные формы (ЖЛФ)
Жидкие
лекарственные формы (ЖЛФ)
– препараты, получаемые смешиванием или растворением действующих веществ в
растворителе, а также путем извлечения действующих веществ из растительного
материала.
По
физико-химической природе ЖЛФ – свободные, всесторонне дисперсные системы, в
которых лекарственное вещество (дисперсная фаза – твердая, жидкая или
газообразная – solvendum) равномерно распределено в жидкой дисперсионной среде
(растворителе – solvens).
Жидкие
лекарственные формы (ЖЛФ) аптек составляют более 60% от общего числа всех
лекарственных препаратов, приготовляемых в аптеках. Изготовление ЖЛФ
регламентируется N 308 от 21 октября 1997 г «ОБ УТВЕРЖДЕНИИ ИНСТРУКЦИИ ПО
ИЗГОТОВЛЕНИЮ В АПТЕКАХ ЖИДКИХ ЛЕКАРСТВЕННЫХ ФОРМ»
1.1
Преимущества и недостатки ЖЛФ
Широкое
применение ЖЛФ обусловлено целым рядом преимуществ перед другими лекарственными
формами:
·
благодаря
применению определённых технологических приёмов (растворение, пептизация,
суспендирование или эмульгирование) лекарственное вещество, находящееся в любом
агрегатном состоянии, может быть доведено до оптимальной степени дисперсности
частиц, растворено или равномерно распределено в растворителе, что имеет
большое значение для оказания лечебного действия лекарственного вещества на
организм и подтверждено биофармацевтическими исследованиями;
·
жидкие
лекарственные формы, отличаются большим разнообразием состава и способов
применения;
·
в составе ЖЛФ
возможно снижение раздражающего действия некоторых лекарственных веществ
(бромидов, йодидов и т.д.);
·
данные
лекарственные формы просты и удобны для применения;
·
в ЖЛФ возможна
маскировка неприятного вкуса и запаха лекарственных веществ, что особенно важно
в детской практике;
·
при приёме внутрь
они всасываются и действуют быстрее, чем твёрдые лекарственные формы (порошки,
таблетки и др.), действие которых проявляется после растворения их в организме;
·
мягчительное и
обволакивающее действие ряда лекарственных веществ наиболее полно проявляется в
виде жидких лекарств.
Вместе
с тем, жидкие лекарства имеют ряд недостатков:
·
они менее
стабильны при хранении, так как в растворенном виде вещества более
реакционноспособны;
·
растворы быстрее
подвергаются микробиологической порче, соответственно у них ограниченый срок
хранения – не более 3-х суток;
·
ЖЛФ требуют
достаточно большого времени и специальной посуды для приготовления, неудобны
при транспортировке;
·
жидкие лекарства
уступают по точности дозирования другим лекарственным формам, так как
дозируются ложками, каплями.
Таким
образом, ЖЛФ широко распространенная сегодня лекарственная форма. Благодаря
своим достоинствам жидкие лекарства и в будущем имеют большие перспективы при
создании новых лекарственных препаратов, поэтому изучение данной темы весьма
целесообразно для будущих провизоров.
Кроме
того, такой недостаток ЖЛФ, как нестабильность при хранении, не позволяет
сократить количество экстемпоральных лекарственных препаратов и увеличить
количество готовых жидких лекарств, поэтому остается весьма актуальным изучение
аптечной технологии ЖЛФ.
2.
Виды растворов.
Растворение
Истинные растворы
Такие растворы характеризуются полной гомогенностью благодаря
одинаковым размерам частиц растворенного вещества и растворителя и отсутствию
поверхностей раздела между ними. Истинные растворы — это однофазные дисперсные
системы. Истинные растворы характеризуются большой прочностью связи между
растворенной жидкостью и растворителем. Растворенная жидкость (вещество) в
дальнейшем не отделяется от растворителя, остается равномерно распределенной в
растворителе. Истинный раствор сохраняет гомогенность неопределенно долгое
время, если только в нем не происходит никаких самопроизвольных вторичных процессов
(например, гидролиза, окисления, фотосинтеза). Истинные растворы бывают
ионно-дисперсными и молекулярно-дисперсными. Размер частиц в первых составляет
менее 1 нм, а растворенное вещество находится в виде отдельных гидратированных
ионов и молекул в равновесных количествах. Истинные растворы всегда прозрачны,
они не должны содержать взвешенных частиц и осадка. Особенностью истинных
растворов является то, что они гомогенны даже при рассматривании в электронный
микроскоп. Компоненты, входящие в их состав, не могут быть разделены никаким
способом. Истинные растворы хорошо диффундируют. К этой группе относятся
растворы электролитов и неэлектролитов, таких как глюкоза, натрия хлорид,
спирт, магния сульфат и т.д.
Истинные растворы высокомолекулярных соединений являются
молекулярно-дисперсными системами, которые образованы дифильными
макромолекулами. С одной стороны, они являются однофазными гомогенными
системами (как и истинные растворы), а с другой — имеют некоторые особенности,
сближающие их с коллоидными растворами (движение молекул, подобное
броуновскому, малые скорости диффузии, неспособность к диализу, повышенная
способность к образованию молекулярных комплексов и некоторые другие).
Суспензии (suspensio) — это такие системы, которые состоят
из раздробленного твердого вещества и жидкой фазы. Размер частиц в них
колеблется от 0,1 до 50 мкм и более (грубодисперсные системы). Суспензии
гетерогенны, но в отличие от коллоидных растворов это мутные жидкости, частицы
которых видны под обычным микроскопом. Эти жидкости седиментируют, их частицы
задерживаются даже крупнопористыми фильтрующими материалами. Они не склонны к
диализу и диффузии.
Эмульсии (emulsus) представляют собой дисперсные
системы, в которых и дисперсная фаза, и дисперсионная среда представлены
взаимонерастворимыми или мало взаиморастворимыми жидкостями. Эмульсии относятся
к грубодисперсным системам, в которых размер дисперсных частиц (капелек)
колеблется в пределах от 1 до 150 мкм, но в некоторых случаях они бывают и
более высокодисперсными.
Комбинированныe дисперсныe системы включают экстракционные
лекарственные формы (настои, отвары, слизи). В них действующие вещества могут
находиться как в растворенном виде, так и в виде тонких суспензий и эмульсий.
Кроме того, комбинированные дисперсные системы могут получаться в результате
сочетаний веществ, по-разному распределяющихся в жидкой среде.
Жидкие лекарственные формы делят на :
·
препараты для
наружного,
·
внутреннего
·
инъекционного
применения.
Жидкие лекарственные формы для внутреннего применения
называются микстурами (от лат. mixturae — «смешивать»), дисперсионной средой в
них является только вода. Микстуры содержат три ингредиента и более. Грубые
дисперсии (частицы размером 5—10 мкм), быстрооседающие и поэтому перед
употреблением взбалтываемые, в аптечной практике обычно называют взбалтываемыми
микстурами — mixturae agitandae (от лат. agito — «трясти»). Более тонкие
растворы, по степени дисперсности приближающиеся к золям, называют микстурами
мутными — mixturae turbidae (от лат. turbidus — «мутный»).
Микстуры, как правило, дозируются столовыми (15 мл),
десертными (10 мл) и чайными (5 мл) ложками. Растворы для приема внутрь
назначают обычно в количестве 5—15 мл, а также в каплях, которые перед
употреблением разводят небольшим количеством воды или молока (масляные
растворы).
Жидкие лекарственные формы для наружного применения
назначаются в виде полосканий, примочек, растираний, клизм, капель.
Дисперсионной средой в них, кроме воды, могут быть этанол, глицерин, различные
масла и другие жидкости.
Растворение
Растворение
(перемешивание жидкостей, а также жидкостей и твердых тел) — основная стадия
изготовления растворов, применяемых наружно, внутрь и в виде инъекций, —
является довольно частой операцией при изготовлении лекарств. Наиболее важным
из всех физико-химических свойств веществ является их способность растворяться
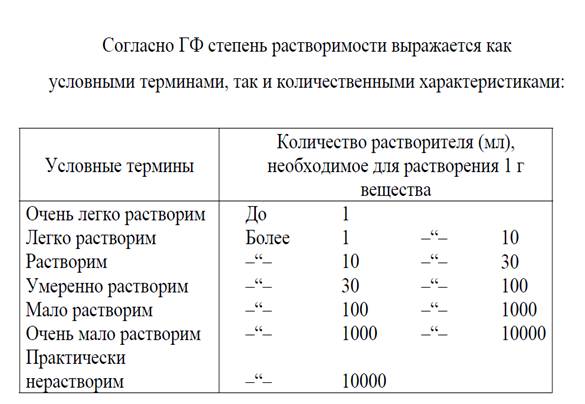
в воде или других растворителях, т.е. растворимость. Растворимость
количественно определяется концентрацией насыщенного раствора при данных
условиях. Она может быть выражена теми же способами, что и концентрация (в
процентах растворенного вещества или в молях на литр раствора), однако наиболее
часто растворимость выражают числом граммов данного вещества, растворяющихся в
100 мл растворителя при определенной температуре. Показатели растворимости в
разных растворителях приведены в частных статьях. Так, например, кислота
ацетилсалициловая мало растворима в воде (растворима в горячей воде), легко - в
спирте, в растворах едких и углекислых щелочей.
Огромную
роль при перемешивании жидкостей и приготовлении растворов играет природа
растворяемого вещества и растворителя. Одно и то же вещество в разной степени
растворимо в различных растворителях, и наоборот — различные вещества
смешиваются с одним и тем же растворителем по-разному.
С
практической стороны важным руководящим правилом, позволяющим до известной
степени разобраться в общих закономерностях растворимости, является давний
принцип — “подобное растворяется в подобном” установленный еще алхимиками.
(«Similia similibus solventur»).
Любой раствор состоит из растворенного вещества и
растворителя, т.е. среды, в которой это вещество равномерно распределено в виде
молекул или еще более мелких частиц — ионов. Но не всегда легко определить,
какое из веществ является растворителем, а какое — растворенным веществом. Как
правило, растворителем считают тот компонент, который в чистом виде существует
в том же агрегатном состоянии, что и полученный раствор. Например, в случае
водного раствора натрия хлорида растворителем является вода. В том случае, если
оба компонента до растворения находились в одинаковом агрегатном состоянии
(например, вода и спирт), то растворителем обычно считается компонент, взятый в
большем количестве.
3.
Растворители,
применяемые в технологии жидких лекарственных форм.
Растворители — индивидуальные химические
соединения или их смеси, способные растворять различные вещества, то есть
образовывать с ними однородные системы переменного состава двух или большего
числа компонентов Для систем жидкость-газ и жидкость-твёрдое тело растворителями принято считать
жидкофазный компонент; для систем жидкость-жидкость и твердое тело-твердое тело — компонент, находящийся в избытке.
К
растворителям относятся вещества, обладающие свойствами:
·
обладающие
активной растворимостью;
·
неагрессивны к
растворяемому веществу и аппаратуре;
·
отличающиеся
минимальной токсичностью и огнеопасностью;
·
доступны и
дешевы.
3.1
Требования, предъявляемые к растворителям
В
принципе, любое вещество может быть растворителем для какого-либо другого
вещества. Однако на практике к растворителям относят только такие вещества,
которые отвечают определённым требованиям.
·
должны быть
устойчивыми при хранении, химически и фармакологически индифферентными
·
должны обладать
высокой растворяющей способностью
·
должны быть
дешевыми, общедоступными и иметь простой способ получения
·
не должны
обладать неприятным вкусом и запахом
·
не должны быть
огнеопасными и летучими
·
не должны служить
средой для развития микроорганизмов
В
зависимости от отрасли промышленности к растворителям предъявляют различные
другие требования, обусловленные особенностями производства. Так, например, для
экстракции пригодны растворители, обладающие избирательной растворяющей
способностью; в электрохимических процессах необходимы растворители, устойчивые
в рабочем диапазоне электродных потенциалов.
Требования безопасности предъявляемые к растворителям.
Почти
все растворители физиологически активны, многие органические к тому же пожаро-
и взрывоопасны. Ароматические углеводороды, галогенпроизводные, амины,
кетоны при значительных концентрациях могут вызывать серьёзные отравления,
приводить к различным кожным заболеваниям (дерматиты, опухоли). Для многих промышленных
органических растворителей разработаны технические условия по обеспечению как
противопожарной безопасности при работе с ними, так и личной защиты от их
физиологически вредных воздействий.
3.2.
Классификация
растворителей
Существуют
несколько подходов к классификации растворителей. Для этого обычно выбирают
какой-то один (реже несколько) характерный признак растворителей, оставляя в
стороне другие. Таким образом, заранее нельзя ожидать безупречной
классификации, так как любая из них будет условной. Поскольку вода является
уникальным растворителем, то ее часто не включают ни в одну из классификаций, а
оставляют как эталон для сравнения. Некоторые системы классификации основаны на
физических свойствах растворителей. В их основу положены такие параметры, как
диэлектрическая проницаемость, вязкость, температура кипения растворителей, а
также дипольные моменты молекул растворителей.
Растворы
бывают
·
ненасыщенные,
·
насыщенные
·
пересыщенные.
Ненасыщенным
называется раствор, у которого граница растворимости не достигнута.
Насыщенный
раствор — это раствор, содержащий максимально возможное при определенных
условиях количество вещества.
Пересыщенный
— это раствор, в котором содержится растворенного вещества больше того количества,
что соответствует его нормальной растворимости при данных условиях .
В
аптечных условиях чаще готовят ненасыщенные растворы, реже — насыщенные и
пересыщенные, так как они являются нестойкими системами. Кроме растворов
твердых и жидких лекарственных средств, применяются еще некоторые растворы
газов в воде, например, аммиака(10—25 %), хлористого водорода (25 %),
формальдегида (36,5—37,5 %) и т. д. В аптеках эти концентрированные растворы в
меру необходимости разводятся водой или другим растворителем до указанной в
рецепте концентрации.
Однако наиболее распространенные классификации основаны на
химических свойствах растворителей. Перечислим некоторые из них.
1.
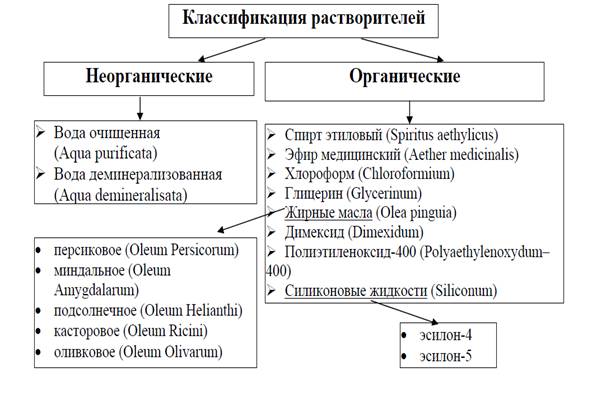
Классификация на неорганические и органические растворители. К числу
неорганических растворителей относятся: вода - самый распространённый
растворитель в природе, жидкий аммиак — хороший растворитель для
щелочных металлов, производные фосфора, серы, солей, аминов. Большое значение имеют
многочисленные органические растворители. Это, прежде всего, углеводороды и их галогенопроизводные, спирты, простые и сложные эфиры, кетоны, нитросоединения.
2. Классификация на основе кислотно-основных свойств. Здесь
особую роль отводят кислотно-основным представлениям Бренстеда-Лоури.
Растворители делят на протонные и апротонные. К протонным относят растворители,
которые проявляют протон-донорную или протон-акцепторную функцию по отношению к
растворенному веществу. В зависимости от этого протонные растворители, в свою
очередь, делят на протогенные (способные поставлять протоны), протофильные
(способные принимать протоны) и амфипротонные (способные как поставлять, так и
принимать протоны).
4. Классификация по способности растворителей к образованию
водородных связей, поскольку при взаимодействии ионов с молекулами
растворителей важную роль играют именно эти связи. По этой классификации
растворители разделены на пять групп.
·
К первой
относятся жидкие растворители, способные к образованию объемной трехмерной
сетки водородных связей (муравьиная кислота, гликоли и т.п.).
·
Ко второй
относятся растворители, в которых образуется двумерная сетка водородных связей.
Они, как правило, содержат одну группу ОН (фенолы, одноатомные спирты,
одноосновные низшие карбоновые кислоты, за исключением муравьиной).
·
К третьей группе
относятся растворители, которые имеют в своем составе электроотрицательные
атомы азота, кислорода, серы, фтора, способные участвовать в образовании
водородных связей (эфиры, тиоэфиры, амины, кетоны, альдегиды и др.).
·
К четвертой
группе относятся растворители, молекулы которых имеют атом водорода, способный
к образованию водородных связей, но не имеют атомов, которые могли бы быть
акцепторами протонов (хлороформ, дихлорэтан и т.п.).
·
К пятой группе
относятся растворители, молекулы которых при обычных условиях не способны к
образованию водородных связей ни в качестве доноров, ни в качестве акцепторов
протонов (углеводороды, четыреххлористый углерод и т.п.).
Среди
весьма большого количества жидкостей, используемых в фармацевтической
технологии в качестве растворителей, наибольшее значение для аптечного способа
изготовления лекарств имеют дистиллированная вода, вода для приготовления
инъекций, деминерализованная вода, этиловый спирт, эфир, жирные масла, глицерин,
вазелиновое масло.
Новые
синтетические растворители типа полиэтиленоксидов и пропиленгликоля,
диметилсульфоксида, диметилформамида, бензилбензоата, этилолеата , нашедшие в
последние два десятилетия весьма заметное распространение в заводском
производстве лекарств, к сожалению, до сих пор практически не используются в
условиях аптек.
В
зависимости от природы растворителя выделяют водные и неводные растворы
4. Неводные растворители
В медицинской практике широкое применение находят растворы на
неводных растворителях (неводные растворы) в качестве примочек, полосканий,
смазываний, обмываний, интраназальных капель, ингаляций.
Для получения растворов из веществ,
нерастворимых в воде или трудно растворимых, для пролонгирования действия,
повышения стабильности, устранения гидролиза применяют неводные растворители.
Наиболее часто на практике встречаются:
1.
масла жирные
растительного происхождения (миндальное и персиковое);
2.
эфиры простые и
сложные (этилолеат);
3.
спирты
одноатомные и многоатомные (этанол 2—30%-ный, поливинол, сорбит, маннит);
4.
амиды
(диметиламид, бета-оксиэтиллактамид);
5.
сульфоксиды и
сульфон (диметилсульфоксид, сульфолан).
Неводные растворы представляют собой гомогенные дисперсные
системы, структурными единицами в которых являются ионы и молекулы. Для
приготовления таких растворов используются неводные растворители, что
обусловлено главным образом тем, что многие лекарственные вещества не
растворяются в воде. В большинстве случаев неводные растворы используют для
наружного применения (например, для смазывания слизистых оболочек, кожных
покровов, примочек, ингаляций, полосканий, промываний, капель для носа и уха,
втираний). Значительно реже они применяются внутрь. Так же, как и к водным, к
ним предъявляются определенные требования. Неводные растворы должны
соответствовать медицинскому назначению для достижения необходимого лечебного
эффекта, не содержать механических включений, быть стабильными при хранении.
Кроме общих требований, к неводным
растворителям предъявляются дополнительные, такие как:
1.
прозрачность;
2.
термостойкость
(температура кипения более 100 °С, а замерзания не выше +5 °С);
3.
биологическая
совместимость (по величине рН и осмотического давления);
5.
стабильность;
6.
вязкость и
текучесть растворителей не должны нарушать всасывание, затруднять фильтрование
и наполнение ампул для готовых растворов.
В состав этой группы растворов входят различные лекарственные
вещества, однако в основном это антисептики, местные анестетики,
противомикозные, антибактериальные, противовоспалительные и болеутоляющие
средства.
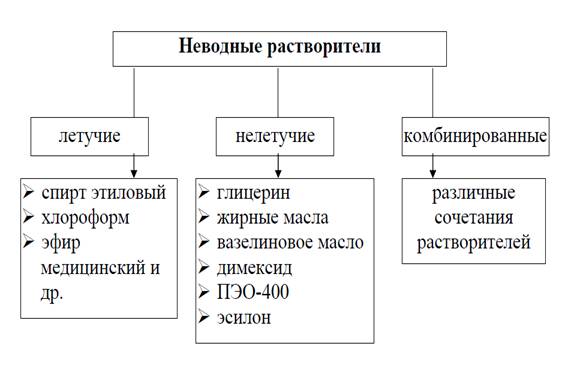
С технологической точки зрения неводные растворители делят на
две группы:
·
летучие
растворители (спирт этиловый, хлороформ, эфир, бензин, скипидар, и др.)
·
нелетучие
растворители (жирные масла, жидкий парафин, глицерин, димексид,
полиэтиленоксиды, эсилоны и др.).
·
комбинированные
растворители (этанол с глицерином, глицерин с димексидом, водой и др.).
Преимуществами их являются возможность сочетания в одной
лекарственной форме нескольких действующих веществ с различной растворимостью,
использование неводных растворителей одновременно в качестве лечебных средств.
Неводные растворы просты в изготовлении, разнообразны по способам назначения,
более стабильны при хранении, чем водные. Качество неводных растворов и выбор
технологических приемов их изготовления зависят главным образом от
физико-химических свойств растворителей. Неводные растворители отличаются друг
от друга химической структурой, наличием и количеством функциональных групп,
диэлектрической проницаемостью, различной растворяющей способностью по
отношению к лекарственным веществам и, как следствие, различной стабильностью,
степенью химической и фармакологической индифферентности. Несмотря на столь
большое разнообразие, все они отвечают требованиям, предъявляемым к
растворителям лекарственных препаратов. В отличие от большинства водных при
приготовлении неводных растворов во флакон помещают сначала растворяемое
вещество (в случае, если вещество рыхлое и объемистое, то с этой целью
используют сухую воронку), а затем растворитель. Процеживание неводных
растворов производят лишь в самом крайнем случае через маленький ватный тампон
при помощи воронки, прикрытой стеклянной пластинкой или часовым стеклом.
Особенно нежелательно процеживание эфирных растворов, так как потери эфира
особенно велики. В случае, если процеживание все же необходимо, то после его
осуществления раствор следует взвесить и восполнить убыль путем добавления
чистого эфира. Тара должна быть обязательно сухой, так как вода плохо смешивается
с органическими растворами (кроме спирта и глицерина), изменяет их растворяющую
способность и часто ускоряет порчу большинства растворителей (эфира, хлороформа
и др.).
4.1
Летучие растворители
4.1.1
Эфир медицинский (Aethes medicinalis)
Эфир медицинский (ГФХ, статья № 34). Это бесцветная,
легко подвижная летучая жидкость своеобразного запаха и вкуса, хорошо
смешивается со спиртом, жирными и эфирными маслами. Использование эфира как
растворителя требует соблюдения ряда предосторожностей вследствие легкой
воспламеняемости препарата и взрывоопасноеTM его паров. В
фармацевтической практике применяется только эфир, удовлетворяющий требованиям
ГФХ в отношении чистоты и окраски. В качестве вспомогательного вещества эфир
используется в самых различных фармацевтических процессах - при извлечении,
растворении, облегчении измельчения ряда твердых лекарственных веществ и т. д.,
а также при изготовлении лекарственных форм, главным образом для внутреннего и
наружного применения. Хранят эфир в склянках оранжевого стекла, в прохладном,
защищенном от света и открытого пламени месте.
4.1.2
Хлороформ ( Chloroformium)
Хлороформ
–это бесцветная,
прозрачная, тяжелая, подвижная, летучая жидкость с характерным запахом и
сладким жгучим вкусом. Смешивается во всех соотношениях с безводным спиртом,
эфиром, бензином. Малорастворим в воде (1 : 200). Плотность 1, 474 - 1, 483.
Температура кипения +59 - 62 'С. Светочувствителен. На свету медленно
разлагается с образованием водорода хлорида и высокотоксичного фосгена ,
который в свою очередь разлагается на хлор и оксид углерода. Хранят по правилам
препаратов списка Б в хорошо укупоренных емкостях. Используется, главным
образом, в лекарственных формах для наружного применения. В неводных растворах
хлороформ обычно прописывают в комбинации с каким-либо основным растворителем:
спиртом этиловым, жирными маслами и др. Более широко он используется в
технологии линиментов. В отличие от спирта этилового хлороформ дозируют по
массе.
4.1.3 Этиловый спирт (Spiritus aethylicis, Spiritus vini)
Этиловый спирт (ГФХ, статьи № 631, 632). Официнальными являются
растворы этилового спирта 95%, 90%, 70%, 40% (в случае отсутствия сведений о
концентрации спирта при приготовлении рецепта ГФХ предписывает пользоваться
спиртом 90% концентрации). Этиловый спирт получается в результате брожения
крахмалсодержащего сырья, главным образом картофеля и зерна. После очистки от
различных примесей и укрепления путем применения специальной технологии (ректификация)
получают спирт нужной концентрации, удовлетворяющей требованиям ГФХ.
Чистый
этиловый спирт представляет собой легко подвижную прозрачную жидкость с
характерным спиртовым запахом и жгучим вкусом. Он летуч, легко воспламеняется.
Этиловый спирт является прекрасным растворителем для большой группы
лекарственных веществ - эфирных масел, органических кислот, смол, йода и т. д.
и легко смешивается с другими растворителями - водой, глицерином, диэтиловым
эфиром, хлороформом и т. д. При смешении спирта с водой наблюдается
разогревание смеси и уменьшение ее объема по сравнению с суммой объемов,
составляющих смесь (явление контракции), зависящее каждый раз от соотношения в
смеси объемов спирта и воды. Это явление требует при получении водно-спиртовых
растворов необходимой концентрации проведения каждый раз предварительных
расчетов по соответствующим формулам пли с применением специальных таблиц,
имеющихся в приложении ГФХ.
Как
растворитель этиловый спирт находит широчайшее применение в фармацевтической технологии
главным образом для приготовления растворов для наружного и внутреннего
использования, а в ряде случаев для приготовления инъекционных лекарств. В
связи со значительной зависимостью растворяющей способности этилового спирта от
его концентрации - процентного содержания абсолютного (безводного) спирта в
спиртовом растворе - при использовании водно-спиртовых растворов необходимо
знать его концентрацию (в аптечной практике применяют только растворы спирта,
главным образом водные; в заводских условиях все шире используют абсолютный,
безводный этиловый спирт). Концентрация спиртового раствора обычно выражается в
процентах по массе, показывающих содержание безводного спирта (в граммах) в 100
г спиртового раствора, или в процентах по объему, показывающих содержание
абсолютного спирта (в миллилитрах) в 100 мл спиртового раствора. Перевод
процентов по объему в проценты по массе и обратно, нередко имеющий место в
практической деятельности фармацевтов, осуществляется по специальным формулам.
Учет
спирта ведется по массе.
В физиологическом отношении спирт является далеко не
индифферентным вспомогательным веществом, что следует иметь в виду при его
использовании. Спирт этиловый и его водные растворы применяют
для растворения многих лекарственных веществ(органических кислот, оснований
алкалоидов, эфирных масел, йода, камфоры, резорцина, ментола, перекиси
водорода, формалина и других веществ). Спирт этиловый может применяться и как
лекарственное средство, имеющее дезинфицирующее, освежающее и раздражающее свойства,
для компрессов и т. д.
Спиртовые
растворы, начиная с 15-20%, обладают бактериостатическим и бактерицидным
свойством, что позволяет применять их в целях дезинфекции аптечной посуды,
хирургического инструментария, рук и т. д. В фармакологическом отношении спирт
является представителем группы веществ наркотического действия. С
биофармацевтической точки зрения необходимо учитывать возможное взаимодействие
спирта с компонентами лекарственной формы и существенное влияние на процессы
абсорбции препарата при любых способах введения. Это последнее обстоятельство
может существенным образом изменить характер кинетики лекарственных веществ в
присутствии спирта, изменить их биологическую доступность, а следовательно, и
терапевтическую эффективность. (Назначение спиртовых растворов ряда препаратов
внутрь, например, в одних случаях характеризуется резким усилением процессов
абсорбции, а в других - снижением их интенсивности.) Растворы этилового спирта
любой концентрации обычно хранят в хорошо закупоренных стеклянных бутылях (для
предупреждения испарения), в прохладном месте, вдали от огня.
Свойства
спирта как растворителя
·
Является хорошим
растворителем алкалоидов, гликозидов, эфирных масел, смол и др. веществ,
которые в воде растворяются плохо.
·
Значительно
труднее, чем вода, проникает через стенки клеток (отнимая воду и белков, спирт
превращает их в осадки, закупоривавших поры клеток и таким образом ухудшается
диффузия) чем ниже концентрация спирта, тем легче он проникает внутрь клеток.
·
Чем крепче спирт,
тем менее возможен гидрометич. процесс. Спирт инактивирует ферменты.
·
Является
бактерицидной средой. В растворах, содержащих ≥ 20% спирта, не
развиваются ни микроорганизмы, ни плесени.
·
Спирт
фармакологически неиндифферентен. Он оказывает как местное, так и общее действие,
что необходимо учитывать при производстве извлечений.
·
Спирт достаточно
летуч и спиртовое извлечение легко сгущается до густых жидкостей и
порошкообразных веществ. Выпаривание и сушка - под вакуумом.
·
Спирт огнеопасен.
·
Спирт является
лимитирующим продуктом
4.2
Нелетучие растворители
4.2.1
Масло вазелиновое, жидкий парафин (Oleum vaselini, Paraffinum liquidum)
Масло вазелиновое, жидкий парафин (ГФХ, статья № 481). Это бесцветная,
без запаха и вкуса, прозрачная вязкая жидкость, являющаяся продуктом
переработки нефти.Масло вазелиновое нерастворимо в воде и спирте. Хорошо
смешивается с хлороформом, эфиром, жирными маслами, кроме касторового. В
медицинской практике используется масло вазелиновое специальной очистки,
удовлетворяющее требованиям ГФХ в отношении содержания возможных примесей
(вода, твердый парафин, органические вещества, сульфиды и т. д.). В масле
вазелиновом в различной степени растворяются многие лекарственные вещества,
например йод, фенол, тимол, камфора, йодоформ, бензойная кислота, атропин-основание
и т. д.Вазелиновое масло практически не всасывается в поверхности кожи и
слизистых оболочек и, как правило, в чистом виде замедляет всасывание самых
различных лекарственных веществ. В медицинской практике вазелиновое масло
применяется в качестве слабительного средства (для приема внутрь) и для
приготовления ряда лекарственных форм для наружного использования (капли, мази
и т. д.).Сохраняют вазелиновое масло в стеклянной таре, в защищенном от света
месте.
4.2.2
Глицерин (Glycerinum)
В медицинской практике обычно применяют глицерин, содержащий
12-16% воды. Это бесцветная, прозрачная, не имеющая запаха вязкая жидкость
сладковатого вкуса, обладающая выраженной растворяющей способностью в отношении
значительного числа лекарственных веществ. В глицерине хорошо растворяются
танин, атропина сульфат, калия йодид, гексаметилентетрамин, анестезин, борная
кислота, ацетилсалициловая кислота, натрия гидрокарбонат, цинка сульфат и т. д.
Глицерин нерастворим в жирных маслах, практически нерастворим в эфире, но
смешивается во всех соотношениях с водой и этиловым спиртом не растворим в
эфире и жирных маслах.. Препарат весьма гигроскопичен. Глицериновые растворы широко
применяются в качестве различных смазываний. В виде глицериновых растворов
прописывают кислоту борную, натрия тетраборат, йод, танин, ихтиол и другие
вещества. Глицерин обладает значительной вязкостью, поэтому приготовление
глицериновых растворов может происходить при подогревании и без подогревания,
что полностью зависит от термолабильности входящих лекарственных веществ. При
подогревании до 40—50 °С вязкость глицерина снижается и процесс растворения ускоряется.
Натрия тетраборат и кислоту борную лучше растворять в подогретом глицерине, при
растворении они образуют глицероборную кислоту, которая придает растворам
кислую реакцию. Для нейтрализации глицероборной кислоты часто наряду с кислотой
борной прописывают натрия гидрокарбонат. Прибавлять его следует осторожно
небольшими порциями, так как реакция нейтрализации протекает бурно и может
происходить разбрызгивание раствора. Входит
в состав извлекаемых смесей, самостоятельно не используется. Глицерин сохраняют
в широкогорлых плотно закрывающихся штангласах.
4.2.3
Диметилсульфоксид, димексид, ДМСО (Dimethyl sulfo-xidum, Dimexidum, DMSO)
В
обычных условиях это бесцветная прозрачная жидкость со слабым специфическим
запахом, напоминающим запах чеснока, жгучего вкуса. Диметилсульфоксид
неограниченно смешивается с водой, при этом температура раствора значительно
повышается.
Диметилсульфоксид
обладает высокой растворяющей способностью; в нем легко растворяются различные
препараты: пенициллин, левомицетин, норсульфазол, бутадион, ацетилсалициловая
кислота, фуразолидон. фарагин, гидрокортизон, различные краски, пигменты и
газы. В растворах диметилсульфоксида, как правило, меняются стабильность
препарата и его абсорбционные свойства. Обладая сам высокой пенетрирующей
(проникающей) активностью, диметилсульфоксид резко ускоряет всасывание
неповрежденными кожей и слизистыми оболочками многих лекарственных веществ. При
этом нередко меняется не только их фармакокинетика, но может иметь место
потенцирование действия препарата.
Диметилсульфоксид
сам по себе оказывает разностороннее биологическое действие на организм.
Применение диметилсульфоксида в лекарственных формах требует тщательного
биофармацевтического эксперимента. Диметилсульфоксид необходимо хранить в
плотно закрытой упаковке, при комнатной температуре, тщательно защитив от
прямого солнечного света.
4.2.4
Масла жирные (Olea pinguia)
Масляные растворы, жирные масла, а также вазелиновое масло —
хорошие растворители для многих лекарственных средств, которые довольно широко
применяются в виде ушных и интраназальных капель. С целью ускорения растворения
применяют легкое подогревание. Если в масляном растворе прописано летучее
вещество, например ментол, камфора, то для устранения потери растворение
производят в предварительно подогретом масле при температуре не выше 40 °С.
Масла жирные (ГФХ, статья № 472).
Жидкие при комнатной температуре, прозрачные вязкие жидкости, представляющие
собой смеси глицеридов различных высокомолекулярных жирных кислот (главным
образом триглицериды пальмитиновой, олеиновой и стеариновой кислот). В
медицинской практике используют только масла, полученные холодным прессованием
(без поджаривания семян) и в холодных прессах. Наиболее часто применяют масло
миндальное (Oleum Amygda-larum), получаемое из семян миндаля обыкновенного
(сладкого и горького), масло персиковое (Oleum Persicorum), получаемое из семян
персика обыкновенного, абрикоса обыкновенного, сливы домашней и алычи для
приготовления инъекций; масло подсолнечное (Oleum Helianthi), получаемое из
семян подсолнечника однолетнего, масло арахисное (Oleum Arachidis), получаемое
из семян земляного ореха (арахиса), и масло кунжутное (Oleum Sesami),
получаемое из семян кунжута индийского - для внутреннего и наружного
применения.
Масла,
используемые для изготовления инъекционных лекарств, должны строго отвечать
требованиям ГФХ в отношении наличия примесей, величины кислотного числа,
прозрачности, плотности и других физико-химических показателей .
В
маслах хорошо растворяются различные препараты - ментол, камфора, фенол, ртути
йодид, фенилсалицилат, алкалоиды - основания, эфирные масла и т. д.
Применение
в качестве вспомогательных веществ (растворителей, формообразователей и т. д.)
жирных масел может вести к изменению стабильности препарата в лекарственной
форме, а также к изменению его фармакокинетической характеристики. Как правило,
в присутствии жирных масел замедляются процессы гидролитической деструкции
лекарственных веществ и скорость абсорбции в организме. Жирные масла хранят в
заполненных доверху хорошо укупоренных стеклянных емкостях и в металлических
упаковках.
4.2.5 Полиэтиленоксид-400 (Polyaethylenoxydum-400)
Полиэтиленоксид-400
является продуктом полимеризации этиленоксида в присутствии воды. Представляет
собой бесцветную, прозрачную, вязкую, гигроскопичную жидкость со слабым
характерным запахом и сладковатым вкусом. ПЭО-400 хорошо растворяется в воде,
этаноле, хлороформе, практически не растворяется в эфире. Достаточно легко
растворяет лекарственные вещества, мало- и труднорастворимые в воде (например,
кислоту бензойную и салициловую, анестезин, камфору и др.). Характерно, что
водные растворы этого полиэтиленоксида резко увеличивают растворимость
некоторых веществ (фурацилин в 26%-ном растворе ПЭО-400 растворяется в 25 раз
лучше, чем в воде дистиллированной). Препарат обладает доказанной биологической
безвредностью и антимикробной стабильностью. За счет высокой осмотической
активности ПЭО-400 нашел широкое применение при изготовлении растворов,
предназначенных для обработки гнойной раневой поверхности. Следует помнить, что
все полиэтиленоксиды, в том числе и ПЭО-400, несовместимы с такими
лекарственными веществами, как фенол, амидопирин, резорцин, танин, тимол и др.
4.2.6 Эсилон-4 и эсилон-5 (Aesilonum)
Эсилон-4 и эсилон-5 являются представителями силиконовых
полимеров. Это этиленсилоксановые жидкости, состоящие преимущественно из смеси
полимеров линейной структуры. Эсилоны во всех соотношениях смешиваются с
эфиром, хлороформом, маслами вазелиновым и растительными. С водой, этиловым
спиртом и глицерином не смешиваются. Растворимость в них неполярных,
лекарственных веществ в значительной степени зависит от вязкости силиконового
полимера. Так, ментол, камфора и фенол растворяются в эсилоне-4 в соотношении 1
: 4, а в эсилоне-5 в соотношении 1 : 10. Эсилон-4 и эсилон-5 применяют в
качестве защитных средств для кожи в форме примочек, лосьонов, кремов и т.д
4.2.7
Пропиленгликоль (Propylenglycolum).
Прозрачная
вязкая бесцветная жидкость сладковатого вкуса. Хорошо смешивается с этиловым
спиртом, водой и не смешивается с жирными маслами. Используется для
приготовления ряда инъекционных лекарств.
Вследствие
гигроскопичности пропиленгликоль, как и другие растворители, рекомендуют
хранить в плотно закрытой таре. Пропиленгликоль способен влиять на стабильность
процесса всасывания лекарственных веществ.
4.2.8
Бензилбензоат (Benzylii benzoas)
Бесцветная
маслянистая жидкость с легким ароматическим запахом и резким вкусом, хорошо
смешивается с жирными маслами, этиловым спиртом и эфиром, плохо растворяется в
воде и глицерине. В бензилбензоате хорошо растворяются многие препараты, трудно
или совсем нерастворимые в обычных растворителях (амид липоевой кислоты, тетурам).
При соблюдении определенных условий после смешения растворов этих препаратов в
бензилбензоате с другими растворителями, чаще с жирными маслами, растворы
сохраняют свою стабильность. Бензилбензоат в настоящее время разрешен в
качестве компонента сложного растворителя для приготовления некоторых инъекций.
Бензилбензоат сохраняют в плотно укупоренной таре, защищенной от действия
света.
5.
Водные растворители
Вода фармакологически индифферентна, доступна и хорошо
растворяет многие лекарственные вещества, но в то же время в ней довольно
быстро гидролизуются некоторые лекарственные вещества и размножаются
микроорганизмы. Это самый дешевый растворитель использующийся в 68% случаев
изготовления растворов (исключая настойки и отвары). Вода близка по строению и
составу к внутренней среде организма она легко всасывается в желудочно-кишечном
тракте и безболезненно проходят внутримышечные иньекции ( в отличии от масляных
растворов), возможно и внутривенное введение лекарственных веществ способных
растворяться в воде, так как достаточно легко добится необходимого уровня pH раствора (pH крови человека 7,36-7,42) в отличие от невозможности
введения других (например спиртовых) растворов.
5.1
Деминерализованная вода (Aqua demineralisata)
Деминерализованная вода получается путем обессоливания
водопроводной воды с помощью специальных ионообменных смол. Деминерализованная
вода может использоваться для мытья аптечной посуды и различных упаковок. Вода
деминерализованная не должна использоваться для парентерального применения, но
может применяться для приготовления всех жидких лекарственных форм, растворов,
реактивов. В случае использования деминерализованной воды для приготовления
глазных лекарств она должна быть простерилизована непосредственно перед
приготовлением лекарства.
В
последнее время уделяют внимание использованию воды деминерализованной вместо
дистиллированной. Это связано с тем, что электрические дистилляторы часто
выходят из строя. Высокое содержание солей в исходной воде приводит к
образованию накипи на стенках испарителя, что ухудшает условие дистилляции и
снижает качество воды. Для обессоливания воды применяется различные установки.
Принцип их действия основан на том, что вода освобождается от солей при
пропускании ее через ионно-обменные смолы. Основной частью таких установок
являются колонки, заполненные катионитами и анионитами. Активность катионитов
определяется наличием карбоксильной или сульфоновой группами, обладающие
способностью обменивать ионы Н+ на ионы щелочных и щелочноземельных
металлов. Аниониты – чаще всего продукты полим-и аминов с формальдегидом,
обменивают свои гидроксильные группы ОН на анионы. Установки также имеют
емкости для растворов кислоты, щелочи и воды дистиллированной для регенерации
смол
5.2
Вода для инъекций (Aqua pro injectionibus)
Вода для инъекций (ГФХ, статья № 74). Для приготовления
инъекционных лекарственных форм водорастворимых препаратов (а также глазных
капель, раствора для орошения и промывания раневых поверхностей) используют
воду для инъекций, которая, помимо требований, предъявляемых к дистиллированной
воде, должна удовлетворять требованию на отсутствие пирогенных веществ (под
последними понимают довольно сложные продукты жизнедеятельности
микроорганизмов, заносимые в дистиллят с мельчайшими капельками воды; следствием
попадания пирогенов с инъекцией в организм являются повышение температуры и
артериального давления, головная боль и т. д.).
Воду
для инъекций хранят в специальных условиях, исключающих возможность попадания в
нее микроорганизмов из окружающей среды (асептические условия). Вода для
инъекций пригодна для приготовления соответствующих лекарственных форм в
течение не более 24 ч с момента ее получения.
5.3
Дистиллированная вода (Aqua destillata)
Дистиллированная вода (ГФХ, статья № 73). Как известно,
питьевая вода всегда содержит примеси растворенных в ней различных химических
соединений и поэтому не пригодна для приготовления лекарств. Растворы
лекарственных веществ для наружного и внутренного применения готовят только на
дистиллированной воде.
Дистиллированная
вода является наиболее широко используемым растворителем при изготовлении
лекарств и ее качество нормируется специальной статьей ГФХ.
Дистиллированная,
вода должна быть бесцветной, прозрачной, не иметь запаха и вкуса: рН
дистиллированной воды должен быть в пределах 5,0-6,8. Дистиллированная вода не
должна содержать хлоридов, сульфатов, нитратов, нитритов, солей кальция и
тяжелых металлов. После выпаривания 100 мл дистиллированной воды остаток,
доведенный высушиванием при 100-105° С до постоянной массы, не должен превышать
0,001%. После кипячения в течение 10 мин 100 мл дистиллированной воды в
присутствии 1 мл 0,01 н. раствора калия перманганата и 2 мл разведенной серной
кислоты должно сохраняться розовое окрашивание раствора (восстанавливающие
вещества). После взбалтывания дистиллированной воды с равным объемом
известковой воды в хорошо закрытом и наполненном доверху сосуде в течение 1 ч
не должно быть помутнения (угольный ангидрид).
Для
получения дистиллированной воды в условиях аптеки используют водопроводную
воду, в сельской местности, где не имеется централизованного водоснабжения,-
воду колодезную или из артезианских скважин. В первом случае воду
непосредственно, без какой-либо обработки, подвергают дистилляции, во втором
случае необходима предварительная подготовка: умягчение, разрушение
органических примесей, связывание аммиака.
6. Комбинированные растворители
В том случае если в рецептах прописываются комбинированные
растворители (например, вода очищенная, спирт этиловый, глицерин и др.), прежде
всего ориентируются на растворимость лекарственных веществ, учитывают свойства
отдельных растворителей (летучесть, вязкость) и соответственно выбирают
наиболее целесообразные технологические приемы и их последовательность. В
расчетах принимают во внимание различные способы дозирования спирта этилового, эфира,
глицерина, димексида и др. Кроме того, объем, вытесняемый лекарственными
веществами, в случае необходимости, вычитают из объема того растворителя,
который обладает наибольшей растворяющей способностью по отношению к данному
лекарственному веществу.
7.
Другие растворители
Другие
растворители:
1.
Спирт метиловый
или древесный. Получается синтетически. По запаху напоминает этиловый. Сильный
яд: доза 15 – 20 мл смертельна. Смешивают с водой.
2.
Изопропиловый
спирт. Ядовит. Образующая смесь с водой, содержит 12,3% воды.
3.
Ацетон . Смешивается
с водой и органическими растворами.
4.
Уксусная кислота .Используется
б/в и водные растворы. Б/в при температуре <16,6ºC застывает в
кристаллы, похожие на лед. Смешивается с водой, спиртом, эфиром и другими
растворителями.
5.
Этиловый эфир. Растворяется
в 12 частях воды. Смешивается со спиртом, хлороформом, петролейным эфиром и др.
6.
Бензины (смесь
углеводородов). Важное свойство – быстро улетучиваются, очень огнеопасны.
7.
Хлороформ.
Смешивается со спиртом, эфиром, бензином. Трудно растворяется в воде (1:200).
8.
Дихлорэтан.
Смешивается со спиртом, эфиром. При вдыхании паров – отравление.
Малоогнеопасен.
9.
Четыреххлористый
углерод .Неогнеопасен.
В
качестве растворителей используются смеси различных индивидуальных веществ,
например бензины, петролейный эфир, смеси спиртов и
эфиров.
8. Стабилизация растворов
Под стабильностью понимают неизменяемость состава и
концентрации находящихся в растворе лекарственных веществ в течении
установленных сроков хранения. Стабильность зависит от качества ЛВ и качества исходных
растворителей. В ряде случаев – особая очистка ЛВ, предназначенных для инъекций
(р-р NaCI для изотонирования должен быть
дегидрогенизирован). Порошок NaCI
нагревают в стеклянной или фарфоровой открытой посуде, воздушных стерилизаторах
при t = 1800С 2 часа при
толщине слоя не более 6-7см. Срок использования 24 часа. Стабильность
достигается соблюдением оптимальных условий стерилизации, использованием
допустимых консервантов, которые позволяют достигать необходимый эффект
стерилизации при более низкой температуре. Стабильность достигается применением
стабилизаторов, соответствующих природе ЛВ.
Реакция
среды водного раствора влияет не только на химическую стабильность, но и на
жизнедеятельность бактерий. Сильнокислая и сильнощелочная среда является консервантом.
Но эти среды создают возможность химических изменений веществ – гидролиз, окисление,
омыление, которые усиливаются при стерилизации, следовательно, для каждого ЛВ
создаётся такое значение рН, которое позволяет сохранить их стабильность до и
после стерилизации и при их хранении.
При хранении некоторые лекарственные вещества теряют
первоначальную структуру, изменяют свои свойства при тепловой стерилизации, в
растворах могут протекать нежелательные химические реакции (гидролиз,
изомеризация, фотохимические и окислительно-восстановительные реакции).
Стабилизировать растворы можно физическими и химическими способами.
Физические способы:
1.
подбор ампул из
химически стойкого материала (например, замена стекла на полимер);
2.
раздельное
ампулирование вещества и растворителя;
3.
соблюдение
принципа газовой защиты.
Химические способы:
1.
добавление
антиоксидантов;
2.
добавление
стабилизаторов.
9.
Биофармацевтические характеристики
Биофармация—
это наука, изучающая зависимость терапевтического действия лекарственных
препаратов на организм от различных факторов (фармацевтических, биологических и
др.).
Биофармация
— это научная дисциплина фармации, занимающаяся изучением влияния физических и
физико-химических свойств лекарственного вещества и лекарственного препарата на
количественную характеристику терапевтического эффекта в организме человека или
животного после приема лекарственного вещества в различных лекарственных
формах. Появилась она после установления фактов терапевтической
неэквивалентности лекарственных препаратов, то есть лекарственные препараты одного
состава, но приготовленные разными фармацевтическими предприятиями, отличались
различной терапевтической эффективностью. Это было обусловлено рядом причин:
измельченностью лекарственных веществ, подбором вспомогательных веществ и
различием технологических процессов, так называемых фармацевтических факторов.
В специальной литературе термин «фармацевтические факторы» получил
распространение, прежде всего, в связи с клиническим подтверждением
экспериментальных данных о существовании зависимости между эффективностью
лекарственных препаратов и методами их получения. В связи с тем, что
терапевтическая эффективность лекарственных препаратов определяется процессами
их абсорбции (всасывания),распределения и элиминации (выведения) из макроорганизма,
биофармация уделяет особое внимание изучению этих процессов, равно как и
влиянию на них физико-химических свойств лекарственных веществ. Поэтому все
изучаемые лекарственные формы в настоящее время рассматриваются в
биофармацевтических аспектах. Основной задачей биофармации в современной
технологии лекарств является максимальное повышение терапевтической
эффективности лекарственных веществ и снижение до минимума возможного побочного
их действия на организм.
Все
фармацевтические факторы, которые оказывают влияние на биологическое действие
лекарственных препаратов, можно разделить на 5 групп:
1)
химическая
модификация препарата (соль, кислота, наличие эфирных связей, комплексные
соединения);
2)
физико-химические,
состояние лекарственного вещества (форма кристалла, размеры частиц, наличие или
отсутствие заряда на их поверхности и т.д.);
3)
вспомогательные
вещества, их природа, количество;
4)
вид лекарственной
формы и пути введения;
5)
фармацевтическая
технология.
1)
Химическая
модификация лекарственного вещества обязательно учитывается при разработке
новых лекарственных препаратов. Она обуславливает кинетику высвобождения и
всасывания лекарственного препарата. Однако в практической деятельности
провизора – технолога этот фактор значения не имеет. Для провизора-технолога
наибольшее значение имеют такие факторы, как физическое состояние
лекарственного вещества, наличие вспомогательных веществ и их природа. Эти
факторы необходимо учитывать при выборе технологии лекарственных препаратов.
2)
Физико-химическое
состояние лекарственного вещества оказывает значительное влияние на его
биологическую активность. Известна, способность химических соединений иметь
различную структуру, характеризующуюся в каждом конкретном случае специфической
совокупностью свойств. Геометрическая форма и состав образующихся кристаллов
существенно зависят от характера растворителя, скорости кристаллизации,
температура процесса, от примесей, величины давления и др. факторов. Считают
например, что 30-60% сульфаниламидов, 70% барбитуратов полиморфны, 1/3 всех
органических соединений имеет по крайней мере две кристаллические формы.
Накоплено достаточное количество экспериментального материала о зависимости
структуры веществ и их биологической доступности. Вопросам измельчения в фармацевтической
технологии придается особое значение. Известно, что с уменьшением размера
частиц резко увеличивается поверхностная энергия измельчаемого лекарственного
вещества. При тонком измельчении лекарственного вещества лучше растворяются,
быстрее и полнее участвуют в химических реакциях и т.д. Измельчение может
существенным образом влиять на терапевтическую активность лекарственных веществ
вследствие изменения процессов их всасывания. Это происходит при изменении
растворимости лекарственных веществ, скорость которой прямо пропорционально
площади поверхности и обратно пропорционально величине частиц вещества. Например,
при назначении одинаковых доз сульфадимезида микронизированного и полученного в
заводском производстве без дополнительного измельчения выявлено, что в первом
случае в плазме крови людей содержание вещества на 40% выше, максимальная
концентрация достигается на 2 часа раньше, а общее количество всосавшегося
вещества на 20% больше, чем во втором случае. При уменьшении размера частиц
кислоты ацетилсалициловой до микронизированных увеличилось приблизительно в 2
раза ее анальгетическое, жаропонижающее и противовоспалительное действие. В
аптечной практике необходимый размер частиц порошка получают при соблюдении
следующих условий измельчения: выбор ступки, время измельчения, применение
аппаратов, порядок смешивания, особые правил и приемы технологии.
3)
Не менее важное
значение в технологии лекарственных форм имеет правильный выбор вспомогательных
веществ. До самого недавнего времени во вспомогательных веществах видели только
индифферентные формообразователи, значение которых сводились к приданию
соответствующей формы и объема лекарственного вещества с целью удобства его
приема, транспортировки, хранения. Однако открытия последних десятилетий привели
к осознанию биологической роли вспомогательных веществ. Они могут усиливать,
снижать действие лекарственных веществ или изменять его характер под влиянием
различных причин (комплексообразование, молекулярные реакции и др.)
4)
Значение
лекарственной формы. Оптимальная активность лекарственного вещества достигается
только назначением его в рациональной, научно обоснованной ЛФ. Выбор ЛФ
определяет и способ введения лекарственного вещества в организм. Эффективность
лекарственного вещества зависит от того, какой путь совершит оно до того, как
попадает в кровь. При ректальном способе лекарственное вещество попадает в
кровь, минуя печень, и не подвергается химическому воздействию ее ферментов,
желудочного сока и желчи. Поэтому оно, всасывается через 7', а при пероральном
– через 30'.
5)
Значение
технологических факторов. Способ получения ЛФ во многом определяет стабильность
препарата, скорость его высвобождения из ЛФ, интенсивность всасывания – короче,
терапевтическую эффективность. Например, выбор способа гранулирования таблеток
обуславливается сохранностью лекарственного вещества в ЛФ. Перспективны
технологии многослойных таблеток и спансул (желатиновых капсул, наполненных
гранулами) для обеспечения пролонгированного и дифференцированного действия.
Оказывается,
что такая обычная технологическая операция, как измельчение, имеет
непосредственное отношение к терапевтическому эффекту лекарственных препаратов.
Это впервые было доказано для сульфаниламидных веществ, затем стероидов,
производных кислоты салициловой, антибиотиков, обезболивающих, мочегонных,
антидиабетических, кардиологических и других лекарственных средств. Образование
различных полиморфных модификаций лекарственных веществ возможно при их
получении (выделении), очистке и сушке, а также при приготовлении и хранении
лекарственных форм. Полиморфные превращения особенно распространены среди
салицилатов, барбитуратов, сульфаниламидов, гормональных препаратов. Например,
кислота ацетилсалициловая встречается в шести кристаллических формах, кортизона
ацетат — в пяти. Дело в том, что полиморфные модификации одного и того же
лекарственного вещества обладают различной растворимостью, температурой
плавления, стойкостью к окислению, а следовательно, неодинаковыми
поверхностными свойствами, от которых зависит скорость абсорбции лекарственных
веществ и их стабильность в лекарственных формах. Так, кислота
ацетилсалициловая (полиморфная модификация II)обладает на 50 % лучшей
растворимостью по сравнению с формой I и в 1,5 раза большей активностью и
биологической доступностью. Скорости растворения безводного кофеина и
теофиллина превосходят скорость растворения их сольватированных форм. Имеется
большое количество работ, в которых показана способность диметилсульфоксида
(ДМСО) легко проникать через неповрежденную кожу, транспортировать,
депонировать и пролонгировать при этом поступление лекарственных веществ в
организм. Так, добавление ДМСО в глазные капли ускоряет проникновение
антибиотиков в ткани глаза, использование же метилцеллюлозы позволяет
удерживать лекарственные вещества в тканях длительное время, тем самым оказывая
пролонгированное действие, что весьма важно при лечении многих хронических
заболеваний органов зрения. Большое количество лекарственных веществ, имеющих
молекулы сложной конфигурации, легко вступают в реакции комплексообразования.
Образующиеся комплексы могут быть весьма прочными и ослаблять основные
фармакологические свойств лекарственного вещества. Интенсивность
технологических процессов, имеющих место при производстве лекарственных
препаратов, может существенно влиять на реакцию комплексообразования, ускоряя
или направляя ее в соответствующую сторону. Особенно ответственными в этом
отношении являются стадии растворения, фильтрования, перекристаллизации,
плавления, смешивания и др., при которых происходит изменение агрегатного
состояния лекарственных и вспомогательных веществ, интенсивности и роста числа
контактов между ними. , при использовании в лекарственных формах ПЭО-4000, ПВП
как загустителей образующийся комплекс с фенобарбиталом обладает весьма слабой
способностью к растворению и всасыванию. В настоящее время доказано, что способ
получения лекарственных форм во многом определяет стабильность препарата,
скорость его высвобождения из лекарственной формы, интенсивность его всасывания
и, в конечном итоге, его терапевтическую эффективность. Таким образом,
биофармация — это теоретическая основа фармациии, в первую очередь,
фармацевтической технологии. Влияние биофармацевтических представлений на
теорию и практику производства лекарственных препаратов несомненно и огромно.
10.
Оценка качества и оформление к отпуску
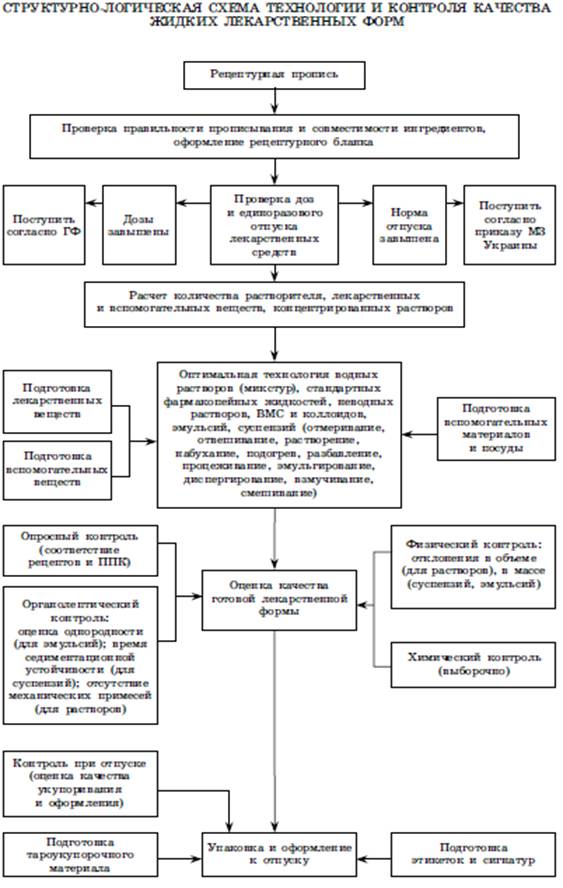
Контроль
качества ЖЛФ осуществляют согласно:
·
Проверка качества
включает все виды внутриаптечного контроля:
·
письменный
·
опросный
·
органолептический
(цвет, вкус, запах), а также однородность и отсутствие механических примесей
·
физический (общая
масса, которая после приготовления лекарственного препарата не должна превышать
норм допустимых отклонений)
·
химический
контроль (выборочно)
·
контроль при
отпуске
Оформление
к отпуску:
·
этикетка
«Внутреннее» или «Наружное»
·
растворы,
содержащие ядовитые вещества, опечатывают, оформляют сигнатурой и
дополнительной этикеткой «Обращаться с осторожностью»
·
если
лекарственный препарат требует особых условий хранения, то наклеивают дополнительные
этикетки, например, «Сохранять в прохладном месте», «Перед употреблением
взбалтывать» и т. д.
Заключение
Технология
ЛФ сравнительно молодая наука. Только в 1924г. она перестала быть областью
эмпирических знаний и завоевала право быть наукой. Началось интенсивное
развитие теоретических и экспериментальных исследований. Биофармацевтическим
вопросам в нашей стране уделяется большое внимание. В каждом
научно-исследовательском институте, где изыскиваются новые лекарственные
средства, имеются специальные лаборатории технологии лекарственных форм, в
задачу которых входит разработка для нового лекарственного препарата рациональной
формы его применения. Применение ни одного нового препарата не разрешается,
если для него не предложена разумная лекарственная форма, если не решены
вопросы по композиции основообразующих и других вспомогательных веществ, если
не найдены наиболее совершенные методы производства лекарства.
Жидкие
лекарственные формы занимают основное место (45-50%) в рецептуре современных
аптек. Много разнообразных прописей жидких лекарств изготавливается в заводских
условиях. Важнейшим веществом, естественно после самого действующего вещества,
является растворитель.
Многие
вновь вводимые в лекарственный каталог вещества обладают плохой растворимостью
в воде, поэтому необходимо проводить исследования направленные на поиск
идеального растворителя, который отвечал бы всем необходимым требованиям с был
бы способен легко растворять любое вещество. Сейчас нам это кажется сказкой но
возможно через много лет ученые создадут такой растворитель. На нынешнее время
в аптечной технологии больше всего преобладают жидкие лекарственные формы на
водной основе для внутреннего применения и на неводных растворителях (масла,
спирт этиловый) для наружного применения. Новые синтетические растворители типа
полиэтиленоксидов и пропиленгликоля, диметилсульфоксида, диметилформамида,
бензилбензоата, этилолеата , нашедшие в последние два десятилетия весьма заметное
распространение в заводском производстве лекарств, к сожалению, до сих пор
практически не используются в условиях аптек.
Производство вручную таких индивидуальных лекарств это
достаточно трудоемкий процесс, требующий больших знаний, опыта работы и навыков
изготовления и контроля качества.
Список
литературы
1.
Райхардт К., Растворители и эффекты среды в органической химии. \ К. Райхардт
-М. Мир, 1991-763 с.
2.
Райхардт К. Растворители в органической химии. \ К. Райхардт- Л. Химия, 1973-
150 с.
3. Днепровский
А.С.,. Теоретические основы органической химии. \ Днепровский А.С.,Темникова
Т.И -Л.: Химия, 1991-560 с.
4.
Фиалков Ю.Я. Растворитель как средство управления химическим процессом. \
Фиалков Ю.Я- Л.: Химия, 1990-283 с.
5. Агажданян Н.А.
Резервы нашего организма. \ Агажданян Н.А., Катков А.Ю М.: Знание, 1990-340с.
6. Краснюк И.И.
Фармацевтическая технология .Учебник для студентов высших учебных заведений \
Краснюк И.И., Валевко С.А., Михайлова Г.В.-М.:изд.центр Академия,2006-592с
7. Одрит Л., Неводные
растворители, пер. с англ. \ Одрит Л., Клейнберг Я.- М [б.м.]., 2001-150с