Практикум по органической химии
МИНИСТЕРСТВО ВЫСШЕГО И СРЕДНЕГО
СПЕЦИАЛЬНОГО ОБРАЗОВАНИЯ РЕСПУБЛИКИ УЗБЕКИСТАН
А.КАРИМОВ, Н.
ЧИНИБЕКОВА
ПРАКТИКУМ
ПО ОРГАНИЧЕСКОЙ ХИМИИ
Учебное пособие для студентов
фармацевтических институтов
Ташкент -2009
Рецензенты:
Ахмедов К. - доктор химических наук, профессор кафедры
органической химии Узбекского национального
университета
Курбонова М. - кандидат фармацевтических наук, доцент кафедры
неорганической, аналитической и физ.коллоидной химии
Ташкентского фармацевтического института
ОГЛАВЛЕНИЕ
Введение
I. ТЕХНИКА ЛАБОРАТОРНЫХ РАБОТ
I.1 Техника безопасности в лаборатории и меры по оказанию первой
медицинской помощи
I.2 Химическая посуда и вспомогательные приспособления
I.3 Основные операции при работе в лаборатории органической химии
I.3.1 Нагревание
I.3.2 Охлаждение
I.3.3 Измельчение
I.3.4 Перемешивание
I.3.5 Высушивание
I.4.Способы выделения и очистки веществ
I.4.1 Фильтрование
I.4.2 Кристаллизация
I.4.3 Возгонка
I.4.4 Перегонка
I.5 Важнейшие физические константы
I.5.1 Температура плавления
I.5.2 Температура кипения
II. методы установления строения
органических соединений
II.1 Качественный элементный анализ органических соединений
III основы строения, свойства и идентификация
органических соединений
III.1 Классификация, номенклатура, пространственное строение и изомерия
органических соединений
III.2 Химическая связь и взаимное влияние атомов в органических соединениях
III.3 Алканы. Циклоалканы
III.4 Алкены, алкадиены, алкины
III.5 Арены
III.6 Галогенопроизводные углеводородов
III.7 Спирты
III.8 Фенолы
III.9 Простые эфиры
III.10 Альдегиды. Кетоны
III.11 Амины
III.12 Диазо-, азосоединения
III.13 Одно- и двухосновные карбоновые кислоты
III.14 Гетерофункциональные карбоновые кислоты
III.14.1 Окси-, фенолокислоты
III.14.2 Оксокислоты
III.14.3 Аминокислоты. Амиды. Уреиды кислот
III.15 Пятичленные гетероциклические соединения
III.15.1 Пятичленные гетероциклические соединения с одним гетероатомом
III.15.2 Пятичленные гетероциклические соединения с двумя гетероатомами
III.16 Шестичленные гетероциклические соединения
III.16.1 Шестичленные гетероциклические соединения с одним гетероатомом
III.16.2 Шестичленные гетероциклические соединения с двумя гетероатомами
III.17 Конденсированные гетероциклические соединения
III.18 Углеводы
Ш.18.1 Моносахариды
Ш.18.2 Полисахариды
III.19 Омыляемые и неомыляемые липиды
IV синтезы органических соединений
IV.1 Галогенирование
IV.1.1 1-Бромбутан
IV.1.2 Бромэтан
IV.1.3 Бромбензол
IV.2 Сульфирование
IV.2.1 п-Толуолсульфокислота
IV.2.2 п-Толуолсульфокислый натрий
IV.2.3 Сульфаниловая кислота
IV.3 Ацилирование
IV.3.1 Этиловый эфир уксусной кислоты
IV.3.2 Ацетилсалициловая кислота
IV.3.3 Ацетанилид
IV.4 Получение гликозидов
IV.4.1 N-гликозид белого стрептоцида
V. Литература
ВВЕДЕНИЕ
Органическая химия в системе высшего фармацевтического образования
занимает важное место, являясь одной из фундаментальных наук, формирующих
научно-теоретический и экспериментальный базис как для усвоения специальных
знаний по фармацевтической химии, фармакогнозии, фармакологии, токсикологической
химии, так и для профессиональной деятельности провизора. Использование этих
знаний при выполнении качественных реакций на функциональные группы, получении
отдельных представителей различных классов органических соединений, проведения
с ними характерных реакций способствует более глубокому усвоению теоретического
материала.
На сегодняшний день развитие органической химии сопровождается появлением
огромного количества новых веществ: в общем перечне лекарственных средств,
свыше 90% составляют органические вещества. Это, в свою очередь, предопределяет
необходимость познания и совершенствования приемов эксперимента и методов
исследования. В связи с этим подготовка специалистов фармацевтического профиля,
которым необходимы знания органической химии, требует не только теоретической
подготовки, но и разносторонних практических навыков и умений в проведении
химического эксперимента.
Практикум по органической химии» является логическим продолжением
лекционного курса по данному предмету и представляет собой единый
учебно-методический комплекс, который способствует творческому подходу к
изучению дисциплины, проведению практических занятий с учетом современных
методов обучения (интерактивные, инновационные). Данное пособие позволяет
ознакомиться с некоторыми способами получения отдельных представителей классов
органической химии в лабораторных условиях при наличии небольших количеств
исходных веществ, реактивов и сравнительно простого оборудования.
Включенный почти в каждую тему практикум направлен на то, чтобы студент
мог в эксперименте увидеть проявление наиболее важных химических свойств,
характерных для функциональных групп, определяющих реакционную способность
соединения. Ведь в профессиональной деятельности иногда с помощью внешне
простых химических проб будет определяться подлинность лекарственного вещества,
решаться вопрос о наличии или отсутствии того или иного компонента в смеси и
т.п. Важно понимать какие химические процессы обуславливают проявление внешнего
эффекта (появление окрашивания, запаха и т.п.).
В настоящем руководстве воплощен опыт многолетней работы коллектива
кафедры органической химии Ташкентского фармацевтического института, на
основании которого определена структура практикума для студентов
фармацевтической специальности.
Практикум включает четыре раздела и список рекомендуемой литературы.
В первом разделе, посвященном технике лабораторных работ, представлены
сведения о химической посуде и вспомогательных приспособлениях, рассмотрены
основные операции практической работы, способы выделения и очистки веществ,
определения важнейших физических констант.
Во втором разделе рассмотрены методы установления строения органических
соединений, приведен качественный элементный анализ исследования структуры
органических веществ.
Третий раздел включает информацию о строении, свойствах и идентификации
органических соединений. По каждой теме приведены общетеоретические вопросы и
ответы на них, контрольные вопросы и упражнения и практические опыты с
подробным описанием протекающих химических процессов.
В четвертом разделе приведены доступные для выполнения в лабораторных
условиях синтезы некоторых органических соединений.
Авторы будут признательны за конструктивные замечания и пожелания
относительно содержания и оформления учебного пособия.
I.
ТЕХНИКА ЛАБОРАТОРНЫХ РАБОТ
I.1
ТЕХНИКА БЕЗОПАСНОСТИ В ЛАБОРАТОРИИ И МЕРЫ ПО ОКАЗАНИЮ ПЕРВОЙ МЕДИЦИНСКОЙ ПОМОЩИ
ОБЩИЕ ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ ДЛЯ РАБОТЫ В ХИМИЧЕСКИХ
ЛАБОРАТОРИЯХ
При работе в лаборатории органической химии студент должен ясно
представлять специфику органических соединений, их ядовитость, огнеопасность,
что требует особо осторожного обращения с ними и соблюдения определенных
правил.
1. В лаборатории студент работает в халате, застегивающийся спереди
(халат легко снять в случае воспламенения). На рабочем месте кроме штатива с
пробирками и реактивов, находится только рабочий дневник и мягкая салфетка.
2. Прежде чем приступить к выполнению работы, нужно внимательно
изучить ее описание, знать свойства получаемых веществ.
. При выполнении работы необходимо соблюдать аккуратность и
осторожность. Невнимательность, незнание свойств веществ, с которыми студент
будет работать, могут привести к несчастному случаю.
. При нагревании химических веществ в пробирке необходимо
закреплять её в наклонном состоянии так, чтобы отверстие ее было направлено в
сторону, противоположную от себя и не в сторону работающих рядом товарищей.
Нагревают пробирку постепенно, передвигая пламя горелки по пробирке сверху
вниз.
. При работе с газоотводной трубкой нагревание пробирки можно
прекращать, только предварительно удалив конец трубки из приемника с жидкостью.
Если убрать источник нагрева преждевременно, жидкость из приемника может
засосать в реакционную пробирку и она может лопнуть, а реакционная смесь
попасть на лицо и руки.
. Никакие вещества в лаборатории нельзя пробовать на вкус.
. При определении запаха пары из пробирки или склянки направляют к
себе движением руки.
. Все опыты с веществами, обладающими резким раздражающим запахом,
следует производить только под тягой.
. Металлический натрий разрезают острым, сухим ножом на
фильтровальной бумаге. Обрезки, остатки сразу же убирают в специальные склянки,
наполненные сухим керосином или вазелиновым маслом. Реакцию с металлическим
натрием следует проводить в совершенно сухой посуде.
10. Горючие и легко воспламеняющиеся жидкости (эфир, бензол, спирт)
наливают вдали от огня, пробирки и колбы с ними нагревают на водяной или
песчаной бане.
11. При воспламенении жидкости в сосуде, необходимо, прежде всего,
погасить источник нагрева, а затем накрыть пламя салфеткой или чашкой. Если
горящая жидкость разлилась на столе или на полу, тушат её только песком или
закрывают плотным куском ткани. Не рекомендуется для тушения применять воду,
так как органические вещества, как правило, не смешиваются с водой и
растекаются вместе с нею, распространяя пламя.
. При загорании одежды необходимо сразу накрыть горящего одеялом
или верхней плотной одеждой.
. При разбавлении серной кислоты водой, следует серную кислоту
тонкой струей добавлять в воду (а не наоборот) при непрерывном помешивании
раствора.
. Воспрещается брать голыми руками щелочные металлы (калий,
натрий, их гидроксиды), а также засасывать ртом кислоты, щелочи и растворители.
. Склянки с реактивами общего пользования должны всегда находиться
на общих полках.
. Остатки горючих жидкостей, кислот, щелочей следует выливать не в
раковину, а в специальные склянки.
. После окончания работы и сдачи её преподавателю практикума
студент обязан привести в порядок свое рабочее место, проверить отключены ли электроприборы,
вода, газ.
ОКАЗАНИЕ ПЕРВОЙ ПОМОЩИ
В каждой лаборатории для оказания первой помощи должна быть аптечка с
гигроскопической ватой, стерильными тампонами и бинтами, лейкопластырем, 3-5%
спиртовым раствором йода, 1% раствором уксусной кислоты, 1-3% раствором
двууглекислой соды, 2% раствором борной кислоты, глицерином, вазелином, мазью
от ожогов, этиловым спиртом, нашатырным спиртом.
. Ожоги от огня или раскаленных предметов быстро обрабатывают мазью от
ожогов, затем прикладывают вату с этой мазью и слабо перевязывают. Для
предварительной обработки обожженного места применяют также марганцевый калий и
спирт. При сильных ожогах пострадавшего направляют в амбулаторию.
. При химических ожогах (попадание на кожу кислоты, щелочи или брома)
пораженное кислотой место промывают большим количеством воды, затем 3%
раствором двууглекислой соды, смазывают мазью от ожогов или вазелином и
перевязывают. Участок кожи, на который попала щелочь, немедленно промывают
большим количеством воды, затем 1% раствором уксусной кислоты, смазывают мазью
от ожогов или вазелином и перевязывают. При попадании на кожу брома немедленно
обмывают её бензолом, бензином или насыщенным раствором гипосульфита.
. При попадании в глаз кислоты его немедленно промывают большим
количеством воды, затем разбавленным раствором соды, снова водой и немедленно
направляют пострадавшего в амбулаторию.
. При попадании в глаз щелочи его сразу же промывают большим количеством
воды, затем разбавленным раствором борной кислоты и немедленно направляют
пострадавшего в амбулаторию.
. Ткань одежды, на которую попали кислота или щелочь, промывают большим
количеством воды, затем обрабатывают 3% раствором двууглекислой соды (в случае
попадания кислоты) или 1% раствором уксусной кислоты (если попала щелочь).
. Порезы рук стеклом промывают сильной струей воды, удаляют из раны
осколки, заливают спиртовым раствором йода и перевязывают.
I.2
ХИМИЧЕСКАЯ ПОСУДА И ВСПОМОГАТЕЛЬНЫЕ ПРИСПОСОБЛЕНИЯ
К основной лабораторной химической посуде относятся колбы, стаканы,
пробирки, чашки, воронки, холодильники, дефлегматоры и другие сосуды различных
конструкций. Химическую посуду изготавливают из стекла различных марок,
отличается она стойкостью к различной температуре, к воздействию большинства
химических реагентов, прозрачна, легко моется.
Колбы в зависимости от назначения изготавливают различного объема и формы
(рис.1.1).
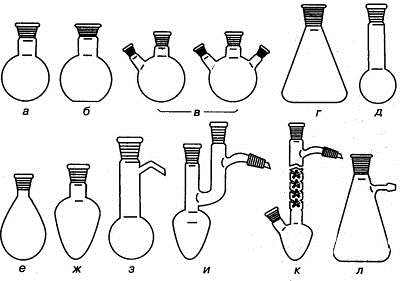

Рис. 1.1. Колбы: а) круглодонная, б) плоскодонная, в) круглодонные с
двумя и тремя горловинами под углом, г) коническая (колба Эрленмейера, д) колба
Кьельдаля, е) грушевидная, ж) остродонная, з) круглодонная для перегонки (колба
Вюрца), и) остродонная для перегонки (колба Кляйзена), к) колба Фаворского, л)
колба с тубусом (колба Бунзена).
органический химия синтез соединение
Круглодонные колбы предназначены для работы при высокой температуре, для
перегонки при атмосферном давлении и для работ под вакуумом. Использование
круглодонных колб с двумя и более горловинами позволяет в процессе синтеза выполнять
одновременно несколько операций: применять мешалку, холодильник, термометр,
капельную воронку и т.д.
Плоскодонные колбы пригодны только для работы при атмосферном давлении и
для хранения жидких веществ.
Конические плоскодонные колбы широко используют для кристаллизации, так
как их форма обеспечивает минимальную поверхность испарения.
Толстостенные конические колбы с тубусом (колбы Бунзена) применяют для
фильтрования под вакуумом до 1,33 кПа (10 мм.рт.ст.) в качестве приемников
фильтрата.

Стаканы (рис. 1.2, а) предназначены для фильтрования, выпаривания (при
температуре не более 1000С), приготовления растворов в лабораторных условиях, а
также для проведения некоторых синтезов, при которых образуются плотные, трудно
извлекаемые из колб осадки. Стаканы не используются при работе с низкокипящими
и огнеопасными растворителями.

Рис. 1.2. Химическая посуда: а) стакан, Рис. 1.3. Чашка фарфоровая б)
бюкс
Бюксы
(рис. 1.2, б) применяют для взвешивания и хранения летучих, гигроскопичных и
легкоокисляющихся на воздухе веществ.
Чашки
(рис. 1.3) используют при выпаривании, кристаллизации, возгонке, сушке,
измельчении и других операциях.
Пробирки
(рис. 1.4) выпускают различной вместимостью, используют для проведения анализа
исследуемых веществ в небольшом количестве. Пробирки с конусным шлифом и
отводной трубкой применяют для фильтрования небольших объемов жидкостей под
вакуумом.
Для
измерения объема жидкости используют мерную посуду: мерные стаканы, цилиндры,
мерные колбы, пипетки, бюретки (рис. 1.5).

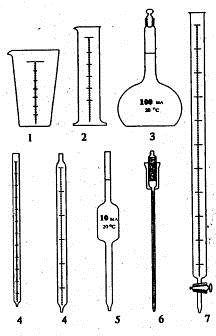
Рис. 1.4. Пробирки: а) цилиндрическая с Рис. 1.5. Мерная посуда: 1)
мензурка, развернутым краем, б) цилиндрическая 2) цилиндр, 3) мерная колба, без
отгиба, в) остродонная (центрифуж- 4) градуированные пипетки, ная), г) с
взаимозаменяемыми конусны- 5) пипетка Мора, 6) пипетка ми шлифами, д) с
конусным шлифом и с поршнем, 7) бюретка отводной трубкой
Для грубого отмеривания жидкостей используют мензурки - расширяющиеся
кверху конические стаканы с нанесенными делениями и мерные цилиндры. Для
отмеривания больших фиксированных объемов жидкостей применяют мерные колбы, их
вместимость колеблется от 10 мл до 2 л, а для точного отмеривания небольших
объемов жидкостей - пипетки и бюретки - пипетки с краном.
Пипетки бывают двух типов: 1) «на наполнение» - нулевая отметка вверху и
2) «на выливание» - верхняя отметка указывает максимальный объем. Для
наполнения пипеток используют резиновые баллоны, медицинские груши. Ни в коем
случае нельзя засасывать органические жидкости в пипетку ртом!
Стеклянное лабораторное оборудование включает в себя также соединительные
элементы, воронки, капельницы, спиртовки, водоструйные насосы, эксикаторы,
холодильники, дефлегматоры.
Соединительные элементы (рис. 1.6) предназначены для сборки на шлифах
различных лабораторных установок.
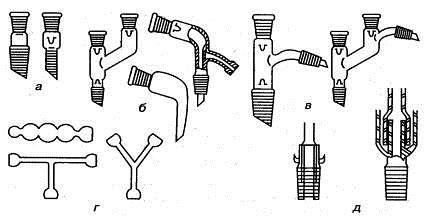
Рис. 1.6. Важнейшие соединительные элементы: а) переходы, б) аллонжи, в)
насадки, г) трубки соединительные, д) затворы
Воронки (рис. 1.7) используются для наливания, фильтрования и разделения
жидкостей.
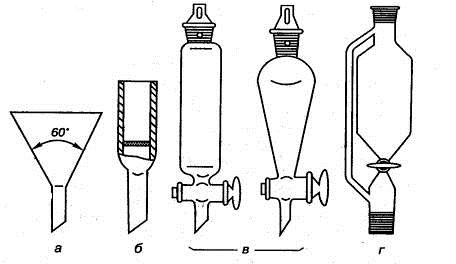
Рис. 1.7. Воронки: а) лабораторная, б) фильтрующая с впаянным стеклянным
фильтром,
в) делительная, г) капельная с боковой трубкой для выравнивания давления
Лабораторные воронки используют для наливания жидкостей в узкогорлые
сосуды и для фильтрования растворов через бумажный складчатый фильтр. Воронки
со стеклянными фильтрами применяют обычно для фильтрования жидкостей,
разрушающих бумажные фильтры. Для разделения несмешивающихся жидкостей при
экстрагировании и очистке веществ предназначены делительные воронки. Капельные
воронки используют для регулируемого добавления жидких реагентов в ходе
проведения синтеза, они похожи на делительные, у них обычно отвод трубки
длиннее, а кран располагается под самим резервуаром, их максимальная емкость не
превышает 0,5 л.
Эксикаторы (рис. 1.8) используют для высушивания веществ под вакуумом и
для хранения гигроскопичных веществ.


Рис. 1.8. Эксикаторы: а) вакуум-эксикатор, б) обычный
Чашки или стаканы с веществами, подлежащими сушке, устанавливают в
ячейках фарфоровых вкладышей, а на дно эксикатора помещают вещество -
поглотитель влаги.
Холодильники (рис. 1.9) применяют для охлаждения и конденсации паров.
Воздушные холодильники используют при кипячении и перегонки высококипящих (tкип›1600С) жидкостей, охлаждающим
агентом служит окружающий воздух. Холодильники с водяным охлаждением отличаются
от воздушных наличием водяной рубашки (охлаждающий агент - вода). Водяное охлаждение
применяют для сгущения паров и перегонки веществ с tкип‹1600С, причем в интервале 120-1600С охлаждающим агентом
служит непроточная, а ниже 1200С - проточная вода. Холодильник Либиха
используют для перегонки жидкостей, шариковый и спиральные холодильники
наиболее применимы в качестве обратных при кипячении жидкостей, так как имеют
большую охлаждающую поверхность.
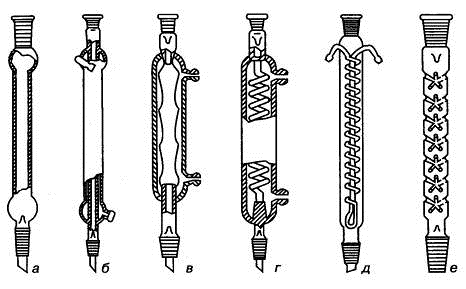

Рис. 1.9. Холодильники и дефлегматор: а) воздушный, б) с прямой трубкой
(Либиха), в) шариковый, г) спиральный, д) Димрота, е) дефлегматор
Дефлегматоры служат для более тщательного разделения фракций смеси при ее
дробной (фракционной) разгонке.
В лабораторной практике для работ, связанных с нагреванием, применяют
посуду из фарфора (рис. 1.10).
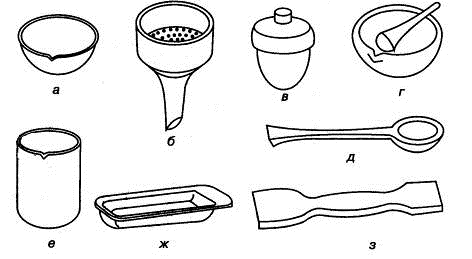

Рис. 1.10. Фарфоровая посуда: а) чашка выпарительная, б) воронка Бюхнера,
в) тигель,
г) ступка и пестик, д) ложка, е) сткакн, ж) лодочка для сжигания, з)
шпатель
Для фильтрования и промывания осадков под вакуумом используют фарфоровые
нутч-фильтры - воронки Бюхнера. Ступки с пестиками презназначены для
измельчения и смешевания твердых и вязких веществ.
Для сборки и закрепления различных приборов в химической лаборатории
пользуются штативами с наборами колец, держателей (лапок) и зажимов (рис.
1.11).
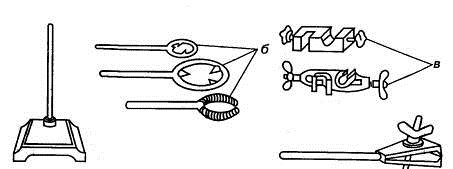

а г
Рис. 1.11. Лабораторный штатив (а) с набором комплектующих частей: б)
кольца, в) зажимы, г) держатель
Для фиксации пробирок используют штативы из нержавеющей стали, сплавов
алюминия или пластмассы, а также держатели ручные (рис. 1.12).


Рис. 1.12. Штатив (а) и ручные держатели для пробирок (б)
Герметичность соединения составных частей лабораторных приборов
достигается с помощью шлифов (рис.1.13) и резиновых или пластиковых пробок.
Пробки подбирают по номерам, которые равны внутреннему диаметру закрываемой
горловины сосуда или отверстия трубки.
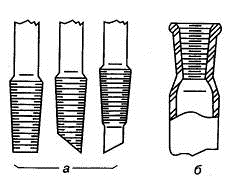
Рис. 1.13. Конусные шлифы: а) керны, б) муфта
Наиболее универсальным и надежным способом герметизации лабораторного
прибора является соединение его отдельных деталей с помощью конусных шлифов
посредством стыковки наружной поверхности керна с внутренней поверхностью
муфты.
I.3
ОСНОВНЫЕ ОПЕРАЦИИ ПРИ РАБОТЕ В ЛАБОРАТОРИИ ОРГАНИЧЕСКОЙ ХИМИИ
Квалифицированное выполнение практических работ химиком-экспериментатором
невозможно без знания техники проведения основных операций. Поэтому необходимо
изучить и освоить наиболее часто применяемые в лаборатории органической химии
операции: нагревание, охлаждение, растворение, высушивание, измельчение,
перемешивание и др. Их правильное выполнение необходимо и для обеспечения
безопасных условий труда.
I.3.1
НАГРЕВАНИЕ
Одним из условий протекания химических реакций в заданном направлении
является строгое соблюдение определенного температурного режима.
Основные органические реакции не ионные и протекают медленно, поэтому
часто их проводят при нагревании, что способствует увеличению скорости реакции
- скорость реакции при нагревании на 100С увеличивается в 2-4 раза (правило
Вант-Гоффа).
Для нагревания используют различные горелки, электронагревательные
приборы, водяной пар и др. Выбор нагревательного прибора проводят с учетом
свойств растворителя, реагирующих веществ и температуры, при которой должна
проводиться реакция.
Горелки бывают газовыми или жидкостными (спиртовыми) (рис. 1.14). Для
быстрого нагревания до относительно высоких температур (≈5000С) применяют
газовые горелки Бунзена и Теклу. Эти горелки представляют собой закрепленную на
металлической подставке металлическую трубку, в нижней части которой имеются
отверстия с приспособлениями для регулировки подачи воздуха. Спиртовая горелка
представляет собой резервуар из толстостенного стекла, через горлышко которого
тянут нитяной фитиль или ватный тампон. Горлышко накрывается металлическим или
притертым стеклянным колпачком.
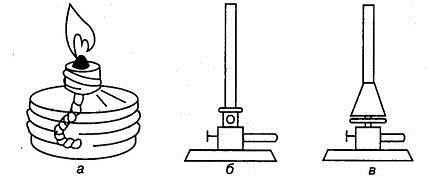

Рис.1.14. Горелки: а) спиртовая, б) газовая Бунзена, в) газовая Теклу
Наиболее широко применяются электронагревательные приборы -
колбонагреватели, плитки, сушильные шкафы, муфельные, тигельные, шахтные печи и
бани. При использовании для нагревания электрических плиток и горелок может
происходить местный перегрев и частичное разложение органических веществ. Для
увеличения равномерности нагрева свыше 1000С применяют асбестовые сетки,
электроколбонагреватели из стекловолокна с вплетенными электрическими спиралями
(рис. 1.15). Во избежание перегрева реакционной смеси пламя горелки не должно
выходить за пределы кружка асбеста на сетке.
При работе с взрывоопасными, легковоспламеняющимися веществами (эфир,
ацетон, бензол и др.), для предотвращения местного перегревания применяют разного
рода нагревательные бани. Теплопроводящей средой в нагревательных банях служат
воздух, песок, вода, органические жидкости, металлы, расплавы солей и др.
Выбирая определенный тип бани, учитывают свойства реакционной смеси,
температурный режим, соблюдение которого необходимо в течение длительного
времени. Уровень нагреваемого вещества в посуде должен соответствовать уровню
теплоносителя бани.
Для незначительного увеличения равномерности нагрева используют воздушные
бани - воронка Бабо с газовой горелкой (рис. 1.16). Максимальная температура,
достигаемая при использовании воздушной бани с электрическим обогревом,
составляет 2500С.


Рис. 1.15. Электроколбонагреватель Рис. 1.16. Воронка Бабо
Большой тепловой инерцией обладают песчаные бани, снабженные
электрическими или газовыми горелками, позволяют поддерживать температуру до
4000С. Посуду с веществами помещают на глубину 2-5 см в предварительно прокаленный
от органических примесей, просеянный песок.
Если в эксперименте необходимо поддерживать температуру, не превышающую
1000С, используют кипящие водяные бани. Емкость с огнеопасными веществами
постепенно погружают в предварительно нагретую водную баню, устранив источники
нагревания. С помощью термометра контролируют температуру смеси и, в случае
необходимости, меняют остывшую воду на горячую. Водяные бани нельзя
использовать при проведении эксперимента с металлическим калием или натрием.
При перегонке легколетучих, горючих веществ (петролейный эфир, диэтиловый эфир
и др.) применяют паровые бани.
Масляные бани имеют относительно большую тепловую инерцию и используются
для нагревания в интервале 100-2500С. Максимально достигаемая температура
зависит от вида теплоносителя (глицерин - до 2000С, парафин - до 2200С).
Следует помнить, что при попадании воды нагретые масла пенятся и
разбрызгиваются, поэтому на нижний конец обратного холодильника надевают
манжету из фильтровальной бумаги. Для предотвращения воспламенения паров
теплоносителя при перегреве баню помещают в вытяжной шкаф, прикрывают
асбестовым картоном или добавляют в баню холодное масло. Ни в коем случае
нельзя тушить водой, песком!
Температура измеряется термометром, помещенным в баню на уровне дна
реакционной колбы, термометр не должен касаться колбы, дна и стенок бани.
Металлические бани используют для нагревания в интервале 200-4000С, более
интенсивное повышение температуры вызывает быстрое окисление поверхности
металла. В качестве теплоносителя используют легкоплавкие сплавы Вуда (Bi:Pb:Sn = 4:2:1) с tпл = 710С, Розе (Bi:Pb:Sn = 9:1:1) с tпл = 940С. Термометр и сосуды
помещают после расплавления и извлекают до затвердения теплоносителей.
Для длительного поддержания температуры в заданном интервале используют
термостаты (рис. 1.17).


Рис. 1.17. Термостаты: а) ультратермостат УТ-15, б) микротермостат МТ-0.3
Следует помнить, что местный перегрев жидкостей выше их температуры кипения
может привести к взрыву. Чтобы этого избежать, в холодную жидкость погружают
запаянные с одной стороны длинные стеклянные капилляры открытым концом вниз или
помещают мелкие кусочки обожженного неглазурованного фарфора, кирпича, так
называемые «кипятильники». Нагреваясь, они выделяют мелкие пузырьки воздуха,
которые обеспечивают перемешивание и способствуют равномерному кипению.
«Кипятильники» используются одноразово, так как при охлаждении жидкость
заполняет их поры.
I.3.2
ОХЛАЖДЕНИЕ
При проведении многих химических работ иногда возникает необходимость в
охлаждении реакционной смеси. Эта операция используется для ускорения
кристаллизации, разделения продуктов с различной растворимостью и т.п. В
экзотермических реакциях выделение значительного количества тепла может
привести к перегреву реакционной смеси, а, следовательно, стать причиной
низкого выхода конечного продукта. В этих случаях необходимо снижение
температуры. Количество отводимого тепла и требуемая температура определяют
выбор охлаждающего вещества.
Простым дешевым и теплоемким агентом служит вода. Реакционный сосуд
охлаждают под струей проточной воды, или периодически погружая в холодную воду.
Циркулирующая холодная вода используется для охлаждения и конденсации паров в
рубашках холодильников. При повышении температуры паров свыше 1500С не следует
применять водяные холодильники, так как вследствие резкого перепада температур
возможно растрескивание стекла.
Для охлаждения до 00С используется измельченный лед. Более эффективное
охлаждающее действие оказывает смесь, состоящая изо льда и небольшого
количества воды, так как достигается больший контакт со стенками колбы или
пробирки. Если присутствие воды не мешает протеканию реакции, удобно
поддерживать низкую температуру, добавляя кусочки льда непосредственно в
реакционную смесь
Использование специальных смесей (табл. 1.1), которыми заполняют
охлаждающие бани, позволяет достигнуть температуру, близкую к 00С и ниже.
Таблица 1.1.
Охлаждающие смеси
|
Компоненты смеси
|
Количественное соотношение
|
Минимальная температура, 0С
|
|
H2O, CH3COONa
|
100:85
|
-4,7
|
|
H2O, NH4Cl
|
100:30
|
-5,1
|
|
H2O, NaNO3
|
100:75
|
-5,3
|
|
H2O,
Na2S2O3.5H2O
|
100:110
|
-8,0
|
|
H2O, CaCl2
|
100:250
|
-8,0
|
|
Лед (снег), CaCl2.6H2O
|
100:41
|
-9,0
|
|
Лед (снег), Na2S2O3.5H2O
|
100:67,5
|
-11,0
|
|
H2O, NH4Cl, NH4NO3
|
100:33:33
|
-12,4
|
|
H2O, CaCl2.6H2O
|
100:250
|
-12,4
|
|
H2O, NH4NO3
|
100:60
|
-13,6
|
|
Лед (снег),
КСl
|
100:30
|
-15,8
|
|
Лед (снег), NH4NO3
|
100:60
|
-17,3
|
|
H2O, NH4SCN
|
100:133
|
-18,0
|
|
Лед (снег), NaNO3
|
100:59
|
-18,5
|
|
Лед (снег), NaСl (техн.)
|
100:33
|
-20,0
|
|
H2O, NH4Cl, NH4NO3
|
100:100:100
|
-25,0
|
|
Лед (снег), KСl (техн.)
|
100:100
|
-30,0
|
|
Лед (снег), конц. НСl
(охл. до 00С)
|
100:100
|
-37,0
|
|
Лед (снег), NaСl (техн.)
|
100:125
|
-40,3
|
|
Лед (снег), CaCl2.6H2O
|
100:143
|
-55,0
|
Добавлением твердого оксида углерода (IV) («сухой лед») к отдельным растворителям (ацетон, эфир и
т.д.) достигается снижение температуры ниже -700С.
При необходимости длительного охлаждения используют холодильные шкафы.
Чтобы избежать коррозии металла при контакте со смесью агрессивных паров и
конденсированной влагой, предупредить взрыв паров органических растворителей,
сосуды в холодильнике плотно укупоривают.
I.3.3
ИЗМЕЛЬЧЕНИЕ
Измельчение - разрушение твердых тел с образованием частиц материала.
Измельчение используется для выполнения многих операций: при получении однородной
массы твердых веществ, при экстрагировании, отборе средней пробы и т.д. Одним
из решающих факторов, определяющим скорость гетерогенной реакции, является
площадь поверхности твердой фазы и возможность контакта ее с жидкой средой.
Измельчение увеличивает реакционную способность соединений.
Основными характеристиками процесса измельчения являются изменение
дисперсности и степень измельчения.
Степень измельчения - отношение среднего размера кусков исходного
материала к среднему размеру частиц измельченного материала.
В зависимости от цели измельчения выделяют дробление (получение кускового
продукта необходимой крупности) и помол (увеличение дисперсности твердого
материала, придание частицам определенной формы). В зависимости от размеров
измельченного продукта выделяют грубое (300-100 мм), среднее (100-25 мм),
мелкое (25-1 мм) дробление и грубый (1000-500 мкм), средний (500-100 мкм),
тонкий (100-40 мкм), сверхтонкий (менее 40 мкм) помол.
Твердые вещества измельчают вручную или механически. Выбор способа и средств
измельчения определяется механическими и химическими свойствами обрабатываемого
материала, требуемой степенью дисперсности. Для непосредственного химического
воздействия желательно тонкое и сверхтонкое измельчение. Материалы для
экстракции и перегонки с водяным паром могут ограничиться грубым измельчением.
Измельчение проводят в ступках (рис. 1.18), изготовленных из различных
материалов. Для измельчения кусков или крупных кристаллов веществ применяются
металлические ступки. Вещества, менее твердые, чем фосфор, измельчают в
приспособлениях из фарфора. Для изготовления аналитических образцов применяют
агатовые ступки, так как минерал обладает большой твердостью, мало истирается и
не засоряет измельчаемое вещество. Размер ступки выбирают в соответствии с
количеством рабочего материала, который не должен занимать более 1/3 ее объема.
Измельчение проводят вращательными движениями, время от времени очищая части
ступки и пестика шпателем и собирая вещество к центру. Вещества целесообразнее
обрабатывать небольшими порциями. Если материал размазывается и налипает, перед
измельчением его смешивают с оксидом кремния (IV), битым стеклом, пемзой.




а) б)
Рис. 1.18. Ступки: а) агатовая, б) для измельчения пылящих и ядовитых
веществ.
С пылящими и ядовитыми веществами работают в вытяжном шкафу, используя
специальные ступки с пылезащитными приспособлениями или закрывая обычную ступку
полиэтиленом с отверстием для пестика.
В лабораториях для измельчения веществ также используют механические
истиратели, дробилки, мельницы и гомогенизаторы.
Следует помнить, что измельчение веществ повышает их химическую
активность, поэтому не исключается возможность взрыва. В целях безопасности
перед обработкой больших количеств неизвестных веществ необходимо на небольшой
пробе убедиться, что возможность взрыва исключена.
I.3.4
ПЕРЕМЕШИВАНИЕ
Перемешивание - способ получения однородных смесей. Данная операция для
твердых сыпучих веществ определяется термином смешение, для жидких -
перемешивание.
Перемешивание выполняется вручную и механически. Операция осуществляется
с помощью перемешивающего устройства или встряхиванием. Периодическое
встряхивание используется, если применение мешалок затруднено, если в процессе
операции не проводят добавление веществ, охлаждение, нагревание. При
значительном выделении газов и паров встряхивание не применяют.
Агрегатное состояние перемешиваемых веществ определяет выбор метода и
аппаратуры для его осуществления. При работе с малыми количествами твердых и
жидких веществ в быстропротекающих реакциях иногда достаточно перемешивания
вручную в химическом стакане с помощью стеклянной палочки или встряхивания
сосуда. Колбы вращают, придерживая за горло, закрытые сосуды многократно
переворачивают. Следует помнить, что в сосудах с низкокипящими жидкостями при
перемешивании повышается давление, поэтому пробки в них необходимо
придерживать.
Работая с вязкими жидкостями, с большими количествами веществ или проводя
реакцию в течение длительного времени, используют механическое перемешивание.
Операция может проводиться посредством магнитных, вибрационных мешалок, а также
мешалок, вращающихся электроприводом.
В нормальных условиях (при атмосферном давлении, температуре окружающей
среды, в присутствии влаги воздуха) перемешивание ведут в открытых широкогорлых
сосудах, толсто- или тонкостенных стаканах, колбах для титрования, широкогорлых
пробирках, в специальных колбах. Эта посуда позволяет одновременно использовать
мешалки, термометры, капельные воронки и др.
Механическое перемешивание эффективно проводится с помощью стеклянных
мешалок (рис. 1.19), которые легко изготовить из толстых палочек или трубок
диаметром 4-10 мм. Им придают различную конфигурацию в зависимости от формы,
величины сосуда и ширины его горловины.
В зависимости от способа перемешивания используют различные типы мешалок
(рис. 1.20).
В открытые цилиндрические, широкогорлые сосуды помещают более эффективные
плоские, пропеллерные или винтовые мешалки.
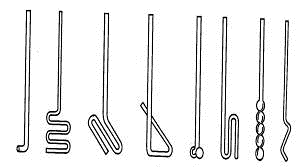


Рис. 1.19. Стеклянные мешалки Рис. 1.20. Мешалки
Для узкогорлой посуды используют мешалки со стеклянными или
фторопластовыми лопастями, которые под действием центробежных сил откидываются
наружу. Они не пригодны для интенсивного перемешивания. При больших скоростях
мешалки такого типа могут легко сломаться и разбить реакционные сосуды.
Пропеллерные и центробежные мешалки не пригодны для тяжелых, твердых
веществ (например, для расплавленного натрия). В этих случаях удобно
использовать мешалку Гершберга со стеклянным стержнем и проволочными лопастями
(d=1-2 мм), которая легко вставляется
через узкое горло реакционного сосуда. Ее лопасти при работе принимают
очертания колбы, легко скользят по стенкам, не оставляя царапин. Для работы с
веществами, прилипающими к стенкам узкогорлых колб, применяют скребковидные
мешалки, однако их нельзя использовать при одновременном введении в колбу
термометра.
Перемешивание в больших объемах осуществляется с помощью металлических
лопастных и центробежных мешалок.
Работая в глубоком вакууме и с небольшими объемами маловязких веществ
(при экстракции жидкости жидкостью, электролизе, титровании), удобно
использовать магнитные мешалки (рис.1.21). Они состоят из мотора с вращающимся
магнитом и помещенного в реакционный сосуд стержня. Под влиянием магнитного
поля, создаваемого ротором электродвигателя, стержень приходит в движение.
Магнитные мешалки можно комбинировать с плоскими электронагревателями, но
следует учитывать невысокую стабильность магнитов при нагревании. Достоинства этого
типа мешалок - возможность использования аппаратуры без специальной подготовки,
помещения перемешивающего стержня в закрытые аппараты (запаянные сосуды).


Рис.1.21. Магнитная мешалка
Для перемешивания жидкостей с газами, для несмешивающихся жидкостей
устанавливают вибрационные мешалки, в которых мембрана со стеклянной или
стальной пластинкой приводится в движение переменным электромагнитным полем.
Этот способ эффективен для образования тонких эмульсий.
При проведении многих требующих перемешивания реакций возникает
необходимость предотвращения утечки летучих веществ, поддержания повышенного
или пониженного давления, изолирования содержимого сосуда от внешней среды
(проникновения воздуха и водяных паров). Герметичность обеспечивается
уплотнителями или специальными устройствами - затворами, а надежная работа
уплотнителей зависит, в свою очередь, от подачи смазывающей жидкости (воды,
масла, глицерина и др.)
Чтобы обеспечить равномерную, бесшумную работу мешалок, необходимо
фиксировать положение их оси. Используемые для крепления штативы должны быть
достаточно неподвижны, а стержень мешалки при вращении не должен колебаться.
Перед началом работы, прокручивая мешалку вручную, необходимо убедиться,
насколько легко она вращается, не задевает ли стенок реактора, термометра и
других деталей прибора.
Получение однородной массы твердых сыпучих твердых материалов из
отдельных веществ путем их смешения может осуществляться одновременно с химическими
превращениями, с измельчением, нагреванием, охлаждением, увлажнением. В
промышленных условиях для этого используются специальные аппараты
периодического и непрерывного действия.
При смешивании нескольких твердых веществ, необходимо, чтобы они имели, по
возможности, наиболее мелкие, одинаковые по размеру частицы.
В лабораторных условиях измельченные вещества можно насыпать на середину
квадратного листа и смешать перекатыванием, приподнимая поочередно его концы.
Хорошо смешиваются твердые вещества при многократном просеивании через сита,
диаметр отверстий которых превышает диаметр рабочих частиц в 2-3 раза. Смешение
может проводиться и путем многократного пересыпания веществ из одного сосуда в
другой, при этом емкости наполняются смешиваемыми веществами не более чем на
половину объема.
Все приборы, предназначенные для измельчения (ступки, мельницы и др.),
могут использоваться и для смешения.
I.3.5
ВЫСУШИВАНИЕ
В органической химии проведение некоторых реакций возможно лишь при
отсутствии влаги, поэтому необходимо предварительное высушивание исходных
веществ. Высушивание - процесс освобождения вещества независимо от его
агрегатного состояния от примеси жидкости. Высушивание может проводиться
физическими и химическими способами.
Физический способ заключается в пропускании через высушиваемое вещество
сухого газа (воздуха), нагревания или выдерживания его в вакууме, охлаждения и
т.д. При химическом способе используют высушивающие реагенты. Выбор способа
высушивания определяется природой вещества, его агрегатным состоянием,
количеством жидкой примеси и требуемой степенью осушения (табл. 1.2).
Высушивание никогда не бывает абсолютным и зависит от температуры и осушающего
средства.
Высушивание газов производят путем пропускания их либо через слой
водопоглощающей жидкости (обычно через концентрированную серную кислоту),
налитой в промывную склянку Дрекселя (рис. 1.22), либо через слой
гранулированного осушителя, помещенного в специальную колонку или U-образную трубку. Эффективным
способом высушивания воздуха или газов является сильное охлаждение. При
пропускании тока через ловушку, охлаждаемую смесью ацетона с сухим льдом или
жидким азотом, происходит вымораживание воды, которая осаждается на поверхности
ловушки.
Таблица 1.2.
Наиболее распространенные осушители и их применение
|
Осушитель
|
Осушаемые вещества
|
Вещества, для которых
применение недопустимо
|
|
Р2О5
|
Газы нейтральные и кислые,
ацетилен, сероуглерод, углеводороды и их галогенопроизводные, растворы кислот
|
Основания, спирты, простые
эфиры, хлороводород, фтороводород
|
|
СаН2
|
Благородные газы,
углеводороды, простые и сложные эфиры, кетоны, тетрахлорметан,
диметисульфоксид, ацетонитрил
|
Вещества кислотного
характера, спирты, аммиак, нитросоединения
|
|
СаО (натронная известь)
|
Газы нейтральные и
основные, амины, спирты, простые эфиры
|
Альдегиды, кетоны, вещества
кислого характера
|
|
Na метал.
|
Простые эфиры,
углеводороды, третичные амины
|
Хлорпроизводные
углеводо-родов, спирты и вещества, реагирующие с натрием
|
|
конц. H2SO4
|
Газы нейтрального и кислого
характера
|
Ненасыщенные соединения,
спирты, кетоны, основания, сероводород, йодоводород
|
|
NaOH, KOH
|
Альдегиды, кетоны, вещества
кислого характера
|
|
безвод. K2CO3
|
Ацетон, амины
|
Вещества кислого характера
|
|
СаС12
|
Парафиновые углеводороды,
олефины, ацетон, простые эфиры, нейтральные газы, хлороводород
|
Спирты, аммиак, амины
|
|
безвод. Na2SO4, MgSO4
|
Сложные эфиры, растворы
веществ, чувствительные к различным воздействиям
|
Спирты, аммиак, альдегиды,
кетоны
|
|
Силика-гель
|
Различные вещества
|
Фтороводород
|
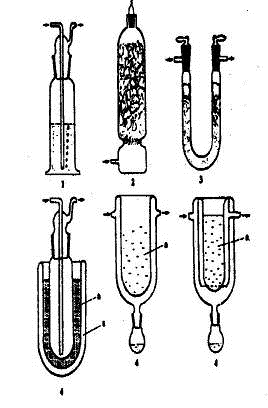
Рис. 1.22. Высушивание газов: 1) склянка Дрекселя, 2) колонка с твердым
осушителем, 3) U-образная трубка,
4) охлаждаемые ловушки: а) охлаждающая жидкость, б) сосуд Дьюара
Высушивание жидкостей обычно осуществляется с помощью непосредственного
контакта с тем или иным осушителем. Твердый осушитель помещают в колбу, в
которой находится высушиваемая органическая жидкость. Следует отметить, что
применение слишком большого количества осушителя может привести к потере
вещества в результате ее сорбции.
Высушивание твердых веществ производится простейшим способом, который
заключается в следующем: высушиваемое вещества помещают тонким слоем на лист
чистой фильтровальной бумаги и оставляют при комнатной температуре. Высушивание
ускоряется, если его проводить при нагревании, например, в сушильном шкафу.
Небольшие количества твердых веществ сушат в обычных или вакуумных эксикаторах,
которые представляют собой толстостенные сосуды с притертой шлифованной
крышкой. Шлифованные поверхности крышки и самого эксикатора должны быть
смазаны. Осушитель находится в нижней части эксикатора, а высушиваемые вещества
в бюксах или чашках Петри размещают на фарфоровые перегородки. Вакуумный
эксикатор отличается от обычного тем, что в его крышке есть кран для
подключения к вакууму. Эксикаторы применяют только для работы при комнатной
температуре, их нельзя нагревать.
.4 СПОСОБЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ ВЕЩЕСТВ
I.4.1
ФИЛЬТРОВАНИЕ
Простейшим способом отделения жидкости от находящихся в ней частиц
твердого вещества является декантация - сливание жидкости с отстоявшего осадка.
Однако таким способом трудно отделить полностью жидкую фазу от твердой. Этого
можно достичь фильтрованием - пропускание жидкости с осадком через фильтрующий
материал. Существуют различные фильтрующие материалы и различные способы
фильтрования.
Наиболее распространенным фильтрующим материалом в лаборатории является
фильтровальная бумага. Из нее изготавливают бумажные фильтры. Размер фильтра
определяется массой осадка, а не объемом фильтруемой жидкости. Отфильтрованный
осадок должен занимать не более половины объема фильтра. Перед началом работы
фильтр смачивают тем растворителем, который предстоит фильтровать. Во время
фильтрования уровень жидкости должен быть немного ниже верхнего края бумажного
фильтра.
Простой фильтр изготавливают из квадратного кусочка фильтровальной бумаги
(рис. 1.23.) Фильтр должен плотно прилегать к внутренней поверхности стеклянной
воронки. Складчатый фильтр имеет большую фильтрующую поверхность, фильтрование
через него идет быстрее. Если в растворе содержаться сильные кислоты или другие
органические вещества, разрушающие бумагу, для фильтрования используют
стеклянные тигли с пористым стеклянным дном или стеклянные воронки с впаянными
в них пористыми стеклянными пластинками. Стеклянные фильтры в соответствии с
размером пор имеют номер: чем больше номер фильтра, тем меньше сечение пор и
тем более мелкие осадки можно на нем фильтровать.
В лаборатории применяют несколько способов фильтрования: простое, в
вакууме, горячее.
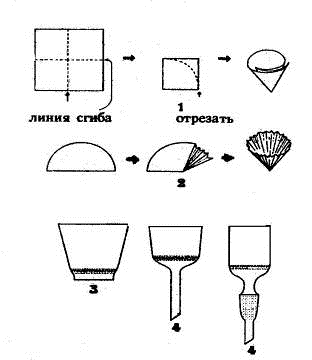
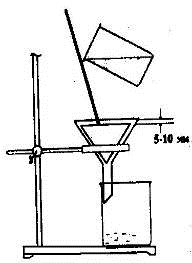

Рис. 1.23. Фильтры: Рис. 1.24. Простое фильтрование
) изготовление простого фильтра, 2) изготовление складчатого фильтра, 3)
фильтрующий тигель с пористой пластинкой, 4) воронки со стеклянной пористой
пластинкой
Простое фильтрование сводится к использованию стеклянной воронки с
вложенным в нее бумажным фильтром (рис. 1.24). Воронку вставляют в кольцо, под
нее ставят стакан или плоскодонную колбу для сбора отфильтрованной жидкости
(фильтрата). Носик воронки должен быть немного опущен в приемник и касаться его
стенки. Фильтруемую жидкость переносят на фильтр по стеклянной палочке.
Для ускорения и более полного отделения осадка от фильтрата прибегают к фильтрованию
в вакууме. В плоскодонную толстостенную колбу Бунзена с помощью резиновой
пробки вставляют фарфоровую воронку Бюхнера (рис. 1.25), имеющую плоскую
дырчатую перегородку, на которую кладут бумажный фильтр. Фильтр вырезают по
размеру дна воронки. Вакуум создают водоструйным насосом. При ослаблении напора
в водопроводной сети вода из насоса может попасть в прибор. Во избежание этого
устанавливают предохранительную склянку.
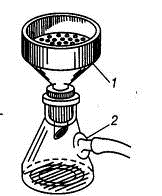



а) б)
Рис. 1.25. Фильтрование а) в вакууме: 1) колба Бунзена, 2) воронка
Бюхнера; б) малых количеств веществ
При проведении фильтрования в вакууме необходимо соблюдать определенные
правила: 1) подключение водоструйного насоса и присоединение его к системе, 2)
смачивание фильтра небольшим количеством того растворителя, который
предполагается фильтровать, 3) внесение фильтрующей жидкости. Собранный на
фильтр осадок отжимают стеклянной пробкой, пока из воронки не перестанет капать
маточный раствор. Если при фильтровании возникает свистящий звук, то это
указывает на неплотно положенный или прорвавшийся фильтр, в этом случае фильтр
следует заменить. Если осадок на воронке Бюхнера требуется промыть, то с
помощью трехходового крана сначала соединяют колбу Бюнзена с атмосферой, затем
осадок пропитывают промывающей жидкостью и фильтруют, вновь подключив вакуум.
После окончания фильтрования сначала отключают всю систему от вакуума, затем
выключают водоструйный насос.
Горячие растворы обычно фильтруются быстрее, чем холодные, так как
нагретая жидкость имеет меньшую вязкость. Горячее фильтрование проводят в
стеклянных воронках, обогреваемых снаружи тем или иным способом (рис. 1.26).
Простейший способ, наиболее применимый для фильтрования водных растворов,
состоит в использовании воронки с укороченным хвостом, которую помещают в
стакан без носика с диаметром несколько меньшим, чем верхний край воронки. На
дно стакана наливают немного воды, а воронку закрывают часовым стеклом. Воду в
стакане доводят до кипения. Когда пары воды нагреют воронку, часовое стекло
снимают и в воронку наливают горячую фильтруемую смесь. В течение всего
процесса фильтрования раствор в стакане поддерживают в состоянии слабого кипения.
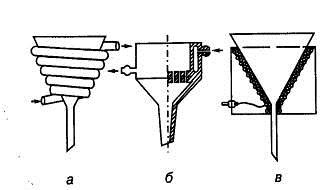


1) 2)
Рис. 1.26. Воронки для 1) горячего фильтрования: а) с паровым обогревом,
б) с обогревом горячей водой, в) с электрическим обогревом; 2) фильтрования при
охлаждении
I.4.2
КРИСТАЛЛИЗАЦИЯ
Кристаллизация является одним из наиболее важных методов очистки и
выделения твердых веществ в лабораторных и промышленных условиях. Метод основан
на процессе образования кристаллов из расплава, раствора или газовой фазы. Но
получаемое в результате кристаллизации вещество не всегда бывает достаточно
чистым, поэтому полученный продукт подвергают дальнейшей очистке, которая
называется перекристаллизацией. Загрязненное вещество при нагревании растворяют
в подходящем растворителе и получают насыщенный раствор. Горячий раствор
фильтруют, освобождая от нерастворимых примесей, затем фильтрат охлаждают. При
охлаждении насыщенного раствора растворимость веществ уменьшается. Часть
растворенного вещества выпадает в виде осадка, который содержит меньше
примесей, чем исходное вещество. Метод применим для веществ, у которых
растворимость существенно возрастает с повышением температуры.
Результат кристаллизации зависит в большей степени от выбора растворителя
(таб. 1.3). Очищаемое вещество должно плохо растворяться в выбранном
растворителе на холоде и хорошо - при его температуре кипения. Загрязняющие
примеси должны трудно растворяться либо быть нерастворимыми в данном
растворителе. Растворитель не должен вступать с растворяемым веществом в
реакцию. Он должен обусловливать образование устойчивых кристаллов и легко
удаляться с поверхности кристаллов при отмывании и высушивании.
Таблица 1.3.
Растворители, применяемые при перекристаллизации
|
Свойства
|
Класс соединений
|
Растворители
|
|
Гидрофобные
|
Углеводороды,
галогенопроизводные углеводородов, простые эфиры
|
Углеводороды, эфир,
галогенопроизводные углеводородов
|
|
Амины, сложные эфиры,
нитросоединения
|
Сложные эфиры
|
|
Нитрилы, кетоны, альдегиды
|
Спирты, диоксан, уксусная
кислота
|
|
Фенолы, амины, спирты,
карбоновые кислоты, сульфокислоты
|
Спирт, вода
|
|
Гидрофильные
|
Соли
|
Вода
|
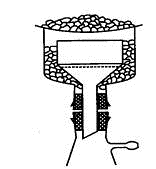
Когда растворитель подобран, вещество нагревают с ним до кипения,
соблюдая все меры предосторожности. Сначала растворитель берут в меньшем
количестве, чем необходимо для полного растворения вещества, а затем через
обратный холодильник добавляют его небольшими порциями (рис. 1.27).
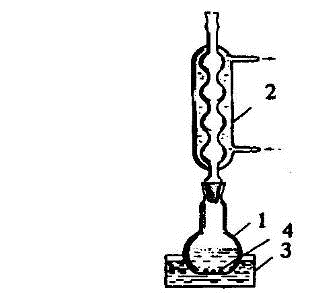
Рис. 1.27. Прибор для кристаллизации:
) колба, 2) обратный холодильник, 3) баня, 4) кипятильники
При необходимости раствор обесцвечивают, добавляя адсорбент (измельченный
активированный уголь, мелко изорванную фильтровальную бумагу). Перед
добавлением адсорбентов раствор следует немного охладить, так как эти вещества
могут усилить процесс кипения, что приведет к энергичному выбросу из колбы.
Смесь растворенного вещества с адсорбентом вновь нагревают до кипения и
фильтруют в горячем виде, используя коническую воронку и складчатый фильтр.
Колбу с фильтратом оставляют охлаждаться. Постепенно из фильтрата выпадают
кристаллы исследуемого вещества. Медленное охлаждение фильтрата позволяет
получить крупные кристаллы, быстрое - мелкие.
Твердые органические вещества при отгонке растворителей могут выделяться
в виде маслянистых жидкостей, что затрудняет их кристаллизацию. Этого можно
избежать путем внесения нескольких чистых кристаллов кристаллизуемого вещества.
Трение стеклянной палочкой о стенки сосуда также облегчает процесс
кристаллизации.
ПРАКТИКУМ
Опыт 1. ПЕРЕКРИСТАЛЛИЗАЦИЯ БЕНЗОЙНОЙ КИСЛОТЫ
Р е а к т и в ы: бензойная кислота, вода
В коническую колбу емкостью 100 мл помещают 1 г бензойной кислоты и 50 мл
воды. Смесь нагревают до кипения - бензойная кислота полностью растворяется.
Горячий раствор быстро фильтруют через складчатый фильтр и фильтрат поровну
разливают в две колбы. Содержимое одной колбы быстро охлаждают под струей
водопроводной воды или во льду и встряхивают. Бензойная кислота выпадает в виде
мелких кристаллов.
Раствор в другой колбе выдерживают при комнатной температуре в течение
20-25 минут. Происходит медленная кристаллизация и образуются блестящие крупные
пластинчатые кристаллы бензойной кислоты. Полученные кристаллы отфильтровывают
и высушивают. Т.пл.=1220С.
Опыт 2. ПЕРЕКРИСТАЛЛИЗАЦИЯ АЦЕТАНИЛИДА
В СПИРТОВОМ РАСТВОРЕ
Р е а к т и в ы: ацетанилид, этиловый спирт
В колбу помещают 1 г ацетанилида и 5 мл этилового спирта. Содержимое
колбы, постоянно встряхивая, нагревают на горячей водяной бане до начала
кипения смеси, достигая полного растворения ацетанилида. Половину полученного
спиртового раствора отливают в пробирку и охлаждают ее. К оставшейся части
горячего раствора при встряхивании добавляют теплую воду (12-15 мл) до
появления слабой мути, после чего раствор слегка подогревают до просветления и
дают ему остыть. При охлаждении спиртового раствора осадок ацетанилида не
образуется, в то времы как из водно-спиртового раствора при легком встряхивании
выделяются кристаллы.
Растворимость ацетанилида в воде гораздо меньше, чем в спирте. Добавление
воды к спиртовому раствору понижает растворимость ацетанилида, чем достигается
насыщенность горячего раствора, при охлаждении которого наблюдается образование
обильного кристаллического осадка. Т.пл.=1140С.
I.4.3
ВОЗГОНКА
Возгонкой (сублимация) называется процесс испарения твердого вещества с
последующей конденсацией его паров непосредственно в твердое вещество, минуя
жидкую фазу. Возгонку применяют для очистки тех органических веществ,
кристаллизация которых затруднена.
Для возгонки небольшого количества вещества при атмосферном давлении его
помещают в фарфоровую чашку и накрывают кружочком фильтровальной бумаги с
мелкими отверстиями, проделанными иглой. Сверху помещают опрокинутую стеклянную
воронку, носик которой плотно закрывают ватным тампоном (рис. 1.28). Чашку осторожно
нагревают. Пары возгоняющегося вещества проходят через отверстия на фильтре и
конденсируются на внутренних стенках воронки. Перегородка защищает кристаллы
чистого вещества от падения в зону нагрева.
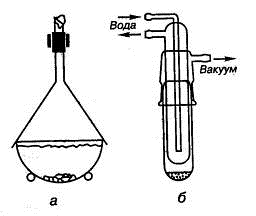
Рис. 1.28. Приборы для возгонки: а) при атмосферном давлении, б) в
вакууме
Скорость возгонки обратно пропорциональна внешнему давлению. Для
увеличения скорости процесса можно повышать температуру, пропускать над
веществом слабый ток воздуха или понижать давление. Проведение возгонки под
вакуумом позволяет также понизить температуру, что очень важно в случае
разлагающихся веществ. Как и при любом испарении, скорость возгонки
пропорциональна площади испаряемой поверхности, поэтому вещество перед
возгонкой необходимо тщательно измельчить и не допускать его плавления.
Недостатками возгонки являются относительно большая длительность процесса
и ограниченность применения. Однако данный метод чистки выгодно отличается от
перекристаллизации отсутствием контакта вещества с растворителем и высоким
конечным выходом.
ПРАКТИКУМ
Опыт 3. ОЧИСТКА НАФТАЛИНА И АНТРАХИНОНА МЕТОДОМ СУБЛИМАЦИИ
Р е а к т и в ы: нафталин, антрахинон
В фарфоровую чашку помещают нафталин (антрахинон), собирают систему для
возгонки. После сублимации наблюдают выпадение кристаллов очищенного нафталина
(антрахинона) на фильтровальной бумаге. Т.пл.=80,30С.
I.4.4
ПЕРЕГОНКА
Перегонка - это процесс разделения многокомпонентных жидких смесей на
отдельные, отличающиеся по составу фракции. С помощью перегонки осуществляют очистку
и разделение летучих веществ, как правило, жидкостей. Перегонка применима лишь
тогда, когда перегоняемое вещество устойчиво при температуре кипения.
В зависимости от условий проведения процесса различают простую,
фракционную перегонку, перегонку с водяным паром и под вакуумом.
Простая перегонка эффективна в тех случаях, когда температуры кипения
входящих в состав смеси веществ существенно различаются (не менее чем на 800С).
Типичный прибор для простой перегонки при атмосферном давлении состоит из круглодонной
длинногорлой колбы с отводом (колба Вюрца), прямого холодильника, аллонжа и
колбы-приемника (рис.1.29).


Рис. 1.29. Прибор для простой перегонки жидких веществ:
) горелка Бунзена, 2) кольцо с зажимом и асбестовой сеткой, 3) перегонная
колба (колба Вюрца), 4) лапка с зажимом, 5) термометр, 6) штативы, 7)
холодильник Либиха, 8) аллонж, 9) приемная колба
В горло колбы Вюрца вставляют термометр таким образом, чтобы ртутный
шарик термометра находился на 0,5 см ниже отверстия отводной трубки колбы
Вюрца. В зависимости от температуры кипения жидкости используют водяной (до
110-1200С) или воздушный (выше 1200С) холодильники.
Жидкость, подлежащую перегонке, вносят в колбу Вюрца через воронку, носик
которой должен быть ниже отвода колбы Вюрца. При этом перегонную колбу
заполняют не более чем на 2/3 объема. Чтобы не возникло перегрева и жидкость
кипела равномерно, в перегонную колбу вносят так называемые «кипятильники» -
небольшие кусочки неглазурованной тарелки или капилляры, опущенные открытым
концом вниз.
Выбор нагревательного прибора зависит от температуры кипения перегоняемой
жидкости, ее горючести и взрывоопасности. Для равномерного нагревания лучше
всего помещать перегонную колбу в соответствующую баню. Перегонку ведут с такой
скоростью, чтобы в течении секунды в приемник стекало не более двух капель
перегонной жидкости (дистиллята). Перегонку нельзя проводить досуха, В колбе
всегда должно оставаться не менее 2-3 мл жидкости.
В течение всей перегонки индивидуального вещества температура паров
должна оставаться постоянной. Если в ходе перегонки температура поднимается,
значит, перегоняется смесь веществ. В начальный момент перегонки температура
обычно бывает ниже ожидаемой. Это может быть связано либо с инерцией ртутного
термометра, либо с тем, что в первый момент отгоняются более летучие примеси.
Поэтому первые порции дистиллята (до достижения постоянной температуры
перегонки) собирают отдельно и выбрасывают. После того, как температура
установилась, собирают основную фракцию вещества. Как только температура вновь
начинает возрастать, приемник меняют для сбора другой фракции.
Температура кипения вещества зависит от давления. Если перегонку вести
при остаточном давлении, то температура кипения перегоняемого вещества будет
отличаться от справочной. В связи с этим нужно всегда фиксировать величину
атмосферного давления, при котором производят перегонку.
Фракционная перегонка служит для разделения смешивающихся жидкостей,
кипящих при различной температуре.
Фракционную перегонку проводят в приборе, принципиально одинаковом с
прибором для простой перегонки, но снабженном дефлегматором (рис. 1.30).
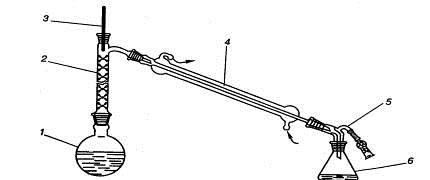

Рис. 1.30. Прибор для фракционной перегонки:
) перегонная колба, 2) дефлегматор, 3) термометр, 4) холодильник, 5)
аллонж с хлоркальциевой трубкой, 6) приемник
Получаемый конденсат паров собирают в виде нескольких фракций. Чем больше
число фракций, тем эффективнее окажется разделение. В каждой из полученных
фракций содержится смесь веществ, но первые фракции обогащены более летучим
компонентом, а последние - менее летучим.
Для повышения эффективности разделения смеси и, следовательно, уменьшения
числа повторных перегонок, используют дефлегматоры. Сущность действия
дефлегматора состоит в том, что при прохождении по нему паров происходит их
охлаждение на стенках дефлегматора м частичная конденсация, в первую очередь
более высококипящего компонента. Конденсирующие пары в виде жидкости (флегмы)
стекают обратно в перегонную колбу (отсюда и возникло название дефлегматора).
Процесс повторяется многократно и это обеспечивает высокую эффективность
разделения.
Для исключения контакта перегнанного вещества с влагой воздуха служит
аллонж с тубусом (отводной трубкой). Аллонж герметично соединен с
колбой-приемником, а тубус - с хлоркальциевой трубкой. Хлоркальциевые трубки
предотвращают попадание паров влаги во внутреннее пространство прибора,
обеспечивая при этом сообщение с атмосферой.
Перегонка с водяным паром основана на том, что высококипящие не
смешивающиеся или мало смешивающиеся с водой вещества при пропускании через них
водяного пара улетучиваются и вместе конденсируются в холодильнике. Собранный в
приемник дистиллят в виде двух слоев несмешивающихся жидкостей разделяют затем
в делительной воронке. С помощью перегонки с водяным паром удается перегнать
при температуре 1000С вещества, кипящие существенно выше (табл. 1.4).
Таблица 1.4.
Некоторые вещества, перегоняемые с водяным паром
|
Вещество
|
Т.кип., 0С
|
Содержание вещества в
дистилляте, %
|
|
Чистое вещество
|
Смесь вещества с водяным
паром
|
|
|
Фенол
|
182,0
|
98,6
|
20,6
|
|
Анилин
|
184,4
|
98,5
|
23,1
|
|
о-Крезол
|
190,1
|
98,8
|
19,3
|
|
Нитробензол
|
210,9
|
99,3
|
15,3
|
|
Нафталин
|
218,2
|
99,3
|
14,4
|
|
Бромбензол
|
156,2
|
95,5
|
61.0
|
С водяным паром можно перегонять органические вещества, которые
практически не смешиваются с водой или ограниченно смешиваются с нею при
температуре кипения, но химически не взаимодействуют.
Перегонку с водяным паром проводят в приборе, состоящем из парообразователя,
перегонной колбы, холодильника и приемника (рис. 1.31).
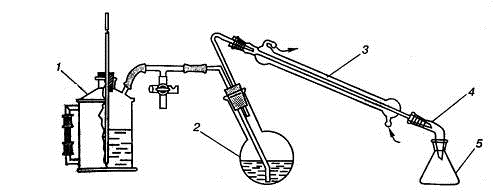

Рис. 1.31. Прибор для перегонки с водяным паром:
) парообразователь, 2) перегонная колба, 3) холодильник, 4) аллонж, 5)
приемник
Парообразователь представляет собой металлический сосуд, снабженный
водомерным стеклом и предохранительной трубкой. Трубка должна доходить почти до
дна и служит для выравнивания давления. Перегонку начинают с того, что воду в
парообразователе доводят до кипения и, перекрыв зажим на тройнике, направляют
струю пара в перегонную колбу. Пар проходит через перегоняемую смесь и, увлекая
за собой перегоняемый компонент смеси, поступает в холодильник и далее в виде
конденсата в приемник. Обычно перегонную колбу также нагревают, чтобы в ней не
конденсировался водяной пар. Перегонку ведут до тех пор, пока дистиллят не
перестанет разделяться на две фазы. Когда будет перегоняться только вода,
открывают зажим на тройнике и лишь после этого прекращают нагревание
парообразователя.
Очистка органических веществ путем перегонки с паром часто дает лучшие
результаты, чем обычная перегонка. Особенно она эффективна в тех случаях, когда
очистке подлежит продукт, сильно загрязненный смолистыми веществами.
Когда для снижения опасности разложения перегоняемого вещества необходимо
понизить температуру кипения, целесообразно проводить перегонку в вакууме. Для
приблизительной оценки температуры кипения вещества в вакууме руководствуются
следующим правилом: при уменьшении внешнего давления вдвое температура кипения
вещества понижается на 15-200С.
Прибор для перегонки в вакууме (рис. 1.32) отличается от прибора для
простой перегонки тем, что в качестве перегонной колбы используется колба с
насадкой Кляйзена, снабженная капилляром с очень маленьким внутренним
диаметром. Через этот капилляр в вакуумированную систему тонкой струйкой,
пробулькивая через жидкость в перегонной колбе, поступает воздух, и таким
образом капилляр выполняет ту же роль, что и кипятильники при простой перегонке.
Капилляр должен доходить практически до самого дна колбы. Сверху на него
надевают кусок резинового вакуумного шланга со вставленной тонкой проволочкой,
снабженный винтовым зажимом Гофмана для тонкой регулировки скорости прохождения
через него пузырьков воздуха.
Отбор фракций при фракционной вакуумной перегонке производят с помощью
специальных аллонжей различных конструкций, называемых «пауками». «Паук»
позволяет менять приемник, не отключая систему от вакуума. В систему для
вакуумной перегонки обязательно входят предохранительная склянка и манометр.
Если собирается прибор на шлифах, все они должны быть предварительно смазаны
вакуумной смазкой. Перегоняемое вещество помещают в колбу Кляйзена, соединяют
систему с вакуумом и проверяют герметичность системы с помощью манометра.
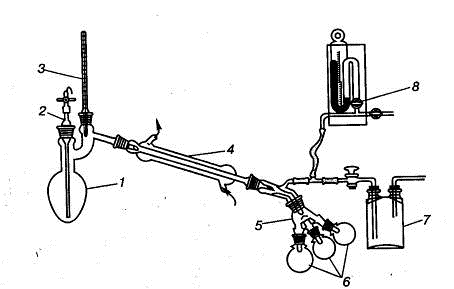

Рис. 1.32. Прибор для перегонки в вакууме:
) перегонная колба, 2) капилляр, 3) термометр, 4) холодильник, 5) аллонж
(«паук»), 7) предохранительная склянка, 8) манометр
По достижении нужного вакуума начинают нагревание колбы. В ходе перегонки
необходимо следить за температурой и давлением. По окончании перегонки сначала
удаляют источник нагрева, колбе дают немного охладиться и лишь после этого
медленно соединяют прибор с атмосферой. Для этого сначала полностью открывают зажим
Гофмана на капилляре, затем открывают трехходовой кран и только тогда выключают
насос. Осторожно открывая кран манометра, медленно впускают в него воздух.
ПРАКТИКУМ
Опыт 4. ПРОСТАЯ ПЕРЕГОНКА ЖИДКИХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Р е а к т и в ы: ацетон, хлороформ, дихлорэтан, бензол
Собирают прибор для простой перегонки (рис.1.29) и проводят перегонку
одну из ниже приведенных жидкостей: ацетон (560С), хлороформ (610С), дихлорэтан
(83,70С), бензол (800С).
Опыт 5. ФРАКЦИОННАЯ ПЕРЕГОНКА ЖИДКИХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Р е а к т и в ы: смеси анилин-хлороформ, хлороформ-ксилол, бензол-ксилол
Собирают прибор для фракционной перегонки (рис.1.30) и проводят перегонку
одной из нижеприведенных смесей: смеси анилин (1840С)-хлороформ (610С),
хлороформ (610С)-м-ксилол (1390С), бензол (800С)-м-ксилол (1390С).
Опыт 6. ПЕРЕГОНКА ЖИДКИХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ С ВОДЯНЫМ ПАРОМ
Р е а к т и в ы: анилин
Собирают прибор для перегонки с водяным паром (рис.1.31) и проводят
перегонку анилина. Анилин отделяют от воды с помощью делительной воронки, сушат
над хлористым кальцием, сливают с хлористого кальция в сухую склянку и
перегоняют методом простой перегонки.
I.5 Важнейшие физические константы
Каждое органическое вещество характеризуется постоянными физическими
свойствами в определенных условиях (температура и давление).
В химической литературе чаще всего приводятся следующие физические
свойства: температура плавления (Т.пл.), температура кипения (Т.кип.),
показатель преломления, удельное вращение, плотность, вязкость, УФ-, ИК-,
ПМР-спектры.
Определив важнейшие физические константы неизвестного соединения и
сравнив их с литературными данными, можно идентифицировать неизвестное вещество
(установить структуру) и доказать его чистоту.
I.5.1
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ
Термином «температура плавления» обозначают диапозон температур, в
котором происходит превращение твердого вещества в жидкое. Начальная
температура плавления - та температура, при которой появляется первая жидкая
капля. Конечная температура плавления - та, при которой все твердое вещество переходит
в жидкое. Разность между конечной и начальной температурой плавления должна
быть не более 10С. Для чистых органических веществ температура плавления должна
быть четкой.
Для определения температуры плавления небольшое количество исследуемого
вещества растирают в ступке и помещают в капилляр, запаянный с одного конца,
постукивая открытым концом, набирают в него немного вещества и бросают
запаянным концом вниз в длинную стеклянную трубку, вертикально стоящую на
жесткой поверхности, для перевода вещества к запаянному концу. Капилляр,
наполненный веществом, прикрепляют с помощью резинового кольца к термометру
таким образом, чтобы вещество находилось на уровне середины шарика термометра.
Термометр с одним или несколькими капиллярами укрепляют в чистой сухой пробирке
с помощью пробки, имеющей вырез напротив шкалы термометра (рис. 1.33). Он не
должен соприкасаться со стенками пробирки, а его резервуар должен находиться
выше дна пробирки на 0,5-1 см.
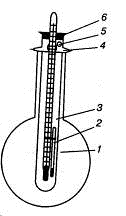
Рис. 1.33. Прибор для определения температуры плавления:
) круглодонная колба, 2) капилляр с веществом, 3) пробирка, 4) отростки
для удерживания пробирки, 5) отверстие, 6) пробка с термометром
Пробирку с термометром укрепляют вертикально в лапке штатива и подводят
под нее на кольце с сеткой стакан (колбу) с вазелиновым маслом. Уровень
жидкости должен быть выше резервуара термометра, а пробирка должна находиться
на расстоянии не меньше чем 0,5-1 см от дна стакана (колбы). Собранный прибор
медленно нагревают, внимательно следя за повышением температуры и состоянием
вещества в капилляре. Наблюдая за веществом в капилляре, отмечают и записывают
изменение окраски, разложение, слипание, спекание и т.п. Когда столбик вещества
начинает заметно сжиматься и «мокнуть», нагревание прекращают. Началом
плавления считают появление первой капли в капилляре, а окончанием -
исчезновение последних кристаллов.
Некоторые органические вещества не имеют характерной точки перехода из
твердого состояния в жидкое и при быстром и сильном нагревании обугливаются,
улетучиваются. К числу таких веществ относится ацетилсалициловая кислота
(аспирин), температура плавления которой определяется по иному. Наполняют
капилляр, как обычно, растертым порошком исследуемого вещества, прикрепляют к
термометру, но в прибор помещают термометр без вещества. Когда температура
достигнет 123-1250С. вносят в прибор термометр с капилляром и продолжают, как
обычно, определение температуры плавления.
ПРАКТИКУМ
Опыт 7. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ ТВЕРДЫХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Р е а к т и в ы: салол, нафталин, ацетанилид, бензойная кислота, аспирин
Собирается прибор для определения температуры плавления (рис.1.33.) и
определяют температуру плавления следующих веществ: салол (420С), нафталин
(80,30С), ацетанилид (1140С), бензойная кислота (1220С), аспирин (1350С).
Полученные данные сравнивают со справочными данными.
I.5.2
ТЕМПЕРАТУРА КИПЕНИЯ
Температура кипения - это температура, при которой происходит переход
вещества из жидкого агрегатного состояния в газообразное. Температуру кипения
исследуемого вещества можно определить двумя способами: 1) путем его перегонки,
2) микрометодом по Сиволобову.
Для выполнения первого способа определения температуры кипения собирают
прибор для простой перегонки (рис. 1.30) и проводят перегонку исследуемого
вещества. При попадании в приемник первой капли отгона отмечают температуру и
условно считают ее температурой начала кипения. Чистое вещество перегоняется
практически полностью в пределах 1-20С. Следует помнить, что для соединений с
Т.кип.<1500С используют водяной холодильник, при Т.кип.>1500С водяной
холодильник заменяют воздушным (стеклянная трубка такой же длины).
Для определения температуры кипения малого количества жидкости используют
микрометод Сиволобова. Каплю жидкости помещают в запаянную с одного конца
тонкостенную стеклянную трубку диаметром 2,5-3 мм. В нее открытым концом
опускают капилляр, который в верхней части на расстоянии 1 см от открытого
конца запаян. Прикрепляют трубку к термометру (рис. 1.34) и нагревают в приборе
для определения температуры плавления.
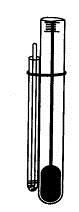
Рис. 1.34. Прибор Сиволобова
Как только исследуемая жидкость в капилляре нагреется до температуры,
чуть выше температуры ее кипения, из капилляра непрерывно начнут выходить
пузырьки. Для точного установления температуры кипения дальнейшее нагревание
прекращают и отмечают ту температуру, при которой прекратится выделение
пузырьков.
ПРАКТИКУМ
Опыт 8. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ЖИДКИХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Р е а к т и в ы: хлороформ, дихлорэтан
Определяют температуру кипения хлороформа, дихлорэтана методом простой
перегонки и микрометодом Сиволобова.
II МЕТОДЫ УСТАНОВЛЕНИЯ СТРОЕНИЯ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Существует два основных метода установления строения органических
соединений. Если исследуемое вещество ранее изучено, то для доказательства его
структуры определяют физические константы и спектральные характеристики,
которые сравнивают с литературными данными. Если же органическое соединение
получено впервые, сначала его подвергают качественному и количественному
элементному анализу, а затем определяют молекулярную массу.
На основании молекулярной массы и данных элементного анализа
устанавливают молекулярную формулу вещества. Определяют структуру углеродного
скелета, природу и положение атомов в пространстве. Для этих целей используют
химические и физические методы. На основании полученных данных выводят
структурную или стереохимическую формулу.
II.1
КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Качественный элементный анализ - это совокупность методов, позволяющих
установить, из каких элементов состоит органическое соединение. Для определения
элементного состава органическое вещество подвергают разрушению, переводят в
простое неорганическое путем полного сжигания, окисления или минерализации
(сплавлением со щелочными металлами), которое затем исследуют аналитическими
методами.
ПРАКТИКУМ
Опыт 9. ОБНАРУЖЕНИЕ УГЛЕРОДА
Р е а к т и в ы: сахароза, хлорид натрия, концентрированная серная
кислота
На кончик скальпеля или металлического шпателя помещают несколько
кристалликов сахарозы (или любое другое органическое вещество) и осторожно
нагревают в пламени горелки. Сахароза расплавляется, темнеет, обугливается и
полностью сгорает. Для сравнения подобный опыт проводится с хлористым натрием.
Хлористый натрий, внесенный на кончике скальпеля в пламя горелки, даже при
длительном нагревании не претерпевает никаких изменений.
Небольшое количество тонкорастертого порошка сахарозы помещают в
фарфоровую чашку и добавляют несколько капель концентрированной серной кислоты
- происходит потемнение белого порошка, обугливание.
Данные опыты подтверждают, что сахароза содержит углерод, то есть
является органическим веществом, легко изменяющимся при нагревании и под
действием концентрированной серной кислоты.
Опыт 10. ОБНАРУЖЕНИЕ УГЛЕРОДА И ВОДОРОДА
Р е а к т и в ы: глюкоза, оксид меди (II), безводный сульфат меди (II), баритова вода
Метод основан на реакции окисления органического вещества порошком оксида
меди (II). В результате окисления углерод,
входящий в состав анализируемого вещества, образует углекислый газ, а водород -
воду. Качественно углерод определяют по образованию белого осадка карбоната
бария при взаимодействии углекислого газа с баритовой водой. Водород
обнаруживают по образованию кристаллогидрата СuSO4 . 5H2O синего цвета.
В пробирку помещают порошок оксида меди (II) на высоту 10 мм, добавляют равное количество органического
вещества и тщательно перемешивают. В верхнюю часть пробирки помещают небольшой
комочек ваты, на который тонким слоем насыпают белый порошок безводного
сульфата меди (II). Пробирку
закрывают пробкой с газоотводной трубкой так, чтобы один её конец почти касался
ваты, а второй - погружают во вторую пробирку с 1 мл баритовой воды. Осторожно
нагревают в пламени горелки сначала верхний слой смеси вещества с оксидом меди
(II), затем - нижний. При наличии
углерода наблюдают помутнение баритовой воды, обусловленное образованием осадка
карбоната бария. После появления осадка пробирку 3 удаляют, а пробирку 1
продолжают нагревать до тех пор, пока пары воды не достигнут безводного
сульфата меди (II). В присутствии
воды наблюдают изменение окраски кристаллов сульфата меди (II) вследствие образования
кристаллогидрата СuSO4 . 5H2O.
С6Н12О6 + СuО ¾® Сu + СО2 + H2O
СuSO4 + Н2O ¾® СuSO4.
5Н2O
Ва(ОН)2 + СО2 ¾® ВаСО3 + H2O
Опыт 11. ОБНАРУЖЕНИЕ ГАЛОГЕНОВ
А. Реакция Бейльштейна
Р е а к т и в ы: хлороформ, медная проволка
Метод обнаружения галогенов (хлор, бром, йод) в органических соединениях
основан на способности оксида меди (II) при высокой температуре разлагать галогеносодержащие органические
соединения с образованием галогенидов меди (II):
+ CuO ¾® CuHal2 + CO2 + H2O
Медную проволочку предварительно очищают: смачивают в соляной кислоте и
прокаливают в пламени горелки до исчезновения окрашивания пламени. Медь при
этом покрывается черным налетом окиси. После охлаждения проволочки небольшое
количество испытуемого вещества помещают на кончик проволочки, свернутый в виде
петли, и вносят в пламя горелки. При наличии галогена пламя окрашивается в
красивый зеленый цвет.
Б. Метод А.В.Степанова
Р е а к т и в ы: хлороформ, этиловый спирт, металлический натрий,
% раствор нитрата серебра
Метод основан на переводе ковалентносвязанного галогена в составе
органического соединения в ионное состояние действием металлического натрия в
спиртовом растворе.
В пробирку помещают 4 капли хлороформа, 2-3 мл этанола и кусочек
металлического натрия (2х2 мм). Реакционная смесь начинает бурно “кипеть”
(выделение водорода), после чего пробирку помещают в стакан с водой для охлаждения.
С2H5OH
+ Na ¾® C2H5ONa + H+ 2H ¾® CH4 + HCl
По окончании выделения пузырьков водорода проверяют, полностью ли
прореагировал металлический натрий, для чего добавляют 3-5 капель этанола.
Убедившись в отсутствии натрия, приливают 3-4 мл воды и подкисляют 20%-ным
раствором азотной кислоты до кислой среды по лакмусу. При последующем
добавлении 1-2 капель 1%-ного раствора нитрата серебра наблюдают появление
обильного осадка xлорида серебра:
-+ Ag+ ¾® AgCl¯
Быстрота и полнота отщепления атома галогена в этих условиях объясняется
одновременным воздействием на хлороформ алкоголята натрия и водорода в момент
выделения.
С2H5ONa + Н2О ¾® C2H5OН + NaОН
NaОН +
HCl ¾® NaCl + H2О
NaОН +
НNО3 ¾® NaNО3 + H2О
NaCl +
AgNО3 ¾® AgCl + NaNО3
В. Открытие галогена разрушением органического вещества сожжением
Р е а к т и в ы: хлороформ, 1% раствор нитрата серебра
Галогены обнаруживают в виде галогенид-ионов по образованию хлопьевидных
осадков серебра галогенидов различного цвета: хлорид серебра - белый, темнеющий
на свету осадок; бромид серебра - бледно-желтый; йодид серебра -
интенсивно-желтый.
Полоску фильтровальной бумаги смачивают хлороформом и зажигают под
перевернутым большим стаканом. После сгорания бумаги на внутренних стенках
стакана появляются росинки воды. Стакан переворачивают и приливают несколько
капель 1%-ного раствора нитрата серебра. Образование мути или белого
творожистого осадка указывает на присутствие галогена в исследуемом хлороформе.
CHCl3
+ О ¾® CО2 + Н2О + HCl
НCl + AgNО3 ¾® AgCl + НNО3
Опыт 12. ОБНАРУЖЕНИЕ АЗОТА
Р е а к т и в ы: мочевина, металлический натрий, 5% раствор сульфата
железа, 1% раствор хлорида железа, 8% раствор соляной кислоты, этиловый спирт.
Азот качественно обнаруживают по образованию берлинской лазури - Fe4[Fe(CN)6]3 - синее
окрашивание.
Опыт проводят в вытяжном шкафу за стеклом или в предохранительных очках,
выполняя приведенные ниже указания. При неосторожном обращении с металлическим
натрием может произойти несчастный случай.
Несколько кристалликов испытуемого вещества мочевины помещают в сухую
пробирку, туда же вносят маленький кусочек металлического натрия, хорошо
очищенного от окисленного слоя. Осторожно нагревают пробирку на пламени
горелки, держа её в деревянном зажиме и следя за тем, чтобы натрий плавился
вмeстe с веществом; отверстие пробирки направляют “от себя”. Через некоторое
время может произойти вспышка. Пробирку продолжают нагревать до получения
однородного сплава, затем её охлаждают и добавляют несколько капель спирта для
удаления остатков металлического натрия, который реагирует со спиртом по
уравнению:
H5ОH + Na C2H5ONа + Н2
В пробирку приливают 1-2 мл воды и нагревают до растворения, к части
раствора прибавляют 2-3 капли свежеприготовленного раствора сульфата железа,
каплю хлорида железа и подкисляют соляной кислотой (для нейтрализации
образующейся в растворе щелочи). При наличии в испытуемом веществе азота
появляется синий осадок берлинской лазури:
NCONH2 + Na NaCN+ FeSO4 Na2SO4 + Fe(CN)2(CN)2 + NaCN
Na4Fe(CN)6Fe(CN)6 + FeCl3 Fe4[Fe(CN)6]3
Опыт 13. ОБНАРУЖЕНИЕ СЕРЫ
Р е а к т и в ы: сульфаниловая кислота, металлический натрий, ацетат
свинца, 1% раствор нитропруссида натрия, 8% раствор соляной кислоты, этиловый
спирт
Серу качественно обнаруживают по образованию темно-коричневого осадка
сульфида свинца (II), а также красно-фиолетового
комплекса с раствором нитропруссида натрия.
В сухую пробирку помещают небольшое количество серосодержащего
органического вещества - сульфаниловой кислоты и небольшой кусочек
металлического натрия. Разрушение вещества сплавлением с металлическим натрием
производят так, как и при определении азота. Если полученный paствор темнеет,
его отфильтровывают от частичек угля. Раствор делят на три части.
Для обнаружения иона S2- одну часть раствора подкисляют соляной кислотой
- ощущается характерный запах сероводорода:
Н2NС6Н4SО3Н + Na Na2SS + HCl H2S + NaCl
Ко второй части раствора приливают раствор ацетата свинца, подкисляют -
выпадает черный осадок PbS или коричневая муть:
РЬ (СН3СОО)2 + Na2S PbS¯ + 2СНзСООNа
К третьей части раствора прибавляют несколько капель свежеприготовленного
раствора нитропруссида натрия. Наблюдают появление красно-фиолетовой окраски,
обусловленное образованием комплексной соли:
Na2S + Nа2[Fе(CN)5NO] Nа4[Fе(CN)5NOS]
III ОСНОВЫ СТРОЕНИЯ, СВОЙСТВА И
ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
III.1
КЛАССИФИКАЦИЯ, ИЗОМЕРИЯ И НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В середине IX века с
интенсивным развитием в области органической химии возникла необходимость
определения новой теории. В 1861 году на Международном съезде естествоиспытателей
и врачей в Шпейере А.М.Бутлеровым была предложена новая теория строения
органических веществ, положения которой заключаются в следующем:
1. Атомы в органических соединениях связаны друг с другом в строгой
последовательности, согласно их валентности. Последовательность связывания
атомов в молекуле называется химическим строением.
2. Химические свойства вещества зависят не только от того, какие
атомы и в каком количестве входят в состав молекулы, но и от того, в какой
последовательности они связаны между собой, т.е. от химического строения
молекулы.
. Атомы в органических соединениях оказывают взаимное влияние друг
на друга, от чего зависит реакционная способность молекулы.
. Изучив реакционную способность вещества, можно установить его
строение и, наоборот, по строению вещества судить о его свойствах.
Одними из классифицированных признаков органических соединений являются
строение углеродного скелета и природа функциональных групп. По первому
признаку органические вещества подразделяются следующим образом:
ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
АЦИКЛИЧЕСКИЕ
ЦИКЛИЧЕСКИЕ
КАРБОЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ
АЛИЦИКЛИЧЕСКИЕ АРОМАТИЧЕСКИЕ
Функциональные группы - это атомы или группы атомов неуглеводородного
характера, которые, являясь заместителями в углеводородной цепи, определяют
химические свойства молекул.
По природе функциональной группы различают разнообразные классы
органических соединений, основные которых приведены в таблице 3.1.
Таблица 3.1.
Классификация органических соединений по природе функциональных групп.
|
Название класса
|
Функциональная группа
|
Общая формула класса
|
|
Галогенопроизводные
углеводородов
|
-F, -Cl,
-Br, -I
|
R-Hal
|
|
Спирты, фенолы
|
-OH
|
R-OH
|
|
Тиоспирты, тиофенолы
|
-SH
|
R-SH
|
|
Простые эфиры
|
-OR
|
R-O-R
|
|
Альдегиды
|
-CH=O
|
R-CH=O
|
|
Кетоны
|
>C=O
|
R2C=O
|
|
Карбоновые кислоты
|
-COOH
|
R-COOH
|
|
Сульфокислоты
|
-SO3H
|
R-SO3H
|
|
Сложные эфиры
|
-COOR
|
R-COOR¢
|
|
Амиды
|
-CONH2
|
R-CONH2
|
|
Нитрилы
|
-CºN
|
R-CºN
|
|
Нитросоединения
|
-NO2
|
R-NO2
|
|
Амины
|
-NH2
|
R-NH2
|
По количеству и однородности функциональных групп органические соединения
делят на монофункциональные, полифункциональные и гетерофункциональные.
Монофункциональные органические соединения содержат одну функциональную группу,
полифункциональные - несколько одинаковых, гетерофункциональные - несколько
различных групп.
Номенклатура органических соединений складывалась на протяжении всего
периода развития органической химии. В историческом аспекте следует выделить
основные номенклатурные системы: тривиальную, рациональную и международную.
Тривиальные названия случайные, они отражают способы получения веществ,
их отличительные свойства или природный источник, из которого соединения
впервые выделялись, например, пирагаллол - продукт пиролиза галловой кислоты,
флуоресцеин - флуоресцирует. Многие тривиальные названия органических
соединений прочно укрепились и до сих пор общепризнанны, особенно в химии
природных и гетероциклических соединений.
Согласно рациональной номенклатуре все вещества в определенном
гомологическом ряду рассматриваются как производные простейшего представителя
данного ряда, в частности у алканов - метана, у алкенов - этилена, у ацетиленов
- ацетилена и т.д. Однако в связи с усложнением химических структур данная
номенклатура оказалось непригодной, поэтому на XIX конгрессе Международного союза теоретической и
прикладной химии в 1957 году были разработаны правила современной номенклатуры,
известной под названием «номенклатура ИЮПАК».
Номенклатура ИЮПАК предусматривает несколько вариантов названий
органических соединений: заместительный и радикало-функциональный.
При названии алканов по заместительной номенклатуре ИЮПАК придерживаются
следующих правил:
1. За основу названия принимают название углеводорода, которому
отвечает наиболее длинная неразветвленная цепь (главная углеродная цепь). Если
в углеводороде имеется несколько цепей одинаковой длины, за главную из них
принимается та, которая имеет наибольшее число разветвлений.
2. Нумеруют атомы углерода главной цепи с того конца, к которому
ближе находится заместитель, если в молекуле алкана заместители расположены на
равном расстоянии от обоих концов, то нумерацию проводят с того конца, к
которому ближе расположен заместитель с названием, стоящим в алфавитном порядке
раньше. Если же на равном расстоянии от обоих концов главной цепи расположены
одинаковые заместители, но с одной стороны количество разветвлений больше, чем
с другой, нумерацию начинают с того конца, где большее число заместителей.
CH3
CH3
CH CH3
CH3-CH-CH-CH2-C-CH2-CH2-CH32,5-диметил-5-этил-3-изопропилоктан
CH3
CH2-CH3
Многообразие органических соединений обусловлено явлением изомерии.
Изомеры - соединения с одинаковым элементным составом, молекулярной
массой, но отличающиеся строением.
Различают следующие виды изомерий:
ИЗОМЕРИЯ
СТРУКТУРНАЯ ПРОСТРАНСТВЕННАЯ
(изомерия строения) (стереоизомерия)
ЦЕПИ ПОЛОЖЕНИЯ ФУНКЦИОНАЛЬНЫХ ГРУПП
КОНФИГУРАЦИОННАЯ КОНФОРМАЦИОННАЯ
ГЕОМЕТРИЧЕСКАЯ ОПТИЧЕСКАЯ
Например:
. изомеры цепи
СН3-СН2-СН2-СН3 и СН3-СН-СН3
н-бутан СН3 2-метилпропан (изобутан)
. изомеры положения
СН2=СН-СН2-СН3 и СН3-СН=СН-СН3
бутен-1 бутен-2
3. изомеры по функциональной группе

бутаналь
метилэтилкетон
4. геометрические изомеры бутена-2

цис-бутен-2
транс-бутен-2
5. конформационные изомеры пропана

КОНТРОЛЬНЫЕ
ВОПРОСЫ И УПРАЖНЕНИЯ
1. Назовите основные способы изображения органических молекул.
Напишите структурные и сокращенные формулы следующих соединений: а) н-бутан, б)
циклопентан, в) пропен, г) этанол, д) уксусная кислота.
2. Назовите основные преимущества структурных формул в сравнении с
молекулярными (брутто-) формулами. Напишите все возможные структурные формулы
соединений, брутто-формула которых: а) С4Н8, б) С3Н8О, в) С3Н7С1.
. Назовите приведенные соединения.
а) Н3С-С=СН-СН2-СН3 б) Н3С-СН-СООН
ï ï
СН3 Br
в)
H3C-CH-CH2-CH2-COOH г) H3C-C-CH2-CH2Br
ï ïï
NO2 О
д) СН3-СН2-С = С-СН3 е) Н2С=СH-СºС-СН3
| |
Н3С СН2-СН3
4. Назовите основные номенклатурные системы органических соединений
и укажите, по какой из них образованы названия следующих соединений: а)
н-гептан, б) тетраметилметан, в) этиловый спирт, г) глицерин, д) уксусная
кислота, е) пентанол-2, к) пропановая кислота. Напишите их стуктурные формулы.
5. Напишите структурные формулы и укажите первичные, вторичные,
третичные и четвертичные атомы углерода в следующих соединениях: а)
3-метилпентан, б) 2,2,4,4-тетраметилгексан, в) этилциклогексан, г)
2-метил-2-фенилбутан.
. Напишите структурные формулы следующих соединений: а)
2,2,4-триметилпентан, б) 2-хлорпропен, в) 3-бромгексан, г)
2-метил-3-хлор-3-этилгексан, д) 2-метилбутен-2, е) метилацетилен.
. Назовите соединения по заместительной номенклатуре ИЮПАК и
рациональной номенклатуре:
СН2-СН3 СН3
ï ï
а) СН3-СН-СН-СН3 б) СН3-СН2-СН-СН2-СН-СН3
ï ï
СН3 СН2-СН3
Н3С-Н2С СН3 СН3
ï ï ï
в) СН3-СН-СН-С-СН3 г) СН3-СН2-СН-СН-СН3
ï ï ï
СН3 СН-СН3 Н3С-СН-СН3
8. Дайте определение понятий «изомерия», «структурные изомеры»,
«стереоизомеры», «конформационные изомеры», «геометрические изомеры» и
«оптические изомеры».
9. Напишите структурные формулы и назовите изомеры состава С6Н14.
. С помощью проекционных формул Ньюмена изобразите заслоненные и
заторможенные конформации н-бутана, возникающие в результате вращения вокруг
С1-С2, С2-С3-связей. Укажите анти- и гош-конформации.
. Используя проекционные формулы Ньюмена, приведите
конформационные изомеры: а) 2-хлорэтанола, 2) 2-аминоэтанола, в)
1,2-дибромэтана, г) этиленгликоля. Укажите энергетически более стабильные
конформеры.
. Назовите соединения, соответствующие приведенным формулам Ньюмена:
а) б) в)
III.2 ХИМИЧЕСКАЯ
СВЯЗЬ И ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
В
органических соединениях различают четыре основных типа химических связей:
ковалентную, ионную, водородную, донорно-акцепторную.
Связь,
образованная за счет общих электронных пар, называется ковалентной связью. Она
образуется между атомами, равными или близкими по электроотрицательности и
является основным типом химической связи в органических соединениях. Связь,
образованная между атомами с одинаковой электроотрицательностью, называется
ковалентной неполярной, и связь, образованная между атомами с незначительной
разницей в электроотрицательности, называется ковалентной полярной.
Ионная
связь образуется между атомами, которые значительно отличаются по
электроотрицательности. В результате образуются противоположно заряженные ионы,
которые электростатически притягиваются друг к другу.
СН3СОО-
Na+ ионная связь
Донорно-акцепторная
связь представляет собой разновидность ковалентной связи и отличается от
последней только способом образования. Если ковалентная связь образуется путем
обобществления пары электронов по одному от каждого атома, то
донорно-акцепторная - за счет двух электронов, предоставляемых одним из атомов.
При этом поставляющий пару электронов в общее пользование, называют донором, а
атом принимающий электроны, - акцептором.
Например:
Н
Н
½ ½ +
Н
N: + Н+ Н N Н
½ ½
H донор акцептор
Н
Частным
случаем донорно-акцепторной связи является семиполярная связь. Она образуется
при взаимодействии атомов, имеющих неподеленные электронные пары (доноры), с
электронейтральными частицами, которые содержат секстет электронов (акцепторы).

Водородная
связь образуется в результате электростатического взаимодействия между
активными атомами водорода в молекуле и атомами с неподеленной электронной
парой (О, N, F) в этой же или в другой молекуле.
N ¬H ···
N- -N ¬
H···O <
водородная
связь
Энергия
водородной связи (10-40 кДж/моль) невелика по сравнению с
энергией ковалентной связи (340-360 кДж/моль). Различают
внутримолекулярные и межмолекулярные водородные связи. Внутримолекулярные
водородные связи возникают в пределах одной молекулы с образованием пяти-,
шести- или семичленных хелатообразных структур (1). Межмолекулярные водородные
связи возникают между двумя или несколькими молекулами с образованием димеров
(2) или ассоциатов (3).

Для
атома углерода характерны три вида гибридизации с участием s- и
р-орбиталей: sр3-, sр2-, sр-. sр3-гибридизация характерна для алканов, sр2-
для алкенов, sр- для алкинов.
В
органических соединениях различают два вида электронных смещений: индуктивный
эффект и мезомерный эффект.
Cмещение
электронной плотности по цепи s-связей называется индуктивным
эффектом (I), а по системе p-связей - мезомерным
эффектом (М).
Индуктивный
эффект проявляется всегда при наличии в молекуле атомов с различной
электроотрицательностью, распространяется только в одном направлении и затухает
через 3-4 s-связи. Бывает положительным (+I) и
отрицательным (-I).
СН3
СН2 СН2 Сl (-I) СН2 =СН СН3 (+I)
Мезомерный
эффект проявляется лишь в том случае, когда заместитель включен в сопряженную
систему молекулы. Различают р,p-сопряжение (=-. .) и p,p-сопряжение (= - =).
СН2=СН
Сl: СН2=СН СH= O СН2=СН СН2 Cl
(+М)
(-М) (М=0)
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Сформулируйте основные положения теории химического строения
органических молекул А.М.Бутлерова.
2. Укажите типы химических связей в следующих соединениях:
 тринитроглицерин
тринитроглицерин
 этанол
этанол
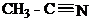 ацетонитрил
ацетонитрил
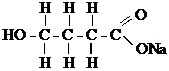 натрий
γ-оксибутират
натрий
γ-оксибутират
 метиламмоний
йодид
метиламмоний
йодид 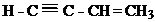 винил ацетилен
винил ацетилен
. Приведите электронные формулы атомов углерода, азота и кислорода.
Объясните, почему углерод в органических соединениях четырехвалентный.
. Какие виды гибридизации возможны для атома углерода в органических
соединениях? Изобразите атомно-орбитальные модели в молекулах этана, этилена и
ацетилена. Как изменяется электроотрицательность атома углерода в зависимости
от гибридизации?
. Определите гибридизацию атома углерода в исходных соединениях и
конечных продуктах реакции:
1)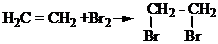
)
3)
)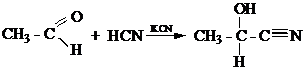
) 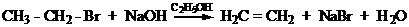
6. Индуктивный эффект. Покажите графически проявление индуктивного
эффекта заместителей в следующих органических соединениях, указав
электродонорные и электроакцепторные заместители:
а) СН3-СН2-С1 б) СН3-СН2-СООН в) СН2=СН-СºСН
г) СН3-С(О)Н д) СН3-СН=СН2 е) СН3-СºN
7. Сопряженные системы с открытой и замкнутой цепью. Определите виды
сопряжения и покажите распределение электронной плотности в молекулах следующих
соединений:
а) СН3-СН=СН2 б) СН2=СН-СН=СН2 в) СН2=СН-С1
г) СН3-СН=СН-СООН д) С6Н5ОН е) С6Н5-С1
8. Мезомерный эффект. Совместное проявление индуктивного и
мезомерного эффектов заместителей. Укажите индуктивные и мезомерный эффекты в
следующих соединениях:
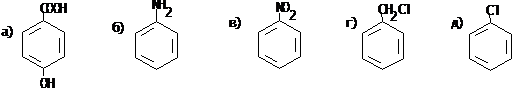
9. Какие свойства - электронодонорные или электроноакцепторные -
проявляют функциональные группы в молекуле 3-метоксипропаналя?
10. Напишите транс-изомер коричной кислоты (С6Н5-СН=СН-СООН)
определите сопряженную систему, вид и знак электронных эффектов карбоксильной
группы.
. Укажите вид и знак электронных эффектов для следующих
соединений: хлоропрен, 4-гидроксибутановая кислота, 2-этоксибутан, этоксибензол
(фенетол), метоксибензол (анизола), анилин, 2-гидроксибензойная кислота,
бензальдегид, бензиловый спирт, хлорбензол, бензилхлорид, аллилхлорид,
винилхлорид, кротоновая кислота, бутановая кислота.
.Проявляют ли одинаковые функциональные группы одни и те же электронные
эффекты в молекулах 2-аминоэтансульфоновой кислоты (таурина) и
п-аминобензолсульфоновой (сульфаниловой) кислоты?
. Приведите пространственное расположение орбиталей в молекуле пропилена, пропина и пропана. Укажите
количество s-, p-, sp3-, sp2-, sp-орбиталей
III.3
АЛКАНЫ. ЦИКЛОАЛКАНЫ
Алканами или предельными углеводородами называют углеводороды
алифатического ряда, в молекулах которых атомы углерода связаны между собой
только простыми ковалентными связями.
Состав их выражается общей формулой СnH2n+2.
Родоначальником гомологического ряда является метан. Каждый член этого ряда
отличается от последующего на звено СН2. Окончание -ан является характерным для
алканов.
Все атомы углерода в алканах находятся в sp3-гибридизации и имеют тетраэдрическую форму.
Называют алканы с разветвленной углеродной цепью согласно заместительной
номенклатуре ИЮПАК и рациональной.
Для алканов характерна структурная и оптическая изомерия. Структурная
изомерия алканов обусловлена разной последовательностью связывания атомов
углерода в молекуле (изомерия цепи). Начиная с углеводорода С7Н16, для алканов
возможна оптическая изомерия. Например, 3-метилгексан
СН3
ï
СН3-СН2-СН-СН2-СН2-СН3
имеет ассиметрический атом углерода и существует в виде двух энантиомеров
(зеркальных изомеров):
СН3 СН3
ï ï
С Н Н С
СН3-СН2 СН2-СН2-СН3 СН3-СН2-СН2 СН2-СН3
R-3-метилгексан
S-3-метилгексан
Главными природными источниками алканов являются нефть и природный газ.
Для получения из нефти смеси алканов и других углеводородов ее подвергают
фракционной перегонке. Существуют и синтетические способы их получения: а)
каталитическое гидрирование оксида углерода (II) (синтез Фишера-Тропша), б) каталитическое гидрирование
алкенов и алкинов, в) взаимодействие галогеналканов с металлическим натрием
(реакция Вюрца), г) сплавление солей карбоновых кислот со щелочами.
В обычных условиях алканы являются малореакционноспособными соединениями.
Они устойчивы к действию кислот, щелочей и окислителей. Химические превращения
алканов чаще сопровождаются гомолитическим расщеплением связей С-Н с
последующим замещением атома водорода другими атомами или группами, т.е. для
них характерны реакции замещения, происходящие по радикальному механизму (SR). При высоких температурах может
наблюдаться гомолитический разрыв связей С-С.
Циклоалканами называют циклические углеводороды, в которых все углеродные
атомы, образующие цикл, находятся в sp3-гибридизованном состоянии.
Циклоалканы классифицируют по размеру цикла, числу циклов и способу
соединения циклов. В соответствии с правилами ИЮПАК названия моноциклических
циклоалканов образуют от названий алканов с соответствующим количеством атомов
углерода, прибавляя префикс цикло-.
Для циклоалканов характерна структурная, геометрическая и оптическая
изомерия.
Такие циклоалканы, как циклопропан и циклогексан, а также их гомологи
входят в состав некоторых видов нефти, из которых могут быть выделены в чистом
виде. Наряду с этим для получения циклоалканов существует ряд синтетических
методов: а) взаимодействие дигалогеналканов с металлическим натрием или цинком,
б) пиролиз кальциевых солей дикарбоновых кислот, в) реакции циклоприсоединения.
Аналогично алканам в молекулах циклоалканов атомы углерода находятся в
состоянии sp3-гибридизации. Но если молекулы
алканов обладают значительной гибкостью за счет свободного вращения вокруг
углерод-углеродных связей, то молекулы циклоалканов, несмотря на возможные
конформационные повороты, представляют собой в определенной степени жесткие
образования.
В химическом отношении циклоалканы во многом ведут себя подобно алканам.
Однако для них характерны не только реакции замещения, протекающие по
радикальному механизму (SR)
(для обычных циклов - пяти- и шестичленных), но и реакции присоединения в
соответствии с правилом Марковникова по электрофильному механизму (АЕ) (для
малых циклов - трех- и четырехчленных). Данное явление объясняется
пространственным строением циклоалканов.
Алканы и циклоалканы широко используются в химической промышленности в
качестве сырья для получения широкого спектра многих органических веществ,
медицине, фармации при изготовлении лекарственных форм, в парфюмерно-косметической
промышленности. Например, вазелин (смесь жидких и твердых алканов с числом
углеродных атомов от 12 до 25) широко используется в фармации в качестве основы
для приготовления мазей, циклопропан применяется в медицинской практике как средство
для ингаляционного наркоза.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
следующих соединений назовите их по рациональной номенклатуре: а)
2-метил-4-этилгексан, б) 2,2-диметил-пропан, в) 2,2,3-триметилпентан, г)
2,4-диметил-4-пропилгептан, д) 2,4-диметил-3-этилпентан.
2. Напишите структурные формулы
следующих углеводородов и назовите их по номенклатуре ИЮПАК: а)
диизопропилметан, б) диметилэтилметан, в) метилдиэтилизопропилметан, г)
втор-бутил-трет-бутилметан, д) метил-пропилметан.
3. Назовите по систематической и
рациональной номенклатуре следующие углеводороды:
СН2-СН3 СН3
ï ï
а) СН3-СН-СН3 б) СН3-СН2-С-СН2-СН-СН3
ï ï
СН3 СН2-СН3
СН3 СН3 СН3 СН2-СН3
ï ï ï ï
в) СН3-СН-СН-С-СН3 г) СН3-СН-СН-СН3 д) СН3-С-СН3
ï ï ï ï
Н3С СН-СН3 Н3С-СН-СН3 СН3-СН-СН3
ï
СН3
4. Напишите формулы структурных изомеров
состава С6Н14, обозначте первичные, вторичные, третичные и четвертичные атомы
углерода. Назовите соединения по систематической номенклатуре.
5. Какие углеводороды образуются при
действии металлического натрия на смесь: а) йодистого метила и йодистого
изопропила, б) йодистого этила и йодистого изобутила, в) бромистого пропила и
бромистого втор-бутила, г) йодистого этила и йодистого пропила.
6. Приведите возможные способы получения
изопентана и напишите схемы его нитрования и сульфирования. Назовите продукты.
7. В чем сущность крекинга и пиролиза
нефтепродуктов?
8. Напишите уравнения реакций, с помощью
которых можно осуществить химические превращения: а) пропановая кислота →
2-нитробутан, б) пропан → 2,3-диметилбутан.
9. Приведите схему реакции Коновалова
для 2-метилбутана. В каких условиях протекает взаимодействие? Опишите механизм
реакции.
10.На примере
циклопропана и циклогексана объясните общность и различие в реакционной
способности циклоалканов. Напишите соответствующие уравнения реакций.
11.Какие
соединения образуются в результате бромирования следующих соединений:
2,2,4-триметилпентана, метилциклопропана и циклогексана? Приведите схемы
реакций и назовите продукты реакций.
12.Напишите схему
реакции получения 1,3-диметилциклопентана из соответствующего дигалогеналкана,
Назовите исходное соединение.
13.Приведите схему
получения 1-метил-4-этилциклогексана по реакции Дильса-Альдера.
14.Какие виды
напряжения существуют в органических молекулах? Какие виды напряжения имеют
место в молекуле циклогексана, находящейся в конформации ванны?
15.Напишите
уравнения реакций, с помощью которых можно осуществить следующие химические
превращения:
SO2, Cl2,
hv
4
NaOH Вr2,
hv Na разб. HNO3,t,p
а) СН3-СН-СООNa
1 2 3 5
ï
CH3
Cl2,
hv
6
HBr
2
H2, кат.
Zn
3
б) 1,3-дибром-2-метилпропан 1 Cl2, hv
4
Cl2, t
5
ПРАКТИКУМ
Опыт 14. ПОЛУЧЕНИЕ МЕТАНА
Р е а к т и в ы: натрия ацетат, натронная известь (смесь NаОН и СаО)
В сухую пробирку на высоту 10 мм помещают тщательно растертую в ступке
смесь ацетата натрия и натронной извести в соотношении 1:2. Пробирку закрывают
пробкой с газоотводной трубкой, устанавливают в штатив и нагревают в пламени
горелки. Выделяется газ - метан:
0
СН3СOONa + NaOH CH4 + Na2CO3
Данный способ является удобным лабораторным методом получения метана.
Опыт 15. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАНА
Р е а к т и в ы: метан, бромная вода, 1% раствор перманганата калия.
Метан (из предыдущего опыта) поочередно пропускают в отдельные пробирки с
бромной водой и 1%-ным раствором перманганата калия. В условиях опыта видимых
изменений не наблюдается. Не прекращая нагревания, поджигают выделяющийся из
газоотводной трубки газ. Метан горит голубоватым пламенем:
СН4 + 2O2 CО2 +
2Н2O
Опыт 16. ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Р е а к т и в ы: бензин, концентрированные серная и азотная кислоты,
бромная вода, 1% раствор перманганата калия, спиртовый раствор щелочи
.1. Взаимодействие с концентрированной серной кислотой.
мл бензина (смесь предельных углеводородов) помещают в пробирку,
прибавляют равный объем концентрированной серной кислоты, осторожно
перемешивают, затем взбалтывают. Происходит разогревание реакционной смеси.
Пробирку охлаждают водой. Бензин не изменяется, что указывает на инертность
предельных углеводородов.
.2. Взаимодействие с концентрированной азотной кислотой.
К 1 мл бензина добавляют 1 мл концентрированной азотной кислоты,
встряхивают вначале осторожно, а затем в течение несколько минут энергично.
Окраска бензина не изменяется: предельные углеводороды в этих условиях не
вступают в реакцию с азотной кислотой.
.3. Взаимодействие с бромной водой.
К 1 мл
бензина добавляют бромную воду по каплям, все время встряхивая пробирку.
Окраска свободного брома не изменяется. Вследствие лучшей растворимости брома в
бензине при встряхивании возможно извлечение бензином брома и окрашивание его в
желтый цвет.
16.4. Взаимодействие с перманганатом калия.
К 1 мл бензина добавляют несколько капель 1%-ного раствора перманганата
калия, при сильном встряхивании фиолетовая окраска не исчезает.
.5. Взаимодействие со спиртовым раствором щелочи.
Несколько капель вазелинового масла (смесь высококипящих предельных
углеводородов) помещают в пробирку, добавляют двойной объем спиртового раствора
щелочи, встряхивают, затем нагревают. Капли масла в щелочи не растворяются, в
отличие от животного и растительного масла.
Опыт 17. БРОМИРОВАНИЕ АЛКАНОВ
Р е а к т и в ы: гексан, 5% раствор брома в тетрахлорметане
В две сухие пробирки помещают по 1 мл гексана, добавляют по каплям равное
количество 5%-ного раствора брома в тетрахлорметане до появления желтой окраски
и перемешивают. Одну из пробирок накрывают колпаком из черной бумаги или ставят
в темное место, другую подвергают воздействию источника УФ-света (например,
кварцевой лампы). Через 5 мин сравнивают окраску растворов в обеих пробирках.
Отмечают обесцвечивание раствора в пробирке, подвергшейся воздействию УФ-света
и отсутствие видимых изменений в другой.
СН3-(СН2)4-СН3 + Br2 hv CH3-CH-(CH2)3-CH3 + HBr
ô
Br
Опыт 18. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ВСПЫШКИ КЕРОСИНА И БЕНЗИНА
Р е а к т и в ы: керосин, бензин
В две фарфоровые чашки наливают по 1-2 мл керосина и бензина. При
поднесении горящей лучинки бензин загорается, керосин не загорается и горящая
лучинка при опускании в него гаснет. Если керосин нагреть до 30-400 и затем
поднести к нему горящую лучинку - он загорится.
.4 АЛКЕНЫ. АЛКАДИЕНЫ. АЛКИНЫ
Алкенами называют углеводороды алифатического ряда, содержащие одну
двойную связь. Общая формула алкенов СnH2n. Атомы углерода, связанные двойной
связью, находятся в состоянии sp2-гибридизации.
Родоначальником гомологического ряда является этилен (СН2=СН2).
Согласно правилам ИЮПАК названия алкенов образуют от названий
соответствующих алканов, заменяя суффикс -ан на -ен (-илен) с указанием
положения двойной связи в цепи углеводородных атомов.
Для алкенов характерна структурная и геометрическая изомерия. Структурная
изомерия алкенов обусловлена разной последовательностью связывания атомов
углерода в молекуле (изомерия цепи) и разным положением двойной связи при одном
и том же углеродном скелете (изомерия положения). Геометрическая или так
называемая цис-транс-изомерия обусловлена различным расположением атомов или
групп в пространстве относительно плоскости двойной связи.
В небольших количествах алкены встречаются в некоторых месторождениях
нефти и природного газа, откуда могут быть выделены в чистом виде. Большинство
методов синтеза основаны на отщеплении (элиминировании) атомов или атомных
групп от молекул алканов, галогеналканов и спиртов.
Вследствие наличия π-связи алкены довольно легко вступают в реакции
присоединения, протекающие с разрывом π-связи. В большинстве случаев такие
реакции идут по ионному механизму и начинаются с атаки электрофильным реагентом
электронов π-связи, а поэтому их называют реакциями электрофильного
присоединения (АЕ). Для алкенов характерны также реакции окисления,
восстановления и полимеризации.
Алкадиенами называют углеводороды алифатического ряда, содержащие две
двойные связи. Общая формула алкадиенов СnH2n-2. Атомы
углерода, связанные двойными связями, находятся в состоянии sp2-гибридизации.
По взаимному расположению двойных связей в молекуле различают алкадиены с
кумулированными (-СН=С=СН-), сопряженными (конъюгированны-ми) (-СН=СН-СН=СН-) и
изолированными (-СН=СН-(СН2)n-СН=СН-)
двойными связями.
Названия алкадиенов по номенклатуре ИЮПАК образуют аналогично алкенам.
Наличие двух двойных связей обозначают суффиксом -диен с указанием положения
каждой из них в главной углеродной цепи.
Для получения алкадиенов с сопряженными связями чаще всего применяют
дегидрирование алканов и алкенов, дегидратацию диолов и непрельных спиртов.
Для алкадиенов с сопряженными связями характерны реакции присоединения и
полимеризации, свойственные алкенам. Однако наряду с этим в химическом
поведении алкадиенов-1,3 имеются некоторые особенности. В реакциях
электрофильного присоединения наблюдается смещение двойной связи и чаще всего
образуется два продукта, из которых один является результатом 1,2-присоединения
по месту двойной связи, а второй - 1,4-присоединения. Для конъюгированных
диенов характерны также реакции с диенофилами (реакция Дильса-Альдера).
Алкинами называют углеводороды алифатического ряда, содержащие одну
тройную связь. Общая формула алкинов СnH2n-2. Атомы углерода, связанные тройной
связью, находятся в состоянии sp-гибридизации.
Родоначальником гомологического ряда алкинов является ацетилен (СН≡СН).
По номенклатуре ИЮПАК названия алкинов образуют от названий соответствующих
алканов, заменяя суффикс -ан на -ин с указанием положения тройной связи в цепи
углеродных атомов.
Алкины чаще всего получают дегидрогалогенированием дигалогензамещенных
алканов и алкилированием ацетилена. Для получения ацетилена существует ряд
специфических способов: получение из метана, из карбида кальция.
Аналогично алкенам, алкины втупают в реакции электрофильного
присоединения, окисления, восстановления и полимеризации. Однако, вследствие
большей электроотрицательности sр-гибридизованных
атомов углерода по сравнению с углеродами в sр2-гибридизации, π-связи алкинов труднее вступают в химическое
взаимодействие с электрофильными реагентами, чем π-связь алкенов. Кроме того, благодаря
высокой электроотрицательности атома углерода в sр-гибридизации алкины с концевой тройной связью R-С≡С-Н обладают слабой
СН-кислотностью и способны замещать атом водорода на металлы и другие группы.
Алканы, алкадиены, алкины являются сырьем для многих химических
производств. Например, этилен используется в производстве этанола,
этиленгликоля, уксусного альдегида, полиэтилена; бутадиен применяется для
получения синтетических каучуков, пластиков; ацетилен нашел широкое применение
для автогенной сварки и резки металлов.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: а)
2,3-диметил-пентен-1, б) изобутилацетилен, в) 2,3-дихлорбутадиен-1,3, г)
цис-бутен-2, д) 3-нитробутин-1, е) симметричный диэтилэтилен, к)
2,5-диметилгептин-3, л) октадиен-1,5-ин-3, м) пентадиен-1,4, н)
метилэтилацетилен.
2. Назовите приведенные углеводороды по систематической и
рациональной номенклатурам:
СН3 СН3
ï ï
а) СН3-С=СН-СН-СН3 б) СН3-С-СН=СН-С-СН3 в) СН3-СºС-СН3
ï ï ï ï
СН3 СН3 СН3 СН3
г) СН3-С-СН=С-СН3 д) СН3-С=С=С-СН3 е) СН3-СºС-СН2-СН=СН2
║ ï ï ï
СН2 С2Н5 СН3 СН3
3. Какие соединения образуются при действии на пропен следующих
реагентов: а) Cl2 (CCl4), б) Cl2 + H2O, в) HBr,
г) H2O (H+), д) H2 (Pd), е) конц. H2SO4? Приведите механизм (а), (в)
реакций.
4. Напишите структурную формулу алкена, озонолиз которого приводит к
образованию смеси следующих продуктов: а) метилэтилкетона и пропаналя, б)
ацетона и уксусного альдегида, в) муравьиного и масляного альдегидов.
. Какие из приведенных алкенов могут существовать в виде цис- и
транс-изомеров: а) пентен-2, б) 2-метилпентен-2, в) гексен-3? Приведите формулы
геометрических изомеров.
. Какими качественными реакциями можно отличить соединения в
следующих парах: а) н-пентан и пентен-2, б) циклопентан и пентен-2?
. Объясните, как образуется сопряженная система в молекуле
пентадиена-1,3. Имеется ли сопряжение в молекуле пентадиена-1,4?
. Напишите уравнения реакций и назовите полученные соединения:
а) 2-метилбутадиен-1,3 + НС1 в) 2,3-диметилбутадиен-1,3 + Н2О
С2Н5ОН+Na СС14
б) гексадиен-2,4 г) пентадиен-1,4 + С12
9. Какие продукты образуются при взаимодействии
2-метилпентадиена-1,3 с бромоводородом? Приведите механизм реакции.
10. Напишите схему реакции взаимодействия пентадиена-1,3 с
акрилонитрилом.
11. Напишите схему изопренового каучука стереорегулярного строения.
Какова конфигурация макромолекулы?
. Приведите схемы реакций получения бутина-2 из пропина через стадию
образования соответствующего магнийорганического соединения.
. Напишите реакции окисления бутина-2 перманганатом калия в
нейтральной и щелочной средах. Назовите конечные продукты.
. С помощью каких реакций можно доказать наличие тройной связи в
молекуле бутина-1.
. Напишите схемы реакции Кучерова для следующих соединений: а)
изопропилацетилен, б) диметилацетилен, в) метилэтилацетилен. Назовите
полученные продукты.
. Напишите уравнения реакций, с помощью которых можно осуществить
следующие химические превращения:
Na Cl2, hv спирт.NaOH
Н2О, Н+
конц. Н2SO4, t
СН3-СН2-ОН
СН2=СН2 + Н2О
С2Н5ОН
+ НОSO2OH C2H5OSO2OH + H2O
этилсерная кислота
tо
CH2-CH2 CH2=CH2
+ H2SO4
ç ç
H
OSO2OH
ПРАКТИКУМ
Опыт 19. ПОЛУЧЕНИЕ ЭТИЛЕНА
Р е а к т и в ы: этиловый спирт, концентрированная серная кислота
В сухую пробирку помещают 8-10 капель концентрированной серной кислоты, 5
капель этилового спирта и несколько крупинок оксида алюминия. Пробирку
закрывают пробкой с газоотводной трубкой и осторожно нагревают в пламени
горелки до начала равномерного выделения газа из реакционной смеси.
Нагревание этилового спирта с концентрированной серной кислотой
сопровождается внутримолекулярной дегидратацией с образованием этилена:
конц. Н2SO4, t
СН3-СН2-ОН СН2=СН2 + Н2О
С2Н5ОН + НОSO2OH C2H5OSO2OH + H2O
этилсерная кислота
tо-CH2 CH2=CH2 + H2SO4
ç ç
H OSO2OH
Опыт 20. ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНА
Р е а к т и в ы: этилен, бромная вода, 1% раствор перманганата калия,
концентрированная серная кислота
Конец газоотводной трубки (предыдущий опыт) поочередно опускают в 3
предварительно подготовленные пробирки, содержащие раствор бромной воды и 1%
водный раствор перманганата калия с концентрированной серной кислотой и без
неё.
При пропускании этилена через раствор бромной воды наблюдают быстрое
обесцвечивание желто-бурой окраски раствора:
СН2=СН2 + Вr2 СН2-СН2
ï ï
Вr Вr
При пропускании этилена через 1% раствор перманганата калия
бледно-розового цвета наблюдают исчезновение первоначальной окраски раствора, а
в случае избытка перманганата калия - появление хлопьевидного осадка бурого
цвета - оксида марганца (IV):
СН2=СН2 + КМnО4 + Н2О 3СН2-СН2
+ 2КОН + 2МnО2¯
ï ï
ОН ОН
При пропускании этилена через 1% раствор перманганата калия в присутствии
концентрированной серной кислоты наблюдают быстрое обесцвечивание раствора,
бурые хлопья не образуются:
СН2=СН2 + КМnО4 + Н2SО4 Н2С=О + К2SО4 + МnSО4 +
Н2О
Продолжая нагревание, быстро поджигают газообразный этилен у конца
газоотводной трубки. Этилен горит светящимся пламенем.
СН2=СН2 + 3О2 2СО2 + 2Н2О
Опыт 21. ПОЛУЧЕНИЕ АЦЕТИЛЕНА
Р е а к т и в ы: карбид кальция
Опыт проводится в вытяжном шкафу!
В пробирку наливают 2-3 мл воды, вносят несколько небольших кусочков
карбида кальция. Быстро закрывают отверстие пробирки пробкой с газоотводной
трубкой. Взаимодействие карбида кальция с водой протекает энергично -
выделяется ацетилен:
СаС2 + 2Н2О СН≡СН + Са(ОН)2¯
Газ поджигают у отверстия пробирки. Ацетилен горит светящимся, слегка
коптящим пламенем:
о
НСºСН +
5О2 4СО2 + 2Н2О
Опыт 22. ХИМИЧЕСКИЕ СВОЙСТВА АЦЕТИЛЕНА
Р е а к т и в ы: ацетилен, 1% раствор перманганата калия, бромная вода,
аммиачный раствор хлорида меди (I),
аммиачный раствор оксида серебра
Конец газоотводной пробирки (предыдущий опыт) поочередно пропускают в три
предварительно подготовленные пробирки, содержащие 1% раствор перманганата
калия, бромную воду, аммиачный раствор хлорида меди (I), аммиачный раствор оксида серебра.
. При пропускании ацетилена через 1% раствор перманганата калия наблюдают
обесцвечивание раствора:
[O]
НСºСН
СО2 + НC(О)Н
KMnO4,
H2O формальдегид
. При пропускании ацетилена через раствор бромной воды, как и в случае с
перманганатом калия наблюдают обесцвечивание раствора:
Br Br
ï ï
НСºСН + Br2 CH=CH CH-CH
ï ï ï ï
Br Br Br Br
. При пропускании ацетилена через аммиачный раствор хлорида меди (I) наблюдают выпадение красного осадка
ацетиленида меди:
НСºСН + 2CuCl + 2NH3 Cu-СºС-Cu + 2NH4Cl
Ацетилен нужно пропускать в аммиачный раствор хлорида меди (I), так как в водном растворе
образующаяся соляная кислота разлагает ацетиленид меди и реакция идет в
обратном направлении:
Cu-СºС-Cu + 2НСl СНºСН + Cu2Cl2
В сухом виде ацетилениды серебра и меди являются взрывчатыми веществами.
Они взрываются от удара или нагревания. Во избежание несчастных случаев после
опыта ацетилениды необходимо разрушить действием разбавленной соляной кислоты.
Для испытания взрывчатых свойств ацетиленида меди его отфильтровывают.
Влажный фильтр с осадком помещают на другой фильтр, затем на асбестовую сетку
или песчаную баню (проводить под тягой) и осторожно нагревают. По мере
высыхания вначале слышится легкое потрескивание, а затем происходит громкий, но
безопасный взрыв.
. При пропускании ацетилена через аммиачный раствор оксида серебра
(раствор готовят путем осторожного прибавления аммиака по каплям к раствору
азотнокислого серебра до полного растворения образовавшегося вначале осадка)
наблюдают выпадание осадка ацетиленида серебра желтого цвета.
АgNО3 + 3NН3 + H2O [Аg(NН3)2]ОН +NН4NO3
НСºСН + 2[Аg(NН3)2]ОН Ag-СºС-Ag + 4NH3 + 2H2O
Полученное ацетиленистое серебра разрушают соляной кислотой :
-СºС-Ag + 2НСl СНºСН + 2AgCl
Опыт 23. НЕПРЕДЕЛЬНЫЙ ХАРАКТЕР КАУЧУКА
Р е а к т и в ы: 5% раствор каучука в бензине, раствор брома в бензине
В пробирку наливают 2 мл раствора каучука в бензине и пипеткой приливают
раствор брома в бензине, энергично встряхивая пробирку после каждого добавления
брома. Происходит обесцвечивание брома вследствие присоединения его по месту
двойных связей к молекуле каучука.
[-СН2-С=СН-СН2-]n + Br2 [-СН2-СBr-СНBr-СН2-]n
½ ½
CH3 CH3
Раствор каучука в бензине готовят заранее. Мелко нарезанный каучук
(девулканизированный) помещают на несколько дней в цилиндр с притертой пробкой.
Каучук, растворяясь в бензине, образует коллоидный раствор.
.5 АРЕНЫ
Аренами называют углеводороды циклического строения, отвечающие критериям
ароматичности Хюккеля: наличие в его структуре плоского цикла, содержащего замкнутую
сопряженную систему, включающую (4n+2) π-электронов, где n≥6.
К наиболее распространенным ароматическим системам, содержащим 6π-электронов относится бензол и его
производные.
По заместительной номенклатуре ИЮПАК одноядерные арены рассматривают как
продукты замещения бензола: метилбензол, этилбензол и т.д. При наличии в
бензольном кольце нескольких заместителей их положение указывают цифрами или
приставками орто-, мета-, пара-. Кроме названий по заместительной номенклатуре
сохранились и тривиальные названия: толуол, ксилол, кумол и т.д.
Основными природными источниками ароматических углеводородов являются
нефть и каменный уголь. Для получения гомологов бензола используют
синтетические способы получения: а) циклотримеризация алкинов, б) реакция
Вюрца-Фиттига, в) алкилирование по Фриделю-Крафтсу.
Атом углерода в аренах находится в состоянии sр2-гибридизации. Ароматические углеводороды, как и алкены
обладают нуклеофильным характером, однако в отличие от них при взаимодействии с
электрофильными реагентами более склонные к реакциям замещения (SЕ), а не присоединения.
В реакциях электрофильного замещения монозамещенных производных бензола,
в зависимости от электронной природы заместителя, вступающая группа может
занимать орто-, мета- или пара-положения, а реакция может протекать быстрее или
медленнее, чем с самим бензолом. Различают заместители I рода (электронодоноры, орто- и пара-ориентанты) и
заместители II рода (электроноакцепторы,
мета-ориентанты).
При наличии в бензольном кольце двух заместителей их ориентирующее
влияние осуществляется более сложно. В зависимости от электронной природы
заместителей и их взаимного расположения различают согласованную (оба
заместителя направляют новую группу в одни и те же положения) и несогласованную
(заместители направляют новую группу в различные положения) ориентацию.
При несогласованной ориентации придерживаются следующих правил:
. Преимущественное направление замещения определяет ориентант I рода.
. По силе ориентирующего влияния заместителей I рода можно расположить в следующий ряд:
О- >
NR2 > NHR > NH2 > OH > OR > NHCOR > OCOR > Alk > F >
Cl > Br > I
3. По силе ориентирующего влияния заместителей II рода можно расположить в следующий ряд:
> SO3H > NO2 > CHO > COCH3 > CN
В химической промышленности арены широко используются в качестве
растворителей и исходного сырья для производства широкого класса органических
соединений, лекарственных препаратов.
Многоядерные арены с конденсированными циклами содержат в своем составе
два и более бензольных ядра, имеющих общие атомы углерода. Наиболее важными
представителями конденсированных аренов являются нафталин, антрацен и
фенантрен. Для них характерны реакции электрофильного замещения, присоединения,
восстановления и окисления.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: а) о-ксилол,
б) м-хлорбензол-сульфокислота, в) сим-триэтилбензол, г) 4-бром-2-нитро-толуол,
д) кумол, е) п-диизопропилбензол, к) аллилбензол.
2. Сравните химические свойства бензола и 1,3-циклогексадиена. В чем
причина имеющихся различий.
. Исходя из бензола и других необходимых реагентов, предложите
схемы синтеза следующих соединений: а) п-хлорбензойная кислота, б)
м-бром-бензойная кислота, в) 2,4-динитротолуол.
. Какие продукты образуются при озонолизе: а) бензола, б) толуола?
. В каких условиях следует проводить реакции бромирования
изопропилбензола (кумола) для введения атома галогена в ароматическое ядро и
боковую углеродную цепь? Приведите соответствующие схемы и механизмы реакций.
6. Назовите приведенные соединения:

7. Расположите следующие ароматические соединения в порядке
возрастания реакционной способности в реакциях SЕ: а) С6H5NH2, б) C6H5OH, в) C6H5NO2, г) C6H5CH3, д) C6H5N(CH3)2, к) C6H5(CH3)2.
8. Определите положения, по которым преимущественно будут
осуществляться реакции SE
следующих дизамещенных бензола:

9. Сравните отношение к действию избытка хлора на толуол: а) в
присутствии FeCl3, б) при освещении или нагревании.
Напишите соответствующие уравнения реакций и укажите их механизм.
10. Напишите уравнения реакции Фриделя-Крафтса на основе бензола,
используя в качестве электрофильных реагентов: а) уксусный ангидрид, б)
этилхлорид, в) пропен. Укажите условия и приведите механизм реакции.
. С помощью каких химических реакций можно отличить толуол, бензол
и стирол? Напишите соответствующие уравнения реакций.
. Напишите уравнение реакции и назовите продукты нитрования
следующих соединений: а) нитробензол, б) кумол, в) п-толуолсульфокислота.
. Напишите уравнения реакций, с помощью которых можно осуществить
следующие химические превращения:
Br2 (FeBr3)
CH3Br, 2Na [O] HNO3 (H2SO4)
а) С6Н6 А
В С Д
Br2, hv
Е
CH3Cl (AlCl3)
15000C
тримеризация C2H5Cl (AlCl3) Д
б) 2CH4
А В
С
разб. HNO3 (t,p)
Е
14.
Какие соединения и в каких условиях можно получить при сульфировании нафталина?
Приведите соответствующие схемы реакций.
15. На примере реакции нитрования α-метилнафталина и β-нитронафталина объясните правила
ориентации в ядре нафталина.
ПРАКТИКУМ
Опыт 24. ПОЛУЧЕНИЕ БЕНЗОЛА
В ступке тщательно растирают 2 г бензоата натрия и 2 г натронной извести
(NaOH + CaO), смесь хорошо перемешивают до измельчения, смесь
пересыпают в пробирку, которую закрывают пробкой с газоотводной трубкой. Нижний
конец трубки входит в пробирку с 2 каплями концентрированной азотной кислоты и
3 каплями концентрированной серной кислоты. Пробирку устанавливают в штатив и
начинают нагревать - сначала осторожно, затем сильнее.
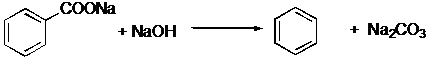
Через
несколько минут в пробирке над слоем нитрующей смеси наблюдают появление темной
капли нитробензола. Нагревание прекращают. В пробирку с нитрующей смесью
добавляют 8-10 капель воды и полученный раствор взбалтывают. Определяют наличие
нитробензола по запаху, ощущают запах горького миндаля, подтверждающий
образование нитробензола.
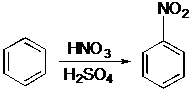
Открыв
пробирку с исходными веществами, ощущают запах бензола.
Опыт 25. ГОРЕНИЕ БЕНЗОЛА
Р е а к т и в ы: бензол
Опыт проводят в вытяжном шкафу!
Небольшое количество бензола наливают в фарфоровую
чашку или тигель и поджигают с помощью горящей лучины или свернутой в трубочку
бумаги. Бензол воспламеняется и горит сильно коптящим пламенем.
Опыт 26. РАСТВОРИМОСТЬ БЕНЗОЛА В РАЗЛИЧНЫХ РАСТВОРИТЕЛЯХ
Р е а к т и в ы: бензол, этиловый спирт, этиловый эфир
В три пробирки наливают по 0,5 мл бензола, в первую добавляют 1 мл воды,
во вторую - 1 мл этилового спирта, в третью - 1 мл этилового эфира. Каждую
пробирку тщательно встряхивают. При отстаивании в пробирке с водой образуются 2
слоя, а в двух других - однородный раствор.
Бензол практически нерастворим в воде, хорошо растворяется в органических
растворителях и сам является хорошим растворителем.
Опыт 27. БРОМИРОВАНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Р е а к т и в ы: бензол, толуол, бромная вода, бром, железная стружка
. В пробирку наливают равные объемы бензола и бромной воды. Смесь
встряхивают. После отстаивания бензол всплывает над водой. Нижний водный слой
обесцвечивается, а бензол окрашивается в желтый цвет.
Бром лучше растворяется в бензоле, поэтому при встряхивании он легко
переходит в бензол, окрашивая его в желтый цвет. Присоединение брома по двойным
связям не происходит.
. В пробирке взбалтывают 2 мл бензола с несколькими каплями брома.
Окраска брома не исчезает, так как и здесь бром не присоединяется к бензолу. Но
после прибавления железных стружек (катализатор) происходит реакция замещения
водорода бензола с образованием бромбензола (тяжелая жидкость) и
п-дибромбензола (твердое вещество).

.
В пробирке взбалтывают 2 мл толуола с несколькими каплями брома. Постепенно
окраска брома исчезает. При этом образуются о- и п-бромтолуолы.

Толуол
благодаря присутствию радикала легче вступает в реакции замещения.
.
В пробирку, закрепленную в штативе, наливают 5 мл толуола и 1 мл брома. Верхнюю
половину столбика реакционной смеси обертывают черной бумагой, а нижнюю
освещают электрической лампой на расстоянии нескольких сантиметров. Через
несколько минут прекращают освещение и черную бумагу убирают. Там, где жидкость
подвергалась действию световых лучей, бром обесцветился, в верхней части
пробирки окраска сохранилась.
Бромирование
толуола при нагревании и на свету приводит к замещению водорода боковой цепи с
образованием бромистого бензила.

Опыт
28. ДЕЙСТВИЕ ПЕРМАНГАНАТА КАЛИЯ НА АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Р е а к т и в ы: бензол, толуол, ксилол, 0,1% раствор перманганата калия,
10% раствор серной кислоты
. В пробирку с 2-3 мл бензола прибавляют 0,5 мл 0,1%-ного раствора
перманганата калия и 1-2 капли 10% серной кислоты. При взбалтывании и
подогревании окраска не изменяется, что указывает на устойчивость бензольного
ядра по отношению к окислителям.
. В пробирку наливают 1-2 мл толуола (ксилол), приливают 0,5 мл раствора
0,1%-ного раствора перманганата калия и 1-2 капли 10% серной кислоты. При
взбалтывании и нагревании окраска раствора исчезает и выделяется двуокись
марганца. Боковая цепь при этом окисляется в карбоксильную группу, образуется
бензойная кислота.

Опыт
29. НИТРОВАНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Р е а к т и в ы: бензол, толуол, концентрированные серная и азотная
кислоты
. Готовят нитрующую смесь смешиванием в широкой пробирке 1,5 мл
концентрированной азотной кислоты и 2 мл концентрированной серной кислоты. К
охлажденной смеси добавляют по каплям 1 мл бензола при сильном, но осторожном
встряхивании, не прекращая охлаждение. Наблюдается разогревание пробирки. Через
3-5 минут встряхивания реакционную смесь выливают в стаканчик с 10 мл воды,
встряхивают и дают отстояться. Нитробензол выделяется в виде тяжелого
желтоватого, масла, мутного от капелек воды.
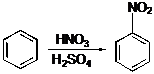
.
В пробирке готовят нитрующую смесь из 2 мл концентрированных азотной и 2,5 мл
серной кислот. Смесь охлаждают и небольшими порциями медленно вливают 1 мл
толуола. После каждой порции толуола смесь хорошо встряхивают и охлаждают. В
дальнейшем опыт проводится аналогично, как и для бензола. Продуктами реакции
нитрования толуола являются о- и п-нитротолуолы (гомологи бензола нитруются
значительно легче бензола):
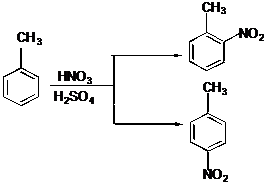
Опыт 30. ПОЛУЧЕНИЕ м-ДИНИТРОБЕНЗОЛА (реакция
Степанова)
Р е а к т и в ы: бензол, нитрат аммония,
концентрированная серная кислота
В пробирку с охлажденным раствором нитрующей смеси (1
г кристаллического нитрата аммония и 5 мл концентрированной серной кислоты)
медленно прибавляют 10 капель бензола. Иногда для растворения бензола требуется
незначительное нагревание. После растворения бензола жидкость выливают в стакан
с 10 мл холодной воды. Наблюдают выделение белого осадка м-динитробензола.
2NH4NO3 + H2SO4 (NH4)2SO4 + 2HNO3
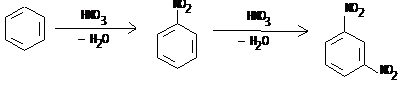
Опыт 31. СУЛЬФИРОВАНИЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Р е а к т и в ы: бензол, толуол, ксилол,
концентрированная серная кислота
Отдельно в сухие три пробирки наливают по 1 мл
бензола, толуола и ксилола, затем в каждую пробирку приливают по 4 мл
концентрированной серной кислоты. Все пробирки нагревают на водяной бане при
частом энергичном встряхивании. Пробирку, содержащую бензол, нагревают более
осторожно, чтобы он не улетучился.
Наблюдают постепенное исчезновение эмульсии в
пробирках и образование гомогенных растворов. После охлаждения реакционной
массы содержимое каждой пробирки выливают в стаканы с холодной водой. Наблюдают
отсутствие органического слоя над водой, что свидетельствует о полном сульфировании
углеводородов (сульфокислоты хорошо растворимы в воде).
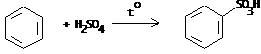
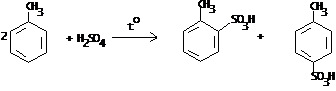
.6 ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Галогенопроизводными углеводородов называют продукты замещения в
углеводородах одного или нескольких атомов водорода атомами галогенов.
Классификация галогенопроизводных углеродов:
первичный хлор бром
C2H5Cl
вторичный
содержащие содержащие
(C2H5)2СCl
фтор C2H5Cl C2H5Br
третичный
содержащие йод
(CH3)3CCl CHF3 содержащие
CHI3
по типу углерода, по
типу
присоединенного галогена
к галогену
ГАЛОГЕНОПРОИЗВОДНЫЕ
УГЛЕВОДОРОДОВ
по типу по
числу
углеводородного галогенов
радикала
моногалогено- полигалогено-
алифатические
алициклические производные производные
CH3Cl
ароматические C6H5Cl C2H5Br CHI3
C6H5Cl
По заместительной номенклатуре ИЮПАК названия галогенопроизводных
углеводородов составляют аналогично названиям соответствующих углеводородов. К
названию атомов галогенов прибавляют на
звание родоначальной структуры.
СН3-СН-СН2-СН-СН3 СН2-СН2-СН-СН=СН2
ï ï ï ï
СН3 Br Br СН3
-бром-4-метилпентан 5-бром-3-метилпентен-1
Для простейших галогенопроизводных используют радикало-функциональную
номенклатуру, согласно которой название составляют из названия углеводородного
радикала, связанного с галогеном, и суффикса -фторид, -хлорид, -бромид или
-иодид. Например:
СН3Сl С2H5Br СН2=СH-Cl
метилхлорид этилбромид винилхлорид
Для галогенопроизводных углеводородов характерна структурная,
геометрическая и оптическая изомерия. Структурная изомерия обусловлена разной
структурой углеродного скелета молекулы и разным положением атомов галогенов в
цепи.
Дигалогенопроизводные с атомами галогенов у одного и того же атома
углерода называют геминальными, у соседних атомов углерода - вицинальными.
Основные способы получения галогенопроизводных углеводородов: а)
галогенирование алканов, алкенов, алкинов, аренов; б) гидрогалогенирование
алкенов, алкинов; в) взаимодействие спиртов с галогеноводородами.
Галогеналканы являются весьма реакционноспособными веществами, для них
характерны реакции нуклеофильного замещения (SN) и отщепления (Е). Они также способны к взаимодействию с
металлами и восстановлению.
Галогеналканы являются электрофильными реагентами. В зависимости от
строения галогеналкана, природы нуклеофила и растворителя реакции
нуклеофильного замещения протекают по двум основным механизмам: бимолекулярный
(SN2) и мономолекулярный (SN1).
По механизму SN2 реакция
происходит в одну стадию через образование переходного состояния, в построении
которого принимает участие как молекула галогеналкана, так и нуклеофильный
реагент. При нуклеофильном замещении нуклеофил атакует электрофильный центр
молекулы галогеналкана со стороны, противоположной связи С-Наl.
d- d++ -- C-Hal Nu …C…Hal Nu - C -- + Hal-
переходное состояние
Поэтому реакции по SN2
механизму характерны для первичных галогенопроизводных углеводородов, например:
CH3Cl + NaOH (вод.) CH3OH + NaCl
механизм:
Скорость реакции выражается формулой V=K[СН3Cl][NaOH].
В третичных галогенопроизводных углеводородов реакции протекают по
мономолекулярному механизму замещения (SN1).
СН3 СН3
½ ½
СН3 - С - Br + NaOH (вод) СН3 - С - ОН + NaBr
½ |
СН3 СН3
Механизм:
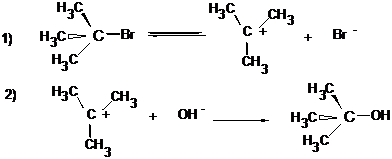
Скорость
реакции выражается формулой V=K[(CH3)3CBr].
Нужно
отметить, что в непредельных и ароматических галогенуглеводородах, если галоген
связан непосредственно с углеродом при двойной связи, реакции нуклеофильного
замещения не наблюдаются. Из-за наличия «положительного» мезомерного эффекта
(р,π-сопряжение) подвижность галогена уменьшается. Примером
могут служить винилхлорид и хлорбензол:
СН2=СН
Сl: С1:
Реакции
нуклеофильного замещения характерны для галогенопроизводных углеводородов, в
которых атом галогена расположен в a-положении по
отношению двойной связи, например как в аллилхлориде (СН2=СН-СН2-Cl) и бензилхлориде (С6Н5СН2Cl).
Галогенопроизводные
углеводородов участвуют также и в реакциях отщепления (элиминирование). Для
третичных галогенопроизводных углеводородов характерно мономолекулярное
элиминирование (Е1), для первичных - бимолекулярное (Е2).
Из
галогенопроизводных углеводородов можно получить широкий спектр органических
соединений: нитро-, аминосоединения, нитрилы, простые и сложные эфиры, спирты,
предельные и непредельные углеводороды, магнийорганические соединения
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: а)
2-хлор-3-метил-пентан, б) 3-хлор-2,2-диметилгексан, в) 4-бром-4-метилгексен-2,
г) виц-дибром-этан, д) п-нитрохлорбензол, е) гем-дихлорэтан.
2. Напишите формулы всех изомеров хлорпентана и назовите их по
международной и рациональной номенклатурам. Указать первичные, вторичные и
третичные галогенопроизводные углеводородов.
. Напишите уравнения реакций взаимодействия водного и спиртового
раствора щелочи с а) изобутилбромидом, б) трет-бутилбромидом. Объяснить
механизм протекания реакций.
. Напишите структурные формулы соединений состава C5H11C1, главная
цепь которых состоит из 4 углеродных атомов. Назовите эти вещества.
. Напишите уравнения реакций водного раствора щелочи с хлористым
этилом и хлористым аллилом. Назовите полученные вещества.
. Какие соединения образуются при действии спиртового раствора
щелочи на изопропилбромид и 1-хлор-2-метилбутан?
. Напишите уравнения реакций превращения 2-бромбутана в
2,2-дийодбутан.
. Приведите возможные схемы и назовите продукты взаимодействия
бромистого бензила и п-бромтолуола со следующими реагентами: а) NaOH (H2O), б) NaCN, в) NH3. Укажите условия реакции.
. Сравните отношение хлорбензола и п-нитрохлорбензола к действию
электрофильных и нуклеофильных реагентов.
. Получите из пропилена 2,2-дихлорпропан.
. Напишите уравнения реакций, с помощью которых можно осуществить
следующие химические превращения:
спирт.р-р NaOH Br2
спирт.р-р NaOH Br2
а) 2-хлорбутан A
B С Д
CH3Cl (AlCl3) Cl2,
t NaOH, H2O PCl5
б) бензол А
В С Д
Cl2, hv KOH (спирт.)
H2O (H2SO4) PBr3
NaOH (вод.)
в) изобутан А
В С Д К
HCl 2Na
Cl2,
hv NaOH
(спирт.)
г)
пропилен А В
С Д
NaOH (вод.)
К
Напишите реакции получения изопропилбромида из соответствующего а) спирта
и б) непредельного углеводорода. Приведите реакции его взаимодействия со
следующими реагентами: а) Na, б)
C2H5ONa, в) CH3COONa, г) C6H5ONa.
12. Приведите для хлорбензола следующие реакции
электрофильного замещения: а) бромирование в присутствии FeCl3, б) сульфирование, нитрование.
Объясните инертность галогена, связанного с sp2-гибридным атомом углерода в реакциях нуклеофильного
замещения.
13. Последовательностью каких реакций можно получить третичный бутилбромид
из изобутилового спирта? Для полученного галогенуглеводорода напишите реакции
взаимодействия с а) NaОH (спирт.), б) NaОН (вод.). Объясните механизм
протекания реакций.
. Какие вещества образуются при дегидрогалогенировании следующих
соединений: 2-метил-2-хлоргексана и 4-метил-2,4-дихлоргексан?
ПРАКТИКУМ
Опыт 32. ПОЛУЧЕНИЕ ХЛОРЭТАНА ИЗ ЭТАНОЛА
Р е а к т и в
ы: этиловый спирт, концентрированная серная кислота, хлорид натрия
В пробирку на высоту около 3 мм помещают хлорид натрия и добавляют 5
капель этанола. После смачивания соли этанолом приливают 4 капли
концентрированной серной кислоты. Пробирку закрывают пробкой с газоотводной
трубкой и осторожно нагревают на слабом пламени горелки, избегая бурного
выделения хлороводорода. Периодически отверстие пробирки подносят к пламени
горелки. Выделяющийся хлорэтан загорается, образуя кольцо зеленого цвета, что
характерно для низших галогеналканов.
2NaCl + H2SO4 Na2SO4 + 2HClH5OH + HCl C2H5Cl + H2O
Опыт 33. ПОЛУЧЕНИЕ ЙОДОФОРМА
Р е а к т и в
ы: этиловый спирт, раствор йода в йодиде калия, 10% раствор гидроксида натрия
В небольшую коническую колбу вносят 1 мл этилового спирта, 1 мл раствора
йода в йодиде калия и 2-3 мл 10%-ного раствора гидроксида натрия. Реакционную
смесь слегка нагревают. При этом окраска йода исчезает, ощущается характерный
запах, появляется бледно-желтая муть. При охлаждении раствора выпадают желтые
игольчатые кристаллы йодоформа. Если муть исчезает, к теплой реакционной смеси
добавляют при перемешивании ещё 1-2 мл раствора йода.
CH2OH + I2 + NaOH CHI3 + HCOONa + H2O + NaI
Опыт 34. ПОЛУЧЕНИЕ ХЛОРОФОРМА ИЗ СПИРТА
Р е а к т и в
ы: этиловый спирт, хлорная известь
В большую пробирку насыпают 2-3 г хлорной извести, добавляют 5 мл воды и
2 мл спирта. Пробирку закрывают пробкой с газоотводной трубкой, встряхивают и
нагревают. После начала реакции нагревание временно прекращают. Из газоотводной
трубки в пробирку-приемник, охлаждаемую водой, отгоняют воду с хлороформом. В
случае замедления или прекращения поступления отгона пробирку снова нагревают.
Хлороформ в виде тяжелой жидкости собирается под водой.
СаС12 + 2О
Са(ОС1)2
Са(ОН)2 + НОС1
СН3СН2ОН + [О] СН3СНО + Н2О
СН3СНО + НОС1 СС13СНО + Н2О
СС13СНО + Са(ОН)2 СНС13 + (НСОО)2Са
Хлорная известь действует на спирт как окислитель и хлорирующий реагент.
Известь применяют свежую, растертую в порошок.
Опыт 35. ПОЛУЧЕНИЕ ХЛОРОФОРМА ИЗ ХЛОРАЛЬГИДРАТА
Р е а к т и в ы: хлоральгидрат, 10% раствор гидроксида натрия
В пробирку помещают несколько кристаллов хлоральгидрата и добавляют 6-8
капель 10% водного раствора гидроксида натрия. Содержимое пробирки, помутневшее
уже при комнатной температуре, слегка нагревают. Ощущают сладковатый запах
выделившихся паров хлороформа:
+NaOH
Сl3С-CН(ОН)2 Сl3С-C(О)Н СНСl3 + HCOONа + Н2О
H2O
Для медицинских целей применяют особо чистый хлороформ, который получают
из хлоральгидрата.
Опыт 36. СВОЙСТВА ХЛОРОФОРМА
Р е а к т и в
ы: хлороформ, раствор йода в йодиде калия
В пробирке смешивают 1 мл хлороформа с 1 мл воды и тщательно встряхивают.
При отстаивании образуется 2 слоя.
В другую пробирку вносят несколько капель раствора йода в йодиде калия и
хлороформа, встряхивают, нижний слой окрашивается в розовый цвет.
Хлороформ плохо растворим в воде, тяжелее воды, обладает характерным
сладковатым запахом, является хорошим pacтворителем многих веществ, при
встряхивании с йодом йод переходит из водного слоя в хлороформный, окрашивая
его в розовый цвет.
Опыт 37. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ХЛОРОФОРМ
Р е а к т и в
ы: хлороформ, резорцин, 10% раствор гидроксида натрия
В про6ирку помещают 2-3 мл воды, 0,5 мл хлороформа, несколько кристаллов
резорцина и 1 мл 10%-ного раствора гидроксида натрия. При кипячении реакционная
мacca окрашивается в красный цвет.
Опыт 38. ГИДРОЛИЗ ХЛОРОФОРМА
Р е а к т и в ы: хлороформ, 10% раствор гидроксида натрия, азотная
кислота, 1% раствор нитрата серебра, 10% раствор аммиака, 1% раствор
перманганата калия
В коническую кол6у наливают 2 мл хлороформа и 10 мл 10%-ного раствора
гидроксида натрия. Реакционную смесь нагревают до кипения хлороформа. После
охлаждения гидролизат разливают в 3 пробирки.
В одну пробирку наливают азотную кислоту до кислой реакции, несколько мл
1%-ного раствора нитрата серебра, сразу образуется обильный осадок хлорида
серебра. В другую пробирку наливают сначала 2-3 мл 1%-ного раствора нитрата
серебра, затем раствор аммиака до полного растворения образующегося осадка
оксида серебра. Аммиачный раствор оксида серебра переливают в пробиpку с
гидролизатом. Сразу же, вследствие восстановления оксида серебра муравьиной
кислотой, образовавшейся при гидролизе хлороформа, выделяется темный осадок
металлического серебра. В третью пробирку добавляют 1%-ный раствор перманганата
калия. Фиолетовая окраска переходит в ярко-зеленую.
Хлороформ при нагревании в щелочной среде гидролизуется. Хлор, связанный
с углеродом, переходит в виде иона в раствор и о6разуется натриевая соль
муравьиной кислоты.
СНСl3 + NаОН NaCl + HCOONa + H2O
НNО3аСl + АgNО3 АgСl¯+ NаNО3
Муравьиная кислота, проявляя свойства альдегида, реагирует с аммиачным
раствором оксида серебра.
Н3СООNа + Аg2О Ag↓ + NаHСO3
Перманганат калия в щелочной среде окисляет муравьиную кислоту и
переходит в соль марганцовистой кислоты. Раствор окрашивается в зеленый цвет.
ООNа + КМnО4 + NаОН Nа2СОЗ
+ К2МnО4 + Na2MnО4 + H2O
Опыт 39. ОПРЕДЕЛЕНИЕ ЧИСТОТЫ ХЛОРОФОРМА
Р е а к т и в ы: хлороформ для наркоза (в оригинальный упаковке),
хлороформ загрязненный, раствор йодида калия, 1% раствор нитрата серебра
Хлороформ под действием света и кислорода постепенно окисляется с
образованием хлороводорода и ядовитого фосгена, который при дальнейшем
окислении разлагается до оксида углерода (IV) и свободного хлора:
[O] [O]
СНСl3
Cl2C=O CO2 + Cl2
-HCl
Параллельно для сравнения проводят опыты с чистым и загрязненным хлороформом.
Для открытия хлороводорода 2 мл хлороформа взбалтывают с 10 мл
дистиллированной воды, отделяют водный слой и делят его на 3 части.
Водный слой испытывают синей лакмусовой бумагой: покраснение
свидетельствует о наличии иона водорода.
Ко второй части водного слоя прибавляют раствор нитрата серебра:
появление осадка или мути указывает на присутствие иона хлора (хлористый
водород).
НСl + АgNО3 АgСl + НNО3
К третьей части водного слоя при6авляют раствор йодида калия,
встряхивают, появление розового окрашивания свидетельствует о наличии в
хлороформе свободного хлора.
КI + Сl2 I2 + КСl
При длительном хранении хлороформа на свету в присутствии кислорода
воздуха может произойти разложение:
СНСl3 + О2 СОСl2 + HCll2
+[О] CО2↑ + Cl2↑
Поэтому хлороформ для наркоза выпускается в склянках из тёмного стекла.
Опыт 40.
ОТЩЕПЛЕНИЕ ГАЛОГЕНА ПОД ДЕЙСТВИЕМ СПИРТОВОГО РАСТВОРА НИТРАТА СЕРЕБРА
Р е а к т и в
ы: бутилбромид, 2% спиртовый раствор нитрата серебра
Опыт проводят параллельно с различными галогенуглеводородами.
В сухую пробирку вносят 1-2 мл спиртового раствора нитрата серебра и 1
каплю бутилбромида. Если при встряхивании не выделяется осадок, реакционную
смесь нагревают до кипения и охлаждают, выделяется осадок бромида серебра.
С4Н9Br + AgNO3 С4Н9ОNO2 + AgBr↓
Опыт 41. ПРОЧНОСТЬ ГАЛОГЕНА БЕНЗОЛЬНОГО ЯДРА
Р е а к т и в ы: хлорбензол, 5% раствор гидроксида натрия, 1% раствор
нитрата серебра
В пробирке смешивают 2 капли хлорбензола и 6-8 капель
5%-ного раствора гидроксида натрия, содержимое пробирки нагревают до кипения и
добавляют 2 капли 1%-ного раствора нитрата серебра. Появления мути или
выделения осадка не наблюдается.
Проведенная реакция указывает на прочную связь
галогена, стоящего в бензольном ядре и невозможность его отщепления в условиях
опыта. Муть за счет мельчайших капелек хлорбензола, который плохо растворяется
в холодной воде, нельзя путать с осадком. В этом легко убедиться - при
нагревании такая муть исчезает.
Опыт 42. ПОДВИЖНОСТЬ ГАЛОГЕНА В БОКОВОЙ ЦЕПИ
Р е а к т и в ы: бензилхлорид, 5% раствор гидроксида натрия, 1% раствор
нитрата серебра
В пробирке смешивают 2 капли бензилхлорида и 6-8
капель 5%-ного раствора гидроксида натрия, содержимое пробирки нагревают до
кипения и добавляют 2 капли 1%-ного раствора нитрата серебра. В пробирке
наблюдается появление белого осадка хлорида серебра:
С6H5CH2Cl + NaOH
С6H5CH2OH + NaCl
NaCl + AgNO3 AgCl ↓ + NaNO3
.7 СПИРТЫ
Спиртами называют производные углеводородов, содержащие одну или
несколько гидроксильных групп, связанных с атомами углерода в sp3-гибридизации.
Классификацию спиртов можно представить следующим образом:
насыщенные
СН3-СН2-СН2-ОН
от
природы
углеводородного ненасыщенные
радикала СН2=СН-СН2-ОН
ароматические
(фенолы)
С6Н5ОН
одноатомные
СН3-СН2-ОН
по
числу двухатомные
гидроксильных НО-СН2-СН2-ОН
СПИРТЫ групп
полиатомные
НОСН2СНОНСН2ОН
первичные
СН3-СН2-СН2-СН2-ОН
по
расположению вторичные
-ОН
группы в СН3-СН-СН2-СН3
углеродной
цепи |
ОН
третичные
СН3
|
СН3-С-СН3
|
ОН
Для названия спиртов применяют международную, рациональную и
радикало-функциональную номенклатуры.
Например:
|
Строение вещества
|
Названия
|
|
международная номенклатура
|
радикало-функциональная
номенклатура
|
рациональная номенклатура
|
|
СН3-СН2-СН2-ОН
|
пропанол-1
|
пропиловый спирт
|
этилкарбинол
|
|
СН3-СНОН-СН3
|
пропанол-2
|
изопропиловый спирт
|
диметилкарбинол
|
|
СН3-СН-СН2ОН | СН3
|
2-метилпропанол-1
|
изобутиловый спирт
|
изопропилкарбинол
|
|
CH2=CH-CH2OH
|
пропен-2-ол-1
|
винилкарбинол
|
аллиловый спирт
|
Для спиртов характерны изомеры углеродного скелета, по положению
гидроксильной группы и положению двойной связи (для непредельных спиртов),
пространственная изомерия.
Одноатомные спирты получают а) гидролизом галогенопроизводных
углеводородов, б) гидратацией алкенов, в) восстановлением карбонильных
соединений (альдегидов, кетонов, карбоновых кислот), г) взаимодействием
альдегидов и кетонов с магнийорганическими соединениями (реактивами Гриньяра);
многоатомные: а) гидроксилированием алкенов, б) гидратацией оксиранов, в)
гидролизом жиров (получение глицерина).
Спирты имеют более высокие температуры плавления и кипения, большую
растворимость в воде, чем соответствующие углеводороды. Такое различие
объясняется наличием водородных связей в спиртах:
. . . О Н . . . О Н . . . О Н
R R R
Для спиртов характерны реакции с участием связей О-Н (замещение атома
водорода металлом), С-О (реакции нуклеофильного замещения SN1, SN2), реакции дегидратации и окислительные реакции.
Одноатомные спирты проявляют слабые кислотные и слабые основные свойства,
т.е. они являются амфотерными соединениями. Их кислотные свойства обусловлены
подвижностью атома водорода гидроксильной группы. Однако спирты являются более
слабыми ОН-кислотами, чем вода, это обусловлено положительным индуктивным
эффектом углеводородного радикала, связанного с гидроксильной группой. Из-за
низкой кислотности одноатомные спирты не вступают в реакцию со щелочами.
Основные свойства одноатомных спиртов обусловлены наличием на атоме кислорода
гидроксильной группы неподеленной пары электронов, способной присоединять
протон.
Реакции, доказывающие кислотно-основные свойства одноатомных спиртов:
H5OH + Na ® C2H5ONa + HH5ONa + HOH ® C2H5OH + NaOH
+ HH5OH + НBr
C2H5-O Br -
Многоатомные спирты являются более сильными ОН-кислотами, чем одноатомные
спирты, поэтому они образуют алкоголяты не только со щелочными металлами, но и
с другими активными металлами, а также со щелочами и гидроксидами тяжелых
металлов. Повышение кислотных многоатомных спиртов связано с
электроноакцепторным влиянием одной гидроксильной группы на другую (-J). С гидроксидом меди (II) многоатомные спирты образуют
комплексное соединение синего цвета.
Непредельные спирты подразделяются на виниловые (СН2=СН-ОН) и аллиловые
(СН2=СН-СН2-ОН). Для аллильных непредельных спиртов характерны реакции и по
двойной связи: а) присоединение галогенов, галогеноводородов, б) гидратация, в)
окисление, г) озонолиз. Соединения, у которых гидроксильная группа находится
при углеродном атоме, образующем кратную связь, называются енолами, они
неустойчивы и изомеризуются в альдегиды или кетоны (правило
Эльтекова-Эрленмейера).
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
следующих соединений и назовите их по всем возможным номенклатурам: а)
метилэтилизопропилкарбинол, б) ди-втор.бутилкарбинол, в)
метилизопропилтрет.бутилкарбинол, г) 2-метил-пентанол-3, д)
2,3-диметилбутанол-2.
2. Напишите схемы получения бутанола-2
из следующих соединений: а) 2-бром-бутана, б) бутена-2, в) бутанона, г)
бутина-2.
3. Напишите уравнения взаимодействия
азотной кислоты со следующими спиртами: а) 3-метил-2-бутанол, б)
2,3,3-триметил-2-бутанол. Назовите конечные продукты.
4. Напишите уравнения реакций
внутримолекулярной дегидратацин следующих соединений: а) пропанола, б)
2-метил-2-бутанола. Назовите образующиеся соединения.
5. Напишите уравнения реакций аллилового
спирта с а) Na, б) СН3СН3ОН, в) НВг и схему осторожного окисления по двойной
связи. Назовите конечные продукты.
6. Напишите уравнения реакций,
протекающих при взаимодействии глицерина с а) Na, б) CuSO4,
(NaOH), в) HBr, г) конц. HNO3, конц. H2SO4, д) CH3COOH, H+, е) C17H35COOH, H+. Назовите полученные продукты.
7. Напишите формулы следующих спиртов:
а) 1,2,3-пропантриол, б) 1,2,4-бутан-триол, в) 1,3,5-пентантриол.
8. Напишите структурные формулы
непредельных спиртов состава C4H7OH и назовите их.
9. Объясните, почему температура кипения
бутилового спирта значительно выше, чем температура кипения его изомера -
диэтилового эфира. Укажите вид изомерии.
10.Гидратацией
каких алкенов можно получить следующие спирты: изопропиловый, трет.бутиловый,
3-метилгексанол-3?
11.Какие спирты
образуются при гидролизе в щелочной среде: трет.бутилбромида,
1-йод-3,4-диметилпентана?
12.Из каких
альдегидов и кетонов при восстановлении могут быть получены:
изопропилметилкарбинол, пентанол-1, диизопропилкарбинол?
13.Напишите схему
получения из этилена по реакции Вагнера этандиола и напишите схемы его реакций:
с азотной кислотой, с этиловым спиртом, с гидроксидом меди (II).
14.Как получить
глицерин из ацетилена, пропилена?
15.Сформулируйте
правило Эльтекова и объясните причину неустойчивости винилового спирта.
16.При помощи
каких химических реакций можно отличить друг от друга этиловый спирт, глицерин,
фенол?
17.Напишите
реакции взаимодействия пропанола-1 и 2-метилпропанола-2 с бромоводородом.
Объясните механизм протекания реакций.
18.Составьте
уравнения реакций по следующим схемам реакций:
? ? ?
а) СНºСН СН3-СНО
С2Н5ОН СН3-СН2-О-С2Н5
PBr3 Mg
CH3CH2CHO H2O
б)
2-метилпропанол-1 А Б
В Д
О2 (Ag)
Н2О NaOH C2H5Cl
в) Этилен
А В C Д
Cu(OH)2
Е
ПРАКТИКУМ
Опыт 43. РАСТВОРИМОСТЬ СПИРТОВ В ВОДЕ
Р е а к т и в ы: метиловый, этиловый, амиловый спирты
В трех пробирках смешивают по 1 мл спиртов с 1 мл воды, встряхивают. В
первой и второй пробирках наблюдается образование однородной смеси. В третьей -
отслоение в два слоя: верхний - спирт, нижний - вода.
С увеличением молекулярного веса растворимость в воде одноатомных
предельных спиртов понижается.
Опыт 44. ПОЛУЧЕНИЕ АЛКОГОЛЯТА НАТРИЯ
Р е а к т и в ы: спирт этиловый абсолютный, натрий металлический
В сухую пробирку наливают 2-3 мл абсолютного этилового спирта, вносят
кусочек металлического натрия, предварительно высушенного фильтровальной
бумагой и закрывают отвepстие пробирки пробкой с газоотводной трубкой. Бурно
выделяющийся водород собирают, прикрыв пробирку пробкой:
СН3СН2ОН + 2Na 2 СН3СН2ОNа + Н2
Пробирку подносят отверстием к пламени горелки. Горение смеси водорода с
воздухом сопровождается характерным звуком - хлопком.
По окончании реакции к раствору алкоголята приливают воду и испытывают
раствор на красную лакмусовую бумагу, которая синеет при разложении алкоголятов
водой за счет образования щелочи.
СН3СН2ОNа + HOH СН3СН2ОН + NaOH
Опыт 45. ОКИСЛЕНИЕ ЭТИЛОВОГО СПИРТА ПЕРМАНГАНАТОМ КАЛИЯ
Р е а к т и в ы: этиловый спирт, 1% раствор перманганата калия, раствор
гидроксида натрия
В пробирку наливают 1-2 мл этилового спирта, 2 капли прибавляют 1 мл
щелочного раствора КМпО4 и нагревают. Ощущается запах уксусного альдегида.
Раствор обесцвечивается, выпадает бурый осадок двуокиси марганца.
Н2О
КМпО4 КОН + МпО2 + [О]
СН3СН2ОН + [О] СН3СНО + Н2О
С помощью пипетки отбирают 1 каплю полученного раствора и добавляют в
пробирку, содержащую 3 капли фуксинсернистой кислоты. Наблюдают появление
розово-фиолетовой окраски раствора, подтверждающей образование уксусного
альдегида.
Опыт 46. ОКИСЛЕНИЕ ЭТИЛОВОГО СПИРТА БИХРОМАТОМ КАЛИЯ
Р е а к т и в ы: этиловый спирт, хромовая смесь (10% раствор серной
кислоты и 5% раствор бихромата калия)
Пробирку с 1 мл этилового спирта и 1 мл хромовой смеси осторожно
нагревают. Оранжевый цвет смеси быстро переходит в зеленый, ощущается запах
уксусного альдегида, напоминающий запах антоновских яблок.
К2Сr2О7 + Н2SO4 КСг(SO4)2
+ H2O + [O]
CН3СН2ОН
+ [О] СН3СНО + Н2О
С помощью пипетки отбирают 1 каплю полученного раствора и добавляют в
пробирку, содержащую 3 капли фуксинсернистой кислоты. Наблюдают появление
розово-фиолетовой окраски раствора, подтверждающей образование уксусного
альдегида.
Опыт 47. ОКИСЛЕНИЕ ЭТИЛОВОГО СПИРТА ОКСИДОМ МЕДИ
Р е а к т и в ы: этиловый спирт, фуксинсернистая кислота
Спираль из медной проволоки нагревают в пламени горелки до появления
черного налета окиси меди. Горячую спираль опускают в сухую пробирку с 1 мл
этилового спирта. Черная поверхность спирали сразу же становится золотистой
вследствие восстановления оксида меди. При этом ощущается характерный запах
уксусного альдегида (запах яблок).
СН3СН2ОН + СuО СН3СНО + Сu + Н2О
В другую пробирку отливают часть полученного раствора и добавляют 1-2
капли фуксинсернистой кислоты. Появляется розово-фиолетовая окраска (цветная
реакция на альдегид).
Опыт 48. ДЕЙСТВИЕ БРОМА НА АЛЛИЛОВЫЙ СПИРТ
Р е а к т и в ы: этиловый, аллиловый спирты, бромная вода
В пробирку вливают 1 мл бромной воды и прибавляют несколько капель сильно
раз6авленного водного раствора аллилового спирта. Бромная вода моментально
обесцвечивается. Параллельно ставят опыт с этиловым спиртом. В данном случае
обесцвечивание не наблюдается.
СН2=СН-СН2ОН + Вr2
СН2Вr-СНВг-СН2ОН
Опыт 49. ВЗАИМОДЕЙСТВИЕ АЛЛИЛОВОГО СПИРТА С ПЕРМАНГАНАТОМ КАЛИЯ
Р е а к т и в ы: аллиловый спирт, 0,5% раствор перманганата калия
В пробирку с 1 мл раствора перманганата калия добавляют несколько капель
разбавленного водного раствора аллилового спирта. Смесь моментально обесцвечивается
вследствие окисления аллилового спирта по месту двойной связи с образованием
глицерина.
СН2 СН2ОН
ïê ï
СН + КМпО4 + Н2О СНОН + КОН + МпО2
ï ê
СН2ОН СН2ОН
Опыт 50. ВЗАИМОДЕЙСТВИЕ МНОГОАТОМНЫХ СПИРТОВ С ГИДРОКСИДОМ МЕДИ (II)
Р е а к т и в ы: глицерин, 5% раствор сульфата меди, 10% раствор
гидроксида натрия
В пробирку вливают 0,5 мл 5% раствора сульфата меди и добавляют 1 мл 10%
раствора гидроксида натрия. Выпадает голубой осадок гидроксида меди. При
добавлении к полученной смеси капли глицерина и взбалтывании осадок гидроксида
меди растворяется, а жидкость приобретает интенсивно-синий цвет. Растворение
осадка и изменение цвeта жидкости - результат образования глицерата меди.
Н СН2-ОН
ô ô
CH2 ОН Н2С - О О - СН
ô HO (CuSO4 + NaOH) ô Сu ô
2 СНОН + Сu HС - О О-СН2 + Н2О
ô НО ô ô
СН2OH H2C - OН Н
Данная реакция является качественной на многоатомные спирты, содержащие в
своей структуре a-гликольный
фрагмент. Образованный хелатный комплекс не разлагается при кипячении.
III.8
ФЕНОЛЫ
По числу гидроксильных групп фенолы делятся на
одноатомные, двухатомные, трех- и полиатомные.
Фенолы существенно отличаются по своим физическим и
химическим свойствам от спиртов. Главной причиной этих отличий является
различный характер электронных взаимодействий гидроксильной группы с
углеводородным радикалом. В фенолах гидроксильная группа связана с углеродом
ароматического кольца и поэтому наряду с отрицательным индуктивным эффектом (-J) имеет место и положительный
мезомерный эффект (+М) (р,π-сопряжение).
По заместительной номенклатуре ИЮПАК названия фенолов
образуют от названий соответствующих аренов с добавлением гидрокси-. Для многих
фенолов используют тривиальные названия. В качестве основы названий гомологов
фенола чаще всего используют слово -фенол.
Например:
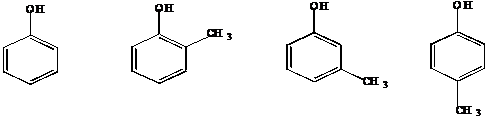
фенол,
2-метилфенол 3-метилфенол 4-метилфенол
гидроксибензол
о-метилфенол м-метилфенол п-метилфенол
о-крезол
м-крезол п-крезол
Природным
источником фенола является каменноугольная смола. Чаще фенолы получают
синтетическими методами а) кумольным способом, б) с помощью серной кислоты, в)
окислительным декарбоксилированием ароматических карбоновых кислот и г) из
солей арилдиазония.
Все
возможные реакции фенолов можно подразделить на реакции с участием связи О-Н
(реакции замещения водорода), связи С-О (реакции нуклеофильного замещения),
арильного радикала (реакции электрофильного замещения), а также реакции
восстановления и окисления. Однако вследствие р,π-сопряжения неподеленной пары электронов атома
кислорода с π-электронной системой ароматического ядра прочность
связи С-О у фенолов значительно выше, чем у спиртов. Поэтому реакции фенолов с
разрывом связи С-О протекают редко.
Фенолы
более сильные О-Н кислоты, чем спирты. Это вызвано тем, что неподеленная пара
электронов атома кислорода в молекуле фенола смещена к ядру (+М), что приводит
к образованию частичного положительного заряда на атоме кислорода и увеличению
поляризации связи О-Н по сравнению со спиртами. Кроме того, образующийся
фенолят-ион имеет повышенную стабильность за счет делокализации отрицательного
заряда по ароматическому радикалу:

основание
кислота сопряженная феноксид-ион
кислота
(сопряженное основание)
Доказательством
более сильных кислотных свойств фенолов по сравнению со спиртами может служить
их реакция с водными растворами щелочей с образованием фенолятов:
С6Н5ОН
+ NaOH C6H5ONa + Н2О
На
кислотность фенола значительное влияние оказывают заместители в ароматическом
ядре. Введение в пара-положение бензольного ядра молекулы фенола
электроноакцепторных заместителей (-NO2, -CN, -Hal и
др.) усиливают кислотные свойства фенола, а введение электронодонорных
заместителей (-NH2, -OCH3 и др.) понижают.
Двухатомные
фенолы являются более сильными кислотами, чем фенол. Поэтому они способны
образовывать соли не только с щелочными, но и с тяжелыми металлами. Для
многоатомных фенолов характерны те же реакции, что и для одноатомных. Они легко
галогенируются, нитруются, сульфируются и т.д.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: а)
о-нитро-фенол, б) п-крезол, в) пирокатехин, г) резорцин, д) гидрохинон, е)
пикриновая кислота.
2. Напишите схемы получения фенола, используя а)
бензолсульфокислоту, б) хлорбензол, в) кумол. Укажите условия реакций. В чем
преимущество кумольного способа получения фенола?
. Напишите схемы реакций, позволяющие синтезировать: а) резорцин
из бензола, б) п-крезол из п-толуидина.
. Напишите схемы реакции взаимодействия фенолята натрия с
изопропилхлоридом и хлорангидридом масляной кислоты. Назовите полученные
продукты.
. Какие соединения образуются при действии на бензиловый спирт
металлического натрия, уксусной кислоты, окислителей?
. Напишите реакцию действия брома на 3,5-диметил-1-гидроксибензол.
. Напишите схемы возможных химических реакций, позволяющих
отличить следующие соединения: а) пирогаллол, фенол, гидрохинон, б) пирокатехин
и резорцин.
. Составьте уравнения по следующей схеме превращений:
NaNO2, HCl H2O, t NaOH, H2O CO2, t,p HCl NaHCO3
Анилин А Б В Д E K
9. Синтезируйте из бензола п-нитрофенол, трибромфенол.
10. Сравните основные и кислотные свойства этанола и фенола и напишите
соответствующие реакции.
11. Напишите структурные формулы всех изомерных фенолов состава
С8Н10О, С7Н8О2, имеющих один алкильный радикал.
. Напишите уравнения реакций п-аминофенола со следующими
реагентами: а) HCl, б) NaOH (H2O), в) CH3J, г) CH3COCl.
. Сравните отношение к действию окислителей одно-, двухатомных
фенола и бензола. Напишите соответствующие уравнения реакций.
. Охарактеризуйте отношение фенола, п-нитрофенола и
2,4,6-тринитро-фенола к действию а) NaOH (H2O), б) NaHCO3
(H2O). Напишите уравнения реакций.
. Напишите схемы реакций резорцина со следующими реагентами: а) NaOH, б) Br2, в) CH3COCl.
. Сравните отношения фенола и бензилового спирта к действию
следующих реагентов: а) Na, б)
NaOH (H2O), в) PCl5, г) Br2. Напишите соответствующие уравнения реакций и назовите
продукты.
. Составьте уравнения реакций по следующей схеме превращений:
O2 10% H2SO4 Na CH3COCl
п-диизопропилбензол
А В C
Д
CH3Cl
Е
ПРАКТИКУМ
Опыт 51. ОБРАЗОВАНИЕ ФЕНОЛЯТА НАТРИЯ
Р е а к т и в ы: фенол кристаллический, 10% раствор гидроксида натрия
В пробирку помещают около 0,5 г кристаллического
фенола и прибавляют 5 мл 10% раствора гидроксида натрия. Фенол полностью
растворяется с образованием прозрачного раствора фенолята натрия.
С6Н5ОН + NaOH C6H5ONa + Н2О
Фенол является слабой кислотой, поэтому он легко
растворяется в щелочах.
Раствор фенолята натрия оставляют для последующих
реакций.
Опыт 52. РАЗЛОЖЕНИЕ ФЕНОЛЯТА НАТРИЯ КИСЛОТОЙ
Р е а к т и в ы: раствор фенолята натрия, 10% раствор
хлороводородной кислоты
В пробирку с прозрачным раствором фенолята натрия,
полученного в предыдущем опыте, добавляют 1-2 капли 10%-ного раствора
хлороводородной кислоты, наблюдают помутнение жидкости вследствие выделения
свободного фенола:
С6Н5ONa + HCl C6H5OH + NaCl
Феноляты как соединения, образованные слабой кислотой,
разлагаются более сильными кислотами.
Опыт 53. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С СОЛЯМИ УГОЛЬНОЙ
КИСЛОТЫ
Р е а к т и в ы: фенол кристаллический, раствор карбоната натрия, раствор
бикарбоната натрия
В две пробирки помещают по кристаллику фенола. В одну из них добавляют 2
мл водного раствора карбоната натрия, в другую - 2 мл бикарбоната натрия.
Пробирки встряхивают. Полное растворение фенола с образованием фенолята натрия
наблюдается в растворе карбоната натрия.
С6Н5ОН + Nа2СО3 C6H5ONa + NaHCO3
В результате гидролиза раствор карбоната натрия
образует достаточно большое количество гидроксильных ионов и хорошо растворяет
фенол.
Nа2СО3 + НОН NaОН +
NaHCO3
Угольная кислота более ионизирована, чем фенол. Она
способна вытеснять из раствора фенолята натрия фенол. Поэтому фенол не
растворяется в растворе бикарбоната натрия.
Опыт 54. ЦВЕТНЫЕ РЕАКЦИИ ФЕНОЛОВ С ХЛОРИДОМ ЖЕЛЕЗА (III)
Р е а к т и в ы: 1% водные растворы фенолов, хлорид
железа (III)
В пробирки помещают по 2 мл водных растворов фенолов и
добавляют по несколько капель 1% раствора хлорида железа (III). Растворы фенола и резорцина
образуют интенсивное фиолетовое окрашивание, раствор пирогаллола -
буровато-красное, раствор о-крезола - интенсивно фиолетовое, быстро переходящее
в грязно-желтое, м-крезол - фиолетовое, п-крезол - темно-синее. Раствор
пирокатехина дает интенсивное зеленое окрашивание, переходящее при сильном
разбавлении водой в фиолетово-синее. Раствор гидрохинона сначала зеленеет,
затем буреет.
Реакция с хлоридом железа является качественной
реакцией на фенолы, химизм этой реакции трактуют по-разному. Одни рассматривают
гидроксил как енольную группу С=С-ОН, дающую реакцию окрашивания с хлоридом
железа (III) за счет образования окрашенного
соединения С6Н5ОFеС12. По мнению
других, хлорид железа (III)
взаимодействует с фенолами с образованием соединений типа фенолятов.
С6Н5ОН + FeCl3 (C6H5О)3Fe
Считают также, что окрашивание является результатом
образования сильно диссоциированных комплексных фенолятов трехвалентного
железа, образующихся по уравнению:
FeCl3 + 6С6Н5ОН 6Н+ + [Fe(OC6H5)6]3- + 3С1-
Опыт 55. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С БРОМОМ
Р е а к т и в ы: фенол,бромная вода
К нескольким кристалликам фенола в сухой пробирке
добавляют по каплям раствор брома. Наблюдается выделение белого осадка 2,4,6-трибромфенола,
бром быстро обесцвечивается на холоду и в обильном количестве выделяется
бромистый водород:

При
последующем добавлении избытка бромной воды наблюдают превращение белого осадка
в светло-желтый (за счет окисления 2,4,6-три-бромфенола и образования
2,4,4,6-тетрабромциклогексадиен-2,5-она-1).

Гидроксильная
группа в молекуле фенола, оказывая сильное электронодонорное влияние,
активирует бензольное кольцо в реакции бромирования и способствует
одновременному замещению атомов водорода в положениях 2,4,6 в отсутствие
катализатора. Данная реакция используется для идентификации фенолов со
свободными орто- и пара-положениями.
Опыт
56. ОКИСЛЕНИЕ ФЕНОЛОВ КИСЛОРОДОМ ВОЗДУХА В ЩЕЛОЧНОЙ СРЕДЕ
Р
е а к т и в ы: 1%-ные водные растворы фенолов (пиракатехин, пирогаллол,
гидрохинон), 5% раствор гидроксида натрия
На
полоску фильтровальной бумаги (20х4) наносят через равные промежутки по 1-2
капле растворов фенолов. В центр полученных пятен добавляют по 1 капле раствора
гидроксида натрия. В центре каждого пятна появляется окрашивание: у
пирокатехина - зеленое, у пирогаллола - темно-коричневое, у гидрохинона -
желтое с зеленой каймой. Резорцин образует окрашенное пятно коричневого цвета
спустя некоторое время.
Под
влиянием кислорода воздуха фенолы способны окисляться с образованием очень
сложной смеси окрашенных продуктов. Щелочная среда значительно облегчает и
ускоряет этот процесс. Окислители действуют одновременно на функциональную
группу и бензольное ядро фенолов, что приводит к глубоким изменениям молекулы
фенола. Выделить определенные продукты невозможно.
Легкость,
с которой ароматическое ядро подвергается окислению, является результатом
влияния гидроксильной группы (бензол окисляется с трудом). Вступая в сопряжение
с подвижной π-электронной системой бензольного ядра, свободная
электронная пара кислорода оказывается частично в тянутой в ядро, повышает
электронную плотность в нем, а следовательно, облегчает вступление в реакции
электрофильного замещения и в частности реакции окисления.
Опыт
57. ДЕЙСТВИЕ ПЕРМАНГАНАТА КАЛИЯ НА ФЕНОЛ
Р
е а к т и в ы: 1% раствор фенола, 5% раствор карбоната натрия, 1% раствор
перманганата калия
К
раствору фенола в пробирке добавляют половинное количество 5% раствора
карбоната натрия и при энергичном встряхивании прикапывают раствор перманганата
калия. Раствор быстро обесцвечивается вследствие легко идущего сжижения фонола
с образованием сложной смеси продуктов окисления.
Опыт
58. ДЕЙСТВИЕ НИТРАТА СЕРЕБРА НА ФЕНОЛЫ
Р
е а к т и в ы: 1%-ные растворы фенолы, 1% раствор нитрата серебра
В
пробирки вносят no 1 мл водного раствора многоатомных фенолов и
добавляют по нескольку капель 1% раствора нитрата серебра. Появляется
коричневое окрашивание раствора, выпадает темный осадок серебра.
С6Н5OH + AgNО3
Ag↓ + …
Многоатомные
фенолы являются сильными восстановителями, они легко выделяют свободное серебро
из раствора нитрата серебра. Наиболее легко выделяет серебро пирогаллол,
значительно медленнее - резорцин.
Опыт
59. НИТРОЗОРЕАКЦИЯ ФЕНОЛОВ (реакция Либермана)
Р
е а к т и в ы: 10% раствор фенола, 10% раствор нитрита натрия,
концентрированная серная кислота, 5% гидроксида натрия
В
пробирку помещают 0,5 мл концентрированной серной кислоты, 2-3 капли 10%-ного
раствора фенола и 1 каплю 10%-ного раствора нитрита натрия. При встряхивании
смесь окрашивается в сине-фиолетовый цвет. Окрашенную смесь выливают в стакан с
5 мл воды - появляется розово-красная окраска раствора. При добавлении 5%-ного
раствора гидроксида натрия раствор окрашивается в синий цвет:

п-нитрозофенол
п-бензохинонмонооксим

раствор
синего цвета
раствор
розово-красного цвета раствор синего цвета
Реакция
основана на конденсации фенола (п-бензохинонмонооксима) с избытком фенола в
присутствии концентрированной серной кислоты. Образующийся индофенол относится
к группе хинониминовых красителей и изменяет окраску в зависимости от рН среды.
Реакция Либермана характерна для фенолов, незамещенных в орто- и
пара-положениях.
Опыт
60. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С РАЗБАВЛЕННОЙ АЗОТНОЙ КИСЛОТОЙ
Р
е а к т и в ы: фенол, разбавленная азотная кислота
В
пробирке с водой растворяют небольшое количество фенола до образования
однородной маслянистой жидкости. В другой пробирке смешивают при охлаждении 2
мл концентрированной азотной кислоты и 3 мл воды. Разбавленную (1:1) кислоту
очень медленно по каплям приливают к фенолу, все время сильно встряхивая и
охлаждая пробирку. Реакция идет бурно. Добавив всю кислоту, выливают
реакционную смесь в трехкратный объем воды, встряхивают. На дне стаканчика
выделяется тяжелое масло, представляющее собой смесь о- и п-нитрофенолов.

Гидроксильная
группа, стоящая в бензольном ядре, являясь заместителем I
рода, активирует о- и п- водород бензольного ядра.
Реакция
замещения у фенолов протекает легче, чем ароматических углеводородов. Поэтому
реакция нитрования фенола происходит и при действии разбавленной азотной
кислоты.
Опыт 61. ВЗАИМОДЕЙСТВИЕ ФЕНОЛА С КОНЦЕНТРИРОВАННОЙ
АЗОТНОЙ КИСЛОТОЙ
Р е а к т и в ы: фенол, концентрированная азотная
кислота
В небольшую коническую колбу наливают 5 мл азотной
кислоты (уд. вес 1,3) и по каплям при размешивании приливают около 0,5 г
расплавленного фенола. После взбалтывания смесь нагревают до кипения.
После охлаждения выпадают кристаллы пикриновой
кислоты. Их можно отделить фильтрованием через сталунный фильтр.
ОН О2N ОН NO2
+ 3НNO3
(конц.) + 3Н2О
NO2
Опыт 62. СВОЙСТВА ТРИНИТРОФЕНОЛА
Р е а к т и в ы: насыщенный раствор тринитрофенола
(пикриновая кислота), 10% раствор гидроксида натрия, 10% раствор серной
кислоты, 1% раствор хлорида железа (III).
а) К насыщенному водному раствору пикриновой кислоты
добавляют несколько капель раствора щелочи - светло-желтая окраска переходит в
темную желто-оранжевую.
При подкислении щелочного раствора серной кислотой
жидкость снова приобретает светло-желтую окраску.
б) К раствору пикриновой кислоты добавляют 1-2 капли
раствора хлорида железа - окраска смеси не меняется.
При введении в ароматическое ядро нитрогруппы
усиливаются кислотные свойства фенолов. Нитрофеноляты щелочных металлов по
свойствам близки к настоящим солям. В растворах они окрашены в ярко-желтый
цвет. Это углубление окраски нитрофенолов в щелочном растворе обусловлено
изменением структуры нитрофенола по сравнению с его нейтральной молекулой.
Большинство нитрофенолов не дает характерного для
многих фенолов окрашивания с хлорным железом.
Опыт 63. ВОССТАНОВЛЕНИЕ ПИКРИНОВОЙ КИСЛОТЫ
Р е а к т и в ы: пикриновая кислота, глюкоза, раствор
гидрокарбоната натрия
Несколько кристалликов пикриновой кислоты растворяют в
3-4 мл раствора гидрокарбоната натрия и добавляют на кончике ножа глюкозу. При
кипячении смеси в течение 2-3 мин оранжевый раствор пикрата натрия постепенно
окрашивается в кроваво-красный цвет. При подкислении охлажденной жидкости
разбавленной серной кислотой красное окрашивание переходит в оранжево-желтое.
Глюкоза, легко окисляющаяся в щелочном растворе,
восстанавливает одну из нитрогрупп пикриновой кислоты до аминогруппы.
Образующаяся пикраминовая кислота, как и другие нитрофенолы, дает со
щелочами окрашенные феноляты.
III.9.
ПРОСТЫЕ ЭФИРЫ
Производные спиртов, фенолов, образующиеся в результате замещения атома
водорода гидроксильной группы углеводородным остатком, называют простыми эфирами.
- O - R′.
Радикалы в простых эфирах могут быть одинаковыми (симметричные эфиры) или
разными (несимметричные или смешанные эфиры):
H5-О-C2H5 CH3-O-C2H5
C6H5-O-C6H5 CH3-O-C6H5
симметричные несимметричные
Названия простых эфиров по радикало-функциональной номенклатуре обычно
образуют из названий углеводородных радикалов, связанных с кислородом, и
суффикса -овый. В заместительной номенклатуре ИЮПАК их рассматривают как
производные углеводородов, в которых один из атомов водорода замещен
алкоксигруппой (RО-). За
родоначальную структуру принимается более сложный по структуре радикал,
например:
СН3-О-СН-СН2-СН3 СН3-СН2-О-СН2-СН-СН3
ï ï
СН3 СH3
метилвтор.бутиловый эфир (Р.Ф.) этилизобутиловый эфир (Р.Ф.)
-метоксибутан (ИЮПАК) 2-метил-1-этоксипропан (ИЮПАК)
Получают простые эфиры взаимодействием алкоголятов и фенолятов с
галогеналканами (реакция Вильямсона) и межмолекулярной дегидратацией из
спиртов.
В химическом отношении простые эфиры являются весьма инертными веществами.
Разведенные минеральные кислоты и щелочи на холоду с ними не реагируют. За счет
наличия на атоме кислорода неподеленных пар электронов простые эфиры проявляют
слабые основные свойства. Под действием иодоводородной и концентрированной
серной кислот простые эфиры подвергаются расщеплению. Концентрированные
минеральные кислоты (НСl, H2SO4, НNO3)
образуют с простыми эфирами оксониевые соли. Протон кислоты присоединяется за
счет неподеленной пары электронов атома кислорода. При длительном пребывании на
воздухе простые эфиры окисляются с образованием взрывоопасных гидропероксидов R-О-ОН и пероксидов R-O-O-R′.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений и назовите их
по международной номенклатуре: а) метилэтиловый эфир, б) метил-изопропиловый
эфир, в) дипропиловый эфир, г) метилфениловый эфир, д) монометиловый эфир
этиленгликоля, е) дифениловый эфир.
2. Назовите приведенные соединения по радикало-функциональной и
систематической номенклатуре:
а) (СН3)3С-О-СН-СН3 б) СН3-СН2-О-СН2-СН-СН3
ï ï
СН3 СH3
в) СН3-СН2-О-СН-СН2-СН3 г) СН3-О-СН2-СH2-СН3
ï
СН3
д) С6Н5-О-СН-СН3 к) СН3-СН2-О-С6Н5
ï
СН3
3. Напишите схемы реакций, позволяющих получить: а) диизопропиловый
эфир из пропана, б) ди-втор-бутиловый эфир из бутилхлорида.
4. Напишите уравнения реакций, подтверждающих наличие слабых
основных свойств простых эфиров.
. Приведите два способа получения диэтилового эфира и напишите
уравнения реакций его взаимодействия со следующими реагентами: а) конц. НСl, б) конц. H2SO4, в) HI, г) О2, д) Nа. Назовите полученные продукты.
. Какие соединения образуются при расщеплении йодоводородной
кислотой на холоду и при нагревании следующих простых эфиров: а) метилэтиловый
эфир, б) метилизопропиловый эфир? Напишите соответствующие уравнения реакций.
. Какими реакциями можно проверить чистоту диэтилового эфира?
. С помощью каких химических реакций можно отличить диэтиловый
эфир от изомерного бутилового спирта?
. С помощью каких реакций можно получить а) из пропилена
диизопропиловый эфир, б) из бензола метилфениловый эфир. Приведите
соответствующие уравнения реакций.
10. Составьте уравнения по следующим схемам превращения:
? ? ?
а) СН º СН СН3 - СНО С2Н5ОН
СН3-СН2-О-С2Н5
Н2О, Н+
PСl5
CH3ONa Na, t
б)
пропилен 1 2
3 4
HI, t
5
HCl
6
. Приведите все возможные структурные формулы простых эфиров, имеющих
формулу С4Н10О. Назовите соединения.
. Какие соединения образуются при нагревании следующих эфиров с
концентрированной HI, взятой в
избытке: а) н-пропиловый, б) метилбутиловый?
. Напишите уравнение расщепления диизобутилового эфира при нагревании с
концентрированной серной кислотой.
. Как действуют щелочные металлы на простые эфиры на холоду и при
нагревании?
ПРАКТИКУМ
Опыт 64. ПОЛУЧЕНИЕ ДИЭТИЛОВОГО ЭФИРА
Р е а к т и в ы: этиловый спирт, концентрированна серная кислота
В сухую пробирку наливают смесь равных объемов этилового спирта и
концентрированной серной кислоты. Пробирку нагревают на песчаной бане до
130-1400 и чрезвычайно осторожно, по каплям добавляют спирт. При этом ощущается
запах диэтилового эфира.
СНЗСН2ОН + НОSО2ОН СН3СН2ОSО2OН + H2O
1300
СНЗСН2ОSО2ОН + НОСН2СН3 СН3СН2ОСН2СН3 + H2S04
Опыт 65. РАСТВОРИМОСТЬ ЭФИРА
Р е а к т и в ы: диэтиловый эфир, этиловый спирт
В одну из двух пробирок наливают 1 мл воды, в другую - 1 мл спирта,
добавляют по 1 мл эфира. В первой пробирке эфир всплывает, а во второй
образуется однородный раствор.
Эфир легче воды, почти не растворяется в ней. Со спиртом он смешивается в
любых соотношениях.
Опыт 66. РАСТВОРИМОСТЬ ОРГАНИЧЕСКИХ ВЕЩЕСТВ В ЭФИРЕ
Р е а к т и в ы: диэтиловый эфир, растительное масло
В пробирку вносят 0,5 мл растительного масла и 2-3 мл эфира. При
взбалтывании масло легко растворяется. Эфир - хороший растворитель. Он широко
применяется для растворения многих органических веществ.
Опыт 67. ОПРЕДЕЛЕНИЕ ЧИСТОТЫ ДИЭТИЛОВОГО ЭФИРА
Р е а к т и в ы: эфир чистый (в стандартной упаковке), эфир загрязненный,
раствор йодида калия, фуксинсернистая кислота
Опыт проводят с чистым и загрязненным эфиром. Эфир смешивают в пробирке с
раствором йодида калия. При этом загрязненный эфир вследствие выделения йода
окрашивается в желтый цвет.
КI + НОН НI + КОН
НI + C2H5O-С2Н5 I2 + Н2О + (С2Н5)2O
Эфир смешивают в пробирке с раствором фуксинсернистой кислоты, если эфир
чист, окрашивание не появляется (отсутствие уксусного альдегида).
При длительном хранении на свету в присутствии воздуха этиловый эфир, как
и другие простые эфиры, легко подвергается самоокислению (аутоокисление).
Процесс протекает медленно при участии молекулярного кислорода воздуха, при
этом образуются перекисные и гидроперекисные соединения.
ОН
О-ОН ï
О2 СН3СН2-О ï СН3СН-О
С2Н5-О-С2Н5
ï + СН3СНО-СН2СН3 или
ï
СН3СН2-О
СН3СН-О
ï
ОН
ОН
ï ОН
ОН О
СН3-СН-О
ï ï ïê
ï + НОН СН3-СН-О-ОН + СН3-СН-ОН
2 СН3-С-Н
СНз-СН-О
ï
ОН
Опыт 68. ВЗАИМОДЕЙСТВИЕ ДИЭТИЛОВОГО ЭФИРА С КИСЛОТАМИ
Р е а к т и в ы: эфир, концентрированные серная и соляная кислоты, 5%
раствор гидроксида натрия
В одну из двух пробирок наливают 2 мл концентрированной серной кислоты, в
другую - 2 мл соляной кислоты. Охладив их до 00, осторожно, малыми порциями,
добавляют в каждую пробирку по 1 мл охлаждeного эфира, все время взбалтывая и
охлаждая реакционную смесь. У образующихся гомогенных растворов запах эфира
отсутствует. Обе смеси осторожно разливают по двум пробиркам, содержащим по 5
мл холодной воды с кусочками льда. Появляется запах и эфир всплывает над водой.
При осторожном добавлении нескольких капель разбавленного раствора щелочи для
нейтрализации части кислоты слой эфира заметно увеличивается.
+ -
C2H5-О-С2Н5
+ H2SO4 [C2H5-О-С2Н5]
HSO4
ï
H
+ -____
C2H5-О-С2Н5
+ HCl [C2H5-О-С2Н5]
Cl
ï
H
Комплексный ион оксония образуется за счет присоединения протона водорода
кислоты к cвободной паре электронов атома
кислорода. Новая ковалентная связь по механизму образования является
координационной или донорно - акцепторной. Ион оксония связан с анионом хлора
электровалентной связью. Соли замещенного оксония непрочны и при прибавлении
воды полностью разлагаются на исходные соединения.
+ H2O
[C2H5-О-С2Н5]
HSO4- C2H5-О-С2Н5 +
H2SO4
ï
H
+ - H2O
[C2H5-О-С2Н5]
Cl C2H5-О-С2Н5 +
HCl
ï
H
III.10
АЛЬДЕГИДЫ И КЕТОНЫ
Альдегидами и кетонами называют производные углеводородов, содержащие в
своем составе карбонильную группу (>С=О). Поэтому их еще называют
карбонильными соединениями.
В альдегидах карбонильная группа связана с углеводородным радикалом и
атомом водорода, в кетонах карбонильная группа связана с двумя углеводородными
радикалами.
- С=О R-С=О
½ альдегид ½ кетон
Н R′
В зависимости от строения углеродного радикала альдегиды и кетоны
подразделяют на алифатические, алициклические и ароматические.
В номенклатуре альдегидов и кетонов используют тривиальные и
систематические названия. По заместительной номенклатуре ИЮПАК названия
альдегидов образуют от названия углеводорода с тем же числом атомов (включая
углерод альдегидной группы), прибавляя суффикс -аль. Нередко в названиях
альдегидов положение указывают греческими буквами α,
β, γ, при этом
буквой α
обозначают атом
углерода, соседний с альдегидной группой, например:
СН3 - СН - С =О 2-метилпропаналь
½ ½ изомасляный альдегид
СН3 Н α-метилпропионовый альдегид
Для названий кетонов широко используют радикало-функциональную
номенклатуру, согласно которой к названиям в алфавитном порядке углеводородных
радикалов при карбонильной группе прибавляют суффикс -кетон. При составлении
названия кетонов по заместительной номенклатуре ИЮПАК выбирается самая длинная
углеродная цепь, в состав которой входит кетогруппа, нумерацию проводят таким
образом, чтобы атом углерода карбонильной группы получил возможно меньший
номер, затем к названию предельного углеводорода, прибавляют суффикс -он и
цифрой обозначают атом углерода, входящий в кетогруппу, например:
О СН3
|| ½ 3-метилбутанон-2
СН3 - С - СН - СН3 метилизопропилкетон
Для карбонильных соединений характерна структурная изомерия. Альдегиды и
кетоны, содержащие одинаковое количество атомов углерода, являются изомерами по
функциональной группе.
Альдегиды образуются при окислении первичных спиртов, при гидролизе
гем-дигалогеналканов с атомами галогена у первичного атома углерода, из
ацетилена в условиях реакции Кучерова образуется уксусный альдегид, при
пиролизе солей карбоновых кислот, озонолизом алкенов. Кетоны получают
окислением вторичных спиртов, из алкинов (кроме ацетилена) в условиях реакции
Кучерова, гидролизом гем-дигалогеналканов с атомами углерода у вторичного
углерода. Ароматические альдегиды и кетоны можно получить окислением
ароматических углеводородов, реакцией формилирования (прямое введение
альдегидной группы в бензольное ядро), ацилированием ароматических
углеводородов по реакции Фриделя-Крафтса.
Химические свойства альдегидов и кетонов определяются наличием в их
молекуле карбонильной группы. Атом углерода карбонильной группы находится в
состоянии sp2-гибридизации и связан с окружающими
его атомами тремя σ-связями, расположенными в одной плоскости под углом
1200. Негибридизованная р-орбиталь атома углерода перекрывается с р-орбиталью
атома кислорода. Образуя π-связь. Атом кислорода как более электроотрицательного
элемента притягивает к себе σ- и π-электроны. В результате этого двойная
связь карбонильной группы сильно поляризована, на атоме кислорода возникает
частичный отрицательный заряд, а на атоме углерода - частичный положительный.
Благодаря такой поляризации альдегиды и кетоны способны вступать в реакции с
нуклеофильными реагентами, которые атакуют атом углерода карбонильной группы.
Альдегиды более реакционноспособны, чем кетоны. Алкильные радикалы за
счет +I-эффекта уменьшают положительный
заряд на атоме углерода карбонильной группы. Наличие в молекуле кетона двух
алкильных групп по карбонильной группе приводит к большому понижению
положительного заряда, чем в молекуле альдегида. Кроме того, алкильные радикалы
в молекуле кетона в большей степени затрудняют подход нуклеофила к карбонильной
группе.
Все реакции альдегидов и кетонов условно можно разделить на следующие
группы:
нуклеофильного присоединения (Н2, НОН, НCN, NaHSO3, С2Н5OH),
присоединения-отщепления (NH3, NH2OH, NH2NH2 и др.),
конденсации (альдольная, сложно-эфирная),
реакции, протекающие с участием атомов водорода α-углеродного атома,
полимеризация альдегидов,
окисление и восстановление альдегидов и кетонов,
отличительные реакции альдегидов и кетонов.
В молекуле непредельных альдегидов карбонильная группа связана с
углеводородным радикалом, содержащим кратную связь, для них характерны реакции
карбонильных соединений, а также ненасыщенных углеводородов. α,β-Непредельные альдегиды, содержащие в
своей структуре сопряженную систему, имеют ряд особенностей, например,
присоединение к ним галогенводородов, воды протекает против правила
Марковникова.
Ароматические альдегиды и кетоны по химическим свойствам сходны с
карбонильными соединениями жирного ряда. Так, ароматические альдегиды дают
реакцию «серебряного зеркала», образуют циангидриды, ацетали и т.д. Однако они
не вступают в реакцию альдольной конденсации, очень трудно полимеризуются.
Ароматические кетоны обладают меньшей реакционной способностью, чем кетоны
жирного ряда, поэтому они не образуют гидросульфитных соединений, не реагируют
с синильной кислотой. Ароматические альдегиды и кетоны дают ряд специфических
реакций: а) Канницаро, б) перекрестная альдольная конденсация, в) конденсация
Перкина, г) бензоиновая конденсация. Для них, наряду с реакциями по альдегидной
группе, характерны реакции электрофильного замещения в бензольном ядре
(галогенирование, нитрование, сульфирование, ацилирование и алкилирование по
Фридель-Крафтсу). Карбонильная группа, являясь заместителем II рода, направляет входящий
заместитель в мета-положение.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: а)
2-метилпентаналь, б) 2-метил-2-фенилбутаналь, в) 3,3-диметилбутанон, г)
салициловый альдегид, д) пропеналь, е) 3-метилгександион-2,4, к) бутаналь.
2. Напишите структурные формулы изомерных оксосоединений состава
С4Н8О, С5Н10О и назовите их по всем возможным номенклатурам.
. Какие карбонильные соединения образуются при а) окислении
бутанола-2, б) пиролизе смесей кальциевых солей муравьиной и пропионовой
кислот, в) каталитической гидратации этилацетилена и метилпропилацетилена, г)
гидролизе 1,1-дибром-3-метилпентана?
. Получите реакцией Фриделя-Крафтса ацетофенон, фенилэтилкетон.
. При помощи каких химических реакций можно отличить ацетон от
пропионового альдегида?
. Какие вещества образуются при взаимодействии следующих
соединений с последующим гидролизом? а) уксусный альдегид и бутилмагнийбромид,
б) метилэтилкетон и изопропилмагнийхлорид, в) муравьиный альдегид и
трет-бутилмагнийбромид.
. Напишите уравнение реакций взаимодействия пропионового альдегида
со следующими реагентами: а) гидроксиламин, б) 2-метилпропаналь, в) гидразин,
г) гидросульфит натрия, д) циановодородная кислота.
8. Напишите формулы соединений, которые получатся при действии
семикарбазида на а) ацетальдегид, б) метилизопропилкетон, в) масляный альдегид.
Назовите конечные продукты.
9. Какие соединения образуются при каталитическом действии
алкоголята алюминия (реакция Тищенко) на пропионовый и изовалериановый
альдегиды? Приведите соответствующие уравнения реакций.
. Напишите формулы соединений, которые получаются при альдольной
конденсации а) пропионового, б) диметилуксусного и в) изомасляного альдегидов.
. Укажите, какие продукты могут получиться при окислении
метилэтилкетона и метилпропилкетона. Объяснить правило Попова.
. Напишите уравнения реакций взаимодействия п-толуилового
альдегида с а) NaHSO3, б) HCN, в) С6Н5NHNH2, г) Ag2O (NH3), д) NH2OH. Назовите полученные продукты.
. Приведите последовательность реакций, с помощью которых можно
получить п-нитробензальдегид из этилбензола. Напишите реакции взаимодействия
полученного альдегида с бисульфитом натрия и фенилгидразином.
. По реакции Канниццаро получена смесь п-метоксибензойнокалиевой
соли и п-метоксиметилбензола. Какой альдегид образует эти продукты? Получите
исходный альдегид из п-крезола и п-оксибензойного альдегида.
. Напишите уравнения реакций взаимодействия коричного альдегида с
а) НСl, б) Br2, в) Ag2O (NH3). Назовите полученные продукты.
. Напишите уравнения реакций, отличающие бензальдегид от
ацетофенона.
. Составьте уравнения по следующим схемам превращений:
NaHSO3
2
Н2O,
Hg2+ HCN
а) СН≡СН
1 3
CH3MgBr
HOH
4 5
Al(OC2H5)3
6
60% KOH
2
[O] KCN
б) бензиловый
спирт 1 3
Cl2
4
CH3Cl (AlCl3)
5
KOH
2
НОН С2Н5ОН
в)
1,1-дихлорпропан 1
3
Cl2 (Р)
4
NH3
5
18.
ПРАКТИКУМ
Опыт 69. ПОЛУЧЕНИЕ МУРАВЬИНОГО АЛЬДЕГИДА
Р е а к т и в ы: метиловый спирт
В пробирку наливают 1 мл метилового спирта. В окислительном пламени
горелки докрасна нагревают медную проволоку, обвернутую в трубочку (колбаска).
Затем ее быстро опускают в пробирку с метиловым спиртом. При этом происходит
восстановление оксида меди до металлической (черная поверхность спирали сразу
же становится золотистой) и окисление метилового спирта до муравьиного
альдегида, присутствие которого ощущается по запаху.
Бумага, смоченная раствором фуксинсернистой кислоты, окрашивается от
образующихся паров формальдегида в красный цвет.
CH3-OH + СuO
H-C(O)H + Cu + H2O
Опыт 70.
ПОЛУЧЕНИЕ УКСУСНОГО АЛЬДЕГИДА
Р е а к т и в ы: этиловый спирт, хромовая смесь, фуксинсернистая кислота
В пробирку наливают 2 мл хромовой смеси и прибавляют 1 мл этилового
спирта. Закрывают пробирку пробкой с газоотводной трубкой, закрепляют в зажиме
штатива и осторожно нагревают. Конец газоотводной трубки опускают в пробирку с
фуксинсернистой кислотой: раствор фуксинсернистой кислоты окрашивается в
кpaснo-фиолетовый цвет и ощущается характерный запах альдегида.
K2Cr2O7 + 4H2SO4 2KCr(SO4)2 + 4H2O + 3O-CH2OH + O CH3-C(O)H +
H2O
Реакционную пробирку с уксусным альдегидом оставляют для последующих
опытов.
Опыт 71. ПРЕВРАЩЕНИЕ УКСУСНОГО АЛЬДЕГИДА В ЙОДОФОРМ
Р е а к т и в ы: уксусный альдегид, раствор йода в йодистом калии, 10%
раствор гидроксида натрия
Пары уксусного альдегида пропускают в раствор йода в йодистом калии,
обесцвеченный едким натром. Ощущается характерный запах йодоформа и получается
лимонно-желтый осадок.
Реакция образования йодоформа из уксусного альдегида - характерное его
свойство.
3I2 + 3NaOH 3NaI + 3IOHCHO + 3IOH CI3CHO + 3H2OCHO + NaOH
CHI3 + HCOONaCHO + 3I2 + 4NaOH CHI3 + 3NaI + H2O + HCOONa
Опыт 72. РЕАКЦИЯ АЛЬДЕГИДОВ С ФУКСИНСЕРНИСТОЙ КИСЛОТОЙ
Р е а к т и в ы: формалин, уксусный альдегид, фуксинсернистая кислота
В две пробирки помещают по 1 мл формалина (40% раствор формальдегида в
воде) и уксусного альдегида, добавляют по 2-3 капли раствора фуксинсернистой
кислоты. Постепенно возникает розово-фиолетовая или фиолетовая окраска. Эта
реакция является качественной реакцией на альдегиды.
Опыт 73. ОКИСЛЕНИЕ ФОРМАЛЬДЕГИДА (реакция серебряного зеркала)
Р е а к т и в ы: 1% раствор формальдегида, 1% раствор нитрата серебра,
10% раствор аммиака
В тщательно вымытую пробирку наливают 1-2 мл аммиачного paствоpa
гдироксида серебра, добавляют 1 мл 1% раствора формальдегида и подогревают на
водяной бане. Через несколько минут стенки пробирки покрываются блестящим слоем
металлического серебра (зеркало).
Альдегиды легко окисляются даже слабыми окислителями, такими как,
например, оксид серебра. Эту реакцию, а также реакцию восстановления гидроксида
меди используют для идентификации альдегидов.
П р и м е ч а н и е. Аммиачный раствор гдироксида серебра готовится
следующим образом: к 1-2 мл 1% раствора водного нитрата серебра добавляют по
каплям 10% аммиак в таком количестве, чтобы образовавшийся осадок снова
растворился. Не следует прибавлять избытка аммиака.
AgNO3
+ NH4OH AgOH + NH4NO3
AgOH Ag2O + H2O
Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH+ 2[Ag(NH3)2]OH HCOOH + 2Ag +
4NH3 + H2O
Опыт 74. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ФОРМАЛЬДЕГИД
Р е а к т и в ы: формалин, 0,5% раствор резорцина, концентрированная
серная кислота
В широкой пробирке смешивают 1 мл свежеприготовленного 0,5%-ного водного
раствора резорцина с 1 мл формалина. Из пипетки, доходящей до дна пробирки,
прикапывают 0,5-1 мл серной кислоты. На границе соприкосновения жидкостей сразу
же образуется малиновое кольцо.
Опыт 75.
ДЕЙСТВИЕ ГИДРАТА ОКИСИ МЕДИ НА АЛЬДЕГИДЫ
Р е а к т и в ы: формалин, уксусный альдегид, 5% раствор сульфата меди,
10% раствор гидроксида натрия
В две пробирки наливают по 1 мл формалина и yкcycного альдегида,
добавляют по 1 мл раствора гидроксида натрия и по капле раствор сульфата меди
до образования голубого осадка.
Осторожно нагревают верхнюю часть содержимого пробирки. Вначале
появляется желтый осадок, затем красный осадок оксида меди (I), а в пробирке с формалином
выделяется свободная медь, образуя медное зеркало.
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4+ 2Cu(OH)2 HCOOH + H2O + 2CuOH
CuOH H2O + Cu2O Cu
CHO + 2Cu(OH)2 CH3COOH + H2O + 2CuOH
Cu2O H2O
Опыт 76. ОКИСЛЕНИЕ БЕНЗАЛЬДЕГИДА ОКСИДОМ СЕРЕБРА
(реакция серебряного зеркала)
Р е а к т и в ы: бензойный альдегид, 1% раствор
нитрата серебра, 10% раствор аммиака
В тщательно вымытую пробирку вносят 1 мл 1% раствора
нитрата серебра. Осторожно, по каплям приливают раствор аммиака до растворения
образующегося осадка гидроксида серебра и 1-2 капли бензальдегида. Пробирку
нагревают на водяной бане. На стенках пробирки выпадает свободное серебро в
виде зеркального налета.
AgNO3 + NH4OH AgOH + NH4NO3
AgOH Ag2O + H2OO + 4NH3 + H2O 2[Ag(NH3)2]OH
С6H5CHO + 2[Ag(NH3)2]OH С6Н5COOH + 2Ag + 4NH3 + H2O
Опыт 77. ОКИСЛЕНИЕ БЕНЗАЛЬДЕГИДА ГИДРОКСИДОМ МЕДИ
Р е а к т и в ы: бензальдегид, 5% раствор сульфата
меди, 10% раствор гидроксида натрия
В пробирку вносят 2-3 мл раствора гидроксида натрия и
1-2 мл раствора сульфата меди. К выделившемуся голубому осадку гидроксида меди
добавляют несколько капель бензальдегида и нагревают, периодически взбалтывая
содержимое пробирки. Выделяется желтый осадок гидроксида меди (I), переходящий в красный осадок
оксида меди (I).
t
С6Н5CHO + 2Cu(OH)2 С6Н5COOH + H2O + 2CuOH
Cu2O H2O
Опыт 78. ПОЛУЧЕНИЕ БИСУЛЬФИТНОГО СОЕДИНЕНИЯ
БЕНЗАЛЬДЕГИДА
Р е а к т и в ы: бензальдегид, насыщенный раствор
бисульфита натрия
В пробирке смешивают 1 мл бензальдегида с 3 мл
насыщенного водного раствора бисульфита натрия и сильно встряхивают. Выпадают
кристаллы бисульфитного соединения, запах бензальдегида исчезает.
С6Н5CHO + NaHSO3 С6Н5CH-SO3Na
К реакционной массе добавляют около 10 мл воды и
пробирку нагревают на горячей водяной бане. Очень скоро кристаллы исчезают,
ощущается характерный запах бензальдегида, в растворе появляются жирные капли.
0
С6Н5CH-SO3Na С6Н5CHO + NaHSO3
OH
Бисульфитное соединение бензойного альдегида при
нагревании в водном растворе легко разлагается.
Опыт 79. ОКИСЛЕНИЕ БЕНЗАЛЬДЕГИДА КИСЛОРОДОМ ВОЗДУХА
Р е а к т и в ы: бензальдегид
Несколько капель бензойного альдегида помещают на
предметное стекло и оставляют на воздухе. Спустя некоторое время в капле
появляются кристаллы бензойной кислоты, плохо растворимые в холодной воде и
хорошо - в горячей.
[О]
С6Н5CHO С6Н5CООН
Ароматические альдегиды при хранении чрезвычайно
легко, легче, чем альдегиды жирного ряда, окисляются до кислот. Окисление
ускоряется светом.
О п ы т 80. ОКИСЛЕНИЕ БЕНЗАЛЬДЕГИДА ПЕРМАНГАНАТОМ
КАЛИЯ
Р е а к т и в ы: бензальдегид, 0,1% раствор
перманганата калия, 10% раствор серной кислоты, этиловый спирт
В пробирке смешивают 1 мл 0,1% раствора перманганата
калия и 2-3 капли бензальдегида. Нагревают пробирку на водяной бане до
исчезновения запаха бензальдегида. Избыток перманганата калия уничтожают
добавлением нескольких капель спирта. Выпавший осадок оксида марганца
отфильтровывают через небольшой фильтр. При подкислении полученного щелочного
раствора серной кислотой выпадают кристаллы бензойной кислоты.
КМпО4+НОН
С6Н5CHO С6Н5CООК
С6Н5CООК + Н2SО4 С6Н5COOH + KHSO4
Опыт 81. ОБРАЗОВАНИЕ ФЕНИЛГИДРАЗОНА БЕНЗАЛЬДЕГИДА
Р е а к т и в ы: бензальдегид, солянокислый раствор
фенилгидразина, ацетат натрия
Несколько кристаллов солянокислого фенилгидразина
растворяют в 5 мл воды, добавляют ацетат натрия (в 3-4 раза больше, чем
фенилгидразин) и 2-3 капли бензальдегида. Смесь встряхивают, выделяются
кристаллы фенилгидразона бензальдегида, плохо pacтвоpимoro в воде.
С6H5CHO + NH2NHC6H5 С6Н5CH=N-NHC6H5 + H2O
Опыт 82. ДЕЙСТВИЕ ЩЕЛОЧИ НА БЕНЗАЛЬДЕГИД
Р е а к т и в ы: бензальдегид, 10% спиртовый раствор
гидроксида калия, этиловый спирт, соляная кислота
К 0,5 мл бензальдегида медленно при встряхивании
добавляют 2 мл спиртового раствора гидроксида калия. Смесь разогревается,
выделяется большое количество бензойнокислого калия. Выпавшие кристаллы
отфильтровывают, промывают небольшим количеством спирта и растворяют в воде.
При подкислении водного раствора соляной кислотой выпадают кристаллы бензойной
кислоты.
В присутствии щелочи 2 молекулы бензойного альдегида
вступают друг с другом в окислительно-восстановительное взаимодействие: одна
молекула альдегида восстанавливается до спирта, другая окисляется до кислоты.
КОН
2С6Н5CHO С6Н5CООК + С6Н5СН2ОН
Опыт 83. ВЗАИМОДЕЙСТВИЕ БЕНЗОЙНОГО АЛЬДЕГИДА С
АНИЛИНОМ (образование основания Шиффа)
Р е а к т и в ы: бензальдегид, анилин, этиловый спирт
Смешивают при взбалтывании равные количества
бензальдегида и анилина, происходит разогревание реакционной массы, смесь
мутнеет, добавляют 2-3 мл спирта и охлаждают. Выделяется осадок бензанилина
(азо-метин, основание Шиффа).
С6Н5С(О)Н + H2NC6H5 C6H5CH = NC6H5 + Н2О.
III.11
АЛИФАТИЧЕСКИЕ И АРОМАТИЧЕСКИЕ АМИНЫ
Аминами называют производные аммиака, в молекуле которого один, два или
три атома водорода замещены углеводородными радикалами.
Классификация аминов:
По заместительной номенклатуре ИЮПАК названия первичных аминов образуют
путем добавления к названию углеводорода суффикса -амин, с последующим
указанием положения аминогруппы в углеродной цепи. При составлении названий
вторичных и третичных аминов их рассматривают как производные первичного амина
с заместителями при азоте. За исходный первичный амин в этом случае принимается
связанный с атомом азота наиболее сложный по структуре радикал. Остальные
углеводородные заместители при азоте перечисляют в алфавитном порядке с
указанием локанта N-. Простейшие
амины чаще всего называют по радикало-функциональной номенклатуре. Согласно
этой номенклатуре названия аминов образуют из названий углеводородных
радикалов, перечисляемых в алфавитном порядке, и суффикса -амин, например:
-CH-CH3 CH3 - N - CH-CH2-CH3
½ CH3-NH-CH2-CH2-CH3 ½ ½2 СH3 СН3
пропанамин-2 N-метилпропанамин-1
N,N-диметилбутанамин-2
изопропиламин метилпропиламин диметилвтор-бутиламин
C6H5-NН2 C6H5-NН-СН3 C6H5-N(СH3)2
анилин N-метиланилин N,N-диметиланилин
метилфениламин диметилфениламин
Изомерия аминов обусловлена разной структурой углеводородных радикалов,
разным положением аминогруппы и метамерией. Сущность метамерии состоит в том,
что амины с одной и той же брутто-формулой могут первичными, вторичными и
третичными.
При нагревании спиртового раствора аммиака с галогеналканами образуется
смесь первичного, вторичного и третичного аминов и соль четвертичного
аммониевого основания (реакция Гофмана). Амины образуются также при
восстановлении нитросоединений и нитрилов, а также при расщеплении незамещенных
амидов карбоновых кислот гипобромитом натрия (перегруппировка Гофмана).
Реакционная способность алкиламинов определяется главным образом наличием
у атома азота неподеленной пары электронов. За счет пары электронов атома азота
амины, с одной стороны, способны присоединять протон от кислоты, проявляя при
этом основные свойства, а с другой - могут атаковать в молекуле реагента
электрофильный центр и образовывать химическую связь с ним, проявляя нуклеофильные
свойства.
Являясь производными аммиака, амины, подобно аммиаку, проявляют ярко
выраженные основные свойства, которые обусловлены наличием на атоме азота
неподеленной пары электронов. При этом алкиламины являются более сильными
основаниями, чем аммиак, а ариламины более слабыми. Алкильные заместители,
обладая +I-эффектом, способствуют делокализации
положительного заряда у атома азота, тем самым повышая его основные свойства.
Таким оброазом, в ряду первичных, вторичных, третичных алкиламинов основность
увеличивается.
Значительное снижение основности ариламинов по сравнению с алкиламинами
обусловлено сопряжением неподеленной пары электронов атома азота с π-электронной системой ароматического
ядра, в результате неподеленная пара электронов частично делокализуется по
ароматическому ядру и становится менее доступной для координации с протоном. На
основность ариламинов существенное влияние оказывают заместители в бензольном
кольце: электронодонорные заместители увеличивают основность, а электроноакцепторные
- уменьшают ее.
Для аминов характерны реакции алкилирования, ацилирование и N-галогенирования, изонитрильная
реакция. Первичные, вторичные амины и третичные ариламины реагируют с азотистой
кислотой, образуя первичные алкиламины - спирты, первичные ариламины -
диазосоединения, вторичные алкил- и ариламины - нитрозосоединения, третичные
ариламины - подвергаются нитрозированию в пара-положение, третичные алкиламины
с азотистой кислотой не реагируют.
Для ариламинов характерны реакции электрофильного замещения
(галогенирование, нитрование, сульфирование) по ароматическому ядру,
свойственные ароматическим углеводородам. Аминогруппа в молекуле ариламина в
результате проявления +М-эффекта выступает в качестве сильного электронодонора
по отношению к бензольному кольцу и тем самым активизирует его реакционную
способность в реакциях электрофильного замещения. Поэтому ариламины вступают в
реакции электрофильного замещения значительно легче, чем бензол. Являясь
ориентантом I рода, аминогруппа направляет
электрофильное замещение в орто- и пара-положение.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы, назовите и классифицируйте (как
первичные, вторичные или третичные) следующие соединения: а) восемь изомерных
аминов общей формулы C4H11N, б) пять изомерных аминов общей формулы C7H8N, содержащих
бензольное ядро.
2. Напишите структурные формулы следующих аминов: N,N-диэтилбутан-амин-2, N,N-диэтиланилин,
4-этиланилин, a-нафтиламин, N-этилпропан-амин-2,
втор-бутилметиламин. Укажите среди них первичные, вторичные и третичные амины.
. Напишите схемы получения а) изопропиламина из изомасляной
кислоты, б) пропиламина из пропена.
. Какие амины получаются при восстановлении металлическим натрием
в спиртовой среде следующих соединений: нитробензол, м-хлорнитробензол,
о-нитротолуол. При восстановлении какого из них получается амин с наименьшей
основностью?
. Напишите уравнения следующих реакций:
а) хлорангидрид масляной кислоты + метиламин,
б) уксусный ангидрид + N-метиланилин,
в) триметиламин + уксусная кислота,
г) N,N-диметилацетамид + кипящая разбавленная соляная кислота,
е) м-нитро-N-метиланилин
+нитрит натрия +серная кислота,
к) анилин с бромной водой,
. Составьте уравнения по следующим схемам превращений:
СН3Сl
4
HBr
AgCN 4H
HNO2
а)
изобутилен 1 2
3 5
CH3COCl
6
[H]
CH3COCl Br2 HOH
HONO, HCl C2H5OH
б)
нитробензол 1 2 3 4 5 6
11. Получите бензиламин из следующих соединений: бензиловый спирт,
фенилнитрометан, бензонитрил, бензальдегид.
12. Нуклеофильные и основные свойства аминов. Сравнение основных
свойств алифатических и ароматических аминов.
. Активирующее влияние аминогруппы на реакционную способность
ароматического кольца в реакциях электрофильного замещения (на примере
галогенирования, сульфирования, нитрования).
. Как взаимодействуют с азотистой кислотой (на холоду) следующие
вещества: о-толуидин, дифениламин, диэтиламин, изобутиламин, N-метил-N-этиланилин, N-этиланилин,
бензиламин, диметилизопропиламин.
. Напишите схемы превращений о-толуидина в следующие вещества:
а) б) в)

16. Напишите соотвествующие уравнения реакций, с помощью которых можно
отличить следующие соединения: а) диметиламин и триэтиламин, б) бензиламин и
анилин, в) метиламин и N-метилпропанамин-1,
г) трипропиламин и N,N-диметиланилин.
17. Как влияет ацилирование ароматической аминогруппы на ее
основность, направление и скорость реакции электрофильного замещения (SE) в бензольном ядре? Сравните
реакционную способность анилина и ацетанилида в реакциях галогенирования и
нитрования. Напишите соответствующие уравнения реакций.
. Напишите схемы реакций соответствующих аминов с минеральными
кислотами, приводящих к образованию: а) метиламмония хлорида, б) диметиламмония
гидросульфата, в) триэтиламмониябромида, г) анилиния хлорида, д) метилфенилфениламмония
йодида.
. Напишите схемы реакций этиламина со следующими реагентами: а) HBr, б) CH3Cl, в) CH3COCl, г) CHCl3,
NaOH. Укажите, в каких реакциях амин
проявляет основные, а в каких нуклеофильные свойства.
ПРАКТИКУМ
Опыт 84. ПОЛУЧЕНИЕ МЕТИЛАМИНА ИЗ АЦЕТАМИДА
Р е а к т и в ы: ацетамид, бром, концентрированный
раствор гидроксида натрия
В большую пробирку с длинной газоотводной трубкой
помещают около 0,2 г ацетамида, 1 мл воды и несколько капель брома. Смесь
встряхивают, охлаждают водой, приливают по каплям концентрированный раствор
щелочи до исчезновения окраски брома и еще примерно такой же объем щелочи.
Пробирку нагревают и отгоняют образующийся метиламин в
приемник с небольшим количеством воды, охлаждаемой льдом. Перегонку продолжают
до увеличения объема жидкости в приемнике в 3-4 раза.
Отгон имеет характерный запах метиламина - сырой рыбы
и аммиака.
Br2 + NaOH NaBrO + NaBr + H2O;CONH2 +
NaBrO CH3NH2 + CO2 + NaBr;2 + NaOH Na2CO3 + H2О
Раствор метиламина используют для последующих опытов.
Опыт 85. ОБРАЗОВАНИЕ СОЛИ МЕТИЛАМИНА
Р е а к т и в ы: метиламин, концентрированная соляная
кислота
К отверстию газоотводной трубки прибора, в котором
получают метиламин (предыдущий опыт), подносят стеклянную палочку, смоченную
концентрированной соляной кислотой. Появляется белый дым и на стеклянной
палочке образуется белый осадок солянокислой соли метиламина.
СН3NН2 +
НС1 СН3NН2 . НС1 или [CH3NH3]+Cl-
солянокислая соль хлористый
метиламина метиламмоний
Амины, являясь производными аммиака, проявляют сильные
основные свойства. Это органические основания. Основность аминов обусловлена
наличием у азота неподеленной пары электронов, не участвующей в образовании
ковалентной связи, и их способностью присоединять протон водорода. За счет
неподеленной пары электронов амины могут вступать в реакции с протонными
кислотами и электрофильными реагентами.
Амины в водном растворе находятся в (виде гидроокисей
замещенного аммония, которые диссоциируют, образуя гидроксильный ион и ион
замещенного аммония.
За счет гидроксильного иона водные растворы аминов
имеют основный характер.
Опыт 86. ОПРЕДЕЛЕНИЕ ОСНОВНОСТИ РАСТВОРА МЕТИЛАМИНА
Р е а к т и в ы: водный раствор метиламина, 1%
спиртовый раствор фенолфталеина, лакмусовая бумага
В пробирку помещают несколько капель водного раствора
метиламина, добавляют 1-2 капли раствора фенолфталеина. Появляется розовое
окрашивание.
Капля водного раствора метиламина, нанесенная на
красную лакмусовую бумагу, вызывает синее окрашивание.
Появление синего окрашивания с лакмусовой бумагой и
красного с раствором фенолфталеина обусловлено щелочным характером водного
раствора метиламина.
СН3NН2 +
НОН [СН3NН3]+ОН-
гидроокись метиламмония
Амины в водном растворе находятся в виде гидроокисей
замещенного аммония, которые диссоциируют, образуя гидроксильный ион и ион
замещенного аммония. За счет гидроксильного иона водные растворы аминов имеют
основный характер.
Опыт 87. ВЗАИМОДЕЙСТВИЕ АМИНОВ С АЗОТИСТОЙ КИСЛОТОЙ
Р е а к т и в ы: этиламин, анилин, диэтиламин, N,N-диметиланилин,
концентрированная соляная кислота, 5% и 30% растворы нитрита натрия
А. В пробирку с 6 каплями этиламина и 3 каплями концентрированной соляной
кислоты добавляют 5 капель 5%-ного раствора нитрита натрия. Наблюдают выделение
газа:
NaNO2
+ HCl HNO2 + NaCl
C2H5NH2 + HNO2 C2H5OH + N2↑ + H2 O
Газ при поджигании не загорает, а образование спирта можно доказать по
реакции с йодоформом.
Б. В пробирку помещают 4 капли анилина, 2-3 мл воды и 2 капли
концентрированной соляной кислоты. Пробирку помещают в стакан со льдом,
охлаждают до 0-50С и при перемешивании добавляют 5 капель 30%-ного раствора
нитрита натрия.

Первичные
ароматические амины с азотистой кислотой образуют соли диазония.
В.
В пробирку с 6 каплями диэтиламина и 3 каплями концентрированной соляной
кислоты добавляют 5 капель 5%-ного раствора нитрита натрия. Пробирку хорошенько
встряхивают. При этом образуется масляная жидкость желтого цвета - N-нитрозодиэтиламин.
H5C2
H5C2
NH + HONO N-N=O + H2O5C2 H5C2
Вторичные алифатические и ароматические амины при взаимодействии с
азотистой кислотой образуют N-нитрозосоединения.
Г. В пробирку помещают 1 каплю N,N-диметиланилина, 2 капли
концентрированной соляной кислоты, затем ее охлаждают в стакане со льдом.
Добавляют 2 капли 30%-ного раствора нитрита натрия, закрывают пробирку пробкой
и хорошенько встряхивают.
В пробирку добавляют до образования зеленого цвета 5%-ный раствор
гидрокарбоната натрия, 2 мл диэтилового эфира, все хорошенько встряхивают.
Наблюдают образование слоя изумрудно-зеленого цвета, образуется п-нитрозо-N,N-диметиланилин.
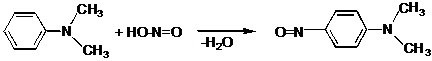
Третичные алифатические амины с азотистой кислотой не реагируют. По
реакции с азотистой кислотой можно отличить первичные, вторичные и третичные
амины.
Опыт 88. ИЗОНИТРИЛЬНАЯ РЕАКЦИЯ
Р е а к т и в ы: раствор метиламина, этиловый спирт,
хлороформ, концентрированный раствор гидроксида натрия, серная кислота
В пробирку вносят 1 мл раствора метиламина, добавляют
равный объем спирта, 2-3 капли хлороформа и 1 мл концентрированного раствора
щелочи. Смесь тщательно перемешивают, нагревают. При нагревании вскоре
обнаруживается характерный неприятный запах изонитрила.
После завершения опыта изонитрил разлагают раствором
серной кислоты.
°
СH3NH2 + CHCl3 + NaOH CH3N≡C + NaCl +
H2O;
H2SO4 ОN≡C + HOH CH3NH2 + HC
OH
Изонитрильная реакция является специфической реакцией
на первичную аминогруппу.
Примечание. Изонитрил обладает устойчивым неприятным
запахом и чрезвычайно ядовит. Поэтому получение его необходимо проводить в
вытяжном шкафу.
Опыт 89. ПОЛУЧЕНИЕ АНИЛИНА ВОССТАНОВЛЕНИЕМ
НИТРОБЕНЗОЛА (реакция Зинина)
Р е а к т и в ы: нитробензол, цинк, концентрированная
соляная кислота, раствор хлорной извести
В пробирку помещают несколько капель нитробензола,
добавляют 1 мл концентрированной соляной кислоты и 0,5 г металлического цинка.
Реакционную смесь осторожно встряхивают. Начало реакции отмечают по выделению
пузырьков газа - водорода. По окончании реакции смесь разбавляют водой и
добавляют раствор хлорной извести или хлорамина. Появляется фиолетовое окрашивание.
Zn + HCl [H] + ZnCl2
C6Н5NО2 +
[H] C6H5NH2 + H2O
Опыт 90. РАСТВОРИМОСТЬ АНИЛИНА В ВОДЕ И СПИРТЕ
Р е а к т и в ы: анилин, спирт
а) В пробирку вносят 0,5 мл анилина, 2-3 мл воды
и встряхивают. После отстаивания анилин оседает на дно в виде капель.
Анилин плохо растворяется в воде (1 часть анилина в 32
частях воды). Смесь можно использовать в последующих реакциях.
б) В пробирке смешивают 0,5 мл анилина с 2-3 мл
спирта. Образуется однородная смесь. Анилин хорошо растворяется в спирте.
Опыт 91. ОБРАЗОВАНИЕ СОЛЯНОКИСЛОЙ СОЛИ АНИЛИНА
Р е а к т и в ы: анилин, концентрированная соляная
кислота
В пробирку помещают несколько капель анилина и 5 мл
воды, пробирку встряхивают. Анилин не растворяется. После добавления нескольких
капель соляной кислоты раствор вследствие образования солянокислой соли анилина
становится прозрачным.
C6H5NH2 + HCl [C6H5NH3]+Cl-
или C6H5NH2 . HCl
Солянокислая соль анилина хорошо растворяется в воде.
Опыт 92. ПОЛУЧЕНИЕ СЕРНОКИСЛОЙ СОЛИ АНИЛИНА
Р е а к т и в ы: анилин, 10% раствор серной кислоты
В пробирку помещают несколько капель анилина и 0,5 мл
воды. Приливают 0,5-1 мл разбавленной серной кислоты. Выпадает осадок.
Сернокислая соль анилина трудно растворима в воде.
+ -
С6H5NН2 + НОSО3Н С6Н5NН3SО3ОН
Опыт 93. АЦЕТИЛИРОВАНИЕ АНИЛИНА (образование
ацетанилида)
Р е а к т и в ы: анилин, уксусный ангидрид или
уксусная кислота
В пробирке осторожно смешивают 0,5 мл анилина с 1 мл
уксусного ангидрида. Смесь нагревают до кипения (осторожно) и выливают в
пробирку с 5 мл воды. Выпадает кристаллический осадок ацетанилида.
Опыт 94. ИЗОНИТРИЛЬНАЯ РЕАКЦИЯ С АНИЛИНОМ
Р е а к т и в ы: анилин, хлороформ, спиртовый раствор
гидроксида натрия, разбавленная серная кислота
Опыт проводят в вытяжном шкафу!
К 2-3 каплям анилина в пробирке прибавляют 2-3 капли
хлороформа, 0,5 мл насыщенного спиртового раствора гидроксида натрия и
нагревают. При этом выделяются отвратительно пахнущие пары изонитрила
(фенилкарбиламин). Если к полученному изонитрилу прибавить разбавленную серную
кислоту до кислой реакции и нагреть, запах исчезнет вследствие гидролиза
изонитрила и перехода его в амин:
С6H5NН2 + СНCl3 + NaOH
С6Н5N≡C + NaCl +
Н2О
С6Н5N≡C + Н2О С6H5NН2 + HCOOH
Опыт 95. КОНДЕНСАЦИЯ АНИЛИНА С ФОРМАЛЬДЕГИДОМ
Р е а к т и в ы: анилиновая вода, 10% раствор
формалина
К 5 мл анилиновой воды добавляют по каплям 2 мл 10%
раствора формальдегида. Постепенно образуется белый осадок.
С6H5NН2 + НС(О)Н С6Н5N=CН2 + Н2О
nС6Н5N=CН2 [-N-CH2-]n
С6H5
Эта реакция может быть использована как качественная
реакция на анилин и формальдегид.
III.12
ДИАЗО-, АЗОСОЕДИНЕНИЯ
Диазосоединениями называют органические вещества, содержащие в своей
структуре группировку из двух атомов азота, связанную с углеводородным
радикалом и остатком минеральной кислоты.
Общая формула диазосоединений ArN2X, где Х - остаток минеральной
кислоты. В зависимости от природы кислотного остатка связь между ArN2 и X может быть ионной или ковалентной. Если Х - остаток сильной
минеральной кислоты (Cl-, Br-, NO3-, HSO4-),
то диазосоединения имеют ионное строение и их называют солями диазония - [Ar-N+ºN]X-. Если же Х - остаток слабой
минеральной кислоты (CN-, HSO3-, OH-, SH-)
диазосоединения имеют ковалентное строение и их называют действительно
диазосоединениями - Ar-N=N-X. Диазосоединения
общей формулы Ar-N=N-О-Ме+, где Ме -
металл, получили название диазотатами. В растворе указанные формы в зависимости
от рН среды могут превращаться друг в друга. В кислой среде диазосоединения
существуют в форме солей диазосоединения, в среде, близкой к нейтральной, имеют
ковалентное строение, а в щелочной среде находятся в форме диазотатов.
Согласно номенклатурным правилам ИЮПАК названия ароматических
диазосоединений образуют путем добавления к названию исходного углеводорода
суффикса -диазо-, а названия солей диазония - добавлением окончания -диазоний с
последующим указанием аниона:
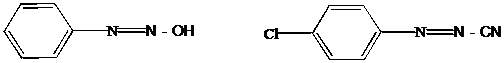
бензолдиазогидроксид
4-метилбензолдиазоцианид
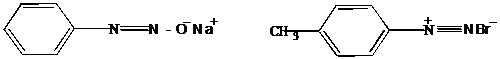
бензолдиазотат
натрия 4-хлорбензолдиазоний хлорид
Диазосоединения образуются при реакции диазотирования первичных
ароматических аминов с азотистой кислотой в среде сильной минеральной кислоты,
чаще хлороводородной или серной. Реакция диазотирования экзотермичная, и
поскольку соли диазония при нагревании легко разлагаются, диазотирование
проводят при температуре 0-50С. Диазосоединения можно получить и при
взаимодействии первичных ароматических аминов с эфирами азотистой кислоты в
присутствии минеральной кислоты в среде этанола.
Реакционная способность солей диазония обусловлена наличием в их
структуре диазокатиона. Реакции с участием солей диазония можно условно
разделить на две группы: с выделением (HOH, KBr (Cu2Br2), KJ, C2H5ОН) и без выделения азота: образование диазопроизводных,
восстановление солей диазония, реакция азосочетания. Реакции солей диазония с
выделением азота сопровождаются разрывом связи С-N в диазокатионе и замещением диазогруппы на другие атомы или
группы атомов. В зависимости от способа разрыва связи С-N замещение диазогруппы может
происходить по механизму SN1
или SR.
Азосоединениями называют органические вещества, содержащие в своем
составе группировку -N=N- (азогруппу), связанную с двумя
углеводородными радикалами.
Названия азосоединений с одинаковыми углеводородными радикалами
составляют из префикса азо- и названия углеводорода. Положение заместителей
обозначают цифрами или орто-, мета-, пара-.
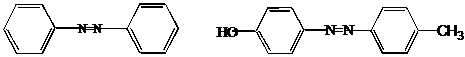
азобензол
2-гидрокси-4′-метилазобензол
о-гидрокси-п′-метилазобензол
Азосоединения
образуются по реакции азосочетания из диазосоединений и при восстановлении
нитроаренов в щелочной среде.
Реакционная
способность азосоединений обусловлена наличием в их структуре азогруппы. За
счет неподеленных пар электронов на атомах азота азогруппы азосоединения
проявляют слабые основные свойства. В присутствии минеральных кислот азогруппа
протонируется. С участием азогруппы азосоединения вступают в реакции окисления
и восстановления.
Азосоединения
представляют собой кристаллические вещества, окрашенные в желтый, оранжевый,
красный, синий и другие цвета, Это свойство позволяет использовать многие из
них в качестве азокрасителей.
Окраска
азосоединений зависит от наличия хромофор и ауксохром. Группы атомов,
определяющие цвет называют хромофорами (-N=N-, -N=O, -NO2, >C=O, >C=C<), а
ауксохромы (-NH2, -NH(CH3)2, -OH, -SO3Н, -COOH) усиливают окраску. Окраска некоторых азокрасителей
зависит от рН среды, что позволяет использовать их в качестве индикаторов.
органический химия синтез соединение
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: фенилдиазоний
нитрат, п-нитрофенилдиазоний сульфат, азобензол, п-аминоазобензол,
2,4-ди-гидрокси-4′-N,N-диметиламиноазобензола.
2. Как влияет рН раствора на строение диазосоединений? На примере
п-толил-диазония бромида, покажите, как изменяется строение диазосоединений при
переходе от кислой к щелочной среде. Назовите формы диазосоединений в кислой,
нейтральной и щелочной среде.
. Какие типы химических превращений характерны для солей диазония?
Напишите соответствующие уравнения реакций.
. Напишите схемы реакций диазотирования следующих соединений: а)
о-нитро-анилин, б) 2,4-динитроанилин, в) п-толуидин.
. Укажите реагенты и условия, необходимые для превращения
п-толил-диазоний хлорида в следующие вещества: толуол, п-крезол, п-хлортолуол,
п-йодтолуол, п-толунитрил, 4-метил-4′-(N,N-диметиламино)азобензол,
2,4-ди-гидрокси-4′-метилазобензол.
. Предложите схему получения а) п-бромфенола из ацетанилида, б)
п-толуи-ловой (4-метилбензойной) кислоты из п-нитротолуола. Напишите все
соответствущие реакции превращений.
. Напишите схемы взаимодействия п-толилдиазоний хлорида со
следующими реагентами: а) NaOH,
б) NaCN, в) C2H5OH, г) KBr. Назовите полученные соединения.
. Предложите схемы синтеза из п-нитроанилина следующих соединений:
а) п-нитрохлорбензола, б) п-нитрофенола, в) п-нитробензойной кислоты.
. На примере м-метоксибензолдиазоний хлорида покажите, как можно
осуществить замену диазогруппы на следующие группы: а) Н, б) ОН, в) ОСН3, г) Cl, д) Br, е) CN, к)
NO2. Напишите уравнения реакций и
назовите продукты.
. Какую реакцию называют азосочетанием? Напишите схемы
азосочетания п-толилдиазоний хлорида с фенолом и N-метиланилином. Назовите продукты. Объясните, почему
азосочетание с фенолами следует проводить в слабощелочной, а с аминами - в
слабокислой среде.
. Составьте уравнения реакций по схеме превращений:
HNO3 [H] HONO, HCl C6H5N(CH3)2 SnCl2, HCl
а) фенол 1 2 3 4 5SO4 KCN (CuCN)
SO4 NaOH NaOH HCI п-толилдиазоний хлорид
б) нафталин 1 2 3 4 5
О Н2О сплав
12. Предложите схему синтеза 1,3,5-трибромбензола из анилина.
13. Исходя из бензола, синтезируйте следующие азокрасители:
а)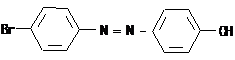 б)
б) 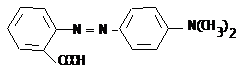
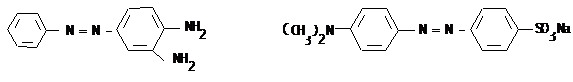
в) г)
14. Перечислите факторы, существенно влияющие на окраску соединений.
Всегда ли окрашенное вещество является красителем? Ответ поясните.
15. Напишите структурные формулы азосоединений, если продуктами их
восстановления являются: а) п-толуидин и п-аминофенол, б) п-нитроанилин и
1-аминонафтол-2.
. Напишите схемы получения азокрасителей, исходя из следующих
соединений: а) п-толуидин и фенол, б) салициловая (о-гидроксибензойная) кислота
и анилин, в) N,N-диметиланилин и сульфаниловая кислота. Назовите полученные
соединения. Обозначьте хромофорные и ауксохромные группы.
. Напишите схему синтеза метилового оранжевого. К какой группе он
относится? Объясните, возможно ли его использование в качестве рН-индикатора.
. Укажите, какие из приведенных соединений будут вступать в
реакцию азосочетания: а) толуол, б) N-метиланилин, в) о-метиланилин, г) бензойная кислота, д) фенол, е)
п-гидроксибензальдегид.
ПРАКТИКУМ
Опыт 96. ВЗАИМОДЕЙСТВИЕ АНИЛИНА С АЗОТИСТОЙ КИСЛОТОЙ
(реакция диазотирования)
Р е а к т и в ы: анилин, 10% раствор нитрита натрия,
разбавленная соляная кислота (1:2), лед
В пробирку вносят 1 мл анилина, прибавляют
разбавленную (1:2) соляную кислоту до полного растворения анилина и несколько
кусочков льда. Раствор охлаждают до 0° и по каплям добавляют 1 мл 10% раствора
нитрита натрия. Температура смеси не должна подниматься выше 50С (регулируют
путем добавления в реакционную смесь кусочков льда):
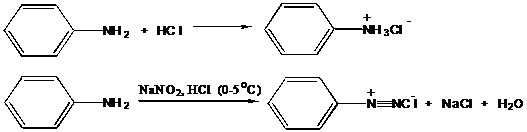
Жидкость
остается прозрачной. Смесь тщательно перемешивают. 1 каплю реакционной массы
стеклянной палочкой помещают на йодкрахмальную бумагу (фильтровальная бумага,
обработанная йодидом калия и крахмалом). При нанесении пробы, содержащей
азотистую кислоту, выделяется свободный йод, который с крахмалом образует
комплекс сине-фиолетового цвета.
Появление
окрашивания на йодкрахмальной бумаге свидетельствует о завершении реакции
диазотирования:
2NaNO2 + 2HCl HNO2 + NaCl
КI + HNO2 2NO + I2 + KOH
Если
окраска йодкрахмальной бумаги не изменяется, то в реакционную смесь
дополнительно приливают несколько капель раствора нитрита натрия. Смесь
перемешивают и вновь берут пробу. Диазотирование прекращают, когда в смеси
появляется избыток азотистой кислоты, не исчезающий при встряхивании в течение
нескольких минут.
Пробирку
с полученным раствором помещают в смесь льда и соли и сохраняют для последующих
опытов.
Опыт
97. РАЗЛОЖЕНИЕ СОЛИ ДИАЗОНИЯ ПРИ НАГРЕВАНИИ
Р
е а к т и в ы: фенилдиазоний хлорид, хлорид железа (III)
В
пробирку помещают 1 мл раствора бензолдиазония хлорида, полученного в
предыдущем опыте, и слегка нагревают в пламени горелки. Наблюдают бурное
выделение пузырьков газа - азота, которое продолжается в дальнейшем и без
нагревания.
По
окончании реакции пробирку закрывают пробкой с газоотводной трубкой, конец
которой опускают в сухую пробирку. Раствор в пробирке нагревают. Образующийся в
процессе разложения соли диазония фенол перегоняется с водяным паром:

Ощущает
характерный запах фенола. При добавлении к раствору фенола 1 капли раствора
хлорида железа (III) наблюдают появление фиолетового окрашивания.
Опыт
98. ПОЛУЧЕНИЕ АНИЛИНОВОГО ЖЕЛТОГО
Р
е а к т и в ы: фенилдиазоний хлорид, 5% раствор ацетата натрия, диметиланилин,
концентрированная соляная кислота
В
пробирку помещают 1 каплю диметиланилина, 5 капель воды и добавляют по каплям
концентрированную соляную кислоту до образования прозрачного раствора. Смесь
охлаждают и добавляют 1 мл раствора фенилдиазоний хлорида, полученного в опыте
96, и энергично встряхивают. При добавлении в пробирку 2-3 капель 5%-ного
раствора ацетата натрия
наблюдают образование желто-оранжевого осадка основного красителя - п-диметил-аминоазобензола:

В
пробирке смешивают несколько капель раствора образовавшегося азокрасителя и 5-6
мл воды. При последующем добавлении в пробирки нескольких капель 10%-ного
раствора хлороводородной кислоты желтая окраска раствора исчезает и появляется
красная. При подщелачивании вновь восстанавливается желтая окраска раствора:
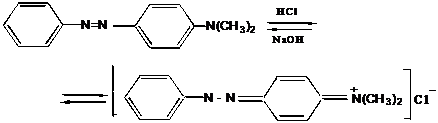
Опыт
99. ПОЛУЧЕНИЕ АНИЛИНОВОГО ОРАНЖЕВОГО
Р
е а к т и в ы: раствор фенилдиазоний хлорида, 10% раствор гидроксида натрия,
фенол, β-нафтол
В
одну пробирку смешивают 1 мл 10% раствора гидроксида натрия и 0,1 г фенола, в
другой - 1 мл 10% раствора гидроксида натрия и 0,1 г β-нафтола. В обе пробирки добавляют 1 мл раствора
фенилдиазоний хлорида, полученного из опыта 96. В первой сразу появляется
оранжевая окраска; во второй - оранжевый осадок.
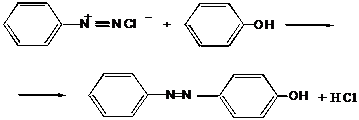

Опыт
100. СИНТЕЗ МЕТИЛОРАНЖА (гелиантин)
Р
е а к т и в ы: сульфаниловая кислота, диметиланилин, нитрит натрия, 10% раствор
гидроксида натрия, 8% раствор соляной кислоты, 10% раствор серной кислоты
Около
2 г сульфаниловой кислоты растворяют в 5 мл 10% раствора гидроксида натрия
(раствор должен иметь щелочную реакцию на лакмус). Раствор охлаждают льдом,
добавляют 0,5 г нитрита натрия и приливают его в 10 мл 10% раствора серной
кислоты с 10 г льда. Полученную диазобензолсульфокислоту сочетают с
диметиланилином следующим образом.
Свежеперегнанный
диметиланилин растворяют в 3 мл 8% соляной кислоты, охлаждают льдом и приливают
раствор диазобензолсульфокислоты. К смеси прибавляют до ясно-щелочной реакции
8-10 мл 10% раствора гидроксида натрия. При стоянии выделяются красивые
оранжево-красные листочки натриевой соли красителя. Их можно отфильтровать и
перекристаллизовать из небольшого количества воды.
+
-

.13 ОДНО- И ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
Карбоновыми кислотами называют производные углеводородов, содержащие в
своем составе карбоксильную группу -СООН.
В зависимости от природы углеводородного радикала, с которым связана
карбоксильная группа, различают алифатические, алициклические и ароматические
карбоновые кислоты. В соответствии с числом карбоксильных групп кислоты
подразделяют на одноосновные (монокарбоновые), двухосновные (дикарбоновые) и
полиосновные (поликарбоновые).
По заместительной номенклатуре ИЮПАК названия карбоновых кислот образуют
из названий исходных углеводородов с тем же числом атомов углерода, включая и
атом углерода карбоксильной группы, к которым прибавляют -овая кислота,
нумерацию главной углеродной цепи начинают с атома углерода карбоксильной
группы. Иногда названия карбоновых кислот образуют от названия углеводорода,
содержащего в качестве заместителя карбоксильную группу, и словосочетания
карбоновая кислота. По рациональной номенклатуре насыщенные монокарбоновые
кислоты рассматривают как производные уксусной кислоты. Очень широко для
названия кислот используют тривиальную номенклатуру.
Например:
СН3-СН-СООН
| СН2=СН-СН2-СООН С6Н5-СООН
СН3
-метилпропановая кислота бутен-3-овая кислота бензойная кислота
α-метилпропионовая кислота
винилуксусная кислота бензолкарбоновая кислота диметилуксусная кислота
аллилуксусная кислота изомасляная кислота
НООС-СН-СООН НООС СООН
| С=С
СН3 Н Н
метилпропандиовая кислота цис-бутендиовая кислота фталевая кислота
метилмалоновая кислота малеиновая кислота 1,2-бензолдикарбоновая к-та
Изомерия кислот обусловлена разной структурой углеводородного радикала,
связанного с карбоксильной группой. Для ненасыщенных кислот характерна изомерия
положения кратной связи, а также геометрическая изомерия, связанная с разным
положением заместителей относительной плоскости двойной связи.
Существует множество способов получения карбоновых кислот, наиболее
важные из них: а) окисление первичных спиртов и альдегидов, б) гидролиз
геминальных тригалогенпроизводных углеводородов, в) гидролиз нитрилов, г)
взаимодействие магнийорганических соединения с оксидом углерода (IV), д) гидрокарбоксилирование алкенов.
Реакционная способность карбоновых кислот определяется наличием в их
структуре карбоксильной группы. Карбоксильная группа представляет собой
сопряженную систему, в которой неподеленная пара электронов атома кислорода
гидроксильной группы вступает в сопряжение с π-электронами карбонильной группы.
Вследствие +М-эффекта со стороны группы -ОН электронная плотность в сопряженной
системе смещена в сторону атома кислорода карбонильной группы (>С=О),
неподеленные пары электронов которого не участвуют в сопряжении. В результате смещения
электронной плотности связь О-Н оказывается сильно поляризованной, что приводит
к появлению в карбоксильной группе ОН-кислотного центра. Но в то же время за
счет +М-эффекта со стороны группы -ОН в молекулах карбоновых кислот в некоторой
степени уменьшается частичный положительный заряд на атоме углерода
карбонильной группы по сравнению с альдегидами и кетонами. Кроме того,
вследствие -I-эффекта карбоксильной группы в
молекуле карбоновой кислоты происходит смещение электронной плотности с
углеводородного остатка, что приводит к появлению С-Н-кислотного центра у α-углеродного атома.
Исходя из вышесказанного, основные реакции карбоновых кислот можно
условно разделить на четыре группы: 1) с участием связи О-Н (кислотные
свойства, 2) нуклеофильное замещение с участием атома углерода карбонильной
группы, 3) замещение атомов водорода при α-углеродном атоме, 4) окисление и
восстановление.
Кислотные свойства карбоновых кислот обусловлены их способностью
отщеплять атом водорода карбоксильной группы в виде протона. На силу карбоновых
кислот оказывает влияние структура углеводородного радикала, связанного с
карбоксильной группой, и заместители в нем. Электронодонорные заместители
увеличивают электронную плотность в кислотном центре и тем самым
дестабилизируют карбоксилат-ион, что в конечном итоге приводит к ослаблению
кислотных свойств. Электроноакцепторные заместители, наоборот, смещая
электронную плотность на себя, повышают устойчивость карбоксилат-иона, что
приводит к усилению кислотности. Таким образом, в ряду насыщенных,
ненасыщенных, ароматических одноосновных карбоновых кислот сила кислот
увеличивается (исключением является муравьиная кислота, являющаяся из-за
отсутствия углеводородного радикала самой сильной кислотой).
Дикарбоновые кислоты обладают более сильными кислотными свойствами, чем
монокарбоновые кислоты с тем же числом атомов углерода. Это обусловлено
взаимным влиянием карбоксильных групп. Вторая карбоксильная группа, обладая
электроноакцепторными свойствами, способствует делокализации заряда аниона и тем
самым повышает его устойчивость.
Ненасыщенные карбоновые кислоты проявляют свойства алкенов по кратной
связи в углеводородном радикале, для них характерны реакции присоединения,
окисления и полимеризации.
Характерны реакции электрофильного замещения в ароматическом кольце для
ароматических карбоновых кислот. Карбоксильная группа, проявляя -I- и -М-эффекты, дезактивирует
бензольное кольцо по отношению к электрофильным реагентам, поэтому реакции
электрофильного замещения протекают значительно труднее, чем для бензола.
Являясь ориентантом II рода,
карбоксильная группа направляет замещение в мета-положение.
Дикарбоновые кислоты по химическим свойствам во многом сходны с
монокарбоновыми. Они образуют одни и те же функциональные производные, с тем
лишь отличием, что реакции могут идти с участием как одной, так и двух
карбоксильных групп. Наряду с этим дикарбоновые кислоты проявляют и ряд
специфических свойств, в частности по-разному относятся к нагреванию. Щавелевая
и малоновая кислоты при нагревании подвергаются декарбоксилированию по одной
карбоксильной группе и превращаются в монокарбоновые кислоты - муравьиную и
уксусную соотвественно; янтарная, глутаровая, малеиновая, фталевая кислоты при
нагревании образуют циклические ангидриды, адипиновая - циклический кетон.
Особое значение в органическом синтезе занимает малоновая кислота. В
результате электроноакцепторного влияния карбоксильных групп в молекуле
малоновой кислоты атомы водорода метиленовой группы приобретают подвижность
(СН-кислотность). С участием метиленовой группы малоновая кислота в присутствии
оснований вступает в реакцию конденсации с альдегидами и кетонами, не
содержащими атома водорода при углероде в α-положении, в результате образуются
ненасыщенные монокарбоновые кислоты. Важным производным малоновой кислоты
является ее диэтиловый эфир («малоновый эфир»), который используется в
органическом синтезе для получения моно- и дикарбоновых кислот.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих карбоновых кислот:
изовалериановая, a-метилмасляная,
3-метилпентановая, винилуксусная, кротоновая кислота, транс-2-бутеновая,
коричная, a-метилглутаровая
кислота, a,a-дибромянтарная кислота,
цис-циклопентан-1,3-дикарбоновая кислота, 3-нитрофталевый ангидрид, малеиновая
кислота, фумаровая кислота, 5-бромизофталевая кислота, этилмалонат,
этилмалоновая кислота.
2. Какие кислоты можно получить действием оксида углерода (IV) на следующие магнийорганические
соединения с последующим гидролизом: пропилмагний-хлорид, изобутилмагнийхлорид,
изоамилмагниййодид, аллилмагнийхлорид?
. С помощью каких реакций можно превратить этиловый спирт в а)
кротоновую и б) пропионовую кислоты?
. Напишите уравнения реакций, при помощи которых можно превратить
в бензойную кислоту а) толуол, б) бромбензол, в) бензонитрил, г) бензиловый
спирт, д) бензотрихлорид, е) ацетофенон.
. Какими химическими реакциями можно обнаружить муравьиную кислоту
в ацетоне? Приведите соответствующие уравнения реакций.
. Напишите схемы взаимодействия уксусной, пропионовой, акриловой и
бензойной кислот с хлором. Назовите полученные соединения.
. Напишите схему реакции получения сложного эфира из этанола и
пропионовой кислоты. Опишите механизм реакции.
. Приведите схемы реакций бензойной кислоты со следующими
реагентами: а) PCl5, б) NaHCO3, в) NH3, t, г)
(СН3СО)2О, д) C2H5OH.
. Напишите схемы реакций, с помощью которых можно отличить
муравьиную, уксусную и метакриловую кислоты друг от друга.
. Приведите схему и механизм взаимодействия акриловой кислоты с
бромоводородом.
. Предложите схему синтеза янтарного ангидрида (ангидрида
бутандиовой кислоты) из 1,2-дибромэтана.
. Предложите схему синтеза изовалериановой кислоты из малонового
эфира.
. Напишите уравнения реакций янтарной и терефталевой кислот со
следующими реагентами: а) NaOH,
б) NaHCO3, в) NH3, t, г) PCl5, д) C2H5OH, е) Br2 (P).
. Напишите уравнение реакции этилендикарбоновой кислоты со
следующими реагентами: а) Br2,
б) KMnO4, H2O, в) H2, Ni, г) HBr.
. Специфические свойства дикарбоновых кислот: декарбоксилирование,
образование циклических ангидридов и амидов (на примере щавелевой и янтарной
кислот).
. Составьте уравнения реакций по следующим схемам:
2H
SOCI2 Mg CO2 H2O
NH3
а) C2H5CCH3 1
2 3 4 5 6
çç
эфир НCI
O
KMnO4
SOCI2 CH3ONa NH2CH3
б) С6Н5СН3 1 2
3 4
Br2
KOH HBr KCN 2H2O,H+ 2NH3
в) (СН3)2СНСООН
1 2 3 5 6 7
спирт
С2Н5ОNa (CH3 )2CHBr
H2O,H+ t
г)
СН2(СООС2Н5)2
1 2 3 4
HBr C2H5OH C2H5ONa NaOH
д) акриловая кислота 1
2 3 4
Н+ НОН
HBr KCN 2H2O,H+
Br2 KCN
2H2O,H+ 2C2H5OH, H+
е) CH3-CH=CH2
1 2 3 4 5
6 7
H2O
PСl5 Mg CO2
H2O CI2 NH3
к) СН3-CH=CH-CH3 1 2 3
4 5 6 7
эфир
1 Допишите приведенные уравнения
реакций:
а) изомасляная кислота + изобутиловыи спирт
б) ацетат натрия + п-нитробензилбромид
в) С6Н5СН=СНСООН + KMnO4
. Используя малоновый эфир, получите следующие кислоты: а) α-фенил-пропионовую, б) этилуксусную,
в) янтарную.
. С помощью какой реакции можно отличить малеиновую и фумаровую кислоты?
Какими соединениями они являются по отношению друг к другу?
. Сравните кислотные свойства следующих кислот: а) муравьиная, уксусная,
щавелевая, б) уксусная, пропионовая, янтарная, в) уксусная, акриловая,
бензойная, г) п-нитробензойная, бензойная, п-гидрокси-бензойная. Ответ
поясните.
ПРАКТИКУМ
Опыт 101. ПОЛУЧЕНИЕ МУРАВЬИНОЙ КИСЛОТЫ ИЗ ЩАВЕЛЕВОЙ КИСЛОТЫ
Р е а к т и в ы: щавелевая кислота, глицерин
В широкую пробирку, закрытую пробкой с газоотводной трубкой, вносят около
1 г щавелевой кислоты и 1 мл глицерина. Пробирку укрепляют наклонно в штативе и
осторожно нагревают. Вначале щавелевая кислота растворяется. Затем начинается
обильное выделение газа. С появлением из газоотводной трубки первых капель
отгоняющейся жидкости нагревание прекращают. Слегка охлаждают пробирку и вводят
еще 1 г щавелевой кислоты. Закрыв отверстие пробирки пробкой и, погрузив
отводную трубку до дна в приемник - пробирку с 2 мл воды, продолжают
нагревание. Приемник охлаждают в стакане с водой. Нагревают реакционную смесь
до потемнения и собирают в приемник отгоняющуюся муравьиную кислоту, которую
используют в последующиx опытах.
СООН t0
СOOH СО2 + НСООН
Двухосновные кислоты, у которых карбоксильные группы расположены близко
друг к другу, при нагревании легко подвергаются процессу декарбоксилирования.
Глицерин выполняет роль катализатора и способствует превращению щавелевой
кислоты в муравьиную.
Опыт 102. ПОЛУЧЕНИЕ МУРАВЬИНОЙ КИСЛОТЫ ИЗ ХЛОРОФОРМА
Р е а к т и в ы: хлороформ, 10% раствор гидроксида натрия
В пробирку помещают 5 капель хлороформа, 2 мл 10% раствора щелочи, смесь
взбалтывают и осторожно нагревают в пламени горелки до исчезновения капель
хлороформа
NaOH OH NaOH
СHCl3 H-C-OH HCOOH HCOONa
NaCl OH -H2O -H2O
Для открытия образовавшегося формиата натрия в пробирку добавляют 2-3
капли аммиачного раствора оксида серебра и наблюдают образование серого осадка
свободного серебра:
HCOONa + 2[Ag(NH3)2]OH 2Ag↓ + HOCOONa + 4NH3 + H2O
Опыт 103. РАЗЛОЖЕНИЕ МУРАВЬИНОЙ КИСЛОТЫ
Р е а к т и в ы: муравьиная кислота, серная кислота концентрированная
В пробирку, закрытую пробкой с газоотводной стеклянной трубкой, наливают
1 мл муравьиной кислоты и 1 мл серной кислоты (уд. вес 1,184) и слабо
нагревают. Муравьиная кислота разлагается с выделением оксида углерода (II), который горит голубым пламенем.
0
НСООН СО + Н2О.SО4
Опыт 104. ДЕЙСТВИЕ ОКИСЛИТЕЛЕЙ НА КИСЛОТЫ
Р е а к т и в ы: муравьиная, уксусная кислоты, 1% раствор перманганата
калия, 10% раствор серной кислоты,известковая вода
В пробирке смешивают 1 мл муравьиной кислоты с 1 мл 1% раствора
перманганата калия, закрывают пробкой с газоотводной трубкой и нагревают. При
нагревании происходит обесцвечивание pacтвopa, выделяется углекислый газ. Его
обнаруживают, пропуская выделяющиеся газообразные продукты в известковую воду.
4, H2SО4
НСООН СО2 + Н2О.
В другую пробирку вносят по 2 мл уксусной кислоты, 10% раствор серной
кислоты и 1% раствор перманганата калия. Раствор обесцвечивается.
Одноосновные предельные карбоновые кислоты устойчивы по отношению к
окислителям. Исключением является муравьиная кислота, легкая окисляемость
которой о6ъясняется отсутствием в ней радикала.
Опыт 105. ПОЛУЧЕНИЕ УКСУСНОЙ КИСЛОТЫ
Р е а к т и в ы: ацетат натрия, концентрированная серная кислота,
лакмусовая бумага
г ацетата натрия помещают в про6ирку и добавляют 1 мл концентрированной
серной кислоты. Смесь перемешивают и нагревают. Выделяющиеся пары уксусной
кислоты обнаруживают по характерному запаху и покраснению влажной синей
лакмусовой бумаги, поднесенной к отверстию пробирки.
СH3COONa
+ H2SO4 СH3COOH + NaHSO4
Опыт
106. ПОЛУЧЕНИЕ СОЛИ
ЖЕЛЕЗА УКСУСНОЙ КИСЛОТЫ
Р е а к т и в ы: 5% раствор натрий ацетата, раствор хлорида железа (III)
СН3СООNа + FеС13 NаС1+ (СН3СОО)3Fе
Полученная соль сразу же гидролизуется до комплексного соединения -
хлорида основного гексацетата железа ([Fе3(ОН)2(СНзСОО)6]+С1-). Образование его
и обуславливает буро-красное oкpaшивание раствора. При кипячении гидролиз идет
дальше, железо выделяется в осадок в виде нерастворимого основного ацетата.
(СНзСОО)3Fe + H2O СНзСООН + Fе(СНзСОО)2ОН.
Опыт 107. ВЗАИМОДЕЙСТВИЕ УКСУСНОЙ КИСЛОТЫ С ГИДРОКАРБОНАТОМ НАТРИЯ
Р е а к т и в ы: уксусная кислота, гидрокарбонат натрия, баритова вода
В пробирку вносят 1 мл разбавленной уксусной кислоты, добавляют несколько
крупинок гидрокарбоната натрия и закрывают пробкой с газоотводной трубкой.
После начала реакции к газоотводной трубке подносят зажженную спичку - она
гаснет. Опускают конец газоотводной тру6ки в пробирку с баритовой водой -
появляется белая муть.
СН3СООН + NаНСО3 СН3СООN а + СО2 + Н2О
СО2 + Ва(OH)2 ВаСО3 + Н2О
Опыт 108.
ПОЛУЧЕНИЕ УКСУСНОЭТИЛОВОГО ЭФИРА
Р е а к т и в ы: натрий ацетат, этиловый спирт, конц. серная кислота
В сухую пробирку вносят прокаленный ацетат натрия (столбик в 1 см), 0,5
мл этилового спирта и 3-4 капли концентрированной серной кислоты. Реакционную
смесь осторожно нагревают. Вскоре появляется характерный приятный запах
уксусноэтилового эфира.
СН3СН2ОН + HOSО2OH СН3СН2ОSО2ОН + Н2О
СН3СН2ОSО2ОН + СН3СООNa СН3СН2ОСОСНз + NaHSО4
Опыт 109.
ВЗАИМОДЕЙСТВИЕ ОЛЕИНОВОЙ КИСЛОТЫ С БРОМОМ
Р е а к т и в ы: олеиновая кислота, бромная вода
В пробирку наливают несколько миллилитров бромной
воды, добавляют по каплям олеиновую кислоту. Реакционную смесь энергично
встряхивают. Раствор обесцвечивается и образуется твердая дибромстеариновая
кислота.
СН3(СН2)7СН=СН(СН2)7СООН + Вг2 СН3(СН2)7СНBr-СНBr(СН2)7СООН
Опыт 110. ВЗАИМОДЕЙСТВИЕ ОЛЕИНОВОЙ КИСЛОТЫ С
ПЕРМАНГАНАТОМ КАЛИЯ
Р е а к т и в ы: олеиновая кислота, 1% раствор
перманганата калия, 10% раствор гидроксида натрия
мл 1% перманганата калия наливают в пробирку,
добавляют 0,5-1 мл раствора гидроксида натрия и 2-3 капли олеиновой кислоты.
Смесь энергично встряхивают. Окраска исчезает, образуется диоксистеариновая
кислота.
Опыт 111. ПОЛУЧЕНИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ ИЗ ДЕРЕВА
Р е а к т и в ы: концентрированный раствор гидроксида калия, 10% раствор
уксусной кислоты, 10% раствор хлорида кальция, концентрированная соляная
кислота
В фарфоровую или железную чашку насыпают 5 г древесных
опилок, приливают 5 мл концентрированного раствора гидроксида калия до
образования густой кашицы. Реакционную смесь нагревают при постоянном
перемешивании. Через несколько минут после начала нагревания начинают
выделяться пузырьки газа - водорода. После прекращения выделения пузырьков газа
нагревание прекращают - смесь превратилась в жидкую желто-коричневую массу.
После охлаждения в чашку добавляют 10-15 мл воды, хорошо перемешивают и
отфильтровывают. К части фильтрата (3-4 мл) прибавляют 10%-ый раствор уксусной
кислоты до кислой реакции по лакмусу и 1-2 мл 10% раствора хлорида кальция. Выпадает
белый осадок щавелевокислой соли кальция.
КОН, t°
(C6H10O5) n
НСООК + другие продукты разложения
t° COOK
НСООК Н2 + ç
COOK
COOK СН3СООН С О О
ç + СаС12 2КС1 + ç Са
COOK
С О О
Клетчатка при нагревании с концентрированным раствором гидроксида калия
разлагается с образованием большого количества продуктов, в том числе
муравьиной кислоты.
Опыт 112. ПОЛУЧЕНИЕ СОЛЕЙ ЩАВЕЛЕВОЙ КИСЛОТЫ
Р е а к т и в ы: натриевая соль муравьиной кислоты, 10% раствор хлорида
кальция
В сухую пробирку помещают небольшое количество натриевой соли муравьиной
кислоты и нагревают в пламени горелки. Вначале соль расплавляется, а затем
разлагается с выделением водорода. Пробирку охлаждают. Плав растворяют в воде.
Если раствор не получается прозрачным, его нагревают. К охлажденному раствору
добавляют несколько капель раствора хлорида кальция - выпадает белый осадок
нерастворимой кальциевой соли щавелевой кислоты.
НСOONa
t0 COONa CaCl2 COO
ç ç Ca + 2NaCl-H2 COONa COO
Опыт 113. РАЗЛОЖЕНИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ ПРИ НАГРЕВАНИИ С КОНЦЕНТРИРОВАННОЙ
СЕРНОЙ КИСЛОТОЙ
Р е а к т и в ы: щавелевая кислота, концентрированная серная кислота,
известковая вода
В пробирку, снабженную тройкой с изогнутой газоотводной трубкой, помещают
1 г кристаллической щавелевой кислоты и приливают 1-2 мл концентрированной
серной кислоты. Укрепив пробирку в зажиме штатива, ее осторожно нагревают до
выделения пузырьков газа. Щавелевая кислота при этом разлагается с выделением
двуокиси углерода и муравьиной кислоты, которая, в свою очередь, разлагается на
окись углерода и воду.
СООН t°
ç СО2 + НСООН
СООН H2SO4
°
НСООН СО + Н2ОSО4
Для обнаружения двуокиси углерода выделяющийся газ пропускают через
известковую воду. Жидкость мутнеет - образуется карбонат кальция.
СО2 + Са(ОН)2 СаСО3 + Н2О
При поджигании газ горит синеватым пламенем, характерным для окиси
углерода.
Опыт 114. ОКИСЛЕНИЕ ЩАВЕЛЕВОЙ КИСЛОТЫ
Р е а к т и в ы: щавелевая кислота, 1% раствор перманганата калия, 10%
раствор серной кислоты кислота, известковая вода
В пробирку, закрытую пробкой с газоотводной трубкой, помещают 2 мл
раствора перманганата калия, подкисленного серной кислотой и приливают 1 мл
насыщенного раствора щавелевой кислоты. Закрепив в зажиме штатива пробирку,
осторожно нагревают. Щавелевая кислота при этом окисляется до двуокиси углерода
и воды.
При пропускании выделяющегося газа в известковую воду раствор мутнеет за
счет образования углекислого кальция.
СООН
ç + KMnO4
+ H2SO4 СО2 + MnSO4
+ K2SO4 + Н2О
СООН
Опыт 115. ПОЛУЧЕНИЕ ФТАЛЕВОГО АНГИДРИДА
Р е а к т и в ы: фталевая кислота
Небольшое количество (0,1 г) фталевой кислоты в сухой
пробирке нагревают в пламени горелки. Кислота плавится, возгоняется и в более
холодной части пробирки появляется белый возгон.
Пробирку охлаждают, затем слегка нагревают, держа
пробирку наклонно. Фталевый ангидрид легко плавится и стекает вниз.

Опыт 116. ПОЛУЧЕНИЕ ФЕНОЛФТАЛЕИНА
Р е а к т и в ы: фталевый ангидрид, фенол, 10% раствор
гидроксида натрия, конц. серная кислота, этиловый спирт
В пробирку помещают приблизительно 0,2 г фталевого
ангидрида, 0,5 г фенола и 0,5 мл концентрированной серной кислоты. Смесь слегка
нагревают. Затем пробирку охлаждают. Прибавляют 2 мл спирта (для растворения
фенолфталеина), несколько капель полученного спиртового раствора выливают в
пробирку с раствором гидроксида натрия. Раствор окрашивается в малиновый цвет.
При подкислении раствора окраска исчезает.

Фенолфталеин
образуется в результате конденсации фталевого ангидрида с фенолом в присутствии
серной кислоты.
III.14
ГЕТЕРОФУНКЦИОНАЛЬНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
III.14.1
ОКСИКИСЛОТЫ, ФЕНОЛОКИСЛОТЫ
Гидроксикислотами называют производные карбоновых кислот, содержащие в
углеводородном радикале одну или несколько гидроксильных групп.
В зависимости от природы углеводородного радикала различают алифатические
гидроксикислоты (оксикислоты) и ароматические (фенолокислоты). Оксикислоты по
взаимному расположению карбоксильной и гидроксильной групп подразделяют на α-,
β-, γ- и т.д.
Число карбоксильных групп в молекуле гидроксикислоты определяют основность, а
число гидроксильных групп - атомность.
Гидроксикислоты чаще называют по тривиальной номенклатуре. По
заместительной номенклатуре ИЮПАК за родоначальное название принимается
тривиальное или систематическое название карбоновой кислоты. Гидроксильная
группа обозначается префиксом гидрокси- (окси-). При использовании тривиального
названия родоначальной структуры положение гидроксильной группы в
углеводородной цепи обозначается буквами греческого алфавита α-,
β-, γ- и т.д.,
а при употреблении систематического названия родоначальной структуры положение
ОН-группы указывается цифрами, например:
СН3-СН-СООН СН2-СН2-СООН СН2-СН2-СН2-СООН
ОН ОН ОН
-гидроксипропановая к-та 3-гидроксипропановая к-та 4-гидроксибутановая
к-та
α-гидроксипропионовая к-та β-гидроксипропионовая к-та γ-гидроксимасляная к-та
молочная кислота

-гидроксибензойная
к-та 3,4,5-тригидроксибензойная к-та
салициловая
кислота галловая кислота
Для
гидроксикислот характерна структурная изомерия, обусловленная разной структурой
углеводородного радикала, с которым связана карбоксильная группа, и разным
положением ОН-группы в углеводородной цепи. Кроме того, в ряду гидроксикислот
часто встречается оптическая изомерия.
Оксикислоты
получают следующими способами: а) гидролизом галогенкарбоновых кислот и
гидроксинитрилов, б) окислением гликолей и гидроксиальдегидов, в) гидратацией α-,β-ненасыщенных карбоновых кислот, г) взаимодействием
сложных эфиров α-галогенкарбоновых кислот с карбонильными соединениями
(реакция Реформатского).
Многие
фенолокислоты содержатся в свободном состоянии или в виде сложных эфиров в
растениях, из которых могут быть выделены в индивидуальном виде. Синтетические
методы получения фенолокислот заключаются в следующем: а) карбоксилирование
фенолов оксидом углерода (IV) (реакция Кольбе-Шмитта), б) гидроксилирование
аренкарбоновых кислот, в) сплавление сульфобензойных кислот со щелочами.
Реакционная
способность оксикислот обусловлена наличием в их структуре двух функциональных
групп - карбоксильной и гидроксильной, фенолокислот - карбоксильной группы,
фенольного гидроксила и ароматического ядра. По карбоксильной группе
гидроксикислоты дают все реакции, свойственные карбоновым кислотам, в
частности, они образуют соли, сложные эфиры, галогенангидриды, амиды. С
участием гидроксильной группы оксикислоты вступают в реакции, характерные для спиртов.
Так они образуют простые и сложные эфиры. За счет фенольного гидроксила
фенолокислоты способны образовывать простые и сложные эфиры, по ароматическому
ядру - вступают в реакции электрофильного замещения, свойственные аренам.
По
сравнению с соответствующими незамещенными кислотами гидрокси-кислоты проявляют
более выраженные кислотные свойства. Это обусловлено электроноакцепторным
влиянием ОН-группы, которая, проявляя -I-эффект,
дополнительно стабилизирует образующийся в процессе ионизации карбоксилат-ион.
По мере удаления ОН-группы от карбоксильной группы сила гидроксикислот
уменьшается, вследствии затухания индуктивного эффекта.
Вместе
с тем для гидроксикислот характерен ряд специфических свойств, обусловленных
взаимным влиянием карбоксильной и гидроксильной групп. Так, при нагревании α-гидроксикислот образуются циклические сложные эфиры -
лактиды, β-гидроксикислоты образуют α-,β-ненасыщенные карбоновые кислоты, γ-гидроксикислоты уже при комнатной температуре
претерпевают внутримолекулярную дегидратацию с образованием циклических сложных
эфиров - лактонов, фенолокислоты при нагревании легко подвергаются
декарбоксилированию. В присутствии концентрированной серной кислоты α-гидроксикислоты при нагревании подвергаются
расщеплению по связи С1-С2, образуя муравьиную кислоту и карбонильное
соединение (альдегид или кетон).
КОНТРОЛЬНЫЕ
ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
следующих кислот и назовите их по систематической номенклатуре: a-оксипропионовая, молочная,
салициловая, a-оксиизовалериановая,
b-оксимолочная, галловая, винная,
яблочная, лимонная, миндальная, хлоряблочная кислоты. Укажите, какие из
приведенных соединений обладают оптической активностью и отметьте
асимметрические атомы углерода. Напишите проекционные формулы Фишера стереоизомеров
этих соединений. Укажите энантиомеры, диастереомеры.
2. Приведите схемы синтеза следующих
оксикислот: а) гликолевой из уксусной, б) молочной из ацетилена, в) a-оксиизомасляной из пропилена, г)
миндальной (оксифенилуксусной) из пропилена.
3. Напишите схемы синтеза молочной
кислоты из следующих веществ: а) ацетальдегида, б) пропионовой кислоты, в)
пировиноградной кислоты, г) пропиленгликоля.
4. Напишите схемы синтеза b-оксимасляной кислоты из следующих
веществ: а) этилацетата, б) ацетальдегида.
5. Напишите, какие продукты получатся
при нагревании следующих кислот: a-оксиизомасляной, b-оксиизовалериановой, 4-гидроксигексановой, 3-метил-
2-оксивалериановой, гликолевой, b-окси-b-фенилпропионовой,
о-гидрокси-метилбензойной, молочной, яблочной.
6. Заполните схемы следующих
превращений:
, 5000C NaOH HBr KCN H2O, H+) CH3-CH=CH2 1 2 3 4 5O ROOR t 0
2 , P KOH Н2О,H+
б) изовалериановая кислота 1 2 3
спирт
7. Определите строение вещества кислого
характера молекулярной C5H10O3 формулы, если оно при нагревании образует вещество C5H8O7 (также кислого
характера), которое присоединяет бром с образованием дибромпроизводного, а при
окислении дает смесь пропионовой и щавелевой кислот.
8. Напишите реакции молочной, яблочной
кислот со следующими реагентами: а) CH3OH (H+), б) t0, в)
PCI5, г) (CH3CO)2O, д) O, к) конц. H2SO4, л) Na, м) NaOH.
9. С помощью каких химических реакций
можно отличить соединения: а) хлор-уксусная и уксусная кислоты, б) молочная и
салициловая кислоты.
10.Напишите схемы
качественных реакций, позволяющих отличить салициловую кислоту от фенола,
бензойной кислоты, ацетилсалициловой кислоты.
11.Напишите схемы
получения из салициловой кислоты таких лекарственных средств, как натрия
салицилат, метилсалицилат, фенилсалицилат (салол), салициламид, оксафенамид,
ацетилсалициловая кислота (аспирин).
12.Составьте
уравнения по следующим схемам превращений:
а)
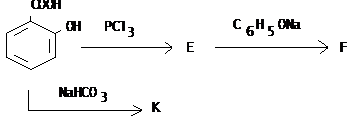
Br2 , P C2H5OH Zn (CH3)2CHC(O)CH3 H3O+
б) CH3CH2COOH 1 2 3 4 5
эфир
NaOH CO2;t;P H+ (CH3CO)2O
в)
C6H5OH 1 2 3 4
1. Приведите схему и механизм получения
салициловой кислоты по методу Кольбе.
2. Напишите реакции бромирования
салициловой кислоты и нагревания лимонной кислоты в присутствии
концентрированной серной кислоты.
3. Сравните кислотные свойства a-, b-, g-оксимасляных кислот. Укажите электронные эффекты функциональных групп.
4. Объясните, почему кислотность салициловой
кислоты выше, чем у ее пара- и мета-изомеров?
5. Напишите схемы качественных реакций,
позволяющих отличить салициловую кислоту от а) фенола, б) бензойной кислоты, в)
ацетилсалициловой кислоты.
6. С помощью каких реакции можно
отличить а) салициловую кислота и салициламид, б) салол и ацетилсалициловую
кислоту.
7. Напишите уравнения реакций
взаимодействия 1,2-диокси-4-бензойной кислоты с а) NaOH, б) NaHCO3,
в) РСl5, г) втор.бутиловым спиртом, д)
фенолом. Назовите полученные соединения.
ПРАКТИКУМ
Опыт 117. ДОКАЗАТЕЛЬСТВА СТРОЕНИЯ МОЛОЧНОЙ КИСЛОТЫ
Реактивы: молочная кислота, концентрированная серная
кислота, раствор йода в калия йодиде, 10% раствор гидроксида натрия
.1. В сухую пробирку помещают 0,5 мл молочной кислоты
и осторожно приливают 0,5 мл концентрированной серной кислоты. Отверстие
пробирки закрывают пробкой с газоотводной трубкой. Содержимое пробирки
осторожно нагревают в пламени горелки. Жидкость в пробирке темнеет и пенится.
Молочная кислота при нагревании в присутствии концентрированной серной кислоты
разлагается с образованием уксусного альдегида и муравьиной кислоты, которая в
данных условиях разлагается до оксида углерода (II) и воды. При поджигании выделяющегося из газоотводной трубки
газа наблюдают голубую окраску пламени, что свидетельствует о выделении оксида
углерода (II):
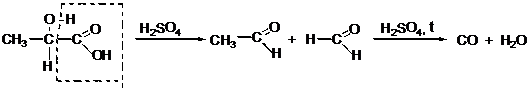
.2. В пробирку помещают 1 мл воды, 0,5 мл
концентрированной серной кислоты и 0,5 мл молочной кислоты. Пробирку закрывают
пробкой с газоотводной трубкой, конец которой опускают в пробирку с 1 мл
раствора йода в йодиде калия, предварительно обесцвеченного прибавлением
нескольких капель 10%-ного раствора гидроксида натрия. Пробирку с молочной
кислотой нагревают в пламени горелки. При нагревании молочная кислота
разлагается с образованием газообразного ацетальдегида, который при пропускании
через раствор гипойодита натрия образует желтый осадок йодоформа с характерным
запахом:
I2 + 2NaOH NaOI + NaI + H2OCHO +
3NaOI I3C-CHO + 3NaOHC-CHO + NaOH CHI3 + HCOONa
Опыт 118. ПОЛУЧЕНИЕ СОЛЕЙ ВИННОЙ КИСЛОТЫ
Р е а к т и в ы: винная кислота, раствор гидроксида
натрия, 5% раствор гидроксида калия
К раствору 0,1 г винной кислоты в 1 мл воды осторожно,
по каплям, добавляют 5% раствор гидроксида калия, потирая стеклянной палочкой о
стенки пробирки. Появляется белый кристаллический осадок кислой калиевой соли
винной кислоты, которая плохо растворима в воде.
НООС-СН-СН-СООН + КОН КООС-СН-СН-СООН + Н2О
ï ï ï ï
НО ОН НО ОН
Полученный осадок делят на две части и по каплям
приливают в первую пробирку - избыток гидроксида калия, во вторую - 0,5 мл
гидроксида натрия. В обеих пробирках растворяется осадок кислой калиевой соли
винной кислоты с образованием средних хорошо растворимых солей.
КООС-СН-СН-СООН + КОН КООС-СН-СН-СООК + Н2О
ï ï ï ï
НО ОН НО ОН
КООС-СН-СН-СООН + NaОН КООС-СН-СН-СООNa + Н2О
ï ï ï ï
НО ОН НО ОН
Раствор используют для следующей реакции.
Опыт 119.
ПОЛУЧЕНИЕ РАСТВОРА ФЕЛИНГА
Р е а к т и в ы: калий-натрий виннокислый, 5% раствор
сульфат меди, 10% раствор гидроксида натрия
К 0,5 мл раствора сульфата меди по каплям приливают около 0,5 мл 10%
раствора гидроксида натрия до образования голубого осадка гидроксида меди. К
выпавшему осадку добавляют раствор калий-натриевой соли винной кислоты
(предыдущий опыт). Голубой осадок растворяется с образованием раствора
ярко-синего цвета (раствор Фелинга).
КООС-СН-СН-СООNa + Сu(ОН)2
КООС-СН - СН-СООNa + Н2О
ï ï ï ï
НО ОН О О
Сu
Сегнетова соль, имеющая 2 свободные спиртовые группы, является
многоатомным спиртом. Многоатомные спирты растворяют голубой осадок гидроксида
меди с образованием соединений типа алкоголята. Поэтому раствор Фелинга можно
рассматривать как гликолят сегнетовой соли.
Раствор Фелинга обладает окислительными свойствами и
применяется для определения восстановителей (альдегиды, сахара). В реакциях он
ведет себя так же, как гидроксид меди: при взаимодействии с восстановителями
выпадает красный осадок оксида меди - Сu2О.
Опыт 120.
СВОЙСТВА РАСТВОРА ФЕЛИНГА
Р е а к т и в ы: формалин, раствор Фелинга
Пробирку с 1 мл раствора Фелинга и разбавленного раствора формалина
нагревают. Выпадает красный осадок оксида меди (I) или свободная медь.
КООС-СН-СН-СООNa + НСНО НСООН + Сu2О Сu
ï ï
О О
Сu
Опыт 121. РАЗЛОЖЕНИЕ ЛИМОННОЙ КИСЛОТЫ
Р е а к т и в ы: кристаллы лимонной кислоты,
концентрированная серная кислота, баритова вода, раствор йода в йодиде калия,
10% раствор гидроксида натрия
В сухую пробирку на высоту 5 мм помещают
кристаллическую лимонную кислоту и осторожно приливают 1 мл концентрированной
серной кислоты. Пробирку закрывают пробкой с газоотводной трубкой, конец
которой опускают в пробирку с 1 мл баритовой водой. Исходную смесь нагревают в
пламени горелки и наблюдают бурное выделение пузырьков газа. Образование белого
осадка карбоната бария свидетельствует о выделении оксида углерода (IV).
СН2СООН
СН2СООН
ï конц.H2S04, t° ï I
НО-С-СООН С = О
+ НСООН
ï
ï
СН2СООН
СН2СООН
О
I I СО Н2О
2СО2 СН3-С-СН3
СО2 + Ва(ОН)2
ВаСО3 + Н2О
Не прекращая нагревания смеси, газоотводную трубку
опускают в пробирку с раствором йода в йодиде калия, предварительно
обесцвеченном добавлением нескольких капель 10%-ного раствора гидроксида
натрия. Наблюдается образование желтого осадка и ощущают характерный запах
йодоформа:
I2 (OH-)
(CH3)2С=O CHI3 + СH3COONa
При поджигании газа, выделяющегося из газоотводной
трубки, наблюдают голубую окраску пламени, что свидетельствует о выделении
оксида углерода (II).
Опыт 122. ПОЛУЧЕНИЕ САЛИЦИЛОВОЙ КИСЛОТЫ И ЕЕ СОЛЕЙ
Р е а к т и в ы: 10% раствор салицилата натрия, 10%
раствор соляной кислоты
В пробирку вносят равные количества 10% раствора
салицилата натрия и 10% раствора соляной кислоты, пробирку встряхивают.
Наблюдает выпадение белого осадка салициловой кислоты:

Опыт 123. РАЗЛОЖЕНИЕ САЛИЦИЛОВОЙ КИСЛОТЫ ПРИ НАГРЕВАНИИ
Р е а к т и в ы: салициловая кислота, баритова вода
В сухую пробирку, снабженную газоотводной трубкой,
помещают небольшое количество салициловой кислоты. Конец газоотводной трубки
опускают в пробирку с баритовой водой. Содержимое первой пробирки нагревают.
При этом салициловая кислота разлагается на фенол и углекислый газ. Углекислый
газ обнаруживают по помутнению баритовой воды, фенол - по характерному запаху.

Опыт 124. ВЗАИМОДЕЙСТВИЕ САЛИЦИЛОВОЙ КИСЛОТЫ С БРОМОМ
Р е а к т и в ы: салициловая кислота, бромная вода
К 1-2 мл насыщенного водного раствора салициловой
кислоты приливают 1-2 мл бромной воды, которая при этом обесцвечивается.
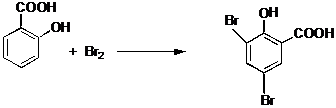
Введение фенольного гидроксила в молекулу бензойной
кислоты резко повышает подвижность атомов водорода бензольного кольца.
Вследствие этого салициловая кислота легко бромируется с образованием в
условиях опыта малорастворимого соединения 3,5-дибромсалициловой кислоты.
Опыт 125. ВЗАИМОДЕЙСТВИЕ САЛИЦИЛОВОЙ КИСЛОТЫ С
ГИДРОКАРБОНАТОМ НАТРИЯ
Р е а к т и в ы: салициловая кислота, фенол, 5% раствор гидрокарбоната
натрия
В две пробирки наливают по 1 мл 5%-ного раствор
гидрокарбоната натрия. В одну пробирку на кончике шпателя добавляют салициловую
кислоту, в другую - такое же количество фенола. Содержимое пробирок
встряхивают. В пробирке с салициловой кислотой наблюдают выделение пузырьков
газа. В пробирке с фенолом видимых изменений не наблюдают, так как фенолы не
вытесняют угольную кислоту из её солей:
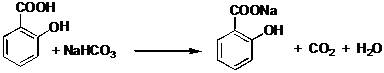
Опыт 126. ОБНАРУЖЕНИЕ ФЕНОЛЬНОГО ГИДРОКСИЛА В САЛОЛЕ
Р е а к т и в ы: салол, этиловый спирт, 1% раствор
хлорида железа
В сухой пробирке растворяют несколько кристаллов
салола в 1 мл спирта. К спиртовому раствору добавляют 1-2 капли раствора
хлорида железа. Появляется фиолетовое окрашивание. В полученный раствор
добавляют 1-3 мл воды. Жидкость мутнеет, выпадает осадок, фиолетовое
окрашивание исчезает.
Салол представляет собой фениловый эфир салициловой
кислоты. Он имеет свободный фенольный гидроксил, за счет которого и появляется
фиолетовое окрашивание с хлоридом железа.

Салол хорошо растворяется в спирте, плохо - в воде.
Поэтому при разбавлении водой фиолетового раствора салол выпадает в осадок и
исчезает фиолетовая окраска.
Опыт 127. ГИДРОЛИЗ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ (АСПИРИН)
Р е а к т и в ы: аспирин, 1% раствор хлорида железа (III)
Несколько кристаллов аспирина растворяют в 5 мл воды.
Раствор делят на две части. К первой прибавляют несколько капель хлорида железа
(III). Фиолетовое окрашивание не
наблюдается. Вторую часть раствора кипятят в течение 5 мин, по запаху
обнаруживают уксусную кислоту. Пробирку охлаждают и добавляют несколько капель
раствора хлорида железа (III).
Наблюдается характерное фиолетовое окрашивание, указывающее на наличие
фенольного гидроксила.
В ацетилсалициловой кислоте отсутствует свободный
фенольный гидроксил. Будучи сложным эфиром, ацетилсалициловая кислота легко
гидролизуется при кипячении водой, образуя салициловую кислоту, которая в свою
очередь дает характерное окрашивание с хлоридом железа (III).
Реакция с хлоридом железа (III) применяется для определения качества
ацетилсалициловой кислоты. При неправильном хранении она может разложиться на
уксусную, обнаруживаемую при открытии склянки по запаху, и салициловую кислоту,
обнаруживаемую с помощью хлорида железа (III).
III.14.2
ОКСОКИСЛОТЫ
К оксокислотам относят альдегидо- и кетонокислоты. Эти соединения
содержат в своем составе карбоксильную группу и альдегидную или кетонную. В
зависимости от расположения функциональных групп различают α-,
β-, γ-оксокарбоновые
кислоты.
Как и в ряду гидроксикислот, для многих оксокислот широко используются
тривиальные названия. По заместительной номенклатуре ИЮПАК карбонильная группа
обозначается в названии префиксом оксо-, например:
Н-С-СООН СН3-С-СООН СН3-С-СН2-СООН
çê çê çê
О О О
оксоэтановая кислота 2-оксопропановая кислота 3-оксобутановая кислота
глиоксалевая кислота a-кетопропионовая кислота b-кетомасляная кислота
пировиноградная кислота ацетоуксусная кислота
Оксокислоты получают а) окислением гидроксикислот - оксикислоты,
содержащие первичную гидроксильную группу образуют альдегидокислоты, а,
содержащие вторичную гидроксильную группу, кетонокислоты; б) гидролизом геминальных
дигалогенкарбоновых кислот.
Оксокислоты являются более сильными кислотами, чем соответствующие
карбоновые кислоты, что связано с электроноакцепторным влиянием карбонильной
группы (-I-эффект).
Для оксокислот характерны реакции, протекающие по карбоксильной группе -
образование солей, ангидридов, галогенангидридов, амидов, сложных эфиров, и
реакции, протекающие по карбонильной группе - реакции присоединения,
присоединения-отщепления, окисление. Однако оксокислоты обладают и рядом
специфических свойств. В частности, a- и b-оксокислоты
легко подвергаются декарбоксилированию. a-Оксокислоты в присутствии концентрированной серной кислоты
отщепляют СО2 и превращаются в альдегид, b-оксокислоты уже при комнатной температуре при
декарбоксилировании образуют ацетон.
В отличие от кислот сложные эфиры b-оксокислот являются довольно устойчивами соединениями.
Важное значение в органическом синтезе имеет этиловый эфир ацетоуксусной
кислоты («ацетоуксусный эфир»). Ацетоуксусный эфир является таутомерным
веществом. Ему присуща кето-енольная таутомерия, обусловленная наличием в
структуре молекулы СН-кислотного центра (подвижные атомы водорода метиленовой
группы) и основного центра - атома кислорода кетонной группы. Подвижность
атомов водорода метиленовой группы связана с электроноакцепторным влиянием
карбонильной и сложноэфирной групп за счет -I-эффекта.
CH3-C-CH2-COOC2H5 CH3-C=CH2-COOC2H5
çê ê
O ОН
кетонная форма енольная форма
С участием кетонной формы ацетоуксусный эфир вступает в реакции,
характерные для альдегидов и кетонов (реакции присоединения,
присоединения-отщепления). Наличие енольной формы объясняет способность
ацетоуксусного эфира обесцвечивать бромную воду, давать фиолетовое окрашивание
с хлоридом железа (III), вступать в
реакцию ацилирования, вступать в реакцию с металлическим натрием или
гидроксидом натрия с образованием натрийацетоуксусного эфира.
Натрийацетоуксусный эфир легко реагирует с галогеналканами, при этом
алкилирование протекает не по атому кислорода, как можно было ожидать, а по
атому углерода.
Характерным свойством ацетоуксусного эфира является способность к
кетонному (образование кетонов при нагревании в присутствии разбавленных
растворов кислот или щелочей) и кислотному (образование кислот при действии
концентрированных растворов щелочей) расщеплению.
Ацетоуксусный эфир широко используется в органическом синтезе для
получения различных кетонов и карбоновых кислот.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
приведенных кислот и назовите их по систематической номенклатуре: глиоксалевая,
пировиноградная, ацетоуксусная, щавелевоуксусная, антраниловая.
2. Назовите приведенные ниже соединения:
а) СН3СН2СОСООН, б) СН3СОСН(С2Н5)СООН,
в) СОНСНСНСООН, г) СН3СОСООСН3
3. Напишите уравнения реакций,
позволяющие получить из а) уксусной кислоты ацетоуксусный эфир, б) этилацетата
оксобутандиовую кислоту, в) пропионо-вой кислоты пировиноградную.
4. Исходя из ацетоуксусного эфира и
других необходимых реагентов, предложите схемы получения: а) метилэтилкетона,
б) 2-метилбутановой кислоты.
5. Напишите формулы веществ, которые
образуются при нагревании следующих кислот: a-метил-b-кетовалериановой,
b-кетокапроновой, 3-оксопентановой,
пировиноградной.
6. Глиоксалевая кислота в отличие от
алифатических альдегидов образует устойчивую гидратную форму. Приведите
строение гидратной формы и объясните причину ее устойчивости.
7. Напишите реакции глиоксалевой кислоты
со следующими веществами: а) Ag2O (NH3), б) HCN.
8. Сравните отношение к нагреванию β-кетовалериановой кислоты и a-метил- b-кетовалериановой кислот.
9. Кето-енольная таутомерия a, b-дикарбонильных соединений на примере ацетоуксусного эфира.
Факторы, определяющие соотношение кетонной и енольной форм в a, b-дикарбонильных соединениях.
10.Напишите
реакции взаимодействи ацетоуксусного эфира со следующими реагентами: а) C2H5ONa, б) HCN, в) NaHSO3, г) NH2OH, д) Br2, е) NH2NH2, к) NH2NHC6H5.
11.Напишите схемы
кетонного и кислотного расщепления ацетоуксусного эфира.
12.Составьте
уравнения по следующей схеме превращений:
C2H5J 2HOH (H+)
а) ацетоуксусный эфир 1 2 3
С2Н5ОNa Na C2H5J H2O, t,
(H+)
б) ацетоуксусный эфир 1 2 3 4
13.Напишите уравнения реакций взаимодействия пировиноградной кислоты с
вторичным бутиловым спиртом и гидразином. Назовите полученные продукты.
14.Напишите формулу метилацетоуксусного и диэтилацетоуксусного эфира.
Укажите, для какого из этих соединений возможна кето-енольная таутомерия. Ответ
поясните.
15.С помощью каких реакций можно отличить глиоксалевую и пировиноградную
кислоты? Приведите соответствующие уравнения реакций.
ПРАКТИКУМ
Опыт 128. РЕАКЦИЯ АЦЕТОУКСУСНОГО ЭФИРА С ХЛОРИДОМ
ЖЕЛЕЗА (III)
Р е а к т и в ы : ацетоуксусный эфир, 1% раствор
хлорида железа (III)
В пробирку вносят 10 капель ацетоуксусного эфира,
прибавляют 2 капли 1%ного раствора хлорида железа. Наблюдают появление
красно-фиолетового окрашивания, которое доказывает наличие енольной формы
ацетоуксусного эфира. Енольная форма ацетоуксусного эфира устойчива за счет
образования внутримолекулярной водородной связи:
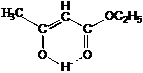
Опыт 129. РЕАКЦИЯ АЦЕТОУКСУСНОГО ЭФИРА С БРОМНОЙ ВОДОЙ
Р е а к т и в ы : ацетоуксусный эфир, бромная вода
В пробирку вносят 10 капель ацетоуксусного эфира,
прибавляют 1 каплю насыщенной бромной воды. Обесцвечивание бромной воды
происходит с участием енольной формы. Присоединение брома приводит к
образованию a-бромацетоуксусного
эфира, не содержащего енольного гидроксила:
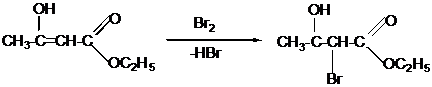
Опыт 130. РАЗЛОЖЕНИЕ АЦЕТОУКСУСНОГО ЭФИРА
Р е а к т и в ы : ацетоуксусный эфир, 10% раствор
серной кислоты, баритова вода, раствор йода в йодиде калия, 10% раствор
гидроксида натрия
В пробирку вносят 10 капель ацетоуксусного эфира,
добавляют 1 мл 10%-ного раствора серной кислоты. Пробирку закрывают пробкой с
газоотводной трубкой, конец которой опускают в пробирку с 1 мл баритовой воды.
При нагревании реакционной смеси наблюдается помутнение раствора баритовой
воды, что указывает на выделение оксида углерода (IV) (декарбоксилирование). Не прекращая нагревание, конец
газоотводной трубки опускают в пробирку с 1 мл раствора йода в йодиде калия,
предварительно обесцвеченного по капельным добавлением 10%-ного раствора
гидроксида натрия. Наблюдают образование светло-желтого осадка и ощущают
специфический запах йодоформа, что подтверждает образование ацетона и этанола:

III.14.3
АМИНОКИСЛОТЫ. АМИДЫ. УРЕИДЫ КИСЛОТ
Аминокислотами называют производные карбоновых кислот, в углеводородном
радикале которых один или несколько атомов водорода заменены на аминогруппу.
В зависимости от природы углеводородного радикала, с которым связана
карбоксильная группа, аминокислоты подразделяют на алифатические и
ароматические. Алифатические аминокислоты по взаимному расположению аминогруппы
и карбоксильной группы делятся на α-, β-,
γ-аминокислоты.
Наиболее распространенными в природе являются α-аминокислоты, входящие в состав
белков.
По заместительной номенклатуре ИЮПАК названия аминокислот образуют из
тривиальных или систематических названий соответствующих карбоновых кислот и
префикса амино-. При использовании тривиальных названий карбоновых кислот
положение аминогруппы обозначают буквами греческого алфавита α,
β, γ, для
образования систематического названия используют цифры. Для аминокислот,
входящих в состав белков, чаще всего применяют тривиальные названия.
Ароматические аминокислоты бензольного ряда рассматривают как производные
бензойной кислоты:
СН2-СООН СН3-СН2-СООН СН3-СН2-СН2-СООН
NН2 NН2 NН2
-аминоэтановая кислота 2-аминопропановая к-та 3-аминобутановая к-та
аминоуксусная кислота α-аминопропионовая к-та β-аминомасляная кислота
глицин α-аланин

-аминобензойная
кислота 4-аминобензойная кислота
о-аминобензойная
кислота п-аминобензойная кислота
антраниловая
кислота
Изомерия
аминокислот аналогична изомерии гидроксикислот. Она может быть обусловлена
разной структурой углеводородного радикала, с которым связана карбоксильная
группа и разным положением аминогруппы в углеродной цепи (структурная
изомерия), для аминокислот, содержащих ассиметрический атом углерода, изомерия
связана с разным положением заместителей в пространстве (оптическая изомерия).
Среди
множества способов получения аминокислот наиболее важными являются: а) действие
аммиака на галогенкарбоновые кислоты, б) действие аммиака и циановодородной
кислоты на альдегиды (синтез Штреккера), в) присоединение аммиака к α, β-ненасыщенным кислотам, г) восстановление
нитробензойных кислот.
В
химическом отношении аминокислоты проявляют свойства первичных аминов и
карбоновых кислот. По карбоксильной группе они образуют функциональные
производные карбоновых кислот - соли, сложные эфиры, амиды, галогенангидриды.
С
участием аминогруппы аминокислоты образуют соли с минеральными кислотами,
вступают в реакции алкилирования, ацилирования, реагируют с азотистой кислотой,
а также дают другие реакции, свойственные первичным аминам. Аминокислоты
обладают амфотерными свойствами, поскольку образуют соли с минеральными
кислотами и с основаниями.
Аминокислоты
обладают некоторыми специфическими свойствами, обусловленными взаимным влиянием
карбоксильной и аминогрупп. При нагревании α-, β-, γ-аминокислот образуются разные продукты: α-аминокислоты, претерпевая межмолекулярную дегидратацию
при нагревании, образуют циклический диамид - дикетопиперазин; β-аминокислоты отщепляют молекулу аммиака, образуя α-, β-ненасыщенные кислоты; γ-аминокислоты претерпевают внутримолекулярную
дегидратацию, образуя циклические амиды - лактамы.
Амидами
называют производные карбоновых кислот, в которых гидроксильная группа
карбоксильной группы заменена на аминогруппу.
Их
можно рассматривать как ацильные производные аммиака, первичных и вторичных
аминов. Получают их при а) взаимодействии галогенангидридов, ангидридов или
сложных эфиров карбоновых кислот с аммиаком, первичными или вторичными аминами,
б) нагревании аммонийных солей карбоновых кислот, в) гидролизе нитрилов.
По
электронному строению амидная группа сходна с карбоксильной. Неподеленная пара
электронов атома азота находится в сопряжении с π-электронами карбонильной группы (р,π-сопряжение), вследствие чего амиды практически не
вступают в реакции с нуклеофильными реагентами и в отличие от аминов являются
очень слабыми основаниями. Как слабые основания амиды образуют соли лишь с
сильными минеральными кислотами, причем протонированию подвергается атом
кислорода карбонильной группы, поскольку при этом образуется стабильный катион.
Амиды могут проявлять и свойства слабых кислот, так при взаимодействии с
металлическим натрием или амидом натрия они образуют соли. Амиды гидролизуются
намного труднее, чем другие функциональные производные карбоновых кислот, они
легко гидролизуются лишь в присутствии минеральных кислот или щелочей. Для
незамещенных амидов характерна реакция дегидратации с образованием нитрилов, а
также расщепление по Гофману и реакции восстановления.
Угольной
кислоте соответствуют два амида - неполный (карбаминовая кислота) и полный
(мочевина или карбамид).
Особый
интерес представляет диамид угольной кислоты - мочевина. Мочевина является
конечным продуктом распада белков. Синтетически может быть получена при
упаривании водного раствора цианата аммония и при взаимодействии аммиака с
оксидом углерода (IV).
В
химическом отношении мочевина проявляет свойства амидов. Однако в отличие от
амидов карбоновых кислот у мочевины более выражены нуклеофильные и основные
свойства, Это связано с тем, что в ее молекуле при карбонильной группе
расположены две аминогруппы. В результате сопряжения неподеленных пар
электронов атомов азота с π-электронами
кратной связи (+М-эффект) основным центром в молекуле мочевины является атом
кислорода.
С
сильными кислотами мочевина образует соли, в водных растворах кислот или
щелочей при нагревании легко гидролизуется с образованием оксида углерода (IV) и
аммиака. Проявляя нуклеофильные свойства, мочевина вступает в реакции с
электрофильными реагентами - галогеналканами и галогенангидридами карбоновых
кислот, образуя соответственно алкилмочевины и ацилмочевины. N-ацильные
производные мочевины называют уреидами. Дикарбоновые кислоты могут образовывать
с мочевиной циклические уреиды. Для мочевины характерны также следующие
реакции: а) разложение с выделением азота под действием азотной кислоты, б)
взаимодействие с гипобромитом натрия, в) биуретовая реакция.
КОНТРОЛЬНЫЕ
ВОПРОСЫ И УПРАЖНЕНИЯ
1. Выведите все изомеры аминокислот состава С4Н9О2N. Назовите их по рациональной и
систематической номенклатирам. Какие из них обладают оптической активностью?
Обозначьте звездочкой асимметрические атомы углерода.
2. Напишите структурные формулы следующих веществ и назовите их по
систематической номенклатуре: а) глицин, б) аланин, в) валин, г) серин.
Отметьте асимметрические атомы углерода в этих соединениях, изобразите
проекционные формулы Фишера. Отнесите к D-, L-стереохимическому
ряду, определите абсолютную конфигурацию ( R-, S-).
. Назовите приведенные соединения:
а)
CH2(OH)CH(NH2)COOH б) CH2(SH)CH(NH2)COOH
в)
(CH3)2CHCH(NH2)COOH г) CH3CH(OH)CH(NH2)COOH
д)
(CH3)2CHCH(OH)CH(NH2)COOH е)
HOOCCH2N +H3Br-
4. В чем заключается амфотерность аминокислот? Напишите формулы
аминокислот в виде биполярных ионов: глицина, аланина, a-аминоизомасляной кислоты.
5. Предложите путь синтеза n-аминосалициловой кислоты из бензола.
. Напишите уравнения реакций, при помощи которых можно осуществить
превращения а) изомасляного альдегида в валин, б) янтарной кислоты в
аспарагиновую кислоту.
. Напишите схемы последовательных реакций, протекающих при
циангидринном (оксинитрильном) синтезе a-аминокислот, если в качестве исходных соединений взять: а)
пропионовый альдегид, б) метилэтилкетон, в) изомасляный альдегид.
. Напишите уравнения реакций аланина с а) (СН3СО)2О, б) СН3Сl, в) C2H5OH, г) Cu(OH)2, д) HNO2, е) CHCl3, NaOH,
к) НС(О)Н.
. Напишите структурные формулы аминокислот - a-аминопропиновая, b-аминомасляная, g-масляная и назовите их по
международной номенклатуре. Какие соединения образуются при нагревании
вышеприведенных аминокислот, приведите уравнения реакций.
. п-Аминобензойная кислота и ее производные, применяемые в
медицине - анестезин, новокаин, новокаинамид. Кислотно-основные свойства, общая
характеристика реакционной способности.
. Напишите схемы реакций уросульфана (уреида сульфаниловой
кислоты) с хлороводородной кислотой и гидроксидом натрия. Какие реакционные
центры в молекуле уросульфана обусловливают его амфотерный характер?
. Напишите уравнения реакций, позволяющих отличить амид бензойной
кислоты и п-толуидин.
. Напишите структурные формулы и названия соединений: а) изомерных
трипептидов, состоящих из глицина и аланина и б) изомерных трипептидов,
состоящих из валина, фенилаланина и цистеина.
. Напишите структурные формулы следующих соединений: амид
циклогексанкарбоновой кислоты, фталимид, N,N-диэтилэтанамид,
п-нитро-ацетанилид, гидразид валериановой кислоты.
. Предложите схему синтеза фенацетина (4-этоксиацетанилида) из
сульфаниловой кислоты.
. Карбамид (мочевина). Гуанидин (иминомочевина). Основные
свойства, образование солей. Сравнение силы основности мочевины и гуанидина.
. Предложите схему синтеза бромизовала (уреида a-бромизовалериановой кислоты) из
изовалериановой кислоты.
. С помощью каких химических реакций можно отличить глицин и
антраниловую кислоту? Приведите соответствующие уравнения реакций.
. Составьте уравнения по следующей схеме превращений:
Br2
NH3 HCl
СН3СН2СООН 1 2
3
HNO2
4
t0
5
ПРАКТИКУМ
Опыт 131. ОБРАЗОВАНИЕ МЕДНОЙ КОМПЛЕКСНОЙ СОЛИ
ГЛИКОКОЛА
Р е а к т и в ы: 1% раствор гликокола, 5% раствор
сульфата меди, 10% раствор гидроксида натрия
К 1 мл раствора сульфата меди добавляют равный объем
10%-ного раствора гидроксида натрия и 1-2 мл раствора гликокола. Голубой осадок
растворяется и появляется характерное интенсивное окрашивание раствора.
О=С-ОН O=C - O
NH2 - CH2
2 ç + Cu(OH)2 ç Cu ç
СН2-NH2 -H2O H2C - NH2 O - C=O
Гликокол, как a-аминокислота, с медью легко образует комплексное циклическое
соединение, окрашенное в синий цвет. Медь в таких внутрикомплексных соединениях
не имеет ионного характера, поэтому в щелочном растворе не происходит выпадения
осадка Сu(ОН)2.
Опыт 132. ВЗАИМОДЕЙСТВИЕ ГЛИКОКОЛА С ФОРМАЛЬДЕГИДОМ
Р е а к т и в ы: 1% раствор гликокола, формалин, 10%
раствор гидроксида натрия, 1% спиртовый раствор фенолфталеина.
К 5 мл 1%-ного раствора гликокола добавляют по каплям
подкрашенный раствор щелочи до появления неисчезающей окраски, что происходит
довольно быстро. В другую пробирку добавляют ту же щелочь к смеси 1 мл
формалина и 3-4 мл воды также до появления окраски. Обе окрашенные жидкости
смешивают и наблюдают обесцвечивание смеси, то есть появление кислой реакции в
результате смешивания щелочных растворов. При дальнейшем постепенном добавлении
к смеси окрашенного раствора щелочи окраска фенолфталеина продолжает исчезать.
Аминогруппа в гликоколе может вступать в обычные
реакции первичной аминогруппы, может и связываться. Например, гликокол как
аминокислота, легко реагирует с формальдегидом в водном растворе по уравнению:
Н2С=О + H2NCH2COOH H2O + Н2С=N-СН2СООН.
Образующееся за счет аминогруппы производное гликокола
проявляет уже ясно выраженные кислотные свойства. После добавления
формальдегида основные свойства исчезают за счет блокировки аминогруппы.
Опыт 133. ДЕЙСТВИЕ АЗОТИСТОЙ КИСЛОТЫ НА АМИНОКИСЛОТЫ
Р е а к т и в ы: 1% раствор гликокола, 5% раствор нитрита
натрия, 8% раствор соляной кислоты.
В пробирке смешивают по 1 мл 5% раствора нитрита
натрия и гликокола, по каплям добавляют 8% раствор соляной кислоты (до кислой
среды). При встряхивании реакционной смеси выделяются пузырьки газа:
NaNO2 + HСl HNO2 + NaCl
NH2-СH2-СOOH + HONO HO-CH2-СOOH + N2 + H2О
Определяя количество выделяющегося азота, можно узнать
количество аминогрупп в аминокислотах.
Опыт 134. ОПРЕДЕЛЕНИЕ СТРУКТУРЫ МОЧЕВИНЫ
Р е а к т и в ы: мочевина, баритова вода, красная
лакмусовая бумага
В пробирку на высоту 5 мм помещают мочевину и
осторожно, не смачивая верхнюю часть пробирки, добавляют 10 капель баритовой
воды. Содержимое пробирки нагревают. Наблюдают выделение пузырьков газа и
образование белого осадка карбоната бария. Выделяющиеся пары окрашивают красную
лакмусовую бумагу в синий цвет, что указывает на выделение аммиака.
О
çç t °
H2N-C-NH2 + 2HOH
Н2СО3 + 2NН3
Н2СО3 СО2 + Н2О
СО2 + Ва(ОН)2 ВаСО3 + Н2О
Мочевина (диамид угольной кислоты) легко гидролизуется
в присутствии кислот, щелочей и воды (при кипячении) с образованием аммиака и
угольной кислоты. Способность амидов кислот легко подвергаться гидролизу резко
отличает их от аминокислот, у которых аминогруппа прочно связана с радикалом и
не гидролизуется.
Опыт 135. РАСТВОРИМОСТЬ МОЧЕВИНЫ И ЕЁ НИТРАТА В ВОДЕ
Р е а к т и в ы: мочевина, концентрированная азотная
кислота, красная лакмусовая бумага
В пробирку на высоту 5 мм помещают сухую мочевину и
добавляют 2 капли воды. Образуется прозрачный концентрированный раствор, что
подтверждает хорошую растворимость мочевины в воде. При нанесении капли
раствора на полоску красной лакмусовой бумаги видимых изменений не наблюдается.
Раствор мочевины нейтрален.
В пробирку с водным раствором мочевины добавляют 2-3
капли концентрированной азотной кислоты. Наблюдают выделение обильного
труднорастворимого в воде кристаллического осадка - нитрата мочевины:
О
ОH
çç ê
_
H2N-C-NH2
+ 2HNO3 H2N-C-NH2 NO3
+
Опыт 136. ОБРАЗОВАНИЕ ЩАВЕЛЕВОКИСЛОЙ СОЛИ МОЧЕВИНЫ
Р е а к т и в ы: мочевина, концентрированный раствор
щавелевой кислоты
В пробирке готовят насыщенный раствор щавелевой
кислоты и добавляют равный объем концентрированного раствора мочевины. Через
несколько секунд начинают выделяться кристаллы труднорастворимой щавелевой соли
мочевины. _
О
СООН О + СОО
çç ç
çç ç _
H2N-C-NH2 + СООН H2N-C-NH3 СОО
Опыт 137. РАЗЛОЖЕНИЕ МОЧЕВИНЫ АЗОТИСТОЙ КИСЛОТОЙ
Р е а к т и в ы: 1% раствор мочевины, 5 % раствор
нитрита натрия, концентрированная серная кислота
К 2 мл раствора мочевины добавляют равный объем
раствора нитрита натрия и 1 мл раствора серной кислоты. Содержимое пробирки
встряхивают и наблюдают бурное выделение пузырьков газа:
NaNO2
+ H2SO4 HNО2 + Na2SO4
О
çç
°
H2N-C-NH2 + 2HONO Н2СО3 + 2N2 + 2H2O
CO2 H2O
Данная реакция используется для количественного
определения мочевины путем измерения объема выделившегося азота.
Опыт 138. РАЗЛОЖЕНИЕ МОЧЕВИНЫ ГИПОБРОМИТОМ НАТРИЯ
Р е а к т и в ы: 1% раствор мочевины, 10% раствор
гидроксида натрия, бром
2NaOH + Br2 NaОBr + NaBr + H2ONCONH2 + NaОBr N2 + CO2 + NaBr + H2O
Реакция протекает количественно. Эта реакция лежит в
основе метода количественного определения мочевины по выделяющемуся азоту,
разработанного А.П.Бородиным.
Опыт 139. РАЗЛОЖЕНИЕ МОЧЕВИНЫ ПРИ НАГРЕВАНИИ
(образование биурета)
Реактивы: мочевина, красная лакмусовая бумага, 10%
раствор гидроксида калия, медный купорос
В сухой пробирке осторожно нагревают около 1 г
мочевины. Сначала мочевина плавится, затем наблюдается обильное выделение
аммиака, который обнаруживается по посинению красной лакмусовой бумаги. Плав
постепенно густеет и снова затвердевает, несмотря на продолжающееся нагревание.
На верхних холодных частях пробирки оседает незначительный белый налет. Охладив
пробирку, добавляют в нее 1-2 мл теплой воды, взбалтывают и сливают жидкость в
другую пробирку. К полученному раствору биурета добавляют 3-4 капли щелочи (до
прозрачности) и 1 каплю медного купороса. Появляется красивое характерное
розово-фиолетовое окрашивание.
При нагревании выше температуры плавления мочевина
распадается с выделением аммиака. При 150-160° 2 молекулы мочевины отщепляют 1
молекулу аммиака и дают хорошо растворимый в теплой воде биурет:
H2NCONH2 + H2NCONH2 NH3 + H2NCONHCONH2
Для биурета характерно образование в щелочном растворе
с солями меди комплексного соединения, имеющего в растворе гидроксида калия
следующий состав: (H2NCONHCONH2)2. KOH . Cu(OH)2.
Опыт 140. КОНДЕНСАЦИЯ МОЧЕВИНЫ С ФОРМАЛЬДЕГИДОМ
Р е а к т и в ы: мочевина, формалин
В сухой пробирке растворяют около 1 г мочевины в 1 мл
формалина. Полученный прозрачный раствор осторожно нагревают. Через короткое
время раствор мутнеет, образуется мочевиноформальдегидная смола.
Химизм происходящей реакции сложен. Один из возможных
механизмов ее состоит во взаимодействии мочевины с гидратной формой
формальдегида:
NH2 NНСН2ОН
/ HOCH2OH /
О=С +
О=С + Н2О
\ HOCH2OH \
NH2 NHCH2OH
Далее при нагревании в присутствии кислых
катализаторов протекает реакция поликонденсации мочевины с образующейся
диметилолмочевиной.
NH2 NН-СН2NHCONHCH2OH
/ HOCH2NHCONHCH2OH /
О=С +
О=С + Н2О
\ HOCH2NHCONHCH2OH \
NH2 NH-CH2NHCONHCH2OH
Мочевина и тиомочевина с формальдегидом вступают в
реакцию конденсации с образованием смолообразных продуктов - карбамидных смол.
Опыт 141. ВЗАИМОДЕЙСТВИЕ АЦЕТАМИДА СО ЩЕЛОЧЬЮ
Р е а к т и в ы: ацетамид, 10% раствор гидроксида
натрия, красная лакмусовая бумага
,2 г ацетамида помещают в пробирку, добавляют 2-3 мл
10%-ного раствора гидроксида натрия и кипятят. При кипячении выделяется аммиак,
который обнаруживается по запаху и по посинению красной лакмусовой бумаги:
CH3CONH2 + NaOH NH3 + CH3COONa
Амиды кислот характеризуются способностью отщеплять
аммиак при нагревании со щелочами и водными растворами кислот. Этим они
отличаются от аминов и аминокислот.
.15 ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
III.15.1
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ОДНИМ ГЕТЕРОАТОМОМ
Гетероциклическими соединениями называют органические вещества,
содержащие циклы, в состав которых помимо атомов углерода входят один или
несколько атомов других элементов - гетероатомов.
По размеру цикла различают трех-, четырех-, пяти-, шести- и семичленные
гетероциклы. В зависимости от природы гетероатоама гетероциклические соединения
подразделяют на кислород-, азот- и серусодержащие.
Пиррол, фуран и тиофен являются пятичленными гетероциклическими
соединениями с одним гетероатомом, их можно рассматривать как производные
бензола, в котором группировка -СН=СН- замещена на гетероатом.
Пиррол, фуран, тиофен можно получить следующими способами: а)
циклиза-цией 1,4-дикарбонильных соединений (синтез Пале-Кнорра), б) взаимным
превращением фурана, пиррола и тиофена (цикл реакций Юрьева). Следует отметить,
что пиррол, фуран и тиофен имеет и специфические способы получения. Так,
синтетически пиррол получают нагреванием диаммонийной соли слизевой кислоты или
же перегонкой сукцинимида с цинковой пылью. Сухой перегонкой слизевой кислоты в
лабораторных условиях получают фуран, в промышленности фуран получают при
нагревании альдопентоз с водоотнимающими средствами. Тиофен получают в
результате парофазной циклизации бутана с серой, а также по реакции Чичибабина
при пропускании смеси ацетилена с сероводородом над катализатором (Al2O3).
Реакционная способность пиррола, фурана и тиофена определяется наличием в
их структуре цикла с π-электроноизбыточной ароматической системой (шесть
р-электронов приходится на пять атомов цикла). Однако степень ароматичности
указанных гетероциклов ниже, чем у бензола, и зависит от природы гетероатома.
Так, в ряду фуран, пиррол и тиофен степень ароматичности увеличивается,
поскольку электроотрицательность атома серы меньше электроотрицательности
атомов азота и кислорода, доля участия неподеленной пары электронов атома серы
в образовании ароматического секстета молекулы тиофена больше, чем атома азота
в пирроле и атома кислорода в фуране.
Вследствие электроотрицательности гетероатома в молекулах пиррола, фурана
и тиофена, в отличие от бензола, электронная плотность распределена
неравномерно, в частности, на атомах углерода в α-положении плотность электронов выше,
чем в β-положении, что определяет
направленность протекания реакций электрофильного замещения.
Пиррол и фуран ацидофобны, то есть в присутствии сильных минеральных
кислот они осмоляются, образуя полимерные продукты. Ацидофобность обусловлена
присоединением протона, преимущественно к α-углеродному атому цикла, что приводит
к нарушению ароматичности кольца, затем происходит либо разрыв цикла с
образованием полимера, либо полимеризация образовавшейся диеновой структуры,
протекающая с сохранением цикла. Введение в фурановое и пиррольное ядро
электроноакцепторных заместителей приводит к снижению ацидофобности этих
соединений. Тиофен ацидофобностью не обладает.
Являясь π-избытычными ароматическими системами, пиррол, фуран, тиофен
легко вступают в характерные для ароматических соединений реакции
электрофильного замещения (нитрование, сульфирование, галогенирование,
ацилирование) в α-положение. Пиррол, фуран и тиофен вступают в реакции
окисления и восстановления.
Следует отметить, что для пиррола и фурана характерны и специфические
химические свойства. Так, являясь слабой NН-кислотой, пиррол взаимодействует с металлическими калием и
натрием, безводным гидроксидом калия, литием в жидком аммиаке, с амидами калия
и натрия, образуя соли. Соли пиррола являются реакционноспособными веществами и
широко используются в органическом синтезе для введения в молекулу пиррола
алкильных и ацильных заместителей, причем направления реакции зависит от
температуры: при температуре ниже 00С образуются соответственно N-алкил и N-ацилпирролы, а при нагревании α-алкил и α-ацилпирролы.
Занимая промежуточное положение между ароматическими соединениями и
1,3-диенами, фуран вступает в характерную для сопряженных диенов реакцию
Дильса-Альдера.
Пиррол, фуран, тиофен широко используются в органическом синтезе
лекарственных средств. Важнейшими производными пиррола являются - пирролидон-2,
порфин, индол; фурана - фурфурол и лекарственные препараты, полученные на его
основе: фурацилин, фурадонин, фуразолидон.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы следующих соединений: а) α-метилфуран, б) N-этилпиррол, в) тиофен, г) β-ацетилтиофен, д) пирролидин, е)
2,5-диметил-фуран, к) 2,5-диметил-2,5-дигидрофуран, л) a-бромтиофен, м) a,a/-диметил-пиррол.
2. Назовите следующие соединения:
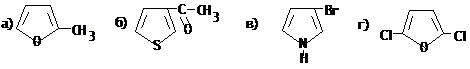
3. Получите 2,5-диметилфуран из 1,4-дикарбонильных соединений.
Напишите схемы получения пиррола и фурана из слизевой кислоты.
4. Приведите электронное строение пиррола, фурана, тиофена.
Ароматичность и ее критерии. Правило Хюккеля. Объясните, почему данные
гетероциклы являются p-избыточными
электронными системами и как это влияет на их реакционноспособность?
. Сравните отношение пиррола, фурана и тиофена к действию
минеральных кислот. Как влияет природа заместителя в гетероцикле на степень
ацидофобности?
. Почему пиррол, фуран и тиофен легче, чем бензол, вступают в
реакции электрофильного замещения? Напишите схемы реакций и назовите продукты
нитрования, сульфирования, галогенирования и ацилирования пиррола, фурана и тиофена.
. Напишите реакции взаимодействия пиррола со следующими
реагентами: а) NaNH2, б) H2 (Pt), в) H2 (Zn + CH3COOH). Назовите
полученные продукты.
. Сравните отношение к действию минеральных кислот пиррола,
пирролина и пирролидина. Какое из приведенных соединений обладает наиболее
выраженными основными свойствами? Ответ поясните.
. Напишите реакции взаимодействия пирролида калия со следующими
реагентами: а) СН3Сl, t < 00, б) CH3COCl, t, в) CO2 (t,p), г) [С6Н5N+≡N]Cl-. Назовите полученные продукты.
. Для фурфурола приведите реакции а) «серебряного зеркала», б)
восстанов-ления, в) нитрования, г) Канниццаро, д) взаимодействия с
фенилгидразином.
. Предложите схемы получения а) метилового эфира
пиррол-2-карбоновой кислоты из пиррола, б) 2-ацетил-5-нитрофурана из фурана.
Напишите уравнения реакций и назовите все продукты реакций.
. Напишите схемы реакций индола со следующими реагентами: а) КОН,
б) СН3СООNO2, в) C5H5N.SO3, г) [С6Н5N+≡N]Cl-, д) H2 (Pt). Назовите полученные продукты.
. Для 5-метил-2-фуранкарбальдегида напишите реакции а) окисления,
б) восста-новления, в) с анилином, г) с конц. раствором КОН.
. Сравните отношение к минеральным кислотам фурана и фурфурола,
причины неацидофобности фурфурола. Ответ поясните. Приведите реакции
нитрования, сульфирования фурана и фурфурола.
. Напишите реакции, подтверждающие наличие альдегидной группы в
молекуле фурфурола.
. Приведите последовательность реакций, позволяющих получить
фурацилин из фурфурола.
. С помощью каких реакций пиррол можно превратить в следующие
соединения:

18. Составьте уравнения по следующим схемам превращений:
NH3 (Al2O3,
t) NaNH2 CH3COCl, t < 00
а) фуран 1
2 3
СН3СООNO2
4
C5H5N.SО3
5
H+, t (CH3CO)2O
HNO3 H2O, H+ NH2NHCONH2
б) альдопентоза 1
2 3 4 5
-H2O
нитрование
3
Ag2O (NH3) t сульфирование
в) фурфурол 1
2 4
-CO2 галогенирование
5
ацилирование
6
2Zn
KOH C2H5Br, t
[O] CH3OH
г) сукцинимид 1 2
3 4 5
CH3COCl,
t<00
6
NH3
(Al2O3, t) H2S (Al2O3,
t) H2SO4
д) фуран
1 2 3
2H2, Pd
4
HNO3
5
ПРАКТИКУМ
Опыт 141. ПОЛУЧЕНИЕ И ОБНАРУЖЕНИЕ ФУРАНА
Р е а к т и в ы: слизевая кислота, концентрированная
соляная кислота, сосновая лучина
В сухую пробирку помещают около 0,5 г слизевой кислоты
и нагревают до разложения. Выделяющиеся при разложении слизевой кислоты пары
фурана обнаруживают с помощью сосновой лучины, смоченной концентрированной
хлороводородной кислотой. В парах фурана сосновая лучина окрашивается в зеленый
цвет:

Опыт 142. ПОЛУЧЕНИЕ И ОБНАРУЖЕНИЕ ПИРРОЛА
Р е а к т и в ы: слизевая кислота, концентрированный
раствор аммиака, глицерин, конц. соляная кислота
Опыт выполняют в вытяжном шкафу!
В пробирке смешивают около 0,5 г слизевой кислоты и 1
мл концентрированного раствора аммиака, затем, добавив 0,5 мл глицерина,
закрепляют её почти горизонтально в держателе штатива. Осторожно прогревают в
пламени горелки нижнюю часть пробирки. Сначала выделяются пары воды, затем
смесь пенится. Образующиеся летучие продукты обладают неприятным специфическим
запахом. Продолжая нагревание, в пробирку вносят сосновую лучину, смоченную
концентрированной соляной кислотой. Выделяющиеся пары пиррола окрашивают лучину
в ярко-красный цвет.
НООС-(СНОН)4-СООН + 2NH3 H4NOOC-(CHOH)4-COONH4

Опыт 143.
ПОЛУЧЕНИЕ ФУРФУРОЛА ИЗ ПЕНТОЗАНОВ
Р е а к т и в ы: древесные опилки, 1% раствор хлорида
железа (III), концентрированная соляная кислота
В пробирку помещают около 1 г растительного сырья
(древесные опилки, отруби, подсолнечная лузга или измельченные кукурузные
початки), добавляют 2 мл концентрированной соляной кислоты, 2 мл воды, 2-3
капли 1%-ного раствора хлорида железа (III) и помещают на водяную баню.
Растительное сырье содержит полисахариды - пентозаны
общей формулы (С5Н8О4)n,
которые при нагревании в кислой среде гидролизуются, образуя пентозы состава
С5Н10О5, чаще альдопентозы - ксилозу и арабинозу:
°
(C5H8O4)n + nH2О nC5HI0О5
Образующиеся альдопентозы подвергаются
внутримолекулярной дегидратации с образованием фурфурола:
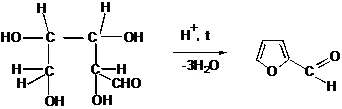
Для обнаружения фурфурола, в пробирку опускают полоску
фильтровальной бумаги, смоченную смесью анилина и ледяной уксусной кислотой
(1:1). В парах выделяющегося фурфурола полоска фильтровальной бумаги
окрашивается в розово-красный цвет, что объясняется образованием продукта конденсации
фурфурола с анилином, сопровождающимся раскрытием фуранового цикла.

Опыт 144. РАСТВОРЕНИЕ ФУРФУРОЛА В ВОДЕ
Р е а к т и в ы: фурфурол, вода
Смешивают 1 мл фурфурола и 4 мл воды. Смесь тщательно
взбалтывают до полного растворения фурфурола в воде (8:100). Водный раствор
фурфурола используют в последующих опытах.
Опыт 145. РЕАКЦИЯ ФУРФУРОЛА С ФУКСИНСЕРНИСТОЙ КИСЛОТОЙ
Р е а к т и в ы: свежеперегнанный фурфурол,
фуксинсернистая кислота
В пробирку помещают несколько капель фуксинсернистой
кислоты и 1-2 капли водного раствора фурфурола. Смесь перемешивают. Через
некоторое время появляется слабое розовое окрашивание.
Эта реакция является цветной качественной реакцией на
альдегидную группу.
Опыт 146. ОКИСЛЕНИЕ ФУРФУРОЛА
Р е а к т и в ы: водный раствор свежеперегнанного
фурфурола, 1% раствор нитрата серебра, 10% раствор аммиака
К 1 мл нитрата серебра осторожно по каплям добавляют
раствор аммиака до выпадения осадка гидроксида серебра и полного его
растворения. К полученному раствору добавляют несколько капель раствора
фурфурола - выпадает черный осадок серебра. Фурфурол при этом окисляется в
фуранкарбоновую (пирослизевую) кислоту.
Опыт 147. ВЗАИМОДЕЙСТВИЕ ФУРФУРОЛА С ФЕНИЛГИДРАЗИНОМ
Р е а к т и в ы: свежеперегнанный фурфурол,
свежеперегнанный фенилгидразин, концентрированная уксусная кислота
-2 капли свежеперегнанного фенилгидразина растворяют в
1 мл уксусной кислоты. К полученному раствору прибавляют по каплям фурфурол,
всё время взбалтывая смесь. Выпадает осадок фенилгидразона.
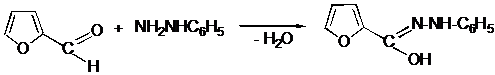
Опыт 148. ВЗАИМОДЕЙСТВИЕ ФУРФУРОЛА С АНИЛИНОМ
Р е а к т и в ы: свежеперегнанный фурфурол,
свежеперегнанный анилин, концентрированная уксусная кислота, этиловый спирт.
На часовом стекле смешивают 1 каплю анилина с 1 каплей
уксусной кислоты, к смеси добавляют по 1 капле фурфурола и спирта. При стоянии
появляется розово-красное окрашивание и выпадает осадок фиолетового цвета.
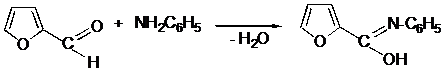
III.15.2
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ ГЕТЕРОАТОМАМИ (ДИАЗОЛЫ)
Важнейшими представителями большого класса пятичленных гетероциклов с
двумя гетероатомами являются пиразол, имидазол. Поскольку в этих соединениях,
один из двух гетероатомов является азот, они получили общее название азолы.
В природе пиразол и его производные не встречаются, из синтетических
способов получения наиболее важными являются: а) присоединение диазоалканов к
ацетиленам, б) взаимодействие гидразина, алкил- или арилгидразинов с
1,3-дикарбонильными соединениями. Имидазол и его производные чаще получают
взаимодействием 1,2-дикарбонильных соединений, аммиака и альдегидов.
По реакционной способности пиразол и имидазол схожи друг с другом, для
них характерны кислотно-основные свойства за счет атомов азота пиррольного и
пиридинового типов. За счет атома азота пиридинового типа пиразол и имидазол
проявляют основные свойства, за счет азота пиррольного типа - слабые кислотные
свойства, то есть они являются амфотерными соединениями и способны вступать в
реакции, как с минеральными кислотами, так и со щелочами, образуя при этом
соли. Однако, имидазол по сравнению с пиразолом является более сильным
основанием.
Наличие в молекулах пиразола и имидазола подвижного атома водорода NH-группы и основного центра - атома
азота пиридинового типа является причиной появления прототропной (азольной)
таутомерии. Прототропная таутомерия обусловлена перемещением атома водорода NН-группы к атому азота пиридинового
типа. В результате таутомерных превращений положения 3 и 5 в молекуле пиразола,
4 и 5 в молекуле имидазола равноценны.
В силу электроноакцепторного влияния атома азота пиридинового типа
реакционная способность пиразола и имидазола с электрофильными реагентами
понижена, при этом направление реакций зависит от природы атакующего реагента и
условий их проведения. Алкилирование и ацилирование пиразола и имидазола
протекает обычно с образованием продуктов N-замещения. Для пиразола характерны также реакции
восстановления: при восстановлении пиразола водородом в момент выделения
образуется частично гидрированный продукт - пиразолин, в присутствии
катализатора - полностью гидрированный пиразолидин. Имидазол устойчив к
действию окислителей и восстановителей.
Одним из важнейшим производным пиразола является пиразолон-5, которое
является таутомерным веществом и может существовать в СН2-, ОН- и NН-форме. Ядро пиразолона-5 входит в
структуру ряда лекарственных препаратов, в частности антипирина, амидопирина и
анальгина. К важнейшим производным имидазола относят такие природные соединения
как алкалоид пилокарпин, α-аминокислота - гистидин и биогенный амин - гистамин.
Бензимидазол представляет собой конденсированную гетероциклическую
систему, состоящую из бензольного и имидазольного колец. Получают его при
нагревании о-фенилендиамина (1,2-диаминобензола) с муравьиной кислотой. По
химическим свойствам бензимидазол во многом напоминает имидазол. В частности,
для него характерны амфотерные свойства, прототропная таутомерия, реакции
алкилирования с участием атома азота. Однако реакции электрофильного замещения
(нитрование, сульфирование) протекают с большим трудом, вследствие влияния
бензольного кольца. Бензимидазольный цикл входит в состав некоторых природных
веществ (витамин В12), а также синтетических лекарственных препаратов,
например, дибазола.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
соединения: а) 4-аминопиразол, б) 2,4-диме-тилтиазол, в)
имидазол-4-сульфокислота, г) 4-нитро-5-метилоксазол, д) 1,2-ди-азол, е)
1,3-тиазол, ж) 1,2-оксазол, з) 2,3-диметил-1-фенилпиразолон-5.
2. Назовите приведенные соединения:
1. Приведите электронное строение
пиразола, имидазола. Укажите пиридиновый и пиррольный атомы азота. Объяснить
ароматичность приведенных соединений.
2. Приведите схемы азольной таутомерии
3-метилпиразола, 5-метилимидазола и укажите равноценные положения в циклах.
3. Напишите схемы реакций,
подтверждающие амфотерный характер пиразола и имидазола.
4. Объясните, какое влияние на
химические свойства оказывает атом пиридинового типа в молекуле пиразола и
имидазола.
5. Напишите уравнения реакций пиразола и
имидазола со следующими реагентами: а) HCl, б) KOH,
в) CH3I, г) CH3COCl, д) конц. HNО3, е) Cl2.
Назовите полученные продукты.
6. Сравните кислотные и основные
свойства имидазола и бензимидазола. Ответ поясните. Приведите схему таутомерных
превращений бензимидазола.
7. Объясните причины появления
прототропной (азольной) таутомерии.
8. Напишите таутомерные формы
пиразолона-5. В основе каких лекарственных препаратов лежит структура
пиразолона-5.
9. Напишите схемы последовательных
превращений, позволяющих, исходя из ацетоуксусного эфира и фенилгидразина,
осуществить синтез антипирина и амидопирина.
10.Изобразите
структурные формулы и укажите химические названия производных пиразолона-5 -
антипирина, амидопирина и анальгина. С помощью каких реакций можно их отличить
друг от друга.
11.Объясните,
почему имидазол и пиразол в отличие от пиррола можно сульфировать и нитровать в
сильнокислой среде.
12.Сравните
кислотные свойства имидазола и пиррола. Напишите схему реакций, доказывающие
кислотные свойства этих соединений.
13.Напишите схемы
реакции пиррола, пиразола и имидазола с металлическим калием и с амидом натрия.
14.Напишите
реакции алкилирования и ацилирования имидазола.
15.Составьте
уравнения по следующим схемам превращений:
NaNO2 [Н] C6H5CHO (СH3)2SO4 HC(O)H, NaHSO3
а) антипирин
1 2 3
4 5
-HCl
-H2O
HCl
2
HCOOH, t NaOH
б) о-фенилендиамин
1 3
конц. HNO3,
t
4
5
СH3Cl
2
СН≡СН
Cl2
в) диазометан
1 3
C2H5OH + Na
4
5
ПРАКТИКУМ
Опыт 149. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНТИПИРИН
Р е а к т и в ы: антипирин, 1% раствор хлорида железа (III), 10% раствор нитрита натрия,
разбавленная серная кислота

В двух пробирках в 4 каплях воды растворяют несколько кристалликов
антипирина. В одну пробирку добавляют 1 каплю 1%-ного раствора хлорида железа (III), во вторую - 1 каплю 10%-ного раствора
нитрита натрия и 3 капли разбавленной серной кислоты. В первой пробирке
наблюдают появление интенсивно-оранжевого окрашивания, обусловленного
образованием комплексного соединения - ферропирина, во второй -
изумрудно-зеленого окрашивания, обусловленного образованием
4-нитрозоантипирина:

Опыт 150. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИДОПИРИН
Р е а к т и в ы: амидопирин, 1% раствор хлорида железа (III), разбавленная соляная кислота,
свежеприготовленный раствор гексацианоферрата (III) калия
В двух пробирках в 4 каплях воды растворяют несколько кристалликов
амидопирина. В одну пробирку добавляют 1 каплю 1%-ного раствора хлорида железа
(III), во вторую - 10 капель
свежеприготовленного раствора гексацианоферрата (III) калия и 1 каплю 1%-ного раствора хлорида железа (III). В первой пробирке появляется
синее, быстро исчезающее окрашивание, в пробирку добавляют ещё 3 капли 1%-ного
раствора хлорида железа (III) -
образуется хлопьевидный коричневый осадок. При последующем подкислении содержимого
пробирки 2 каплями разбавленной соляной кислоты, осадок растворяется, а раствор
приобретает неисчезающее интенсивное сине-фиолетовое окрашивание (отличительная
реакция амидопирина от анальгина).
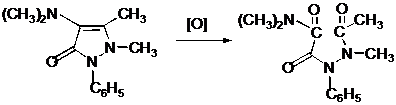

Во второй пробирке наблюдают появление темно-синего окрашивания раствора,
обусловленного образованием берлинской лазури (отличительная реакция
амидопирина от антипирина).
Опыт 151. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНАЛЬГИН
Р е а к т и в ы: анальгин, 1% раствор хлорида железа (III), 10% раствор соляной кислоты
В двух пробирках в 4 каплях воды растворяют несколько кристалликов
анальгина. В одну пробирку добавляют 1 каплю 1%-ного раствора хлорида железа (III), во вторую - 4 капли 10%-ного раствора
соляной кислоты. В первой пробирке наблюдают появление темно-синего
окрашивания, переходящего в темно-зеленое, а затем в желтое.
Во второй пробирке при нагревании в течение 2 минут на водяной бане
ощущают резкий запах оксида серы (IV) и формальдегида:

Затем в пробирку к охлажденному раствору добавляют 2 капли 1%-ного
раствора хлорида железа (III).
Наблюдают постепенное появление желто-красного окрашивания (отличительная
реакция анальгина от других препаратов группы пиразолона-5)
III.16
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
III.16.1
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ОДНИМ ГЕТЕРОАТОМОМ
Важнейшими представителями шестичленных гетероциклов с одним гетероатомом
являются пиридин, хинолин, изохинолин, акридин.
Пиридин можно рассматривать как аналог бензола, в молекуле которого
СН-группа замещена атомом азота.
Для названия производных пиридина осуществляют нумерацию атомов цикла или
используют обозначения греческими буквами α, β, γ.
Пиридин и его монометильные производные α-,
β-, γ-пиколины
содержатся в небольших количествах в каменноугольной смоле, из которой их
выделяют в индивидульном виде. Кроме того, существуют и синтетические способы
их получения, основанные на реакции конденсации альдегидов с аммиаком. Так, из
уксусного альдегида и аммиака при 4000С в присутствии катализатора Al2O3 образуется смесь 2- и 4-метилпиридинов, при нагревании
акролеина с аммиаком образуется β-пиколин, конденсацией ацетальдегида и
формальдегида с аммиаком получают пиридин.
По строению пиридин имеет сходство с бензолом. Как и бензол, является
ароматическим соединением, содержащим циклическую 6π-электронную сопряженную систему.
Неподеленная пара электронов атома азота не участвует в образовании
ароматического секстета и обусловливает основные свойства пиридин. Однако, в
отличие от бензола, в молекуле пиридина электронная плотность распределена
неравномерно, вследствие электроноакцепторного влияния атома азота в
пиридиновом цикле на всех углеродных атомах электронная плотность понижена,
причем в большой степени - в положениях 2,4,6 (α- и γ-положения), в меньшей - в положениях
3 и 5 (β-положения). То есть пиридин является π-дефицитной ароматической системой.
Характерные для пиридина реакции можно условно разделить на три группы:
· реакции, протекающие с участием гетероатома: взаимодействие с
кислотами, с оксидом серы (IV), с
алкил- и ацилгалогенидами;
· реакции замещения атомов водорода пиридинового цикла: реакции
электрофильного и нуклеофильного замещения;
· реакции восстановления и окисления.
Следует отметить, что реакции электрофильного замещения в пиридиновом
цикле протекают в β-положение и идут с большим трудом, чем в бензоле. Так,
нитрование, сульфирование и галогенирование происходят только в жестких
условиях. В отличие от бензола пиридин достаточно легко реагирует с
нуклеофильными реагентами в α-, γ-положения.
Реакции восстановления протекают в пиридине легче, чем в бензоле. Однако
пиридиновое кольцо устойчиво к действию окислителей, под действием
пероксикислот пиридиновый цикл окисляется по атому азота с образованием N-оксидов. Вследствие некоторого
электронодонорного эффекта атома кислорода, реакции электрофильного замещения
протекают легче, чем в пиридине и идут по α-, γ-положениям.
Важнейшими производными пиридина являются его монометильные производные -
α-,
β-, γ-пиколины,
гидрокси- и аминопиридины, пиридинкарбоновые кислоты.
Химические свойства пиколинов и пиридина сходны. Как и пиридин, они
образуют соли с сильными кислотами и алкилгалогенидами, окисляются и
восстанавливаются.
α- и γ-гидроксипиридины имеют таутомерные
формы - гидрокси- и оксоформы. В водном растворе эти соединения находятся
преимущественно в оксо-, или так называемой пиридоновой, форме, а в неполярных
растворителях и в газовой фазе преобладает гидроксиформа. β-Гидроксипиридин в водном растворе
существует в нейтральной и биполярной формах. Гидроксипиридины являются
бифункциональными соединениями. По гетероатому они проявляют свойства пиридина,
по гидроксигруппе - свойства фенола. Реакции электрофильного замещения
(нитрование, сульфирование, галогенирование) в 2- и 4-гидроксипиридинах
протекают по положениям 3 и 5, в 3-гидроксипиридине - по положению 2. Многие
производные гидроксипиридинов применяются в медицине, представителем этой
группы является пиридоксин (витамин В6).
Аминопиридины являются более сильными основаниями, чем пиридин и анилин. α-,
γ-Аминонопиридины,
как и гидроксипиридины могут существовать в двух таутомерных формах - аминной и
иминной, более устойчивой является аминоформа. Реакционная способность
аминопиридинов зависит от положения аминогруппы в пиридиновом кольце.
3-Аминопиридин обладает свойствами, характерными для ароматических аминов, с
участием аминогруппы он вступает в реакции алкилирования, ацилирования,
диазотирования. 2- и 4-аминопиридины в обычных условиях солей диазония не
образуют, с галогеналканами реагируют по атому азота пиридинового цикла. По
пиридиновому кольцу для аминопиридинов характерны реакции электрофильного
замещения. α-Аминопиридин в реакциях электрофильного замещения образует
продукты преимущественно в положении 5, β-аминопиридин - в положении 2, γ-аминопиридин - в положении 3.
Широкое применение в синтезе лекарственных препаратов находят
пиридинкарбоновые кислоты. Так, никотиновая (3-пиридинкарбоновая) кислота и ее
амид известны как две формы витамина РР, на основе производных изоникотиновой
(4-пиридинкарбоновой) кислоты созданы лекарственные препараты против
туберкулеза - изониазид и фтивазид. Пиридинкарбоновые кислоты являются
бифункциональными соединениями. По карбоксильной группе они образуют соли,
галогенангидриды, сложные эфиры, амиды; по пиридиновому кольцу протекают
реакции свойственные пиридину. Вследствие наличия в структуре молекул
кислотного и основного центров, пиридинкарбоновые кислоты являются амфотерными веществами.
К шестичленным гетероциклам с одним гетероатомом относятся и хинолин.
Хинолин представляет собой конденсированную гетероциклическую систему,
состоящую из пиридинового и бензольного колец. Из способов синтеза хинолина и
его производных наиболее важными являются синтез Скраупа и синтез
Дебнера-Миллера.
По химическим свойствам хинолин напоминает пиридин. Для него характерны
реакции с участием гетероатома, реакции электрофильного и нуклеофильного
замещения атомов водорода хинолинового ядра, а также реакции окисления и
восстановления. Реакции электрофильного замещения в молекуле хинолина легче
протекают в бензольном кольце преимущественно в положениях 5 и 8, а реакции
нуклеофильного замещения - в пиридиновом кольце в положении 2. Восстановление
хинолина протекает в первую очередь в пиридиновом ядре, окисление - в
бензольном. Это обусловлено тем, что из-за электроноакцептор-ного влияния
гетероатома в молекуле хинолина электронная плотность распределена
неравномерно: в пиридиновом кольце она ниже, чем в бензольном.
Хинолиновое ядро является структурным фрагментом некоторых алкалоидов и
лекарственных средств (хинозол, нитроксолин, энтеросептол).
КОНТРОЛЬНЫЕ
ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите формулы строения следующих
соединений: а) 3-метилпиридин, б) 2-аминопиридин, в) N-оксид пиридина, г) пиридинийсульфат, д) g-пиколин, е) 5-винил-2-метилпиридин,
к) 2-метилхинолин, л) N-ацетилпиридинийхлорид.
2. Назовите следующие соединения:
1. Напишите схемы получения пиридина из
а) ацетилена и циановодородной кислоты, б) соответствующих альдегидов и
аммиака.
2. Отметьте сходство и различие в
строении, свойства пиридина и бензола. Приведите примеры реакции. Объясните,
почему пиридин не вступает в реакцию алкилирования и ацилирования по
Фриделю-Крафтсу.
3. Сравните реакционную способность
пиррола и пиридина. Объясните различное отношение циклов к действию минеральных
кислот.
4. Напишите реакции бромирования,
нитрования и сульфирования пиридина. Укажите условия реакций, а также
дезактивации пиридинового цикла в случае с протонными реагентами.
5. Приведите схему получения N-оксида пиридина. Сравните отношение
пиридина и N-оксида пиридина к действию
электрофильных и нуклеофильных реагентов. Напишите схемы нитрования,
сульфирования, аминирования, гидроксилирования и ацилирования N-оксида пиридина.
6. Приведите схемы получения a, b, g-гидроксипиридинов
из пиридина. Напишите возможные таутомерные превращения гидроксипиридинов.
7. Приведите схемы получения a, b, g-аминопиридинов
из пиридина. Напишите возможные таутомерные превращения аминопиридинов.
8. Охарактеризуйте основные центры в
молекулах аминопиридинов. Напишите схемы взаимодействия a, b, g-аминопиридинов
со следующими реагентами: 1) хлороводородная кислота, 2) йодметан, 3)
ацетилхлорид. Назовите продукты реакций.
9. Напишите реакции взаимодействия
2-метилпиридина со следующими реагентами: а) амидом натрия с последующим
алкилированием йодметаном, б) хлороводородной кислотой, перманганатом калия, в)
бензальдегидом в присутствии хлорида цинка при нагревании.
10.Из b-пиколина получите а) никотинамид
(витамин РР), б) N,N-диэтиламид никотиновой кислоты
(кордиамин).
11.Приведите схему
получения а) изониазида (гидрозид изоникотиновой кислоты), б) фтивaзида.
12.Напишите схемы
реакций никотиновой кислоты со следующими реагентами: 1) НСl, 2) СН3I, 3) СН3СOСl, 4) NаОН (Н2О), 5) С2Н5ОН (Н+), 6) SОСl2, 7) NН3, 8) t0 , ОН-. Назовите продукты.
13.Используя
синтез Скраупа, напишите схемы получения следующих соединений: 1)
8-гидроксихинолина, 2) 5-метокси-8-нитрохинолина, 3) 8-гидрокси-5-нитрохинолина.
14.Обладает ли
8-гидроксихинолин амфотерным характером? Напишите схемы реакций
8-гидроксихинолина с раствором серной кислоты, солями меди (II) и железа (III). Назовите продукты и укажите их применение.
15.Напишите схемы
взаимодействия хинолина со следующими реагентами: а) HCl, б) H2SO4 (на холоду), в) CH3I, г) NaNH2,
д) KOH. Назовите продукты.
16.Напишите схемы
реакций никотиновой кислоты со следующими реагентами: 1) НСl, 2) СН3I, 3) СН3СOСl, 4) NаОН (Н2О), 5) С2Н5ОН (Н+), 6) SОСl2, 7) NН3, 8) t0 , ОН-. Назовите продукты.
17.Составьте
уравнения реакция по следующим схемам превращений:
HCl
3
Br2, SO3,
t 2NH3 CH3COCl
а) пиридин
1 2 4
NaNH2,
HCl
5
CH3COCl
2
HCN, t, Co
(II) SO3
б) 2СН≡СН
1 3
NaNH2
4
KNO3, конц. H2SO4
5
CH3Cl
2
СН3СООН+Н2О2
конц.HNО3
в) пиридин
1 3
NaNH2
4
РСl3,
5
ПРАКТИКУМ
Опыт 152. РАСТВОРЕНИЕ ПИРИДИНА В ВОДЕ
Р е а к т и в ы: пиридин
В пробирке смешивают 2 капли пиридина и 10 капель
воды. Ощущается характерный запах пиридина. Наблюдают образование гомогенного
раствора, который используют для проведения последующих опытов. Пиридин
смешивается с водой в любых соотношениях, взаимодействуя с ней:
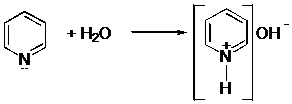
Опыт 153. ОПРЕДЕЛЕНИЕ ОСНОВНОГО ХАРАКТЕРА ПИРИДИНА
Р е а к т и в ы: водный раствор пиридина, красная
лакмусовая бумага
Красную лакмусовую бумагу помещают на предметное
стекло и наносят на нее с помощью стеклянной палочки 1 каплю водного раствора
пиридина. Наблюдают появление синего окрашивания лакмусовой бумаги. Водный
раствор пиридина имеет щелочную реакцию.
Опыт 154. ВЗАИМОДЕЙСТВИЕ ПИРИДИНА С ХЛОРИДОМ ЖЕЛЕЗА (III)
Р е а к т и в ы: водный раствор пиридина, 1% раствор
хлорида железа (III)
В пробирку помещают 1 мл водного раствора пиридина,
приливают и 0,5 мл 1%-ного раствора хлорида железа (III). Наблюдают образование буро-коричневого осадка
гидроксида железа (III):

Опыт 155. ДЕЙСТВИЕ ОКИСЛИТЕЛЕЙ НА ПИРИДИН
Р е а к т и в ы: водный раствор пиридина, 1% раствор
перманганата калия, 10% раствор карбоната натрия
В пробирку помещают смесь равных количеств водного
раствора пиридина, 1% раствора перманганата калия и 10% раствор карбоната
натрия. Смесь тщательно встряхивают. Обесцвечивание раствора перманганата калия
не наблюдается, окраска раствора не исчезает и при нагревании смеси до кипения.
Пиридин устойчив к действию окислителей.
Опыт 156. ВЗАИМОДЕЙСТВИЕ ПИРИДИНА С ПИКРИНОВОЙ
КИСЛОТОЙ
Р е а к т и в ы: водный раствор пиридина, насыщенный водный
раствор пикриновой кислоты
В пробирку помещают 1 каплю водного раствора пиридина
и 2 капли насыщенного водного раствора пикриновой кислоты. Содержимое пробирки
встряхивают и наблюдают образование желтых игольчатых кристаллов пикрата
пиридиния:

Полученный кристаллический осадок соли растворим в
избытке пиридина.
Опыт 157. ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ АММОНИЕВОЙ СОЛИ
ПИРИДИНА
Р е а к т и в ы: пиридин, йодметан
В пробирку помещают 2 капли пиридина и йодметана.
Однородная смесь разогревается, желтеет, мутнеет и расслаивается. Наблюдают
выделение быстро твердеющего масла:

Опыт
158. РАСТВОРИМОСТЬ ХИНОЛИНА В ВОДЕ
Р
е а к т и в ы: хинолин
К
0,5 мл хинолина добавляют 3 мл воды, содержимое пробирки энергично встряхивают.
Хинолин малорастворим в холодной воде (6:100). После отстаивания
водно-хинолиновой смеси тяжелые капли хинолина опускаются на дно пробирки, а
водный раствор сливают для проведения опытов.
Опыт
159. ОСНОВНЫЕ СВОЙСТВА ХИНОЛИНА
Р
е а к т и в ы: хинолин, концентрированная соляная кислота, 10% раствор
гидроксида натрия
В
пробирку помещают 2-3 капли хинолина и по каплям при встряхивании до получения
гомогенного раствора добавляют концентрированную соляную кислоту:
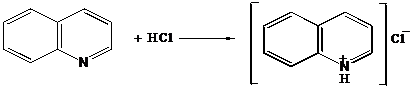
Хинолин
при взаимодействии с сильными кислотами образует хорошо растворимые в воде
соли. При добавлении в пробирку нескольких капель 10%-ного раствора гидроксида
натрия наблюдают выделение капель хинолина:
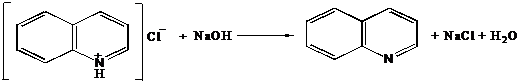
Хинолин
подобно пиридину, является слабым третичным основанием (К=1.10-9). С сильными
минеральными кислотами он образует растворимые в воде соли. Щелочи разлагают
эти соли.
Опыт
160. ДЕЙСТВИЕ ОКИСЛИТЕЛЕЙ НА ХИНОЛИН
Р
е а к т и в ы: водный раствор хинолина, 2% раствор перманганата калия, 5%
раствор гидрокарбоната натрия.
В пробирку помещают 0,2 мл насыщенного водного
раствора хинолина, по 2 капли 2%-ного раствора перманганата калия и 5%-ного
раствора гидрокарбоната калия. Содержимое пробирки встряхивают и нагревают в
пламени горелки. Наблюдают обесцвечивание раствора:

Опыт 161. ВЗАИМОДЕЙСТВИЕ ХИНОЛИНА С ПИКРИНОВОЙ
КИСЛОТОЙ
Р е а к т и в ы: водный раствор хинолина, насыщенный
водный раствор пикриновой кислоты
В пробирку помещают 1 каплю водного раствора хинолина
и 2 капли насыщенного водного раствора пикриновой кислоты. Содержимое пробирки
встряхивают и наблюдают образование желтых игольчатых кристаллов пикрата
хинолиния:

Опыт
162. ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ АММОНИЕВОЙ СОЛИ ХИНОЛИНА
Р
е а к т и в ы: хинолин, йодметан
В
пробирку помещают 2 капли хинолина и йодметана. Однородная смесь разогревается,
желтеет, мутнеет и расслаивается. Наблюдают выделение быстро твердеющего масла:
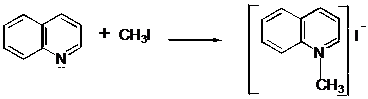
III.16.2
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ ГЕТЕРОАТОМАМИ (ДИАЗИНЫ)
Диазинами называют шестичленные гетероциклы, содержащие в качестве
гетероатомов два атома азота. Существует три изомерных диазина - пиридазин
(1,2-диазин), пиримидин (1,3-диазин) и пиразин (1,3-диазин).
Пиридазин и его производные получают конденсацией гидразина с насыщенными
или ненасыщенными 1,4-дикарбонильными соединениями. Преимущество этого способа
заключается в том, что образующийся продукт не требует дальнейшего окисления.
Пиримидин и его производные получают конденсацией мочевины с
1,3-ди-карбонильными соединениями. Так, при взаимодействии мочевины с малоновым
эфиром в присутствии этилата натрия образуется производное пиримидина -
барбитуровая кислота, которая существует в оксо- и гидроксиформе. Для получения
пиримидина барбитуровую кислоту действием хлороксида или пентаоксида фосфора
превращают в 2,4,6-трихлорпиримидин, который затем восстанавливают.
Пиразин и его производные получают конденсацией 1,2-диаминов с
1,2-ди-карбонильными соединениями.
По строению и свойствам пиридазин, пиримидин и пиразин во многом
напоминают пиридин. Подобно пиридину, молекулы пиридазина, пиримидина и
пиразина имеют в своем составе замкнутую сопряженную систему из 6π-электронов и обладают ароматическим
характером. Неподеленные пары электронов атомов азота не участвуют в сопряжении
и придают диазинам основные свойства. Из-за дезактивирующего влияния атомов
азота друг на друга, пиридазин, пиримидин и пиразин являются более слабыми
основаниями, чем пиридин. По этой причине диазины, несмотря на наличие двух
основных центров, образуют соли только с одним эквивалентом минеральной
кислоты.
Наличие в структуре молекул пиридазина, пиримидина и пиразина двух атомов
азота пиридинового типа приводит к значительному понижению электронной
плотности на атомах углерода диазинового цикла. Поэтому диазины характеризуются
очень низкой реакционной способностью в реакциях электрофильного замещения и,
наоборот, высокой активностью в реакциях нуклеофильного замещения. Реакции
электрофильного замещения возможны только тогда, когда диазиновый цикл
активирован электронодонорными группами (NH2, ОН и др.).
Среди производных пиримидина важную биологическую роль выполняют
гидрокси- и аминопиримидины. Они входят в состав нуклеиновых кислот, витамино,
антибиотиков, лекарственных препаратов.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1 Напишите структурные формулы
следующих соединений: а) 1,2-диазин, б) 2,4,6-тригидроксипиримидин, в) N-оксид пиразина, г) пиперазин, д)
урацил, е) тимин, к) цитозин.
2 Назовите приведенные соединения:
1 Напишите схемы последовательных
химических превращений, позволяющих получить: а) пиримидин из малонового эфира
и мочевины, б) пиразин из этилендиамина и глиоксаля. Назовите промежуточные
продукты.
2 Сравните реакционную способность
пиримидина и пиридина в реакциях электрофильного и нуклеофильного замещения.
Объясните имеющиеся различия. Напишите соответствующие уравнения реакций.
3 Приведите схему получения
барбитуровой кислоты, напишите возможные таутомерные превращения. Приведите
реакцию взаимодействия барбитуровой кислоты с гидроксидом натрия.
4 Охарактеризуйте электронное строение
пиридазина, пиримидина и пиразина. Объясните, почему эти соединения, несмотря
на наличие двух основных центров, образуют соли только с одним эквивалентом
кислоты.
5 Наличие каких электродонорных
заместителей в молекуле пиримидина способствует протеканию реакции SE. Напишите схему нитрования
2-амино-гидроксипиримидина и бромирование 2-аминопиримидина.
6 Напишите схемы таутомерных
превращений урацила, тимина и цитозина. Назовите вид таутомерии.
7 Приведите схему получения
барбитуровой кислоты из малонового эфира и мочевины. Напишите возможные
таутомерные превращения барбитуровой кислоты.
8 Напишите схемы и назовите продукты
реакций барбитуровой кислоты и 5,5-диэтилбарбитуровой кислоты с гидроксидом
натрия.
9 Составьте уравнения по следующим
схемам превращений
С2Н5ОNa C2H5I C2H5ONa C2H5I мочевина NaOH
а) малоновый
эфир 1 2 3
4 5 6
-С2Н5ОН -С2Н5ОН
-С2Н5ОNa
NaNH2, NH3
4
Br2 4NH3 О=CH-НC=O [O]
CH3COOОH
б) СН2
= СН2 1 2
3 5
-2H2O -H2O [H]
6
HCl
2
NH2NH2
CH3I
в) малеиндиальдегид
1 3
H2,
Ni
4
ПРАКТИКУМ
Опыт 163. СПЛАВЛЕНИЕ ПРОИЗВОДНЫХ БАРБИТУРОВОЙ КИСЛОТЫ С ГИДРОКСИДОМ
НАТРИЯ
Р е а к т и в ы: барбитал (5,5-диэтилбарбитуровая кислота),
кристаллический гидроксид натрия, разбавленная серная кислота
Опыт выполняют в вытяжном шкафу!
В ступку помещают лопатку барбитала и двойное количество кристаллического
гидроксида натрия. Смесь тщательно растирают, переносят в тигель и сплавляют.
Ощущают характерный запах аммиака. Выделяющиеся пары аммиака окрашивают красную
лакмусовую бумагу, смоченную водой в синий цвет:

Полученный
сплав растворяют в воде и подкисляют разбавленной серной кислотой. Наблюдают
выделение пузырьков газа оксида углерода (IV) и ощущают
запах прогорклого масла (свободная диэтилуксусная кислота):
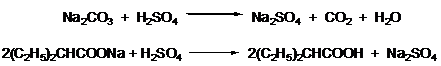
Данная
реакция подтверждает строение производных барбитуровой кислоты как циклических
уреидов, которые при сплавлении с кристаллическим гидроксидом натрия
подвергаются расщеплению.
Опыт
164. ВЗАИМОДЕЙСТВИЕ БАРБИТУРАТОВ С РАСТВОРОМ ГИДРОКСИДА НАТРИЯ
Р
е а к т и в ы: барбитал, 10% раствор гидроксида натрия
В
пробирку на кончике шпателя помещают барбитал и 1 мл воды. Содержимое пробирки
встряхивают и к полученной суспензии приливают 1 мл 10%-ного раствора
гидроксида натрия. Раствор становится прозрачным, что обусловлено образованием
водорастворимых моно-, динатриевой солей 5,5-ди-этилбарбитуровой кислоты.
Динатриевая соль 5,5-диэтилбарбитуровой кислоты в водном растворе
гидролизуется. Равновесие в реакции смещено в сторону образования мононатриевой
соли 5,5-диэтилбарбитуровой кислоты:

Опыт
165. ВЗАИМОДЕЙСТВИЕ БАРБИТУРАТОВ С НИТРАТОМ СЕРЕБРА
Р
е а к т и в ы: барбитал, 10% раствор гидроксида натрия, 2% раствор нитрата
серебра
В
пробирку на кончике шпателя помещают барбитал и 2 мл 10%-ного раствора
гидроксида натрия. Смесь энергично встряхивают и фильтруют. К полученному
фильтрату по каплям прибавляют 2%-ный раствор нитрата серебра. Наблюдают
образование белого осадка моносеребряной соли барбитала, исчезающего при
встряхивании раствора:

Растворение
однозамещенной серебряной соли барбитала обусловлено присутствием в растворе
мононатриевой соли и образованием растворимой серебряно-натриевой соли
барбитала:
При
последующем добавлении 2%-ного раствора нитрата серебра наблюдают выделение
белого осадка дисеребряной соли барбитала, не исчезающего при встряхивании:
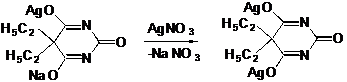
Данная
реакция является общегрупповой и позволяет подтвердить подлинность
лекарственных препаратов - производных барбитуровой кислоты.
III.17
КОНДЕНСИРОВАННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Важное
значение из группы конденсированных гетероциклов имеет пурин и его производные.
Пурин представляет собой конденсированную гетероциклическую систему, состоящую
из пиримидинового и имидазольного колец.
Пурин
и его производные чаще получают конденсацией 4,5-диамино-пиримидинов с
карбоновыми кислотами (метод Траубе).
Пурин
является ароматическим соединением. Его молекула имеет плоское строение и
содержит замкнутую сопряженную систему, состоящую из 10π-электронов. Наличие в структуре пурина имидазольного
кольца сообщает ему ряд свойств, характерных для имидазола, так, пурину
свойственна азольная таутомерия. Аналогично имидазолу, пурин является
амфотерным соединением и образует соли с сильными кислотами и основаниями.
Атомы азота пиримидинового цикла, вследствие электроноакцепторного влияния друг
на друга, не протонируются сильными кислотами.
Наиболее
важными производными пурина являются оксо- и аминопурины. Представителями
оксопуринов являются мочевая кислота (2,6,8-тригидрокси-пурин), ксантин
(2,6-дигидроксипурин) и гипоксантин (6-гидроксипурин). Эти соединения
образуются в организме в процессе превращения нуклеиновых кислот. Мочевая
кислота, ксантин и гипоксантин в результате лактам-лактимной таутомерии
существуют в двух таутомерных формах - оксоформе (лактамная) и гидроксиформе
(лактимная). Наряду с лактам-лактимной таутомерии, у оксопуринов возможна
азольная таутомерия, связанная с миграцией атома водорода между атомами азота в
имидазольной цикле.
Мочевая
кислота является двухосновной кислотой, с водными растворами щелочей она
образует кислые и средние соли, которые называются уратами. В гидроксиформе
мочевая кислота вступает в реакции нуклеофильного замещения, так, с РОСl3
образует 2,6,8-трихлорпурин, который широко используется в синтезе производных
пурина - аденина, гуанина, гипоксантина, ксантина. При нагревании мочевой
кислоты с азотной кислотой с последующим прибавлением к реакционной смеси
аммиака появляется пурпурно-фиолетовое окрашивание, связанное с обарзованием
аммонийной соли пурпурной кислоты, называемой мурексидом.
Гипоксантин
и ксантин по химическим свойствам аналогичны мочевой кислоте. Они существуют в
двух таутомерных формах - лактамной и лактимной. Подобно мочевой кислоте, эти
соединения образуют соли со щелочами. Наряду с этим, гипоксантин и ксантин
обладают слабо выраженными основными свойствами и образуют соли с сильными
минеральными кислотами, то есть они амфотерны. Гипоксантин и ксантин широко распространены
в растительном и животном мире. Важное значение в фармации имеют N-метильные
производные ксантина - теофиллин (1,3-диметилксантин), теобромин
(3,7-диметилксантин) и кофеин (1,3,7-триметилксантин). Теофиллин, теобромин и
кофеин получают из природного сырья или синтетически - метилированием ксантина.
Теофиллин и теобромин являются амфотерными веществами. Их кислотные свойства
обусловлены подвижностью атома водорода в NН-фрагмента
молекулы, основные - наличием пиридинового атома азота. Кофеин проявляет только
слабые основные свойства.
Важнейшими
аминопроизводными пурина являются аденин (6-аминопурин) и гуанин
(2-амино-6-гидроксипурин), входящие в состав нуклеиновых кислот в качестве
пуриновых оснований. Гуанин существует в двух таутомерных формах - лактамной и
лактимной. Более устойчива лактамная форма, в виде которой гуаниновый фрагмент
находится в нуклеиновых кислотах.
КОНТРОЛЬНЫЕ
ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
следующих соединений: а) гипоксантин, б) ксантин, в) мочевая кислота, г)
аденин, д) гуанин, е) теофиллин, к) теобромин, л) кофеин. Назовите их по
систематической номенклатуре.
2. Назовите следующие соединения:

1. Напишите схему получения
8-метилпурина из 4,5-диаминопиримидина.
2. Напишите схемы реакций,
подтверждающих амфотерный характер пурина.
3. Напишите схемы реакций, доказывающих
наличие в мочевой кислоте пиримидинового и имидазольного циклов. Назовите
продукты.
4. Приведите схемы таутомерных
превращений ксантина, гипоксантина.
5. С помощью каких реакций можно
доказать амфотерный характер ксантина и гипоксантина?
6. Объясните, почему мочевая кислота
двухосновная, а не трехосновная. Напишите схемы получения солей мочевой
кислоты.
7. Напишите схемы химических
превращений, позволяющих превратить а) моче-вую кислоту в пурин и б) аденин в
гипоксантин.
8. Приведите схемы реакций,
подтверждающих амфотерный характер теофиллина, теобромина.
9. Напишите уранения реакции,
позволяющие осуществить следующие химические превращения:
Nа
POCl3 [Н]
4
а) мочевая кислота 1
2
НСl 5
3
КОН NН3 [Н]
NаNО2, НСl НСl
б) 2,6,8-трихлорпурин 1
2 3 4 5
ПРАКТИКУМ
Опыт 166. РАСТВОРИМОСТЬ МОЧЕВОЙ КИСЛОТЫ И ЕЕ СОЛЕЙ В ВОДЕ
Р е а к т и в ы: мочевая кислота, 10% раствор гидроксида натрия,
насыщенный раствор хлорид аммония
В пробирку помещают на кончике шпателя мочевую кислоту и по каплям при
встряхивании добавляют воду. После прибавления 10 капель воды отмечают плохую
растворимость мочевой кислоты. К полученной взвеси добавляют 1 каплю 10%-ного
раствора гидроксида натрия. Раствор становится прозрачным вследствие
образования хорошо растворимой в воде динатриевой соли мочевой кислоты:

К
полученному раствору добавляют 1 каплю насыщенного раствора хлорида аммония и
наблюдают образование белого осадка диаммониевой соли мочевой кислоты - урата
аммония:

Опыт
167. МУРЕКСИДНАЯ РЕАКЦИЯ
Р
е а к т и в ы: мочевая кислота, концентрированная азотная кислота, 10% раствор
аммиака
Опыт
выполняется в вытяжном шкафу!
В
фарфоровую чашку помещают несколько кристаллов мочесвой кислоты и 3-4 капли
концентрированной азотной кислоты. Полученную смесь осторожно упаривают над
пламенем горелки досуха. Образовавшийся розово-красный остаток после остывания
смачивают 1-2 каплями 10%-ного раствора аммиака. Наблюдают появление
пурпурно-фиолетовой окраски.
Мурексидная
реакция является общегрупповой реакцией на пурин и его производные.
III.18 УГЛЕВОДЫ
Общая
формула углеводов - Сх(Н2О)у. В зависимости от числа моносахаридных единиц,
связанных в молекулу, углеводы делятся на простые (моносахариды) и сложные (ди-
и полисахариды).
III.18.1
МОНОСАХАРИДЫ
Моносахариды
(монозы) представляют собой полигидроксильные соединения, содержащие
альдегидную или кетонную группу.
Моносахариды
классифицируют следующим образом:
В
названиях моносахаридов, как правило, используют тривиальную номенклатуру. Все
тривиальные названия имеют окончания -оза, например, глюкоза, фруктоза,
галактоза и др. Номенклатура ИЮПАК практически не применяется.
Молекулы
моносахаридов содержат несколько асимметричных атомов углерода и поэтому они
существуют в виде различных пространственных изомеров. Количество
стереоизомеров определяется по формуле Вант-Гоффа:
N = 2n2,
где n - число асимметричных атомов углерода
Так,
альдопентоза имеет 3 асимметрических атома углерода, следовательно, ей
соответствует 8 стереоизомеров (23). Все изомеры моносахаридов подразделяют на D- и L-стереохимические
ряды, принадлежность к которым определяется по конфигурации асимметрического
атома углерода, максимально удаленного от карбонильной группы (для пентоз - С4,
для гексоз - С5). Если конфигурация этого хирального атома углерода совпадает с
конфигурацией D-глицеринового альдегида, то моносахарид относят к D-ряду,
если же с конфигурацией L-глицеринового альдегида - то к L-ряду.
Пространственные
изомеры моносахаридов, отличающиеся конфигурацией одного или нескольких атомов
углерода, являющиеся зеркальными отображениями друг друга называются
энантиомерами. Диастереомерами называют стереоизомеры, не являющиеся
зеркальными изомерами. Диастереомеры, различающиеся конфигурацией только одного
ассиметрического атома углерода, называются эпимерами.
НС=О НС=О
НС=О НС=О
│
│ │
│
Н - С - ОН НО - С - Н НО - С - Н Н - С
- ОН
│
│ │
│
НО
- С - Н Н - С - ОН НО - С - Н Н - С
- ОН
│
│ │
│
Н - С - ОН НО - С - Н Н - С - ОН НО - С -
Н
│
│ │
│
Н - С - ОН НО - С - Н Н - С - ОН НО - С -
Н
│
│ │
│
СН2ОН СН2ОН СН2ОН
СН2ОН
D-глюкоза L-глюкоза
D-манноза L-манноза
энантиомеры энантиомеры
диастереомеры
эпимеры
Строение моносахаридов изображают с помощью формул Колли-Толленса и
Хеуорса. Образовавшаяся в процессе циклизации моносахарида гидроксильная группа
при аномерном центре называется полуацетальной или гликозидной. В зависимости
от его расположения различают α- и β-аномеры.
Моносахариды являются таутомерными веществами. Для них характерна
цикло-оксо таутомерия или иначе называемая кольчато-цепная таутомерия. При
растворении моносахаридов воде осуществляется переход циклических форм -
пиранозные и фуранозные с α- и β-конфигурацией аномерного центра в
оксоформу, переход одной формы в другие происходит непрерывно до установления
равновесия. Способность моносахаридов к цикло-оксо таутомерии объясняет явление
мутаротации - самопроизвольное изменение величины оптического вращения
свежеприготовленных растворов оптически активных соединений с течением времени.
Углеводы широко распространены в природе, они образуются в зеленых частях
растений из углекислого газа и воды в процессе фотосинтеза. Важнейшим способом
получения моносахаридов является кислотный гидролиз природных ди- и
полисахаридов. Синтетические методы - распад по Руффу, циангидридный синтез -
применяют, как правило, для получения малодоступных моносахаридов.
Являясь полигидроксикарбонильными соединениями, моносахариды проявляют
химические свойства карбонильных соединений, многоатомных спиртов, а также
циклических полуацеталей. Химические превращения моносахаридов можно условно
разделить на две группы: 1) реакции с участием открытых форм моносахаридов и 2)
реакции с участием циклических форм. К реакциям с участием открытых форм
моносахаридов относятся реакции восстановления, окисления, эпимеризация,
образование озазонов, взаимодействие с гидроксиламином и внутримолекулярная
дегидратация. Образование гликозидов, алкилирование, ацилирование относят к
реакциям с участием циклических форм.
Моносахариды имеют немаловажное биологическое значение и широко
применяются в органическом синтезе лекарственных средств. Так, глюкоза является
источником энергии для большинства организмов и используется в качестве сырья
для производства витамина С и лекарственного препарата глюконата кальция.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите проекционные формулы Фишера
энантиомеров глюкозы, галактозы, маннозы, сорбозы, фруктозы, ксилозы,
арабинозы, рибозы, 2-дезоксирибозы и отнесите к D-, L-стереохимическому
ряду. Объясните, как определяется принадлежность моносахаридов к D-, L-стереохимическому ряду. Дайте определение понятиям:
асимметрический атом углерода, энантиомеры, диастереомеры и эпимеры.
2. Изобразите b-D-галактопиранозу и b-D-ксилопиранозу
формулами Хеуорса с привлечением правил перехода к ним от формул
Колли-Толленса. Дайте определение понятию: аномеры. Отличаются ли аномеры
химическими и физическими свойствами?
3. Объясните цикло-оксо таутомерию
моносахаридов на примере глюкозы. Какие функциональные группы имеются в
открытой и циклической форме моносахаридов?
4. Какое явление называют муторатацией?
Приведите схемы цикло-оксо таутомерных превращений а) D-маннозы, б) D-фруктозы,
в) D-рибозы.
5. Что такое эпимеризация и какие
соединения назвают эпимерами? На примере D-маннозы приведите карбонильно-ендиольную таутомерию.
Являются ли D-фруктоза и D-глюкоза эпимерами? Ответ поясните.
6. Приведите формулы фуранозных и
пиранозных форм D-галактозы.
Укажите аномерный атом углерода, Какие соединения называются аномерами?
7. Напишите схемы реакций с помощью
которых можно доказать, что D-глюкоза
является полиоксиальдегидом, D-фруктоза
- полиоксикетоном.
8. Приведите схемы реакций, доказывающих
наличие в молекуле D-глюкозы и D-фруктозы а) полуацетального
гидроксила, б) пятиспиртовых гидроксилов, в) альдегидной и кетонной групп.
9. Напишите схемы окисления D-глюкозы в нейтральной, кислой и
щелочных средах, назовите продукты.
10.Почему фруктоза
вступает в реакцию «серебряного зеркала»? Что происходит с фруктозой в
аммиачном среде и как называется такое превращение? Приведите схемы
соответствующих превращений.
11.Напишите
уравнения и назовите продукты реакций D-маннозы со следующими реагентами: а) [H], б) Br2,
в) конц. HNO3,
г) C6H5NHNH2, д) NH2OH, е) C2H5OH, к) CH3I, л) (CH3CO)2O.
12.Объясните,
можно ли с помощью реакции образования озазонов отличить D-глюкозу, D-маннозу и D-фруктозу?
Напишите соответствующие уравнения реакций.
13.Напишите
уравнения реакций, позволяющих превратить D-фруктозу в следующие соединения: а) D-маннозу, б) метил-β-D-фруктофуранозид, в) пентаацетил-α-D-фруктопиранозу.
14.Приведите схему
получения метил-β-D-галактопиранозида из соответствую-щего моносахарида. К
какому классу химических соединений и к какой группе природных веществ
относится полученное соединение?
15.В какой среде
реакции окисления моносахаридов сопровождаются разрушением углеродной цепи?
Приведите схемы реакций.
16.В какой среде
при реакциях окисления сохраняется углеродный скелет? Приведите схемы реакций.
17.Каким способом
можно в одну стадию превратить уроновые кислоты в альдоновые? Напишите схему
получения D-глюконовой кислоты из
соответствующей уроновой кислоты.
18.Составьте
уравнения по следующим схемам превращений:
СН3ОН 4CH3I HOH, H+
цикло-оксотаутом. Ag2O (NH3)
а) глюкоза
1 2 3
4 5
НСl
(г)
3C6H5NHNH2
6
Br2 (H2O)
2
4
эпимеризация конц. HNO3
б) 1 D-галактоза
5
NH2OH
3
6
NH2NHC6H5
ПРАКТИКУМ
Опыт 168. ОБРАЗОВАНИЕ МОНОЗЫ ПРИ ОКИСЛЕНИИ МНОГОАТОМНОГО СПИРТА
Р е а к т и в ы: маннит или сорбит, насыщенная
свежеприготовленная бромная вода, 10% раствор гидроксида натрия, раствор
сульфата меди
,1-0,2 г сорбита (маннита) растворяют в 2 мл воды,
добавляют 8-10 мл бромной воды и нагревают на кипящей водяной бане до
обесцвечивания. Если окраска не исчезает, продолжают нагревание в пламени
горелки. К охлажденному бесцветному раствору добавляют раствор щелочи и
несколько капель раствора сульфата меди. Полученный голубой осадок гидроксида
меди при взбалтывании растворяется, образуя раствор синего цвета. Раствор
нагревают. Выпадает осадок красного цвета, что объясняется появлением в
продуктах альдегидной группы:
СН2ОН Н-С=О
Н ОН Н ОН
НО Н
Br2
НО Н
Н ОН
Н ОН
Н ОН
Н ОН
СН2ОН СН2ОН
Опыт 169. ОКИСЛЕНИЕ МОНОСАХАРИДОВ БРОМНОЙ ВОДОЙ
Р е а к т и в ы: 1% растворы глюкозы и фруктозы,
бромная вода
Опыт проводят одновременно с растворами глюкозы и
фруктозы. К 1 мл каждого раствора добавляют по 5 мл бромной воды. Смесь нагревают
на кипящей водяной бане в течение 15 мин. Если окраска не исчезает, продолжают
кипячение жидкости на пламени горелки до полного обесцвечивания раствора
глюкозы.
Исчезновение окраски бромной воды в пробирке с
раствором глюкозы указывает на процесс окисления глюкозы с образованием
глюконовой кислоты. Неизменяющаяся желтая окраска с раствором фруктозы
указывает на отсутствие реакции окисления (кетозы окисляются в более жестких
условиях).
Н-С=О НО-С=О
Н ОН Н ОН
НО Н Br2, H2O НО Н
Н ОН
Н ОН
Н ОН
Н ОН
СН2ОН СН2ОН
Опыт 170. ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МОНОСАХАРИДЫ
Р е а к т и в ы: 1% растворы глюкозы и фруктозы,
концентрированный раствор гидроксида натрия
К 1-2 мл 1%-ных растворов глюкозы и фруктозы добавляют
двойной объем концентрированного раствора щелочи и нагревают в течение 2-3 мин
до кипения. Окраска растворов изменяется. Жидкости охлаждают и подкисляют
раствором серной кислоты. Окраска бледнеет и появляется запах карамели (жженого
сахара).
В щелочной среде при нагревании монозы легко
окисляются, осмоляются, расщепляются с образованием сложной смеси веществ,
окрашивающих раствор в темный цвет.
Опыт 171. ВЗАИМОДЕЙСТВИЕ МОНОСАХАРИДОВ С АММИАЧНЫМ
РАСТВОРОМ ОКСИДА СЕРЕБРА (реакция серебряного зеркала)
Р е а к т и в ы: 1% раствор глюкозы, 1% раствор
нитрата серебра, 10% раствор аммиака
Аммиачный раствор оксида серебра готовят, добавляя к
1% раствору нитрата серебра по каплям водный раствор аммиака до растворения
первоначально образующегося осадка.
К 1 мл аммиачного раствора серебра добавляют 1 мл
раствора глюкозы и помещают на несколько минут в горячую воду. Если стенки
пробирки чистые, выделяющееся при окислении глюкозы металлическое серебро
осаждается в виде зеркального налета, в противном случае выпадает черный
осадок.
AgNO3 + NH4OH
AgOH + NH4NO3
AgOH
Ag2O + H2O
Ag2O
+ NH4OH [Ag (NH3)2]OH +
H2O
Н-С=О
Н ОН
НО Н [Ag (NH3)2]OH
Н ОН
Ag↓ + продукты окисления
Н ОН
СН2ОН
Опыт 172. ОБРАЗОВАНИЕ ОЗАЗОНА ГЛЮКОЗЫ
Р е а к т и в ы: 0,5% раствор глюкозы, хлороводородная
соль фенилгидразина, ацетат натрия
Опыт проводят в вытяжном шкафу!
В пробирку помещают несколько крупинок хлороводородной
соли фенилгидразина и ацетата натрия, добавляют 2 капли 0,5%-ного раствора
глюкозы. Пробирку помещают на 45 минут в предварительно нагретую до кипения
водяную баню. По истечении времени наблюдают образование желтого
кристаллического осадка озазона глюкозы.
Н-С=О Н-С=N-NH-C6H5
Н ОН Н ОН
НО Н NH2NHC6H5 НО Н
Н ОН -H2O Н ОН -C6H5NH2
Н ОН
Н ОН
СН2ОН СН2ОН
Н-С=NH
Н-С=N-NH-C6H5
C=О C=N-NH-C6H5
НО Н 2NH2NHC6H5 НО
Н
Н ОН -NH3, -H2O Н ОН
Н ОН
Н ОН
СН2ОН СН2ОН
Опыт 173. ДОКАЗАТЕЛЬСТВА НАЛИЧИЯ α-ГЛИКОЛЬНОГО ФРАГМЕНТА В ГЛЮКОЗЕ
Р е а к т и в ы: 0,5% раствор глюкозы, 10% раствор
гидроксида натрия, 2% раствор сульфата меди (II)
В пробирку помещают 6 капель 10%-ного раствора
гидроксида натрия и 1 каплю 2%-ного раствора сульфата меди (II). Наблюдают образование синего
осадка гидроксида меди (II). При
добавлении 1 капли 0,5%-ного раствора глюкозы осадок быстро растворяется с
образованием прозрачного синего раствора:
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
О
Н-С=О Н-С
Н ОН Н ОН
2 НО Н Cu(OH)2 НО
Н
О Cu
Н
ОН H
ОН
Н ОН
-H2O Н
СН2ОН СН2О
Данная реакция подтверждает наличие α-гликольного фрагмента в молекуле
глюкозы. Полученный раствор сохраняют для выполнения следующего опыта.
Опыт 174. ВОССТАНОВЛЕНИЕ ГИДРОКСИДА МЕДИ(II) ГЛЮКОЗОЙ В ЩЕЛОЧНОМ РАСТВОРЕ (проба
Троммера)
Р е а к т и в ы: сахарат меди (II) из предыдущего опыта
К полученному в предыдущем опыте прозрачному раствору
сахарата меди (II) синего цвета
прибавляют несколько капель воды так, чтобы высота жидкости в пробирке
составляла 20 мм. Пробирку держат наклонно и осторожно нагревают в пламени
горелки верхнюю часть раствора. Наблюдают переход синей окраски раствора в
зеленую, а затем его обесцвечивание. Одновременно появляется желтый осадок
гидроксида меди (I), превращающийся
в красно-коричневый осадок оксида меди (I).
сахарат меди (II) CuOH + H2О + продукты окисления глюкозы
CuOH Cu2О + Н2O
Проба Троммера используется для обнаружения восстанавливающих
сахаров.
Опыт 175. ДЕЙСТВИЕ ФУКСИНСЕРНИСТОЙ КИСЛОТЫ НА ГЛЮКОЗУ
Р е а к т и в ы: 1% раствор глюкозы, формалин,
насыщенный раствор фуксинсернистой кислоты
В две пробирки вливают по 1 мл раствора
фуксинсернистой кислоты. В первую пробирку добавляют формалин, во вторую -
раствор глюкозы. Вскоре в первой пробирке появляется розово-фиолетовое
окрашивание, вторая остается бесцветной.
Глюкоза, как и другие моносахариды, представляет в
растворе равновесную смесь нескольких таутомерных форм, в которой открытая
форма содержится в незначительном количестве. Поэтому глюкоза не дает некоторых
характерных реакций на альдегидную группу (не образует бисульфитные
производные, не дает реакцию с фуксинсернистой кислотой).
Опыт 176. ДЕЙСТВИЕ РАСТВОРА ФЕЛЛИНГА НА ГЛЮКОЗУ
Р е а к т и в ы: 5% раствор глюкозы, сульфат меди (II), сегнетова соль, 10% раствор
гидроксида натрия
В пробирку помещают 2 капли водного раствора сульфата
меди (II) и 2 капли щелочного раствора
сегнетовой соли - калиево-натриевой соли виной кислоты. Наблюдают выделение
голубого осадка гидроксида меди (II),
который с сегнетовой солью образует водорастворимый комплекс синего цвета:
СООК COO NaOOC
H H
Н-С-ОН Cu(OH)2 H-C-O O-C-H
Cu
Н-С-ОН -KOH, -NaOH H-C-O O-C-H
H H
COONa
COOK OOC раствор Феллинга
Затем в пробирку добавляют 3 капли 5%-ного раствора
глюкозы и смесь нагревают до кипения. Наблюдают постепенное обесцвечивание
раствора и образование красно-коричневого осадка оксида меди (I).
Н-С=О
Н ОН
НО Н КОН, NaOH
Н ОН + раствор Феллинга
Н ОН
СН2ОН
продукты окисления + сегнетова соль + 2CuOH + 2H2O
t
2CuOH Cu2O + H2O
Опыт 177. РЕАКЦИЯ
СЕЛИВАНОВА НА КЕТОЗЫ
Р е а к т и в ы: 1% растворы глюкозы, фруктозы,
реактив Селиванова (0,01 г резорцина в смеси 10 мл воды и 10 мл
концентрированной хлороводородной кислоты)
В две отдельные пробири помещают по 2 мл
свежеприготовленного реактива Селиванова. В одну из пробирок вносят 0,5 мл
раствора глюкозы, в другую - 0,5 мл раствора фруктозы. Пробирки помещают на 2
мин в кипящую водяную баню.
В пробирке с фруктозой в отличие от глюкозы наблюдают
быстрое появление красного окрашивания раствора. При последующем нагревании
пробирок в пламени горелки до кипения окрашенный раствор мутнее и выделяется
осадок.
Реакция обусловлена образованием
5-гидроксиметилфурфурола, который под влиянием концентрированной соляной
кислоты конденсируется в окрашенное вещество.

Кетозы
в условиях опыта превращаются в 5-гидроксиметилфурфурол в 15-20 раз быстрее,
чем альдозы, что и обусловливает быстроту появления окраски и ее интенсивность
в растворе фруктозы. Альдогексозы в этих условиях лишь при длительном кипячении
приобретают слабо-розовую окраску.
Реакция
Селиванова позволяет обнаружить в смеси сахаров кетогексозы как в свободном
состоянии, так и в связанном состоянии (дисахариды).
Ш.18.2 ДИ- И ПОЛИСАХАРИДЫ
Дисахаридами называют углеводы, молекулы которых состоят из двух остатков
моносахаридов одинаковой или разной природы, соединенных между собой
гликозидной связью. В зависимости от способа образования гликозидной связи,
дисахариды разделяют на две группы - восстанавливающие и невосстанавливающие.
В восстанавливающих дисахаридах гликозидная связь образуется за счет
полуацетальной (гликозидной) гидроксильной группы одного и любой спиртовой
гидроксильной группы (чаще у С4) другого моносахарида. При этом в молекуле
остается одна свободная полуацетальная гидроксильная группа, вследствие чего
дисахарид сохраняет способность к цикло-оксо таутомерии, следовательно,
обладает восстанавливающими свойствами. Представителями восстанавливаю-щих
дисахаридов является мальтоза (4-О-(α-D-глюкопиранозидо)-D-глюко-пираноза), целлобиоза (4-О-(β-D-глюкопиранозидо)-D-глюкопираноза), лактоза (4-О-(β-D-галактопиранозидо)-D-глюкопираноза). В
свежеприготовленных растворах таких дисахаридов наблюдается явление
мутаротации. Мальтоза, целлобиоза, лактоза в растворе существуют в трех
таутомерных формах - α- и β-циклической и альдегидной. Они, как и
моносахариды, вступают в реакции с фенилгидразином, гидроксиламином,
циановодородной кислотой, реакции окисления и восстановления. Являясь
О-гликозидами, дисахариды легко гидролизуются в кислой среде с образованием
двух молекул моносахаридов.
Целлобиоза и мальтоза имеют разное пространственное строение. В молекуле
мальтозы α-гликозидная связь расположена аксиально, а в молекуле
целлобиозы β-гликозидная связь - экваториально. Такая пространственная
структура мальтозы является причиной клубкообразного строения амилозы
(составная часть крахмала), а пространственная структура целлобиозы - причиной
линейного строения целлюлозы.
В молекулах невосстанавливающих дисахаридах гликозидная связь образуется
за счет полуацетальных гидроксильных групп обоих моносахаридов. Такие дисахариды
не имеют в своем составе свободного полуацетального гидроксила, поэтому в
растворах они существуют только в циклической форме, их растворы не
мутаротируют и не обладают восстанавливающими свойствами. Невосстанавливающие
дисахариды не дают реакций по альдегидной группе и гликозидному гидроксилу. Они
способны лишь к обращованию простых и сложных эфиров. Представителем
невосстанавливающих дисахаридов является сахароза. Молекула сахарозы состоит из
остатков D-глюкозы и D-фруктозы. Сахарозу иначе можно назвать как α-D-глюкопиранозидо-β-D-фруктофураноза. Под действием
минеральных кислот при нагревании сахароза гидролизуется с образованием смеси D-глюкозы и D-фруктозы. При этом происходит изменение знака удельного
вращения, то есть характерное для сахарозы вращение плоскости поляризации
вправо изменяется на левое вращение. В связи с изменением в процессе гидролиза
сахарозы знака удельного вращения, гидролиз сахарозы получит название инверсии,
а образующаяся в процессе гидролиза смесь равных количеств D-глюкозы и D-фруктозы называется инвертным сахаром. Инвертный сахар
является основной составной частью пчелиного меда.
К полисахаридам относят соединения, молекулы которых содержат более
десяти моносахаридных звеньев, связанных О-гликозидной связью. Гликозидные связи
в полисахаридах, как правило, образуются за счет гликозидного гидроксила одного
и спиртового гидроксила другого моносахаридных остатков. На конце
полисахаридной цепи находится восстанавливающий остаток моносахарида, но
поскольку его доля в молекуле ничтожна, то полисахариды с большой молекулярной
массой практически не обладают восстанавливающей способностью. Если в состав
полисахаридов входят остатки только одного моносахарида, то их называют
гомополисахаридами, а полисахариды, состоящие из разных моносахаридных единиц,
называют гетерополисахаридами. К гомополисахаридам относятся крахмал, гликоген,
целлюлоза, декстран, инулин и пектиновые вещества. Крахмал состоит из двух
составляющих - растворимой в воде амилозы (20%) и нерастворимой - амилопектин (80%).
Хондроитинсульфат, гиалуроновая кислота, гепарин относят к гетерополисахаридам.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
следующих соединений: а) α-мальтоза, б) метил-β-D-лактозид, в) целлобионовая кислота,
г) фрагменты амилозы, амилопектина.
2. Дайте определение понятию
«восстанавливающие дисахариды» и «невосстанавливающие дисахариды». Приведите
примеры.
3. Объясните, способны ли
свежеприготовленные растворы мальтозы, целлобиозы, лактозы и сахарозы к
мутаротации. Напишите возможные таутомерные превращения.
4. Приведите схемы качественных реакций,
подтверждающих восстанавливающую способность мальтозы. Можно ли с помощью этих
реакций отличить лактозу от сахарозы? Ответ поясните.
5. Напишите схемы реакций лактозы со
следующими реагентами: а) [H], б)
Br2, в) конц. HNO3, г) C6H5NHNH2, д)
NH2OH, е) C2H5OH, к) CH3I, л) (CH3CO)2O. Назовите продукты.
6. Напишите схему превращений сахарозы в
инвертный сахар. Как называют это явление и в чем его суть?
7. Сколько невосстанавливающих дисахаридов
можно построить из двух остатков D-глюкопиранозы?
Приведите строение этих соединений и назовите их.
8. Сколько восстанавливающих дисахаридов
можно построить из двух остатков D-глюкопиранозы?
Приведите структуры полученных соединений и дайте им систематические названия.
9. Напишите реакции гидролиза лактозы,
мальтозы, целлобиозы, генциобиозы,
10.Какими
качественными реакциями можно установить отсутствие восстановительной
способности у сахарозы?
11.Напишите
таутомерные превращения целлобиозы и генциобиозы. Дайте систематическое
название всем таутомерам. Объясните явление мутаротации.
12.Каким образом
можно установить наличие таутомерных превращений в свежеприготовленных
растворах мальтозы, целлобиозы, лактозы, генциобиозы ?
13.Напишите
реакции исчерпывающего алкилирования сахарозы, мальтозы, целлобиозы, лактозы,
генциобиозы с последующим гидролизом продукта реакции.
14.Напишите
реакции ацилирования сахарозы, мальтозы, лактозы, целлобиозы, генциобиозы с
последующим гидролизом продукта реакции.
15.Будут ли
обладать восстановительными свойствами мальтоза и метил-b-лакто-зид? Ответ подтвердите
приведением схем соответствующих реакций.
16.Напишите
реакции взаимодействия мальтозы и сахарозы с а) Cu(OH)2 на холоду и
при нагревании, б) реактивом Толленса, в) HCN.
17.Какие
соединения из дисахаридов: лактоза, мальтоза, целлобиоза, генциобиоза, сахароза
вступают в реакцию с фенилгидразином с образованием озазона? Ответ поясниет
соответствующими реакциями.
18.Какой продукт
образуется при окислении бромной водой мальтозы, лактозы, целлобиозы,
генциобиозы? Напишите соответствующие уравнения реакций.
19.Какие продукты
образуются при гидролизе продуктов окисления бромной водой лактозы, мальтозы,
целлобиозы, генциобиозы?
20.Объясните
различие в строении целлюлозы и крахмала. Как различаются свойства крахмала и
целлюлозы?
ПРАКТИКУМ
Опыт 178. ДОКАЗАТЕЛЬСТВО НАЛИЧИЯ ГИДРОКСИЛЬНЫХ ГРУПП В
ДИСАХАРИДАХ
Р е а к т и в ы: 1%-ные растворы лактозы и сахарозы,
2% раствор сульфата меди (II),
10% раствор гидроксида натрия
В одну из пробирок помещают 1 каплю 1%-ного раствора
сахарозы, в другую - лактозы. В обе пробирки добавляют 4 капли 10%-ного
раствора гидроксида натрия и 1 каплю 2%-ного раствора сульфата меди (II). В обеих пробирках наблюдают
выделение ярко голубой осадка гидроксида меди (II), который растворяется при последующем встряхивании
пробирки. Образуется прозрачный синий раствор комплексной соли меди (II) c лактозой в одной пробирке и раствор комплексной соли меди (II) с сахарозой:
t
CuSO4 + 2NaOH
Cu(OH)2 + Na2SO4
Лактоза + Cu(OH)2
комплексная соль меди (II) с лактозой
-Н2О
Сахароза + Cu(OH)2
комплексная соль меди (II) с сахарозой
-Н2О
Опыт 179. ВОССТАНАВЛИВАЮЩАЯ СПОСОБНОСТЬ ДИСАХАРИДОВ
Р е а к т и в ы: комплексные соли меди (II) с лактозой и сахарозой из
предыдущего опыта
В комплексные соли меди (II) с лактозой и сахарозой из предыдущего опыта приливают по 2
мл воды, взбалтывают и осторожно нагревают. В пробирке с лактозой наблюдают
образование осадка, окраска которого изменяется от желтой до красно-коричневой,
во второй пробирке с сахарозой меди никаких видимых изменений не происходит,
так как сахароза не обладает восстанавливающими свойствами.
комплексная соль t другие продукты
меди (II) с
лактозой -H2O лактобионовая кислота + CuOH + окисления лактозы
t
CuOH Cu2О + Н2O
Опыт 180. ПОЛУЧЕНИЕ САХАРАТА КАЛЬЦИЯ
Р е а к т и в ы: 20% раствор сахарозы, известковое
молоко
мл 20%-ного раствора сахарозы взбалтывают с таким же
количеством известкового молока (часть извести должна остаться нерастворенной)
и фильтруют. При кипячении фильтрата осаждается труднорастворимый
трехкальциевый сахарат.
12H22O11.3CaO.3H2O
Опыт 181. ГИДРОЛИЗ САХАРОЗЫ
Р е а к т и в ы: 2% раствор сахарозы, 10% раствор
серной кислоты, концентрированная соляная кислота, резорцин
В пробирку наливают 2-3 мл 2%-ного раствора
свекловичного сахара и добавляют 2-3 капли разбавленной серной кислоты. Раствор
нагревают на кипящей водяной бане в течение 5-10 мин, затем охлаждают, доводят
до слабо щелочной реакции (проба на лакмус), делят на 2 части.
Сахароза состоит из двух моносахаридов - глюкозы и
фруктозы, связанных гликозидной связью, которая легко расщепляется при
гидролизе с образованием свободных глюкозы и фруктозы.
Полученная в результате гидролиза глюкоза вступает во
взаимодействие с жидкостью Феллинга с образованием красного осадка оксида меди
(I) (опыт 176). Ко второй части
раствора добавляют кристаллик резорцина, 1 мл соляной кислоты и нагревают до
кипения - появляется красноватое окрашивание, указывающее на образование
фруктозы (опыт 177).
Опыт 182. СВОЙСТВА КРАХМАЛА
Р е а к т и в ы: крахмал
Около 1 г сухого крахмала взбалтывают с 5-6 мл воды,
дают смеси отстояться, сливают воду и повторяют промывание крахмала новыми
порциями воды еще 2-3 раза. Добавив последнюю порцию воды и хорошо взболтав
смесь, наливают суспензию крахмала в стакан с 50 мл воды, нагретой до кипения.
Образуется почти прозрачный, слегка опалесцирующий крахмальный клейстер.
Охлаждают раствор и используют его для последующих
реакций.
Опыт 183. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КРАХМАЛ
Р е а к т и в ы: 0,5% раствор крахмального клейстера,
раствор йода в йодиде калия
В пробирку помещают 5 капель 0,5%-ного раствора
крахмального клейстера и 1 каплю раствора йода в йодиде калия. Наблюдают
появление интенсивно-синей окраски раствора. При нагревании окрашенного
раствора крахмала с йодом окраска исчезает, а при охлаждении появляется вновь.
Крахмал представляет собой смесь двух олигосахаридов -
амилозы (20%) и амилопектина (80%). Молекулы амилозы в комплексах с йодом
образуют вокруг молекулы йода спираль, при нагревании спираль амилозы
раскручивается.
Опыт 184. ВЗАИМОДЕЙСТВИЕ КРАХМАЛА С ГИДРОКСИДОМ МЕДИ (II)
Р е а к т и в ы: 0,5% раствор крахмального
клейстера,10% раствор гидроксида натрия, 5% раствор сульфата меди (II)
К 1-2 мл клейстера добавляют несколько капель 10%-ного
раствора гидроксида натрия и 1-2 капли 5%-ного раствора сульфата меди (II). Смесь нагревают в кипящей воде 2-3
мин. Раствор остается почти неокрашенным, голубые хлопья нерастворившегося
гидроксида меди (II) при нагревании
чернеют, красный или желтый осадок не образуются.
В очень длинных цепях молекул крахмала свободные
гликозидные гидроксильные группы расположены лишь на концах цепи, то есть
относительное количество их в молекуле очень мало, поэтому крахмал не дает
реакций со щелочью, не восстанавливает гидроксид меди.
Опыт 185. КИСЛОТНЫЙ ГИДРОЛИЗ КРАХМАЛА
Р е а к т и в ы: 0,5% раствор крахмального клейстера,
10% раствор серной кислоты, раствор йода в йодиде калия
В пробирку помещают 1 мл 0,5%-ного раствора
крахмального клейстера, 10 капель 10%-ного раствора серной кислоты и нагревают
на водяной бане в течение 20 мин. Раствор становится прозрачным.
Каплю раствора наносят на предметное стекло и
смешивают с 1 каплей йода в йодиде калия. Отсутствие интенсивного синего
окрашивания свидетельствует о полном гидролизе крахмала
+
(С6Н10О5)n + n Н2O n C6H12O6
Наличие глюкозы можно доказать реакцией взаимодействия
с гидроксидом меди (II) (опыт 173).
III.19
ОМЫЛЯЕМЫЕ И НЕОМЫЛЯЕМЫЕ ЛИПИДЫ
Липидами (жироподобные вещества) называют группу природных органических
соединений, главным образом производных высших алифатических кислот и спиртов.
Разное отношение жироподобных веществ к воздействию гидролизующих
реагентов положено в основу деления липидов на омыляемые (жиры, воски,
фосфолипиды, гликолипиды) и неомыляемые (изопреноиды и простагландины).
Жиры являются сложными эфирами глицерина и высших алифатических кислот,
то есть триацилглицеринами, или триглицеридами. Триацилглицерины бывают
простыми и смешанными. Простые включают остатки одинаковых кислот, смешанные -
разных. По консистенции жиры могут быть твердыми и жидкими. Твердые жиры
содержат, преимущественно остатки насыщенных высших жирных кислот, жидкие
(масла) - остатки ненасыщенных высших кислот. Жиры животного происхождения, как
правило, твердые вещества, растительные - жидкие.
По систематической номенклатуре ИЮПАК родоначальной структурой в молекуле
жира выступает глицерин. Ацильные остатки жирных кислот перечисляют в начале
названия в алфавитном порядке, если необходимо, употребляют множительные
приставки ди- и три-. Тривиальные названия жиров образуют из приставок,
построенных из названий соответствующих жирных кислот путем опускания части
названия кислоты -иновая кислота и добавлением суффикса -ин.
СН2-О-СО-С17Н35
СН2-О-СО-С11Н23
СН -О-СО-С17Н35
СН -О-СО-С15Н31
СН2-О-СО-С17Н35
СН2-О-СО-С17Н35
тристеароилглицерин
1-лауроил-2-пальмитоил-3-стеароилглицерин
тристеарин
1-лауро-2-пальмитостеарин
Изомерия жиров связана в основном с различным взаимным расположением
ацильных остатков в структуре триацилглицерина (структурная изомерия). Молекулы
смешанных триглицеридов, содержащие асимметрический атом углерода, существует в
виде двух оптических изомеров. Для жиров, молекулы которых содержат остатки
непредельных кислот, характерна геометрическая изомерия.
Для синтеза триацилглицеринов пригодно большинство реакций О-ацилирования
спиртов (этерификация, взаимодействие глицератов натрия с хлорангидридами
кислот и др.), однако, синтетические способы получения жиров из глицерина не
имеют промышленного значения ввиду доступности разнообразного природного сырья.
Как и все сложные эфиры, жиры способны подвергаться гидролизу. При
наличии в молекуле триглицерида остатков ненасыщенных кислот он проявляет и
свойства алкенов - окисление, гидрогенизация, присоединение галогенов.
Реакцию гидролиза жиров используют в аналитической практике при
установлении качества жира. С этой целью определяют так называемое число
омыления - количество миллиграммов КОН, которое расходуется при гидролизе 1 г
жира, которое характеризует общее содержание свободных и связанных в
триглицеридах жирных кислот. Следует отметить, что в качестве примеси жиры
содержат некоторое количество карбоновых кислот. О количественном содержании
этих кислот позволяет судить кислотное число (число нейтрализации) - количество
миллиграммов КОН, необходимое для нейтрализации 1 г жира. Разность между числом
омыления и кислотным числом составляет эфирное число, характеризующее
содержание остатков жирных кислот, эфирносвязанных с остатками глицерина.
Для получения твердого мыла выделившуюся при гидролизе смесь высших
жирных кислот нейтрализуют содой. Молекулы мыла содержат в своей структуре
гидрофильный («стремящийся» к молекуле воды) карбоксилат-анионный фрагмент и
гидрофобную («избегающую» контакта с водой) протяженную углеродную цепь. В
результате такого строения мыла обладают практически одинаковой способностью
растворять как гидрофильные (вода, спирты), так и липофильные (углеводороды,
эфиры) вещества.
Детергенты, или синтетически моющие средства, как и мыла, относятся к
поверхностно-активным веществам. Их молекулы тоже включают неполярный
(гидрофобный) углеводородный фрагмент и полярную (гидрофильную) часть,
представленную анионоидной или катионоидной функциональной группировкой,
связанной с ионами натрия или минеральной кислоты соответственно. В зависимости
от строения полярной части молекулы синтетические моющие средства делятся на
анионные, катионные и нейтральные.
Воски - это сложные эфиры высших карбоновых кислот и высокомолекулярных
спиртов, содержащие четное число углеродных атомов в кислотных и спиртовых
остатках. Воски делят на животные (спермацет, пчелиный воск и др.) и
растительные (карнаубский воск). Температура плавления восков повышается с
удлинением углеродной цепи молекул, в связи с этим воски бывают мягкие и
твердые.
Твины - синтетические продукты, близкие по строению к глицеридам, они
являются неполными простыми эфирами шестиатомного спирта сорбита и
полиэтиленгликоля, у которых свободные гидроксильные группы в остатке сорбита
этерифицированы высшими жирными кислотами.
К неомыляемым липидам относят простагландины и изопреноиды.
Простогландины являются производными эйказановой кислоты, имеющие в своем
составе циклопентановое кольцо. К изопреноидам относится группа природных
соединений, образованных как продукты превращений изопрена. Они в свою очередь
подразделяются на терпены, каратиноиды, стероиды. В настоящее время
простагландины и изопреноиды проявляют целый ряд разнообразных физиологических
и фармакологических свойств, так простагландины регулируют обмен веществ в
клетках организма, влияют на процессы свертывания крови, снижают кровяное
давление и т.д.
КОНТРОЛЬНЫЕ ВОПРОСЫ И УПРАЖНЕНИЯ
1. Напишите структурные формулы
следующих соединений и укажите консистенцию соединения: а)
1-О-пальмитоил-2,3-ди-О-стеароилглицерин, б) триолеин, в)
три-О-(9,10-дийодстеароил)глицерин, г)
1-О-линоленоил-2-О-линолеил-3-О-олеоилглицерин, д)
1,2-ди-О-олеоил-3-О-пальмитоилглицерин, е) тристеарин, к)
2-О-олеоил-1-О-пальмитоил-3-О-стеароилглицерин, л)
1-О-пальмитоил-2,3-ди-О-стеароилглицерин.
2. Назовите следующие соединения:
а) СН2-О-СО-С17Н35 б) СН2-О-СО-С11Н23 в) СН2-О-СО-С17Н29
СН -О-СО-С17Н35 СН -О-СО-С15Н31 СН -О-СО-С19Н31
СН2-О-СО-С17Н35 СН2-О-СО-С17Н35 СН2-О-СО-С15Н31
3. Напишите уравнение реакции щелочного
гидролиза триацилглицерина, в состав которого входят линоленовая, линолевая и
пальмитиновая кислоты. Назовите продукты реакции. Объясните, на чем основано
моющее действие мыла.
4. Напишите уравнения реакции триолеина
со следующими реагентами: а) Br2,
б) KMnO4, в) I2. Объясните значение этих реакций. Дайте определение
понятиям «кислотное число», «йодное число», «число омыления».
5. Что общего в структуре всех жиров
растительного и животного происхождения. В чем отличие строения твердых и
жидких жиров?
6. Напишите реакцию олеиновой кислоты с
перманганатом калия в щелочной среде. Какой структурный фрагмент ответственен
за наблюдаемый результат?
7. Напишите реакцию гидрогенизации
линоленоилпальмитоилолеоилглицерина. Какова консистенция исходного вещества и
продукта реакции?
8. Напишите уравнения реакций
пероксидного окисления олеиновой и линолевой кислот. Где встречаются такие
реакции, какие последствия они вызывают?
9. К какому классу соединений относятся
жиры и воски? Что представляет собой пчелиный воск?
10.Напишите
реакцию получения валидола взаимодействием ментола с изовалериановой кислотой.
11.Напишите
гидратацию лимонена с образованием терпина. Терпингидрат, применение в
медицине.
12.Отметьте
асимметрические атомы углерода в формулах лимонена, пинена, камфоры. Сколько
оптических изомеров имеет камфора?
13.Напишите схемы
качественных реакций, иллюстрирующих непредельные свойства лимонена.
14.Напишите
качественные реакции, которыми можно доказать наличие в камфоре карбонильной
группы.
15.Какие продукты
могут образовываться при взаимодействии эстрона со следующими реагентами: а)
бромом, б) фенилгидразином, в) уксусным ангидридом?
16.Какие продукты
могут образовываться при взаимодействии холевой кислоты со следующими
реагентами: а) этанолом в присутствии соляной кислоты, б) хлористым ацетилом,
в) диметилсульфатом в щелочной среде, г) хромовой смесью на холоду?
ПРАКТИКУМ
Опыт 186. ЭМУЛЬГИРОВАНИЕ ЖИРОВ
Р е а к т и в ы: растительное масло, 10% раствор
гидроксида натрия, 10% раствор карбоната натрия, раствор мыла, раствор белка
В пять пробирки вносят по 1-2 капли растительного масла.
В первую пробирку добавляют 1 мл воды, во вторую - 1 мл 10%-ного раствора
гидроксида натрия, в третью - 1 мл 10% раствора карбоната натрия, в четвертую -
1 мл раствора мыла, в пятую - 1 мл раствора белка. Содержимое каждой пробирки
сильно встряхивают, во всех пробирках происходит образование эмульсии - мутной
жидкости, в которой мелкие капельки жира взвешены в воде.
Пробирки с полученными эмульсиями ставят в штатив и
через несколько минут отмечают, какие вещества образуют устойчивые эмульсии.
Наименее устойчивая эмульсия - масло в воде. Она
быстро разрушается, так как капельки масла слипаются в более крупные капли и,
наконец, образуют на поверхности воды слой жира.
Опыт 187. ОМЫЛЕНИЕ ЖИРОВ
Р е а к т и в ы: растительное масло, 10% раствор
гидроксида натрия, насыщенный раствор хлорида натрия
В небольшую чашечку помещают 2-3 мл жидкого жира
(растительное масло), вливают раствор щелочи и кипятят, добавляя воду до тех
пор, пока взятая стеклянной палочкой капля жидкости не растворится полностъю в
дистиллированной воде. Раствор охлаждают и приливают 20 мл насыщенного раствора
хлорида натрия. При размешивании мыло всплывает на поверхность и затвердевает.
Всплывший слой снимают на марлю, отжимают и сохраняют для следующих опытов.
СН2-О-СО-R СН2-ОH
СН -О-СО-R + NaOH t СН -ОH + 3RCOONa
СН2-О-СО-R СН2-ОH
ОПЫТ 188. ОПРЕДЕЛЕНИЕ НЕПРЕДЕЛЬНОСТИ ЖИРА
Р е а к т и в ы: растительное масло, твердый жир,
раствор брома в хлороформе, хлороформ
В одну пробирку вносят 1 каплю растительного масла, в
другую - 1 каплю расплавленного твердого жира и приливают по каплям хлороформ
до растворения. К растворам жиров в хлороформе добавляют по каплям раствор
брома в хлороформе до появления неисчезающей желтой окраски. Растительное масло
вследствие более высокой степени непредельности требует большего количества
раствора брома.
СН2ОСО(СН2)7СН =СН(СН2)7СН3 Вr2 СН2ОСО(СН2)7СНBr-СНBr(СН2)7СН3
СНОСО(СН2)7СН=СН(СН2)7СН3 СНОСО(СН2)7СНBr-СНBr(СН2)7СН3
СН2ОСО(СН2)7СН=СН(СН2)7СН3 СН2ОСО(СН2)7СНBr-СНBr(СН2)7СН3
ОПЫТ 189. ОКИСЛЕНИЕ РАСТИТЕЛЬНЫХ МАСЕЛ ПЕРМАНГАНАТОМ
КАЛИЯ
Р е а к т и в ы: растительное масло, 0,5% раствор
перманганата калия, 10% раствор ацетата натрия
В пробирку вносят по 0,5 мл растительного масла,
10%-ного раствора ацетата натрия, 0,5% раствор перманганата калия. Содержимое
пробирки тщательно встряхивают. Характерная малиново-фиолетовая окраска
раствора перманганата калия исчезает, в результате окисления входящих в
растительное масло глицеридов непредельных кислот.
СН2ОСО(СН2)7СН =СН(СН2)7СН3 [O] СН2ОСО(СН2)7СНOH-СНOH(СН2)7СН3
СНОСО(СН2)7СН=СН(СН2)7СН3 H2O СНОСО(СН2)7СНOH-СНOH(СН2)7СН3
СН2ОСО(СН2)7СН=СН(СН2)7СН3 СН2ОСО(СН2)7СНOH-СНOH(СН2)7СН3
Р е а к т и в ы: мыло
Кусочек полученного мыла (опыт 187) растворяют в 2-3
мл воды. Подогревают пробирку и убеждаются, что при нагревании мыло
растворяется значительно быстрее. При встряхивании содержимого пробирки
наблюдается обильное вспенивание.
RCOONa + НОН RСООН
+ NaOH
Другие щелочные мыла (калиевые, аммониевые) также
хорошо растворяются в воде.
Полученный водный раствор следует сохранить для
выполнения опытов, описанных ниже.
Опыт 191. ВЫДЕЛЕНИЕ СВОБОДНЫХ ЖИРНЫХ КИСЛОТ ИЗ МЫЛА
Р е а к т и в ы: раствор мыла, 10% раствор серной
кислоты
С помощью пипетки помещают в пробирку 5 капель
концентрированного раствора мыла и добавляют к нему 1 каплю 10% раствора серной
кислоты. Выпадает хлопьевидный белый маслянистый осадок свободных жирных
кислот, которые в воде не растворяются.
С17Н33СОNа + HOSO3OH C17H33COOH + NaHSO4
Опыт 192. ГИДРОЛИЗ СПИРТОВОГО РАСТВОРА МЫЛА
Р е а к т и в ы: мыло, этиловый спирт, спиртовый
раствор фенолфталеина
В сухую пробирку помещают кусочек мыла, 1 мл спирта,
энергично взбалтывают и добавляют 1 каплю раствора фенолфталеина. Окраска
раствора не изменяется.
К полученному раствору мыла прибавляют по каплям
дистиллированную воду - появляется розовое окрашивание. Разбавление спиртового
раствора мыла водой вызывает гидролиз мыла. В результате образуются свободные
мало диссоциирующие кислоты и гидроксид натрия. Появление в растворе
гидроксильных ионов изменяет окраску фенолфталеина.
C17H35COONa + НОН С17Н35СООН + NaOH
Опыт 193. ОБРАЗОВАНИЕ НЕРАСТВОРИМЫХ КАЛЬЦИЕВЫХ СОЛЕЙ
Р е а к т и в ы: мыло, 5% раствор хлорида кальция
В пробирку вносят 1 мл раствора мыла и добавляют по
каплям при взбалтывании 5% раствор хлорида кальция. Выпадает белый осадок
труднорастворимой в воде кальциевой соли жирных кислот.
C17H35COONa + CaCl2 NaCl +
(C17H35COO)2Ca.
IV.
СИНТЕЗЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органическим синтезом называется получение органического вещества
заданного состава и строения из более простых соединений.
Основы органического синтеза заложены немецким химиком Ф.Велером, который
в 1824 году впервые из неорганического вещества - цианата аммония получил
органическое вещество - мочевину:
NH4OCN
NH2CONH2
В последующие годы были осуществлены синтезы анилина (И.Н.Зинин, 1842
г.), уксусной кислоты (Г.Кольбе, 1845 г.), жиров (М.Бертло, 1854 г.),
сахаристых веществ (А.М.Бутлеров, 1861 г. и др.)
Во второй половине XIX
века сформировалась общая теория строения органических веществ (теория
Бутлерова), которая послужила основой для направленного синтеза сложных
органических веществ.
Первые синтезированные органические вещества нашли применение в медицине
и текстильной промышленности. В конце ХIХ века были получены синтетические лекарственные препараты,
что послужило основой для развития химико-фармацевтической промышленности. К
середине ХХ века были синтезированы отдельные представители природных веществ:
алкалоиды, витамины, антибиотики, пептиды, нуклеиновые кислоты, липиды,
углеводы.
Современный этап развития органической химии обогащен электронной теорией
механизмов химических реакций, стереохимическими представлениями, новыми
методами проведения химических реакций - от применения лазерной техники и
ультразвука до ферментативных процессов. Это позволяет осуществить синтезы
сложнейших природных соединений и их аналогов.
Разработка химической схемы синтеза (рис.4.1.) является довольно сложной
задачей, требующей больших знаний в области органической химии.
выбор методики синтеза
(литературный поиск)
описание методики синтеза
в
лабораторном журнале,
зарисовка прибора
выполнение синтеза
очистка синтезированного
соединения
определение растворимости
подтверждение химическая идентификация
некоторых физико-химичес- строения
полу- (проведение качественных
ких констант и спектраль- ченного
вещест- реакций на функциональ-
ных
характеристик ва
ные группы)
составление отчета
о проделанной работе
Рис. 4.1. Разработка химической схемы синтеза
Прежде чем приступить к проведению органического синтеза, следует
внимательно изучить методику, подготовить реактивы, химическую посуду, собрать
необходимые приборы. Особое внимание следует уделять вопросам безопасной
работы.
Полученные соединения содержат примеси, после проведения синтеза всегда
проводят очистку, определяют физические константы полученного вещества.
Установленные физические константы сопоставляют со справочными данными.
Результаты экспериментальной работы фиксируют в лабораторном журнале следующим
образом:
-§.
номер работы
-§. Синтез
название и структурная формула синтезируемого вещества
-§. Литература
4-§: Исходные вещества
название и количество
-§. Вспомогательные реактивы
название и количество
-§. Основная реакция
-§. Побочные реакции
-§. Расчет количества исходных веществ и определение коэффициента
избыточности
-§. Методика синтеза
приводится описание методики синтеза
-§. Рисунок
зарисовка приборов и приспособлений, используемых при синтезе
11-§. Расчет выхода продукта
-§. Физические константы
плотность, tкип, tпл, растворимость
-§. Вывод
IV.1
ГАЛОГЕНИРОВАНИЕ
Галогенированием называют реакции введения галогена в молекулу
органического вещества. Галогенпроизводные широко применяют в различных
синтезах как исходные продукты вследствие подвижности галогена и способности
его легко замещаться на различные функциональные группы.
Галогенирование осуществляют путем реакций замещения (заместительное
галогенирование) или присоединения (присоединительное галогенирование).
Заместительное галогенирование наблюдается при галогенировании насыщенных
углеводородов, ароматических углеводородов, спиртов, альдегидов и карбоновых
кислот.
При действии галогенов на насыщенные углеводороды процесс протекает при
инициировании светом по свободно-радикальному механизму:
СН3-СН2-СН3 + Cl2 CН3-СН-СН3 + HCl
Cl
Галогенирование ароматических углеводородов осуществляется по механизму
электрофильного замещения в присутствии катализаторов (FeCl3):

Замещение
гидроксильной группы на галоген в спиртах проходит по реакции нуклеофильного
замещения, причем отмечают бимолекулярное (SN2) и
мономолекулярное (SN1) замещение. Для первичных спиртов характерен SN2,
для третичных - SN1.
3Cl + NaOH (вод.) ® CH3OH + NaCl
СН3
СН3
½
½
СН3 - С - Br
+ NaOH (вод.) ® СН3 - С - ОН + NaBr
½
|
СН3
СН3
Галогенирование алифатических карбоновых кислот в α-положение проводят с помощью
галогенов в присутствии фосфора (реакция Гелля-Фольгарда-Зелинского):
P
СН3-СН2-СООН + Br2
СН3-СН-СООН
+ HBr
Br
Присоединительное галогенирование характерно для малых циклоалканов,
ненасыщенных углеводородов и соединений, содержащих кратную связь.
Например:
СН3
Вг
+ HBr
CН3 - СН2 - СН - СН3
Н3СН2СН=СН2
+ Вг2 CН3СН2СНВгСН2Вг
СН2=СН-COOH
+ HВг CН2-СН2-СOOH
Br
Реакции присоединительного галогенирования протекают по электрофильному
механизму. Следует помнить, что реакции присоединения по кратным связям в
ненасыщенных углеводородах протекают согласно правило Марковникова, в
ненасыщенных карбоновых кислот - против правила Марковникова.
IV.1.1
1-БРОМБУТАН
Н3-СН2-СН2-СН2-Вг
Схема синтеза
КВг + Н2SО4
НВг + КНSО4
C4H9OH +
НОSО3Н С4Н9ОSО3Н + Н2О
С4Н9ОSОЗН
+ НВг Н2SО4 + С4Н9Вг
КВг + H2SО4 + C4H9OH
С4Н9Вг + KHSО4 + Н2О
Побочные реакции
C4H9OH + НОSО3Н
С4Н9ОSО3Н + Н2О
С4H9OSО3Н
+ C4H9OH С4Н9ОSО2ОС4Н9
+ Н2О 4H9OSО3Н + C4H9OH
С4Н9ОС4Н9 + Н2SО4
Н3СН2СН2СН2OSО2OH
CН3СН2СН=СН2 + Н2SО4 Н3СН2СН2СН2OH
+ [O] CН3СН2СН2СНО
+ Н2О Н3СН2СН=СН2 +
НВг CН3СН2СНВгСН3
Н2SО4 +
2НВг SО2 + Вг2 + 2Н2ОН3СН2СН=СН2
+ Вг2 CН3СН2СНВгСН2Вг
С4Н9ОSО3Н
+ C4H9OH С4Н9ОC4H9
+ Н2О
Посуда, приборы
колба круглодонная емкостью 250 мл
колба Вюрца емкостью 50 мл
воронка делительная
аллонж
холодильник Либиха
термометр
водяная баня
колбонагреватель
Реактивы
н-бутиловый спирт С4Н9ОН (d=0,81г/см3)
- 18,6 г (23 мл)
бромид калия КВг -18,7 г
концентрированная серная кислота H2SО4 (d=1,84 г/см3) -12,5 мл
дистиллированная вода - 17,5 мл
разбавленный раствор бисульфита натрия
% раствор бикарбоната натрия
хлорид кальция
Методика синтеза и выделение продукта
В круглодонную колбу емкостью 250 мл помещают бромид калия, воду и
н-бутиловый спирт. При охлаждении в водяной бане и перемешивании в колбу
небольшими порциями добавляют 25 мл концентрированной серной кислоты. Колбу
оборудуют обратным холодильником и нагревают при слабом кипении в
колбонагревателе в течение 2 ч. В процессе нагревания раствор окрашивается в
красновато-коричневый цвет. Обратный холодильник убирают, колбу соединяют с
нисходящим холодильником. Усиливают нагревание и отгоняют 1-бромбутан в
приемник с 50 мл холодной воды.
Отгон вместе с водой переносят в делительную воронку, отделяют нижний
слой. Если продукт окрашен, к нему добавляют разбавленный раствор гидросульфита
натрия (для удаления следов брома). Примеси дибутилового эфира и бутанола-1
удаляют в сухой делительной воронке при обработке продукта равным объемом
концентрированной серной кислоты (осторожно!). Нижний (кислотный) слой сливают.
1-Бромбутан промывают последовательно водой, 10%-ным раствором гидрокарбоната
натрия, вновь водой. Затем мутный раствор 1-бромбутана сушат безводным хлоридом
кальция, слегка нагревая на водяной бане.
Высушенный продукт перегоняют, собирая фракцию, кипящую в интервале
98-1030С. Практический выход »12 г (70%).
Описание конечного продукта
Бутил бромид - бесцветная жидкость с характерным запахом, смешивается с
этиловым спиртом и диэтиловым эфиром, хорошо растворяется в ацетоне, tкип=101,50С, d=1,299 г/см3. При хранении на свету разлагается с выделением
брома.
IV.1.2
БРОМЭТАН
Н3-СН2-Вг
Схема синтеза
КВг + Н2SО4 НВг + КНSО4H9OH + НОSО3Н С4Н9ОSО3Н +
Н2О
С4Н9ОSОЗН + НВг Н2SО4 + С4Н9Вг
КВг + H2SО4 + C4H9OH С4Н9Вг + KHSО4 + Н2О
Побочные реакцииH9OH + НОSО3Н С4Н9ОSО3Н + Н2ОH9OSО3Н + C4H9OH
С4Н9ОSО2ОС4Н9 + Н2ОH9OSО3Н + C4H9OH С4Н9ОС4Н9 + Н2SО4Н3СН2СН2СН2OSО2OH
CН3СН2СН=СН2 + Н2SО4Н3СН2СН2СН2OH + [O] CН3СН2СН2СНО + Н2ОН3СН2СН=СН2 + НВг CН3СН2СНВгСН3
Н2SО4 + 2НВг SО2 + Вг2 + 2Н2ОН3СН2СН=СН2 + Вг2 CН3СН2СНВгСН2Вг
С4Н9ОSО3Н + C4H9OH С4Н9ОC4H9 + Н2О
Посуда, приборы
колба круглодонная емкостью 250 мл
колба Вюрца емкостью 50 мл
воронка делительная
аллонж
холодильник Либиха
термометр
водяная баня
колбонагреватель
Реактивы
н-бутиловый спирт С4Н9ОН (d=0,81г/см3)
- 18,6 г (23 мл)
бромид калия КВг -18,7 г
концентрированная серная кислота H2SО4 (d=1,84 г/см3) -12,5 мл
дистиллированная вода - 17,5 мл
разбавленный раствор бисульфита натрия
% раствор бикарбоната натрия
хлорид кальция
Методика синтеза и выделение продукта
В круглодонную колбу емкостью 250 мл помещают бромид калия, воду и
н-бутиловый спирт. При охлаждении в водяной бане и перемешивании в колбу
небольшими порциями добавляют 25 мл концентрированной серной кислоты. Колбу
оборудуют обратным холодильником и нагревают при слабом кипении в
колбонагревателе в течение 2 ч. В процессе нагревания раствор окрашивается в
красновато-коричневый цвет. Обратный холодильник убирают, колбу соединяют с
нисходящим холодильником. Усиливают нагревание и отгоняют 1-бромбутан в
приемник с 50 мл холодной воды.
Отгон вместе с водой переносят в делительную воронку, отделяют нижний
слой. Если продукт окрашен, к нему добавляют разбавленный раствор гидросульфита
натрия (для удаления следов брома). Примеси дибутилового эфира и бутанола-1
удаляют в сухой делительной воронке при обработке продукта равным объемом
концентрированной серной кислоты (осторожно!). Нижний (кислотный) слой сливают.
1-Бромбутан промывают последовательно водой, 10%-ным раствором гидрокарбоната
натрия, вновь водой. Затем мутный раствор 1-бромбутана сушат безводным хлоридом
кальция, слегка нагревая на водяной бане.
Высушенный продукт перегоняют, собирая фракцию, кипящую в интервале
98-1030С. Практический выход »12 г. (70%).
Описание конечного продукта
Бутил бромид - бесцветная жидкость с характерным запахом, смешивается с
этиловым спиртом и диэтиловым эфиром, хорошо растворяется в ацетоне, tкип=101,50С, d=1,2990. При хранении на свету разлагается с выделением
брома.
IV.1.3
БРОМБЕНЗОЛ
Н5-Вг
Схема синтеза

Побочные
реакции
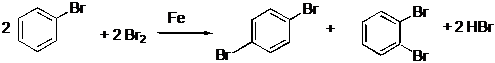
Посуда,
приборы
колба
круглодонная двугорлая емкостью 250 мл
колба
Вюрца емкостью 50 мл
воронки
делительная и капельная
холодильник
обратный с газоотводной трубкой
термометр
водяная
баня
прибор
для перегонки с водяным паром
колбонагреватель
Реактивы
бензол
С6Н6 (d=0,879 г/см3) - 19,4 г (22 мл)
бром
Вг2 (d=3,1 г/см3) - 31 г (10 мл)
железные
опилки - 0,5 г
%
раствор гидроксида натрия
безводный
хлорид кальция
Методика
синтеза и выделение продукта
Работа
проводится в вытяжном шкафу!
В
круглодонную двухгорлую колбу, снабженную капельной воронкой и обратным
холодильником с газоотводной трубкой, вносят 0,5 г железных опилок, 22 мл
предварительно осушенного бензола, а затем по частям прибавляют 10 мл брома из
капельной воронки. После добавления очередной порции брома содержимое колбы
осторожно взбалтывают. Оставшееся количество брома после начала выделения
бромоводорода приливают в колбу, не допуская бурного протекания реакции. Для
завершения реакции колбу в течение 30 мин нагревают на теплой водяной бане (~250С),
затем постепенно повышают температуру бани до 60-700С. Нагревание прекращают,
когда над жидкостью в колбе исчезнут бурые пары брома. Смесь выливают в колбу
Вюрца емкостью 50 мл и отгоняют бромбензол с водяным паром. Сменив приемник и
слив воду из холодильника, отгоняют п-дибромбензол. Дистиллят с бромбензолом
переносят в делительную воронку, отделяют от верхнего водного слоя и сушат
безводным хлоридом кальция. Из высушенного продукта отгоняют с воздушным
холодильником фракцию, кипящую при температуре 152-1580С. Полученный продукт
переносят в делительную воронку, промывают водой, разбавленным раствором
гидроксида натрия, сушат хлоридом кальция. Практический выход ≈ 18 г
(40%).
Описание
конечного продукта
Бромбензол
- тяжелая прозрачная жидкость, плохо растворима в воде, хорошо растворяется в
спирте, эфире, хлороформе, бензоле, tкип=156,20С, d=0,1495
г/см3.
IV.2
СУЛЬФИРОВАНИЕ
Введение
сульфогруппы -SO3H в молекулу вещества называют сульфированием.
Сульфирование осуществляют прямым путем с использованием сульфирующих агентов: H2SO4, SO3,
олеум и т.д.
Простым
примером сульфирования является сульфирование ароматических углеводородов по
механизму электрофильного замещения:
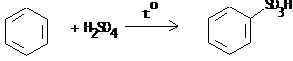
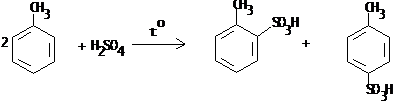
Следует
отметить, что соединения с электродонорными заместителями более
реакционноспособны в реакциях сульфирования и направляют входящую сульфогруппу
в орто- и пара-положения, соединения с электроноакцепторными заместителями
менее реакционноспособны и направляют сульфогруппу в мета-положение.
Путем
подбора оптимальных условий возможно селективное сульфирование, так при
сульфировании фенола на холоду приемущественно образуется о-фенолсульфокислота,
тогда как при 1000С - п-фенолсульфокислота.
Прямое
сульфирование алканов протекает с трудом и сопровождается, как правило,
окислением вещества:
CН3-СН2-СН2-СН3
+ Н2SO4 CН3-CН2-CН-СН3 + H2O
SO3H
Значительно
легче сульфируются ненасыщенные углеводороды согласно правилу Марковникова:
CН3-СН2-СН=СН2 +
Н2SO4 CН3-CН2-CН-СН3
SO3H
IV.2.1
п-Толуолсульфокислота
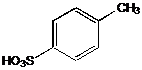
Схема
синтеза
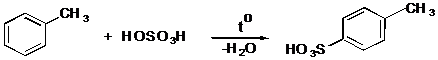
Побочные
реакции
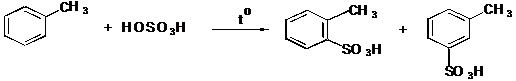
(мизерном
количестве) + Н2О
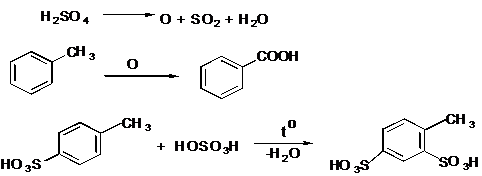
Посуда,
приборы
колба
круглодонная емкостью 200 мл
холодильник
обратный
стакан
емкостью 500 мл
песчаная
баня
прибор
для получения хлороводорода
фильтр
стеклянный
эксикатор
фарфоровая
чашка
электрическая
плита
Реактивы
толуол
С6Н5СН3 (d=0,867 г/см3) - 27,8 г (32 мл)
концентрированная
серная кислота H2SО4 (d=1,84 г/см3) - 34,9 г (19 мл)
активированный
уголь
хлорид
натрия
Методика
синтеза и выделение продукта
Работу
проводят в вытяжном шкафу!
В
длинногорлую круглодонную колбу емкостью 200 мл, снабженную обратным водяным
холодильником, помещают 32 мл толуола, 19 мл концентрированной серной кислоты и
2-3 капилляра. Смесь, часто перемешивая, нагревают в течение 1 часа при слабом
кипении раствора. К этому времени слой толуола почти исчезает, что служит
признаком окончания реакции. Теплую реакционную смесь выливают в стакан со 100
мл воды. К полученному раствору темного цвета добавляют 1 г активированного
угля и кипятят в вытяжном шкафу до обесцвечивания. Уголь отфильтровывают через
складчатый фильтр, а раствор упаривают в фарфоровой чашке на песчаной бане до
50 мл.
Полученный
раствор охлаждают льдом и для осаждения п-толуол-сульфокислоты насыщают
газообразным хлороводородом, полученным в колбе Вюрца из хлорида натрия и
концентрированной серной кислоты (перед добавлением серной кислоты соль следует
смочить концентрированной хлороводородной кислотой). Хлороводород пропускают до
насыщения раствора и прекращения образования осадка. Кристаллический продукт
отфильтровывают на стеклянном фильтре и тщательно отжимают.
Бюкс
с веществом сначала помещают в эксикатор и сушат над серной кислотой, а затем -
над щелочью (для поглощения хлороводорода). Высушивание продукта длится в
течение нескольких дней. Практический выход » 40 г (77%).
Описание
конечного продукта
п-Толуолсульфокислота
- бесцветное кристаллическое вещество, хорошо растворимое в воде, этаноле,
эфире. Гигроскопична, на воздухе расплывается, tпл=104-1050С.

.2.2
п-Толуолсульфокислый натрий
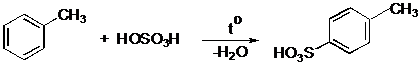
Схема
синтеза
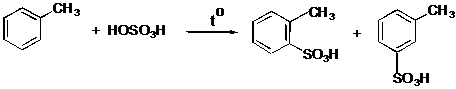

Побочные
реакции
(мизерном
количестве) + Н2О
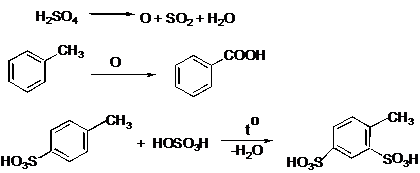
Посуда,
приборы
колба
круглодонная емкостью 250 мл
форштосс
делительная
воронка
холодильник
Либиха
колбонагреватель
воронка
Бюхнера
колба
Бунзена
стакан
емкостью 500 мл
Реактивы
толуол
С6Н5СН3 (d=0,867 г/см3) - 28 г (32 мл)
концентрированная
серная кислота H2SО4 (d=1,84 г/см3) - 20 мл
бикарбонат
натрия - 15 г
хлорид
натрия - 40 г
Методика
синтеза и выделение продукта
В
длинногорлую круглодонную колбу, соединенную с помощью рогатого форштосса с
обратным холодильником, вносят толуол, через делительную воронку по каплям
добавляют концентрированную серную кислоту, добавляют осколки фарфора,
закрывают верхнее горло пробкой и нагревают на асбестовой сетке до кипения,
периодически перемешивая содержимое колбы. После закипания интенсивность
нагревания уменьшают, нагревание продолжают в течение одного часа, реакционную
смесь периодически через каждые 2-3 минуты помешивают, чтобы оба слоя
перемешивались. При нагревании в течение часа слой толуола исчезает, из
холодильника прекращается стекание капель толуола, что является признаком
окончания реакции. Ещё теплую реакционную смесь, сильно перемешивая, переносят
в стакан со 100 мл воды, а колбу споласкивают небольшим количеством воды. Если
реакционная смесь начинает в стакане кристаллизироваться, то её нагревают до
растворения выпавших кристаллов. Кислый раствор частично нейтрализуют,
осторожно небольшими порциями вносят 15 г бикарбоната натрия, все время
перемешивая. Затем добавляют 40 г хлорида натрия, перемешивают реакционную
смесь и нагревают её до кипения. Если соль растворяется не полностью, массу
слегка охлаждают, затем осторожно добавляют воду и нагревают. Горячий раствор
фильтруют, маточный раствор охлаждают льдом. Выпавшие кристаллы отсасывают и
промывают 20 мл холодного раствора хлорида натрия. Практический выход » 17 г (с примесью хлорида натрия).
Описание
конечного продукта
п-Толуолсульфокислый
натрий - бесцветное кристаллическое вещество, хорошо растворимое в воде,
этаноле, эфире.
IV.2.3 Сульфаниловая кислота
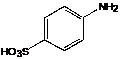
Схема
синтеза

Посуда,
приборы
колба
круглодонная емкостью 100 мл
холодильник
воздушный
воронка
Бюхнера
колба
Бунзена
масляная
баня
воронка
для горячего фильтрования
кристаллизатор
стаканы
емкостью 100, 250 мл
Реактивы
анилин
свежеперегнанный С6Н5NH2 (d=1,022 г/см3) - 8,18 г (9,1 мл)
концентрированная
серная кислота H2SО4 (d=1,84 г/см3) - 30,3 г (16,5 мл)
%
раствор хлороводородной кислоты HС1
гидроксид
натрия - 4 г
активированный
уголь
бумага
индикаторная универсальная
Методика
синтеза и выделение продукта
Работу
проводят в вытяжном шкафу!
В
круглодонную колбу емкостью 100 мл помещают 9,1 мл свежеперегнанного анилина и
набольшими порциями при постоянном встряхивании добавляют 16,5 мл концентрированной
серной кислоты. Смесь сильно разогревается. Колбу закрывают воздушным
холодильником и нагревают на масляной бане (~170-1800С) в течение 2 ч. Для
определения момента завершения реакции пробу смеси растворяют в 1 мл воды и
добавляют раствор гидроксида натрия (до щелочной реакции). Реакция завершена,
если не выделяются маслянистые капли анилина.
По
окончании реакции смесь слегка охлаждают и осторожно, при перемешивании
стеклянной палочкой, переносят в стакан со 150 мл холодной воды. Выделяется
кристаллический осадок сульфаниловой кислоты. Смесь охлаждают в кристаллизаторе
с измельченным льдом в течение 20 мин и осадок отфильтровывают на воронке
Бюхнера, промывая небольшим количеством холодной воды. Полученный продукт
растворяют в стакане в минимальном количестве горячей воды, в случае
необходимости добавляют немного активированного угля, раствор кипятят в течение
5 мин. Фильтруют на воронке для горячего фильтрования через складчатый фильтр.
При охлаждении из фильтра выделяются бесцветные кристаллы сульфаниловой
кислоты. Осадок отфильтровывают, промывают небольшим количеством холодной воды
и сушат между листами фильтровальной бумаги на воздухе. Практический выход » 12 г (70%).
Описание
конечного продукта
Сульфаниловая
кислота (п-аминобензолсульфокислота) - бесцветное кристаллическое вещество,
трудно растворима в большинстве органических растворителей и холодной воде. При
1000С теряет кристаллизационную воду, при нагревании до 2800С разлагается, не
плавясь.
IV.3
АЦИЛИРОВАНИЕ
Ацилирование
- введение ацильной группы -С=О в молекулу органического соединения путем
замещения атома водорода. В зависимости от атома, к которому присоединяется
ацильная группа, различают C-, O-, N-, S-ацилиро-вание.
Частными
случаями реакции ацилирования являются реакции формилирования (введение НСО-
группы), ацетилирования (СН3СО- группы) и бензоилирования (С6Н5СО- группы).
Несмотря
на различия в методах проведения реакций, общим для всех вариантов ацилирования
является реакция вещества и ацилирующего агента, протекающая как правило по механизму
электрофильного замещения. Наиболее распространенными ацилирующими агентами
являются ангидриды и хлорангидриды карбоновых кислот.
Наиболее
распространенной реакцией С-ацилирования является реакция Фриделя-Крафтса.
Реакция протекает в присутствии кислот Льюиса (чаще всего хлорида алюминия):
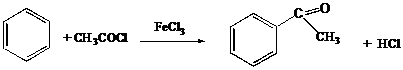
Реакцию
ацилирования по Фриделю-Крафтсу удается распространить на ароматические
углеводороды и галогенопроизводные. Ароматические амины образуют с
катализатором неацилирующийся комплекс, реакция удается, если аминогруппа
защищена ацетилированием.
Ароматические
соединения с сильными акцепторными заместителями (-NO2, -CN, -C=O) не
ацилируются по Фриделю-Крафтсу.
Реакция
этерификации, являющаяся по сути реакцией О-ацилирования, используется в
качестве основного способа получения сложных эфиров.
2SO4
СН3СН2СООН
+ С2Н5ОН СН3СН2СООС2Н5 + Н2O
Реакции
этерификации возможны для окси- и фенолокислот. Фенолы и фенолокислоты
этерифицируются не карбоновыми кислотами, а их ангидридами и хлорангидридами.

Реакции
N-ацилирования характерны для первичных и вторичных
алифатических и ароматических аминов, аминокислот.
СН3NН2 +
СН3СОС1 СН3NН-СОСН3 + НС1
IV.3.1 Этиловый эфир уксусной
кислоты
СН3-C=O
ОСН2CH3
Схема
синтеза
конц.
H3SO4, t
СН3СООН
+ СН3СH2ОН СН3СООСН2СН3 + Н2О
Посуда,
приборы
колбы
Вюрца емкостью 100 мл - 2 шт
колба
коническая емкостью 100 мл
холодильник
Либиха
капельная
воронка
делительная
воронка
термометр
водяная
баня
масляная
баня
алонж
Реактивы
уксусная
кислота СН3СООН (d=1,05 г/см3) - 21 г (20 мл)
этиловый
спирт С2Н5ОН (d=0,79 г/см3) - 18,15 г (23 мл)
концентрированная
серная кислота H2SО4 (d=1,84 г/см3) - 4,6 г (2,5 мл)
%
раствор карбоната натрия - 50 мл
насыщенный
раствор хлорида кальция - 50 мл
безводный
хлорид кальция
индикаторная
бумага универсальная
Методика
синтеза и выделение продукта
Работу
проводят в вытяжном шкафу!
В
колбу Вюрца емкостью 100 мл помещают 3 мл этанола и 2,5 мл концентрированной
серной кислоты. Колбу снабжают капельной воронкой, а отводной отросток колбы
соединяют с нисходящим холодильником, снабженным аллонжем и приемником. Колбу
помещают на маслянистую баню и нагревают до 1400С. С помощью капельной воронки
медленно приливают смесь 20 мл ледяной уксусной кислоты и 20 мл этилового спирта
с такой скоростью, с какой отгоняется образующийся уксусноэтиловый эфир.
Полученный
этилацетат переносят в делительную воронку и для удаления непрореагировавшей
уксусной кислоты промывают 40%-ным раствором карбоната натрия до нейтральной
среды верхнего слоя по универсальной индикаторной бумаге. Затем отделяют нижний
слой, а верхний эфирный слой встряхивают с 50 мл насыщенного раствора хлорида
кальция для удаления непрореагировавшего спирта. После разделения слоев в
делительной воронке эфирный слой переносят в коническую колбу емкостью 100 мл,
сушат безводным хлоридом кальция (~10 г), отфильтровывают через складчатый
фильтр в колбу Вюрца, соединенную с низходящим холодильником, и перегоняют на
водяной бане, собирая фракцию, кипящую при 75-790С. Практический выход ≈
20 г (65%).
Описание
конечного продукта
Уксусноэтиловый
эфир (этиловый эфир уксусной кислоты, этилацетат) - бесцветная жидкость с
приятноым запахом, смешивается со многими органическими растворителями
(этиловый спирт, бензол, хлороформ), ограниченно растворяется в воде, tкип=77,150С,
d=1,901 г/см3.
IV.3.2 Ацетилсалициловая
кислота

Схема
синтеза
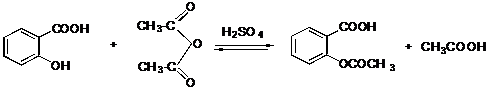
Побочные
реакции
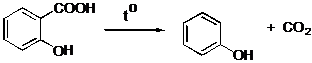
Посуда,
приборы
колба
круглодонная емкостью 100 мл
форштосс
делительная
воронка
термометр
холодильник
Либиха
колбонагреватель
воронка
Бюхнера
колба
Бунзена
стакан
емкостью 250 мл
Реактивы
салициловая
кислота о-НОС6Н4СООН - 6,5 г
уксусный
ангидрид (СН3СО)2О (d=1,082 г/см3) - 6 г
концентрированная
серная кислота H2SО4 (d=1,84 г/см3) - 0,5 мл
толуол
- 40 мл
дистиллированная
вода
В
круглодонную колбу емкостью 100 мл помещают салициловую кислоту, уксусный
ангидрид и серную кислоту. Смесь слегка нагревают и перемешивают, колбу
закрывают обратным холодильником и нагревают в течение часа на водяной бане при
температуре 600С, затем температуру бани повышают до 900С и продолжают
нагревание еще в течение одного часа. Затем реакционную массу, периодически
перемешивая стеклянной палочкой, охлаждают вначале на воздухе, а затем в
кристаллизаторе холодной водой со льдом
Выпадают
блестящие игольчатые кристаллы. Их отфильтровывают на воронке Бюхнера,
промывают ледяной водой, а затем небольшим количеством толуола. Выход » 7,5 г.
Описание
конечного продукта
Ацетилсалициловая
кислота (аспирин) - бесцветное кристаллическое вещество, растворяется в этиловом
спирте, диэтиловом эфире, трудно растворяется в воде, tпл=136,50С.
IV.3.3 Ацетанилид
С6Н5NH-C=O
CH3
Схема синтеза
(CH3CO)2O, CH3COONa
С6Н5NH2
С6Н5NH2 . HCl С6Н5NH-C=O
CH3COOH,
-NaCl CH3
Посуда,
приборы
стакан
емкостью 500 мл
колбы
конические емкостью 50 мл - 2 шт
воронка
Бюхнера
колба
Бунзена
термометр
водяная
баня
кристаллизатор
Реактивы
анилин
свежеперегнанный С6Н5NH2 (d=1,022 г/см3) - 4,6 г (4,5 мл)
уксусный
ангидрид (СН3СО)2О (d=1,082 г/см3) - 6,5 г (6 мл)
кристаллический
ацетат натрия СН3СООNа - 7,5 г
хлороводородная
кислота HС1 (d=1,19 г/см3) - 5 мл
Методика
синтеза и выделение продукта
Работу
проводят в вытяжном шкафу!
В
стакан с 250 мл воды приливают 5 мл концентрированной хлороводородной кислоты и
при перемешивании прибавляют 4,5 мл свежеперегнанного анилина. Раствор
нагревают на водяной бане до 500С и при интенсивном перемешивании приливают 6
мл уксусного ангидрида и сразу же - предварительно приготовленный раствор 7,5 г
ацетата натрия в 50 мл воды. Реакционную массу охлаждают в кристаллизаторе со
льдом.
Выпавшие
кристаллический осадок отфильтровывают на воронке Бюхнера, промывают малыми
количествами холодной воды (3 порции по 50 мл) и сушат. Выход ≈ 5,5 г
(69%).
Описание
конечного продукта
Ацетанилид
- бесцветное кристаллическое вещество без запаха, растворяется в этиловом
спирте, диэтиловом эфире, хлороформе, умеренно растворяется в воде, tпл=1140С,
d=1,026 г/см3.
IV.4 ПОЛУЧЕНИЕ
ГЛИКОЗИДОВ
Гликози́ды - органические соединения, молекулы которых состоят
из углеводного <#"876815.files/image184.gif">
Схема
синтеза

Посуда,
приборы
стакан
емкостью 150 мл,
колбы
конические емкостью 50 мл - 2 шт,
воронка
Бюхнера,
колба
Бунзена,
водяная
баня,
кристаллизатор
Реактивы
глюкоза
С6Н12О6 - 10 г.
белый
стрептоцид NH2SO2C6H4NH2 - 9,6 г.
концентрированная
соляная кислота НС1 - 1 капля
смесь
диэтилового эфира и этилового спирта
Методика
синтеза и выделение продукта
В
стакан емкостью 150 мл всыпают 10 г глюкозы, вливают 100 мл теплой воды и смесь
перемешивают до полного растворения глюкозы. Затем в раствор глюкозы порциями
добавляют 9,6 г белого стрептоцида. Реакционная смесь тщательно перемешивается.
Реакционную
смесь нагревают в течение 30 минут на водяной бане, охлаждают. В охлажденную
реакционную смесь добавляют 1 каплю концентрированной хлороводородной кислоты.
Образуются белые кристаллы, которые отфильтровывают на воронке, промывают
смесью диэтилового эфира и этилового спирта. Выход ≈ 18 г.
Описание
конечного продукта
N-гликозид
белого стрептоцида - бесцветное кристаллическое вещество без запаха, не
растворяется в этиловом спирте, диэтиловом эфире, умеренно растворяется в воде.
ЛИТЕРАТУРА
1. Черных
В.П. и др. Органическая химия. т. 1, 2, 3, Харьков, «Осново», 1993, 1995, 1998
гг.
2. Черных
В.П. и др. Общий практикум по органической химии. Харьков, «Золотые страницы»,
2002 г.
. Черных
В.П. Лекции по органической химии. Харьков, «Золотые страницы», 2003 г.
. Татаренко
А.Н., Тиллаев К.С. Малый практикум по органической химии. Т., «Медицина», 1977
г.
. Шабаров
Ю.С. Органическая химия. т. 1, 2, М., «Химия», 1996 г.
. Тюкавкина
Н.А., Бауков Ю.Н. Биоорганическая химия. М., «Медицина», 1985 г.
7. Тюкавкина
Н.А. Руководство к лабораторным занятиям по органической химии. М., «ПАИМС»,
1993 г.
. Степаненко
Б.Н. Курс органической химии. М., «Высшая школа», т. 1, 2, 1981 г.
. Пальянц
Н.Ш. Конспект лекций по органической химии. Ташкент, 2000 г.
. Нейланд
О.Я. «Органическая химия». М., «Высшая школа», 1990 г.
. Реутов
О.Л., Курц А.Л., Бутин К.П. Органическая химия. М., «Мир», т. 1-4, 1999-2002
гг.
. Смит
В., Бочков А., Кейпл Р. Органический синтез. М., «Мир», 2001 г.
. Сайкс
П. Механизмы реакций в органической химии. М., «Химия», 1991 г.
14. G.London.
Organic Chemistry. Oxford Univ. Press, 2002.
. J.Jonle,
K.Mills. Heterocyclic Chemistry. Blackwell Scince, 2002.