Метаболизм гема
Лекция
Метаболизм гема
1. Строение и синтез
гема
гем билирубин гемоглобин
Гем является простетической группой
многих белков: гемоглобина, миоглобина, цитохромов митохондриальной ЦПЭ,
цитохрома Р450, участвующего в микросомальном окислении. Ферменты
каталаза, пероксидаза, цитохромоксидаза содержат гем в качестве кофермента. Все
клетки организма имеют гемсодержащие белки, поэтому синтез гема идёт во всех
клетках, за исключением эритроцитов, не имеющих, как известно,
белоксинтезирующей системы.
Гем имеет тетрапиррольную структуру,
т.е. состоит из 4-х замещенных пиррольных колец, соединенных между собой с
помощью метиленовых мостиков. Эта структура называется порфирином (без железа).
Протопорфирин, в который включено железо, называется ГЕМ. В геме
гемоглобина находится протопорфирин IX, который имеет 4 метильных, 2 винильных радикала и 2 остатка
пропионовой кислоты. Железо в геме находится в восстановленном состоянии (Fe+2) и связано двумя ковалентными и двумя координационными связями с
атомами азота пиррольных колец. Две координационные связи идут на связь с
остатками гистидина в молекулах глобина. Белковая часть Hb состоит из димеров α1b1 и α2b2.
При окислении железа гем
превращается в гематин (Fe3+).
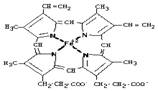
Рис. 1. Строение гема
Синтез гемоглобина происходит в кроветворных органах, причем гем и глобин
синтезируются по отдельности. Затем соединяются, и образуется третичная и
четвертичная структура гемоглобина.
Гем синтезируется
во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном
мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатацитах -
для образования цитохрома Р450.
1-образование
5-аминолевулиновой кислоты из глицина и сукцинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из
субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует
пиридоксальзависимый фермент аминолевулинатсинтаза (является ключевым ферментом
биосинтеза гема, кофермент - производное витамина В6, фермент
ингибируется по принципу отрицательной обратной связи избытком гема).
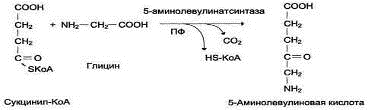
2- из митохондрий 5-аминолевулиновая кислота поступает в
цитоплазму
-соединение 2 молекул 5-аминолевулиновой кислоты в молекулу порфобилиногена
(аминолевулинатдегидратаза),
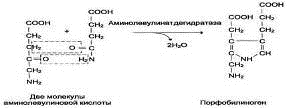
-дезаминирование порфобилиногена с образованием гидроксиметилбилана
(порфобилиногендезаминаза),
5-ферментативное превращение гидроксиметилбилана в молекулу уропорфобилиногена
III, (уропорфириноген III косинтаза)
-декарбоксилирование последнего с образованием копропорфириногена
III (уропорфириногендекарбоксилаза)
7-Гидроксиметилбилан может также неферментативно превращаться в уропорфириноген
I,
8-уропорфириноген I декарбоксилируется в копропорфириноген I (уропорфириногендекарбоксилаза)
9-из цитоплазмы копропорфириноген III опять поступает в митохондрии,
10-окислительние копропорфириногена III в протопорфириноген IX (копропорфириноген III оксидаза)
11-протопорфириногена IX окисляется в протопорфирин IX (копропорфириноген III оксидаза)
12-к протопорфирину IX присоединяется двухвалентное железо, образуется гем
(феррохелатаза). Источник железа - белок ферритин. В комплексе с
ферритином в организме хранится (депонируется) резерв железа.
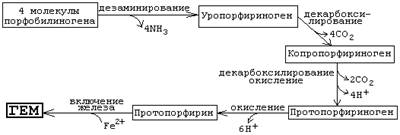
Рис. 2 Схема реакций, протекающих
при синтезе гема
2 (в цитозоль) 3
Глицин+сукцинил-КоА→5-аминолевулиновая
кислота → 2 5-аминолевулината →
4 7 8
Порфобилиноген→гидроксиметилбилан→уропорфириногенI→
копропорфириноген I
↓5
уропорфобилиноген III
↓6
копропорфириногена III
↓ 9 поступает в митохондрии
копропорфириноген III
↓10
протопорфириноген IX
↓11
протопорфирин IX
↓12 (Fe+2)
Гем
2. Регуляция биосинтеза
гема
Регуляторный фермент - пиридоксальзависимая
аминолевулинатсинтаза. Гем по принципу отрицательной обратной связи
ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является
индуктором трансляции α- и β - цепей гемоглобина. Скорость реакции регулируется:
1) аллостерически
(гем-аллостерический ингибитор
2) на уровне трансляции
фермента (гем - корепрессор, синтез фермента на этапе трансляции регулирует
железо: участке инициации мРНК имеется последовательность нуклеотидов,
образующая шпилечную петлю, которая называется железочувствительным элементом,
взаимодействие железа с ним вызывает снижение сродства этого белка к мРНК,
кодирующей аминолевулинатсинтазу. При низких концентрациях железа
железосвязывающий белок присоединяется к железочувствительному элементу,
находящемуся на 5'-нетранслируемом конце мРНК, и трансляция
аминолевулинатсинтазы тормозится
Аминолевулинатдегидратаза
также аллостерически ингибируется гемом, но так как активной этого
фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не
имеет большого физиологического значения Дефицит пиридоксальфосфата и
лекарственные препараты, которые являются его структурными аналогами, снижают
активность аминолевулинатсинтазы.
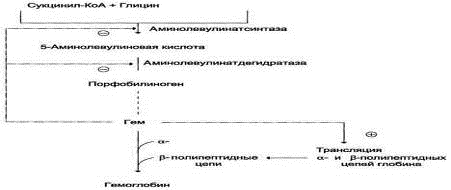
Рис. 3. Регуляция синтеза гема и
гемоглобина
. Синтез глобина
Цепи α
и b
глобина синтезируются на полисомах, образованных, как правило, пятью
рибосомами. Цепь α освобождается первой, присоединяется к b - цепи, еще связанной с рибосомой, и отделяет ее, образуя димер (αb). Два
димера соединяются в молекулу НЬ (α2b2). Соединение гема с глобином может происходить или в процессе
синтеза полипептидных цепей или после окончания синтеза глобина. Ферменты
синтеза гема аллостерические, ингибируются гемом и гемоглобином. Синтез
пептидных цепей происходит только в присутствии гема. При низкой концентрации
гема синтез глобина замедляется. Отсюда синтез гема и глобина происходит
координированно и ни один из этих компонентов не образуется в избыточном или
недостаточном количестве.
. Аномалии синтеза гема
При некоторых
наследственных нарушениях метаболизма порфиринов происходит их накопление - Порфирия
(«порфирин» в переводе с греч. означает пурпурный). Наследственные порфирии
обусловлены генетическими дефектами ферментов, участвующих в синтезе гема, за
исключением аминолевулинатсинтазы, отмечают снижение образования гема
(аллостерический ингибитор), следовательно активность аминолевулинатсинтазы
повышается и это приводит к накоплению промежуточных продуктов синтеза гема -
аминолевулиновой кислоты и порфириногенов. Различают в зависимости от локализации
процесса порфирии:
1) печёночные
сопровождаются накоплением порфиринов в гепатоцитах
2) эритропоэтические
наследственные сопровождаются накоплением порфиринов в нормобластах и
эритроцитах
При врожденной
эритропоэтической порфирии происходит накопление уропорфирина I,
преждевременное разрушение эритроцитов. Моча у больных окрашена в красный цвет,
зубы флюоресцируют в ультрафиолете ярко-красным светом из-за накопления
порфиринов. Кожа очень чувствительна к свету. Наблюдают нейропсихические
расстройства, нарушения функций РЭС, повреждения кожи. Порфириногены не
окрашены и не флуоресцируют, но на свету они легко превращаются в порфирины,
которые проявляют интенсивную красную флуоресценцию в ультрафиолетовых лучах.
Нейропсихические расстройства при порфириях связаны с тем, что аминолевулинат и
порфириногены являются нейротоксинами.
Иногда при лёгких
формах наследственных порфирий заболевание может протекать бессимптомно, но
приём лекарств, являющихся индукторами синтеза аминолевулинатсинтазы,
вызвать обострение болезни. Индукторами синтеза аминолевулинатсинтазы являются
такие известные лекарства, как сульфаниламиды, барбитураты, диклофенак,
вольтарен, стероиды, гестагены. В некоторых случаях симптомы болезни не
проявляются до периода полового созревания, когда повышение образования β - стероидов вызывает
индукцию синтеза аминолевулинатсинтазы.
Порфирии наблюдают
при отравлениях солями свинца, так как свинец ингибирует
аминолевулинатдегидратазу и феррохелатазу. Некоторые галогенсодержащие
гербициды и инсектициды являются индукторами синтеза аминолевулинатсинтазы,
поэтому попадание их в организм сопровождается симптомами порфирии.
Генетически обусловленное нарушение
синтеза одной из нормальных цепей гемоглобина приводит к талассемии. Если
угнетается синтез b -
цепей, развивается b-талассемия, α - цепей - α - талассемия. При b-талассемии
наряду с НЬА в крови появляется до 15% НЬА2 и резко повышается
содержание HbF. Болезнь характеризуется поражением печени, селезенки,
разрушением костного мозга, деформацией черепа, тяжелой гемолитической анемией.
α - талассемия
несовместима с жизнью, так как α - цепи входят в состав всех гемоглобинов.
. Обмен железа
А) содержание и функции
железа
Общее содержание железа в организме - 3-4 г.:
· 70% циркулирует в
составе гемоглобина эритроцитов;
· 25% железа хранится
в ретикулоэндотелиальной системе печени, селезенке, костном мозгу. Это
резервное железо.
· Около 0,1% железа
циркулирует в плазме крови в связанной с белками форме.
· Остальное его
количество входит в состав гемсодержащих белков миоглобина, цитохромов,
каталазы, пероксидазы.
· железо входит в
состав белков, не содержащих гемогруппы, - железосерных, флавопротеинов
Б) Обмен железа
В обмене железа принимает участие ряд белков. Трансферрин мембран клеток
слизистой кишечника участвует во всасывании железа и переносе его из клеток
слизистой в кровь. Апотрансферрин крови отличается от мембранного
трансферрина аминокислотным составом. Имеет два центра связывания железа. В
плазме крови могут быть разные молекулярные формы этого белка:
моно-ферритрансферрин (присоединен один атом железа), диферритрансферрин
(присоединено два атома железа) и апотрансферрин (не содержит железа). Трансферрин
- это транспортная форма железа в крови. Апоферритин содержится во всех тканях.
Его функция - запасание железа. Этот белок имеет несколько субъединиц и может
присоединять до 4500 атомов металла. При присоединении железа к этому белку
образуется ферритин. Гемосидерин - резервная форма железа
(возможно, образуется при укрупнении молекул ферритина).
В) Нарушения обмена
железа и основные биохимические показатели
В пищевых продуктах железо
трехвалентное, а через клеточные мембраны транспортируется двухвалентный металл
(витамин С способствует переводу трехвалентного железа в двухвалентное и его
всасыванию).
Дефицит железа приводит к развитию гипохромной макроцитарной анемии (при
хронических кровопотерях, нарушении всасывания железа). При избыточном
поступлении железа в организм (массивные переливания крови, усиление всасывания
железа, наследственный идиопатический гемохроматоз, неадекватная терапия
препаратами железа) возможна интоксикация. Накопление железа в паренхиматозных
клетках печени, сердца, поджелудочной железы, других органах сопровождается
функциональными и органическими повреждениями тканей.
В плазме крови железо связано с
особым белком b1-глобулиновой фракции - трансферрином. В норме этот белок
насыщен железом лишь на 30%. Максимальное количество железа, которое может
присоединить трансферрин до своего насыщения, обозначают как общую
железосвязывающую способность сыворотки крови (ОЖСС). ОЖСС дает
представление о содержании трансферрина в организме. Очевидно, этот показатель
складывается из насыщенной железом части трансферрина (это содержание
сывороточного железа) и ненасыщенной (НЖСС). Отношение связанного в
трансферрине железа к общему представляет собой коэффициент насыщения
трансферрина.
Нормальные значения: сывороточное
железо - 14,3 - 21,5 мкмоль/л; свободный трансферрин (НЖСС) - 26,9-41,2
мкмоль/л; общий трансферрин (ОЖСС) - 54-72 мкмоль/л.
. Обмен меди
Медь входит в состав ферментов,
например цитохромоксидазы (перенос е на 1/2O2,). Медь присутствует в
активном центре лизилоксидазы - фермента, осуществляющего формирование
поперечных сшивок между полипептидными цепями коллагена и эластина.
Недостаток меди приводит к образованию дефектного коллагена. В хранении и
транспорте меди главную роль играет белок церулоплазмин, синтезирующийся
в печени. Он участвует в образовании трансферрина. При нарушении синтеза
церулоплазмина происходит патологическое накопление меди в печени и мозгу, что
приводит к нарушению функции ЦНС (гепатолентикулярная дистрофия, болезнь
Вильсона-Коновалова).
Медь встречается в эритроцитах
(10%), около 90% ее входит в состав церулоплазмина (Сu-α2-глобулиновый комплекс).
Незначительное количество находится в свободном состоянии. Содержание меди
в крови: женщины - 13,4-24,4 мкмоль/л; мужчины - 11,0-22,0 мкмоль/л;
новорожденные - 3,1-9,4 мкмоль/л; концентрация церулоплазмина - 300-380 мг/л.
Обмен меди нарушен при анемиях, маточных кровотечениях, заболеваниях с распадом
тканей.
. Катаболизм гемоглобина
Эритроциты имеют короткое время
жизни (примерно 120 дней). При физиологических условиях в организме взрослого
человека разрушается около
-2x1011 эритроцитов в
сутки. Их катаболизм происходит главным образом в ретикулоэндотелиальных
клетках селезёнки, лимфатических узлов, костного мозга и печени. При
старении эритроцитов снижается содержание сиаловых кислот в составе
гликопротеинов плазматической мембраны. Изменённые углеводные компоненты
гликопротеинов мембран эритроцитов связываются рецепторами клеток РЭС, и
эритроциты «погружаются» в них эндоцитозом. Распад эритроцитов в этих клетках начинается
с распада гемоглобина на гем и глобин и последующего гидролиза ферментами
лизосом белковой части гемоглобина.
А) Распад гема
Билирубин образуется при распаде
гемоглобина, который протекает в клетках ретикулоэндотелиальной системы -
купферовских клетках печени, гистиоцитах соединительной ткани любого органа.
) Вначале происходит разрыв
метинового мостика между 1-м и 2-м пиррольными ядрами порфиринового кольца с
одновременным окислением двухвалентного железа в трехвалентное. Образуется
пигмент вердоглобин.
) Вердоглобин окисляется под
действием НАДФН2-зависимой гемоксигеназы теряет железо (Fe+2→ Fe+3) и глобин, уходит вода
и СО, порфириновое кольцо разворачивается в цепи и образуется желчный пигмент
желто-зеленого цвета - биливердин.
) Под действием НАДФН2-зависимой
биливердин-редуктазы биливердин ферментативным путем восстанавливается в
красно-желтый пигмент - билирубин (свободный, неконъюгированный,
нерастворимый)
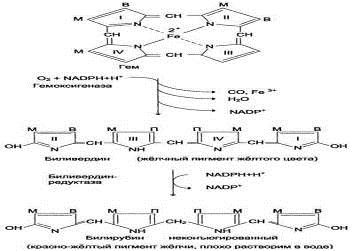
Рис. 4.
Распад гема. М - (-СН3) -
метильная группа; В - (-СН=СН2) - винильная группа; П - (-СН2-СН2-СООН)
- остаток пропионовой кислоты. В ходе реакции одна метильная группа
превращается в окись углерода и, таким образом, раскрывается структура кольца.
Образованный биливердин под действием биливердинредуктазы превращается в
билирубин.
Б) Метаболизм билирубина
Свободный, неконьюгированный
билирубин нерастворим в воде, поэтому в крови транспортируется в комплексе с
альбумином. Для определения свободного билирубина в крови необходимо
предварительное осаждение белка спиртом (непрямая реакция Ван-Дер-Берга).
Только после этого билирубин вступает во взаимодействие с диазореактивом,
поэтому его иначе называют непрямым билирубином. Свободный (непрямой) билирубин
не проходит через почечный барьер и в мочу не попадает.
) В печени непрямой билирубин
соединяется (конъюгирует) с УДФ-глюкуроновой кислотой под действием УДФ-глюкуронилтрансферазы
с образованием глюкуронид билирубина - прямого, связанного,
конъюгированного, билирубина, он растворим в воде, дает прямую реакцию
с диазореактивом (прямая реакция Ван-Дер-Берга). Прямой (связанный)
билирубин - это нормальный компонент желчи, попадающий в кровь в очень
небольшом количестве. Он может проходить через почечный барьер, но в крови его
очень мало, поэтому в моче он не определяется обычными лабораторными методами.
) Вместе с желчью прямой билирубин
попадает в тонкий кишечник.
) в кишечнике от него отщепляется
глюкуроновая кислота (b-глюкуронидаза)
) происходит восстановление прямого
билирубина с образованием: 5-уробилиногена → 1-уробилиногена →
1-стеркобилиногена.
) Уробилиногены реабсорбируются в
кишечнике и включаются в эн-теропеченочную и экстрапеченочную циркуляцию; в
почках окисляются в уробилин; выводятся с мочой.
) Стеркобилиноген не всасывается,
при контакте с воздухом окисляется в стеркобилин и выводится с калом.

Рис. 5. Образование билирубиндиглюкуронида
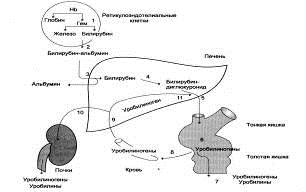
Рис. 6. Билирубин - уробилиногеновый
цикл в печени
1 - катаболизм Нb в ретикулоэндотелиальных клетках
костного мозга, селезёнки, лимфатических узлов;
- образование транспортной формы
комплекса билирубин-альбумин;
- поступление билирубина в печень;
- образование билирубинглюкуронидов;
- секреция билирубина в составе
жёлчи в кишечник;
-катаболизм билирубина под действием
кишечных бактерий;
- удаление уробилиногенов с
фекалиями;
- всасывание убилиногенов в кровь;
- усвоение уробилиногенов печенью;
- поступление части уробилиногенов в
кровь и выделение почками с мочой; 11 - небольшая часть уробилиногенов
секретируется в жёлчь.
В. Распределение желчных
пигментов в норме следующее:
кровь: общий билирубин - 8,55-20,52 мкмоль/л, непрямой (свободный)
билирубин - 6,41-15,40 мкмоль/л, прямой (связанный) билирубин-0-5,1 мкмоль/л; желчь:
прямой (связанный) билирубин; кал: стеркобилиноген; моча:
уробилиноген - 0,5-3,4 мг/сут.
. Нарушения обмена
билирубина. Желтухи. Диагностика
Определение желчных пигментов имеет
важное значение в дифференциальной диагностике желтух различной этиологии. Желтуха
- это синдром, характеризующийся желтой окраской кожи, слизистых, сыворотки в
результате отложения желчных пигментов при нарушениях желчеобразования и
желчевыделения. Различают 3 вида желтух:
1. Гемолитическая
желтуха (надпеченочная). Усиленный гемолиз
эритроцитов приводит к интенсивному образованию в клетках
ретикулоэндотелиальной системы непрямого билирубина. Печень не в состоянии
связать весь этот билирубин с глюкуроновой кислотой. В результате в крови и
тканях накапливается непрямой билирубин. Так как через печень идет повышенный
поток непрямого билирубина, образуется больше и прямого билирубина. Увеличение
потока прямого билирубина в желчь приводит к увеличению образования
уробилиногенов и стеркобилиногена в кишечнике. Кал приобретает более
интенсивное окрашивание.
Кровь: повышение общего билирубина
за счет повышения непрямого билирубина. Кал: повышение стеркобилиногена (темная
окраска).
Моча: билирубин (-),
уробилиноген(+).
Желтуха новорождённых - «физиологическая желтуха», наблюдающаяся в первые дни жизни
ребёнка. Причиной повышения концентрации непрямого билирубина в крови служит
ускоренный гемолиз и недостаточность функции белков и ферментов печени,
ответственных за поглощение, конъюгацию и секрецию прямого билирубина. У
новорождённых не только снижена активность УДФ-глюкуронилтрансферазы, но и,
по-видимому, недостаточно активно происходит синтез второго субстрата реакции
конъюгации УДФ-глюкуроната. УДФ-глюкуронилтрансфераза - индуцируемый фермент.
Новорождённым с физиологической желтухой вводят лекарственный препарат
фенобарбитал.
Одно из неприятных осложнений
«физиологической желтухи» - билирубиновая энцефалопатия. Когда
концентрация неконъюгированного билирубина превышает 340 мкмоль/л, он проходит
через гематоэнцефалический барьер головного мозга и вызывает его поражение.
2. Паренхиматозная
желтуха (печеночная). Повреждение клеток
печени приводит к нарушению их функций.
. Нарушается экскреция прямого
билирубина в желчные капилляры. Он частично попадает в кровь, где увеличивается
его содержание. Прямой билирубин способен проходить через почечный барьер,
поэтому в моче определяется билирубин. Снижение содержания прямого билирубина в
желчи приведет к уменьшению образования стеркобилиногена.
. Нарушается процесс конъюгации
свободного билирубина, поэтому в крови увеличится содержание и непрямого
билирубина.
. Нарушается процесс разрушения
уробилиногена, который в большом количестве попадает в общий кровоток и
выделяется с мочой.
. При патологии небольшая часть
неконъюгированного билирубина ковалентно связывается с альбумином -
5-билирубин. При лабораторном анализе определяется как часть прямого
билирубина. Из-за ковалентной связи с альбумином циркулирует более недели после
исчезновения билирубина в моче. При паренхиматозной желтухе на долю δ-билирубина приходится
89-90% от общего билирубина.
Кровь: повышение содержания общего
билирубина за счет повышения уровней непрямого и прямого билирубинов (рост доли
δ - билирубина).
Кал: понижение стеркобилиногена
(более светлая окраска кала).
Моча: билирубин (+), уробилиноген
(+,-).
3. Обтурационная желтуха
(механическая, подпеченочная). При
частичной или полной закупорке желчных протоков нарушается желчевыделение и
составные части желчи попадают в кровь, т.е. в крови увеличивается содержание
прямого билирубина, а значит, он будет и в моче. Так как желчь в меньшем
количестве или совсем не поступает в кишечник, резко уменьшается количество
стеркобилиногена. При полной закупорке кал обесцвечивается.
Кровь: повышение содержания общего
билирубина (за счет непрямого и особенно прямого билирубина).
Кал: резкое снижение уровня
стеркобилиногена (ахоличный стул).
Моча: билирубин (+), уробилиноген
(-).
Проявления обтурационной и
паренхиматозной желтухи очень сходны. Критерием для дифференцированного
диагноза является наличие уролиногена в моче (при паренхиматозной желтухе) и
резкое увеличение прямого билирубина в крови (при обтурационной).
Таблица 1. Виды желтух
|
Название
|
Причины возникновения
|
Биохимические показатели продуктов обмена билирубина
|
|
|
кровь
|
кал
|
|
Гемолитическая желтуха (надпеченочная, новорожденных)
|
Разрушение эритроцитов
|
↑ непрямого билирубина
|
↑ уробилирубина
|
↑ уробилирубина, стеркобилина
|
|
Паренхиматозная желтуха (печеночная)
|
повреждение клеток печени вирусами, токсинами
|
↑ прямого и непрямого билирубина
|
Появление прямого билирубина, ↓ уробилирубина
|
↓ выделения стеркобилина
|
|
Обтурационная желтуха (механическая, подпеченочная)
|
Механические нарушения оттока желчи в кишечник
|
↑ прямого и непрямого билирубина
|
↑ прямого билирубина
|
Отсутствие желчных пигментов (бесцветный)
|
9. Биохимические
механизмы патогенеза печеночной недостаточности
Повреждение печени приводит к
нарушению ее метаболических функций, в том числе реакций обезвреживания. Признаки
печеночной недостаточности:
) развитие желтухи (в острых случаях
может наступить смерть до ее появления); 2) тяжелые нарушения обмена
электролитов, в частности гипокалиемия, обусловленная вторичным
гиперальдостеронизмом; гиперальдостеронизм связан с нарушением инактивации
альдостерона в печени;
) удлинение протромбинового времени
и другие нарушения свертывания крови, так как основные белки системы
свертывания крови синтезируются в печени;
) сниженпе концентрации мочевины в
плазме и накопление NH3;
) гипогликемия (из-за нарушения
синтеза и распада гликогена).
Накопление токсических веществ -
аммиака, билирубина, чужеродных соединений - является основной причиной
наступления печеночной комы.
Повреждения клеток
печени могут быть, вызваны различными факторами: инфекционными болезнями (как правило, вирусными); токсинами,
лекарственными препаратами (парацетамол), алкоголем; гипоксией и / или застоем
крови при сердечной недостаточности, коме; длительной закупоркой желчных
протоков.