Ответы экзамен горения и взрыва
1.
Актуальность изучения вопросов теории горения и взрыва
для
защиты окружающей среды.
Пожары
и взрывы причиняют значительный материальный ущерб, в ряде случаев вызывают тяжелые
травмы и гибель людей. Ущерб от пожаров и взрывов в промышленно развитых
странах превышает 1% национального дохода и имеет тенденцию постоянного роста.
В России также происходит ежегодное увеличение количества пожаров и убытков от
них, а количество людей, погибающих на пожарах, превышает 12 тысяч в год.
Наибольшие
убытки от пожаров и взрывов отмечаются в энергетике, в нефтегазодобыче и
переработке. Колоссальные материальные убытки и экологический ущерб приносят
лесные пожары.
С каждым годом увеличиваются объемы обращающихся на объектах
экономики горючих веществ и материалов. Знание свойств этих веществ и
материалов, влияющих на их пожарную и взрывную опасность, является одним из
условий, необходимых для прогнозирования развития пожара и его опасных
факторов, а в конечном итоге позволяет планировать противопожарные меры.
2.
Понятия горение (10) и горючая система
Горение ,
сложное, быстро протекающее химическое превращение, сопровождающееся выделением
значительного количества тепла и
обычно ярким свечением (пламенем). В большинстве случаев основу Г. составляют
экзотермические окислительные реакции вещества, способного к Г. ( горючего ), с
окислителем. Современная физико-химическая теория горения
относит к горению
все химические процессы, связанные с быстрым превращением и
тепловым или диффузионным их ускорением, в том числе разложение взрывчатых веществ, озона,
и др.; соединение ряда веществ с хлором,
фтором
и т. д.; взаимодействие многих металлов
с хлором,
окисей натрия
и бария с двуокисью
углерода и т. д. Химическая реакция
горения
в большинстве случаев является сложной, т. е. состоит из большого числа элементарных
химических процессов. Кроме того, химическое превращение при горении тесно связано с рядом физических процессов
— переносом тепла и масс и
характеризуется соответствующими гидро- и
газодинамическими закономерностями.
В большинстве случаев при пожаре окисление горючих
веществ происходит кислородом воздуха.Горючее вещество и кислород
являются реагирующими веществами и составляют горючую систему, а
источник зажигания вызывает в ней реакцию горения. Источником зажигания может
быть горящее пли накаленное тело, а также электрический разряд, обладающий
запасом энергии, достаточным для возникновения горения и др.
Горючие системы подразделяются
на однородные и неоднородные. Однородными являются системы, в которых горючее
вещество и воздух равномерно перемешаны друг с другом (смеси горючих газов,
паров с воздухом). Горение таких систем называют горением кинетическим.
Скорость его определяется скоростью химической реакции, значительной при
высокой температуре. При определенных условиях такое горение может носить
характер взрыва или детонации. Неоднородными являются системы, в которых горючее
вещество и воздух не перемешаны друг с другом и имеют поверхности раздела (твердые
горючие материалы и нераспыленные жидкости). В процессе горения неоднородных
горючих систем кислород воздуха проникает (диффундирует) сквозь продукты
горения к горючему веществу и вступает с ним в реакцию. Такое горение называют диффузионным
горением, так как его скорость определяется главным образом сравнительно
медленно протекающим процессом-диффузией.
3.
Виды реакций горения.
Горение подразделяется на тепловое и цепное.
В основе теплового
горения лежит химическая реакция ,
способная протекать с прогрессирующим самоускорением вследствие накопления
выделяющегося тепла. Цепное горение встречается в случаях некоторых
газофазных реакций при низких давлениях.
По
агрегатному состоянию
горючего и
окислителя
различают: 1) гомогенное горение — горение газов и парообразных горючих
в среде газообразного окислителя
(большей частью кислорода
воздуха);
2) горение взрывчатых веществ
и порохов;
3) гетерогенное горение — горение жидких и
твёрдых горючих в среде газообразного окислителя;
горение в системе
жидкая горючая смесь — жидкий окислитель
(например, кислота).
Виды
горения
Диффузионное
горение Характеризуется
раздельным подачей в зону горения горючего и окислителя. Перемешивание
комонентов происходит в зоне горения. Пример: горение водорода и кислорода в ракетном двигателе,
горение газа в бытовой газовой плите.
Горение
предварительно смешанной среды (гомогенное горение)
Как
следует из названия, горение происходит в смеси, в которой одновременно
присутствуют горючее и окислитель. Пример: горение в цилиндре двигателя
внутреннего сгорания бензиново-воздушной смеси после инициализации процесса свечой
зажигания.
Беспламенное
горение В отличие от
обычного горения , когда наблюдаются зоны окислительного пламени и восстановительного пламени, возможно
создание условий для беспламенного горения . Примером может служить каталитическое окисление
органических веществ на поверхности подходящего катализатора,
например, окисление этанола на платиновой
черни.
Тление
Вид
горения , при котором пламя не образуется, а зона горения
медленно распространяется по материалу. Тление обычно наблюдается у пористых
или волокнистых материалов с высоким содержанием воздуха или пропитанных окислителями.
Тление в определённых условиях приводит к самовозгоранию материалов.
Автогенное
горение Самоподдерживающиеся
горение . Термин используется в технологиях
сжигания отходов.
Возможность автогенного (самоподдерживающегося) горения
отходов определяется предельным содержанием балластирующих компонент: влаги и
золы. На основе многолетних исследований шведский ученый Таннер предложил для
определения границ автогенного горения использовать
треугольник-схему с предельными значениями: горючих более 25%, влаги менее 50%,
золы менее 60%.[1]
Горение
и взрыв В определённых условиях
скорость горения может меняться, при этом
можно наблюдать процессы перехода горения
во взрыв. При высоких скоростях горения
генерируются звуковые волны, например при сжигании смеси водорода с кислородом
можно наблюдать изменение частоты звука горения
в зависимости от соотношения концентраций.
4. Горение в
техногенных устройствах и горение при техногенных пожарах
Техногенная
опасность – состояние, внутренне присущее технической
системе, промышленному или транспортному объекту, реализуемое в виде поражающих
воздействий источника техногенной чрезвычайной ситуации на человека
и окружающую среду при его возникновении, либо в виде прямого или
косвенного ущерба для человека и окружающей среды в процессе нормальной эксплуатации
этих объектов.
К
техногенным относятся чрезвычайные ситуации,
происхождение которых связано с производственно-хозяйственной деятельностью
человека на объектах техносферы. Как правило, техногенные ЧС
возникают вследствие аварий, сопровождающихся самопроизвольным выходом в
окружающее пространство вещества и (или)
энергии.
Наиболее распространенными
источниками возникновения чрезвычайных ситуаций техногенного характера являются
пожары и взрывы, которые происходят: - на промышленных объектах; - на объектах
добычи, транспортировки, хранения и переработки легковоспламеняющихся, горючих
и взрывчатых веществ; - на транспорте; - в шахтах, горных выработках,
метрополитенах; - в зданиях и сооружениях жилого, социально-бытового и
культурного назначения, а также в лесных и торфяных массивов.
Виды пожаров – характеристики
различных пожаров в зависимости от условий их возникновения
и развития. В целях детального изучения пожаров и разработки
тактики борьбы с ними все пожары классифицируются по группам,
классам и видам . По условиям газо- и теплообмена с окружающей
средой пожары разделены на 2 большие группы – на открытом
пространстве и в ограждениях.
Пожары на открытом
пространстве условно могут быть разделены на 3 вида :
распространяющиеся; нераспространяющиеся
(локальные); массовые.
Нераспространяющиеся
(локальные) - пожары , у
которых размеры остаются неизменными. Локальный пожар представляет
собой частный случай распространяющегося, когда возгорание окружающих
пожар объектов от лучистой теплоты исключено. В этих условиях
действуют метеорологические параметры. Так, например, из достаточно мощного
очага пожара огонь может распространяться в
результате переброса искр и головней в сторону негорящих объектов по
направлению ветра. Такой механизм характерен для крупных пожаров
лесоскладов, в сельской местности, на открытых складах различных материалов, в
районах городской застройки с узкими улицами. На крупных складах нефти и нефтепродуктов
пожар одного или группы резервуаров
относится к виду нераспространяющихся.
Однако при определенных условиях пожары на
нефтескладах перерастают в распространяющиеся. Распространение горения
на соседние резервуары может происходить при выбросах горящих нефтепродуктов и
деформациях металлических резервуаров.
Классификация пожаров
по признаку распространения тесно связана со временем их развития. Массовый
пожар может возникнуть на больших
площадях складов твёрдых и жидких горючих материалов, в лесных массивах,
сельских населенных пунктах и рабочих поселках, застроенных зданиями с низкой сопротивляемостью
воздействию пожара .
Пожары
в ограждениях различают двух видов :
открытые и закрытые. Открытым пожарам
свойственно свободное выгорание горючих материалов без перехода во
взрыв (вспышку). Эти пожары развиваются
при полностью или частично открытых проёмах (ограниченная вентиляция).
Они характеризуются высокой скоростью распространения горения с
преобладающим направлением в сторону открытых проёмов и переброса через них
факела пламени, вследствие чего создаётся угроза перехода огня в верхние
этажи и на соседние здания (сооружения). При открытых пожарах
скорость выгорания материалов зависит от их физико-химических свойств,
распределения в объёме помещения и условий газообмена.
Экспериментально установлено, что
при закрытых пожарах (в
помещениях) скорость выгорания наиболее распространённых горючих материалов не
зависит от их физико-химических свойств, распределения в объёме помещения и
полностью лимитируется расходом воздуха, поступающего через щели и неплотные
соединения окон и дверей. Исключение составляют особо опасные
кислородосодержащие горючие материалы (целлулоид, порох и др.), а также
некоторые синтетические полимерные материалы, содержащие легколетучие
компоненты. Скорость выгорания таких веществ и материалов очень высока и может
протекать либо без доступа кислорода, либо при ограниченном доступе. Для
закрытых пожаров характерны опасность
перехода пожара во взрыв (вспышку) при
увеличении поступления воздуха в помещение после периода протекания пожара в условиях ограниченного доступа
воздуха, а также опасность разрушения строительных конструкции при превышении
пределов их огнестойкости. Вместе с тем тушение пожаров
в помещениях достигается легче в связи с возможностью применения высокоэффективного
объёмного способа пожаротушения.
От вида
пожара , определяемого свойствами горючих
веществ и материалов, зависит выбор способов и средств тушения
пожара . Так, при горении металлов и металлосодержащих веществ
наиболее приемлемыми средствами пожаротушения являются огнетушащие порошки, а
при пожарах разливов ЛБЖ и ГЖ основным средством
тушения является пена.
5.
Горючие и окисляющие вещества.
Горючими называются
вещества , способные самостоятельно гореть после изъятия источника загорания.
По степени горючести вещества делятся на:
горючие (сгораемые), трудногорючие (трудносгораемые) и негорючие
(несгораемые).
К горючим относятся такие вещества, которые
при воспламенении посторонним источником продолжают гореть и после его
удаления.
К трудногорючим относятся такие вещества,
которые не способны распространять пламя и горят лишь в месте воздействия
источника зажигания.
Негорючими являются вещества, не воспламеняющиеся
даже при воздействии достаточно мощных источников зажигания (импульсов).
Горючие вещества могут быть в трех агрегатных
состояниях: жидком, твердом и газообразном (возможно и 4-ое состояние
вещества – плазма)
Большинство горючих веществ независимо от агрегатного
состояния при нагревании образует газообразные продукты,которые при
смешении с воздухом, содержащим определенное количество кислорода,
образуют горючую среду. Горючая среда может образоваться при тонкодисперсном
распылении твердых и жидких веществ.Из горючих газов и пыли образуются горючие
смеси при любой температуре, в то время как твердые вещества и жидкости могут
образовать горючие смеси только при определенных температурах.
При горении твердых материалов горючее
вещество и воздух не перемешаны, имеют поверхность раздела, и горение
протекает в так называемом диффузионном режиме, т.е. скорость реакции определяется
скоростью подвода (отвода) продуктов реакции (лимитирующая стадия - диффузия).
Если молекулы кислорода хорошо перемешаны с
горючим веществом – горение определяется кинетикой химической реакции (обмен
электронами), а режим -кинетическим. Горение такой смеси может происходить в
виде взрыва.
Вещества окисляющие (окисляющиеся)
— вещества, поддерживающие горение, вызывающие воспламенение и / или способствующие
воспламенению др. веществ в результате окислительно-восстановительной
экзотермической реакции. (в процессе окислительно-восстановительной реакции окислитель
присоединяет электроны).
На основании степени их опасности окисляющие
вещества отнесены к одной из следующих групп: а = окислители, сильно
способствующие горению
b = окислители, способствующие
горению
с = окислители, незначительно
способствующие горению
Окислителем в процессе горения может
быть кислород, а также хлор, бром и другие вещества.
В большинстве случаев при пожаре окисление горючих веществ
происходит кислородом воздуха.
В воздухе содержится около 21%
кислорода. Горение большинства веществ становится невозможным,
когда содержание кислорода в воздухе понижается до 14-18%, и только некоторые
горючие вещества (водород, этилен, ацетилен и др.) могут гореть при содержании
кислорода в воздухе до 10% и менее. При дальнейшем уменьшении содержания
кислорода горение большинства веществ прекращается.
6.
Общее понятие о цепных реакциях и автокатализе.
К
цепным реакциям относят
реакции, протекающие с образованием свободных радикалов, способных превращать
реагенты в конечные продукты, поддерживая постоянство свободных радикалов или
даже увеличивая их (разветвленная цепная
реакция ).
Разветвленные цепные
реакции характеризуются тем,
что в каждом элементарном акте продолжения цепи происходит увеличение числа
активных частиц (напр., окисление водорода кислородом). Это приводит к автокатализу
и при критических условиях к самовоспламенению, или цепному взрыву.
В
цепных реакциях выделяют три стадии: зарождение цепи,
ее развитие и обрыв. Зарождение (иницирование) происходит под воздействием
светового, радиационного, термического или другого воздействия.
Цепные
реакции — химические и ядерные реакции, в которых появление
активной частицы (свободного
радикала или атома
в химических, нейтрона
в ядерных процессах) вызывает большое число (цепь) последовательных превращений
неактивных молекул
или ядер. Свободные радикалы или атомы в отличие от молекул обладают свободными
ненасыщенными валентностями (непарным электроном), что приводит к их взаимодействию с исходными молекулами.
При первом же столкновении свободного радикала (R°) с молекулой происходит
разрыв одной из валентных связей последней, и, таким образом, в результате
реакции образуется новая химическая связь и новый свободный радикал, который в
свою очередь реагирует с другой молекулой — происходит цепная
реакция
Автокатализ
(от авто...
и катализ),
ускорение химической реакции одним из её продуктов
Катализ
(от греч. katálysis — разрушение), изменение
скорости химических реакций в присутствии веществ (катализаторов),вступающих в промежуточное химическое взаимодействие с
реагирующими веществами, но восстанавливающих после каждого цикла промежуточных
взаимодействий свой химический состав. Реакции с участием катализаторов
называются каталитическими
Катализаторы,
вещества, изменяющие скорость химических реакций посредством многократного промежуточного
химического взаимодействия с участниками реакций и не входящие в состав
конечных продуктов. Более 70% всех химических превращений веществ, а среди
новых производств более 90% осуществляется с помощью К.
7. Деструкция
веществ и энерговыделение при горении. Продукты горения.
Деструкция
- разложение органических веществ и превращение их в неорганические с высвобождением
энергии. лат.Destructio – разрушение
При горении веществ в воздухе происходит быстрая химическая
реакция между горючим веществом и кислородом воздуха с интенсивным тепловыделением.
Образование пламени связано с газообразным состоянием веществ , поэтому горение жидких и твердых веществ предполагает их переход в
газообразную фазу. В случае горения
жидкостей этот процесс обычно заключается в простом кипении с испарением у
поверхности. При горении почти всех
твердых материалов образование веществ ,
способных улетучиваться с поверхности материала, и попадание в область пламени
происходит путем химического разложения (пиролиза)
При полном горении продуктами сгорания являются двуокись углерода (CO2), вода (H2O), азот (N), сернистый ангидрид (SO2), фосфорный ангидрид. При неполном горении
обычно образуются едкие, ядовитые горючие и взрывоопасные продукты:
окись углерода, спирты, кислоты, альдегиды.
8.
Температуры горения.
Тепло, выделяющееся при сгорании топлива,
воспринимается продуктами сгорания, которые нагреваются до определенной
температуры , называемой температурой горения .
Различают калориметрическую, теоретическую и действительную температуры
сгорания топлива.
В уравнение теплового баланса реального
горения входят составляющие, величина которых зависит не только от
теплофизических свойств топлива, но и от условий, при которых протекает
горение . Например, от степени подогрева топлива и воздуха, потерь
теплоты при горении , тепловосприятия в топке, коэффициента избытка
воздуха.
Чтобы выявить потенциальные возможности топлива,
вводят понятие горения без подогрева топлива и воздуха при
идеальном адиабатическом процессе, т. е. горения с теоретическим
количеством воздуха, без потерь теплоты и без теплообмена в топочной камере и с
окружающей средой. Полученная в этих условиях температура продуктов сгорания
называется теоретической.
Калориметрическая
температура отражает влияние подогрева топлива и
воздуха и коэффициента избытка расхода воздуха α на
температуру адиабатического горения . Повышение
температуры подогрева топлива и воздуха увеличивает приход теплоты
в зону горения и повышает температуру
горения , а увеличение коэффициента избытка
воздуха α вызывает увеличение объема продуктов сгорания Vг,
что понижает температуру горения .
Поэтому в зависимости от влияния этих факторов калориметрическая температура
может быть выше или ниже теоретической.
В реальных условиях не все тепло, выделяющееся при
горении , идет на нагрев продуктов реакции, так как часть тепла
передается экранной системе топочной камеры и некоторое количество тепла теряется
в окружающую среду; кроме того, при высоких температурах происходит
диссоциация части продуктов сгорания (СО2 и Н2О),
сопровождающаяся поглощением тепла.
Отношение действительной температуры
горения топлива к теоретической называется пирометрическим
коэффициентом.
9.
Ламинарный и турбулентный газодинамические режимы горения
Дозвуковое горение (дефлаграция) в
отличие от взрыва
и детонации протекает с низкими скоростями и не связано с
образованием ударной
волны. К дозвуковому
горению относят нормальное ламинарное
и турбулентное
распространения пламени, к сверхзвуковому — детонацию.
Ламинарное пламя обладает вполне определённой скоростью перемещения
относительно неподвижного газа, которая зависит от состава смеси, давления
и температуры и определяется только химической кинетикой и
молекулярной теплопроводностью. Эта нормальная скорость является физико-химической
константой смеси.
10.
Гомогенное и гетерогенное горение.
Горением называется
сложный физико-химический процесс взаимодействия горючего вещества
и окислителя, характеризующийся самоускоряющимся превращением
и сопровождающийся выделением большого количества тепла
и света. (Обычно в качестве окислителя участвует кислород воздуха,
которого содержится около 21%).
Для возникновения и развития процесса
горения необходимы: горючее вещество, окислитель и источник
воспламенения, инициирующий реакцию.
Горючее вещество и окислитель должны
находиться в определенных соотношениях друг с другом.
Горение , как правило, происходит в
газовой фазе. Поэтому горючие вещества, находящиеся в конденсированном
состоянии (жидкие, твердые материалы), для возникновения и
поддержания горения должны подвергаться газификации (испарению,
разложению), в результате которой образуются горючие пары и газы в
количестве, достаточном для горения .
В зависимости от агрегатного состояния горючих
веществ горение может быть гомогенным и
гетерогенным .
Гомогенное
горение : компоненты горючей смеси находятся в газообразном
состоянии. Причем, если компоненты перемешаны, то горение называют кинетическим. Если не перемешаны – диффузионное горение.
Гетерогенное
горение : характеризуется наличием раздела фаз в горючей
смеси (горение жидких и твердых горючих веществ в среде
газообразного окислителя).
Горение
различается также по скорости распространения пламени и в зависимости от этого
фактора оно может быть:
-
дефляграционным (скорость
пламени в пределах нескольких метров с секунду);
-
взрывным (скорость пламени до сотен метров в
секунду);
-
детонационным (скорость пламени
порядка тысяч метров в секунду).
Кроме того
различают: ламинарное горение,
характеризуемое послойным распространением фронта пламени по горючей смеси; турбулентное, характеризуемое
перемешиванием слоев потока и повышенной скоростью выгорания.
Равномерное
распространение горения устойчиво лишь в том случае, если оно не сопровождается
повышением давления. Когда горение происходит в замкнутом пространстве, или
выход газообразных продуктов затруднителен, то повышение температуры приводит к
интенсивному расширению газовых объемов и взрыву.
Под взрывом понимают быстрое превращение
веществ, сопровождающееся выделением энергии и образованием сжатых газов,
способных производить работу.
Пожаром называется
неконтролируемое горение вне специального очага, наносящее материальный ущерб и
представляющее опасность для людей.
11.
Кинетический и диффузионный режимы горения.(2)
Горючие системы подразделяются
на однородные и неоднородные. Однородными являются системы, в которых горючее
вещество и воздух равномерно перемешаны друг с другом (смеси горючих газов,
паров с воздухом). Горение таких систем называют горением кинетическим.
Скорость его определяется скоростью химической реакции, значительной при
высокой температуре. При определенных условиях такое горение может носить
характер взрыва или детонации. Неоднородными являются системы, в которых горючее
вещество и воздух не перемешаны друг с другом и имеют поверхности раздела (твердые
горючие материалы и не распыленные жидкости). В процессе горения неоднородных
горючих систем кислород воздуха проникает (диффундирует) сквозь продукты
горения к горючему веществу и вступает с ним в реакцию. Такое горение называют диффузионным
горением, так как его скорость определяется главным образом, сравнительно
медленно протекающим процессом-диффузией.
12.
Состав горючих веществ и окислителя при расчётах параметров
горения
в атмосфере.
При большинстве пожаров в основе
горения лежат реакции соединения горючих веществ с кислородом воздуха и только
в отдельных случаях, когда горят взрывчатые вещества, пиротехнические изделия и
другие материалы с положительным кислородным балансом, горение происходит за
счет кислорода, содержащегося в молекуле горючего вещества или кислорода
окислителя.
Поскольку
воздух состоит из 21 % (об.) кислорода и 79 % (об.) азота, т.е. в нем на 1 моль
кислорода приходится 79/21 = 3,76 молей азота, то уравнение реакции горения
вещества в воздухе составляют с учетом того, что на каждый моль кислорода
приходится по 3,76 моля азота.
Например, реакции горения водорода, метана, этана, пропана,
ацитилена и спирта, и запишутся в виде следующих уравнений:
2Н2 +02 +3,76N2 = 2H2 0 + 3,76N2.
СН4 + 202 +
2 * 3,76N2 = С02
+ 2Н20 + 2 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С3Н8 + 502
+ 5* 3,76N2 = 3С02
+ 4Н20 + 5 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С2Н50Н + 302 + 3 • 3/76N
2 = 2С02
+ ЗН20 + 3 • 3,76N2;
Азот в уравнениях химических
реакций горения учитывается потому, что он поглощает часть теплоты, выделяемой
в результате реакций горения, и входит в состав продуктов сгорания — дымовых газов.
При написании
уравнения горения и составлении материального баланса, как правило, записывают
только продукты полного окисления СО2 и Н2О. Если в
составе горючего вещества есть сера (S), то при сгорании образуется SО2 –
его также записывают.
Азот (N), входящий в состав горючего вещества, при горении в воздухе не
окисляется, а выделяется в виде свободного азота (N2). Объясняется
это тем, что при горении в воздухе температура горения относительно невысокая
(1500-2000 К) и при такой температуре окислы азота не образуются. По
уравнениям химических реакций горения рассчитывается количество воздуха, необходимого
для полного сгорания единицы массы или единицы объема горючего вещества, а также
состав и количество продуктов сгорания.
13.
Влажность, летучие продукты пиролиза и межфазовые переходы
Пиролиз (от греч. руr-огонь и lysis-разложение, распад)–
разложение или др. превращения хим. соединений при нагревании.
Образование пламени связано с газообразным состоянием
вещества, поэтому горение жидких и твердых веществ, сопровождающееся
возникновением пламени, предполагает их предварительный переход в газообразную
фазу. В случае горения жидкостей этот процесс обычно заключается в простом кипении
с испарением у поверхности, в то время как при горении почти всех твердых
веществ образование продуктов, способных улетучиваться с поверхности материала
и попадание в область пламени, происходит путем химического
разложения или пиролиза.
Для протекания процесса горения необходимо горючее
вещество, кислород (воздух) и источник воспламенения. Горючее вещество и кислород
составляют горючую систему. Источник воспламенения вызывает в ней реакцию
окисления. При установившемся горении источником воспламенения служит теплота
зоны реакции.
Горючие системы могут быть однородными (однофазными, гомогенными)
и неоднородными (многофазными, гетерогенными, гетерофазными). К гомогенным
относятся газообразные системы, в которых горючее вещество и окислитель перемешаны
друг с другом, например, смеси горючих газов с воздухом. К неоднородным
относятся системы, в которых горючее вещество и окислитель находятся в разных
фазах, отделены друг от друга поверхностью раздела, например твердые горючие
материалы и жидкости, находящиеся в соприкосновении с воздухом, струи горючих
газов, поступающие в воздух.
При горении гетерогенных горючих систем кислород, для того
чтобы вступить в реакцию с горючим веществом, должен продиффундировать через
область пространства, занятую смесью воздуха и продуктов горения.
При высоких температурах наблюдается диффузионное горение,
при низких — кинетическое
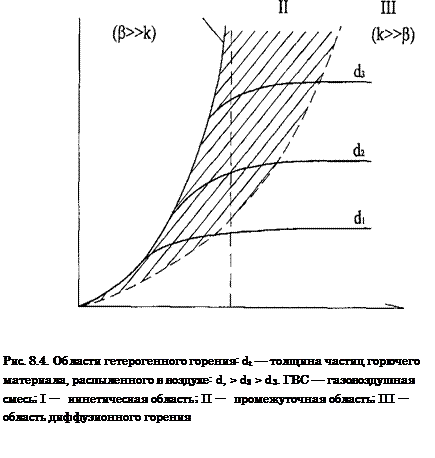 Горение
всех видов газов, жидкостей и твердых веществ на пожарах (за исключением
некоторых взрывчатых веществ и пиротехнических изделий) является диффузионным. Так как наблюдаемая скорость химической реакции в диффузионной
области определяется скоростью диффузии кислорода в зону реакции, то все
реакции горения в этой области имеют одинаковую скорость, не зависящую от
природы горючего. Температурная зависимость скорости реакции в этой области
сравнительно невелика и определяется изменением физических констант (коэффициента
диффузии, вязкости и т.д.) от температуры.
Горение
всех видов газов, жидкостей и твердых веществ на пожарах (за исключением
некоторых взрывчатых веществ и пиротехнических изделий) является диффузионным. Так как наблюдаемая скорость химической реакции в диффузионной
области определяется скоростью диффузии кислорода в зону реакции, то все
реакции горения в этой области имеют одинаковую скорость, не зависящую от
природы горючего. Температурная зависимость скорости реакции в этой области
сравнительно невелика и определяется изменением физических констант (коэффициента
диффузии, вязкости и т.д.) от температуры.
При горении гомогенных горючих систем,
в которых окислитель и горючее вещество находятся в одной фазе, диффузионные
явления обычно роли не играют.
Горение,
зависящее только от скорости химической реакции, называется кинетическим.
Скорость кинетического горения смесей значительно превышает скорость
диффузионного горения горючих веществ, находящихся в них. Горение таких смесей
в замкнутом объеме представляет взрыв. На практике кинетическое горение наблюдается
только в начальной фазе пожара. Так, пожар ЛВЖ в резервуарах часто возникает в
результате взрыва образовавшейся в них смеси паров жидкости с воздухом. При
взрыве смеси крыша резервуара сбрасывается и горение паров жидкости происходит
в диффузионной области.
14.
Теплота сгорания горючих веществ
Горючее, имеющее в своем составе водород, при сгорании
образует воду в газообразном состоянии, которая, охлаждаясь, будет конденсироваться.
Так как в процессе конденсации паров тепло выделяется, то общее количество
теплоты, полученное при сгорании вещества, будет больше на эту величину, при
этом количество теплоты, выделяющееся при конденсации паров, равно количеству
теплоты, затраченному на парообразование. Тогда Qв = Qн+r,
где – Qв высшая теплота сгорания вещества, r – удельная теплота
парообразования воды, а Qн – низшая теплота сгорания это количество
теплоты, выделяющееся при полном сгорании единицы количества горючего вещества
(моль, кг или м3).
Qн может быть рассчитана по закону Гесса, который
говорит о том, что тепловой эффект химической реакции равен разности сумм теплоты образования продуктов реакции и теплоты образования исходных веществ,
при этом надо учитывать, что теплота образования простого вещества
(вещества, молекулы которого состоят из атомов одного элемента, например, N2,
O2, H2, S, C...) принимается равной нулю. Удельная
теплота сгорания (формулы Д. И. Менделеева).
Высшая:
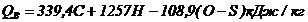
Низшая:

где
C,H,W,S – суммарное
содержание веществ в % по массе, 25,1*(9Н+W )– теплота затраченная
на испарение влаги W вещества и воды, образующейся при сгорании водорода
Н горючего вещества (кДж/кг)
15.
Стехиометрия горения. Удельный расход окислителя
на
горение техногенного вещества.
Уравнение
реакции горения вещества в воздухе составляется с учетом того, что в нем на 1
моль кислорода приходится 3,76 молей азота. Например, реакции горения
водорода, метана, этана, пропана, ацитилена и спирта, и запишутся в виде
следующих уравнений:
2Н2 +02 +3,76N2 = 2H2 0 + 3,76N2.
СН4 + 202 +
2 * 3,76N2 = С02
+ 2Н20 + 2 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С3Н8 + 502
+ 5* 3,76N2 = 3С02
+ 4Н20 + 5 • 3,76N2;
С2Н2 + 2,502
+ 2,5* 3,76N2 = 2С02
+ Н20 + 2,5 • 3,76N2;
С2Н50Н + 302 + 3 • 3/76N
2 = 2С02
+ ЗН20 + 3 • 3,76N2;
Азот
в уравнениях химических реакций горения учитывается потому, что он поглощает
часть теплоты, выделяемой в результате реакций горения, и входит в состав
продуктов сгорания — дымовых газов. При написании уравнения горения и
составлении материального баланса, как правило, записывают только продукты
полного окисления СО2 и Н2О. Если в составе горючего
вещества есть сера (S), то при сгорании образуется SО2– также
записывают. Азот
(N), входящий в состав горючего вещества, при горении в воздухе не окисляется,
а выделяется в виде свободного азота (N2). Объясняется это тем, что
при горении в воздухе температура горения относительно невысокая (1500-2000 К)
и при такой температуре окислы азота не образуются. По уравнениям химических реакций
горения рассчитывается количество воздуха, необходимого для полного сгорания
единицы массы или единицы объема горючего вещества, а также состав и количество
продуктов сгорания.
Минимальное
количество воздуха, необходимое для полного сгорания единицы массы (кг)
или объёма (м3) горючего вещества, называется теоретически
необходимым и обозначается Vв0.
Для горения
индивидуального вещества(газа) потребуется удельный
объём воздуха, рассчитываемый по формуле: Vв0 = 4,76*О/ Z
(м3воздуха/м3газов), где О – количество молей
кислорода, Z – количество молей горючего, 4,76 – количество молей
воздуха, приходящихся на один моль кислорода.
Например:
Определить удельный объём воздуха Vв0 для
горения водорода,
метана, этана, пропана и ацитилена. Решение: Из уравнений реакций
горения ( см. уравнения выше, без записи азота):
для
водорода: 2Н2
+02 = 2H2 0
4,76*1/2=2,38
м3воздуха/м3водорода
для
метана: СН4
+ 202 = С02 + 2Н20 4,76*2/1=9,52
м3воздуха/м3метана
для
этана: С2Н6
+ 3,502 = 2С02 + 3Н20 4,76*3,5/1=16,66
м3воздуха/м3этана
для
пропана: С3Н8
+ 502 = 3С02 + 4Н20 4,76*5/1=
23,8 м3воздуха/м3пропана
для
ацителена: С2Н2
+ 2,502 = 2С02 + Н20
4,76*2,5/1= 11,9 м3воздуха/м3ацитилена
Для
горения смеси химических соединений (древесина, торф ,нефть, смесь газов и др.)
– для
сгорания 1 кг жидких и твердых веществ потребуется:
Vв0 = 0,269*(С/3+Н+S/8 – О/8) м3воздуха/кг горючего, где С, Н, S, О – процентное содержание
соответствующего элемента по массе.
Например:
Определить
объём воздуха, теоретически необходимого для горения для 5 кг торфа состава: С – 40%, Н – 4%, О – 13%, N – 20%, А
(зола) – 10%, W –
13%. Решение: Так как азот, зола и влага топлива не принимают
участие в горении, то на 1кг торфа потребуется
– для
сгорания 1 м3 смеси газов потребуется: Vв0 =( ∑Ki*Гi )/21( м3воздуха/м3смеси
газов),
где Ki – количество молей кислорода,
расходуемых на 1 моль i-го газа, Гi – процентное содержание i-го газа в смеси газов (%).
Например:
Определить
объём воздуха, теоретически необходимого для горения 1м3
природного газа состава: СН4 – 86,5%, С2Н6 –
3%, С3Н8 – 1%, СО2 – 7,3%, N2 – 2,2%.
Решение. Из
уравнений реакций горения соответствующих газов определяем коэффициенты Ki для метана, этана и пропана (СО2
и N2 не
принимают участие в горении).
для
метана: СН4
+ 202 = С02 + 2Н20, откуда Кметана
= 2;
для
этана: С2Н6
+ 3,502 = 2С02 + 3Н20 откуда Кэтена
= 3,5;
для
пропана: С3Н8
+ 502 = 3С02 + 4Н20 откуда Кпропана
= 5;
Для
сгорания 1 м3 природного газа указанного состава потребуется:
Vв0 = (2*86,5+3,5*3+5*1) /21= 8,98 (
м3воздуха/м3 природного газа)
16.
Состав
атмосферного воздуха при расчётах параметров горения.
При большинстве пожаров в основе
горения лежат реакции соединения горючих веществ с кислородом воздуха и только
в отдельных случаях, когда горят взрывчатые вещества, пиротехнические изделия и
другие материалы с положительным кислородным балансом, горение происходит за
счет кислорода, содержащегося в молекуле горючего вещества или кислорода
окислителя.
Поскольку
воздух состоит из 21 % (об.) кислорода и 79 % (об.) азота, т.е. в нем на 1 моль
кислорода приходится 79/21 = 3,76 молей азота, то уравнение реакции горения
вещества в воздухе составляют с учетом того, что на каждый моль кислорода
приходится по 3,76 моля азота.
Например, реакции горения водорода, метана, этана, пропана,
ацитилена и спирта, и запишутся в виде следующих уравнений:
2Н2 +02 +3,76N2 = 2H2 0 + 3,76N2.
СН4 + 202 +
2 * 3,76N2 = С02
+ 2Н20 + 2 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С3Н8 + 502
+ 5* 3,76N2 = 3С02
+ 4Н20 + 5 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С2Н50Н + 302 + 3 • 3/76N
2 = 2С02
+ ЗН20 + 3 • 3,76N2;
Азот в уравнениях химических
реакций горения учитывается потому, что он поглощает часть теплоты, выделяемой
в результате реакций горения, и входит в состав продуктов сгорания — дымовых газов.
При написании
уравнения горения и составлении материального баланса, как правило, записывают
только продукты полного окисления СО2 и Н2О. Если в
составе горючего вещества есть сера (S), то при сгорании образуется SО2 –
его также записывают.
Азот (N), входящий в состав горючего вещества, при горении в воздухе не
окисляется, а выделяется в виде свободного азота (N2). Объясняется
это тем, что при горении в воздухе температура горения относительно невысокая
(1500-2000 К) и при такой температуре окислы азота не образуются. По
уравнениям химических реакций горения рассчитывается количество воздуха, необходимого
для полного сгорания единицы массы или единицы объема горючего вещества, а также
состав и количество продуктов сгорания.
17.
Удельный
теоретический расход воздуха на горение техногенного вещества.
Уравнение
реакции горения вещества в воздухе составляется с учетом того, что в нем на 1
моль кислорода приходится 3,76 молей азота. Например, реакции горения
водорода, метана, этана, пропана, ацитилена и спирта, и запишутся в виде
следующих уравнений:
2Н2 +02 +3,76N2 = 2H2 0 + 3,76N2.
СН4 + 202 +
2 * 3,76N2 = С02
+ 2Н20 + 2 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С3Н8 + 502
+ 5* 3,76N2 = 3С02
+ 4Н20 + 5 • 3,76N2;
С2Н2 + 2,502
+ 2,5* 3,76N2 = 2С02
+ Н20 + 2,5 • 3,76N2;
С2Н50Н + 302 + 3 • 3/76N
2 = 2С02
+ ЗН20 + 3 • 3,76N2;
Азот
в уравнениях химических реакций горения учитывается потому, что он поглощает
часть теплоты, выделяемой в результате реакций горения, и входит в состав
продуктов сгорания — дымовых газов. При написании уравнения горения и
составлении материального баланса, как правило, записывают только продукты
полного окисления СО2 и Н2О. Если в составе горючего
вещества есть сера (S), то при сгорании образуется SО2– также
записывают. Азот (N), входящий в состав
горючего вещества, при горении в воздухе не окисляется, а выделяется в виде
свободного азота (N2). Объясняется это тем, что при горении в воздухе
температура горения относительно невысокая (1500-2000 К) и при такой
температуре окислы азота не образуются. По уравнениям химических реакций
горения рассчитывается количество воздуха, необходимого для полного сгорания
единицы массы или единицы объема горючего вещества, а также состав и количество
продуктов сгорания.
Минимальное
количество воздуха, необходимое для полного сгорания единицы массы (кг)
или объёма (м3) горючего вещества, называется теоретически
необходимым и обозначается Vв0.
Для горения
индивидуального вещества(газа) потребуется удельный
объём воздуха, рассчитываемый по формуле: Vв0 = 4,76*О/ Z
(м3воздуха/м3газов), где О – количество молей
кислорода, Z – количество молей горючего, 4,76 – количество молей
воздуха, приходящихся на один моль кислорода. Например:
Определить удельный объём воздуха Vв0 для
горения водорода,
метана, этана, пропана и ацитилена. Решение: Из уравнений реакций
горения ( см. уравнения выше, без записи азота):
для
водорода: 2Н2
+02 = 2H2
0 4,76*1/2=2,38
м3воздуха/м3водорода
для
метана: СН4
+ 202 = С02 + 2Н20 4,76*2/1=9,52
м3воздуха/м3метана
для
этана: С2Н6
+ 3,502 = 2С02 + 3Н20 4,76*3,5/1=16,66
м3воздуха/м3этана
для
пропана: С3Н8
+ 502 = 3С02 + 4Н20 4,76*5/1=
23,8 м3воздуха/м3пропана
для
ацителена: С2Н2
+ 2,502 = 2С02 + Н20
4,76*2,5/1= 11,9 м3воздуха/м3ацитилена
Для
горения смеси химических соединений (древесина, торф ,нефть, смесь газов и др.)
– для
сгорания 1 кг жидких и твердых веществ потребуется:
Vв0 = 0,269*(С/3+Н+S/8 – О/8) м3воздуха/кг горючего, где С, Н, S, О – процентное содержание
соответствующего элемента по массе.
Например:
Определить
объём воздуха, теоретически необходимого для горения для 5 кг торфа состава: С – 40%, Н – 4%, О – 13%, N – 20%, А
(зола) – 10%, W –
13%. Решение: Так как азот, зола и влага топлива не принимают
участие в горении, то на 1кг торфа потребуется
Vв0 = 0,269*(40/3+4 – 13/8) = 4,23
м3/кг, а
на 5кг – 4,23*5 = 21,15 м3воздуха.
– для
сгорания 1 м3 смеси газов потребуется: Vв0 =( ∑Ki*Гi )/21( м3воздуха/м3смеси
газов),
где Ki – количество молей кислорода,
расходуемых на 1 моль i-го газа, Гi – процентное содержание i-го газа в смеси газов (%).
Например:
Определить
объём воздуха, теоретически необходимого для горения 1м3
природного газа состава: СН4 – 86,5%, С2Н6 –
3%, С3Н8 – 1%, СО2 – 7,3%, N2 – 2,2%.
Решение:. Из
уравнений реакций горения соответствующих газов определяем коэффициенты Ki для метана, этана и пропана (СО2
и N2 не
принимают участие в горении).
для
метана: СН4
+ 202 = С02 + 2Н20, откуда Кметана
= 2;
для
этана: С2Н6
+ 3,502 = 2С02 + 3Н20 откуда Кэтена
= 3,5;
для
пропана: С3Н8
+ 502 = 3С02 + 4Н20 откуда Кпропана
= 5;
Для
сгорания 1 м3 природного газа указанного состава потребуется:
Vв0 = (2*86,5+3,5*3+5*1) /21= 8,98 (
м3воздуха/м3 природного газа)
18.
Коэффициент
избытка воздуха.
 Практически при горении на пожарах расход
воздуха значительно больше. Разность между количеством воздуха, идущим на
горение, и теоретически необходимым, называется избытком воздуха. Отношение
количества воздуха, практически расходующегося при горении (Vв) к теоретически необходимому количеству
(Vв0), называется коэффициентом
избытка воздуха aв : aв
= Vв / Vв0
Практически при горении на пожарах расход
воздуха значительно больше. Разность между количеством воздуха, идущим на
горение, и теоретически необходимым, называется избытком воздуха. Отношение
количества воздуха, практически расходующегося при горении (Vв) к теоретически необходимому количеству
(Vв0), называется коэффициентом
избытка воздуха aв : aв
= Vв / Vв0
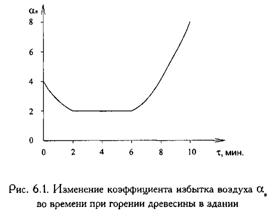
При пожарах внутри помещений коэффициент избытка воздуха непостоянен и
изменяется во времени даже при постоянной площади приточных проёмов. На
величину aв влияют вид и состояние
горючего вещества, величина площади пожара и условия диффузии воздуха к зоне
горения. С увеличением площади пожара коэффициент aв уменьшается и достигает минимума при максимальной
площади пожара ( вследствии увеличения Vв0 ). По мере выгорания вещества
на этой площади коэффициент aв снова увеличивается. (см. рис.
6.1.)
19.
Определение
количества и состава продуктов сгорания вещества
Состав и количество
продуктов сгорания определяются по уравнениям химических реакций горения и рассчитывается
количество воздуха, необходимого для полного сгорания единицы массы или
единицы объема горючего вещества.
При большинстве пожаров в основе
горения лежат реакции соединения горючих веществ с кислородом воздуха и только
в отдельных случаях, когда горят взрывчатые вещества, пиротехнические изделия и
другие материалы с положительным кислородным балансом, горение происходит за
счет кислорода, содержащегося в молекуле горючего вещества или кислорода
окислителя.
Поскольку
воздух состоит из 21 % (об.) кислорода и 79 % (об.) азота, т.е. в нем на 1 моль
кислорода приходится 79/21 = 3,76 молей азота, то уравнение реакции горения
вещества в воздухе составляют с учетом того, что на каждый моль кислорода
приходится по 3,76 моля азота.
Например, реакции горения водорода, метана, этана, пропана,
ацитилена и спирта, и запишутся в виде следующих уравнений:
2Н2 +02 +3,76N2 = 2H2 0 + 3,76N2.
СН4 + 202 +
2 * 3,76N2 = С02
+ 2Н20 + 2 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С3Н8 + 502
+ 5* 3,76N2 = 3С02
+ 4Н20 + 5 • 3,76N2;
С2Н6 + 3,502
+ 3,5* 3,76N2 = 2С02
+ 3Н20 + 3,5 • 3,76N2;
С2Н50Н + 302 + 3 • 3/76N
2 = 2С02
+ ЗН20 + 3 • 3,76N2;
Азот в уравнениях химических
реакций горения учитывается потому, что он поглощает часть теплоты, выделяемой
в результате реакций горения, и входит в состав продуктов сгорания — дымовых газов.
При написании
уравнения горения и составлении материального баланса, как правило, записывают
только продукты полного окисления СО2 и Н2О. Если в
составе горючего вещества есть сера (S), то при сгорании образуется SО2 –
его также записывают.
Азот (N), входящий в состав горючего вещества, при горении в воздухе не окисляется,
а выделяется в виде свободного азота (N2). Объясняется это тем, что
при горении в воздухе температура горения относительно невысокая (1500-2000 К)
и при такой температуре окислы азота не образуются.
Теоретический
объём продуктов сгорания (aв=1) твердых и жидких горючих
веществ определяется по формуле: Vпс0=( С02+ Н20+ N2+ SО2)*22,4/М (м3/кг), где С02, Н20, N2, SО2 – число киломолей соответствующего
вещества в уравнении реакции горения одного киломоля горючего вещества. М–
молекулярная масса горючего вещества, кг/кмоль.
Например Определить объем и состав (в
объемных процентах) продуктов сгорания 1 кг этилацетата (СН3СООС2Н.) при 273 К и давлении 101,3 кПа. ( т.е. при
нормальных условиях).
Решение. Составляем уравнение горения
этилацетата в воздухе:
CH3COOC2H5+502+5*3,76N2=4C02+4H20+18,8N2.
Определяем
состав продуктов сгорания в объемных процентах:
C02=4*100/26,8=15,92%;
H20=4*100/26,8=15,92%; N2=100
– 2*15,92=68,16% .
Если
горение протекает при избытке воздуха ∆Vв, то находим его по формуле: ∆Vв=(aв -1)*
Vв0
Полное количество азота в продуктах сгорания составит:
VN2= VN20+0,79(aв -l)*
Vв0, а количество избыточного
кислорода: ∆VO2=0,21.( aв -l)*
Vв0
Полное
количество продуктов сгорания: Vпс = Vпс0 + ∆Vв
20.
Энтальпия
и энтропия
Энтальпия, или общее теплосодержание
насыщенного пара, это количество теплоты, необходимое для повышения
температуры 1кг вещества от абсолютного нуля до пара заданной температуры.
Энтальпия
в общем случае является функцией температуры и давления. Увеличение энтальпии с
приращением температуры: Δi = Срср (Т2
– Т1) = Срср (t2 – t1), Дж/кг, т.е. изменение энтальпии идеального
газа равно произведению средней теплоёмкости при постоянном давлении на
разность температур газа.
Энтропия
– функция
состояния рабочего тела, выражается соотношением:
ds = dq / T = (du + dl) / T, Дж/(кг∙К), где: ds – приращение энтропии, Дж/(кг∙К).
 dq–изменение тепловой энергии
рабочего тела, Дж/кг. du–приращение внутренней энергии, Дж/кг.
dl – внешняя работа, Дж/кг.
Т – абсолютная температура, К
dq–изменение тепловой энергии
рабочего тела, Дж/кг. du–приращение внутренней энергии, Дж/кг.
dl – внешняя работа, Дж/кг.
Т – абсолютная температура, К
Таким образом, энтропия – это
параметр, который изменяется только от количества переданной или отведённой теплоты.
При ds > 0 теплота к системе подводится, при
ds < 0 – отводится. В термодинамике
широко используются не только координаты p – v, но и s – T, а также термодинамическое состояние
вещества представляют диаграммой i – s.
 Энтропия не может быть измерена
каким-либо образом, как например, объем и определяется только расчетным путем.
Количество теплоты: q = Т • ds или dq=Tds .
Энтропия не может быть измерена
каким-либо образом, как например, объем и определяется только расчетным путем.
Количество теплоты: q = Т • ds или dq=Tds .
Функциональные
зависимости T=T(s) и р = р (v) определяют термодинамические
процессы, поэтому в термодинамике широко используются не только координаты « р
-v», но и «s-Т» — координаты, характеризующие теплообмен с
внешней средой
21. Энтальпия
окислителя и воздуха, участвующего в горении
Энтальпия
— это полная
энергия рабочего тела в потоке, зависящая от термодинамического состояния тела
и представляющая собой сумму внутренней энергии u и потенциальной энергии pv,
т.е.: i=u+pv. В случае пожара это энергия горючих
веществ, окислителя и воздуха, поступающих в зону горения или уходящих из неё.
Тепловой
баланс
внутреннего пожара на любой стадии развития, отнесённый к единице площади пожара:
Qнр * Wм + QФ = Q1 + Q2+Q3+Q4 + Q5+Q6, кДж/(м2*с),
где
Qнр — низшая удельная теплота
сгорания вещества, кДж/кг;
Qф — энтальпия горючих
веществ и воздуха, поступающих на горение в единицу времени на 1 м2 площади пожара, кДж/(м2*с);
Wм — массовая скорость выгорания
горючего вещества с 1 м2 горящей поверхности, кг/(м2*с);
Q1 — энтальпия продуктов
сгорания, уходящих из зоны горения с единицы площади пожара в единицу
времени, кДж/(м2*с);
Q2 — энтальпия избытка
воздуха, поступающего на горение, кДж/(м2*с);
Q3— количество теплоты, излучаемой
пламенем, кДж/(м2*с);
Q4 — количество теплоты,
затрачиваемой на нагрев реагирующих веществ, кДж/(м2*с);
Q5 — количество теплоты,
затрачиваемой на нагрев строительных конструкций, кДж/(м2*с);
Q6 — потери теплоты вследствие
неполноты химического сгорания, кДж/(м2*с).
Количество
теплоты, излучаемой пламенем факела в единицу времени с единицы поверхности, может
быть определено по формуле Стефана-Больцмана: Q3=ε0*σ*Т4
пл , кДж/(м2-с),
где
ε0 — степень черноты пламени;
σ — постоянная Стефана-Больцмана, σ = 5,67*10-11 кВт/(м2*К4);
Тпл — температура пламени, К.
При
горении нефтепродуктов степень черноты пламени близка к единице.

 Если форму пламени принять конической, то отношение
поверхности пламени Fпл к площади пожара Fп для случая горения нефтепродуктов
в резервуарах примерно составит:
Если форму пламени принять конической, то отношение
поверхности пламени Fпл к площади пожара Fп для случая горения нефтепродуктов
в резервуарах примерно составит:
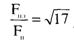
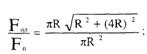
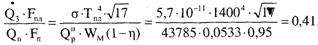
Таким образом, на внутренних пожарах
доля теплоты, теряемой излучением, меньше половины теплоты, выделяющейся в
результате горения.
Тепловой
баланс открытого пожара отличается от внутреннего тем, что в правой части
уравнения отсутствует величина Q5. На открытом пожаре наибольшее
значение имеет теплота, уносимая с продуктами сгорания и излучаемая зоной
горения. Последнее обстоятельство способствует распространению пожара и затрудняет
действия пожарных.
22.
Уравнение теплового баланса процесса горения
при
адиабатических условиях.
Выделившееся в результате
сгорания тепло нагревает продукты горения (CO2, H2O, N2...) от начальной
температуры T0 до температуры Tг, увеличивая их
теплосодержание и уравнение теплового баланса будет: Qн*(1 – h) = ∑ { Hпгi(Tг) – Hпгi(T0)}* Vпгi где: Qн – низшая
теплота сгорания вещества; h
– коэффициент теплопотерь (доля потерь тепла на излучение); Hпгi(Tг) и Hпгi(T0) – значения теплосодержания (энтальпии)
i-го продукта горения при температуре горения и начальной температуре; Vпгi – объем i-го продукта горения.
Если теплосодержание продуктов горения при Т = 273 К принять равным нулю,
то уравнение теплового баланса будет: Qн*(1 – h) = ∑Hпгi(Tг) * Vпгi
При горении в адиабатических
условиях, т. е. горении с теоретическим
количеством воздуха (aв=1)
без потерь теплоты (h = 0) и без теплообмена с окружающей средой уравнение теплового
баланса будет: Qн =∑ Hпгi(Tг) * Vпгi ,
или в случае общего
теплового баланса внутреннего пожара (см. 21) Qнр * Wм = Q1
где Qнр
— низшая удельная теплота сгорания вещества, кДж/кг;
Wм
— массовая скорость выгорания горючего вещества с 1 м2 горящей поверхности, кг/(м2*с);
Q1
— энтальпия продуктов сгорания, уходящих из зоны горения с
единицы площади пожара в единицу времени, кДж/(м2*с);
23.
Калориметрическая (адиабатическая) температура горения.
Реальная
температура горения.
Выделяющаяся
в зоне горения теплота воспринимается продуктами сгорания, вследствие чего они
нагреваются до высокой температуры. Различают калориметрическую,
теоретическую и действительную температуры горения.
Действительной
температурой горения называется температура реально устанавливающаяся
в условиях пожара.
Под
калориметрической
температурой понимается температура, которую
приобретают продукты полного сгорания, когда вся теплота расходуется на их
нагревание.
При
вычислении теоретической температуры пренебрегают
потерями теплоты в окружающую среду, но учитывают расход теплоты на диссоциацию
продуктов реакции (что происходит при температурах выше 1973 К).
Калориметрическую температуру горения вычисляют для следующих
постоянных условий:
–воздух и горючее вещество
находятся при нормальных условиях (273 К);
–коэффициент избытка воздуха
равен единице;
–вещество полностью сгорает
(недожог отсутствует);
– потери теплоты отсутствуют
(процесс адиабатный).
24. Расчет
адиабатической температуры продуктов стехиометрически полного горения
техногенного вещества.
Температура горения зависит от концентрации горючего
в горючей смеси. Если горение происходит с избытком воздуха, т.е. при α
> 1, то выделившееся в результате сгорания тепло частично затрачивается на нагрев
этого лишнего воздуха. В горючей смеси с α < 1 из-за недостатка воздуха
полное сгорание горючего вещества произойти не может, поэтому и тепловыделение в
такой смеси будет неполным. В следствии этого, максимальная температура горения
будет при сгорании стехиометрической смеси, т.е. при α = 1. Адиабатическую
температуру горения рассчитывают для стехиометрической смеси, т.е. при
условии α = 1 по формуле Qн = ∑ { Hпгi(TАД) – Hпгi(T0)}* Vпгi, (см.22)
где Qн – низшая
теплота сгорания вещества; Hпгi(TАД) и Hпгi(T0) – значения теплосодержания (энтальпии)
i-го продукта горения при температуре горения и начальной температуре; Vпгi – объем i-го продукта горения.
Методом интерполяции находят TАД, которая является решением
уравнения для Qн , с допустимой погрешностью.
25.
Воспламенение горючей газообразной смеси.
Тепловое самовоспламенение
Горение
в горючих смесях ( воспламенение) может возникнуть в результате их самовоспламенения,
зажигания внешним источником или самовозгорания. Самовоспламенение и
зажигание характерны для газообразных, жидких и твердых веществ. Самовозгорание
характерно для твердых материалов (особенно находящихся в мелкораздробленном
состоянии) или высококипящих жидкостей, распределенных на материалах с развитой
поверхностью.
Теория самовоспламенения
(теория теплового взрыва) рассматривает стационарное в тепловом отношении
состояние системы «горючее вещество – окислитель», при котором теплоотвод
равен тепловыделению. Эта теория (ак. Семенов Н. Н.) позволяет
определить условия достижения критического состояния, при дальнейшем развитии
которого, происходит самовоспламенение. Рассматривается сосуд объёмом V, в котором находится горючая
смесь. Температура стенок сосуда поддерживается постоянной и равна Т0.
При температуре смеси Т в ней будет протекать химическая реакция со
скоростью W, подчиняющаяся закону Аррениуса:
W = К0спехр
(—E/RT)где
с — концентрация кислорода; п — порядок реакции; Е — энергия
активации; R — универсальная газовая
постоянная.
Скорость выделения тепла в
результате протекания реакции q1 равна: q1= q К0 сп ехр
(—E/RT)V,
где q — тепловой эффект реакции. Выделившееся тепло расходуется на
нагрев смеси и на потери в окружающую среду. Количественно потери тепла q2 оцениваются: q2 = α S (T-T0), где α –коэффициент теплоотвода; S — площадь поверхности стенок сосуда.
Изменение подвода и отвода тепла
в зависимости от температуры, выражаемое приведенными соотношениями
иллюстрируется на рис. Три кривые q2 (Т) соответствуют трем значениям Т0.
При установившемся состоянии системы q1 равно q2, и температура в сосуде определится
как абсцисса точек пересечения кривых q1 (Т) и q2 (Т). Из рис. видно, что кривые
прихода и отвода тепла пересекаются в двух точках, а иногда в одной.
В первом случае: нагрев смеси,
имевшей начальную температуру Т0. Нагревание смеси
прекратится и система достигнет равновесного состояния, когда температура газа
станет равной Та, соответствующей точке пересечения а
кривых q1 и q2. Такое равновесие будет
устойчивым. Вторая точка пересечения кривых б находится в области
более высоких температур, и тепловой режим в этом случае 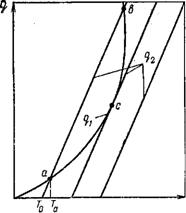 будет неустойчивым. При отклонении
от равновесного состояния, соответствующего точке б, система в
него уже не возвращается. Повышение начальной температуры Т0 стенок
сосуда приводит к смещению вправо кривой теплоотвода q2. Значение стационарной температуры
Та будет при этом плавно возрастать. При некоторой
температуре стенки кривые подвода и отвода тепла будут касаться одна другой,
как это показано при среднем положении кривой теплоотвода на рис. Точка касания
кривых с является граничной точкой существования стационарного
режима. Небольшое повышение температуры стенки будет сопровождаться превышением
прихода тепла над отводом, что вызовет повышение температуры смеси и
соответственно увеличение скорости взаимодействия горючего с окислителем. Процесс,
характеризующийся переходом от медленно протекающей реакции к прогрессивно
ускоряющемуся выгоранию смеси, является процессом самовоспламенения.
будет неустойчивым. При отклонении
от равновесного состояния, соответствующего точке б, система в
него уже не возвращается. Повышение начальной температуры Т0 стенок
сосуда приводит к смещению вправо кривой теплоотвода q2. Значение стационарной температуры
Та будет при этом плавно возрастать. При некоторой
температуре стенки кривые подвода и отвода тепла будут касаться одна другой,
как это показано при среднем положении кривой теплоотвода на рис. Точка касания
кривых с является граничной точкой существования стационарного
режима. Небольшое повышение температуры стенки будет сопровождаться превышением
прихода тепла над отводом, что вызовет повышение температуры смеси и
соответственно увеличение скорости взаимодействия горючего с окислителем. Процесс,
характеризующийся переходом от медленно протекающей реакции к прогрессивно
ускоряющемуся выгоранию смеси, является процессом самовоспламенения.
Процессы самовоспламенения могут иметь тепловой, цепной и комбинированный
цепочечно-тепловой характер. Формулировка основных положений теории
цепных реакций дана в трудах Н. Н. Семенова и его школы. Сущность этой
теории заключается в следующем. Инициированная каким-либо образом химическая
реакция приводит к образованию активных центров. В свою очередь, эти центры вызывают
химические превращения, при которых вновь создаются активные центры, и в конечном
итоге возникает цепная реакция.
Начавшийся
процесс химических превращений будет продолжаться до тех пор, пока на одном из
звеньев начальный центр не вступит в реакцию обрыва. Обрыв цепи может
происходить либо в объеме реагирующей смеси при взаимодействии начальных
центров реакции между собой или с какими-либо примесями, либо на поверхности
стенок реакционного сосуда.
Процессом
зарождения цепи всегда является эндотермическая реакция. Поглощение энергии необходимо
для разрыва внутримолекулярных связей. Энергия активации, необходимая для
элементарных актов продолжения цепи, обеспечивается тепловым эффектом одного из
экзотермических процессов продолжения цепи.
Реакции,
протекающих по механизму прямых цепей, не могут привести сами по себе к
возникновению самовоспламенения поскольку длина прямой цепи всегда конечна и
скорость образования начальных центров цепей при начавшейся реакции убывает
(вследствие расходования компонентов). Самовоспламенение является
следствием протекания разветвленных цепных реакций, отличающихся
тем, что в них наряду с актами продолжения цепи возникают и такие реакции, в
которых взамен одного прореагировавшего активного центра возникают по крайней
мере два новых.
27.
Температура самовоспламенения.
Температура
самовоспламенения
— наименьшая температура горючего вещества, при которой происходит резкое
увеличение скорости экзотермической реакции с воздухом, заканчивающееся воспламенением.
Определяют в условиях специальных испытаний, характеризующихся идентичностью
параметров теплоотвода.
Температура
самовоспламенения — минимальная температура, при которой в нагретой газовоздушной
смеси начинается самопроизвольный (т. е. без внешнего подвода теплоты)
процесс горения, за счет выделения теплоты горящими частицами газа.
Температура
самовоспламенения не является фиксированной для данного газа и зависит от
многих параметров: его содержания в газовоздушной смеси, степени однородности
смеси, формы и размеров сосуда, в котором смесь нагревается, быстроты и способа
ее нагрева, каталитического влияния стенок сосуда, давления, под которым
находится смесь. Точный учет перечисленных факторов весьма сложен, поэтому на
практике, например, при оценке взрывоопасности, пользуются экспериментальными
данными.
Температуры
самовоспламенения горючих газов в кислороде несколько ниже, чем в воздухе. Введение
в состав газов балластных примесей (азота и диоксида углерода) приводит к
увеличению температуры самовоспламенения. Присутствие в сложных газах
компонентов с низкой температурой самовоспламенения приводит к снижению
температуры самовоспламенения смеси.
29.
Методы определения температуры самовоспламенения.
Температура
самовоспламенения зависит от многих факторов:
от
химического состава;
от его
физических свойств (теплоемкость, теплопроводность);
от времени
индукции ti;
от давления
в сосуде Р;
от
материала стенок сосуда;
от
начальной температуры стенокTS;
от метода
определения температуры самовоспламенения.
Существует
целый ряд экспериментальных методов определения температуры самовоспламенения газовых
смесей. Основными из них являются:
метод
впуска заранее заготовленной холодной смеси в эвакуированный нагретый сосуд;
метод
нагревания компонентов смеси раздельно и затем смешивание в потоке нагретого
сосуда (метод концентрических трубок).
метод
адиабатического сжатия заранее заготовленной смеси.
30. Методы экспериментального
определения температуры самовоспламенения. Существует четыре основных метода
определения температуры самовоспламенения, которые отличаются друг от друга главным
образом способами нагрева, смешения газов или паров горючего с окислителем.
Характерной особенностью метода является то, что здесь исключается возможность
непосредственного участия стенок в реакциях воспламенения. 3. Метод «струй».
Два потока
— горючего газа или пара и окислителя нагреваются раздельно. Самовоспламенение
происходит при смешении этих потоков на выходе из нагревательных труб, без
соприкосновения реагирующей смеси с горячими стенками, но при совершенно
неопределенном составе смеси перед ее воспламенением. 4. Метод «капли».
Этот метод
наиболее распространен в лабораторной практике для определения температуры самовоспламенения
паров жидкостей. Испытуемая горючая жидкость подается каплями из бюретки в нагретый
тигель. Через него пропускается с регистрируемой скоростью кислород, воздух или
другой окислитель. Температуру тигля, при которой капля самовоспламеняется,
принимают за температуру самовоспламенения. Здесь, как и в методе струй,
неопределенным является состав смеси перед ее воспламенением.
31.
Самовоспламенение - резкое увеличение скорости экзотермических объемных
реакций, сопровождающееся пламенным горением и/или взрывом.
Температура
самовоспламенения - наименьшая температура окружающей среды, при которой в
условиях специальных испытаний наблюдается самовоспламенение вещества.
32.
Принудительное воспламенение или зажигание.
Зажигание -
принудительное воспламенение рабочей смеси в камере сгорания двигателя внутреннего
сгорания. Имеют распространение две системы зажигание: батарейное и от магнето.
При батарейном зажигании электрический ток низкого напряжения (6-12 в) от
аккумуляторной батареи через выключатель поступает в первичную обмотку
индукционной катушки зажигания. Индуктированный во вторичной обмотке катушки
зажигания ток высокого напряжения (12 000-15 000 в) подводится к ротору распределителя
зажигания. Ток с ротора поступает к контакту, от которого подается к свече того
цилиндра, где должно произойти воспламенение рабочей смеси. Батарейное
зажигание отличается простотой устройства, меньшей стоимостью и обеспечивает
хороший пуск двигателя; применяется главным образом на автомобилях.
Зажигание
принудительное – воспламенение горючей смеси, искусственно вызываемое путем воздействия
на нее внешнего источника тепла (электрического разряда, раскаленного тела,
внесенного извне пламени и т.п.).
Принудительное
воспламенение горючей смеси возможно лишь в определенных пределах по концентрации.
Горючая смесь может подаваться в зону горения в готовом виде. В этом случае
скорость распространения фронта пламени определяется только кинетикой
химических реакций. Такое горение называется кинетическим, а пламя -
нормальным.
33.
Индукционный период воспламенения. Границы зажигания.
С
температурой самовоспламенения TSвсегда связана величина ti - индукционный
период или задержка воспламенения, поскольку переход отTS к TB всегда связан с
некоторым временем развития реакций и накопления тепла.
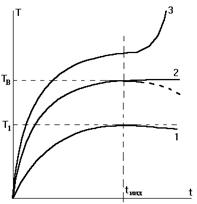
Три вида
кривых изменения Т смеси от времени и определение времени индукции как времени,
соответствующего точке перегиба. Нижняя кривая соответствует случаю
стационарного разогрева до Т1. Пунктирная линия отражает более реальный
случай, когда учитывается расход горючего. Верхняя кривая соответствует
самовоспламенению.
Индукционный
период наглядно показан на рис. 6.
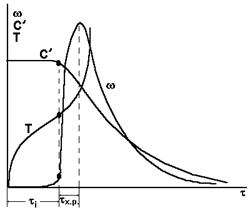
Рис.6.
Кривые
зависимости с’=f(t), Т=f(t), =f(t) имеют характерный перегиб (рис.6.).
Характерные
признаки самовоспламенения:
ti>>tх.р.
( tx.p. -
время химической реакции; это время, соответствующее увеличению скорости
химической реакции ве раз, или время от начала заметного хода химической
реакции до момента, когда скорость химической реакции достигает максимального
значения.)
время ti составляет
порядка 85% от общего времени процесса воспламенения, при этом (ti) = 0,05 мах.
ti ~ Е.
При
измерении температуры TB обязательно дается ti.
TS наиболее
близка к TB при ti стремящейся к бесконечности .
Практически
ti ~ 10 с.
Концентрационные
границы зажигания газа – предельные концентрации горючего газа в смеси с воздухом,
при к-рых смесь воспламеняется и горит. Газовоздушная смесь способна гореть
только при определ. соотношении горючего газа и воздуха. Наименьшая
концентрация горючего газа в смеси, при к-рой газ зажигается (бедная смесь),
наз. нижним пределом воспламенения, а наибольшая, при к-рой газ может гореть
(богатая смесь), — верхним. Подогрев газовоздушной смеси раздвигает границы
зажигания. Наличие их в осн. объясняется снижением темп-ры горения для бедных и
богатых смесей. При потерях теплоты в окружающую среду темп-ра пламени так
сильно падает, что смесь не способна гореть. Для бедных смесей она падает
потому, что необходимо нагревать большое кол-во лишнего воздуха, не участвующего
в процессе горения. У богатых смесей лишнего воздуха нет, наоборот, значит,
часть газа не обеспечена им для горения и не может гореть. На нагрев этого газа
расходуется значит. кол-во теплоты, из-за чего темп-ра падает. Границы
зажигания для метана и природного газа — 5 и 15%, для пропана — 2,4 и 9,5%. Для
обнаружения утечек газа с запасом по отношению к нижнему пределу воспламенения
запах газа должен резко ощущаться при его концентрации в 1 % — для природного
газа и 0,5% — для сжиж.
34. Область
воспламенения газа, пара или взвеси - интервал концентрации горючего вещества,
равномерно распределённого в данной окислительной среде (обычно в воздухе), в
пределах которого вещество способно воспламеняться от источника зажигания с
последующим распространением самостоятельного горения по смеси.
Область
воспламенения ограничена нижними и верхними концентрационными пределами воспламенения
(КПВ). Значения КПВ зависят от рода веществ и окислительной среды, параметров
состояния, направления распространения пламени, формы и размера сосуда, в
котором заключена смесь.
Данные об
области воспламенения используются при расчёте взрывобезопасности среды внутри
технологического оборудования, а также при расчёте предельно допустимых
взрывобезопасных концентраций газов и паров в воздухе рабочей зоны при работах,
связанных с появлением источников зажигания.
35.
Кинетическое горение газа. Структура кинетического пламени.
Горение
газа осуществляется в объеме и относится к гомогенному горению и может
происходить в кинетической и диффузиооной областях.
Кинетическое
горение – после воспламенения происходит распространение пламени, связанное с постоянной
передачей тепла от сгоревших к новым порциям топлива.
Передача
тепла зависит от характеристик пламени, диффузии и законов теплопроводности. При
распространении пламени в неподвижной или движущейся ламинарной смеси, форма
передачи тепла – молекулярная теплопроводность; при турбулентном движении
газоокислительной смеси – турбулентная диффузия.
Факел,
который образуется при истечение заранее подготовленной смеси топлива и
окислителя в окружающую среду (она может быть тоже окислительной). Такой тип
называют - кинетическим факелом - (кинетическое горение, кинетическое пламя).
Для этого типа главную роль играет кинетика химических реакций (тепловой и цепной
механизмы распространения пламени).
tсмеш= 0
<< tхим.р.: кинетический режим горения (tпреобр≈tхим.р.)
При
кинетическом режиме горения интенсивность горения (tпреобр) определяется
концентрацией горючего (составом смеси), родом горючего и окислителя, температурой
и давлением смеси, т.е. зависит от того же, чем определяется скорость
химических реакций, – зависит только от кинетики самих химических реакций.
Поэтому такой вид горения и называется - кинетическим.
Кинетическое
пламя – это горение однородной газовой смеси, которое происходит благодаря распространению
пламени в горючей смеси, непрерывно поступающей в топочную камеру.
Ламинарное
“кинетическое” пламя – имеет место при ламинарном движении горючей смеси.
Пусть в
горелку, расположенную вертикально, во избежании искривления факела подаётся
однородная смесь. При ламинарном движении смеси скорость её движения
распределяется в горелке по параболе. Аналогичное распределение скорости
сохраняется и на выходе из горелки: у стенок горелки скорость очень мала, далее
она возрастает, достигая максимального значения на оси горелки.
При
зажигании в устье горелки вблизи её среза в точках, где скорость потока равна
скорости нормального распространения пламени Uн, пламя держится устойчиво,
образуя зажигающее кольцо, обеспечивающее непрерывное зажигание поступающей
смеси по периферии струи. У стенок горелки, где скорость смеси менее, чем Uн,
пламя не может проникнуть в горелку, так как вследствие теплоотдачи через
стенки скорость распространения пламени уменьшается и становится меньше
скорости струи в этом месте.
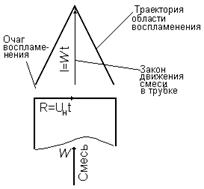
Рис.2.
Распределение по скоростям в пламени горелки
Кольцевая
зона зажигания образуется естественно в результате замедленного движения на
периферии горелки и диффузии горючего газа из потока наружу.
Пламя в процессе
распространения от периферии к центру одновременно относится потоком, и в результате
этого достигает оси струи на некотором расстоянии от устья горелки, образуя
конусообразный факел. Тонкая зона горения, образующая фронт пламени, обычно
имеет ярко-голубой цвет, благодаря чему в пространстве факел чётко выделяется.
Время,
необходимое для распространения пламени от периметра горелки до центра струи
 ,где R – радиус
горелки.
,где R – радиус
горелки.
За это
время центральные струи, двигаясь со скоростью W, проходят расстояние 
которое
соответствует длине факела. Получаем, что длина ламинарного факела равняется 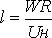
Таким
образом, горение протекает по поверхности конусообразного факела, причём
глубина зоны горения составляет десятые доли миллиметра, основной же объём
факела остаётся инертным.
36. Теория нормального
распространения пламени разработана академиком Н.Н. Семеновым на основании
представления о поджигании фронтом пламени граничных холодных слоев посредством
теплопроводности. В прежних теориях предполагалось, что зажигание происходит
при нагревании до температуры самовоспламенения. Как известно, эта величина не
является константой, как считалось ранее некоторыми исследователями.
Температура самовоспламенения представляет собой функцию кинетических и
тепловых параметров. При нагревании горючей смеси происходит реакция с
выделением тепла, которое, в свою очередь, в силу закона Аррениуса повышает
скорость химической реакции. Этот самоускоряющий процесс ( автоускоряющаяся
лавина) и воспринимается как самовоспламенение. В отличие от гомогенной смеси,
в которой движение фронта пламени происходит путем переноса тепла и вещества
при соответствующем перемещении в пространстве зоны реакции, в пылегазовых
смесях наблюдается воспламенение металлических частиц вследствие притока к ним
тепла от горящей соседней частицы, т.е. наблюдается эстафетный механизм
горения.
37. Нормальная скорость
распространения пламени - скорость перемещения фронта пламени относительно
несгоревшего газа в направлении, перпендикулярном к его поверхности. Сущность
метода определения нормальной скорости .распространения пламени заключается в
приготовлении горючей смеси известного состава внутри реакционного сосуда,
зажигании смеси в центре точечным источником, регистрации изменения во времени
давления в сосуде и обработке экспериментальной зависимости “давление-время” с
использованием математической модели процесса горения газа в замкнутом сосуде и
процедуры оптимизации. Математическая модель позволяет получить расчетную
зависимость “давление-время”, оптимизация которой по аналогичной
экспериментальной зависимости дает в результате изменениe нормальной скорости в
процессе развития взрыва для конкретного испытания.
38.
Диффузионное горение газа. Структура диффузионного пламени.
Диффузионное
горение газов – сложный процесс, характеризующийся взаимодействием химических
реакций с процессами переноса и конвекцией.
Факел,
который образуется при истечении топлива в среду окислителя (или окислителя в
среду топлива, горючего). Его называют - диффузионным факелом - (диффузионное
горение, диффузионное пламя). Для этого типа главную роль играет явление
диффузии, смешения (молекулярной, турбулентной).
При
диффузионном режиме горения tпреобр определяется гидродинамикой геометрической
области преобразования, т.е. определяется интенсивностью процесса смешения, а
также родом горючего и окислителя.
tсмеш
>> tхим.р.:диффузионный режим горения (tпреобр≈tсмеш)
Диффузионное
горение имеет место в условиях, когда горючее и окислитель диффундируют в зону
р-ции с противоположных сторон; таково, напр., Г. свечи, фитиля. Если при этом
константа скорости k р-ции Г. много меньше константы скорости диффузии реагенты успевают
перемещаться и р-ция протекает в обычном кинетич. режиме (относительно
низкотемпературном). При
реагенты успевают
перемещаться и р-ция протекает в обычном кинетич. режиме (относительно
низкотемпературном). При  реагенты взаимод. тотчас же после их
поступления в зону р-ции, прежде чем они полностью перемешаются, и р-ция
протекает в режиме Г., т.е. при высоких т-рах. Отношение диффузионных потоков
реагентов определяется стехиометрией р-ции; концентрации горючего и окислителя
в зоне р-ции малы, осн. компонент смеси-продукты сгорания, к-рые диффундируют в
области, занятые горючим и окислителем (рис. 4). Выделяющееся при р-ции тепло
передается горючему и окислителю, к-рые поступают в зону р-ции нагретыми до
высокой т-ры. В отличие от Г. перемешанных смесей, т-ра диффузионного Г.
зависит от отношения
реагенты взаимод. тотчас же после их
поступления в зону р-ции, прежде чем они полностью перемешаются, и р-ция
протекает в режиме Г., т.е. при высоких т-рах. Отношение диффузионных потоков
реагентов определяется стехиометрией р-ции; концентрации горючего и окислителя
в зоне р-ции малы, осн. компонент смеси-продукты сгорания, к-рые диффундируют в
области, занятые горючим и окислителем (рис. 4). Выделяющееся при р-ции тепло
передается горючему и окислителю, к-рые поступают в зону р-ции нагретыми до
высокой т-ры. В отличие от Г. перемешанных смесей, т-ра диффузионного Г.
зависит от отношения . При
. При она совпадает с т-рой Г. перемешанной
стехиометрич. смеси горючего и окислителя, с уменьшением -падает. По этой причине
диффузионное Г. не реализуется в конденсиров. средах, для к-рых значенияочень
малы; помимо газофазных систем, диффузионное Г. характерно для гетерог. р-ций
на пов-сти (Г. твердых в-в, гетерог.-каталитич. Г.). Массовая скорость m
диффузионного Г. определяется скоростью диффузии реагентов в зону р-ции. Рост m
с увеличением скорости диффузии возможен лишь до определенного предела. Это
предельное значение m близко по величине к массовой скорости Г. в пламени,
распространяющемся по стехиометрич. смеси горючего и окислителя. По достижении
предельного значения m p-ция переходит в низкотемпературный кинетич. режим
(происходит срыв Г.). От начальной т-ры реагентов Т0 m практически не зависит,
однако при нек-ром минимальном для данного набора остальных параметров значении
Г0 диффузионное Г. невозможно.
она совпадает с т-рой Г. перемешанной
стехиометрич. смеси горючего и окислителя, с уменьшением -падает. По этой причине
диффузионное Г. не реализуется в конденсиров. средах, для к-рых значенияочень
малы; помимо газофазных систем, диффузионное Г. характерно для гетерог. р-ций
на пов-сти (Г. твердых в-в, гетерог.-каталитич. Г.). Массовая скорость m
диффузионного Г. определяется скоростью диффузии реагентов в зону р-ции. Рост m
с увеличением скорости диффузии возможен лишь до определенного предела. Это
предельное значение m близко по величине к массовой скорости Г. в пламени,
распространяющемся по стехиометрич. смеси горючего и окислителя. По достижении
предельного значения m p-ция переходит в низкотемпературный кинетич. режим
(происходит срыв Г.). От начальной т-ры реагентов Т0 m практически не зависит,
однако при нек-ром минимальном для данного набора остальных параметров значении
Г0 диффузионное Г. невозможно.

Рис. 4. Распределение
концентрации окислителя (1), горючего (2), продуктов реакции (3) и т-ры смеси
(4) во фронте диффузионного горения; х-пространственная координата,
ТГ-адиабатич. т-ра горения.
Пламя,
которое образуется при истечении топлива в среду окислителя, называется
диффузионным.
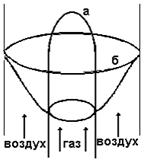
Рис.4 Форма
диффузионного пламени а) при избытке окислителя, б) при избытке горючего.
Ламинарное
диффузионное пламя наблюдается при ламинарном истечении горючего и окислителя.
39.
Турбуле́нтность, устар. турбуле́нция (лат. turbulentus — бурный,
беспорядочный), турбуле́нтное тече́ние — явление, заключающееся в
том, что при увеличении скорости течения жидкости или газа в среде
самопроизвольно образуются многочисленные нелинейные фрактальные волны и
обычные, линейные различных размеров, без наличия внешних, случайных,
возмущающих среду сил и/или при их присутствии. Механизм турбулентного
распространения пламени и величина f/T зависят от масштаба турбулентности. В
случае мелкомасштабной турбулентности, когда длина пути смешения мала по
сравнению с шириной зоны ламинарного горения, считают, что фронт пламени в
потоке имеет некоторое среднее положение и среднюю толщину и, так же как при
горении в ламинарном потоке, сгорание происходит путем распространения
непрерывного фронта пламени. Увеличение же скорости турбулентного распространения
пламени вызвано увеличением скорости горения на единице поверхности такого
осредненного фронта пламени. Это происходит вследствие того, что на процессы
молекулярного переноса накладываются процессы турбулентного переноса,
увеличивающие коэффициент переноса до ам + ат, где ат — коэффициент турбулентной
температуропроводности. Скорость турбулентного распространения пламени
определяется интенсивностью тепло- и массообмена и скоростью химического
реагирования горючей смеси в потоке в специфических условиях зоны турбулентного
горения, обусловливаемых ее аэродинамической и тепловой структурой.
40.
Пла́мя — явление, вызванное свечением раскалённой газообразной среды, в
ряде случаев содержащей плазму и/или диспергированные твёрдые вещества, в
которой происходят физико-химические превращения реагентов, приводящие к
свечению, тепловыделению и саморазогреву.
41.
Излучение светящихся пламен складывается из излучения трехатомных газов и
излучения раскаленных частичек сажи, образующихся в результате крекинга
углеводородов. Наличие сажи в пламени резко меняет его эмиссионные
характеристики. Сажистые частицы имеют непрерывный спектр излучения. В тех
областях спектра теплового излучения пламени, где нет полос поглощения трехатомных
газов, излучают только сажистые частицы.
Излучение
светящегося пламени складывается из излучения трехатомных газов СО2 и Н2О и сажистых
частиц.
43. Под
скоростью горения жидкости понимается количество ее, выгорающее в единицу
времени. Зависит от режима горения(ламинарного, турбулентного). Когда течение
потока паров становится турбулентным ( лри d 8Q см и выше), количество тепла,
передаваемое на единицу поверхности жидкости, с повышением диаметра резервуара
изменяется очень незначительно, в связи с чем и скорость горения увеличивается
мало. Это положение очень важно, так как хранение нефтепродуктов и других
горючих жидкостей чаще всего происходит в резервуарах диаметром выше 80 см. Поскольку скорость горения жидкости в таких резервуарах незначительно изменяется при
увеличении их диаметра, следовательно, интенсивность подачи огнегасительных
средств на единицу свободной поверхности жидкости является практически постоянной.
Увеличение начальной температуры Т0 жидких ВВ имеет двойной эффект. Во-первых,
с ростом Т0 возрастает скорость горения жидкости.
44. Вблизи
от капли по сферической поверхности устанавливается зона горения, диаметр
которого получается в 1-5 раз больше размера капли. Испарение капли протекает
за счет теплоты излучения из зоны горения. В пространстве между каплей и зоной
горения находится пары жидкого топлива и продукты горения, в пространстве вне
зоны горения – воздух и продукты горения. В зону горения изнутри диффундирует
пары топлива, а снаружи кислород. Здесь эти компоненты вступают в химическую
реакцию, которая сопровождается выделением теплоты и образованием продуктов
сгорания. Из зоны горения телота переносится наружу и к капле, а продукты
сгорания диффундируют в окружающее пространство между каплей и зоной горения.
Так
как скорость горения капли жидкости топлива определяется наиболее медленной
стадией процесса - скоростью испарения, то время её выгорания можно расписать
на основе уравнения теплового баланса её испарение за счёт теплоты, полученной
из зоны горения. Таким образом, продолжительность выгорания капли,
испоряющейся при лучистом нагреве от окружающей зоны горения, пропорциональна
первой степени её начального радиуса.
Вопрос
45.
Деструкция - разложение органических веществ
и превращение их в неорганические с высвобождением энергии.
47.
Ключевым фактором, определяющим пожарную опасность материалов, является сырье,
из которого они изготовлены. Наиболее часто встречающиеся минеральные
строительные материалы - это природный камень, бетон, кирпич, керамика,
асбоцемент, стекло и т.д. Они относятся к негорючим (НГ), но даже при небольшом
добавлении полимерных или органических веществ - не более 5-10% от массы - их
свойства меняются. Увеличивается пожарная опасность, и из НГ они переходят в
категорию трудносгораемых. В последние годы широкое распространение получила
продукция на основе полимеров, принадлежащая к неорганическим материалам и
являющаяся горючей. При этом от объема и химического строения полимера зависит
принадлежность конкретного материала к группе горючести. Выделяют два основных
типа полимерных соединений. Это реактопласты, образующие при нагревании
коксовый слой, который состоит из негорючих веществ и защищает материал от
воздействия высоких температур, препятствуя горению. Другой тип - это
термопласты (плавятся без создания теплозащитного слоя).
Вне
зависимости от типа, полимерные строительные материалы нельзя перевести в
разряд негорючих, но возможно снизить их пожарную опасность. Для этого
применяются антипирены - различные вещества, которые способствуют повышению
огнестойкости. Все органические материалы относятся к группе горючих, а их
пожарная опасность повышается при добавлении различных полимеров. Например,
лакокрасочные материалы не только повышают горючесть, но и способствуют более
быстрому распространению пламени по поверхности, увеличивают дымообразование и
токсичность. В этом случае к СО (угарному газу) - основному продукту горения
органических материалов - добавляются и другие токсичные вещества.
49.
Производства, связанные с получением и переработкой металлов, их сплавов,
гидридов металлов и металлоорганических соединений характеризуются повышенной
пожарной и взрывопожарной опасностью. Горение металлов, их сплавов,
металлосодержащих веществ, в т.ч. металлоорганических веществ согласно ГОСТ
27331-87 подразделяются на 3 класса:
класс Д1 –
горение легких металлов (алюминий, магний и их сплавы, кальций, титан), условно
«тяжелых» металлов (цирконий, ниобий, уран и др.);
класс Д2 –
горение щелочных металлов (литий, натрий, калий и др.);
класс Д3 –
(металлоорганические соединения: алюмо-, литий-, цинк- органика, гидриды
алюминия, лития и др.). Каждый из перечисленных металлов и их гидридов в
обычном состоянии представляет собой твердое вещество, кроме
металлоорганических соединений (МОС), представляющих собой жидкости.
Из
особенностей металлов, которые имеют прямое отношение к их пожаро-,
взрывоопасности и горению необходимо отметить следующие:
склонность
к самовозгоранию при обычных условиях (т.е. пирофорность);
способность
взрываться в состоянии аэровзвеси;
взаимодействие
горящих металлов с водой, некоторыми газовыми огнетушащими составами: хладонами
(хлорфторуглеводороды), азотом (например, магний) и др.
Способностью
самовоспламеняться обладают щелочные металлы, стружка, металлические порошки,
имеющие неокисленную активную поверхность, гидриды металлов, МОС (классы
пожаров Д2, Д3).
Наиболее
пожаро-, взрывоопасными металлами, горение которых происходит по классу Д1, являются
легкие металлы в виде продуктов их переработки: порошков разной дисперсности,
стружки. Металлы в виде изделий различной конфигурации (листы, профили и т.п.)
поджечь практически невозможно, если обеспечиваются условия преобладания
теплоотвода над теплоприходом.
50.
Пиротехника – это наука о свойствах пиротехнических (огневых) составов и изделий
из них и способах их изготовления.
Пиротехнические
составы при сжигании (или взрыве) дают световой, тепловой, дымовой, звуковой
или реактивный эффекты, используемые в военной технике и в ракетах различного
назначения.
Пиротехническими
составами снаряжают следующие виды средств военного назначения:
осветительные
средства (авиабомбы, артиллерийские снаряды, авиационные факелы и др.), используемые
для освещения местности в ночных условиях;
фотоосветительные
средства (фотобомбы, фотопатроны), используемые при ночной аэрофотосъемке и для
других целей;
трассирующие
средства, делающие видимой траекторию полета пуль и снарядов (и других подвижных
объектов) и тем самым облегчающие пристрелку по быстро движущимся целям;
средства
инфракрасного излучения, используемые для слежения за полетом ракет и в
качестве ложных целей;
ночные
сигнальные средства (патроны и др.), применяемые для подачи сигналов;
дневные
сигнальные средства (патроны и др.), используемые для той же цели, но в дневных
условиях;
зажигательные
средства (бомбы, снаряды, пули и многие др.), служащие для уничтожения военных
объектов противника;
маскирующие
средства (дымовые шашки, снаряды и др.), употребляемые для получения дымовых завес;
ракеты
различного назначения и дальности полета, использующие твердое пиротехническое
топливо;
учебно-имитационные
средства, употребляемые как на маневрах и учениях, так и в боевой обстановке.
Они имитируют действие атомных бомб, фугасных снарядов и бомб, а также
различные явления на поле боя: орудийные выстрелы,пожары и др., и могут этим
дезориентировать службу наблюдения противника;
целеуказательные
средства (снаряды, бомбы и др.), указывающие местонахождение объектов противника;
пиротехнические
газогенераторы, используемые для различных целей.
Горение
пиротехнического состава – это окислительно-восстановительная реакция, в
которой окисление горючих идет одновременно с восстановлением окислителей.
По степени
гомогенности начальной системы различают несколько видов горения:
горение
твердого или жидкого топлива за счет кислорода воздуха – это гетерогенное
горение;
горение
взрывчатых газовых (или жидких) смесей или индивидуальных взрывчатых веществ –
это гомогенное горение.
Пиротехнические
составы – механические смеси твердых, тонко измельченных компонентов – по
степени гомогенности находятся посередине между конденсированным топливом и
индивидуальными веществами (или гомогенными смесями).
Степенью
гомогенности определяются многие свойства пиротехнических составов.
Горение
пиротехнических составов осуществляется теплопередачей из зоны реакции к слоям,
в которых идет подготовка к процессу горения. На том же принципе основано и
воспламенение пиросоставов. Для возникновения горения необходимо создать
местное повышение температуры в составе. Это достигается обычно непосредственным
воздействием на состав горячих пороховых газов или применением специальных
воспламенительных составов.
Когда
пиросостав приводится в действие огневым импульсом и горение его происходит в
открытом пространстве, то скорость горения его невелика (обычно несколько
миллиметров в секунду).
Если же
горение происходит в замкнутом пространства или если в качестве инициатора
используется капсюль-детонатор, то может возникнуть взрыв (скорость которого
измеряется сотнями, а иногда и тысячами метров в секунду).
В некоторых
случаях ускорение горения наблюдается и при сгорании в открытом пространстве
большого количества пиротехнических составов.
52.
Различают беспламенное горение твердых веществ (кокс, сажа, древесный уголь,
щелочные и щелочноземельные металлы) и горение с образованием пламени
(древесина, торф и т. д.). Скорость горения данного вещества зависит от
температуры, давления, величины удельной поверхности вещества, скорости
диффузии кислорода через пограничный .слой и скорости окислительных реакций и.
Поскольку основой является реакция окисления, при уменьшении толщины
пограничного слоя увеличивается скорость горения. Это и происходит в условиях
пожара при увеличении скорости воздушных потоков, омывающих поверхности горящих
веществ.
Вопрос
53. Термическое действие (фугасное).
Термическое
действие, вызванное взрывом, в зависимости от используемого взрывчатого
вещества различается по интенсивности длительности воздействия на окружающие
предметы и материалы. Как правило, взрыв пороха вызывает более длительное зажигательное
действие, чем взрыв бризантных взрывчатых веществ. Термическое действие
сопровождается долями секунды. Бризантные взрывчатые вещества при взрыве
создают более высокую температуру. Термическое воздействие носит локальный
характер и по дальности не превышает 10…30 диаметров объема заряда взрывчатого
вещества. На объектах, предметах и материалах, находящихся в непосредственной
близости к месту взрыва, если не возникло открытое горение, наблюдаются следы,
окопчения и оплавления.
Вопрос
54. Кумулятивный эффект.
кумуляция,
усиленное в определённом направлении действие взрыва. К. э. создаётся зарядом
взрывчатого вещества, имеющим углубление - кумулятивную выемку, обращенную к
мишени (например, к стальной броневой плите). Кумулятивная выемка, обычно
конической формы, покрыта металлической оболочкой (облицовкой), её толщина в
зависимости от диаметра заряда варьируется от долей мм до мм. Механизм
действия кумулятивного
заряда состоит в следующем. После взрыва капсюля-детонатора,
находящегося на противоположной по отношению к выемке стороне заряда, возникает
детонационная волна, которая перемещается вдоль оси заряда. Волна разрушает
коническую оболочку, начиная от её вершины, и сообщает материалу оболочки
большую скорость. Давление продуктов взрыва, достигающее ~ 1010
н/м2 (105 кгс/см2),
значительно превосходит предел прочности металла. Поэтому движение металлической
оболочки под действием продуктов взрыва подобно течению жидкой
плёнки (подчеркнём, что течение металла не связано с его плавлением, а вызвано
чрезвычайно высокой механической нагрузкой). Движущийся металл образует
сходящийся под определённым углом к оси конуса поток, который переходит в
тонкую (порядка толщины оболочки) металлическую струю, перемещающуюся вдоль оси
с очень большой скоростью (~ 10 кмlceк). Действие этой струи и
обусловливает высокую пробивную способность взрыва кумулятивного заряда (рис.
1). Высокоскоростная струя пробивает стальную броню подобно тому, как
мощная струя воды проникает в мягкую глину. Глубина проникновения (равная
примерно длине струи) пропорциональна образующей конической оболочки. Давление,
возникающее при столкновении струи с броневой плитой, настолько превышает
напряжение разрушения стали, что прочность мишени не играет существенной роли.
При
схлопывании конической оболочки скорости отдельных частей струи оказываются
несколько различными, в результате струя в полёте растягивается. Поэтому
небольшое увеличение промежутка между зарядом и мишенью увеличивает глубину
пробивания из-за удлинения струи. При значительных расстояниях между зарядом и
мишенью струя разрывается на части, и эффект пробивания снижается. Использование
заряда с кумулятивной выемкой, но без металлической облицовки снижает К. э.,
поскольку вместо металлической струи действует струя газообразных продуктов
взрыва (рис. 2).
Термин
"кумуляция" иногда применяется специалистами в более широком смысле -
для обозначения явлений в которых течение среды приводит к концентрированию
энергии в небольшом объёме, но не обязательно сопровождается образованием
струй. Примерами таких явлений служат сходящиеся к центру (к оси) сферические
(цилиндрические) детонационные или ударные волны, схлопывание пустой полости в
жидкости под действием большого давления и т. п. К. э. используется в
военном деле и в научных исследованиях для изучения свойств веществ при высоких
давлениях.
55. По
скорости взрывчатого разложения различают:
быстрое
сгорание,
детонацию,
происходящую с наибольшей скоростью и поэтому сопровождающуюся максимальным
разрушительным действием.
Быстрым
сгоранием взрывчатого вещества обычно называют процесс, скорость
распространения которого по массе ВВ не превышает нескольких метров в секунду,
а иногда - даже долей метра в секунду. Характер действия в этом случае - более
или менее быстрое нарастание давления газов и производство ими работы
разбрасывания или метания окружающих тел. Если процесс быстрого сгорания
происходит на открытом воздухе, то он не сопровождается сколько-нибудь
значительным эффектом.
Примером
такой формы взрывчатого разложения может служить сгорание на открытом воздухе
бездымного пороха.
Пороха
(особенно бездымные) в закрытом объеме, например в патроннике ружья,
разлагаются более энергично, чем на открытом воздухе, причем горение в этом
случае сопровождается резким звуком. Это - типичная форма взрывчатого
разложения ВВ в форме быстрого сгорания.
Взрыв,
называемый иногда обыкновенным взрывом или взрывом второго рода, - это процесс,
который может протекать с переменной скоростью, но значительно большей, чем в
первом случае, в среднем со скоростью сотен метров в секунду.
Взрывчатые
вещества, разлагающиеся в этой форме, характеризуют резкий подъем давления в месте
взрыва, удар газов по окружающей среде или производство работы: раскалывание и
дробление преграды на небольших расстояниях от места взрыва.
Примером
этой формы взрывчатого разложения может служить вызванный лучом огня взрыв прессованного
пироксилина в оболочке, протекающий со скоростью нескольких сотен метров в
секунду.
Детонацией,
или взрывом первого рода, называют процесс, который распространяется по массе вещества
с максимальной скоростью, измеряемой обычно тысячами метров в секунду.
Например, скорость детонации прессованного тротилового заряда составляет около
6700 м/сек.
Характер
действия при детонации - особенно резкий скачок давления и удар газов,
сопровождающийся сильнейшим разрушительным эффектом. Здесь налицо не
раскалывание, а дробление преграды на мельчайшие куски.
Взрывчатых
веществ очень много. По своему применению все они разбиваются на три большие
группы:
инициирующие,
бризантные
(дробящие),
метательные
(пороха).
Инициирующие
ВВ употребляются для снаряжения различных капсюлей, которые служат инициаторами
взрывных процессов. Взрывчатое превращение этих веществ вызывается
незначительным механическим или тепловым воздействием и, как правило, протекает
в форме детонации.
Благодаря
очень малому заряду дробящего вещества в капсюле ружейного патрона (0,004-0,005 г) он не оказывает сильного разрушительного действия и не может служить детонатором.
Бризантные
ВВ в их чистом виде применения в охотничьих боеприпасах не находят.
56.
По́рох — многокомпонентная твёрдая система, способная к закономерному
горению параллельными слоями без доступа кислорода извне с выделением большого
количества тепловой энергии и газообразных продуктов, используемых для метания
снарядов, движения ракет и в других целях. Горение параллельными слоями, не
переходящее во взрыв, обусловливается передачей тепла от слоя к слою и достигается
изготовлением достаточно монолитных пороховых элементов, лишённых трещин.
Скорость горения порохов зависит от давления по степенному закону, увеличиваясь
с ростом давления, поэтому не стоит ориентироваться на скорость сгорания пороха
при атмосферном давлении, оценивая его характеристики. Регулирование скорости
горения порохов очень сложная задача и решается использованием в составе
порохов различных катализаторов горения. Горение параллельными слоями позволяет
регулировать скорость газообразования. Газообразование пороха зависит от
величины поверхности заряда и скорости его горения.
Величина
поверхности пороховых элементов определяется их формой, геометрическими
размерами и может в процессе горения увеличиваться или уменьшаться. Такое
горение называется соответственно прогрессивным или дегрессивным. Для получения
постоянной скорости газообразования или её изменения по определённому закону
отдельные участки зарядов (например ракетных) покрывают слоем негорючих материалов
(бронировкой). Скорость горения порохов зависит от их состава, начальной температуры
и давления.
57.
Различают два вида пороха: смесевые (в том числе дымный) и нитроцеллюлозные
(бездымные). Пороха, применяемые в ракетных двигателях, называются твёрдыми
ракетными топливами. Основу нитроцеллюлозных порохов составляют нитроцеллюлоза
и пластификатор. Помимо основных компонентов эти пороха содержат различные
добавки.
Современные
дымные пороха изготовляются в виде зёрен неправильной формы. Основой для получения
пороха являются смеси серы, калийной селитры и угля. Эффективность горения
дымного пороха во многом связана с тонкостью измельчения компонентов, полнотой
смешения и формой зёрен в готовом виде. Дымный порох легко воспламеняется под
действием пламени и искры (температура вспышки 300 °C), поэтому в обращении опасен. В настоящее время дымный порох используется в фейерверках. Примерно
до конца XIX века применялся в огнестрельном оружии и взрывных боеприпасах.
По составу
и типу пластификатора (растворителя) нитроцеллюлозные пороха делятся на: пироксилиновые,
баллиститные и кордитные. В состав пироксилиновых порохов обычно входит 91-96 %
пироксилина, 1,2-5 % летучих веществ (спирт, эфир и вода), 1,0-1.5 %
стабилизатора (дифениламин, центролит) для увеличения стойкости при хранении,
2-6 % флегматизатора для замедления горения наружных слоев пороховых зёрен и
0,2-0,3 % графита в качестве добавок. Такие пороха изготовляются в виде
пластинок, лент, колец, трубок и зёрен с одним или несколькими каналами;
применяются в стрелковом оружии и в артиллерии. Основу баллиститных порохов
составляют нитроцеллюлоза и неудаляемый пластификатор, поэтому их иногда
называют двухосновными. . Порох изготовляются в виде трубок, шашек, пластин, колец
и лент. По применению баллиститные пороха делят на ракетные (для зарядов к ракетным
двигателям и газогенераторам), артиллерийские (для метательных зарядов к
артиллерийским орудиям) и миномётные (для метательных зарядов к миномётам).
Кордитные пороха содержат высокоазотный пироксилин, удаляемый (спирто-эфирная
смесь, ацетон) и неудаляемый (нитроглицерин) пластификатор. Это приближает
технологию производства данных порохов к производству пироксилиновых порохов.
Преимущество кордитов — большая мощность, однако они вызывают повышенный разгар
стволов из-за более высокой температуры продуктов сгорания.
Основными
характеристиками пороха являются: теплота горения Q — количество тепла, выделяемое
при полном сгорании 1 килограмма пороха; объём газообразных продуктов V
выделяемых при сгорании 1 килограмма пороха (определяется после приведения газов
к нормальным условиям); температура газов Т, определяемая при сгорании пороха в
условиях постоянного объёма и отсутствия тепловых потерь; плотность пороха
ρ; сила пороха f — работа, которую мог бы совершить 1 килограмм пороховых газов, расширяясь при нагревании на Т градусов при нормальном атмосферном
давлении.
58.
Взрывчатыми могут быть конденсированные (твёрдые и жидкие) вещества, газы, а
также взвеси частиц твёрдых или жидких веществ в газах. Во взрывной технике
применяются конденсированные и водонаполненные ВВ, преимущество которых
заключается в значительной концентрации энергии в единице объёма. В сочетании с
большой скоростью процесса это позволяет получать при взрыве огромные мощности.
Резко расширяясь, сжатый газ наносит по окружающей среде удар огромной силы.
Происходит взрыв. Материалы, находящиеся вблизи от заряда, подвергаются
дроблению и сильнейшей пластической деформации (местное, или бризантное,
действие взрыва); вдали от заряда разрушения менее интенсивны, но зона, в
которой они происходят, гораздо больше (общее, или фугасное, действие взрыва).
59. Состав
продуктов взрыва — качественное и количественное содержание химических веществ,
образующихся из взрывчатого вещества (ВВ) в результате взрыва. Состав продуктов
взрыва определяется в основном составом ВВ (рецептурой ВВ) и условиями
взрывания. При нулевом и положительном кислородном балансе для ВВ, состоящих из
углерода, водорода, азота и кислорода, в основном в продуктах взрыва углерод
окисляется до СО2, водород до Н2О, азот выделяется в свободном виде. Кроме
того, в небольших количествах идет образование окислов азота NO, NO2, N2O3,
свободного водорода Н2, аммиака NH3, метана СН4. Чем больше кислородный баланс,
тем больше образуется окислов азота. Если в состав ВВ входят металлы (например,
алюминий), то в продуктах взрыва они присутствуют, как правило, в виде окислов
(Al2O3). При наличии серы образуются SO2 и H2S, при наличии хлора — хлористый водород
HCl и хлориды металлов. Если в состав ВВ входит калиевая, кальциевая или
натриевая селитра, то в продуктах взрыва образуются твёрдые окислы К2О, СаО или
Na2О. Кислоро́дный бала́нс — отношение количества кислорода,
содержащегося во взрывчатом веществе (ВВ) к его количеству, необходимому для
полного окисления всех остальных компонентов этого ВВ.
60.
Стойкость ВВ определяет возможность, длительность и сроки хранения, а также
условия хранения и использования ВВ на взрывных работах. Стойкостью называется
способность ВВ сохранять в нормальных условиях хранения и применения
постоянство своих физико-химических и взрывчатых характеристик. Нестойкие ВВ
могут в определенных условиях снижать и даже полностью утрачивать способность к
взрыву или же, наоборот, настолько повышать свою чувствительность, что
становятся опасными в обращении и подлежат уничтожению. Они способны к
саморазложению, а при известных условиях и к самовозгоранию, что при больших
количествах этих веществ может привести к взрыву. Следует различать физическую
и химическую стойкость ВВ.
Физическая
стойкость рассматривает такие свойства ВВ, как гигроскопичность, растворимость,
старение, затвердевание, слеживаемость.
Химическая
стойкость ВВ определяется подогреванием небольшого количества вещества в
течение определенного времени с одновременным контролем за скоростью
разложения.
61.
Основными параметрами ударной волны, определяющими ее поражающее действие
являются: избыточное давление, скоростной напор и продолжительность фазы
сжатия. Избыточное давление в ударной волне- разность между давлением во фронте
ударной волны и в окружающей невозмущенной среде. Один из основных параметров
ударной волны ядерного взрыва, характеризующий ее поражающее действие. Определяет
характер и тяжесть поражения личного состава, повреждений военной техники и
других объектов в данной области пространства. Значение и изменение избыточного
давления во времени зависят от мощности и вида взрыва, удаления от его центра
(эпицентра) и среды, в которой он произведен. Величина скоростного напора
находится в прямой зависимости от скорости и плотности воздуха за фронтом
ударной волны. Оба эти параметра зависят от избыточного давления волны и
связаны c величиной этого давления (при идеальных условиях фронтом ударной
волны) определёнными равенствами. Для сильных ударных волн скоростной напор
больше избыточного давления, но при избыточном давлении менее 4,9 кг/см скоростной
напор меньше избыточного давления ударной волны. Подобно максимальному
избыточному давлению ударной волны, максимальный скоростной напор уменьшается
по мере удаления от центра взрыва, хотя и иными темпами.
62. Детона́ция
(нормальная) — сверхзвуковой комплекс, состоящий из ударной волны и экзотермической
химической реакции за ней.
Механизм
превращения энергии на фронте детонационной волны существенно отличается от механизма
дефлаграции — волны медленного горения, сопровождающейся дозвуковыми течениями.
Принципиальная возможность явления детонации следует из того, что при
прохождении через фронт всякой ударной волны вещество нагревается. Если ударная
волна достаточно сильна, то это нагревание может поджечь горючую смесь, что и
приводит к детонации. Возникающая при этом поверхность нормального разрыва называется
детонационной волной. Изменение термодинамических параметров среды при прохождении
через фронт детонационной волны описывается детонационной адиабатой. Явление детонации
лежит в основе действия бризантных взрывчатых веществ, широко применяемых как в
военном деле, так и в гражданской хозяйственной деятельности при производстве
взрывных работ. Волна Д. возбуждается интенсивным механич. или тепловым
воздействием (удар, искровой разряд, взрыв металлич. проволочки под действием
электрич. тока и т.п.). Сила воздействия, необходимого для возбуждения Д.,
зависит от хим. природы ВВ. К механич. и тепловому воздействию особенно
чувствительны Инициирующие взрывчатые вещества, к-рые входят в состав
капсюлей-детонаторов, используемых для возбуждения Д. вторичных (менее
чувствительных) ВВ.
В
однородном ВВ волна Д. обычно распространяется с постоянной скоростью, к-рая
среди возможных для данного ВВ скоростей детонационной волны является
минимальной. В этом случае зона хим. реакции перемещается относительно
продуктов реакции со скоростью звука. Благодаря этому волна разрежения,
возникающая при расширении газообразных продуктов, не может проникнуть в зону
реакции и ослабить ударную волну.
64.
Температу́ра взры́ва — максимальная температура, до которой
нагреваются продукты химических реакций, протекающих при взрыве.
Температура
взрыва зависит от состава взрывчвтого вещества (ВВ), параметров заряда ВВ (размеры,
плотность, влажность и др.) и условий взрывания (наличие оболочки, способ
инициирования и др.).
Температура
взрыва для определенных условий может быть рассчитана или определена экспериментально.
Для экспериментального определения используют оптические цветовые методы.
65.
Ско́рость детона́ции — скорость распространения детонационной волны
по заряду взрывчатого вещества (ВВ). Скорость детонации определяется составом и
состоянием заряда, условиями взрывания. При одинаковых условиях скорость
детонации постоянна и её значение — максимально возможное при этих условиях.
Такое свойство делает скорость детонации одной из важнейших характеристик
взрывчатых веществ. Минимальная скорость детонации для твердых
(конденсированных) взрывчатых веществ 1,2 км/с. Обычная скорость детонации
промышленных ВВ 2,5-6,5 км/с, а взрывчатых химических соединений 7-9 км/с. Чем
выше скорость детонации, тем выше давление детонации и эффективность действия
взрыва.
66.
Взрывные работы
работы в народном хозяйстве, выполняемые воздействием Взрыва на естественные
(горные породы, древесина, лёд) или искусственные (бетон, каменная и кирпичная
кладка, металлы и др.) материалы с целью контролируемого их разрушения и
перемещения или изменения структуры и формы. В. р. осуществляются с помощью
взрывчатых веществ (См. Взрывчатые вещества) (ВВ) и средств взрывания,
создающих начальный импульс для возбуждения взрыва ВВ (капсюли-детонаторы с
огнепроводным шнуром, электродетонаторы), а также передающих начальный импульс
на требуемое расстояние (например, Детонирующий шнур). Для размещения ВВ внутри
разрушаемого объекта (заряжания) предварительно создаётся полость (Шпур,
Скважина, камера), как правило, Бурением, поэтому совокупность процессов для
выполнения взрывов часто называют буро-взрывными работами. Дозированное
количество ВВ, помещённое в полость или на поверхность разрушаемого объекта и
снабженное средством взрывания, называется Зарядом.
При
Составлении энергетического баланса взрыва парогазовой среды следует различать
долю горючего вещества, участвующего во взрыве, и расход энергии этого взрыва
на формирование ударной волны.