|
Вещество
|
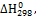 
|
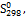 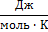
|
Теплоемкость, Дж/(моль K) K)
|
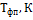
|
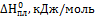
|
|
|
|
Коэффициенты уравнения 
|
|
|
|
|
|
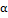
|
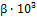
|
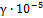
|
|
|
|
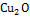
|
-167,36
|
93,93
|
62,34
|
23,85
|
-
|
|
-
|
|
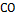
|
-110,5
|
197,4
|
28,41
|
4,1
|
-0,46
|
|
-
|
|

|
0
|
33,3
|
22,64
|
6,28
|
-
|
1356
|
13,02
|
|
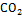
|
-393,5
|
213,6
|
44,14
|
9,04
|
-8,53
|
|
-
|
1. Расчет теплового
эффекта химической реакции при стандартных условиях
Тепловым эффектом
реакции называется теплота, выделяющаяся или поглощающаяся при реакции,
протекающей термодинамически необратимо при равенстве температур начала и конца
процесса.
За стандартные
условия принимают температуру 298 К и давление 0,1 МПа. Расчеты тепловых
эффектов химических реакций основаны на законе Гесса: «Тепловой эффект
химических реакций зависит только от вида и состояния исходных веществ и
продуктов реакции и не зависит от пути процесса». Закон Гесса применим к
процессам, которые проводят при постоянном объеме или давлении.
Тепловые эффекты химических реакций
в стандартных условиях можно рассчитать по табличным значениям стандартных
теплот образования DН0обр
или стандартных теплот сгорания DН0сгор.
Стандартной
теплотой образования данного вещества называется тепловой эффект образования 1
моля рассматриваемого вещества из простых веществ, устойчивых в этих условиях.
Стандартной
теплотой сгорания данного вещества называется тепловой эффект реакции окисления
1 моля этого вещества кислородом с образованием высших оксидов, входящих в это
вещество.
По закону Гесса
следует, что тепловой эффект реакции равен разности между стандартными
теплотами образования продуктов реакции и исходных веществ с учетом
стехиометричемких коэффициентов.
 , (1)
, (1)
где  - тепловой эффект химической реакции при стандартных условиях;
- тепловой эффект химической реакции при стандартных условиях;
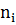 -
стехиометрические коэффициенты.
-
стехиометрические коэффициенты.
Если тепловой эффект реакции
положительный, то процесс называется эндотермическим, если тепловой эффект
реакции отрицательный, то процесс называется экзотермическим.
Подставляя числовые значения,
получим:
Реакция является экзотермической,
проходит с выделением тепла.
2. Расчет теплового
эффекта химической реакции по уравнению Кирхгофа
Зависимость
теплового эффекта химической реакции от температуры выражается уравнением
Кирхгофа:
 , (2)
, (2)
где 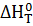 - тепловой эффект химической реакции при температуре Т;
- тепловой эффект химической реакции при температуре Т;
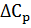 -
разность теплоемкостей продуктов реакции и исходных веществ с учетом
стехиометрических коэффициентов.
-
разность теплоемкостей продуктов реакции и исходных веществ с учетом
стехиометрических коэффициентов.
 (3)
(3)
Для расчетов необходимо знать
зависимость теплоемкости от температуры для исходных веществ и продуктов
реакции, выражаемую уравнением (4):
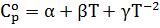 , (4)
, (4)
где α, β, γ - коэффициенты, которые
определяются опытным путем.
Подставляем в уравнение (4) значения
из таблицы 1:
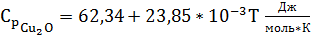 ,
,
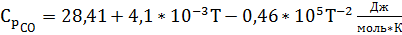 ,
,
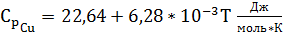 ,
,
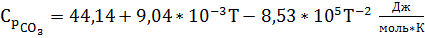 .
.
При температуре 1356 К, входящей в
интервал расчета, медь претерпевает фазовое превращение первого рода.
Удельная теплоемкость меди в жидком
состоянии:
 .
.
Из уравнений (3), (4) следует:
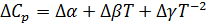 , (5)
, (5)
где 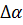 ,
, 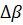 ,
, 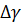 - разность коэффициентов α, β, γ продуктов реакции и
исходных веществ с учетом стехиометрических коэффициентов.
- разность коэффициентов α, β, γ продуктов реакции и
исходных веществ с учетом стехиометрических коэффициентов.
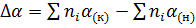 , (6)
, (6)
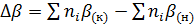 , (7)
, (7)
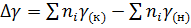 . (8)
. (8)
Для процесса, проходящего в
интервале температур 298-1356 К, получим разность коэффициентов α, β, γ:
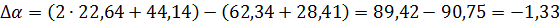 .
.
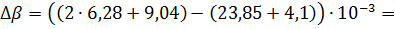
 .
.
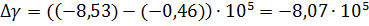 .
.
Согласно выражению (5), уравнение
зависимости теплоемкости от температуры, в интервале температур 298-1356 К,
выглядит следующим образом:
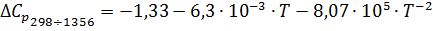 .
.
Аналогично производим вычисления
зависимости теплоемкости от температуры, в в интервале температур 1356-1500 К,
учитывая уравнение температурной зависимости удельной теплоемкости меди при
температуре фазового перехода.
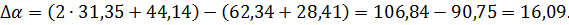
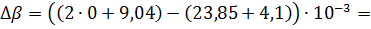
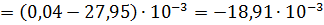 .
.
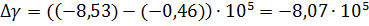 .
.
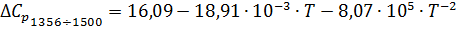 .
.
Уравнение теплового эффекта
химической реакции, с учетом фазового перехода, будет иметь вид:
 , (9)
, (9)
Проинтегрировав уравнение (9) и
подставив числовые значения температур, получим:
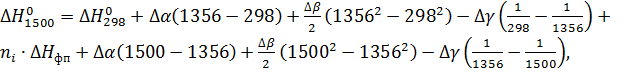 (10)
(10)
где 
Подставляя остальные числовые
значения, получим:
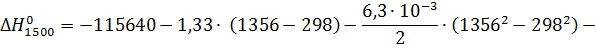
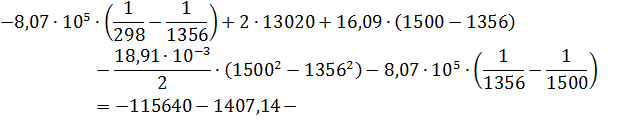
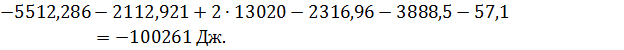
Значение теплового эффекта
химической реакции 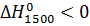 . Это
означает, что в ходе реакции выделяется тепло. Процесс является
экзотермическим.
. Это
означает, что в ходе реакции выделяется тепло. Процесс является
экзотермическим.
3. Расчет изменения
изобарно-изотермического потенциала
Критерием принципиальной
осуществимости процесса при постоянном давлении и температуре является
изменение изобарно-изотермического потенциала 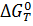 (энергии Гиббса).
(энергии Гиббса).
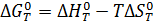 (11)
(11)
где 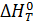 - изменение энтальпии;
- изменение энтальпии;
 -
изменение энтропии.
-
изменение энтропии.
Условие принципиальной
осуществимости процесса, т.е. возможности протекания реакции в прямом
направлении без затраты энергии, является неравенство  . Неравенство
. Неравенство  свидетельствует
о невозможности протекания процесса. Признаком завершенности процесса и
установлении термодинамического равновесия в системе является условие
свидетельствует
о невозможности протекания процесса. Признаком завершенности процесса и
установлении термодинамического равновесия в системе является условие 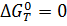 .
.
Для начала рассчитаем величину 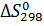 - разность стандартных абсолютных энтропий продуктов реакции и
исходных веществ с учетом их стехиометрических коэффициентов:
- разность стандартных абсолютных энтропий продуктов реакции и
исходных веществ с учетом их стехиометрических коэффициентов:
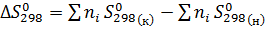 . (12)
. (12)
 .
.
Уравнение для 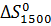 с учетом фазового перехода будет иметь вид:
с учетом фазового перехода будет иметь вид:
 ,
(13)
,
(13)
где 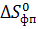 =
=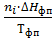 -
изменение энропии при фазовом переходе.
-
изменение энропии при фазовом переходе.
Предварительно проинтегрировав
уравнение (13), подставим числовые значения:

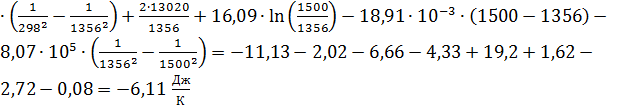 .
.
Уравнение изменения энергии Гиббса
имеет вид:
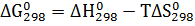 . (14)
. (14)
Рассчитаем данную величину:
 .
.
Изменение энергии Гиббса при 1500К:

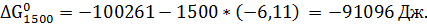
Возможен самопроизвольный процесс в
прямом направлении.
Проведен расчет химической реакции.
Реакция 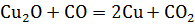 протекает с выделением тепла и является экзотермической, так как D Н< 0.
протекает с выделением тепла и является экзотермической, так как D Н< 0.
Реакция термодинамически возможна в
области температур начиная с 298К до 1500К, так как в этой области температур
энергия Гиббса DG < 0.
Список использованных
источников
1 Краткий справочник физико - химических величин / К.П. Мищенко [и
др.]; под ред. А.А. Равделя; - Л.: Химия, 1983. - 232 с.