Биохимические процессы автолиза мышечной ткани курицы
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
«Калининградский
государственный технический университет»
Кафедра химии
Курсовая
работа по биологической химии
Биохимические
процессы автолиза мышечной ткани курицы
Проверил:
д.б.н., профессор Сергеева Н.Т
Выполнил:
студентка группы 10-ПБ
Кислицына Ирина Игоревна
Калининград
г.
СОДЕРЖАНИЕ
Введение
1. Литературный
обзор
1.1 Морфология
мышечной ткани курицы
1.2 Химический
состав и пищевая ценность компонентов мышечной ткани курицы
1.2.1 Белковый
состав
1.2.2
Аминокислотный состав
1.2.3 Липидный
состав
1.2.4 Углеводы
1.2.5
Минеральные вещества
1.2.6 Витамины
1.2.7
Экстрактивные вещества
1.3
Биохимический механизм автолититических процессов
1.3.1 Изменение
углеводной системы
1.3.2 Изменение
фосфоросодержащих веществ
1.3.3 Изменения
липидной системы
1.3.4 Изменение
белковой системы
1.3.4.1 Гниение
1.4 Влияние
хранения при низких температурах на содержание ФТА в мышечной ткани курицы
2. Экспериментальная
часть
2.1 Определение
аминоазота формольным титрованием
2.2 Результаты
исследований
Выводы
Список
используемой литературы
Введение
Мышечная ткань подвержена скоровременному распаду, автолизу, поскольку
длительное их хранение в обычных условиях без специальной обработки невозможно.
Мышечная ткань - благоприятная среда для развития микроорганизмов и в обычных
условиях хранения (при комнатной температуре) быстро разлагается в результате
их жизнедеятельности и развитии физико-химических и биохимических процессов.
Для предотвращения этого процесса необходимо ограничить или исключить развитие
микроорганизмов и затормозить ферментативные процессы. Из известных способов,
наиболее широко распространено сохранение их при пониженных температурах. Этот
способ наиболее универсален, эффективен и надежен. Кроме того, мышечная ткань
при низких температурах не изменяет своего химического состава.
Цель курсовой работы - изучить биохимические процессы автолиза мышечной
ткани курицы.
Для достижения поставленной цели были сформулированы следующие задачи:
1. Изучить морфологию мышечной ткани курицы.
2. Изучить биохимическую ценность мышечной ткани курицы.
. Изучить процессы автолиза мышечной ткани курицы.
. Изучить влияние хранения при низких температурах на содержание
ФТА в мышечной ткани курицы.
1. Литературный обзор
.1 Морфология мышечной
ткани курицы
Среди тканей (группы или слоя клеток, одинаковых по
морфологическому строению, выполняющих ту или иную специальную функцию и
объединенных межклеточным веществом) мышечная занимает по своей массе первое
место. Мышечная ткань участвует в выполнении важных физиологических функций:
движения, кровообращения, дыхания и т.п.
По морфологическому строению различают мышечную ткань двух
типов, поперечнополосатую, гладкую. К поперечнополосатым относится скелетная
мускулатура; гладкие мышцы находятся в стенках пищеварительного тракта,
диафрагмы, кровеносных сосудов и т.д.
Скелетные мышцы у птиц нелетающих или летающих с трудом
(куры) бледного цвета, у остальных птиц - темно-красные. Распределены крайне
неравномерно в отличие от млекопитающих животных. Превращение грудных
конечностей птиц в крылья способствовало максимальному развитию грудных мышц и
мышц тазовых конечностей. Основная масса мышц у птиц расположена в области
грудной кости при переходе их на крылья. В связи с этим у кур грудные мышцы
составляют около 45 % массы мышц всего скелета. Второй областью по мощности
развития мышц является верхняя половина тазовой конечности. Эта группа мышц
обеспечивает передвижение птицы по земле и составляет свыше 18 % массы всех
скелетных мышц (рис.1)
Мышцы области грудно-пояснично-крестового отдела туловища,
вследствие малоподвижности этого отдела, крайне слабы. У кур эти мышцы
составляют около 2,6 % массы мышц всего скелета.
На грудной клетке птиц расположены межреберные наружные и
внутренние мышцы, подниматели ребер, поперечная грудная мышца и лестничные
мышцы. Брюшная стенка птиц состоит из тех же мышц, что и у млекопитающих, но
они слабо развиты.
Мышцы глубокие тазовой конечности с медиальной поверхности
следующие: ягодичные, внутренняя подвздошняя, напрягатель широкой фасции,
прямая бедренная мышца, стройная мышца, медиальная широкая мышца, квадратная
мышца бедра, двоичная мышца, длинный аддуктор, передняя большеберцовая мышца,
длинный разгибатель пальцев, задняя большеберцовая мышца.

Рис.1
Мышцы курицы:
1- портняжная мышца; 2- напрягатель широкой фасции бедра; 3-
двуглавная мышца бедра; 4- полусухожильная мышца; 5- брюшные мышцы; 6-
икроножная мышца; 7- пяточная и длинная малоберцовая мышца; 8- сгибатели
пальцев; 9- разгибатели пальцев; 10- вентральная зубчатая мышца; 11- мышца
крыловой складки; 12- большая грудная мышца; 13- сгибатели пясти и пальцев; 14-
разгибатели пясти и пальцев; 15- дорсальные мышцы шеи; 16- вентральные мышцы
шеи: а - трахея, б - зоб.
У курицы с латеральной стороны хорошо выражены следующие
мышцы: широчайшая мышца спины, трапециевидная мышца, ромбовидная мышца,
предлопаточная мышца, большая дельтовидная мышца, локтевые мышцы, малая
дельтовидная мышца, двуглавая мышца плеча, средняя дельтовидная мышца, малая
грудная мышца, мышца крыловой складки, малая локтевая мышца, длинный и короткий
лучевой разгибатель запястья, супинатор, короткий и длинный разгибатель
пальцев, локтевой разгибатель запястья, глубокий сгибатель предплечья, короткий
сгибатель запястья.
Мышцы шеи многочисленные, хорошо развиты и сильно
дифференцированы, особенно в участке, ближайшем к голове.
На голове лицевые мышцы отсутствуют. Жевательные мышцы сильно
развиты.
Диафрагма представляет собой сухожильную пластинку,
расправленную по вентральной поверхности легких. Ее весьма слабые мускульные
зубцы подходят от ребер.
Ножки (конечности) на 1-2 см ниже пяточного сустава относят к
субпродуктам. В них входят мышцы: абдуктор, сгибатели и разгибатели пальцев.
В целом мышечная ткань представлена из сложных, вытянутых в
длину клеток - мышечные волокна
Между мышечными клетками (волокнами) находятся тонкие
прослойки межклеточного вещества, состоящего из соединительнотканных волоконец
и бесструктурного (киселеобразного) вещества и представляющего собой рыхлую
соединительную ткань.
Волокна соединяются в пучки, образующие отдельные мускулы.
Мускулы покрыты плотными соединительнотканными пленками (фасциями). Между
пучками и волокнами проходят и разветвляются сосуды и нервы.
Длина этих вытянутых клеток может доходить до 15 см, а
толщина - до 10-100 мкм. Поверхность мышечного волокна покрыта эластичной
оболочкой - сарколеммой. Большую часть объема мышечных клеток (60-65 %)
занимают миофибриллы - длинные тонкие нити, собранные в пучки, которые
расположены параллельно оси волокна. Они окружены внутриклеточной жидкостью,
саркоплазмой, в которой содержаться гликоген, липиды, некоторые ферменты,
неорганические соли, аминокислоты и экстрактивные азотистые вещества (АТФ и ее
производные, креатин и др.)
Цвет мышц зависит от содержания в них гемопротеинов, а также от вида и
возраста птицы. В красных мышцах содержится меньше белков, больше жира,
холестерина, фосфатидов, аскорбиновой кислоты; в белых мышцах больше карнозина,
гликогена, фосфокреатина, аденозинтрифосфата.
Относительно жировой ткани, у кур жир не откладывается в межмышечном и
межволоконном пространстве.
В отличие от животных соединительная ткань птицы менее развита. В тушках
птицы содержится в 2 раза меньше соединительной ткани (6 - 7 %), чем в тушах
убойных животных.
1.2 Химический состав и
пищевая ценность компонентов мышечной ткани курицы
Пищевая ценность мышечной ткани птицы характеризуется
количеством и соотношением белков, жиров, витаминов, минеральных веществ и
степенью их усвоения организмом человека.
Химический состав мышечной ткани птицы зависит от факторов,
возраста, упитанности, породы, содержания при откорме, части, вида птицы.
Хорошая усвояемость (на 96%) объясняется химическим составом.
Таблица 1. Содержание белков, жиров и углеводов в мышечной
ткани цыпленка-бройлера I категории (%) и суточная потребность в них человека
массой 45 кг, г/кг
|
Показатели
|
Содержание [23]
|
Потребность [9]
|
Потребность на
массу 46 кг, г
|
Удовлетворение
потребности, %
|
|
Белки
|
16
|
1,5
|
69
|
23
|
|
Жиры
|
14
|
1
|
46
|
30,5
|
|
Углеводы
|
0,5
|
2
|
92
|
0,5
|
Из таблицы 1 видно, что белки мышечной ткани курицы
составляют 23%, жиры - 30,5% , углеводы - 0,5% от суточной потребности человека
массой 46 кг.
1.2.1
Белковый состав
Белки мышечной ткани принято разделять по морфологическому признаку
клеток: саркоплазматические, миофибриллярные белки и белки стромы.
Распределение белков в структурных элементах мышечной ткани можно
представить в виде схемы:

Белки саркоплазмы. При экстрагировании мышечной ткани раствором хлористого калия с ионной
силой, соответствующей ионной силе саркоплазмы, в экстракте обнаруживается
группа растворимых белков, состоящая из миогена, глобулина X, миоглобулина и миоглобина (таб.2)
Миоген представляет собой гетерогенную фракцию белков состоящую из
большого числа индивидуальных ферментов. Миогеновая фракция составляет около
20% от всех белков мышц, Т. Барановский в 1939 г. выделил из миогеновой фракции
миоген А (около 20% фракции), миоген В (около 80%) и в небольшом количестве
миоген С. Миоген растворяется в воде. Молекулы миогена имеют глобулярную форму.
Молекулярная масса миогена А 150000, а миогена В - 81 000. Изоэлектрическая
точка миогеновой фракции лежит в пределах рН 6,0-6,5.
В.А. Энгельгардт обнаружил у миогена способность катализировать одну из
важнейших реакций, протекающих в процессе гликолиза мышечной ткани, -
расщепление гексозодифосфата на две фосфотриазы. В миогеновой фракции идентифицированы
альдолаза (миоген А), дегидрогеназа фосфороглицероальдегида, фосфоглюкомутаза,
компоненты фосфорилазы.
Глобулин X (10-20% от всех
белков мышц) не растворяется в воде, растворяется в солевых растворах даже с
низкой ионной силой, высаливается при половине насыщения, осаждается при
диализе водного экстракта мышц против воды. Молекулярная масса 160000.
Изоэлектрическая точка лежит при рН 5,2. Глобулин X обладает ферментативными свойствами.
Миоальбумин составляет в мышечной ткани 1-2% от всех белков. Он
растворяется в воде, не осаждается хлористым натрием при полном насыщении, но
осаждается сернокислым аммонием. Изоэлектрическая точка миоальбумина находится
при рН 3,3.
Миоглобин - дыхательный пигмент мышечной ткани, окрашивающий ее в красный
цвет (рис.4). Он является сложным белком, распадается при гидролизе на
белок-глобин и небелковую группу-гем. В мышцах он играет роль резервуара
кислорода, так как обладает большим сродством к кислороду, чем гемоглобин. От
гемоглобина отличается своей белковой частью. Гем содержит порфириновое кольцо,
в котором железо связано координационной связью. Молекулярная масса миоглобина
16800. Изоэлектрическая точка лежит при рН 7,0. Миоглобин хорошо растворяется в
воде.
мышечный ткань биохимический аминоазот

Рис.4
Молекула миоглобина: а - третичная структура; б - участки полипептидных цепей,
соответствующие  - спиральной конфигурации
- спиральной конфигурации
Миоглобин способен соединяться не только с кислородом, но и другими газами
- окисью азота, окисью углерода, сероводородом. При взаимодействии с кислородом
миоглобин может превратиться в оксимиоглобин, который легко отдает кислород и
метмиоглобин - окисленное соединение, содержащее трехвалентное железо.
Производные миоглобина - оксимиоглобин, метмиоглобин, нитрозомиоглобин имеют
характерные спектры поглощения, по которым их можно определять.
В мышечной ткани содержатся и другие пигменты, которые играют важную роль
в процессах окисления в мышце, но они находятся в незначительных количествах и
не влияют на ее окраску. К ним относятся цитохромы, флавины и др.
Таблица 2. Содержание белков саркоплазмы, %
|
Белки
|
Содержание
|
Содержание белков
саркоплазмы к общему белку, %
|
|
Общий белок
|
16
|
|
|
Миогены (А,В,С)
|
3,2
|
20
|
|
Глобулин Х
|
3,2
|
20
|
|
Миоальбумин
|
0,16 - 0,32
|
1-2
|
|
Миоглобин
|
0,096 - 0,16
|
0,6-1,0
|
Из таблицы 2 видно, что белки сарколеммы составляют от 41,6%
до 43 % от общего белка, из них основной частью от общего количества белков
являются такие белки сарколеммы, как миогены (А,В,С) и глобулин Х, составляющие
по 20 % .
Белки миофибрилл - миозин, актин, актомиозин, тропомиозин. Играют главную
роль в двигательной функции организма и потому называются сократительными. Это
преимущественно фибриллярные белки (таб. 3).
Миозин - фибриллярный белок составляет около 40% белков клетки мышечной
ткани. Миозин - полноценный, хорошо переваримый белок. Совершенно чистый миозин
растворим в воде и образует вязкий раствор с массовой долей до 4% белка.
Растворы солей щелочных металлов небольшой молярной концентрации (0,25 - 0,04
моль/дм3) осаждают миозин из его растворов; в солевых растворах
повышенной молярной концентрации (до 0,6 моль/дм3) он растворяется.
Температура денатурации миозина около 45 - 50 °С (у птицы около 51 °С);
изоэлектрическая точка определяется при рН=5,4. Биологические функции миозина
связаны с координированным движением живых организмов и автолитическими
превращениями мышечных тканей после убоя животных.
Таблица 3. Содержание белков миофибрилл, %
|
Белки
|
Содержание
|
Содержание белков
саркоплазмы к общему белку, %
|
|
Общий белок
|
16
|
|
|
Миозин
|
5,6 - 6,4
|
35 - 40
|
|
Актин (G-F)
|
1,92 - 2,4
|
12 - 15
|
|
Тропомиозин
|
0,32
|
2
|
Из таблицы 3 видно, что белки миофибрилл составляют от 49% до 57% от
общего белка, из них основной частью от общего белка являются миозин (35% -
40%) и актин (12% - 15%).
Молекула миозина представляет собой длинную фибриллярную нить с
глобулярной головкой и построена из двух больших и двух малых полипептидных
цепей (Рис.5). Большие полипептидные цепи, свернутые в α
- спираль, закручены относительно
одна другой и образуют двойную спираль. На конце молекулы миозина две более
короткие полипептидные цепочки присоединены к спирали и как бы продолжают её.
Но они не связываются в общую спираль, а находятся в свободном состоянии,
образуя шарообразное утолщение - головку.
Большое количество полярных групп, а также фибриллярная форма молекулы
обусловливают высокую гидратацию миозина и его способность связывать большое
количество воды, а также ионы калия, кальция и магния.

Рис.5.
Строение молекулы миозина: 1 - глобулярная «головка»; 2 - фибриллярный «хвост»
Тропомиозин - белок палочковидной формы с относительной молекулярной
массой около 70 000 Да, постоянно присутствующий в структуре тонких (актиновых)
филаментов. Биологическая роль тропомиозина сводится к регулированию
взаимодействия актина и миозина в процессе мышечного сокращения. Массовая доля
тропомиозина составляет 10-12% всех белков миофибрилл или 2,5% белков мышц.
Растворим в воде, но из мышечной ткани водой не извлекается. Изоэлектрическая
точка определяется при рН 5,1.
Актин может существовать в двух формах: глобулярной - G-актин (рис.6) и фибриллярной - F-актин. В растворах с низкой ионной
силой актин существует в виде шаровидного G-актина с молекулярной массой 47000. При повышении ионной
силы G-актин полимеризуется в F-актин. Полимеризация ускоряется в
присутствии аденозинфосфата (АТФ), ионов Мg2+.
Актин составляет 12-15% всех мышечных белков и является основным
компонентом тонких нитей. Относится к полноценным и легкоусвояемым белкам.
Актомиозин - это сложный комплекс, который формируется при
добавлении раствора актина к раствору миозина и сопровождается увеличением
вязкости раствора. Поскольку цепь F-актина содержит много молекул G-актина, каждая нить F-актина
может связывать большое число молекул миозина. Рост прекращается при добавлении
АТФ или в присутствии ионов Mg2+. Содержание актомиозина указывает
на глубину автолитических превращений в процессе трупного окоченения.

Рис.6.
Строение двойной спирали G-актина
Белки стромы входят в состав
сарколеммы и рыхлой соединительной ткани, объединяющей мышечные волокна в пучки
и белки ядер. Эти белки не растворяются в водно-солевых растворах. К ним
относятся соединительнотканные белки; коллаген, эластин и ретикулин и
гликопротеиды - муцины и мукоиды. Последние представляют собой слизистые белки,
выполняющие защитные функции и облегчающие скольжение мышечных пучков. Эти
белки извлекаются щелочными растворами.
В ядрах мышечных клеток содержатся, по крайней мере, три
белковые фракции: нуклеопротеиды, кислый белок и остаточный белок. Ядро
мышечных клеток построено главным образом из нуклеопротеидов. Простетической
группой этих сложных белков является дезоксирибонуклеиновая кислота, белковыми
компонентами нуклеопротеидов - гистоны. Это неполноценные белки - в них нет
триптофана. Нуклеопротеиды растворяются в щелочах, «Кислый белок» также
растворяется в щелочах. В отличие от гистонов в молекуле «кислого белка»
содержится триптофан. После удаления нуклеопротеидов и «кислого белка» в ядрах
остается желеобразная масса - остаточный белок, по свойствам и аминокислотному
составу похожий на коллаген.
Белки обеспечивают организм аминокислотами, которые необходимыми
прежде всего для собственного белкового биосинтеза. Избыточные аминокислоты,
разрушаясь, поставляют организму энергию.
Минимальная суточная потребность в белке составляет у
мужчин 37 г, у женщин 29 г, однако рекомендованные нормы потребления почти вдвое
выше. При оценке пищевых продуктов важно также учитывать качество белка. При
отсутствии или низком содержании незаменимых аминокислот белок считается
малоценным. Соответственно такие белки должны потребляться в большем
количестве. Различные белки <#"791002.files/image007.gif">
Коферментные формы:
Являются не только центральными звеном белкового обмена, но и
одним из важных звеньев между обменом белков, углеводов, липидов.
Участвует в белковом обмене, а именно в промежуточном обмене
аминокислот - реакции трансаминирования и дезаминирования.
Трансаминирование:

Ниацин (Витамин В5, витамин РР, никотиновая
кислота, никотинамид) - производное пиридина, существует в виде никотиновой
кислоты или никотинамида.

Его коферментными формами являются никотинамидадениндинуклеотид
(НАД) и фосфорилированная по рибозе форма - никотинамидадениндинуклеотидфосфат
(НАДФ).

Являются коферментами дегидрогеназ, участвующие в окислении углеводов,
жирных кислот, глицерина, аминокислот, участвуют в превращении субстратов цикла
Кребса и терминальных стадиях дегидрирования в дыхательной цепи. НАДФ - донор
водорода при синтезе жирных кислот, холестерина.
Реакция: перенос 2 Н+ от НАДН+ Н+ на пируват - образование молочной
кислоты (Гликолиз):

Ниацин влияет на высшую нервную деятельность, на органы пищеварения, на
обмен холестерина, образование эритроцитов, сердечно-сосудистую систему.
Витамин В12 (кобаламины,
цианокобаламин)

Состоит из планарной группы (в основе цикл коррина), которая содержит
восстановленные пиррольные кольца, координационно связанные с атомом Со в
центре, расположены перпендикулярно к ней 2 нуклеозидные группы, имеющие
диметилбензимидазол и аденин и (альфа) Д-рибофуранозу.
Ферментные системы, в составе которых в качестве простетической группы
участвуют не свободный витамин В12,а так называемые В12-коферменты, или
кобамидные коферменты. Последние отличаются тем, что содержат 2 типа лигандов:
метильную группу и 5'-дезоксиаденозин. Соответственно различают метилкобаламин
СН3-В12 и дезоксиаденозилкобаламин.
Кофермент трансферазы в реакции синтеза метионина:

1.2.7 Экстрактивные вещества
Различают азотистые и безазотистые экстрактивные вещества. К
безазотистым относятся углеводы и все соединения, возникающие из них в процессе
метаболизма мышечной ткани. Общее содержание их составляет 05 - 1.0%. Азотистые
экстрактивные вещества представляют собой различные соединения, содержащие
азот, но не являющиеся белками. К ним следует отнести карнозин, карнитин,
ансерин, креатин и содержащие фосфат соединения: креатинфосфат (КФ), аденозинтрифосфат
(АТФ), аденозиндифосфат (АДФ) и аденозинмонофосфат(АМФ), или аденилатфосфат.
После прекращения жизни макроэргические фосфатные соединения распадаются с
образованием неорганического фосфата, нуклеозидов, пуриновых и пиримидиновых
оснований, которые также обнаружены во фракции азотистых экстрактивных веществ.
Кроме того, в этой фракции находятся глутатион и свободные аминокислоты, а
также конечные продукты азотистого обмена - мочевина, соли аммония и
креатинин (таб.8).
Таблица. 12. Содержание отдельных азотистых экстрактивных
веществ в мышечной ткани цыпленка - бройлера I категории, мг %
|
Вещество
|
Содержание
|
Вещество
|
Содержание
|
|
 Карнозин Карнозин
|
0,2-0,3
|
 АТФ АТФ
|
0,25-0,4
|
|
 Ансерин Ансерин
|
0,09-0,15
|
 Инозиновая кислота Инозиновая кислота
|
0,01
|
|
 Карнитин Карнитин
|
0,02-0,05
|
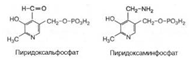
Пуриновые
основания 
|
0,07-0,23
|
|
 Холин Холин
|
0,08
|
 Свободные АК Свободные АК
|
0,1-0,7
|
|
Креатин+креатинфосфат
 
|
0,2-0,55
|
Мочевина

|
0,002-0,2
|
Из таблицы 12 видно, что в мышечной ткани содержится
сравнительно большое количество карнозина - 0,2-0,3 мг%, креатин+креатинфосфат
- 0,2-0,55 мг%, энергии АТФ - 0,25 - 0,4 мг%
Специфическими азотистыми экстрактивными веществами мышечной ткани
являются карнозин и карнитин. По химической структуре карнозин представляет
собой дипептид, состоящий из остатков  -аланина и гистидина.
-аланина и гистидина.
Карнозин участвует в процессах фосфорилирования, происходящего в
мышцах при образовании макроэргических фосфатных соединений аденозннтрифосфата
к креатинфосфата и при использовании в этом процессе неорганического фосфата.
Креатин представляет собой метилгуанидинуксусную кислоту. При
жизни креатин содержится в мышцах примерно на 80% и в виде
креатинфосфата, участвующего в реакциях, связанных с мышечным сокращением.
Глютатион - трипептид, состоящий из трех аминокислот -
глютаминовой, цистеина, и глицина. Он существует в восстановленной и окисленной
формах, создавая в живой мышце вместе с другими соединениями определенный
окислительно - восстановительный потенциал. За счет входящей в его состав
сульфигидрильной группы является активатором ряда ферментов. В мышцах
содержится преимущественно в восстановленной форме в количестве до 40 мг%, при
посмертных изменениях мышечной ткани может явиться источником образования
свободных аминокислот - цистеина, глицина и глютаминовой кислоты.
АТФ, АДФ и АМФ - аденозинфосфаты - являются мононуклеотидами,
играющими в мышечной ткани важную роль в процессе обмена веществ и реакциях,
связанных с освобождением энергии для мышечной работы.
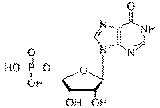
АТФ состоит из пуринового основания - аденина, D-рибозы и трех остатков фосфорной кислоты. В процессе
посмертных изменений АТФ дезаминируется и переходит в инозинмонофосфат (ИМФ),
который также обнаруживается во фракции азотистых экстрактивных веществ.
В
мышечной ткани содержаться свободные аминокислоты, присутствующие при жизни
птицы в результате постоянного процесса обновления белков и образующиеся при
расщеплении различных белковых и небелковых компонентов мышечной ткани.
1.3
Биохимический механизм автолититических процессов
После прекращении жизни птицы состав и свойства отмирающих
тканей не остаются неизменными. Общее направление их изменений может быть
характеризовано как распад биологических систем, образующих живые ткани.
Исходная причина этого распада - дезорганизация обмена веществ в тканях в результате
прекращения поступления кислорода и приостановки процессов синтеза и выработки
энергии. Вследствие этого обратимые прижизненные химические процессы становятся
необратимыми, а деятельность тканевых ферментов приобретает разрушительный
характер. Начинается самораспад, или автолиз, тканей. Главная роль в развитии
автолитических процессов принадлежит ферментам, расщепляющим белки, углеводы,
липиды, нуклеиновые кислоты на более простые вещества.
Автолизу подвергаются все ткани и органы. Но набольшее практическое
значение имеют автолитические изменения мышечных тканей, а именно изменения:
углеводной, белковой, липидной систем и фосфорасодержащих веществ.
Автолитические изменения тканей сходны для всех теплокровных
животных и птиц, отличаясь лишь в некоторых деталях и особенно в скорости их
развития. Некоторое влияние на скорость и глубину автолитических изменений мяса
оказывает состояние животных и птиц перед убоем: усталость, истощенность,
заболевания.
В ходе автолитических процессов изменяется состояние мышечной
ткани: парное, развитие посмертного окоченения, после разрешения посмертного
окоченения, созревание .
К парному состояния относят мышечную ткань непосредственно после
убоя птицы и разделки (для птицы
<#"791002.files/image004.gif">-амилазой, амило-1,6-гликозидязой и  -гликозидазой. В процессе амилолиза образуются олигосахариды,
затем мальтоза и, наконец, глюкоза и другие моносахариды.
-гликозидазой. В процессе амилолиза образуются олигосахариды,
затем мальтоза и, наконец, глюкоза и другие моносахариды.
В период развития окоченения преобладает фосфоролитический путь
распада гликогена. К этому времени в мясе накапливается максимальное количество
основного продукта гликолиза - молочной кислоты. В последующем преобладает
амилолиз и количество моносахаридов увеличивается.
Распад гликогена:
Подготовительная стадия: Образование глюкозы и подготовка к ослаблению связи в ней между С3
и С4
. Образование глюкозофосфорных эфиров под действием  - глюканфосфорилазы.
- глюканфосфорилазы.

.1. Перенос остатка фосфорной кислоты в глюкозо-1-фосфате от С1
к С6 под действием фосфоглюкомутазы

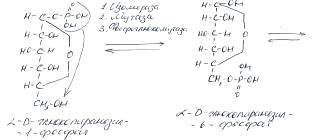
Активация глюкозы - подготовка к ослаблению связи С3-С4.
. Изомеризация глюкозо-6-фосфата в фруктозу-6-фосфат -
внутримолекулярная перестройка под действием глюкозо-6-фосфатизомеразы

. Перенос фосфорной кислоты от АТФ к С1 фруктозы под
действием фосфофруктокиназы.

Связь между С3 и С4 достаточно ослаблена для
ее разрыва с участием альдолазы.

. Дихотомический разрыв С3-С4 связи в
фруктозо-1,6-фосфате под действием альдолазы
Образовавшийся глицеральдегид - 3 - фосфат учавствует в
окислительном фосфорилировании.
Стадия генерации АТФ
Окислительное фосфорилирование на уровне субстрата с участием
фермента глицераль-3-фосфатдегидрогеназы (5,6,7)
. Образование ферментсубстратного комплекса

В результате окисления альдегидной группы глицеральдегид-3-фосфата
в карбоксильную образуется энергия, частично запасаемая в тиоэфирной связи, а
частично рассеивающаяся в виде тепла.
. Фосфоролиз: перенос фосфоацила с потенциальной энергией на
неорганический фосфат

Таким образом, фосфоролиз позволяет потенциальную энергию
окисления альдегидной группы кумулировать в макроэргической фосфатной связи
1,3-дифосфоглицерата.
. Перенос остатка фосфорной кислоты богатого энергией с
1,3-дифосфоглицерата на АДФ под действием фосфоглицераткиназы

. Подготовительная реакция. Перенос фосфорного остатка от С3
к С2 в 3-фосфоглицерате под действием фосфоглицератмутазы

Окислительное фосфорилирование на уровне субстрата (9,10,11)
. Отщепление воды под действием енолазы

За счет реакции дегидратации произошло окисление атома С2
с образованием энергии, частично запасаемая в макроэргической связи и частично
рассеивающаяся в виде тепла.
. Перенос макроэргической связи с фосфорным остатком от
фосфоенолпирувата на АДФ под действием пируваткиназы. Образуется 2 молекулы
АТФ.

. Перенос Н+ с кофермента НАДН+ Н+ на
пируват - восстановление пирувата до лактата под действием лактаддегидрогеназы

Суммарное уравнение процесса:

В результате накопления в мышечной ткани молочной и ортофосфорной
кислот снижается рН среды, достигающего минимума к моменту максимального
развития окоченения.
Увеличение содержания ортофосфата происходит вначале
преимущественно в результате дефосфорилирования промежуточных продуктов
гликогенолиза - глюкозофосфорных эфиров. В дальнейшем возрастает значение
распада КФ и мононуклеотидов.
В изменении количества молочной кислоты отмечены три периода:
сравнительно медленный рост в самом начале автолиза, быстрый рост в период
развития окоченения и некоторое снижение ее количества по мере разрешения
окоченения. Первый очень непродолжительный период медленного накопления обусловлен
наличием в мышцах оксимиоглобина, кислород которого способен окислять
пировиноградную кислоту до конечных продуктов: Н2О и СО2.
Его длительность и влияние на дальнейшее накопление молочной кислоты связаны с
содержанием миоглобина в мышцах. В мышцах с более светлой окраской образуется
больше молочной кислоты и меньше редуцирующих сахароз, чем в мышцах с более
темной окраской, содержащих больше миоглобина.
Большое значение имеет количество гликогена в мышцах перед убоем
птицы. Соответственно этому меняется и содержание молочной и ортофосфорпой
кислот в мышцах к моменту полного развития окоченения, а отсюда и величина рН.
В мышцах здоровой отдохнувшей птицы она лежит в пределах 5,5-5,7, в мышцах
утомленной или истощенной (в том числе болезнью) птицы - 6,2-6,8, По этой же
причине рН мышечной ткани плохо откормленных птиц выше, чем упитанных.
При замораживании гликолитическпй распад мышечного гликогена идет
с тем меньшей скоростью, чем ниже температура. Замораживание на ранних сроках
автолиза и при более низкой температуре дает возможность свести к минимуму
накопление продуктов гликолиза.
Но при замораживании мышц так же обнаружено нарастание
амилолитических (гидролитических) превращений гликогена, что может быть
следствием выхода «кислых» гликозидаз из ограничивающих структур (лизосом) и
активации всех гликозидаз ионами хлора.
При холодильном хранении мороженых мышц установлено значительное
уменьшение редуцирующих сахаров. Для мышц с различной глубиной автолиза
выявлена общая закономерность уменьшения содержания редуцирующих сахаров: чем
больше хранятся мышцы в мороженом виде и чем выше температура их холодильной
обработки, тем меньше они содержат редуцирующих углеводов.
В
отличие от хранения при положительных температурах, когда преобладает распад
гликогена, в процессе замораживания обнаружен ресинтез гликогена, который более
отчетливо наблюдается в мышцах, содержащих значительное количество редуцирующих
сахаров. Поэтому можно считать, что одним из путей ресиптеза гликогена в этих
условиях может быть обращение фосфоролиза. Этому способствует увеличение
концентрации редуцирующих сахаров, в том числе и глюкозофосфатов, в свободной
воде при замораживании. Ресинтезированный в процессах замораживания гликоген
при размораживании мышц снова вовлекается в гликолитические и гидролитические
превращения.
.3.2 Изменение фосфоросодержащих
веществ
После убоя изменяется содержание креатинфосфорной кислоты,
что свидетельствуют о снижении количества фосфора креатинфосфорной кислоты до
12% от первоначального уровня. Большая часть креатинфосфата распадается еще до
того момента, когда наблюдаются первые физические обнаруживаемые признаки
окоченения. К этому моменту содержание креатинфосфата в мышцах не превышает 5%
общего кислоторастворимого фосфора. Креатинфосфорная кислота, принимая участие
в гликолитическом цикле, действует только как средство происходящего при этом
ресинтеза АТФ и не может играть какой-либо другой роли в изменениях, связанных
с послеубойным окоченением мышц.
Миозин обладает ферментативными свойствами, которые вызывают
расщепление АТФ. При ферментативном распаде АТФ соединяется с миозином, в
результате чего отщепляется третья частица фосфорной кислоты, а АДФ отделяется
от миозина. Свободный миозин соединяется с новой молекулой АТФ или с актином.
Кроме того АТФ влияет на механические свойства нитей миозина,
значительно увеличивая их растяжимость. В этом отношении АТФ превышает по силе
действия другие органические эфиры, содержащие пирофосфатные связи.
Процессы распада АТФ и увеличения степени жесткости мышечной
ткани при развитии послеубойного окоченения протекают параллельно.
Принимая во внимание значение АТФ в процессах гликолиза при
сокращении мускулов и в изменении механических свойств миозиновьгх нитей можно
сделать вывод о зависимости окоченения мускулов от недостатка АТФ.
Известно, что АТФ непрерывно синтезируется в процессе
гликолиза в количестве 1,5 моля на каждый моль образующейся молочной
кислоты. Однако этот синтез в той или другой степени уравновешивается
расщеплением АТФ миозином. Поэтому пока имеются неизрасходованные резервы
гликогена, не может произойти полного распада АТФ, и мышца не переходит в
состояние окоченения.
Небольшие изменения концентрации АТФ в конце процесса
гликолиза оказывают решающее влияние на растяжимость мышцы, и конечное падение
скорости превращения АТФ соответствует в каждом отдельном случае наступлению
окоченения.
Распад АТФ в процессе нарастания посмертного окоченения
вызывает переход большей части актомиозина в нерастворимое состояние. При этом
вследствие наличия в мышечной ткани на данной стадии его послеубойных изменений
остаточного легкогидролизуемого фосфора не может образоваться высокоактивный
актомиозин. В дальнейшем распад легкогидролизуемого фосфора резко замедляется,
а в некоторый случаях к концу вторых суток хранения практически
приостанавливается. После вторых суток происходит некоторое увеличение его
количества.
Как известно, кроме аденозинтрифосфорной кислоты (АТФ),
аденозиндифосфорная кислота (АДФ) и пирофосфорная кислота также содержат
легкогидролизуемый фосфор.
В присутствии этих кислот актомиозин с высоким процентом
активности не может образоваться. Аденозиндифосфорная и ортофосфорная кислоты
такими свойствами не обладают.
Через 1-2 суток после убоя фракция остаточного фосфора в
основном состоит из неорганического ортофосфата и негидролизуемого фосфора.
Следовательно, на этой стадии послеубойного хранения наличие остаточного
фосфора в этой фракции не может быть отнесено за счет АТФ, АДФ и пирофосфорной
кислоты. Вместе с этим увеличение легкогидролизуемого фосфора на 4-6 сутки
созревания мяса должно быть отнесено за счет появления в экстракте
пирофосфорной кислоты или АДФ, но не АТФ. Ввиду того, что пирофосфорная кислота
оказывает на актомиозиновый комплекс действие, аналогичное АТФ, не исключена
возможность влияния образующегося остаточного легкогидролизуемого фосфора на
процесс диссоциации актомиозина на актин и миозин.
В этих превращениях принимают учащие ферменты гликолиза и
миознновая АТФ - аза. Однако последний фермент не может быть единственным,
принимающим участие в распаде АТФ, так как он катализирует только реакцию:

Поэтому он должен был бы приводить к значительному увеличению
количества АДФ в мускулах после прекращения жизни животного.
Однако этого не происходит. После прекращения жизни АДФ
обычно не накапливается в больших количествах. Протекает следующая реакция с
участием миокиназы:


Миокиназа является дополнительным фактором. Определяющим
скорость распада АТФ.
Замораживание и хранение мышечной ткани в мороженом виде
обусловливает резкое торможение распада АТФ. Хотя мороженные мышцы после очень
длительного хранения сохраняют существенные количества АТФ, все же выявляется
определенная убыль АТФ.
Как видно, в основном происходит распад АТФ,
накопление неорганического фосфата, инозинмонофосфорной кислоты (ИМФ) и
аммиака, т. е. суммарную реакцию можно записать в следующем виде:

1.3.3 Изменения липидной системы
Изменения структуры и свойств липидов отличаются рядом
особенностей. В начальный период хранения мышечной ткани курицы в нем протекает
ряд биохимических процессов, оказывающих существенное влияние на качественные
показатели. При этом даже самые незначительные, иногда еле уловимые, изменения
в составе или строении компонентов мышечной ткани могут решающим образом
воздействовать на её свойства в целом (рис.8).

Рис.8.
Изменение липидной системы
В отличие от изменений в выделенных (чистых) жирах
превращение липидов в тканях начинается сразу же после убоя, подвергаясь
воздействию мышечных липаз. Чем выше запасы гликогена в мышцах, тем интенсивнее
его распад и значительнее понижение рН тканей. В связи с этим активность
мышечных липаз, как и в живом организме осуществляющих гидролиз тканевых
липидов, уменьшается.

При хранении ткани целостность и функция мембран нарушаются.
Разрушаются также и мембраны клеточных органелл, в том числе лизосом. Это
приводит к выходу из них гидролитических ферментов, и в частности липазы,
оптимум действия которой ниже оптимума действия мышечной липазы и лежит в пределах
рН 4,0-4,5. Таким образом, гидролитическое расщепление жиров продолжается в
послеубойный период достаточно активно. В мышечных тканях уже после
непродолжительного хранения отмечается увеличение содержания свободных жирных
кислот, а также ди- и моноглицеридов - продуктов неполного гидролиза
триглицеридов.
В течение некоторого времени в тканях может продолжаться и  -окисление жирных кислот, в основном
низкомолекулярных.
-окисление жирных кислот, в основном
низкомолекулярных.
Процессы окисления (дегидрирования) в анаэробных условиях,
создающихся в тканях сразу после убоя животных, из-за недостатка акцепторов
водорода (накапливаются восстановленные формы дегидрогеназ) сколько-нибудь
глубоко идти не могут. Процесс останавливается на стадии образования гидрокси-
и кетокислот, которые под действием тканевых декарбоксилаз превращаются в
кетоны:

Низкомолекулярные кетоны (метилалкилкетоны) обладают неприятным
специфическим запахом и могут вызывать порчу по типу кетонного прогоркания.
Ферментативные процессы достаточно интенсивно протекают при хранении продуктов
при комнатной температуре, а по мере понижения температуры они замедляются.
Процессы ферментативного расщепления липидов при низких температурах, как,
впрочем, и белков, изучены пока недостаточно [29]. Они закладывают как бы
основу, от которой в дальнейшем зависят скорость и направление изменений в
липидах и в мышцах в целом. При более длительном хранении продуктов, и в
особенности при хранении их в неблагоприятных условиях, в мышечной ткани происходит
интенсивное окисление липидов по свободнорадикальному механизму, с образованием
пероксидов и продуктов их превращения, т. е. альдегидов, кетонов и т. д.
При расщеплении составных компонентов липидов (фосфолипидов,
триацилглицеринов, стероидов), помимо глицерина и жирных кислот, образуются
свободные основания, дальнейшее превращение которых может привести к
возникновению токсичных продуктов. Холин, например, при бактериальном окислении
образует триметиламин и другие ядовитые вещества. Микроорганизмы
интенсивно расщепляют аминокислоты. В результате различных видов микробного
ферментативного дезаминирования выделяются значительные количества аммиака,
который вступает в реакцию нейтрализации со свободными жирными кислотами с
образованием аммиачного мыла. Развивающаяся щелочная среда благоприятствует
росту плесеней.
В ходе всех этих процессов быстро изменяются тканевые липиды по
типу кетонного прогоркания. Последующие изменения под действием
микроорганизмов связаны с развитием гнилостных процессов и с глубоким, распадом
тканей.
1.3.4 Изменение белковой системы
Факт беспорядочного сокращения и расслабления мышечных
волоком, установленный методами гистологических исследований, не оставляет
сомнений в том, что решающее значение для изменений прочностных свойств и
водосвязывающей способности мышечной ткани в период развития и разрешения
окоченения имеет изменение состояния белков миофибрилл в связи с актом
сокращения.
Хотя в основе посмертного сокращения лежит в общем тот же
механизм, что и в живой мышце, имеются и существенные различия, Работа,
совершаемая мышцей, или ее напряженное состояние при жизни животного
обусловлены тетаническим характером сокращения мышечных волокон, когда
происходит последовательное наложение волн их одиночного (однократного) сокращения,
При этом каждое из этих одиночных сокращений совершается за счет энергии,
выделяющейся при распаде АТФ. Мгновенный распад АТФ катализируется
ферментативной АТФ-азной способностью миозина. Химизм этого процесса можно
вырядить следующей обобщенной схемой (символом М обозначен миозин):
 (1)
(1)
Образующийся АДФ расходуется на синтез АТФ
по реакции взаимодействия с КФ, катализируемой креатннкиназой:
 (2)
(2)
Неорганический фосфат (Фн) вовлекается
в реакции гликолитического цикла, участвуя в фосфорилировании гликогена. В
аэробной фазе этого цикла происходит восстановление расходуемых на сокращение
АТФ к КФ.
В отмирающих мышцах, когда аэробная фаза
гликолитического цикла затухает» распад гликогена заканчивается образованием
молочной кислоты. Поэтому реакции (1) и (2) возможны лишь до тех пор, пока не
израсходованы запасы КФ. Затем начинается распад АДФ на более простые вещества.
Величина запасов КФ влияет на развитие посмертных изменений, замедляя их в
самой начальной фазе тем больше, чем больше КФ содержится в мышцах.

Рис.9. Схема взаимодействия между актином, тропомиозином и миозином
Механизм акта сокращения в свете
современных взглядов рассматривается на основе представления о системе
скользящих относительно одна другой нитей: нити актина подтягиваются к центру
саркомера в результате взаимодействия актина с активными центрами (головками)
молекул миозина, которые являются носителями его АТФ-азной способности. При
этом возникающее напряжение передается на упругие внутримышечные
соединительнотканные структурные элементы, к которым крепятся миофибриллы.
Предполагают, что расслабление волокон в прижизненных условиях происходит под
влиянием упругого восстановления деформации этих элементов после того, как
условия, обеспечивающие взаимодействие актина и миозина, снимаются (т. е. после
распада АТФ) (рис.9).
В присутствии АТФ актин находится в
глобулярной G-форме.
Процессу сокращения предшествует образование актиновых нитей. Т. е. переход
глобулярного G-актина
в фибриллярный F-актин по схеме:
 (3)
(3)
При этом образуются двойные спирали, в
канавках которых укладываются молекулы тропомиозина, регулирующею длину
образующихся нитей.
Таким образом, в присутствии АТФ актин
находится в глобулярной G-форме и не связан с миозином, мышечное волокно расслаблено.
Распад АТФ, катализируемый АТФ-азой (миозином), приводит к полимеризации актина
в F-формe, взаимодействию его
двойных спиралей с головками миозина с образованием актомиозина и сокращению
миофибрилл. Описанный механизм процессов, предшествующих прижизненному
сокращению и сопутствующих ему, можно распространить и на посмертное
сокращение.
Ферментативный распад АТФ под действием
АТФ-азы начинается в мышечной ткани сразу после убоя. Методом хроматографии на
бумаге установлено, что содержание АТФ в мышечной ткани быстро уменьшается в
первые часы после прекращения жизни, уменьшение практически заканчивается через
24 ч.
В начальной стадии автолиза количество
распадающейся АТФ компенсируется за счет распада КФ. Ее содержание в мышцах
остается примерно на одном уровне. Это задерживает развитие сокращения (фаза
задержки). Таким образом в течение первых 4-5 ч сохраняется в основном
свойства, характерные для парного состояния. Но быстрое снижение количества КФ,
за счет энергии распада которого она частично ресинтезируется в процессе
автолиза, приводит к практически полному ее исчезновению в течение 1-2 суток
после прекращения жизни птицы.
Возможные причины различий в скоростях
распада АТФ в светлых и темных мышцах трудно объяснимы, так как активность
АТФ-азы одинакова.
Соответственно скорости распада АТФ
развиваются признаки посмертного окоченения, максимум развития которого
наступает к моменту ее почти полного исчезновения.
В прижизненных условиях акт сокращения и
расслабления миофибрилл зависит от концентрации ионов магния и кальция. В
присутствии только ионов магния АТФ медленно расщепляется, но сокращения
миофибрилл не происходит. В отсутствии ионов магния наличие ионов кальция
вызывает расщепление АТФ без существенного сокращения с выделением тепла, В
расслабленной мышце магний связан с АТФ и пластифицирует сократительную
систему. Появление ничтожных количеств ионов кальция в присутствии магния вызывает
быстрый ферментативный распад АТФ и сокращение миофибрилл.
При посмертном сокращении передача нервных
импульсов, регулирующих сокращение - расслабление миофибрилл, исключается.
Поэтому фактором, инициирующим посмертное сокращение, является нечто иное.
Возможно, что им является изменение электростатических потенциалов вследствие
увеличения степени диссоциации электролитов в результате подкисления среды. Но
может быть в кислой среде кальций образует растворимый монокальцийфосфат. Сам
факт резкого возрастания концентрации ионов магния и кальция в период развития
окоченения неоднократно подтвержден экспериментально. Впервые увеличение
концентрации ионов кальция было обнаружено И.А. Смородинцевым и сотрудниками
еще в 1935 г [26].
Посмертное сокращение отличается от
прижизненного и в другом отношении. После одиночного прижизненного сокращения,
когда ионы кальция выводятся из сферы реакций сокращения, нити актина легко
скользят относительно нитей миозина под действием небольших напряжений. Это
обусловлено пластифицирующим действием Мg • АТФ, который
препятствует образованию поперечных связей между нитями актина и миозина. При
окоченении, когда АТФ практически отсутствует Мg • АТФ нет. Поэтому
образуются поперечные связи. Мышца становится жесткой и нерастяжимой. Попытки
растянуть ее приводят к разрыву волокон.
После разрешения посмертного окоченения,
как показали гистологические исследования, большинство волокон расслаблено.
Причины этого расслабления еще недостаточно ясны. Но, во всяком случае,
расслаблению должно предшествовать ослабление поперечных связей между актином и
миозином, возникающих при окоченении.
Полной диссоциации актомиозина на актин и
миозин ни после разрешения окоченения, ни в дальнейшем не происходит.
Были обнаружены обратимые изменений прочности
связи между углеводным и белковым компонентами мукополисахаридбелковых
комплексов соединительной ткани: количество прочносвязанного углеводного
компонента возрастало с развитием окоченения и уменьшалось по мере его
разрешение. Это может быть интерпретировано как доказательство изменения
внутренней энергии структурных элементов соединительной ткани под действием
напряжений, вызываемых сокращением волокна.
Снижение прочностных свойств тканей в
период после разрешения окоченения в какой-то, но незначительной мере связано с
продолжающимся расслаблением небольшой части мышечных волокон.. Возрастающее
значение начинает приобретать распад белковых комплексов. Методом электронной
микрографии было показано наличие фрагментации миофибрилл в грудном мускуле
цыплят, хранившемся при 5° С, хотя при этом не было получено доказательств
участия в этом протеолитических ферментов. Все же пока наиболее вероятной
причиной распада миофибрилл представляется деятельность протеолитических
ферментов мышечной ткани. Оптимум активности протеиназ мышечной ткани по одним
данным находится при рН 3,8-4,5, по другим - они имеют два оптимума - при рН
3,8 и 4,8, причем активность в отношении белков мышечной ткани значительно выше
при рН З,8. Считается возможным, что катепсины активны в пределах рН 5,4-6,8.
Наиболее вероятной причиной слабой активности катепсинов в период посмертных
изменений является их локализация в структурных элементах мышечного волокна. Их
активность значительна выше в вытяжке из намельченной мышечной ткани. Существует
несколько типов катепсинов: А, В, С, D, E. Каждый отличается рН-активностью, специфичностью. А, В и С
сходны с действием трипсина, пепсина и химотрипсина, D, Е сходны с амино- и
карбоксипептидазами и дипептидазами:

Достаточно определенных данных о
количественных изменениях свободных аминокислот при автолизе мышечной ткани
нет. Это вполне естественно, так как результаты исследований зависят от многих
факторов: состояния животного перед убоем, метода исследования, изменений самих
аминокислот в ходе автолиза. Анализ многих источников все же дает основание
считать, что в ходе автолиза в существенно увеличивается количество свободных
гистидина, аспарагиновой кислоты, глицина, треонина, тирозина, фенилаланина,
лейцина, а также и других аминокислот, хотя и менее значительно.
Источником накопления свободных
аминокислот могут быть природные пептиды мышечной ткани: карнозин, ансерин,
глютатион. Но их распад приводит к появлению весьма ограниченного набора
аминокислот. Поэтому основным источником появления свободных аминокислот
следует считать гидролиз промежуточных продуктов белкового распада.
Агрегационные взаимодействия миофибриллярных белков
при замораживании более интенсивны, чем при хранении мышц в условиях низких
положительных температур. При замораживании и хранении мышц уменьшается
извлекаемость белков актомиозинового комплекса, реактивность тиоловых групп
миозина, резко уменьшается реактивность кислых и основных групп во всех белках,
а также резко снижается водоудерживающая способность мышц. Основные изменения
при замораживании обусловлены вымерзанием воды. Поскольку миозиновая АТФ-аза
при замораживании ингибируется, значительного сокращения структур
контрактильных белков за счет энергии АТФ при замораживании, по-видимому, не
происходит.
1.3.4.1 Гниение
Гнилостные
бактерии (putrefactive bacteria) [греч. Bacterion - палочка] - бактерии,
развивающиеся на мертвом органическом веществе и участвующие в процессе
гниения. Гнилостные бактерии являются анаэробами или факультативными
анаэробами, обладающими мощными протеолитическими ферментами, с помощью которых
они расщепляют белки на полипептиды и аминокислоты, подвергаемые затем
дезаминированию или декарбоксилированию (напр., бактерии родов Bacillus
<#"791002.files/image053.gif">
NH3 и летучие жирные кислоты образуются при
восстановительном дезаминировании под действием ферментов анаэробных бактерий:

Таким
образом, дезаминирование аминокислот под воздействием ферментов микроорганизмов
приводит к образованию аммиака, жирных кислот, кетокислот и оксикислот, причем
некоторые кетокислоты и оксикислоты могут претерпевать дальнейшие превращения.
Так, кетокислоты при каталитическом действии декарбоксилаз превращаются в
альдегиды и углекислый газ:

Оксикислоты-
в спирт и углекислый газ:

Амины
образуются в результате декарбоксилирования аминокислот:

Многие
амины даже в очень малых количествах обладают сильным фармакологическим
действием, например кадаверин, образующийся при декарбоксилировании лизина.

Из
аминокислот тирозина и триптофана в результате дезаминирования и
декарбоксилирования образуются крезол, фенол, скатол, индол- дурно пахнущие и
ядовитые вещества.

В
процессе гниения из аминокислот, содержащих серу, выделяются сероводород и
аммиак и образуются меркаптаны. Например:

Из
липидной части липопротеидов в результате ряда превращений лецитина
образуется холин, в процессе гниения которого может образоваться окись
триметиламина, обладающая рыбным запахом.

1.4 Влияние хранения при
низких температурах на содержание ФТА в мышечной ткани курицы
Во время замораживания и хранения мышечной ткани
наблюдаются изменения в углеводной системе: уменьшается количество гликогена и
увеличивается количество глюкозы и молочной кислоты. При быстром замораживании
процесс накопления глюкозы и молочной кислоты протекает длительнее, чем при
медленном замораживании.
Замораживание и хранение вызывают значительные
изменения в составе фосфорных соединений: содержание органического фосфора
уменьшается, а неорганического нарастает. Накопление кислот обусловливает
понижение рН. При медленном замораживании все процессы развиваются интенсивнее.
По данным Матрозовой С.И. содержание аминоазота в мышечной ткани курицы в
первые сутки составляло 80 мг%, на тридцатые сутки хранения при -25 0С
содержание аминоазота составляло 105 мг%, на шестидесятые сутки - 120 мг%. За
первый месяц количество аминоазота увеличилось на 25 мг%, а за второй месяц -
на 15 мг%, т.е. при хранении в быстро замороженной мышечной ткани химические
реакции протекают интенсивнее, чем в ткани, медленно замороженной, так как при
медленном замораживании значительная часть соединений, способных подвергаться
ферментативному распаду в течении первых 30 суток, бывает уже израсходована
[13].
Поэтому обычно в процессе хранения замороженной
мышечной ткани довольно длительный период не наблюдается значительного
накопления аминного азота и аммиака.
Не смотря на то, что при низких температурах скорость
ферментативных реакций очень невелика, влияние ферментов микроорганизмов не
исключается.
Исследуемый материал:
Тушка цыпленка - бройлера I категории
Производитель: ОАО ТПК «Балтптицепром», г. Калининград
Масса потрошеной тушки: 1,388 кг
Убой: 8.10.12 г. около 7.00 утра
Возраст птицы: 40 дней
В 100 г содержится:
· Белок - не менее 16 г
· Жиры - 14 г
· Энергетическая ценность = 190 ккал
Проведение исследования:
. Охлажденная голень курицы, хранившаяся 30 часов
. Мышечная ткань курицы, хранившаяся 30 суток при - 25
0С
. Мышечная ткань курицы, хранившаяся 60 суток при - 25
0С
2.1 Определение
аминоазота формольным титрованием
1. Мышечную ткань измельчить в гомогенизаторе, взвесить 10г, с
записью до второго знака, в колбе на 100мл. Залить водой на 2/3колбы
дистиллированной водой и дать отстоятся в течение 20 мин.
2. Колбу поставить в кипящую водяную баню и нагревать в течение 15
мин. После колбу остудить, довести дистиллированной водой до метки, перемешать
и отфильтровать через складчатый фильтр.
. В колбу №1 на 150 мл налить 10 мл полученного фильтра (опыт), в
колбу №2 налить такое же количество свежекипяченой охлажденной дистиллированной
воды (контроль). В обе колбы добавить по 3 капли фенолфталеина; нейтрализуем
контроль щелочью или кислотой до слабо-розового цвета, то же самое проделываем
с опытом.
. В обе колбы добавляем по 10 мл формольной смеси и титруем гидроксилом
натрия контрольную колбу до ярко-розового цвета. Записываем значение гидроксила
натрия, пошедшего на титрование. После титруем колбу №1 (опыт) то же до
ярко-розового цвета и записываем значение гидроксила натрия, пошедшего на
титрование. После проверяем, чтобы количества растворов в колбах были
одинаковыми, если в колбе №1 больше, то в колбу №2 доливается дистиллированная
вода.
. В колбу с контролем добавляем еще 2 капли гидроксила натрия,
чтобы раствор окрасился до интенсивно красного цвета. Записываем значение
гидроксила натрия, пошедшего на титрование. То же самое проделываем с колбой №1
(опыт). Записываем значение гидроксила натрия, пошедшего на титрование.
Значение аминоазота, содержимого в курице, можно считать после того, как
во всех колбах будет уравнены объемы растворов и их окраска.
Значение аминоазота, содержимого в курице, рассчитывается по формуле:

где X=(a + b)-(c + d),
мл; V1- общий объем экстракта из мышечной ткани, мл; m- масса навески мышечной ткани, мл; V- объем фильтрата, взятого на
определение, мл; 1,4- количество мг азота, соответствующее 1 мл 0,1 н NaOH
.2 Результаты
исследований
Таблица 1. Количество 0,1 н. NaOH, пошедшее на титрование ФТА, мл.
|
Проба
|
Объем NaOH
|
|
V1 (пошло NaOH)
|
V2 (добавлено NaOH)
|
|
Контроль 1
|
V1 = 0,1
|
V1 = 0,2
|
|
V2 = 0,1
|
V2 = 0,2
|
|
V3 = 0,1
|
V3 = 0,3
|
|
Опыт 1,
охлажденная голень курицы, хранившаяся 30 часов
|
V1 = 0,7
|
V1 = 0,3
|
|
V2 = 0,6
|
V2 = 0,3
|
|
V3 = 0,8
|
V3 = 0,2
|
|
Контроль 2
|
V1 = 0
|
V1 = 0,2
|
|
V2 = 0
|
V2 = 0,2
|
|
V3 = 0
|
V3 = 0,2
|
|
Опыт 2, мышечная
ткань, хранившаяся 30 суток
|
V1 = 0,8
|
V1 = 0,2
|
|
V2 = 0,8
|
V2 = 0,3
|
|
V3 = 0,7
|
V3 = 0,2
|
|
Контроль 3
|
V1 = 0,1
|
V1 = 0,2
|
|
V2 = 0,1
|
V2 = 0,2
|
|
V3 = 0,1
|
V3 = 0,3
|
|
Опыт 3, мышечная
ткань, хранившаяся 60 суток
|
V1 =0,9
|
V1 = 0,3
|
|
V2 = 1,0
|
V2 = 0,2
|
|
V3 = 1,0
|
V3 = 0,3
|
. Охлажденное филе курицы,
хранившаяся 30 часов.
Х=(0,7 + 0,27) - (0,1 + 0,23) = 0,64
мл.
V1=100 мл.
К=1
m=10 г.
V=10 мл.
 мг%
мг%
. Филе курицы, хранившееся 30 суток
при температуре - 25 0С
Х=(0,77+0,23) - (0+0,2) =0,8 мл.
V1=100 мл.
К=1
m=10 г.
V=10 мл.
 мг%
мг%
. Филе курицы, хранившееся 60 суток
при температуре - 25 0С
Х=(0,97+0,27) - (0,1+0,23) = 0,91мл.
V1=100 мл.
К=1
m=10 г.
V=10 мл.
 мг%
мг%
Таблица 2. Содержание ФТА в мышечной ткани курицы, мг
%.
|
Хранение, сутки
|
Содержание ФТА
|
Динамика накопления
ФТА, мг%/сут
|
|
Экспериментальные
данные
|
Литературные данные
[13]
|
Экспериментальные
данные
|
Литературные данные
|
|
Контроль 1
|
89,6
|
80
|
-
|
-
|
|
30
|
112
|
105
|
0,75
|
0,83
|
|
60
|
127,4
|
120
|
0,51
|
0,5
|
Из таблицы 2 видно, что содержание ФТА в мышечной
ткани цыпленка-бройлера на 30 и 60 сутки хранения при температуре - 25 0С
повысилось по сравнению с первыми сутками соответственно на 20% и на 29,7% .
По данным Матрозовой С. И. содержания ФТА в мышечной ткани
цыпленка-бройлера на 30 и 60 сутки хранения при температуре - 23 0С
повысилось по сравнению с первыми сутками соответственно на 23,8% и на 33,3% .
В течение первых 30 суток по экспериментальным данным скорость накопления
ФТА составляет 0,75 мг% в сутки, в течении следующих 30 суток - 0,51 мг%. По
данным Матрозовой С. И. в первые 30 суток скорость накопления ФТА составляет
0,83 мг% в сутки, в течении следующих 30 суток - 0,5 мг%.
Динамика накопления ФТА по экспериментальным данным имеет сходную
тенденцию в сравнении с данными Матрозовой С. И., что подтверждается на
графике1.

График 1.
Влияние хранения 30 и 60 суток при - 25 0С на содержание ФТА в мышечной ткани
курицы
Выводы
В данной курсовой работе было достигнуто решение поставленных задач:
1. По морфологическому строению различают мышечную ткань двух типов:
поперечнополосатую (скелетная мускулатура) и гладкую (в стенках
пищеварительного тракта, диафрагмы, кровеносных сосудов).
. Биохимическую ценность мышечной ткани курицы обуславливает
содержание полноценных белков, в состав которых входят все незаменимые
аминокислоты, липидов - триацилглицерины (самая энергоемкая форма хранения
энергии), фосфолипиды и холестерин (входят в состав клеточных мембран), а так
же незаменимых жирных кислоты - линоленовая (С18:2ω3), линолевая (С18:2ω6) и арахидоновая (С20:4ω6), оказывающие антиатерогенное
действие.
3. Содержание углеводов мышечной ткани курицы не превышает 0,5%.
Углеводы выполняют энергетические, пластические, защитные функции и являются
запасным питательным веществом в виде гликогена в печени и мышцах.
. Макроэлементы мышечной ткани курицы участвуют в нормализации
водного баланса и поддержании кислотно-щелочного баланса (К и Na); входят в состав коферментов,
таких, как биотин, тиамин, коэнзим А, глютатион, липоевая кислота (S), НАД,
НАДФ, пиридоксальфосфат, в состав витаминов, например витамин В12,
ДНК, РНК, АТФ, ЦТФ (Р). Принимают участие в обмене белков, жиров и углеводов.
. Микроэлементы мышечной ткани курицы входят в cостав эмали зубов
(P); гемоглобина, обеспечивающий
транспорт кислорода, фермента - гемопротеина, катализирующий перенос электронов
на кислород в процессе окислительного фосфорилирования, активируют ферменты
класса оксидоредуктаз (Fe);
участвуют в синтезе анаболитических гормонов (инсулин, тестестерон), в
метаболизме витамина Е, активируют ферменты карбоангидразы (класса лиаз) и
уриказы (класса оксидоредуктаз).
6. Витамины в составе коферментов участвует в обмене
белков (витамин В6), в процессах окисления углеводов, глицерина,
аминокислот, окисления жирных кислот и их синтезе, синтезе холестерина (витамин
РР); в синтезе нуклеиновых оснований, влияют на жировой обмен в печени,
центральной и переферической нервной системы (В12).
. В ходе автолиза мышечной ткани курицы анаэробный гликолиз
приводит к накоплению в мышцах молочной, пировиноградной и фосфорной кислот, в
результате чего изменяется рН от 7,2-7,4 до 3,8-4,8. В кислой среде распад
липидов под действием гидролитических ферментов липаз приводит к накоплению
свободных жирных кислот, ди- и моноглицеридов; а так же распад белковых молекул
под действием протеолитических ферментов катепсинов - к образованию свободных
аминокислот.
. В связи с накоплением аминокислот и обсемененностью
микроорганизмами мышечной ткани курицы начинаются процессы гниения,
сопровождающиеся декарбоксилированием и дезаминированием аминокислот, с
образованием конечных дурнопахнущих и ядовитых продуктов: аммиака, сероводорода,
скатола, индола, крезола, фенола, меркаптанов.
. На 30 и 60 сутки хранения курицы при t = - 25 0C происходит увеличение количества формольно титруемого аминоазота на 20%
и 30 % соответственно по сравнению с первыми сутками, что свидетельствует об
автолитическом распаде белков мышечной ткани под действием протеолитических
ферментов и накоплении свободных аминокислот.
Список используемой литературы
1. Алехина
Л.Т., Большаков А.С. Технология мяса и мясопродуктов. - М.: Агропромиздат,1988.
- 576 с.: ил.
. Антипова
Л.В., Глотова И.А., Рогов И.А. Методы исследования мяса и мясных продуктов. -
М.: Колос, 2001. - 376 с.: ил.
. Антонов
В.К. Химия протеолиза. - М.: Наука, 1991. - 504 с.
. Винникова
Л.Г. Технология мяса и мясных продуктов. Учебник. - Киев: Фирма «ИНКОС», 2006.
- 600 с.: ил.,цв. вкл. 22 с.
. Горбатов
Физико-химические и биохимические основы технологии мяса и мясопродуктов
. Журавская
Н.К., Алехина Л.Т., Отряшенкова Л.М. Исследование и контроль качества мяса и
мясопродуктов.- М.: Агропромиздат,1985.-296 с
. Заяс Ю.Ф.
Качество мяса и мясопродуктов.- М.: Легкая и пищевая промышленность, 1981. -
480 с.
. Ковальская
Л.П., Шуб И.С., Мелькина Г.М. Технология пищевых производств. - М.: Колос,1999.
- 752 с.: ил.
. Кольман Я.,
Рем К.-Г. Наглядная биохимия, пер. с нем. - М.: «Мир», 2009. - 400 с.: ил.
. Комов В.П.
Биохимия: учеб. для вузов. - М.: Дрофа,2006. - 638 с.: ил.
. Коснырева
Л.М. Товароведение и экспертиза мяса и мясных товаров: Учебник для студ. высш.
учеб. заведений/ Л.М. Коснырева, В.И. Криштафович, В.М. Позняковский. - М.:
Издательский центр «Академия», 2005. - 320 с.
. Крылова
Н.Н., Лясковская Ю.Н. Биохимия мяса. - М.: Пищепромиздат,1957. - 360 с.
. Матрозова
С.И. Технохимический контроль в мясной и птицеперерабатывающей промышленности.
- М.: Пищевая промышленность, 1977. - 190 с.
. Месхи А.И.
Биохимия мяса, мясопродуктов и птицепродуктов. - М.: Легкая и пищевая
промышленность, 1984. - 280 с.
. Митрофанов
Ю.А. Переработка птицы. - М.: Агропромиздат, 1990. - 303 с. ил.
. Нечаев А.П.
Пищевая химия. - СПб.: ГИОРД, 2007. - 640 с.
. Павловский
П.Е., Пальмин В.В. Биохимия мяса. - М.: «Пищевая промышленность», 1975.
. Горбатов
В.М.. Физико - химические и биологические основы технологии мяса и
мясопродуктов: Справ. издание. - М.: «Пищевая промышленность», 1973. - 494 с.:
ил.
. Постольки
Я., Груда З. Замораживание пищевых продуктов. - М.: Пищевая промышленность,
1974. - 600 с.
. Рогов И.А.,
Антипова Л.В, Дунченко Н.И. Химия пищи. - М.: Колос,2007. - 853 с.:ил.
. Рогов И.А.,
Забашта А.Г., Казюлин Г.П. Общая технология мяса и мясопродуктов. - М.: Колос,
2000. - 367 с.: ил.
. Сергеева
Н.Т. Практикум по биохимии. Учебное пособие. - Калининград: Изд-во ФГОУ ВПО
«КГТУ», 2008. - 211 с.
. Скурихин
И.М., Волгарева М.Н. Химический состав пищевых продуктов: Книга 1: Справочные
таблицы содержания основных пищевых веществ и энергетической ценности пищевых
продуктов. - М.: ВО «Агропромиздат», 1987. - 224 с.
. Скурихин
И.М., Нечаев А.П. Все о пище с точки зрения химика: Справ. издаие. - С46 М.:
Высш. шк. 1991. - 288 с.: ил.
. Скурихин
И.М., Тутельян В.А. Химический состав российских пищевых продуктов: Справочное
издание. - М.: ДеЛи принт,2002. - 236 с.
. Смородинцев
И.А. Биохимия мяса.- М.: Птицепромиздат, 1952. - 300 с.
. Соловьев
В.И. Созревание мяса. - М.: «Пищевая промышленность», 1966. - 338 с.: ил.
. Химический
состав пищевых продуктов: Книга 1: Справочные таблицы содержания основных
пищевых продуктов/ Под ред. проф., д-ра техн. наук И.М. Скурихина, проф., д-ра
мед. наук М.Н. Волгарева. - 2-е изд., перераб. и доп. - М.: ВО «Агропромиздат»,
1987. - 224 с.
. Шаробайко
В.И. Биохимия продуктов холодильного консервирования. - М.: Агропромиздат,
1991. - 255 с.: ил. - (Учебники высш. учеб. заведений)