Фармакогностическое изучение дудника обыкновенного (Angelica archangelica L.)
ПЯТИГОРСКИЙ
ФИЛИАЛ
ГОСУДАРСТВЕННОГО
БЮДЖЕТНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ
ВЫСШЕГО
ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ВОЛГОГРАДСКИЙ
ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
МИНИСТЕРСТВА
ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
«ФАРМАКОГНОСТИЧЕСКОЕ
ИЗУЧЕНИЕ ДУДНИКА ОБЫКНОВЕННОГО (ANGELICA
ARCHANGELICA
L.)»
.04.02 -
фармацевтическая химия, фармакогнозия
Диссертация
на соискание
ученой степени
кандидата
фармацевтических наук
На
правах рукописи
Григорян
Элина Рудольфовна
Научный
руководитель:
доктор
фармацевтических наук,
доцент
Т.В. Орловская
Пятигорск
- 2012г.
ВВЕДЕНИЕ
Актуальность темы. Согласно данным
Всемирной организации здравоохранения почти 80 % населения нашей планеты
предпочитают использовать для лечения препараты растительного происхождения
[89], поэтому по-прежнему актуальным является исследование и разработка на их
основе лекарственных средств.
Наряду с высоким и оправданным
интересом исследователей к поиску принципиально новых источников фитопрепаратов
заслуживают не меньшего внимания лекарственные растения, уже давно применяемые
в медицине, но вместе с тем, имеющие не полностью раскрытый
фармакотерапевтический потенциал. Научные сведения о многих из них, в
частности, об их химическом составе, фармакологических свойствах были получены
десятки лет назад в рамках, имевшихся в то время возможностей науки, и с тех
пор практически не пополнялись.
По данным мировой статистики, около
70 % населения Земли страдает патологиями желчевыводящих путей и заболеваниями
мочеполовой системы. Большинство препаратов, использующихся в России при данной
патологии, имеют синтетическое происхождение. Препараты на основе растительного
сырья в большинстве своем выпускаются зарубежными производителями и
представлены на отечественном фармацевтическом рынке биологически активными
добавками (БАД). Однако такой путь на наш взгляд является нерациональным, так
как в этом случае приходиться применять БАДы практически постоянно. Кроме того,
использование БАД не всегда эффективно при уже возникшей патологии. В то время
как лекарственные препараты такого типа стандартизированы по биологически
активным веществам, что повышает их качество и чем они выгодно отличаются от
БАДов.
Особо актуальным представляется
поиск лекарственных средств с направленным фармакологическим действием,
например, диуретической и антимикробной активностями в сочетании с
антиоксидантным эффектом, которые связаны с содержанием полифенольного
комплекса.
В этой связи наше внимание привлек
интерес дудник обыкновенный (Angelica archangelica L.) из сем.
сельдерейные (Apiaceae). Сырье
дудника обыкновенного включено в ряд зарубежных фармакопей. Несмотря на широкую
популярность за рубежом, в нашей стране это растение известно лишь в народной
медицине как эффективное средство для лечения кашля.
Ограниченность производимой из данного
сырья продукции объясняется не только недостаточностью химических исследований,
но и отсутствием современной нормативной документации.
А в связи с тем, что в целях
рационального использования природного сырья основной акцент делается на
разработку и внедрение новых конкурентоспособных, малоотходных и безопасных
технологий, актуальным является изучение различных комплексов биологически
активных соединений (БАС).
Особенно актуальна на сегодняшний
день проблема преодоления зависимости отечественной фармацевтической
промышленности от импортного сырья и лекарственных препаратов. Правительством
России поставлена задача развития собственных возможностей для создания
эффективных отечественных лекарственных средств.
Таким образом, комплексное
исследование фитохимического состава, совершенствование нормирования качества,
в зависимости от пути использования сырья и группы БАС, определяющих
фармакологическую активность, является актуальной проблемой для
фармацевтической науки и практики.
Цель и задачи исследований. Целью
настоящей работы явилось фармакогностическое изучение дудника обыкновенного
корневищ и корней, разработка нормативной документации (НД) на сырье, как
потенциального источника получения БАС, обладающих желчегонной и мочегонной
активностью.
Для реализации поставленной цели
необходимо решить следующие задачи:
1. Изучение возможности культивирования
дикорастущего и сортового дудника обыкновенного в условиях Кавказских
Минеральных Вод.
. Провести фитохимический анализ
подземной части дудника обыкновенного (полифенольных соединений, углеводов,
эфирного масла, аминокислот, макро- и микроэлементов).
. Установить морфолого-анатомические
диагностические признаки и товароведческие показатели сырья.
. Определить острую токсичность и
провести предварительное изучение специфической биологической активности
различных фитосубстанций.
. Разработать фармакопейную статью
(проект ФС) «Дудника обыкновенного корневища и корни» и инструкцию по сбору и
сушке.
Научная новизна работы. Проведенные
интродукционные исследования в условиях ботанического сада Пятигорской ГФА
(КМВ), позволили прогнозировать выращивание этого вида и особенности
интродукции в условиях культуры на КМВ.
Изучен химический состав эфирного масла
подземных органов дудника обыкновенного, произрастающего на Северном Кавказе.
Методом газожидкостной хроматографии с последующим анализом масс-спектров
идентифицирован 21 компонент, из них 3 ранее не описанных для этого вида:
Методами бумажной, тонкослойной и
высокоэффективной жидкостной хроматографии (ВЭЖХ) идентифицированы 24
соединения, из них 7 впервые для данного вида:
v коричные кислоты: цикориевая, феруловая;
v фенолокислоты: галловая, эллаговая;
v кумарины: дикумарин;
v дубильные вещества: эпикатехин, танин.
Впервые изучен полисахаридный комплекс.
Обнаружены: водорастворимые полисахариды - 3,48 %; пектиновые вещества - 6,42
%; и гемицеллюлозы - 10,25 %. Установлено, что моносахаридный состав углеводов
представлен глюкозой, рамнозой, ксилозой, арабинозой, маннозой, галактозой.
Содержание углеводов в сырье в пересчете на галактуроновую кислоту составляет
6,49 %.
Установлен аминокислотный состав, которые
представлен 15 аминокислотами, из которых 9 являются незаменимыми, основной по
содержанию является аспарагиновая.
Изучен макро- и микроэлементный состав,
представленный 28 элементами, из которых доминирующими являются: калиий,
кальций, магний, марганец, натрий, железо.
Проведена стандартизация сырья дудника
обыкновенного с учетом современных требований предъявляемых к подлинности и
качеству лекарственного растительного сырья (ЛРС).
Впервые предложены методика оценки качества
корневищ и корней дудника обыкновенного, достоверно устанавливающая содержание
ангелицина и хлорогеновой кислоты спектрофотометрическим методом.
Проведены фармакологические скрининговые
исследования стандартизированных фитосубстанций на основе исследуемого сырья.
Практическая значимость. Предложен новый вид ЛРС
для включения в Государственную фармакопею России XII издания.
Разработан унифицированный подход к
стандартизации корневищ и корней дудника обыкновенного в соответствии с
современными требованиями и группой действующих БАС, которые включены в
нормативную документацию (НД).
Разработана методика количественного определения
суммы кумаринов (дифференциальная спектрофотометрия), а также ТСХ-методики
качественного определения ангелицина в сырье дудника обыкновенного.
Показана возможность использования исследуемого
вида растительного сырья в комплексных малоотходных технологиях получения
современных лекарственных фитопрепаратов.
Выявлена возможность использования
отечественного сырья дудника обыкновенного для получения фитопрепаратов
обладающих желчегонной, диуретической, спазмолитической, антибактериальной и
антиоксидантной активностью.
Внедрение результатов исследования. На основании
проведенных исследований разработаны НД:
. Проект ФС «Дудника обыкновенного корневища и
корни».
. Инструкция по сбору и сушке дудника
обыкновенного корневища и корни.
По материалам исследований составлены
информационные письма: «Морфолого-анатомическое изучение дудника обыкновенного»
и «Методика количественного определения суммы кумаринов в пересчете на
ангелицин в корневищах и корнях дудника обыкновенного (акты внедрения……….в
учебный процесс кафедры фармакогнозии с курсом ботаники ГБОУ ВПО Курского
государственного медицинского университета).
Основные положения, выносимые на защиту:
. Результаты интродукционных исследований
дудника обыкновенного на территории КМВ.
. Результаты изучения химического состава
подземных органов дудника обыкновенного физико-химическими методами.
. Показатели подлинности и нормы качества
дудника обыкновенного корневища и корни, необходимые для разработки проекта
нормативной документации.
. Результаты изучения фармакологической
активности сырья дудника обыкновенного.
Апробация работы и публикации. Основные
фрагменты диссертационной работы доложены на 65 и 66-ой региональных
конференциях «Разработка, исследование и маркетинг новой фармацевтической
продукции» (Пятигорск, 2010, 2011). Работа по изучению дудника обыкновенного
была представлена и прошла в финал Конкурса исследовательских проектов и
научно-технических разработок молодых изобретателей в рамках реализации
социально значимого Проекта «Золотой век инноваций» (Ставрополь, 2012).
По теме диссертации опубликовано 10 научных
работ, из них 4 в изданиях, рекомендованных ВАК.
Связь задач исследований с проблемным планом
фармацевтических наук. Диссертационная работа выполнена в соответствии с планом
научно-исследовательских работ ГБОУ ВПО Пятигорской ГФА Минздравсоцразвития
России (номер государственной регистрации 01200112164) и соответствует проблеме
«Фармация» секция № 38 Ученого совета МЗСР РФ.
ГЛАВА 1. СОВРЕМЕННОЕ СОСТОЯНИЕ
ФАРМАКОГНОСТИЧЕСКИХ ИССЛЕДОВАНИЙ ДУДНИКА ОБЫКНОВЕННОГО (ANGELICA
ARCHANGELICA
L.)
Головой качнул седой
Дядя Дягиль над водой
Над веселым тростником,
Над зеленым лозняком.
Голова - как белый шар.
Дядя Дягиль наш не стар!
Он еще позеленеет,
Пожелтеет, потемнеет,
Станет тощим и сухим
И под ветерком лихим
Склонит голову... Тогда
Будет он не дядя, А дуда!
1.1
Ботаническая характеристика рода Angelica
Согласно системе А.Л. Тахтаджяна род
Дудник (Angelica)
принадлежит к отделу Magnoliophyta, классу Magnoliopsida, подклассу Rosidae, надпорядку
Cornanae, порядку Apiales, подпорядку
Apiineae, семейству Apiaceae,
подсемейству Apioideae, трибе Peucedaneae [125].
В настоящее время существуют
различные точки зрения относительно систематического положения вида Angelica archangelica. Некоторые
авторы этот и некоторые другие виды выделяют в род Archangelica
<#"730627.files/image001.gif">
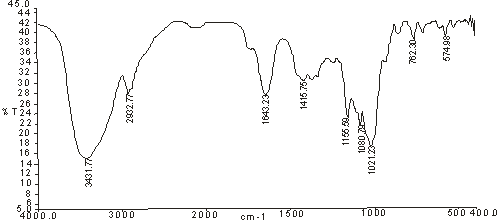

Рисунок 18 - ИК-спектры
полисахаридов корневищ и корней дудника обыкновенного: 1 - ВРПС-Х; 2 - ВРПС-Г;
3 - ПВ
По характеристическим полосам поглощения в
ИК-спектрах анализируемых углеводных фракций установлено наличие остатков
галактуроновых кислот в пиранозной форме в составе полисахаридов, находящихся в
4С1-α-конформации.
Выявлено, что уроновые кислоты благодаря первичным и вторичным спиртовым
гидроксилам ассоциированы внутримолекулярными водородными связями.
Карбоксильные группы преимущественно находятся в ионизированной форме и
частично этерифицированы метанолом.
5.2.2.5 Изучение
физико-химических характеристик пектинов
Анализ проводили по методикам указанным в
разделе 2.2.9. Значимых различий в физико-химических характеристиках пектинов в
растворимой в горячей воде и кислотной фракциях не установлено.
Пектины имеют кислую реакцию среды в пределах рН
от 3,1 до 3,6, что исключает раздражающее влияние на слизистую оболочку желудка
при их пероральном применении.
Титрометрическим методом определено содержание в
ПВ свободных (Кс) 4,50±0,22 % и этерифицированных (Кэ) 4,10±0,20 %
карбоксильных групп соответственно. Степень этерификации (λ)
при этом составляет 47,7±2,36 %. Следовательно, ПВ относятся к
низкоэтерифицированным пектиновым веществам.
Эти данные свидетельствуют о перспективности
галактуронидов в качестве энтеросорбентов, а значит, и как антиоксидантов, а
также вспомогательных компонентов при изготовлении лекарственных форм другого
назначения.
С фармакологической точки зрения наибольший
интерес из всех обнаруженных углеводов представляет галактуроновая кислота
(мономер пектина), имеющая значение и как лекарственное (энтеросорбент,
антимикробное), и как вспомогательное (стабилизатор, пролонгатор, наполнитель)
вещество [89]. Поскольку наибольшее ее содержание отмечено во фракциях,
извлеченных аммония оксалатом и горячей водой, то именно эти фракции
дополнительно исследованы на наличие галактуроновой кислоты методом
спектрофотометрии по реакции с карбазолом (раздел 2.2.8). В обоих случаях на
спектрах выявлен максимум поглощения при длине волны 530 нм, характерный для
уронидов даже при совместном присутствии нейтральных углеводов (рис. 19).
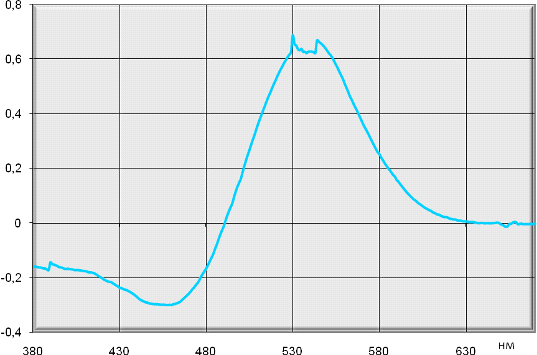
Рисунок 19 - Спектр светопоглощения продукта
взаимодействия углеводных фракций, извлеченных из корневищ и корней дудника
обыкновенного горячей водой и раствором аммония оксалата с карбазолом
Характер спектра, а именно:
положение максимума светопоглощения при 530 ± 2 нм, отсутствие других
максимумов (характерных для восстанавливающих сахаров), выраженный пик,
доказывают наличие галактуроновой кислоты в анализируемом объекте (рис. 19).
Используя известную расчетную формулу [47], в сравнении со стандартным образцом
галактуроновой кислоты, содержание полигалактуроновой кислоты в сырье составило
6,29±1,5 %.
Таким образом, учитывая достаточно
высокий выход углеводов из подземных органов дудника обыкновенного (17,11-20,57
%), полисахариды можно считать перспективными в отношении фармакологических
исследований и учитывать их в качестве целевого продукта при комплексной
переработке сырья.
5.3
Исследование эфирного масла
Известно, что количество эфирного
масла и его химический состав в большей степени зависят от вида и даже подвида
растения, места и условий его произрастания, фазы вегетации, метеорологических
условий и времени суток на момент сбора, а также от условий сушки и хранения
сырья с момента сбора и до момента анализа [26, 82, 147, 148].
Несмотря на то, что в химическом
отношении наиболее изученной группой БАС (по данным литературы) являются
эфирные масла в теоретическом плане всегда представляет интерес их исследование
и сравнение с данными литературы, так как эта группа БАС является одной из
самых лабильных по составу в зависимости от многих факторов. Это необходимо
учитывать также и потому, что изменение компонентного состава в целом и
содержание основного соединения эфирного масла может менять не только его
органолептические свойства (запах, вкус), но и биологическую активность [144].
5.3.1
Определение содержания эфирного масла
Эфирное масло получали методом
гидродистилляции из воздушно-сухого сырья (метод 2 - Клевенджера) [83]. Время
перегонки составляло 3 часа. Эфирное масло отделяли от воды эфиром диэтиловым и
в течение 12 часов высушивали над фосфора (V) оксидом в
эксикаторе.
Содержание эфирного масла в
различных образцах сырья составляло от 3,0 до 3,03 % и представляло собой
легкоподвижную жидкость зеленого цвета, с характерным запахом и приятным
вкусом.
5.3.2
Определение подлинности изучаемых образцов эфирного масла
Полученные образцы эфирного масла
анализировали согласно требованиям ОФС ГФ XI «Масла
эфирные» и соответствующих методик ГФ XI и XII изданий
[29, 30, 31].
Физико-химические показатели
исследуемых эфирных масел представлены в таблице 21.
Таблица 21 - Физико-химические
показатели эфирного масла
плотность 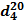 угол
вращения
угол
вращения 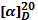
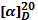 показатель
показатель
преломления 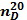
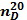 температура
температура
затвердевания,
Скислотное
число
(IA)эфирное
число
|
(IE)
|
|
|
|
|
|
|
0,8781
|
-240
|
1,467
|
-2
|
1,10-1,14
|
11,06-11,11
|
Растворимость в спирте этиловом дает
представление не только о подлинности, но и о качестве масла. Большинство
углеводородов плохо растворимо в спирте (особенно в разведенном), поэтому по
растворимости можно судить об их количестве в масле. В равной степени по
растворимости можно определить и примесь жирных масел [81]. Растворимость
эфирного масла дудника обыкновенного в спирте этиловом приведена в таблице 22.
Таблица 22 - Растворимость эфирного масла
дудника обыкновенного в спирте этиловом
|
Растворимость
|
Значение
|
|
в
70% спирте этиловом
|
легко
растворимо
|
|
в
80% спирте этиловом
|
очень
легко растворимо
|
|
в
90% спирте этиловом
|
очень
легко растворимо
|
Таким образом, растворимость эфирного масла
дудника обыкновенного можно характеризовать терминами «легко растворимо» (70%
спирт этиловый) и «очень легко растворимо» (80% и 90% спирт этиловый) (табл.
22).
Подлинность масла определяли по
органолептическим характеристикам (цвет, прозрачность, запах и вкус). Более
надежной оценкой подлинности является анализ методом ГЖХ, а при необходимости -
методом хромато-масс-спектроскопии.
Оценка качественного состава эфирных масел
данным ГЖХ может быть затруднена в связи с наличием стереоизомеров, дающих
близкие времена удерживания при хроматографии. В связи с этим, работа по
идентификации компонентов эфирного масла исследуемых образцов была проведена
методом газожидкостной хромато-масс-спектрометрии (раздел 2.3.1).
В корневищах с корнями Angelica
archangelica идентифицировали
21 соединение, что составляет 95,81 % от всех обнаруженных. Доминирующими
компонентами являются бициклические монотерпеновые углеводороды: α-пинен,
β-пинен
(45,34%), а также кумарин - остхол (9,11 %) (табл. 23, рис. 20).
Так как возможной органической примесью к сырью
дудника обыкновенного могут являться корневища и корни дудника лесного
представляло интерес сравнительное изучение эфирного масла из указанного сырья.
Компонентный состав эфирного масла Angelica
sylvestris представлен 31
компонентом, основным по содержанию являются куминовый альдегид (41,03%) и
спирты 2-карен-10-ол, 3-карен-10-ол (37,37%). Всего идентифицировано 98,78% от
общего состава эфирного масла (табл. 23, рис. 21).
Сравнивая полученные данные с литературными,
следует, что компонентный состав эфирного масла из дудника обыкновенного, флоры
Северного Кавказа отличается от всех ранее исследованных образцов, полученных
от растений из других регионов РФ и стран Европы, и в тоже время отличается
наиболее высоким показателем общего выхода эфирного масла [144]. Также отмечены
основные различия в содержании компонентов эфирного масла дудника обыкновенного
и дудника лесного, что позволяет разработать методики идентификации эфирного
масла двух видов (табл. 23).
Проведя данный фрагмент работы, мы убедились,
что изученные нами образцы эфирного масла отличались от ранее исследованных как
по составу, так и по количеству идентифицированных компонентов, в связи, с чем
считаем, что проводить стандартизацию сырья, только по показателю «Эфирное
масло» нецелесообразно.
Таблица 23 - Химический состав эфирных масел
подземных органов дудника обыкновенного и д. лесного
|
Дудник
обыкновенный
|
Дудник
лесной
|
|
Компонент
|
Время
удерживания, мин
|
Содержание,
%
|
Компонент
|
Время
удерживания, мин
|
Содержание,
%
|
|
α-пинен
|
4,687
|
15,58
|
циклофенчен
|
4,058
|
0,14
|
|
камфен
|
4.965
|
1,38
|
камфен
|
4,355
|
0,15
|
|
β-пинен
|
5,433
|
29,76
|
2-туйен
|
4,833
|
0,04
|
|
3-карен
|
5,982
|
3,43
|
β-пинен
|
4,921
|
1,79
|
|
лимонен
|
6,321
|
2,52
|
циклогексендион
|
5,678
|
0,06
|
|
пинокарвеол
|
8,553
|
0,96
|
пара-цимол
|
5,999
|
0,68
|
|
терпиненол
|
9,285
|
0,94
|
эвкалиптол
|
6,174
|
0,68
|
|
α-терпинеол
|
9,529
|
1,29
|
терпинен
|
6,885
|
0,62
|
|
пара-куминовый
альдегид
|
10,581
|
2,75
|
линалоол
|
8,004
|
0,18
|
|
борнилацетат
|
11,408
|
4,95
|
пентален
|
9,519
|
0,17
|
|
α-элемен
|
13,490
|
1,93
|
борнеол
|
10,003
|
0,52
|
|
α-гурьюнен
|
14,270
|
1,07
|
1-терпинен-4-ол
|
10,370
|
0,29
|
|
куркумен
|
15,091
|
0,65
|
α-терпинеол
|
10,778
|
0,39
|
|
α-мууролен
|
15,477
|
0,76
|
1,3-циклогесадиен-
1-метанол
|
10,895
|
1,14
|
|
неидентифиц.
|
16,081
|
2,97
|
оксиран
|
12,148
|
0,93
|
|
цис-агарон
|
16,278
|
1,47
|
пара-куминовый
альдегид
|
12,364
|
41,03
|
|
спатуленол
|
16,929
|
4,74
|
цитраль
|
13,314
|
1,07
|
|
эпи-пачулен
|
17,275
|
0,95
|
1-циклогесен-1-карбоксальдегид
|
13,442
|
0,16
|
|
неидентифиц.
|
17,804
|
1,22
|
2-карен-10-ол
|
13,739
|
12,53
|
|
кадинол
|
18,000
|
5,81
|
3-карен-10-ол
|
13,973
|
24,84
|
|
эудесмол
|
18,428
|
4,76
|
1,3,3-триметил-цикло-гексен-4-карбокси
|
16,456
|
1,96
|
|
экзалтолид
|
21,005
|
0,99
|
пара-изопропил-бензойная
кислота
|
18,047
|
1,15
|
|
остхол
|
25,237
|
9,11
|
этилацетилбензоат
|
18,892
|
2,49
|
|
|
|
ионон
|
19,725
|
1,52
|
|
|
|
куркумен
|
19,929
|
1,26
|
|
|
|
Миртеноевая
кислота
|
20,157
|
0,39
|
|
|
|
цингиберен
|
20,314
|
0,75
|
|
|
|
фарнезол
|
20,705
|
0,73
|
|
|
|
сесквифелландрен
|
21,148
|
0,66
|
|
|
|
каратол
|
23,234
|
1,07
|

Рисунок 21 - Хроматограмма эфирного масла
корневищ и корней дудника обыкновенного

Рисунок 22 - Хроматограмма эфирного масла
корневищ и корней дудника лесного
.4 Исследование
фенольных соединений
Наиболее изученной группой биологически активных
соединений в корневищах и корнях дудника обыкновенного являются фенольные
соединения особенно кумарины (раздел 1.2), кроме того для некоторых из них
доказан выраженный фармакологический эффект (раздел 1.3). Однако данные
соединения до настоящего времени не выступали в качестве аналитической или
ведущей группы БАС. В связи с этим нами проведено изучение фенольных соединений
с целью разработки методик качественной и количественной оценки сырья.
5.4.1 Качественное
обнаружение фенольных соединений
Учитывая высокую разностороннюю биологическую
активность фенольных соединений, был проведен поиск этих веществ с помощью
качественных реакций и хроматографическими методами.
Таблица 24 - Качественные реакции на
флавоноидные соединения
|
Реактив
|
Класс
флавоноидов
|
Наблюдаемое
окрашивание
|
Результат
реакции
|
|
Металлический
магний в солянокислой среде
|
флавонолы,
флаваноны, флавоны
|
красное
|
+
|
|
Раствор
аммиака
|
флавонолы,
флаваноны, флавоны, флаванонолы
|
желтое,
при нагревании оранжево-красное
|
+
|
|
халконы,
ауроны
|
красное
(пурпурное)
|
-
|
|
Раствор
аммиака, натрия карбонат
|
антоцианы
|
синее
или фиолетовое
|
_
|
|
Кислота
серная
|
флавоны,
флавонолы
|
ярко-желтое
|
+
|
|
Свинца
ацетат основной
|
флавоны,
халконы, ауроны
|
ярко-желтое
|
+
|
|
Кислота
борная и лимонная
|
катехины,
лейкоантоцианидины, флавонолы,флаванонолы
|
зеленая
или желтая флюоресценция
|
_
|
|
Соли
диазония
|
флавоны
|
оранжевая
или красная
|
+
|
Примечание: «+» - результат положительный, «-» -
результат отрицательный
Для установления классов флавоноидов,
присутствующих в сырье использовали следующие доступные нам реактивы: кислоту
хлористоводородную разбавленную, магний металлический, раствор аммиака, натрия
карбонат, кислоту серную (разведенную), свинца ацетат основной, кислоту борную,
кислоту лимонную, соли диазония (свежеприготовленные). По результатам
качественных реакций можно предположить, что основные классы флавоноидов
представлены флавонолами и флавонами (табл. 24).
Рисунок 23 - Схема выделения фенольных
соединений
Изучение этилацетатной фракции продолжили
методом бумажной хроматографии (БХ) (раздел 2.4.1).
Для обнаружения флавоноидов на
хроматографическую бумагу наносили 30 мкл извлечения из дудника обыкновенного и
спиртовые растворы СО флавоноидов (рутина, гиперозида, кверцетина, лютеолина, лютеолин-7-гликозида
и апигенина). Время экспозиции хроматограмм 24 часа. Когда фронт растворителя
доходил до конца хроматографической бумаги, ее доставали из камеры и сушили в
вытяжном шкафу. После этого хроматограммы последовательно обрабатывали парами концентрированного
аммиака и спиртовым раствором щелочи, затем посматривали в УФ-свете до и после
проявления.
При хроматографическом изучении исследуемых
извлечений дудника обыкновенного, обнаружено шесть контрастных зон адсорбции
(табл. 25, 26 и 27). По результатам БХ в различных системах в этилацетатном
извлечении из подземной части дудника обыкновенного, было обнаружено шесть
контрастных зон адсорбции. Три из них по своим хроматографическим
характеристикам совпадали с зонами адсорбции СО апигенина, кверцетина и рутина.
Таблица 25 - Результаты хроматографического
разделения флавоноидов дудника обыкновенного в системе БУВ (4:1:5)
|
CO и исследуемое извлечение
|
Окраска
зон адсорбции
|
Значение
Rf
|
|
УФ-свет
|
Пары
аммиака, УФ-свет
|
10%
раствор алюминия хлорида спиртовой, УФ-свет
|
|
|
Апигенин
|
коричневая
|
желто-коричневая
|
желтая
|
0,76±0,03
|
|
Лютеолин
|
коричневая
|
желто-зеленая
|
желто-зеленая
|
0,70±0,02
|
|
Кверцетин
|
желто-корич.
|
желтая
|
зелено-желтая
|
0,74±0,03
|
|
Гиперозид
|
-
|
темно-желтая
|
желто-зеленая
|
0,55±0,03
|
|
Рутин
|
желтая
|
желто-бурая
|
коричневая
|
0,54±0,03
|
|
Извлечение
|
- коричневая
желто-корич. -
желтая
-
|
-
желто-коричневая желтая темно-желтая желто-бурая желтая
|
желто-зеленая
желтая зелено-желтая желто-зеленая коричневая желто-зеленая
|
0,82±0,03
0,81±0,02
0,84±0,03 0,70±0,02 0,64±0,03
0,32±0,02
|
Таблица 26 - Результаты хроматографического
разделения флавоноидов дудника обыкновенного в системе БУВ (4:1:2)
|
CO и исследуемое извлечение
|
Окраска
зон адсорбции
|
Значение
Rf
|
|
УФ-свет
|
Пары
аммиака, УФ-свет
|
10%
раствор алюминия хлорида спиртовой, УФ-свет
|
|
|
Апигенин
|
коричневая
|
желто-коричневая
|
желтая
|
0,77±0,02
|
|
Лютеолин
|
коричневая
|
желто-зеленая
|
желто-зеленая
|
0,72±0,03
|
|
Кверцетин
|
желто-корич.
|
желтая
|
зелено-желтая
|
0,75±0,02
|
|
Гиперозид
|
-
|
темно-желтая
|
желто-зеленая
|
0,70±0,02
|
|
Рутин
|
желтая
|
желто-бурая
|
коричневая
|
0,70±0,03
|
|
Извлечение
|
-
коричневая желто-корич. - желтая -
|
-
желто-коричневая желтая темно-желтая желто-бурая желтая
|
желто-зеленая
желтая зелено-желтая желто-зеленая коричневая желто-зеленая
|
0,82±0,02
0,87±0,02 0,75±0,03 0,68±0,02 0,60±0,03 0,35±0,04
|
Таблица 27 - Результаты хроматографического
разделения флавоноидов дудника обыкновенного в системе: кислота уксусная 15 %
|
CO и исследуемое извлечение
|
Окраска
зон адсорбции
|
Значение
Rf
|
|
УФ-свет
|
Пары
аммиака, УФ-свет
|
10%
раствор алюминия хлорида спиртовой, УФ-свет
|
|
|
Рутин
|
желтая
|
желто-бурая
|
коричневая
|
0,62±0,03
|
|
Гиперозид
|
-
|
темно-желтая
|
желто-зеленая
|
0,50±0,02
|
|
Кверцетин
|
желто-корич.
|
желтая
|
зелено-желтая
|
0,29±0,01
|
|
Лютеолин
|
коричневая
|
желто-зеленая
|
желто-зеленая
|
0,22±0,01
|
|
Апигенин
|
коричневая
|
желто-коричневая
|
желтая
|
0,20±0,01
|
|
Извлечение
|
желтая
- - желто-корич. коричневая -
|
желто-бурая
темно-желтая желтая желтая желто-коричневая -
|
коричневая
желто-зеленая желто-зеленая зелено-желтая желтая желто-зеленая
|
0,64±0,02
0,57±0,02
0,35±0,02
0,29±0,01
0,20±0,01
0,17±0,01
|
Кроме БХ для определения флавоноидов
использовали хроматографию в тонком слое сорбента (ТСХ). Полученное с помощью
70 % спирта этилового извлечение из сырья дудника обыкновенного - 30 мкл
наносили на пластинки и хроматографировали в системе этилацетат-кислота
муравьиная-вода (70:15:15). Система должна быть свежеприготовленной.
Хроматографическую камеру насыщали в течение 30 минут. Стандартными образцами
(СО) служили спиртовые растворы рутина, лютеолина, апигенина, кверцетина и гиперозида.
После прохождения растворителем расстояния 10-11 см, пластинки вынимали из
камеры, сушили и просматривали в УФ-свете при длине волны 365 нм. Результаты
определения представлены в таблице 28.
В результате ТСХ в извлечении из подземных
органов дудника обыкновенного корневища и корни, приготовленного с помощью 70 %
спирта этилового нами было обнаружено семь контрастных зон адсорбции, три из
которых сравнением с СО идентифицированы как флавоноиды (апигенин, кверцетин и
рутин).
Таблица 28 - Результаты тонкослойной
хроматографии спиртоводного извлечения дудника обыкновенного корневища и корни
|
CO и исследуемое извлечение
|
Флюоресценция
и окраска после проявителя
|
Значения
Rf
|
|
УФ-свет
|
пары
аммиака
|
|
|
Апигенин
|
темно-коричневая
|
желто-коричневая
|
0,77±0,03
|
|
Лютеолин
|
темно-коричневая
|
желто-коричневая
|
0,79±0,02
|
|
Кверцетин
|
желтая
|
темно-желтая
|
0,74±0,02
|
|
Рутин
|
темно-коричневая
|
желто-коричневая
|
0,65±0,02
|
|
Гиперозид
|
-
|
темно-желтая
|
0,68±0,03
|
|
Извлечение
|
темно-коричневая
темно-коричневая темно-коричневая желтая - темно-коричневая -
|
желто-коричневая
желто-коричневая желто-коричневая темно-желтая темно-желтая желто-бурая
бежевая
|
0,87±0,04
0,79±0,02
0,65±0,02
0,64±0,02 0,45±0,03 0,35±0,03 0,10±0,01
|
Определение фенолкарбоновых кислот проводили
методом БХ. Хроматограммы проявляли в УФ-свете и обрабатывали раствором аммиака
и 1 % водным раствором железа (III)
хлорида. Наилучшее разделение, а значит наибольшее количество зон абсорбции
(голубое свечение в УФ-свете) достигнуто в системах БУВ (4:1:2) и 2 % уксусной
кислоте, поэтому дальнейшее изучение гидроксикоричных кислот продолжили в этих
системах с использованием следующих стандартных образцов: спиртовые растворы
кофейной, коричной, галловой, n-кумаровой и феруловой кислот. Результаты
хроматографического разделения фенолкарбоновых кислот в спиртоводном извлечении
дудника обыкновенного представлены в таблице …….
По результатам БХ в извлечении из подземной
части дудника обыкновенного, было обнаружено шесть контрастных зон адсорбции,
три из которых сравнением со СО идентифицированы как кофейная, галловая и
феруловая кислоты.
Таблица 29- Результаты БХ этилацетатного
извлечения дудника обыкновенного в системе БУВ (4:1:2)
|
CO и исследуемое извлечение
|
Окраска
зон адсобции
|
Значение
Rf
|
|
УФ-свет
|
Пары
аммиака, УФ-свет
|
3
% р-р железа (III) хлорида
|
|
|
Коричная
к-та
|
-
|
желтая
|
оранжевая
|
0,77±0,03
|
|
Кофейная
к-та
|
светло-голубая
|
ярко-
голубая
|
сине-зеленая
|
0,82±0,01А;
0,28±0,01Б
|
|
Феруловая
к-та
|
голубая
|
ярко-голубая
|
оранжевая
|
0,83±0,03А;
0,33±0,02Б
|
|
Галловая
к-та
|
темно-серо-голубая
|
-
|
|
0,62±0,02А
|
|
n-кумаровая
к-та
|
светло-фиолетовая
|
фиолетовая
|
желто-оранжевая
|
0,40±0,01А;
0,50±0,01Б
|
|
Извлечение
|
светло-голубая
|
голубая
|
серо-зеленая
кофейная
|
0,82±0,01
|
|
голубая
|
ярко-голубая
|
оранжевая
феруловая
|
0,83±0,03А;
0,33±0,02Б
|
|
голубая
|
желто-зеленая
|
сине-зеленая
хлорогеновая
|
0,63±0,02А;
0,72±0,01Б
|
|
сине-фиолетовая
|
|
|
цикоривая
|
|
темно-серо-голубая
|
-
|
|
0,61±0,02А галловая
|
|
сиреневая
|
желтая
|
эллаговая
|
0,25±0,01А;
0,1±0,01Б
|
Примечание: А - БУВ (4:1:2); Б - 2 % р-р
уксусной кислоты
5.4.2 Изучение
фенольных соединений методом ВЭЖХ
С использованием метода ВЭЖХ провели
аналитический скрининг и определили относительное содержание отдельных
идентифицированных фенольных веществ в исследуемом объекте (раздел 2.4.2).
Результаты представлены в таблице …. и рисунке 24.
В результате было обнаружено 24 соединения, из
которых идентифицированы: хлорогеновая кислота, умбеллиферон, кислота, танин,
рутин, эпикатехин, дикумарин, цикориевая, галловая, феруловая и эллаговая
кислоты.
Таблица30 - Компонентный состав фенольных
соединений корневищ и корней дудника обыкновенного
|
№
|
Время,
мин
|
Высота,
mV
|
Площадь,
mV·сек
|
Содержание,
%
|
Название
|
|
1.
|
2,875
|
499,30
|
3025,17
|
3,50
|
метанол
|
|
2.
|
2,918
|
509,14
|
4308,90
|
4,99
|
умбеллиферон
|
|
3.
|
3,217
|
193,39
|
1233,05
|
1,43
|
неидентифицирован
|
|
4.
|
3,309
|
1118,43
|
7371,75
|
8,54
|
галловая
кислота
|
|
5.
|
4,079
|
32,71
|
737,26
|
0,85
|
танин
|
|
6.
|
4,526
|
34,02
|
1119,70
|
1,30
|
Хлорогеновая
кислота
|
|
7.
|
5,095
|
30,05
|
913,52
|
1,06
|
эпикатехин
|
|
8.
|
5,529
|
29,33
|
723,77
|
0,84
|
дикумарин
|
|
9.
|
6,005
|
29,31
|
613,26
|
0,71
|
цикориевая
кислота
|
|
10.
|
6,279
|
31,63
|
1126,73
|
1,31
|
неидентифицирован
|
|
11.
|
7,016
|
32,83
|
2142,74
|
2,48
|
феруловая
кислота
|
|
12.
|
8,748
|
35,39
|
1681,55
|
1,95
|
неидентифицирован
|
|
13.
|
9,146
|
37,72
|
1195,42
|
1,38
|
неидентифицирован
|
|
14.
|
11,06
|
78,30
|
7401,31
|
8,57
|
рутин
|
|
15.
|
11,94
|
39,88
|
2417,00
|
2,80
|
неидентифицирован
|
|
16.
|
16,97
|
3,14
|
188,77
|
0,22
|
эллаговая
кислота
|
|
17.
|
19,43
|
202,01
|
11527,44
|
13,35
|
неидентифицирован
|
|
18.
|
25,8
|
31,03
|
2301,62
|
2,67
|
неидентифицирован
|
|
19.
|
40,48
|
72,13
|
4562,73
|
5,29
|
неидентифицирован
|
|
20.
|
45,85
|
219,04
|
14547,77
|
16,85
|
неидентифицирован
|
|
21.
|
48,72
|
118,34
|
10466,09
|
12,12
|
неидентифицирован
|
|
22.
|
58,07
|
37,05
|
3170,17
|
3,67
|
неидентифицирован
|
|
23.
|
61,46
|
38,80
|
3104,01
|
3,60
|
|
24.
|
65,01
|
5,31
|
440,40
|
0,51
|
неидентифицирован
|
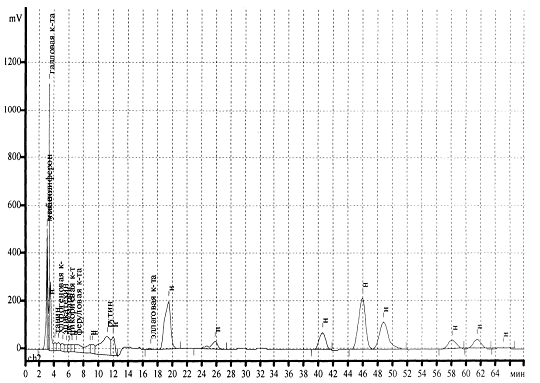
Рисунок 24 - Хроматограмма водно-спиртового
извлечения из корневищ и корней дудника обыкновенного
.4.3 Выделение
кумаринов
Для выделения кумаринов 1,0 кг измельченных до
размера частиц 1-1,5 мм корневищ и корней дудника обыкновенного экстрагировали
70 % спиртом этиловым методом фильтрационной экстракции. Полученное извлечение
(10 л) упаривали в вакууме до водного остатка (3 л), который оставляли на ночь
в холодильнике при температуре +40 С. Выпавший осадок хлорофилла и липофильных
веществ отфильтровывали на складчатом фильтре и промывали 200 мл воды.
Водный фильтрат (3,2 л) предварительно очищенный
гексаном, обрабатывали хлороформом (3 раза по 1 л). Полученное хлороформное
извлечение упаривали в вакууме, водный остаток оставляли для выделения
флавоноидов и фенолкарбоновых кислот (рис. 23). Хроматографически в
хлороформном экстракте обнаружены вещества 5.01, 5.02, 5.03, 5.04, 5.05, 5.06,
5.07, 5.08, 5.09, 5.10. С целью освобождения от веществ некумариновой природы
мы использовали лактонные свойства производных кумарина. Для этого остаток
хлороформного извлечения растворяли в 200 мл 3 %
раствора натрия гидроксида. Полученный раствор обрабатывали (4 раза по 100 мл)
хлороформом. Водную фракцию подкисляли 10 %
раствором кислоты серной до рН 3-4. При этом происходит замыкание о-кумариновых
кислот в кумарины, которые вновь извлекали хлороформом (4 раза по 150 мл).
Извлечения объединяли, промывали
дистиллированной водой до отрицательной реакции на лакмус, сушили безводным
сульфатом натрия и упаривали. Получили 44,25 г смолообразного остатка, который
растворяли в 50 мл этилового спирта, смешивали с 50 г силикагеля и высушивали
при температуре 30-350 С до удаления
запаха спирта. Порошок наносили на подготовленную колонку силикагеля (d=3
см, h=45 см, суспензия силикагеля в хлороформе). Колонку элюировали хлороформом
и смесью хлороформа со спиртом. Процесс разделения контролировали, просматривая
колонку в УФ-свете, а также хроматографированием отбираемых фракций (по 50 мл)
нисходящей хроматографией на бумаге, импрегнированной формамидом в хлороформе,
а также тонкослойной хроматографией на пластинках «Silufol»
в системе растворителей: бензол-этилацетат (2:1).
Фракции, содержащие индивидуальные вещества,
упаривали в вакууме и остатки кристаллизовали из этилового спирта или из
спирто-хлороформной смеси.
В результате получили вещества кумариновой
природы: 5.01 (3,50 г, т. пл. 101-1020 С), 5.02 (6,07 г, т. пл. 188-1900 С),
5.03 (2,12 г, т. пл. 161-1630 С), 5.04 (1,35 г, т. пл. 141-1430 С), 5.05 (9,59
г, т. пл. 84-850 С), 5.06 (7,26 г, т. пл. 138-1400 С), 5.07 (1,34 г, аморфное
вещество), 5.08 (2,03 г, аморфное вещество), 5.09 (4,05 г, 233-2340 С), 5.10
(1,12 г, т. пл. 67-680 С).
Физико-химическое изучение других фракций, ввиду
их малого выхода, нами не проводилось.
.4.4 Выделение
производных фенолкарбоновых кислот
Для выделения фенолкарбоновых кислот из
подземных органов дудника обыкновенного использовали этилацетатные фракции
(рис. 23).
Этилацетатную фракцию выдерживали при
температуре +40 С в течение 5 суток. При этом выпадал желто-зеленый осадок,
который отфильтровывали, перекристаллизовали из спирта этилового. В результате
выделили 5,02 г вещества (5.11, т.пл. …). Ацетоновый раствор вещества 5.11
давал положительную реакцию на свободную кислоту эллаговую (с натрия нитритом и
кислотой уксусной образуется красно-фиолетовая окраска, при стоянии переходящая
в красно-коричневую).
Этилацетатную фракцию после отделения осадка
концентрировали под вакуумом до образования смолы, которую растворяли в минимальном
количестве спирта метилового, быстро охлаждали и выливали в избыток диэтилового
эфира при перемешивании. При этом образовался осадок, который отфильтровывали,
растворяли в спирте этиловом, смешивали с 30 г полиамидного сорбента,
высушивали на воздухе при температуре 20-250 С. Для разделения осадка,
полученного при прибавлении диэтилового эфира, использовали хроматографию на
колонке с полиамидным сорбентом (d=3 см, h=45 см, размер частиц сорбента
0,2-0,3 мм, суспензия полиамида в этилацетате). Сухой порошок полиамидного
сорбента с суммой веществ смешивали с этилацетатом и наносили полученную
суспензию на подготовленную колонку. Элюирование проводили водой и
водно-спиртовыми смесями (5 %, 10 % спирт этиловый). Фракции отбирали по 50 мл
и анализировали их состав хроматографией на бумаге в системе растворителей: 2 %
раствор уксусной кислоты. Фракции, содержащие индивидуальное вещество
объединяли, упаривали в вакууме и кристаллизовали из разбавленного спирта
этилового. В результате выделили 5 веществ: 5.12 (0,63 г, 248-2500 С), 5.13
(0,95 г, 203-2060 С), 5.14 (0,19 г, 168-1700 С), 5.15 (0,5 г, 204-2060 С) и
5.16 (1,02 г, т. пл. 194-1960 С).
Физико-химическое изучение других фракций, ввиду
их малого выхода, нами не проводилось.
Вещество 5.12 образует синюю окраску
с 1 % раствором железа (III) хлорида, что характерно для
кислоты галловой и ее эфиров [11].
Вещества 5.11-5.16 по флуоресценции
пятен на хроматограммах в фильтрованном УФ-свете и качественными цветными
реакциями были отнесены к производным коричной кислоты [44].
Голубое окрашивание пятна вещества
5.13 на хроматограммах после обработки реактивом барбитуровой кислоты
свидетельствует о наличии в структуре этого соединения хинной кислоты [275].
Выделенные вещества 5.11 и 5.12 с диазореактивом
образуют серо-коричневую окраску, что позволяет отнести их к ароматическим
фенольным веществам.
5.4.5 Спектральная
характеристика выделенных фенольных соединений
Вещества 5.01 - 5.10 на основании качественных
реакций и ТСХ отнесены к производным кумарина, а интенсивная голубая
флуоресценция веществ на хроматограммах, усиливающаяся после проявления парами
аммиака или спиртовым раствором натрия гидроксида, позволила предположить
наличие в их структуре свободной гидроксильной группы у С-7.
Данные УФ- (максимумы поглощения в
области 210-270 нм и 290-360 нм) и ИК-спектроскопии (табл. …) подтверждают
предварительные данные об отнесении исследуемых соединений к производным
кумарина [70].
Изучение спектров поглощения молекул
в инфракрасной области имеет важное значение для идентификации и установления
строения природных кумаринов.
Таблица31 - Спектральная
характеристика выделенных кумаринов (производных бензо-α-пирона) в
УФ- и ИК-области
|
Номер
вещества
|
Название
вещества
|
УФ-спектр,
нм
|
ИК-спектр,
ν, см-1
|
|
5.01
|
императорин
|
219,
250, 265 перегиб, 301
|
3140,
3116, 3076, 3025 (С-Н), 1726 (CO-δ-лактона),
1628, 1590 (С=С)
|
|
5.02
|
бергаптен
|
222,
245, 250, 259, 268, 311
|
3144,
3111, 3087, 3011 (С-Н), 1734 (CO-δ-лактона),
1632, 1579 (С=С)
|
|
5.03
|
псорален
|
|
3161,
3122, 3064 (С-Н), 1732 (CO-δ-лактонного
цикла), 1640, 1625, 1584, 1546 (С=С)
|
|
5.04
|
оксипейцеданин
|
220,
249, 266, 306
|
3159,
3124, 3064 (С-Н), 1730 (CO-δ-лактона),
1620, 1580 (ароматическое кольцо), 1256 (эпокси-группа), 1074 (бензофуран)
|
|
5.05
|
остол
|
232,
258
|
3115,
3083, 3033 (С-Н), 1725 (CO-δ-лактонного
цикла), 1612, 1562 (ароматическое кольцо)
|
|
5.06
|
ангелицин
|
248,
300
|
|
|
5.07
|
неидентифиц.
|
-
|
-
|
|
5.08
|
неидентифиц.
|
-
|
-
|
|
5.09
|
умбеллиферон
|
216,
244, 254, 300, 324
|
3182
(О-Н), 1713, 1688 (CO-δ-лактона),
1622, 1613, 1575, 1512 (С=С ароматического цикла)
|
|
5.10
|
кумарин
|
275,
325
|
3115,
3058, 3001(С-Н), 1711 (CO-δ-лактонного
цикла), 1625, 1606, 1567 (С=С бензольного цикла)
|
Полосы валентных колебаний в области 1750-1700
см-1 относятся к карбонильным группам, точное значение зависит от положения заместителей
в бензольном кольце. Сильные полосы поглощения, наблюдаемые в ИК-спектрах
кумаринов в области 1620-1470 см-1 обусловлены колебаниями ароматических
двойных связей. В ИК-спектре псоралена имеется в области выше 3000 см-1 три
типа полосы: 3161, 3122 и 3064 см-1, соответствующих трем типам С-Н-связям:
фурановому, бензольному, a-пирановому замещенным циклам.
Тогда как в спектрах кумарина отсутствует первый
тип связи С-Н, что приводит к исчезновению высокочастотной полосы (3161 см-1).
Все фурокумарины, за исключением с не полностью
замещенным фурановым кольцом, в спектре поглощения дают полосу 3170-3130 см-1,
кумарины и фурокумарины - полосу 3130-3110 см-1. Все соединения, имеющие
С-Н-связи замещенного бензольного ядра, поглощают в области 3090-3045 см-1.
К валентным колебаниям С-Н-связей в фурановом
кольце некоторые авторы относят две полосы: 3175-3157 и 3137-3112 см-1. По
мнению других исследователей, полоса 3139-3110 см-1 свидетельствует о наличии
С-Н-связей a-пиронового кольца.
В области 3100-2850 см-1 обнаруживаются также
полосы валентных колебаний С-Н-связей.
В области 1750-1680 см-1 находится полоса
поглощения карбонильной группы δ-лактонов.
В растворе четыреххлористого углерода или хлороформа карбонильная полоса a-, β-
и δ-ненасыщенных
лактонов появляется в интервале 1725-1745 см-1.
По положению полосы С=О-группы можно отличать
кумарины от хромонов. Для хромонов эта полоса лежит ниже 1680 см-1.
В области 1639-1615 см-1 одну из полос относят к
валентным колебаниям С=С-связей фуранового цикла.
Ароматические полосы, связанные с колебаниями
С=С-связей находятся в области 1620-1580 и 1550-1450 см-1. Интенсивность полос
поглощения в области 1650-1550 см-1 позволяет отличать кумарины от насыщенных
фурокумаринов, а также ненасыщенные фурокумарины от фурокумаринов с насыщенным
фурановым циклом. Исследование, именно, этой области может позволить
представить характер замещения в фурокумаринах. Например, по интенсивности
полос поглощения при 1650-1550 см-1 можно отличать 5- и 8-замещенные
фурокумарины. В первом случае в ИК-спектре соединений содержатся две
интенсивные полосы в области 1630-1600 и 1585 см-1, причем первая полоса
расщеплена на два максимума. 8-замещенные фурокумарины в этой области имеют,
резко отличные по интенсивности, полосы при 1620 и 1585 см-1, при этом полоса
1620 см-1 значительно менее интенсивная. Это отчетливо видно в спектрах
5-замещенного фурокумарина - оксипейцеданина (рис. 25) и 8-замещенного
фурокумарина - императорина (рис. 26).
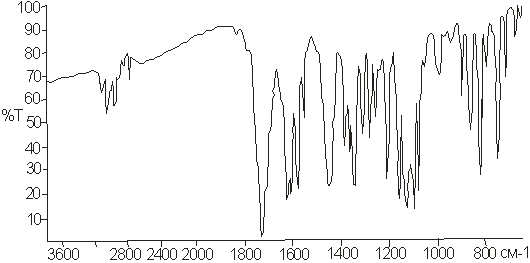
Рисунок 25 - ИК-спектр
оксипейцеданина
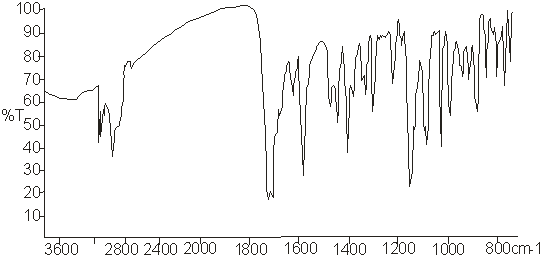
Рисунок 26 - ИК-спектр императорина
В отличие от ненасыщенных
фурокумаринов фурокумарины с насыщенным фурановым циклом дают при 1650-1500
см-1 две интенсивные полосы, но первая полоса из них не расщеплена на два
максимума, как в случае 5-замещенных фурокумаринов [70, 93, 116].
Таким образом, изучение области
ИК-спектра с привлечением УФ-спектров позволяет определить характер замещения в
кумариновых производных, отличить фурокумарины от кумаринов, а также
идентифицировать полностью замещенные фурокумарины.
Особый интерес вызывало изучение
структуры коричных кислот, т.к. по литературным данным в корнях дудника
обыкновенного ранее были обнаружены только кофейная, хорогеновая и
протокатеховая кислоты [108].
Максимум поглощения веществ 5.13 -
5.16 в области 330 нм и «плечо» в области 280-300 нм в УФ-спектре веществ
5.13-5.16 (табл. …) характерны для гидроксикоричных кислот, имеющих
кислородсодержащие функциональные группы при С3 и С4 [1].
Таким образом, сравнение физико-химических
свойств выделенных соединений, величин их Rf
в нескольких системах растворителей, а также идентичность УФ- и ИК-спектров
позволили охарактеризовать выделенные соединения.
Таблица 32- Спектральная характеристика
выделенных фенолкарбоновых кислот в УФ- и ИК-области
|
Номер
вещества
|
Название
вещества
|
УФ-спектр,
нм
|
ИК-спектр,
ν, см-1
|
|
5.11
|
эллаговая
кислота
|
256,
366
|
3350
(фенольные оксигруппы), 3390 (Ar -OH группы),
1700 (С=O),
1620-1450 (Ar).
|
|
5.12
|
галловая
кислота
|
216,
273
|
1712
(C=O и COOH),
3400-3300 (-OH),
1620-1455 (С=С), 1023(СH3-O)
|
|
5.13
|
хлорогеновая
кислота
|
245,
300 пл, 330
|
2970,
2900, 2780 (OH),
1740-1710 (сложноэфирная группировка), 1660, 1625 (>C=O),
1605-1550 (Ar), 840
(замещенный бензол)
|
|
5.14
|
феруловая
кислота
|
242,
290 пл, 324
|
|
|
5.15
|
цикориевая
кислота
|
280
пл, 330
|
|
|
5.16
|
кофейная
кислота
|
217,
234, 299 пл, 325
|
3400,
3235, 2975 (OH), 1647,
1630 (>C=O), 1607,
1540 (Ar), 880,
860 (замещенный бензол)
|
.5 Исследование
дубильных веществ
В связи с тем, что
перманганатометрическим методом в соответствии с ОФС ГФ ХI под
названием «дубильные вещества» определяется сумма всех полифенольных соединений
и сумма всех легко окисляемых соединений, переходящих в водное извлечение, нами
использовался спектрофотометрический метод, в котором для осаждения дубильных
веществ используется 1
%
раствор коллагена [40].
Около 2,0 г (точная навеска)
измельченного сырья, проходящего сквозь сито с диаметром отверстий 3 мм,
помещают в колбу вместимостью 500 мл, заливают 250 мл нагретой до кипения воды
и кипятят с обратным холодильником в течение 30 мин при периодическом
перемешивании. Охлаждают до комнатной температуры, фильтруют через вату,
отбрасывая первые 50 мл фильтрата. Аликвоту переносят в мерную колбу
вместимостью 50 мл, и доводят водой до метки (раствор А). Параллельно к 30 мл
водного извлечения добавляют раствор коллагена 1 %. Смесь взбалтывают 60 мин,
фильтруют через бумажный фильтр. Определенное количество, соответствующее
конкретному виду ЛРС переносят в мерную колбу вместимостью 50 мл, доводят водой
до метки (раствор Б). Измеряют оптическую плотность обоих растворов на
спектрофотометре при длине волны 277 нм в кювете с толщиной слоя 10 мм. В
качестве раствора сравнения используют воду.
Содержание дубильных веществ,
осаждаемых раствором коллагена 1 % в пересчете на галловую кислоту и абсолютно
сухое сырье в процентах (Х) определяют как разницу между содержанием дубильных
веществ в растворах А и Б.
УФ-спектры поглощения водных
извлечений корневищ и корней дудника обыкновенного представлены на рисунке …..
Результаты количественного
определения представлены в таблице ….
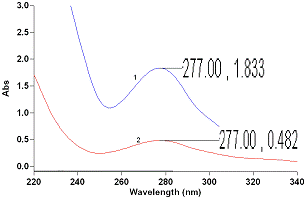
Рисунок…. - УФ-спектр раствора
извлечения из корневищ и корней дудника обыкновенного: 1 - водное извлечение, 2
- водное извлечение после адсорбции дубильных веществ 1 % раствором коллагена
5.6
Исследование витаминного состава
Определение ретинола и токоферола
проводили методом жидкостной хроматографии на жидкостном микроколоночном
хроматографе Милихроме-4-УФ, предназначенном для разделения сложных смесей
веществ методом высокоэффективной жидкостной хроматографии, идентификации и
количественного анализа компонентов разделяемой смеси.
Метод высокоэффективной жидкостной
хроматографии позволил обнаружить витамин Е и А, содержание которых в
корневищах и корнях дудника обыкновенного составили 75,77 и 203,47 мкг/г
соответственно.
5.7
Исследование аминокислотного состава
Для проведения анализа сырье
предварительно экстрагировали водой (1:20, 700 С, 30 мин, трижды), извлечения
фильтровали, объединяли, упаривали досуха. Сухой остаток исследовали на
содержание свободных и связанных аминокислот, образующихся после гидролиза (6
моль/л раствор хлористоводородной кислоты, 1:5, 1100 С, 72 часа) с последующим
удалением растворителя, растворением сухого остатка массой около 0,2 г (точная
навеска) в ацетатном буферном растворе (рН 5,5) и доведением объема раствора до
10 мл.
Для анализа аминокислот использовали
метод ВЭЖХ с применением аминокислотного анализатора марки «ААА-339» (Чехия) на
колонке Waters AccQ Tag размером
3,9 · 150 мм в сравнении со стандартными образцами аминокислот
(соответствующими ТУ 6-09-3147-83) в концентрации 2,5 моль/л. Детектирование
зон адсорбции аминокислот проводили с помощью 1% раствора нингидрина,
приготовленного на основе ацетатного буферного раствора (рН 5,5). Идентификацию
и содержание аминокислот определяли по времени удерживания и площади пиков на
хроматограмме [256].
Статистически достоверные средние
результаты определения аминокислот (n=7, р=0,95)
методом ВЭЖХ представлены в таблице ….. Полученные данные свидетельствуют о
наличии 15 аминокислот с суммарным количественным содержанием 6,62 %.
Представленные аминокислоты могут быть как свободными, так и образованными
после гидролиза пептидов, белков. Из обнаруженных аминокислот 9 являются
незаменимыми (треонин, валин, изолейцин, аргинин, метионин, лейцин, лизин,
фенилаланин, гистидин) с суммарным содержанием 51,2 % аминокислот. Их наличие
свидетельствует о высокой биологической ценности анализируемого сырья. Из
количественно доминирующих аминокислот следует отметить накопление глутаминовой
кислоты, аргинина, лейцина, аланина, аспарагиновой кислоты, глицина.
Биологическая значимость глутаминовой кислоты, глицина определяется их
способностью нормализовать нарушенные функции мозгового кровообращения, аланина
- как компонента пантотеновой кислоты (витамина), аспарагиновой кислоты -
участием в обмене веществ [33].
Таблица 33 - Аминокислотный состав
корневищ и корней дудника обыкновенного
|
Аминокислоты
|
Содержание,
%
|
|
Глутаминовая
кислота
|
0,92±0,045
|
|
Аргинин
|
0,82±0,041
|
|
Лейцин
|
0,60±0,030
|
|
Аланин
|
0,57±0,028
|
|
Аспарагиновая
кислота
|
0,54±0,026
|
|
Глицин
|
0,51±0,025
|
|
Лизин
|
0,41±0,020
|
|
Треонин
|
0,40±0,020
|
|
Фенилаланин
|
0,38±0,018
|
|
Серин
|
0,36±0,018
|
|
Тирозин
|
0,33±0,016
|
|
Валин
|
0,27±0,013
|
|
Гистидин
|
0,26±0,013
|
|
Изолейцин
|
0,17±0,008
|
|
Метионин
|
0,08±0,004
|
|
Сумма
аминокислот
|
6,62±0,331
|
5.8 Исследование
элементного состава
В настоящее время при поиске
эффективных растительных средств исходят из того, что в патогенезе развития и
формирования осложнений большую роль играют нарушения минерального обмена, а
недостаточность сведений о содержании макро- и микроэлементов в лекарственном
растительном сырье служит серьезным препятствием на пути его рационального
использования. Изучение элементного состава актуально и по другой причине это -
проблема загрязнения окружающей среды [5].
Сведения о минеральном составе
лекарственных растений позволят использовать их более полно и комплексно для
лечения и профилактики ряда патологий, связанных с нарушением минерального
баланса. В связи с этим представляло интерес определить минеральный состав
изучаемых видов лекарственного растительного сырья.
Содержание микроэлементов в растении
в первую очередь зависит от почвенно-экологических условий и химических свойств
микроэлементов.
Из 92 встречающихся в природе
элементов 81 обнаружен в организме человека, при этом 15 из них (Ca, P, K, Cl, Na, Zn, Mn, Mo, I, Se, S, Mg, Fe, Cu, Co) признаны
эссенциальными, т.е. жизненно необходимыми (биогенными), а 10 (F, Si, Ti, V, Cr, Ni, As, Br, Sr, Cd) относят к
вероятно (условно) необходимым (условно эссенциальными элементами) [117, 118].
Существенную роль в течение многих
заболеваний играет нарушение микроэлементного равновесия в организме человека.
Для восполнения недостатка микроэлементов широко применяются минеральные соли,
однако их усвоение не превышает 3-10 %. Ценным источником минеральных элементов
могут стать лекарственные растения и препараты растительного происхождения
[105]. Установлено, что растения служат одними из лучших накопителей макро- и микроэлементов
(в настоящее время в растительных организмах обнаружено более 70 химических
элементов), которые оказывают несомненный терапевтический эффект при лечении
заболеваний человека и животных. Это связано в первую очередь с тем, что
минеральные вещества находятся в них в наиболее доступной и усвояемой форме, в
оптимальных для организма соединениях и в наборе, свойственном живой природе в
целом [86].
Переход макро- и микроэлементов в
лекарственные формы общеизвестен. В наибольших количествах извлекаются в настои
и отвары марганец и цинк, в наименьших - железо. Среднее содержание тяжелых
метало в водных извлечениях уменьшается для микроэлементов в следующем ряду:
кадмий > цинк > свинец > медь > железо [87].
Учитывая, что изучаемый вид может
использоваться для получения экстемпоральных лекарственных форм, определение
микроэлементов в сырье имеет и практическое значение.
Качественное и количественное
содержание макро - микроэлементов в сырье (золе) проводилось в центральной
испытательной лаборатории при ФГУП «Кавказгеолсъемка» по методике предприятия
МП - 4С - полуколичественным спектральным методом анализа минерального сырья из
кратера угольного электрода (50 элементов) (раздел 2.5).
В результате исследований было
выявлено 20 макроэлементов, 8 микроэлементов, относящихся к группе жизненно
необходимых для человека медь (0,01 %), цинк (0,02 %), серебро (0,00001 %),
галлий (0,001 %), барий (0,03 %), стронций (0,06 %), фосфор (5,0 %), марганец
(0,1 %), никель (0,001 %), титан (0,05 %), ванадий (0,0006 %), хром (0,001 %),
железо (0,3 %), бор (0,03 %), кальций (10,0 %), магний (3,0 %), алюминий (3,0
%), кремний (10,0 %), калий (30,0 %), натрий (1,5 %).Остальные элементы
содержатся в количествах меньше порога обнаружения. Выявлена следующая
закономерность уменьшения эссенциальных и условно эссенциальных элементов:
K>Si>Ca>P>Mg=Al>Na>Fe>Mn>Sr>Ba>Zn>Pb=Cu>Mo>Ca=Ni=Cr>Be>V>Y=Sc>Co.
Примечателен тот факт, что в растении не
накапливаются токсические элементы (висмут, мышьяк, сурьма, кадмий, таллий,
лантаноиды и актиноиды).
Установлено, что корневища с корнями
дудника обыкновенного содержат жизненно необходимые для человека элементы, к
таким относится железо, участвующее в окислительных процессах, поддержании
иммунитета, цинк, роль которого в обмене веществ весьма значительна (при его
дисбалансе возникает карликовость, бесплодие, половой инфантилизм, различные
формы анемии, дерматиты и т.д.). Медь является важнейшим компонентом ферментов,
витаминов, участвует в системе антиоксидантной защиты и в процессах обмена
веществ. Марганец обеспечивает стабильность клеточных мембран нервных клеток и
нервной системы в целом, необходим для нормального функционирования половых
желёз и опорно-двигательного аппарата [117].
ВЫВОДЫ ПО ГЛАВЕ 5
1. Исследован качественный состав дудника
обыкновенного, выявлено наличие углеводных производных, сапонинов, дубильных
веществ, органических кислот, флавоноидов, кумаринов, фенолкарбоновых кислот,
аскорбиновой кислоты, антрагликозидов и аминокислот.
. Установлено количественное содержание
полисахаридов (17,11-20,57 %), конденсированных дубильных веществ (…………...),
органических кислот (…………), аскорбиновой кислоты (….............), ретинола
(75,77 мкг/г), токоферола (203,47 мкг/г) и аминокислот (6,62 %).
3. Выделены различные углеводные фракции: растворимые
в спирте этиловом (0,42 %), холодной воде (1,70 %), горячей воде (1,78 %),
растворе аммония оксалата (6,42 %) и растворах щелочей (10,25 %). Методом ГЖХ
впервые установлен и качественный и количественный моносахаридный состав. В
подземных органах дудника обыкновенного преобладает гемицеллюлоза,
преимущественно состоящая из глюкозы, в водорастворимых фракциях преобладающими
являются глюкоза, арабиноза, галактоза, а ВРПС-Г - и манноза. По
характеристическим полосам поглощения в ИК-спектрах анализируемых углеводных
фракций установлено наличие остатков галактуроновых кислот. Определены
физико-химические свойства пектинов: рН водных растворов, содержание свободных
и этерифицированных карбоксильных групп, полигалактуроновой кислоты (6,29 %).
4. Методом газовой
хромато-масс-спектрометрии в эфирном масле корневищ и корней дудника
обыкновенного идентифицировали 21 соединение, что составляет 95,81 % от всех
обнаруженных. Доминирующими компонентами являются бициклические монотерпеновые
углеводороды: α-пинен, β-пинен
(45,34 %), а также кумарин - остхол (9,11 %).
5. Методами БХ, ТСХ и ВЭЖХ в исследуемом сырье
идентифицированы фенольные соединения: фенолкарбоновые кислоты, флавоноиды и
кумарины.
6. В индивидуальном виде выделены и
установлена структура…. соединений, среди которых 6 производных фенолкарбоновых
кислот: эллаговая, галловая, кофейная, хлорогеновая, феруловая и цикориевая;
7. Изучен качественный и количественный
состав свободных и связанных аминокислот, представленных 15 соединениями, 9 из
которых являются незаменимыми (треонин, валин, изолейцин, аргинин, метионин,
лейцин, лизин, фенилаланин, гистидин) с суммарным содержанием 51,2 %
аминокислот.
8. Изучен макро- и микроэлементный состав,
в результате было выявлено 20 макроэлементов, из которых 8 являются эссенциальными.
В растении не накапливаются токсические элементы (висмут, мышьяк, сурьма,
кадмий, таллий, лантаноиды и актиноиды).
ГЛАВА 6. РАЗРАБОТКА МЕТОДОВ СТАНДАРТИЗАЦИИ СЫРЬЯ
ДУДНИКА ОБЫКНОВЕННОГО
Разработка современной НД,
обеспечивающей высокое качество лекарственного растительного сырья, с
привлечением наиболее современных и перспективных физико-химических методов в
настоящее время является актуальной задачей [145].
Согласно требованиям, предъявляемым
к современным методам стандартизации ЛРС необходимо разработать показатели норм
качества в зависимости от пути его использования при производстве лекарственных
средств [112].
Исходя из первичного аналитического
скрининга, в изучаемом сырье фенольные соединения являются доминирующими и на
их долю приходится основной вклад ожидаемого фармакологического эффекта,
поэтому и разрабатывали методики их качественного и количественного
определения.
6.1 Разработка
оптимальной методики экстракции сырья
Главная проблема при разработке методики
количественного определения для лекарственного растительного сырья состоит в
изучении основных гидродинамических факторов экстракционного процесса.
Процесс экстракции зависит от измельченности
сырья, времени экстракции, температурного режима, типа экстрагента, соотношения
сырье - экстрагент.
Измельченность сырья оказывает большое влияние
на процесс экстрагирования. Оптимальные значения степени измельченности,
найденные различными авторами в среднем совпадают и равны 0,5-2 мм.
Проведенные нами исследования по изучению
влияния степени измельченности на экстракцию БАС из сырья приведены в таблице
…...
В каждом из полученных экстрактов
определяли выход экстрактивных веществ в соответствии с методикой ОФС ГФ ХI [31, 88].
Таблица 34 - Выбор оптимальной
степени измельченности сырья для экстракции БАС
|
Степень
измельченности сырья, мм
|
Содержание
экстрактивных веществ, экстрагент, %
|
|
вода
|
40
% спирт этиловый
|
70
% спирт этиловый
|
|
0,5
|
14,32
|
24,36
|
20,45
|
|
1,0
|
15,42
|
24,38
|
22,46
|
|
2,0
|
14,41
|
24,25
|
22,32
|
|
3,0
|
8,95
|
20,06
|
16,21
|
Примечание: указано средне значение из 6
определений
Изданных таблицы видно, что максимальное
извлечение экстрактивных веществ из корневищ и корней дудника обыкновенного
достигается уже при степени измельчения 2 мм. Дальнейшее измельчение не
приводит к существенному увеличению результатов.
Тип растворителя, применяемого для экстракции
действующих веществ, играет решающую роль. Для экстрагирования суммы фенольных
соединений из растительного сырья в литературе описано применение спиртов и
спирто-водных растворов. Нами проведено изучение оптимальной концентрации
этилового спирта для извлечения суммы фенольных соединений. Как следует из
полученных данных (табл. …), максимальное извлечение экстрактивных веществ
достигается 40 и 70 % спиртом этиловым. Однако по данным БХ данные извлечения
отличаются по составу. Экстракт, приготовленный с помощью спирта этилового 40
%, представлен в основном фенилкарбоновыми кислотами, а 70 % флавоноидами и
кумаринами.
Для извлечения флавоноидов в литературе описана
экстракция в аппарате Сокслета, многократная экстракция кипящим 50-9:5 спиртом.
Для извлечения суммы флавоноидов нами использована экстракция с нагреванием на
кипящей водяной бане до наступления равновесия [….]. Проведенные исследования
динамики экстракции флавоноидов из измельченного материала кипящим спиртом при
соотношении сырье-растворитель 1:100 показали максимальный выход флавоноидов
через 30 минут - для травы мальвы низкой, через 45 минут - для травы донника
рослого и через 1,5 часа - для листьев земляники с последующим наступлением
равновесия.
Таблица 35 Выбор времени экстрагирования суммы
флавоноидов из лекарственного сырья
|
Время
экстракции, мин
|
Содержание
суммы флавоноидов, %
|
|
Листья
земляники
|
Трава
донника рослого
|
Трава
мальвы низкой
|
|
15
мин
|
2,05
|
3,00
|
1,18
|
|
30
мин
|
2,77
|
3,17
|
1,21
|
|
45
мин
|
2,79
|
3,38
|
1,21
|
|
60
мин
|
3,04
|
3,35
|
1,21
|
|
1
ч 15 мин
|
3,22
|
3,35
|
-
|
|
1
ч 30 мин
|
3,76
|
-
|
-
|
|
1
ч 45 мин
|
3,76
|
-
|
-
|
Для этого нами проведены исследования по
разработке методик качественного и количественного определения основных групп
БАС.
Для качественного обнаружения БАС использовали
метод хроматографии в тонком слое сорбента, который имеет ряд преимуществ, как
селективность, высокая чувствительность, быстрота проведения анализа,
устойчивость хроматограмм к действию агрессивных проявителей и нагреванию,
удобство препаративного разделения и др.

Установлено, что оптимальными условиями
экстрагирования являются: трехкратная экстракция 70% водным этанолом в
соотношении 1:25, измельченность сырья от 0,5 до 3 мм (рис. 4).
Создание лекарственной формы лабазника
вязолистного
На первом этапе технологии лекарственной формы
растения предложен жидкий экстракт лабазника, полученный методом реперколяции с
делением сырья на равные части, с использованием 5 перколяторов по 3 законченных
цикла, экстрагент 70% этанол. Проводили 4 опыта, варьируя время экстракции (10,
14, 18 и 24 ч). В каждом из полученных экстрактов определяли выход
экстрактивных веществ в соответствии с методикой ГФ ХI
изд., вып.2. Выявили, что оптимальное время контакта фаз составляет 14 часов
(рис.6).

СПИСОК ЛИТЕРАТУРЫ
1. Авдеева,
Е.В. Лекарственные растения, содержащие фенилпропаноиды, как источник получения
гепатопротекторных и иммуномодулирующих препаратов: дис. … д-ра фармац. наук:
15.00.02 / Авдеева Е.В. - Пятигорск, 2007. - 288 с.
. Авраменко,
Л.Г. Изучение кумаринов дудников скального и низбегающего и взаимосвязи между
строением и спазмолитической активностью: автореф. дис. … канд. фармац. наук:
792 / Л.Г. Авраменко. - Моква, 1971. - 28 с.
. Анаболитическая,
антиоксидантная, гепатозащитная, противовоспалительная активности некоторых
природных кумаринов и хромонов / Комиссаренко Н.Ф. [и др.] // Растительные
ресурсы. - 1993. - Вып. 3. - С. 15-21.
. Анненков,
Н.И. Ботанический словарь / Н.И. Анненков. - Спб.: типография Императорской
Академии наук, 1878. - 646 с.
. Антропогенные
воздействия на лекарственные растения / С.А. Листов [и др.] - М.: МЗ СССР,
1990. - 106 с.
. Атлас
ареалов и ресурсов лекарственных растений СССР. - М.: ГУГК, 1980. - 340 с.
. Атлас
лекарственных растений СССР. - М.: Медгиз, 1962. - С. 178-179.
. Бандюкова,
В.А. Качественный анализ флавоноидов в растительном материале при помощи
хроматографии на бумаге / В.А. Бандюкова, А.А. Шинкаренко. - Пятигорск, 1972. -
24 с.
. Бандюкова,
В.А. Методы исследования природных флавоноидов / В.А. Бандюкова. - Пятигорск:
Бальнеологический ин-т, 1977. - 72 с.
. Бандюкова,
В.А. Тонкослойная хроматография флавоноидов: методические рекомендации / В.А.
Бандюкова, А.А. Шинкаренко. - Пятигорск, 1973. - 16 с.
. Бандюкова,
В.А. Фенолокислоты растений, их эфиры и гликозиды / В.А. Бандюкова // Химия
природ. соединений. - 1983. - № 3. - С.263-272.
. Башкирова,
Р.М. Растения рода дягиль: химический состав и фармакологические свойства /
Р.М. Башкирова, А.Ю. Касьянова, И.В. Галяутдинов // Фармация. - 2004. - № 4. -
С. 46-48.
. Беляева,
В.А. Пряно-вкусовые растения / В.А. Беляева. - М.: Госторгиздат, 1946. - 108 с.
. Березовская,
И.В. Классификация химических веществ по параметрам острой токсичности при
парентеральных способах введения / И.В. Березовская // Хим.-фармац. журн. -
2003. - Т. 37, № 3. - С. 32-34.
. Беркутенко,
А.Н. Лекарственные и пищевые растения Аляски и Дальнего Востока России / А.Н.
Беркутенко. - Владивосток: Изд-во Дальневосточного ун-та, 1995. - 192 с.
. Ботаника.
Энциклопедия «Все растения мира»: пер. с англ. / под ред. Д. Григорьева. - М.:
Könemann,
2006 (русское издание). - С. 94-95.
. Брежнев,
Д.Д. Дикие сородичи культурных растений флоры СССР / Д.Д. Брежнев, О.Н. Корвина.
- Л.: Колос, 1981. - 376 с.
. Бузина,
Г.В. Титрометрический метод количественной и качественной характеристики
пектиновых веществ / Г.В. Бузина, О.Ф. Иванова, Л.Б. Сосновский //
Хлебопекарная и кондитерская пром-сть. - 1965. - № 4. - С. 15-18.
. Вайс,
Р.Д. Фитотерапия. Руководство: пер. с нем. / Р.Д. Вайс, Ф.М. Финтельман. - М.:
Медицина, 2004. - 552 с.
. Вермейлен,
Н. Полезные травы. Иллюстрированная энциклопедия: пер. с англ. Б.Н. Головкина /
Н. Вермейлен. - М.: Лабиринт Пресс, 2002. - С. 44.
. Войткевич,
С.А. Эфирные масла для парфюмерии и аромотерапии. - М.: Пищевая пром-ть, 1999.
- 284 с.
. Вульф,
Е.В. Мировые ресурсы полезных растений (Пищевые, кормовые, технические,
лекарственные и др.): справочник / Е.В. Вульф, О.Ф. Малеева. - Л.: Наука, 1969.
- 569 c.
. Гавель,
И.В. Региональные проблемы экологической оценки лекарственного растительного
сырья и фитопрепаратов на примере Алтайского края: дис. … докт. фармац. наук:
15.00.02 / Гравель И. В. - Москва, 2005. - 395 с.
. Гаммерман,
А.Ф. Лекарственные растения (растения-целители): справочное пособие / А.Ф.
Гаммерман, Г.Н. Кадаев, А.А. Яценко-Хмелевский. - М.: Высш. шк., 1983. - 400 с.
. Георгиевский,
В.П. Биологически активные вещества лекарственных растений / В.П. Георгиевский,
Н.Ф. Комисаренко, С.Е. Дмитрук. - Новосибирск: Наука, 1990. - 333 с.
. Горяев,
М.И. Методы исследования эфирных масел / М.И. Горяев, И. Плива. - Алма-Ата: АН
КазССР, 1962. - 752 с.
. ГОСТ
21569-76Е. Корневища и корни дягиля лекарственного. - Введ. 01.04.1977. - М.:
Изд-во стандартов, 1976. - 3 с.
. ГОСТ
30178-96. Сырье и продукты пищевые. Атомно-абсорбционный метод определения
токсичных элементов. - Введ. 1998-01-01. - М.: Стандартинформ, 2010. - 10 с.
. Государственная
фармакопея Российской Федерации. - 12-е изд. - М.: Науч. центр экспертизы
средств мед. применения, 2007. - Ч. 1. - 704 с.
. Государственная
фармакопея Российской Федерации. - 12-е изд. - М.: Науч. центр экспертизы
средств мед. применения, 2010. - Ч. 2. - 678 с.
. Государственная
фармакопея СССР: в 2 вып. - 11-е изд. - М.: Медицина, 1987-1989. - 2 вып.
. Григорян,
Э.Р. Антибактериальное действие дудника обыкновенного / Э.Р. Григорян, М.В.
Мазурина // Научная жизнь. - 2010. - №2. - С. 3-4.
. Григорян,
Э.Р. Биоэлементный и аминокислотный состав дудника обыкновенного корневищ с
корнями / Э.Р. Григорян, Т.В. Орловская // Разработка, исследование и маркетинг
новой фармацевтической продукции: сб. науч. тр. - Пятигорск, 2011. - Вып. 66. -
С. 44-45.
. Григорян,
Э.Р. Изучение влияния экстракта дудника обыкновенного на тонус гладкой
мускулатуры кишечника / Э. Р. Григорян, Т.В. Орловская // Научные ведомости
БелГу. Серия Медицина, Фармация. - 2012. - № 10 (129), вып. 18. - С. 160-162.
. Григорян,
Э.Р. Морфолого-анатомическое изучение корневищ и корней дудника обыкновенного /
Э.Р. Григорян, Т.В. Орловская // Разработка, исследование и маркетинг новой
фармацевтической продукции: сб. науч. тр. - Пятигорск, 2012. - Вып. 67. - С.
24-28.
. Григорян,
Э.Р. Исследование фенольных соединений дудника обыкновенного (Angelica
archangeliсa
L.) , выращенного в
условиях Северного Кавказа / Э. Р. Григорян, Т.В. Орловская // Научные
ведомости БелГу. Серия Медицина, Фармация. - 2012. - №, вып. 18. - С. 160-162.
.
. Григорян,
Э.Р. Некоторые результаты фитохимического исследования дудника обыкновенного /
Э.Р. Григорян, Т.В. Орловская // Разработка, исследование и маркетинг новой
фармацевтической продукции: сб. науч. тр. - Пятигорск, 2010. - Вып. 65. - С.
27-28.
. Григорян,
Э.Р. Химический анализ подземных органов Angelica
archangelica / Э.Р. Григорян,
Т.В. Орловская // Изв. высш. уч. зав. Сев.-Кавк. регион. - 2012. - № 2. - С.
67-71.
40. Гринько,
Е.Н. Исследования по стандартизации лекарственного растительного сырья,
содержащего дубильные вещества: автореф. дис. … канд. фармац. наук: 14.04.02 /
Е.Н. Гринько. - М., 2011. - 23 с.
41. Дикорастущие
полезные растения России / отв. ред. А.Л. Буданцев, Е.Е. Лесиовская. - СПб.:
СПХФА, 2001. - С. 18-20.
. Долгова,
А.А. Руководство к практическим занятиям по фармакогнозии А.А. Долгова, Е.Я.
Ладынина. - М.: Медицина, 1977. - 288 с.
. Дополнения
и изменения № 5 к санитарно-эпидемическим правилам СанПин 2.3.3 1078-01
«Гигиенические требования безопасности и пищевой ценности пищевых продуктов»
СанПин 2.3.2.2227-07. - М., 2007. - 261 с.
. Драник,
Л.И. Выделение и химическое изучение полифенольных соединений артишока:
автореф. дис. … канд. фармац. наук: 15.00.02 / Л.И. Драник.Л., 1967. - 16 с.
. Дроздова,
И.Л.
. Жбанков,
Р.Г. Инфракрасные спектры и структура углеводов / Р.Г. Жбанков. - Минск: Наука
и техника, 1972. - 456 с.
. Зависимость
колориметрической реакции галактуроновой кислоты и нейтральных моносахаридов с
карбазолом от условий ее проведения / М.П. Филиппов [и др.] // Изв. АН МССР:
Сер. биол. и хим. наук. - 1976. - № 1. - С. 75-86.
. Завражнов,
В.И. Лекарственные растения Центрального Черноземья / В.И. Завражнов, Р.И.
Китаева, К.Ф. Хмелев. - Воронеж, 1977. - 447 с.
. Зайцев,
Г.Н. Математическая статистика в экспериментальной ботанике / Г.Н. Зайцев. -
М.: Наука, 1984. - 424 с.
. Запрометов,
М.Н. Фенольные соединения и их роль в жизни растения / М.Н. Запрометов // 56-е
Тимирязевское чтение: сб. науч. тр. - М., 1996. - С. 1-45.
. Запрометов,
М.Н. Фенольные соединения: распространение, метаболизм и функции в растениях /
М.Н. Запрометов. - М.: Наука, 1994. - 240 с.
. Захаров,
В.П. Лекарственные вещества из растений и способы их производства / В.П.
Захаров, Н.И. Либизов, Х.А. Асланов. - Ташкент: Фан, 1980. - 232 с.
. Зотиков,
Ю.М. К химическому исследованию дягиля аптечного - Archangelica officinalis
(Moench) Hoffm., культивируемого в Ленинградской области / Ю.М. Зотиков, П.Е.
Розенцвейг // Вопросы фармакогнозии. - Л., 1967. - Вып. 4. - С. 126-133.
. Зотиков,
Ю.М. Противовоспалительное действие сухого экстракта из корня дягиля аптечного
/ Ю.М. Зотиков, А.Д. Качанов // Раст. ресурсы. - 1978. - Т.14, вып. 4. - С.
579-581.
. Измеров,
Н.Ф. Параметры токсикометрии промышленных ядов при однократном воздействии /
Н.Ф. Измеров, И.В. Саноцкий, К.К. Сидоров. - М.: Медицина, 1977. - 197 с.
. Изучение
биологически активных соединений лекарственных растений флоры Северного Кавказа
/ Челомбитько В.А. [и др.]. // Вопросы биол., мед. и фармац. химии. - 2012. - №
4. - С. 39-43.
. Изучение
и применение лечебно-профилактических препаратов на основе природных
биологически активных веществ / под ред. В.Г. Беспалова, В.В. Некрасовой. -
СПб.: Эскулап, 2000. - 468 с.
. Иллюстрированный
определитель растений Ленинградской области / под ред. А. Л. Буданцева, Г.П.
Яковлева. - М.: Товарищество научных изданий КМК, 2006. - 799 с.
. Кант,
К. Фитотерапия / К. Кант. - М.: Издание А. Выжелевской, 1913. -165 с.
. Касьянова,
А.Ю. Влияние внесения сульфата кобальта на биомассу растений и накопление
кумаринов в корнях Angelica archangelica L. / А.Ю. Касьянова, P.M. Баширова,
Н.В. Кудашкина // Химия растит. сырья. -2004. - № 1. - С.41-45.
. Касьянова,
А.Ю. Дягиль лекарственный (Archangelica
officinalis
Hoffm.) в Предуралье:
перспективы интродукции, пути повышения биологической продуктивности и изучение
биохимического состава: дис. … канд. биол. наук: 06.01.13 / А.Ю. Касьянова. -
М., 2005. - 139 с.
. Касьянова,
А.Ю. Методические рекомендации по постановке интродукционных экспериментов с
Angelica archangelica в Республике Башкортостан / А.Ю. Касьянова, A.M.
Мингажева. - Уфа: Изд-во Башкирск. ун-тета. - 2002. - 20 с.
. Касьянова,
А.Ю. Сообщества с доминированием Angelica archangelica L. / А.Ю. Касьянова,
С.М. Ямалов // Итоги биол. исследований: сб. науч. тр. - Уфа: РИО БашГУ, 2003.
- Вып. 7. - С. 245-246.
. Клепцова,
И.А. Эколого-гигиеническая оценка техногенного загрязнения лекарственного
растительного сырья (на примере Томского района): дис. … канд. мед. наук:
14.00.07 / Клепцова И.А. - Томск, 2001. - 118 с.
. Королев,
В.А. Фармакогностическое изучение представителей рода Донник: автореф. дис. …
канд. фармац. наук : 15.00.02 / В.А. Королев. - Пермь, 1996. - 26 с.
. Косман,
В.М. Информационное обеспечение для идентификации фенольных соединений в
обращено-фазовой ВЭЖХ. Флавоны, флавонолы и их гликозиды / В.М. Косман, И.Г.
Зинкевич // Раст. ресурсы. - 1997. - Т. 33, вып. 2. - С. 14-26.
. Косман,
В.М. Информационное обеспечение для идентификации фенольных соединений
растительного происхождения. Кумарины и фурокумарины / В.М. Косман, И.Г.
Зинкевич, Н.Ф. Комиссаренко // Раст. ресурсы. - 1997. - Т. 33, вып. 3. - С.
32-36.
. Косьянов,
Г. И. Исследование СО2-экстрактов из корней и корневищ Potentilla erecta и
Archangelica officinalis / Г.И. Косьянов, Э.А. Шафтан, Е.С. Климова // Химия
природ. соединений. - 1977. - № 1.- С. 108-109.
. Кочетков,
Н.К. Химия биологически активных природных соединений / Н.И. Кочетков. - М.:
Химия, 1970. - 378 с.
. Кузнецова,
Г.А. Природные кумарины и фурокумарины / Г.А. Кузнецова. - Л.: Наука, 1967. -
248 с.
. Куркин,
В.А. Фенилпропаноиды лекарственных растений. Распространение, классификация,
структурный анализ, биологическая активность / В.А. Куркин // Химия природ.
соединений. - 2003. - № 2. - С. 87-110.
. Кучеров,
Е.В. Распространение и запасы Angelica archangelica L. в Башкирской АССР / Е.В.
Кучеров, Н.В. Маслова // Растит. ресурсы. - 1985. - Т. 2, вып. 2. - С. 169-172.
. Кучеров,
Е.В. Ресурсы основных видов дикорастущих лекарственных растений в Башкирии /
Е.В. Кучеров, А.Х. Галеева. - Уфа: Башк. кн. изд-во. - 1986. -149 с.
. Лавренов,
В.К. Полная энциклопедия лекарственных растений: в 2 т. / В.К. Лавренов, Г.В.
Лавренова. - СПб.: Нева; М.: ОЛМА-ПРЕСС, 1999. - Т. 1 - С. 403-404.
. Лысенко,
Е.А. Эколого-биологические особенности Angelica archangelica лесостепи Украины
/ Е.А. Лысенко // Растит. ресурсы. - 1994. - Вып. 3. - С. 34-41.
. Маевский,
П.Ф. Флора средней полосы европейской части России / П.Ф. Маевский. - Изд.
10-е, перераб. и доп. - М.: Товарищество научных изданий КМК, 2006. - С. 396.
. Маслова,
Н.В. Биоморфологические особенности Angelica archangelica в культуре в условиях
лесостепной зоны Башкирской АССР: автореф. дис. … канд. биол. наук: 03.00.05 /
Н.В. Маслова. - Свердловск, 1989. - 24 с.
. Маслова,
Н.В. Дудник дягилевый, дягиль лекарственный Angelica archangelica L. / Н.В.
Маслова // Биология и экология основных видов полезных растений на Южном Урале.
- М.: Наука. - 1993. - С. 68-85.
. Машковский,
М.Д. Лекарственные средства / М.Д. Машковский. - 15-е изд. перераб. и доп. -
М.: Новая волна, 2005. - 1206 с.
. Методика
исследований при интродукции лекарственных растений / Н.И. Майсурадзе [и др.] //
Лекарственное растениеводство: Обзорная информация. - М., 1984. - № 3. - 32 с.
. Методические
рекомендации по расширению номенклатуры отечественных официнальных
лекарственных растений / под общ. ред. Т.Л. Киселевой. - М.: Изд-во Проф.
ассоциации натуротерапевтов, 2009. - 88 с.
. Методы
контроля качества эфирных масел / Н.В. Сегуру [и др.] // Фармация. - 2005. - №
3. - С. 3-5.
. Молчан,
Н.В. Определение эфирного масла в лекарственном растительном сырье / Н.В.
Молчан, И.П. Рудакова, И.А. Самылина // Фармация. - 2009. - № 5. - С. 3-4.
. Новиков,
В.С. Популярный атлас-определитель. Дикорастущие растения / В.С. Новиков, И.А.
Губанов. - 5-е изд., стереотипное. - М.: Дрофа, 2008. - С. 288-289.
. О
возможности использования лекарственных растений для лечения и профилактики
микроэлементозов и патологических состояний / М.Я. Ловкова [и др.] //
Микроэлементы в медицине. - 2005. - Т. 6, № 4.-С.3-9.
. Определение
свинца в модельных растворах методом изотопного разбавления / А.А. Абрамов [и
др.] // Фармация. - 1998. - № 5. - С.33-34.
. Определение
содержания экстрактивных веществ в лекарственном растительном сырье / А.А.
Сорокина [и др.] // Фармация. - 2010. - № 3. - С. 3-4.
. Официальный
сайт Всемирной Организации Здравоохранения. [Электронный ресурс]. - Режим
доступа: http://www.who.org. - Загл. с экрана.
. ОФС
42-0011-03 Определение содержания радионуклидов в лекарственном растительном
сырье. Стронций-90, цезий-137. Отбор проб, анализ, оценка результатов. - М.,
2003. - 27 с.
. ОФС
42-0013-03 «Правила приемки лекарственного растительного сырья и методы отбора
проб» // Фармация. - 2003. - № 6. - С. 3-8.
. Пат.
2403566 Российская Федерация, С2 Способ количественного определения
восстанавливающих сахаров / Н.Ш. Кайшева, А.Ш. Кайшев, Т.В. Орловская (РФ). - №
2008149186/21; заявл. 12.12.08; опубл. 10.11.10, Бюл. № 31. - 14 с.
. Перельсон,
М.Е. Спектры и строение кумаринов, хромонов и ксантонов М.Е. Перельсон, Ю.Н.
Шейнкер, А.А. Савина. - М.: Медицина, 1975. - 232 с.
. Пехов,
А.В. Экстрагирование растительного сырья / А.В. Пехов, Н.Ф. Дюбанькова, Р.С.
Мазуренкова // Тр. Краснодар. НИИ пищ. пром-ти.- 1969. - Т. 5. - С. 224-247.
. Пилат,
Т.П. Биологически активные добавки к пище (теория, производство, применение) /
Т.П.Пилат, А.А. Иванов. - М.: Авваллон, 2002. - С. 77-79.
. Пименов,
М.Г. Перечень растений - источников кумариновых соединений / М.Г. Пименов. -
Л.: Наука, 1971. - 202 с.
. Пластины
Сорбфил [Электронный ресурс]. - Режим доступа:
http://www.sorbfil.com/plates_index.htm. - Загл. с экрана.
. Полезные
растения СССР. - М.; Л.: Изд-во АН СССР. - 1951. -Т. 1. - 198 с.
. Пономарев,
В.Д. Экстракция растительного лекарственного сырья / В.Д. Пономарев. - М.:
Медицина, 1976. - 204 с.
. Попов,
А.П. Лекарственные растения в народной медицине / А.П. Попов. - Киев: Здоровье,
1969. - С.151-153.
. Попова,
Н.В. Лекарственные растения мировой флоры / Н.В. Попова, В.И. Литвиненко. -
Харьков: СПДФЛ Мосякин В.Н., 2008. - 510 с.
. Потанина,
О.Г. Оценка доброкачественности лекарственного растительного сырья с учетом
диагностически значимых признаков / О.Г. Потанина, И.А. Самылина // Фармация. -
2003. - № 4. - С. 12-14.
. Потанина,
О.Г. Совершенствование стандартизации и контроля качества лекарственного
растительного сырья и лекарственных форм из него на основе микроскопического
метода исследования: дис. … д-ра фармац. наук / Потанина О.Г. - М., 2003. - Т.
1. - 432 с.
. Потанина,
О.Г. Совершенствование стандартизации и контроля качества лекарственного
растительного сырья и лекарственных форм из него на основе микроскопического
метода исследования: дис. … д-ра фармац. наук / О.Г. Потанина. - М., 2003. - Т.
2. - 217 с.
. Почему
растения лечат / М.Я. Ловкова [и др.] М.: Наук, 1989. - 256 с.
. Проблемы
нормирования тяжелых металлов в лекарственном растительном сырье / О.И.
Терешкина [и др.] // Фармация. - 2010. - № 2. - С. 7-11.
. Пряности,
специи, эфирные масла. Полная энциклопедия. - СПб.: ВЕСЬ, 2001. - С. 69-71.
. Растительные
ресурсы России: Дикорастущие цветковые растения, их компонентный состав и
биологическая активность. Т.3. Семейства Fabaceae
- Apiaceae / отв. ред. А.Л.
Буданцев. - СПб.; М.: Товарищество научных изданий КМК, 2010. - 601 с.
. Регистр
лекарственных средств России [Электронный ресурс]. - Режим доступа:
http://www.rlsnet.ru/. - Загл. с экрана.
. Руководство
по экспериментальному (доклиническому изучению новых фармакологических веществ
/ под ред. Р.У. Хабриева. - 2-е изд., перераб. и доп. - М.: Медицина, 2005. -
832 с.
. Салихова,
Р.А. Изучение антимутагенных свойств дудника лекарственного (Angelica
archangelica
L.) микроядерным
тестом / Р.А. Салихова, Ш.Н. Дулатова, Г.Г. Порошенко // Бюл. эксперим.
биологии и медицины. - 1993. - Т. 115, № 4. - С. 371-372.
. Самылина,
И.А. Пути использования лекарственного растительного сырья и его стандартизация
/ И.А. Самылина, И.А. Баландина // Фармация. - 2004. - № 2. - С. 39-41.
. Самылина,
И.А. Фармакогнозия. Атлас: учеб. пособие: в 3 т. / И.А. Самылина, О.Г. Аносова.
- М.: ГЭОТАР-Медиа, 2007. - Т. 1. - 192 с.
114. СанПин
2.3.2 1078-01 «Гигиенические требования к качеству и безопасности
продовольственного сырья и пищевых продуктов» от 14.11.2001/22.03.02.
[Электронный ресурс]. - Режим доступа: <http://www.service-holod.ru/SanPiN2/SanPiN_2_3_2_1078_01.htm>.
- Загл. с экрана.
. Сборник
методических рекомендаций по стандартизации лекарственных средств / В.Л.
Багирова [и др.]. - 2006, М.: Пеликан. - 392 с.
116. Серкеров,
С. Инфракрасные спектры и строение сесвитерпеновых лактонов и кумаринов / С.
Серкеров, А. Алескерова. - Баку, 2006. - 224 с.
. Скальный,
А.В. Биоэлементы в медицине / А.В. Скальный, И.А. Рудаков. - М.: ОНИКС 21 век:
Мир, 2004. - 276 с.
. Скальный,
А.В. Химические элементы в физиологии и экологии человека / А.В. Скальный. -
М.: ОНИКС 21 век: Мир, 2004. - 216 с.
. Скляровский,
Л.Я. Лекарственные растения в быту / Л.Я. Скляровский, И.А. Тубанов. - М.:
Россельхозиздат, 1986. - 280 с.
. Современные
методы анализа и оборудование в санитарно-гигиенических исследованиях (научно-практическое
руководство) / под ред. Г.Г. Онищенко, Н.В. Шестпалова. - М.: ФГУП Интерсэн,
1999. - 496 с.
. Спиридонов,
Н.А. Цитотоксическое действие лекарственных растений на лимфобластоидные клетки
в культуре / Н.А. Спиридонов, В.В. Архипов // Хим.-фармац. журн. - 1994. - Т.
28, № 9. - С. 49-51.
. Спутник
хроматографиста. Методы жидкостной хроматографии / О.Б. Рудаков [и др.]. -
Воронеж: Водолей, 2004. - 528 с.
. Степаненко,
Б.Н. Химия и биохимия углеводов (Моносахариды) / Б.Н. Степаненко. - М.: Высш.
шк., 1977. - 222 с.
. Степаненко,
Б.Н. Химия и биохимия углеводов (Полисахариды) / Б.Н. Степаненко. - М.: Высш.
шк., 1978. - 256 с.
. Тахтаджян,
А.Л. Система магнолиофитов / А.Л. Тахтаджян. - Л.: Наука, 1987. - 439 с.
. Ткачев,
А.В. Библиотека хромато-масс-спектрометрических данных летучих веществ
растительного происхождения / А.В. Ткачев. - Новосибирск: Новосибирский ин-т
орган. химии им. Н.Н. Ворожцова СО РАН, 2006.
. Толкачев,
О.Н. Биологически активные вещества льна: использование в медицине и питании
(обзор) / О.Н. Толкачев, А.А. Жученко мл. // Хим.-фармац. журн. - 2000. - Т.
34, № 7. - С. 23-30.
. Универсальная
энциклопедия лекарственных растений / сост. И.Н. Путырский, В. Н. Прохоров. -
М.: Махаон, 2000. - С. 115-116.
. Филиппов,
М.П. Доступность гидроксильных групп пектиновых веществ для дейтерирования /
М.П. Филиппов, М.С. Комисаренко // Химия природ. соединений. - 1987. - № 3. -
343-348.
. Филиппов,
М.П. ИК-спектроскопическое определение карбоксильных групп в пектиновых
веществах / М.П. Филиппов // Журн. аналит. химии. - 1973. - Т. 28, вып. 5. - С.
30-31.
. Филиппов,
М.П. Инфракрасные спектры пектиновых веществ / М.П. Филиппов // Методы анализа
пищевых продуктов (Проблемы аналитической химии). - М.: Наука, 1988. - Т. 8. -
С. 198-216.
. Филиппов,
М.П. Природа связи в растительной ткани, строение и инфракрасные спектры как
основа классификации пектиновых веществ: автореф. … дис. д-ра хим. наук / М.П.
Филиппов. - Одесса, 1990. - 38 с.
. Флора
СССР: в 30 т. / ред. Б.К. Шишкин. - М.; Л.: Изд-во Академии наук СССР, 951. -
Т. 17. - С. …………..
. Фоканов,
А.М. Совершенствование метода определения всхожести семян / А.М. Фоканов //
Селекция и семеноводство. - 1983. - № 1. - С. 39-42.
. Фоканов,
А.М. Урожайные свойства семян с разной всхожестью / А.М. Фоканов, Н.Ф. Лоскутов
// Селекция и семеноводство. - 1980. -№ 7. - С. 37-40.
. Фурст,
Г.Г. Методы анатомо-гистохимического исследования растительных тканей / Г.Г.
Фурст. - М.: Наука, 1979. - 155 с.
. Хавезов,
И. Атомно-адсорбционный анализ: пер. с болг. / И. Хавезов, Д. Палев; под ред.
С.З. Яковлевой. - Л.: Химия, 1983. - 144 с.
. Химия
углеводов / Н.К. Кочетков [и др.]. - М.: Химия, 1967. - 672 с.
. Хорошайлов,
Н.Г. Энергия прорастания - важный показатель качества семян / Н.Г. Хорошайлов
// Селекция и семеноводство. - 1977. - № 2. - С. 60-62.
. Хренова,
Д.Х. Изучение процесса экстракции при получении препарата растительного
происхождения / Д.Х. Хренова, Т.Д. Даргаева, Л.И. Брутко // Технологические
аспекты создания лекарственных форм. ВНИИ Фармации. - 1986. - Т. 24. - С.
85-90.
. Хроматография
на бумаге / под ред. И.М. Хайца, К. Мацека. - М.: Изд-во иностран. лит., 1962.
- 851 с.
. Черепанов,
С.К. Сосудистые растения России и сопредельных государств (в пределах бывшего
СССР) / С.К. Черепанов. - СПб.: Мир и семья, 1995. - 990 с.
. Чуролинов,
П.К. Фитотерапия в дерматологии и косметике / П.К. Чуролинов. - София, 1979.
-150 с.
. Шарыгина,
И.С. Дягиль аптечный, душица обыкновенная, иссоп лекарственный их биология и
эфирномасличность под Ленинградом: автореф. … дис. канд. биол. наук: 03.00.04 /
Шарыгина И.С - Л., 1960. -18 с.
. Шемерянкина,
Т.Б. Требования к стандартизации лекарственного растительного сырья и
фитопрепаратов на его основе / Т.Б. Шемерянкина, Т.А. Сокольская, Т.Д. Даргаева
// Вопр. биол., мед. и фармац. химии. - 2010. - № 3. - С. 9-12.
. Шретер,
Г.К. Лекарственные растения и растительное сырье, включенные в отечественные
фармакопеи / Г.К. Шретер. - М., 1972. - 119 с.
147. Щипицина,
О.С. Компонентный состав эфирного масла различных вегетативных частей дудника
лекарственного Сибирского региона / О.С. Щипицина, А.А. Ефремов // Химия раст.
сырья. - 2010. - № 4. - С. 115-119.
148. Щипицина,
О.С. Сравнительный анализ эфирного масла из корней сибирского и европейского
подвидов Angelica
archangelica / О.С. Щипицина,
А.А. Ефремов // Успехи современного естествознания. - 2011. - № 5. - С.
126-128.
. Экологическая
оценка кормовых угодий по растительному покрову / Л.Г. Раменский [и др.]. - М.:
Сельхозгиз, 1956. - 470 с.
. Энциклопедический
словарь лекарственных растений и продуктов животного происхождения: учеб.
пособие / под ред. Г.П. Яковлева, К.Ф. Блиновой. - 2-е изд., перераб. и доп. -
СПб.: Спец. лит., 2010. - 407 с.
. Энциклопедия
лекарственных растений. - М.: Ридерс Дайджест, 2004. - С. 79.
. Angelica
sylvestris L. - Дудник лесной // Иллюстрированный определитель растений Средней
России: в 3 т. - Т.2: Покрытосеменные (двудольные: раздельнолопастные). - 2003,
М.: Т-во науч. изд. КМК, Ин-т технологических исследований. - С. 613.
. Заявка
2337200 Великобритания, МПК 6 A
61 К 9/72. - А 61 К 35/78. Smoking substances
for use in therapy by inhalation, based on a mixture of a least five medicinal
herbs, ginkgo leaves as base and starch syrup/glycerin binders / O.S. Bae. - №
9810054.8; НПК A5B. -
1999.
154. Пат.
169922 Польша,
МПК
6 А
61 Л
35.78б.
- Sposob ortzywania nowego preparatu przeciwgrzybiczego I nowi preparat
przeciwgrzybiczy / T. Wolski, S. Kawka, J. Wolsky. - № 298797; опубл.
30.06.1996
155. Пат.
589140 США, МПК6 A 61 К 35/78.
Phytoestrogen supplement prepared from
pomegranate seeds and a herbal mixture or coconut milk / E.P. Lansky. - №
777895; опубл.
06.04.1999; НПК 424/195,1 ;
РЖ
Химия.
- 2000. - 00-09-190. - 190 с.
. 2D
NMR spectroscopic analyses of archangelicin from the seeds of Angelica
archangelica / M. Muller [et al.] // Acta Pharm. - 2004. - Vol. 54, № 4. - P.
277-285.
. A
bioassay using Artemia salina for detecting phototoxicity of plant coumarins /
T. Ojala [et al.] // Planta Med. - 1999. - Vol. 65, № 8. - Р.
715-718.
. A
combination of riboflavin, magnesium, and feverfew for migraine prophylaxis: a
randomized trial / Maizels M. [et al.] // Acta Pharm. - 2004. - Vol. 44. - P.
885-890.
. Activity
of furanocoumarin from Archagelica officinalis Hoffm. and Hercleum sosnowskyi
Manden. friits on dermatophytes / B. Kedzia // Herba Pol. - 1996. - Vol. 42, №
1. - Р.
47-54.
. American
Herbal pharmacopoeia. Angelica sinensis monograph. 2002.
[Электронный ресурс]. - Режим доступа: http://www.herbal-ahp.org/order_online.htm.
- Загл. с экрана.
161. Analysis
of mineral contents of edible Medicinal Plants in Korea / S.B. Han [et al.] //
Food Sci. Biotechnol. - 2001. - Vol. 10. - № 3. - P. 225-230.
162. Analysis
of mineral contents of edible Medicinal Plants in Korea / S.-B. Han [et al.] //
Food Sci. Biotechnol. - 2001. - Vol. 10, № 3. - P. 225-230.
. Anderson,
K.N. Parthenolide induces apoptosis in glioblastomas without affecting
NF-kappaB / K.N. Anderson, B.E. Bejcek // J. Pharmacol. Sci. - 2008. - Vol.
106, № 2. - P. 318-320.
. Antifibrotic
effect of Chinese herbs Astragalus mongholicus and Angelica sinensis in a rat
model of chrtnic punmycin aminonuclcosidc / H. Li J. Wang [et al.] // Life Sci.
- 2004. - № 74. - Р.
1645-1658.
165. Antiproliferative
effect in rat vascular smooth muscle cells by osthole, isolated from Angelica
pubescens / J.H. Guh [et al.] // Eur. J. Pharmacol. - 2002. - Vol. 298. - P.
191-197.
166. Antiproliferative
effect in rat vascular smooth muscle cells by osthole, isolated from Angelica
pubescens II Eur. / Guh J.H. [et al.] // J. Pharmacol. -1996. - Vol. 298. - P.
191-197.
. Anti-ulcerogenic
effect of some gastrointstinally acting plant extracts and their combination /
M.T. Khayyl [et al.] // Arzneimittelforschung. - 2001. - Bd. 51, № 7. - Р.
545-553.
. Baerheim
Swendsen, A. Die Verbreitung der Umbelliferose in der Pflanzenfamilie der
Umbelliferen / A. Baerheim Svendsen // Acta chem. scand. - 1956. - Vol. 10, №
9. - P. 1500-1501.
. Baerheim
Swendsen, A. Paper chromatography as a qualitative procedure for the phytochemical
analysis of organic acids / A. Baerheim Svendsen // Pharm. Acta helv. - 1954. -
Bd. 25. - S. 230-236.
. Baerheim
Swendsen, A. The phytochemistry of radix Angelicae / A. Baerheim Svendsen //
Blyttia. - 1953. - Vol. 11. - P. 96-104; Chem. Abstrs. - 1956. - Vol. 50,
№7963.
. Baerheim
Swendsen, A. Zur Chemie norvegischer Umbelliferen / A. Baerheim Swendsen. -
Oslo, 1954. - 144 p.
. Berger,
F. Dia Angelikawurzel, ihre Kultur und Verwendung / F. Berger // Acta
Phytother. - 1971. - T. 18, № 5. - P. 86-93.
. Berger,
F. Handbuch der drogenkunde: Bd 1-6 / F. Berger. - Wien, 1950. - Bd. 2. - 457
S.; 1952. - Bd 3. - 558 S.
. Beyrich,
Th. Uber Furocumarine: Isolierung von Phellopterin aus Fruchten von Heracleum
mantegazzianum und Angelica archangelica L. / Th. Beyrich // Arch. Pharm. -
1965. - Bd. 298, H. 10. - S. 672-676.
. Bioactive-guided
fractionation and GC/MS fingerprinting of Angelica sinensis and Angelica
archangelica root components for antifungal and mosquito deterrent activity /
D.E. Wedge [et al.] // J. Agric. Food Chem. - 2009. - Vol. 57, № 57. - Р.
464-470.
. Biologocal
screening of 100 plant extracts for cosmetic use (1): inhibitory activities of
tyrosinase and DOPA auto-oxidation / K.T. Lee [et al.] // International J. of
cosmetic Science. - 1997. - № 19. - Р.
191-298.
. Biotechnology
inagriculture and forestry. - B.: Heidelberg: Springer. - 1988. - Vol. 4. - 550
p.
. Bogucka-Kocka,
A. Apoptotic activities of ethanol extracts from some Apiaceae on human
leukaemia cell lines / A. Bogucka-Kocka, H.D. Smolarz, J. Kocki // Fitoterapia.
- 2008. - Vol. 79, № 7-8. - Р.
487-797.
. Bomme,
U. Evaluierung von Engelwurz (Angelica archangelica) Herkunften unter
besonderer Berticksichtigung von Gehalt und Zusammensetzung des atherisches Ols
/ U. Bomme, E. Feicht, G. Hillenmeyer // Z. Arz. Gew. - 2000. - Vol. 5, № 1. -
S. 28-35.
. Bomme,
U. Kulturanleitung fur Engelwurz / U. Bomme // Bayerische Landesanstalt fur
Bodenkultur und Pflanzenbau. - 2001. - P.
. Bomme,
U. Neue Herkunfte bei Engelwurz und Baldrian verftigbar / U. Bomme // Gemiise.
- 1997. - № 11. - S. 637-641.
. Boros,
R. Experimental results on seed storage, germination and growing of angelica
(Angelica archangelica L.) / R. Boros, J. Domokos // Herba Hungarica. - 1982. -
T. 21. - № 2. - P. 15-21.
. British
Herbal Pharmacopoeia 1996. - London: Published by the British Herbal Med.
association, 1996. - 212 p.
. British
Pharmacopoeia 2009 [Электронный
ресурс]. - Режим доступа: ttp://www.pharmacopoeia.co.uk/2009/.
- Загл. с экрана.
185. Buch,
M.L. A bibliography of organic acids in higher plants / M.L. Buch // Agr.
Handb. - 1960. - № 164. - P. 1-100.
. Buchner,
L.A. Ueber eine eigenthumliche fluchtige Saure aus der Angelicawurzel / L.A.
Buchner // Ann. Chem. und Pharm. - 1842. - Bd. 42. - S. 226-233.
. Calixto,
J.B. Anti-inflammatory compounds of plant origin. Part I. Action on arachidonic
acid pathway, nitric oxid and nuclear factor κB
(NF-κB)
/ J.B. Calixto, M.F. Otuki, A.R.S. Santos // Planta Med. - 2003. - Vol. 69, №
11. - P. 973-983.
. Carbonier,
J. Contribution a létude des furocuomarines du genre Angelica / J.
Carbonier, D. Molho // Planta med. - 1982. -
Vol. 44, № 3. - P. 162-165.
. Characteristic
immunostimulation by angelan isolated from Angelica gigas Nakai / S.B. Han [et
al.] // Immunopharmacology. -1998. - Vol. 40, № 1. - P. 39-48.
. Chemoprotective
of benzo [a]pyrene induced forestomach cancer in mice by natural phtalides from
celery seed oil / G.O. Zheng [et al.]. // Nutr. Cancer. - 1993. Vol. 19, № 1. -
Р.
77-86.
191. Chen,
C.-Y. Elemental analysis of the Taiwanese health food Angelica keiskei by INAA.
/ C.-Y. Chen // J. of radioanalitical and nuclear chemistry. - 2002. -Vol. 252.
- № 3. - P. 551-558.
192. Chunyan,
H. Effect of Angelica sinensis aqueous extract on uterus, ovary NF-kB/β-actin
and IL-6/β-actin mRNA
expression level in pelvic inflammation model rats / Chunyan Huang, Xiaoping
Chen // African J. of Pharmacy and Pharmacology. - 2012. - Vol. 6. - P.
860-863.
. Ciamician,
G. Ueber Angelica-Oil / G. Ciamician, P. Silber // Ber. Dtsch. chem. Ges. -
1896. - Jg. 29. - S. 1811-1816.
. Computer-assisted,
high-performance liquid chromatography with mass spectrometric detection for
the analysis of coumarins in Peucedanum palustre and Angelica archangelica / M.
Eeva [et al.] // Phytochem. Anal. - Vol. 15, № 15. - Р.
167-174.
. David,
E.W. Bioactivity-Guided Fractionation and GC/MS Fingerprinting of Angelica
sinensis and Angelica archangelica Root Components for Antifungal and Mosquito
Deterrent Activity / E.W. David // J. Agric. Food Chem. - 2009. - P. 464-470.
. Direct
headspace gas chromatographic analysis with glass capillary columns in quality
control of aromatic herbs / F. Chialva [et al.] // J. Chromatogr. - 1983. -
Vol. 279, № 25. - P. 333-340.
. Doneanu,
C. Suprercritical carbon dioxide extraction of Angelica archangelica L. root
oil / C. Doneanu, G. Anitescu // J. Supercrit. Fluid. - 1998. - № 12. - Р.
59-67.
. Duke,
J.A. CRC handbook of medicinal herbs. - Boca Raton (Fla.): CRC press. - 1986. -
677 p.
. Duke,
J.A. Medicinal plants of China / J.A. Duke, E.S. Ayensu // Algonac (Mich.):
Reference publ. - 1985. - Vol. 1-2. - 705 p.
. Efficacy
and safety of 6.25 mg t.i.d. feverfew CO-extract (MIG-99) in migraine
prevention - a randomized, double-blind, multicentre, placebo-controlled study
/ Diener H. [et al.] // Cephalalgia. - 2005. - Vol. 25, № 11. - P. 1031-1041.
. Elgohary,
A.A. Prophylactic effect of Angelica archangelica against acute lead toxicity
in albino rabbits / A.A. Elgohary, M.W. Shafaa. // Romanian J. Biophys. - Vol.
19, № 4. - P. 259-275.
. Enoki,
T. Antidiabetic activities of chalcones isolated from a Japanese herb, Angelica
keiskei / T. Enoki, H. Ohnogi, K. Nagamine // J. of agriculture food chemistry.
- 2007. - Vol. 55. - P. 6013-6017.
. Escher,
S. Neue Phellandren - Derivate aus dem Wurzelol von Angelica archangelica L. /
S. Escher, U. Keller, B. Willhelm // Helv. Chim. Acta. - 1979. - Vol. 65, №
7. - P. 2061-2072.
204. European Pharmacopoeia, 6th
edition, 2008 [Электронный ресурс].
- Режим доступа:
<http://www.edgm.eu>. - Загл. с экрана.
205. Evans,
R.W. «Natural» or Alternative Medications for Migraine Prevention: Feverfew /
R.W. Evans, F.R. Taylor // Headache. - 2006. - Vol. 46, № 6. - P. 1012-1018.
206. Extracts
of feverfew inhibit granule secretion in blood platelets and polymorph nuclear
leucocytes / Heptinstall S. [et al.] // Lancet. - 1985. - Vol. 1, № 8437. - P.
1071-1074.
207. Extracts
of feverfew may inhibit platelet behavior via neutralization of sulphydryl
groups / Heptinstall S. [et al.] // J. Pharm. Pharmacol. - 1987. - Vol. 39, №
6. - P. 459-465.
. Farnsworth,
N.R. A review of some biologically active compounds isolated from plants as
reported in the 1974-75 literature / N.R. Farnsworth, G.A. Cordell // Lloydia.
- 1976. - Vol. 39, № 6. - Р.
420-455.
. Feverfew
// United States Pharmacopeia 30 and National Formulary 25 and Supplements. -
New York, 2006. - P. 925.
. Ficher,
F.C. Apterin, a common furanocoumarin glycoside in the Umbelliferae / F.C.
Ficher, A. Baerheim Svendsen // Phytochemistry. - 1976. - Vol. 15, № 6. - P.
1079-1080.
. Fournier,
P. Le livre des plantes médicinales et vénéneuses de France /
P. Fournier. - Vol. 1-3. Paris, - 1947. - T. 1.
450 p.; 1948. - T. 2. 504 p.; 1948. - T. 3. 636 p.
. Garnier,
G. Ressources médicinales de la flore française / G. Garnier, L.
Bézanger-Beauquesne, G. Debraux. - Paris, 1961. - T. 1-2. - 1511 p.
213. Glowniak,
K. Investigation of the gasoline exctracts of some umbelliferous fruits:
Sterols and fatty acids in Angelica (Archangelica officinalis) fruits / K.
Glowniak // Acta pol. pharm. - 1978. - T. 35, № 3. - S. 353-357.
. Glowniak,
K. Study of the coumarins of Archangelica officinalis Hoffm. fruits / K.
Glowniak, A. Gawron, B. Kwietniowska // Ann. UMCS. C. - 1976. - Vol. 31. - P.
349-354; Chem. Abstrs. 1978. - Vol. 89, №72952.
. Harbone,
J.B. Flavonoid patterns on the fruits of the Umbelliferae / J.B. Harbone, C.A.
Williams // Phytochemistry. - 1972. - Vol. 11, № 5. - P. 1741-1750.
. Hauffe,
K.D. Elicitor-stimulated furanocoumarin biosynthesis in cultured parsley cells:
S-adenosyl-L-methionine: bergaptol and S-adenosyl-L-methionine: xanthhotoxol
O-methyltransferase / K.D. Hauffe, K. Hahlbrock, D. Scheel // Z.
Naturforschung. - 1985. - № 41. - P. 228-239.
. Hawryl,
M. Separation of coumarins from Angelica archangelica L. in high-performance
liquid chromatography and thin-layer chromatography systems / M. Hawryl, E.
Soczewinski, Т.Н.
Dzido // J. of Chromatography. - 2000. - Vol. 886. P. 7581.
. Hepatoprotective
effect of Angelica archangelica in chronically ethanol-treated mice / M.I. Yeh
[et al.] // Pharmacology. - 2003. - Vol. 68, № 2. - Р.
70-73.
. Hethelyi,
E.B. Gland GC-MS determination of variations in the essential oil and chemical
nature of seed and roots of species grown in Finland / E.B. Hethelyi, B.
Galambosi // Olaj, Szappan, Kozmetika. - 2003. - Vol. 52, № 3. - P. 105-114.
. Holm,
Y. Enantiomeric composition of monoterpene hydrocarbons in n-hexane extracts of
Angelica archangelica L. roots and seeds / Y. Holm, P.Vuorela, R. Hiltunen //
Flavour Fragnance J. - 1997. - Vol. 12. - P. 397-400.
. Horhammer,
L. Indentifizierung von Umbelliferen-wurzeln und Nachweis der wichtigsten
Verfalschungen mit Hilfe der Dunnschichtchromatographie / L. Horhammer, H.
Wagner, D. Kraemer-Heydweiller // Dtsch. Apoth. Ztg. - 1966. Jg. 106, H. 9. -
S. 267-272.
. Immunostimulating
polysaccharide from cell culture of Angelica gigas Nakai / K.-S. Ahn [et al.]
// Biotechnology Letters. - 1998. - Vol. 20, №1. - P. 5
. Insecticidal
effect of phthalides and furanocoumarins from Angelica acutiloba against
Drosophila melanogaster / Miyazawa Y. [et al.] // J. Agric. Food Chem. - 2004.
- P. 4401-4405.
. Isolation
and characterization of plant cell walls and cell-wall components / W.S. York
[et al.] // Meth. Enzymol. - 1985. - Vol. 118. - P. 3-40.
. Isolation,
Identification, and Screening for COX-1- and 5-LO-Inhibition of Coumarins from
Angelica archangelica / G. Roos [et al.] // Pharmaceutical Pharmacological
Letters. - 1997. - Band 7. - Heft 157. - S. 157-160.
. Jones,
Q. Chemical analyses of seeds / Q. Jones, F.R. Easrly // Econ. Bot. - 1966. -
Vol. 20, № 2. - P. 127-155.
. Joshi,
S. Hepatoprotective and antioxidant activity of the aqueous extract of Angelica
glauca Edgew. root / S. Joshi, O. Prakash //Asian J. of Traditional Medicines.
- 2008. - № 3. - P. 58-66.
. Ka,
M.-H. Antioxidative activity of volatile extracts isolated from Angelica
tenuissimae Roots, Peppermint leaves, Pine needles, and sweet Flag leaves /
M.H. Ka, E.H. Choi, H.S. Chun // J. of agriculture food chemistry. - 2005. -
Vol. 53. - P. 4124-4129.
. Kerschbaum,
M. Uber Lactone mit grossen Ringen die Trager des vegetablischen Moschus-Duftes
/ M. Kerschbaum // Ber. Dtsch. chem. Ges. - 1927. - Bd. 60, № 4. - S. 902-909.
. Kiss,
I. Volatile terpenes from the roots of Angelica archangelica / I. Kiss, G.
Tibori, G. Racz // Rev. Med. (RSR). - 1980. - T. 26, № 1. - P. 79-82; Chem.
Abstrs. - 1980. - Vol. 94, №1199.
. Kleiman,
R. Search for new industrial oils: Umbelliferae seed oil rich in petroselinic
acid / R. Kleiman, G.F. Spencer // J. Amer. Oil Chem. Soc. - 1982. - Vol. 59, №
1. - P. 29-38.
. Klouwen,
M.H. De vorming van monoterpenen en pentadekenolide in de vluchtige olie van
Angelica archangelica / M.H. Klouwen. - Amsterdam, 1961. - 77 S.
. Klouwen,
M.H. Quantitative determination of pentadecanolide in the volatile oil of
Angelica arhangelica by gas chromatography / M.H. Klouwen, R. ter Heide Perfum.
Essent. Oil. Rec. - 1965. -Vol. 56, №3. - P. 156-158; Chem. Abstrs. - 1965. -
Vol. 63, №1651.
. Klouwen,
M.H. Terpenes: The monoterpene hydrocarbon composition of volatile oil of
Angelica archangelica (Umbelliferae) / M.H. Klouwen, R. ter Heide Perfum. and
Essent . Oil. Rec. - 1965. - Vol.56, №4. - 224-228; Chem. Abstrs. - 1965. -
Vol. 65, №2845.
. Knutson
C.A., A.A. Jeans, Analyt. Biochem., Vol. 24, 470 - 481 (1968).
. Korta,
J. Badania nad wasnościami antybiotycznymi oleików eterycznych niektórych
gatunków z rodziny Umbelliferae / J. Korta, J. Sparzyk // Acta boil.
Crac. Ser. Bot. - 1964. - Vol. 6, № 2. - P.
149-160.
. Kraft,
P. Synthesis of medium and large ring compounds, XXXVIII: Ring enlargement of
cyclodecanone by a chiral building block: Synthesis and olfactory properties of
(12R)-(+)-12-methyl-13-tridecanolide / P. Kraft, W. Tochtermann // Liebigs
Annalen der Chemie. - 1994. - № 12. - Р.
1161-1164.
. Lee,
S.-B., Rasmussen S.K. Molecular marcers in some medicinal / S.-B. Lee, S.K.
Rasmussen // Euphitica. - 2000. - № 144. - P. 89-71.
. Liu,
Y.M. Observation on clinical effect of Angelica effect injection in treating acute
cerebral infarction / Y.M. Liu, J.J. Zhang, J. Jiang // Zhongguo Zhongxiyi
Jiehe Zazhi. - 2004. - № 24. - Р.
205-208.
. Lopes,
D. 14-Metylpentadecano-15-lacton (muscolide): a new macrocyclic lacton from oil
of Angelica archangelica / D. Lopes, H. Strobl, P. Kolodziejczuk // Chem.
Biodivers. - 2004. - Vol. 1, № 12. - Р.
1880-1881.
. Lu,
R.-M. Thin layer chromatography and densitometry of ligustilide in
umbelliferous plants / R.-M. Lu, L.-Y. He, X.-Q. Zhang // Yao Hsuch Pao. -
1980. Vol.6. - P. 371-374; Chem. Abstrs. - 1981. - Vol. 94, №71576.
. Luszczki,
J.J. Time-course and dose-response relationships of imperatorin in the mouse
maximal electroshock seizure threshold model / J.J. Luszczki, K. Glowniak, S.J.
Czuczwar // Neurosci. Res. - 2007. - Vol. 59, № 1. - Р.
18-22.
. Marco,
K. Polysaccharides from the root of Angelica sinensis protects bone marrow and
gastrointestinal tissues against the cytotoxicity of cyclophosphamide in mice /
K. Marco, C. Hui, K. K. William Wu. // J. Med. Sci. - 2006. - № 3. - P. 1-6.
. Margoob,
M.A. Thin Layer Chromatography (TLC) in detection of current nature of drug
abuse in Kashmir / M.A. Margoob, A.B. Majid, M. Dhuha // JK-Practitioner. -
2004. - Vol. 11, № 4. - P. 257-260.
. Masada,
Y. Analysis of essential oils by gas chromatography and mass-spectrometry / Y.
Masada. - New York, 1976. - 334 p.
. McLafferty
F.W. Eight Peak Index of Mass Spectra / F.W. McLafferty, D.B. Stauffer. -
London: University of Notinham, 1983. - Р.
256.
. McLafferty,
F.W. The Wiley. NBS Registry of Mass Spectral Data; Wiley / F.W. McLafferty,
D.B. Stauffer. - London: Interscience, 1989. - Р.
563.
. Meyer,
H. Uber die fluchtigen Sauren in der Angelica officinalis/ H. Meyer, D. Zenner
// Liebigs Ann. Chem. - 1845. - Bd. 55. - S. 317.
. Modulation
of GdCl3 and Angelica sinensis polysaccharides on differentially expressed
genes in liver of hepatic immunological injury mice by cDNA microarray // World
J. Gastroenterol. - 2003. - Vol. 9. - P. 1072-1076.
. Muller,
R. Ueber Methylathyllessigsaure und im atheischen Oel der Fruchte von Angelica
archangelica L. / R. Muller // Ber. Dtsch. chem. Ges. - 1881. - Jg. 14. - S.
2476-2484.
251. Natural
Substances in the Compositae: The Bohlmann Files [Электронный
ресурс].
- Режим
доступа:
http://bohlmann. bgbm.org/bohlmann/ccq. - Загл.
с
экрана.
252. Nielsen,
B.E. Constituents of the umbelliferous plants: Constituents of the roots of
Angelica archangelica L. / B.E. Nielsen, H. Kofod // Acta chem. scand. - 1963.
- Vol. 17, № 4. - P. 1161-1163.
. Nielsen,
B.E. Constituents of the umbelliferous plants: The structure of archangelicine,
a coumarine from Angelica archangelica L. ssp. Litoralis Thell. / B.E. Nielsen,
J. Lemmich // Acta chem. scand. - 1964. - Vol. 18, № 4. - P. 932-936.
. Nivinskiene,
O. The chemical composition of the essential oil of Angelica archangelica L.
roots growing wild in Lithuania / O. Nivinskiene, R. Butkiene, D. Mockute //
JEOR. - 2005. - Vol. 17, № 4. - P. 373-376.
. Nivinskienë,
O. Chemical composition of seed (fruit) essential oils of Angelica archangelica
L. growing wild in Lituviana / O. Nivinskienë,
R. Butkienë,
D. Mockutë
// Chemija. - 2005. - T. 16, №3-4. - P. 51-54.
. Nivinskienë,
О.
Changes in chemical composition of essential oil of Angelica archangelica L.,
roots during storage / О.
Nivinskienë,
R. Butkienë,
D. Mockutë
// Chemija. - 2003. - T. 14, № 1. - P. 52-56.
257. Nocturnal
melatonin excretion is decreased in patients with migraine without aura attacks
associated with menses / Brun J. [et al.] // Cephalalgia. - 1995. - Vol. 15, №
2. - P. 136-139.
258. Novel
antiproliferative falcarindiol, furanocoumarin ethers from the root of Angelica
japonica / H. Matsunaga // bioorganic and Medicinal Chemistry Letters. 1998. -
№ 8. - Р.
1-6.
. Ojala,
A. Seed dormancy and germination in Angelica archangelica subsp. archangelica
(Apiaceae) / A. Ojala // Ann. Bot. Fennici. - 1985. - Vol. 22. - P. 53-62.
. Optimiertes
Verfahren zur Praxisnahen Wasserdampf-destillation atherisher Ole aus frischen
Pflanzenteilen / U. Bomme [et al.] // Z. Arznei Gew. Pfl. - 2000. Vol. 5, № 2.
- S. 71-79.
. Parczewski,
A. Materialy do poznania olejków krajowych roślin z rodziny
Umbelliferae: Badanie skladu chemicznego olejku z owoców Archangelica
officinalis Hoffm. / A. Parczewski // Diss. Pharm. et
Pharmacol. PAN. - 1963. - T. 15, № 1. - S. 35-42.
. Pasqua,
G. Accumulation of essential oils in relation to root differentiation in
Angelica archangelica L. / G. Pasqua, B. Monacelli, A. Silvestrini // European
J. of Histochemistry. - 2003. - Vol. 47, № 1. - Р.
87-90.
. Pasqua,
G. In vitro root differenciation and essential-oil accumulation in Angelica
archangelica / G. Pasqua, B. Monacelli, A. Silvestrini // In Vitro Cell. Dev.
Biol. - 2001. - Plant 37. - Р.
763-766.
. Pistrick,
K. Notes on neglected and underutilized crops. Current taxonomic overviews of
cultivated plants in the families Umbelliferae and Labiatae II / K. Pistrick //
Genetic Resources and Crop Evolution. - 2002. - № 49. - P. 211-225.
. Plouvier,
V. Sur un flavonoloside isolé der Rhodotypos kerrioides Sieb. et Zucc.
(Rosacées): Presence de narcissine, linarine, diosmine dans diverses
espéces V. Plouvier // C. r. Acad. sci. D. -
1967. - T. 264,
№1. - P. 145-148.
. Protective
effect of Angelica sinensis polysaccharide onexperimental immunological colon
injury in rats / L. Shao-Ping [et al.] // World J. - 2003. - Vol. 9, № 12. - P.
1-5.
. Qualitative
TLC determination of some polycyclic aromatic hydrocarbons in sugar-beet / Eva
S. Loncar [et al.] // J. Serb. Chem. Soc. - 2005. - Vol. 70, № 10. - P.
1237-1242.
. Quantification
of ligustilide in the roots of Angelica sinensis and related umbelliferous
medicinal plants by high-performance liquid chromatography and liquid
chromatography-mass spectrometry / G.H. Lu [et al.] // J. Chromatogr. - 2004. -
P. 101-107.
. Recent
developments in bioavailabity of falcarinol / J. Haraldsdottir [et al.] //
proceedings of workshop in Karresbaeksminde. - Denmark, 2002. - P. 24-29.
. Rhyu,
M.R. Radix Angelica elicits both nitric oxidependent and calcium
influx-mediated relaxation in rat aorta / M.R. Rhyu, J.H. Kim, E.Y. Kim // J.
Cardiovasc Pharmacol. - 2005. - № 46. - Р.
99-104.
271. Sarker,
S.D. Natural Medicine:
The Genus Angelica / S.D. Sarker,
L. Nahar // Current Medicinal Chemistry. -
2004.
- Vol. 11,
№
11.
- P. 1479-1500.
272. Schönfelder,
P. Angelicae radix / P. Schönfelder
// Teedrogen und phytopharmaka. - Stuttgard: Wiss. Verl.-Ges, 1997. - S. 62-65.
. Shang,
P. Analysis of Angelica polysaccharides constituents by high-performance liquid
chromatography / P. Shang, Q.B. Mei, C.H. Cho // Chung Kuo Yao Hsueh Tsa Chih.
- 2000. - № 35. - Р.
332-335.
274. Shui-Yin,
W. Comparative study of ligustilide in different parts of radix Angelicae
sinensis by high-performnce liquid chromatography / W. Shui-Yin, T. Man-Ling,
C. Foo-Tim // ANYL. - 2003. -
№ 66.
- P. 187-191.
275. Shimiat,
N. New method for location of organic asids on paper chromatograms / N.
Shimiat, C. Pischer, J.N. Mecoven // J. Pharm. Sci. - 1963. - Vol. 52. - P.
468-472.
. Sigurdsson,
S. Antiproliferative effect of Angelica archangelica fruits / S. Sigurdsson,
H.M. Ogmundsdottir, S. Gudbjarnason // Z. Naturforsch., C: Biosci. - 2004. -
Bd. 59, № 7-8. - S. 523-527.
. Sigurdsson,
S. Inhibition of acetylcholinesterase by extracts and constituents from
Angelica archangelica and Geranium sylvaticum / S. Sigurdsson, S. Gudbjarnason
// Z. Naturforsch., C: Biosci. - 2007. - Bd. 62, № 9-10. - S. 689-693.
. Sigurdsson,
S. The cytotoxic effect of two chemotypes of essential oils from the fruits of
Angelica archangelica / S. Sigurdsson, H.M. Ogmundsdottir, S. Gudbjarnason //
Anticancer Res. - 2005. - Vol. 25, № 3B. - P. 1877-1880.
. Spath,
E. Uber die Cumarine der Droge, Semen Angelicae / E. Spath, F. Vierhapper //
Monatsh. Chem. - 1938. - Bd. 72, № 3. - S. 179-189.
. Spath,
E. Uber die Konstitution des Umbelliprenins / E. Spath, F. Vierhapper // Ber.
Dtsch. chem. Ges. - 1938. - Bd. 71, № 8. - S. 1667-1681.
. Spath,
E. Uber naturliche Cumarine: Die Konstitution des Angelicins (aus Angelica
archangelica L.) / E. Spath, O. Pesta // Ber. Dtsch. chem. Ges. - 1934. - Bd.
67, H. 5. - S 853-858.
. Spath,
E. Xanthotoxol, ein neuer Naturstoff aus Semen Angelicae und uber die
Totalsyntese von Xanthoxol und Imperatorin / E. Spath, F. Vierhapper // Ber.
Dtsch. chem. Ges. - 1937. - Bd. 70, №. 2. - S. 248-250.
. Steck,
W. Leaf coumarins of Angelica archangelica / W. Steck, B.K. Bailey // Can. J.
Chem. - 1969. - Vol. 47, № 13. - P. 2425-2430.
. Steinmetz,
E.F. Materia medica vegetabilis / Steinmetz E.F. - Amsterdam, 1954. - T. 1-3. -
589 p.
. Sue-Jing,
W. Antioxidant Activities of Some Common Ingredients of Traditional Chinese
Medicine, Angelica sinensis, Lycium barbarum and Poria cocos / Wu Sue-Jing, Ng
Lean-Teik, Lin. Chun-Ching // Phytother. Res. - 2004. - Vol. 18. - P.
1008-1012.
. Taskinen,
J. 12-Methyl-ω-tridecanolide, a
new macrocyclic lactone from Angelica root oil / J. Taskinen // Acta chem.
scand. B. - 1975. - Vol. 29, №5. - P. 637-638.
. Taskinen,
J. A new sesquiterpene alcohol of the copane series from Angelica root oil / J.
Taskinen // Acta chem. scand. B. - 1975. - Vol. 29, № 10. - P. 999-1001.
. Toguchida,
T. Hepatoprotective and nitric oxide production inhibitory activities of
coumarin and polyacetylene constituents from the roots of Angelica furcijuga I.
/ T. Toguchida // Bioorganic and Medicinal Chemistry Letters. - 1998. Vol. 8. -
№ 16 (18). - Р. 2191-2196.
. Uber
Polyine aus der Familie Umbelliferen / F. Bohlmann [et al.] // Chem. Ber. -
1961. - Jg. 94, №. 4. - S. 958- 967.
. Uptake
and transport of organic andinorganic nitrogen by arbuscular mycorrizal fungi /
H.-J. Hawkins // Plant and Soil. - 2000. - Vol. 226, № 2. - Р.
. Wei,
A. Antioxidant activities and volatile vonstituents of various essential oils /
A. Wei, T. Shibamoto // J. of agric. food chem. - 2007. - Vol. 55. - P.
1737-1742.
. Weiss,
R.F. Herbal Medicine / R.F. Weiss. - England: Beaconsfield Publishers, 1988. -
P. 46-47.
. West,
T.F. The addition of nitrosyl chloride to β-phellandrene
and the occurrence of the phellandrenes in some essential oils / T.F. West //
J. Soc. Chem. Ind. - 1939. - Vol. 58, № 3. - P. 122-125.
. Wolski,
T. The countent and compostion of essential oils and fatty acids from the
fruits of Angelica (Archangelica officinalis Hoffm.) / T. Wolski, A. Najda, A.
Ludwiczuk // Herba Pol. - 2003. - T. 49, № ¾.
- S. 151-156.
. Ye,
Y.N. Mechanistic study of proliferation induced by Angelica sinensis in a
normal gastric epithelial cell line / E.S. Liu [et al.] // Biochem. Pharmacol.
- 2001. - № 61. - Р.
1439-1448.
. Yi-Chian,
Pharmacological effects of Radix Angelica Sinensis on cerebral infarction. /
Yi-Chian, Wu1 and Ching-Liang Hsieh. // Wu and Hsieh Chinese Medicine. - 2011.
- P. 1-32.
. Zschocke,
S. Polyacetylenic acetate and a coumarin from Angelica pubescens f. biserrata /
S. Zschocke, J.-H. Liu, R. Bauer // Phytochemistry. - 1998. Vol. 49. - № 1
(103). - Р. 211-213.