Биотрансформация ксенобиотиков
Введение
Стремительные темпы развития промышленного производства, химизация
народного хозяйства ведут к появлению во внешней среде большого количества
разнообразных химических соединений, постоянно загрязняющих биосферу и пагубно
влияющих на живую природу.
В силу различных причин многие химические вещества, поступающие в
организм и ранее не встречающиеся в нем, получили название чужеродных или
ксенобиотиков (от греческих слов xenos
- чужой, biotos- жизнь). К таким веществам относятся
синтетические и природные лекарственные препараты, пестициды, промышленные
яды,отходы производств, пищевые добавки, косметические средства и прочие.
Актуальность проблем, рассматриваемых в ксенобиологии все возрастает. Это
обусловлено тем, что ежегодно на Земле синтезируются десятки тысяч новых
соединений. Ряд из них вовлекаются в круговорот веществ в природе. Чем шире
масштабы производства химических соединений, тем больше влияние они оказывают
на биологические процессы в почве, водоемах и на суше, тем сильнее проявляются
побочные и отдаленные последствия их действия на живые системы.
Воздействие ксенобиотиков на живой мир, и на человека в частности
происходит, в самых различных комбинациях этих соединений не только друг с
другом, но и с фактором окружающей среды. Поэтому многие из ксенобиотиков,
вошедших в сегодняшнюю практику могут являться носителями опасного
биологического действия.
Биотрансформация органических ксенобиотиков
Многие ксенобиотики, попав в организм, подвергаются биотрансформации и
выделяются в виде метаболитов. В основе биотрансформации по большей части лежат
энзиматические преобразования молекул. Биологический смысл явления -
превращение химического вещества в форму, удобную для выведения из организма, и
тем самым, сокращение времени его действия.
Метаболизм ксенобиотиков проходит в две фазы (рисунок 1).

Рисунок 1. Фазы метаболизма чужеродных соединений
В ходе первой фазы окислительно-восстановительного или гидролитического
превращения молекула вещества обогащается полярными функциональными группами,
что делает ее реакционно-способной и более растворимой в воде. Во второй фазе
проходят синтетические процессы конъюгации промежуточных продуктов метаболизма
с эндогенными молекулами, в результате чего образуются полярные соединения,
которые выводятся из организма с помощью специальных механизмов экскреции.
Разнообразие каталитических свойств энзимов биотрансформации и их низкая
субстратная специфичность позволяет организму метаболизировать вещества самого
разного строения. Вместе с тем, у животных разных видов и человека метаболизм
ксенобиотиков проходит далеко не одинаково, поскольку энзимы, участвующие в
превращениях чужеродных веществ, часто видоспецифичны.
Следствием химической модификации молекулы ксенобиотика могут стать:
. Ослабление токсичности;
. Усиление токсичности;
. Изменение характера токсического действия;
. Инициация токсического процесса.
Метаболизм многих ксенобиотиков сопровождается образованием продуктов
существенно уступающих по токсичности исходным веществам. Так, роданиды,
образующиеся в процессе биопревращения цианидов, в несколько сот раз менее
токсичны, чем исходные ксенобиотики. Гидролитическое отщепление от молекул
зарина, зомана, диизопропилфторфосфата иона фтора, приводит к утрате этими
веществами способности угнетать активность ацетилхолинэстеразы и существенному
понижению их токсичности. Процесс утраты токсикантом токсичности в результате
биотрансформации обозначается как "метаболическая детоксикация". В
процессе метаболизма других веществ образуются более токсичные соединения.
Примером такого рода превращений является, в частности, образование в организме
фторуксусной кислоты при интоксикации фторэтанолом.
В ряде случаев в ходе биотрансформации ксенобиотиков образуются вещества,
способные совершенно иначе действовать на организм, чем исходные агенты. Так,
некоторые спирты (этиленгликоль), действуя целой молекулой, вызывают
седативно-гипнотический эффект (опьянение, наркоз). В ходе их биопревращения
образуются соответствующие альдегиды и органические кислоты (щавелевая
кислота), способные повреждать паренхиматозные органы и, в частности, почки.
Многие низкомолекулярные вещества, являющиеся факультативными аллергенами,
подвергаются в организме метаболическим превращениям с образованием
реакционноспособных промежуточных продуктов. Так, соединения, содержащие в
молекуле амино- или нитрогруппу в ходе метаболизма превращаются в
гидроксиламины, активно взаимодействующие с протеинами крови и тканей, формируя
полные антигены. При повторном поступлении таких веществ в организм помимо
специфического действия развиваются аллергические реакции.
Порой сам процесс метаболизма ксенобиотика является пусковым звеном в
развитии интоксикации. Например, в ходе биологического окисления ароматических
углеводородов инициируются свободно-радикальные процессы в клетках, образуются
ареноксиды, формирующие ковалентные связи с нуклеофильными структурами клеток
(белками, сульфгидрильными группами, нуклеиновыми кислотами и т.д),
активирующие перекисное окисление липидов биологических мембран (рисунок 2). В
итоге инициируется мутагенное, канцерогенное, цитотоксическое действие
токсикантов.

Аналогично ареноксидам на клетки действуют N-оксиды, нитрозамины,
гидроксиламины, также являющиеся канцерогенами и мутагенами. В опытах на
собаках установлена прямая зависимость между канцерогенной активностью (рак
мочевого пузыря) и концентрацией в моче продуктов N-окисления веществ в ряду:
1-нафтиламин, 2-нафтиламин, 4-аминодифенил. По такому же механизму действуют на
организм галогенированный бензол, нафтанол и многие другие ксенобиотики.
Процесс образования токсичных продуктов метаболизма называется
"токсификация", а продукты биотрансформации, обладающие высокой
токсичностью - токсичными метаболитами. Во многих случаях токсичный метаболит
является не стабильным продуктом, подвергающимся дальнейшим превращениям. В
этом случае он также называется промежуточным или реактивным метаболитом.
Реактивные метаболиты это как раз те вещества, которые часто и вызывают повреждение
биосистем на молекулярном уровне. Общим свойством практически всех реактивных
метаболитов является их электродефицитное состояние, т.е. высокая
электрофильность. Эти вещества вступают во взаимодействие с богатыми
электронами (нуклеофильными) молекулами, повреждая их. К числу последних
относятся макромолекулы клеток, в структуру которых входят в большом количестве
атомы кислорода, азота, серы. Это, прежде всего, белки и нуклеиновые кислоты.
Реактивные метаболиты либо присоединяются к нуклеофильным молекулам, образуя с
ними ковалентные связи, либо вызывают их окисление. В обоих случаях структура
макромолекул нарушается, следовательно, нарушаются и их функции.
Биоактивация далеко не всегда сопровождается повреждением биосубстрата,
поскольку одновременно в организме протекают процессы детоксикации и репарации.
Интенсивность этих процессов может быть достаточной для компенсации ущерба,
связанного с образованием реактивных метаболитов. Тем не менее при введении
высоких доз токсиканта, повторном воздействии защитные механизмы могут
оказаться несостоятельными, что и приведет к развитию токсического процесса.
Концепция l и ll фазы метаболизма ксенобиотиков
l фаза метаболизма в широком смысле может быть определена, как этап
биотрансформации, в ходе которого к молекуле соединения либо присоединяются
полярные функциональные группы, либо осуществляется экспрессия таких групп,
находящихся в субстрате в скрытой форме. Это достигается либо путем окисления
или (значительно реже) восстановления молекул с помощью оксидо-редуктаз, либо
путем их гидролиза эстеразами и амидазами.
Фаза ll - этап биологической конъюгации промежуточных продуктов
метаболизма с эндогенными молекулами, такими как глутатион, глюкуроновая
кислота, сульфат и т.д. Специфические системы транспорта конъюгированных
дериватов обеспечивают их выведение из организма. В ходе биопревращений
липофильный и, следовательно, трудновыводимый ксенобиотик становиться
гидрофильным продуктом, что обусловливает возможность его быстрой экскреции.
Классическим примером биотрансформации ксенобиотиков является метаболизм
бензола в организме (рисунок 2)
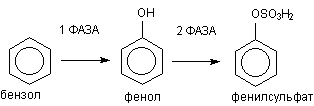
Рисунок 2. Метаболизм бензола
В ходе l фазы метаболизма обеспечивается превращение жирорастворимого
субстрата в полярный продукт путем включения в молекулу гидроксильной группы. В
ходе ll фазы образовавшийся фенол взаимодействует с эндогенным сульфатом, в
результате полярность образующегося продукта еще более возрастает. Фенилсульфат
прекрасно растворяется в воде и легко выделяется из организма.
Локализация процессов биотрансформации
Основным органом метаболизма ксенобиотиков в организме человека и
млекопитающих является печень, главным образом благодаря разнообразию и высокой
активности здесь ферментов биотрансформации. Кроме того, портальная система
обеспечивает прохождение всех веществ, поступивших в желудочно-кишечный тракт,
именно через печень, до того, как они проникнут в общий кровоток. Это также
определяет функциональное предназначение органа. Тончайшая сеть печеночных
капилляров, огромная площадь контакта между кровью и поверхностью гепатоцитов,
обеспечивающаяся микроворсинками базальной поверхности печеночных клеток,
обусловливают высокую эффективность печеночной элиминации токсиканта на
клеточном уровне.
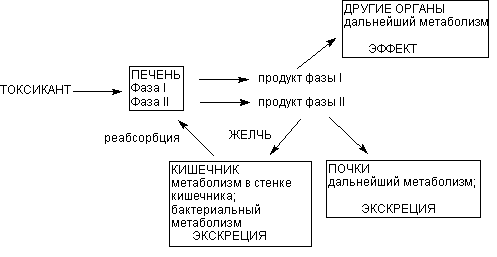
Рисунок 3. Локализация этапов метаболических превращений ксенобиотиков в
организме
Продукты l фазы метаболизма поступают в общий кровоток и могут оказывать
действие на органы и системы. Печень выбрасывает в кровь и продукты ll фазы
метаболизма. Из крови продукты превращения могут захватываться почками,
легкими, другими органами, повторно печенью для экскреции с желчью. С желчью
метаболиты поступают в кишечник, где частично реабсорбируются и повторно
поступать в печень (цикл печеночной рециркуляции).
Несмотря на доминирующую роль печени в метаболизме ксенобиотиков, другие
органы также принимают участие в этом процессе. Почки и легкие содержат энзимы
и l и ll фаз метаболизма. Особенно велика роль почек, поскольку в этом органе
имеется специфическая система захвата и катаболизма продуктов конъюгации,
образующихся в печени. Активность других органов, таких как кишечник,
селезенка, мышечная ткань, плацента, мозг, кровь - значительно ниже, однако
наличие энзимов, катализирующих процессы биотрансформации, при отравлении
токсифицирующимися ксенобиотиками, имеет ключевое значение в развитии
патологических процессов в этих органах. В процессе внепеченочного метаболизма
могут образовываться продукты, как аналогичные продуктам печеночного
происхождения, так и отличные от них. Иногда в ходе внепеченочного метаболизма
может осуществляться активация метаболитов, образующихся в печени.
Энзимы, участвующие в метаболизме ксенобиотиков, локализованы в основном
внутриклеточно. Небольшое их количество определяется в растворимой фракции
циотозоля, митохондриях, большинство же связаны с гладким эндоплазматическим
ретикулумом. Методом ультрацентрфугирования гладкий эндоплазматический
ретикулум выделяется из исследуемых клеток в виде фрагментов мембранных
структур, называемых микросомами. Поэтому основная группа ферментов,
участвующих в метаболизме ксенобиотиков, получила название "микросомальные
энзимы".
Первая фаза метаболизма
Разнообразие чужеродных химических веществ, способных подвергаться в
организме метаболическим превращениям, является следствием многообразия
энзимов, участвующих в l фазе биотрансформации и их низкой субстратной
специфичности. Многие из энзимов существуют в нескольких формах (изоферменты),
различающихся по своим физико-химическим свойствам (молекулярная масса,
электрофоретическая подвижность, абсорбцией света с разними длинами волн),
отношению к индукторам и ингибиторам (см. ниже) и активностью в отношении
субстратов различного строения.
Энзимы рассматриваемой группы, цитохромР-450 зависимые оксидазы (Р-450),
как правило, обладают низкой субстратной специфичностью, вызывая превращения
веществ самого разного строения, и потому часто называются оксидазами смешенной
функции (ОСФ). Р-450 относятся к группе гемопротеинов типа цитохромов b -
пигментов, активно связывающих монооксид углерода. Название
"цитохромР-450" энзимы получили в силу того, что максимум поглощения
света пигментом, связанным с СО, осуществляется при длине волны 450 нм.
Р-450 представляют собой семейство энзимов, локализующихся в эндоплазматическом
ретикулуме, которые могут быть разделены с помощью иммунологических и иных
методов на несколько подсемейств. Отдельные ткани содержат несколько различных
изоформ Р-450. Встречаются тканеспецифичные формы энзимов. Изоферменты Р-450
часто проявляют перекрестную субстратную специфичность, таким образом, как
правило, более чем один изофермент принимает участие в метаболизме
ксенобиотика. Наличие специфических форм энзимов обусловлено генетическими
механизмами, а повышение содержания в тканях различных изоферментов
индуцируется действием на организм различных ксенобиотиков: лекарств, ядов,
экотоксикантов. Р-450 подвержены не только активации, но и инактивации, как
исходными ксенобиотиками, так и их реактивными метаболитами.
Реакции микросомального окисления, протекающие при участии Р-450, как
правило, зависят от содержания O2 и НАДФН в среде. Молекулярный
кислород активируется цитохромомР-450 (или другими цитохормами, например,
Р-448). Активация осуществляется с помощью НАДФН при участии флавин-содержащего
энзима НАДФН-цитохромР-450 редуктазы. Поскольку донором электронов в
превращениях субстратов, катализируемых этими энзимами, является НАДФН.
ЦитохромР-450, НАДФН-цитохромР-450 редуктаза и фосфолипиды биологических
мембран, в которые встроены оба энзима, образуют микросомальный
монооксигеназный комплекс. Несмотря на то, что энзимы комплекса связаны с
биологическими мембранами, их свойства могут быть изучены in vitro.
Установлены основные закономерности протекания ферментативных процессов с
участием микросомального монооксигеназного комплекса (рисунок 5).

Рисунок 5. Упрощенная схема превращения субстрата при участии Р 450
Как видно из рисунка на начальном этапе ксенобиотик (S) вступает во
взаимодействие с окисленной формой цитохромаР-450. Затем к этому комплексу с
помощью НАДФН-зависимой цитохромР-450 редуктазы присоединяется электрон,
донором которого является восстановленный НАДФН. После этого комплекс
взаимодействует с кислородом. После взаимодействия со вторым электроном (донор
- НАДФН) происходит активация связанного с цитохромом кислорода, который
приобретает способность связывать протоны и образовывать воду. Образовавшаяся
при этом форма цитохромаР-450 гидроксилирует субстрат.
Метаболизируемое вещество не связывается непосредственно с геминовой
группой цитохромаР-450. Оно присоединяется к белковой части цитохрома. Процесс
превращения ксенобиотиков чувствителен к СО, поскольку это вещество вытесняет
кислород из связи с железом геминовой группы цитохромаР-450. Некоторые оксидазы
резистентны к СО (образование N-оксидов). Поскольку Р-450 - гемопротеины, их
активность отчасти регулируется процессами синтеза гема, т.е. связана с
метаболизмом железа. Нарушение метаболизма, голодание, понижение соотношения
НАДФН/НАДФ+ могут приводить к снижению активности Р-450.
Реакции, катализируемые цитохромомР-450.
Окисление ксенобиотиков при участии Р-450 - основной механизм их
биотрансформации в l фазе метаболизма. Р-450 катализирует окисление практически
всех классов органических молекул. Субстратом для энзимов являются и простые
молекулы типа хлороформа и стероиды и сложные гетероциклические соединения,
например антибиотик циклоспорин. Р-450 могут катализировать не только
окисление, но и восстановление некоторых биосубстратов, например
четыреххлористого углерода, галотана, некоторых других галогенированных
углеводородов с образованием свободных радикалов. Такое необычное превращение
реализуется в условия пониженного парциального давления кислорода в тканях.
Эпоксидирование и гидроксилирование ароматических соединений
Метаболизм полициклических и ароматических углеводородов сопровождается
образованием реакционно-способных промежуточных продуктов метаболизма, в
частности ареноксидов, способных вызывать некроз клеток и являющихся канцерогенами.
биотрансформация
ксенобиотик микроорганизм
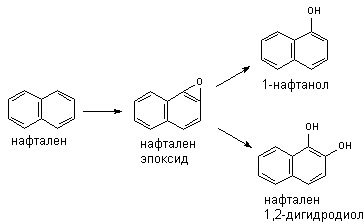
Эпоксид, возникающий в процессе метаболизма, может подвергаться
неэнзиматическому гидролизу с образованием нафтанола, либо, взаимодействуя с
эпоксидгидролазой, превращаться в дигидродиол, а также образовывать конъюгаты с
глутатионом, которые выделяются из организма в виде производных меркаптуровой
кислоты.
Эпоксидирование алифатических и алициклических соединений.
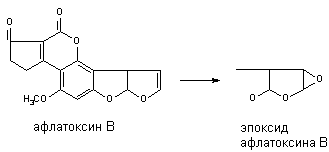
Многие алифитические и алициклические соединения, содержащие в молекуле
непредельные связи метаболизируют с образованием чрезвычайно стабильных
эпоксидов (превращение алдрина в диалдрин). Это же превращение лежит в основе
образования канцерогенных продуктов метаболизма афлатоксинов:окисление.
Превращению могут подвергаться такие вещества, как анилин и его
производные, ацетаминофлюорен и др. В результате окисления атома азота могут
образовываться гидроксиламины, оксимы и N-оксиды
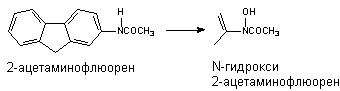
Оксимы образуются в процессе гидроксилирования иминов или первичных
аминов

Десульфурирование и расщепление эфиров
Фосфоротиоаты (1) и фосфородитиоаты (2), являющиеся представителями
большой группы инсектицидов, приобретают способность угнетать активность
ацетилхолинэстеразы (за счет этого реализуется их биологическая активность) в
результате ферментативного преобразования соединений
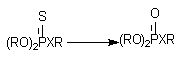
Х = О (1); Х = S(2)
Процесс разрушения эфирных связей при атоме фосфора ФОС также во многом
обусловлен действием Р-450, хотя процесс может идти и при участии
гидролитических энзимов.
Оксилительное деалкилирование
Классическим примером превращения данного типа является О деалкилирование
р-нитроанизола. Поскольку продукт превращения легко определяется, реакцию
нередко используют для оценки активности Р-450.
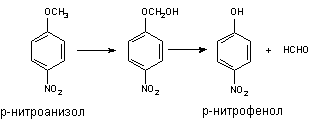
При участии цитохромаР-450 и других монооксигеназ происходит окисление
тиоэфирных связей, в молекулах таких ксенобиотиков как хлорпромазин, альдикарб,
метиокарб и др. Этот вид превращения характерен также для метаболизма
сернистого иприта
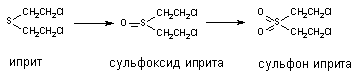
Установлено, что при этом токсичность вещества возрастает (сульфон иприта
токсичнее исходного вещества).
Дегидрогеназы
Помимо микросом, энзимы, участвующие в окислении ксенобиотиков,
выявляются также в митохондриях и растворимой фазе цитозоля. Процесс
дегидрирования ксенобиотиков проходит в организме чаще в форме
гидроксилирования. Среди прочих веществ такому превращению подвергаются
многочисленные спирты и альдегиды при участии алкоголь- и альдегиддегидрогеназ.
Благодаря высокой активности этих энзимов, печень - основной орган метаболизма
спиртов. Энзимы идентифицированы также в почках и легких. НАД-зависимая
алкогольдегидрогеназа печени обладает невысокой субстратной специфичностью.
Так, под влиянием этого энзима метаболизируют не только первичные и вторичные
алифатические спирты, но и ароматические спирты, а также такие соединения, как
р-нитробензиловый спирт и т.д. В результате окисления образуются
соответствующие альдегиды:
Восстановление
В тканях человека и других млекопитающих содержатся ферменты,
восстанавливающие молекулы некоторых ксенобиотиков. К их числу относятся, в
частности, нитрозоредуктазы (превращают группы NO2- в NH2-),
нитроредуктазы (восстанавливают нитраты до нитритов), азоредуктазы (активируют
восстановительное расщепление азогрупп с образованием первичных аминогрупп),
дегалогеназы (контролируют восстановительное дегалогенирование таких веществ
как гексахлоран, ДДТ и др.).
Вторая фаза метаболизма. Конъюгация
Превращение молекул в первой фазе биотрансформации усиливает их
полярность, уменьшает способность растворяться в липидах. Уже только благодаря
этому целый ряд чужеродных соединений лучше выделяется с мочой. Эффект еще
более усиливается, когда к образовавшимся в ходе 1 фазы метаболизма продуктам
присоединяются такие эндогенные вещества, как ацетат, сульфат, глюкуроновая
кислота, глутатион и т.д. Как и энзимы l фазы метаболизма ксенобиотиков, энзимы
ll фазы обладают слабой субстратной специфичностью и участвуют в превращениях
большой группы химических веществ.
Ацетилирование
Аминогруппы ароматических соединений часто подвергаются ацетилированию.
Уксусная кислота переносится на аминогруппу в форме ацетил-КоА с помощью
соответствующих трансфераз, в частности - ацетил-КоА:амин-N-ацетилтрансферазы. Ацетилированию
могут подвергаться ариламингруппы, сульфамидные группы, алифатические амины,
группы гидразина. У людей выражены генетически обусловленные различия в
способности к реакции N-ацетилирования. Замедленное ацетилирование отмечается у
гомозиготных по рецессивному аллелю индивидов. Высокая активность
ацетилирования отмечается у гетерозиготных индивидов или людей, гомозиготных по
доминантному аллелю.
Конъюгация с глюкуроновой кислотой.
Глюкуроновая кислота имеет большое значение в механизме биотрансформации
ксенобиотиков.

Рисунок 6. Глюкуроновая кислота
Она активно присоединяется к молекулам алифатических и ароматических
спиртов, органических кислот, серосодаржащих соединений. Процесс конъюгации
приводит к образованию эфиров глюкуроновой кислоты - глюкуронидов. В реакцию
конъюгации глюкуроновая кислота вступает в активной форме
уридиндифосфоглюкуроновой кислоты (УДФГК) и переносится на молекулу-акцептор с
помощью соответствующей трансферазы: УДФ-глюкуронозилтрансферазы (УДФ-ГТ).
Энзим идентифицирован в микросомальной фракции клеток печени, почек, других
органов. УДФГК образуется в процессе взаимодействия глюкозо-1-фосфата с
уридинтрифосфорной кислотой (УТФ) в растворимой фракции цитозоля клеток. УДФ-ГТ
индуцируется при поступлении в организм таких веществ, как фенобарбитал, ПАУ,
диоксины, полигалогенированные бифенилы. С помощью конъюгации с глюкуроновой
кислотой метаболизируют и некоторые эндогенные вещества, например стероиды и
билирубин.
В кишечнике под влиянием глюкуронидазы, энзима кишечной микрофлоры,
глюкурониды могут расщепляться с образованием веществ, способных к реабсорбции
и обратному поступлению в кровь (явление кишечно-печеночной циркуляции
ксенобиотика).
Факторы, влияющие на биотрансформацию ксенобиотиков
Чужеродные соединения, обычно метаболизируются несколькими различными
путями, образуя множество метаболитов. Скорость, с которой протекает каждая из
этих реакций и их относительная важность зависят от многих факторов в
результате чего происходят изменения в картине метаболизма и возникают различия
в токсичности. Эти факторы по своему происхождению могут быть генетическими,
физиологическими или связанными с условиями окружающей среды.
К генетическим факторам относятся видовые различия и различия внутри
одного вида.
К физиологическим факторам, которые влияют на метаболизм, относятся
возраст, пол, состояние питания, заболевания и т. д. К факторам окружающей
среды можно отнести стресс из-за неблагоприятных условий, облучение
ионизирующий радиацией, свет , ОВП и т. д., наличие других ксенобиотиков, а
также большое влияние на процессы (скорость) метаболизации природа (структура)
самих ксенобиотиков.
Биодоступность ксенобиотиков
Результат воздействия ксенобиотика на живой организм определяется
свойствами ксенобиотика, организма, биоценоза и биотопа и обусловлен
биодоступностью соединения. Под биодоступностью понимают способность различных
соединений подвергаться биотрансформации. Биодоступность определяется
генетическими свойствами организмов, осуществляющих трансформацию поступающих в
организм веществ, условиями окружающей среды, влияющими на скорость переноса
соединений в организмы и клетки, токсичностью соединений для организма-мишени и
их концетрации в окружающей среде. В зависимости от времени полураспада
химические соединения классифицируют на легко доступные (от 1 до 7 сут),
умеренно доступные (от 7 сут до 4 недель), трудно доступные (от6 мес до 1
года).
Ключевой фактор в биодоступности ксенобиотика - его способность вступать
в реакции подготовительного и центрального метаболизма, которая в свою очередь
определяется свойствами ксенобиотика и зависит от особенностей организма.
Выявлен ряд закономерностей биохимической доступности многих ксенобиотиков в
зависимости от их химической структуры. Так наблюдается тенденция, чем сложнее
молекула ксенобиотика, тем менее доступна для биодеградации, тем меньше
микроорганизмов способно к ее утилизации. Например, скорость биодеградации
насыщенных соединений, как правило, выше скорости биодеградации ненасыщенных; алифатических
углеводородов выше, чем с разветвленной.
Микроорганизмы-деструкторы
Ведущая роль в трансформации и минерализации органичсеких ксенобиотиков
принадлежит хемоорганотрофным микроорганизмам. Важным аспектом улучшения
экологического состояния окружающей среды является поиск
микроорганизмов-деструкторов различных органических загрязнителей внешней
среды, в т.ч. и почвы.
Нефтедеструкторы
Одной из серьезных проблем защиты природной среды при нефтегазодобыче
является ликвидация нефтяного загрязнения почвы. Нефть и нефтепродукты нарушают
экологическое состояние почвенных покровов и в целом деформируют структуру
биоценозом. Почва, обладающая огромной адсорбирующей способностью, аккумулирует
в себе большую часть нефтяных загрязнений, изменяются ее физические,
агрохимические и микробиологические характеристики. В результате утрачивается
сельскохозяйственное значение угодий. В связи с этим необходимы экологически
безопасные и экономически обоснованные методы, направленные на интенсификацию
процессов биоразложения углеводородов и восстановление плодородия
сельскохозяйственных земель.
Биологический препарат «АМИР» представляет собой сферические гранулы
пористого стеклофосфатного носителя, диаметром 3-6 мм, и клеток микроорганизмов
- деструкторов углеводородов, иммобилизованных в поры носителя. В одном грамме
биопрепарата содержится не менее 109 жизнеспособных спор. Препарат
обладает высокой окисляющей активностью в отношении углеводородов нефти и
нефтепродуктов, переводит их в экологически нейтральные соединения.
Способствует рекультивации среды обитания и восстановлению разрушенных
экологических связей в биоценозе. Объектами применения могут быть загрязненные
нефтепродуктами почвы и водоемы, промстоки предприятий и техногенно -
разрушенные территории, при рН среды 4,5-8,2 и температуре 30-400С.
Химический состав метафосфатов включает калий, магний, кальций и
микроэлементы, которые обеспечивают в течение не менее 18 месяцев оптимальные
условия для жизнедеятельности микроорганизмов. В качестве физиологически активных
микроорганизмов используется комбинация из следующих, ниже перечисленных:
. Протеолитические и амилолитические микроорганизмы Pseudomonas,
Bacillus, Micrococcus, Spirillum.
. Актиномицеты. Streptomyces, Streptoverticillium, Actinomadura,
Nocardiopsis.
. Азотофиксирующие бактерии. Azotobacter, Aerobacter, Achromobacter.
. Целлюлозоразлагающие и гумусоразлагающие микроорганизмы. Trichoderma,
Rhizoctonia, Cytophaga, Sporangium, Cellovibrio.
. Денитрификаторы. Aerobacter, Micrococcus.
Технология применения и нормы расхода
До проведения очистки с помощью биопрепарата проводится
системно-организованный мониторинг объекта, анализ степени загрязнения,
биотесты активности почв/ водных акваторий. Составляется регламент необходимого
комплекса работ, подбираются ассоциация штаммов микроорганизмов-деструкторов,
оптимальная для применения на объекте.
Микроорганизмы-деструкторы ПХБ
Проведен поиск на загрязненных территориях микроорганизмов, способных
разлагать в почве ПХБ. Выделены из почв и охарактеризованы 18 штаммов
микроорганизмов-деструкторов ПХБ.
Наиболее эффективными оказались штаммы деструкторов ПХБ бактерий
Alcaligenes latus ТХД-13 и дрожжей Hansemila californica AT. Они депонированы
во Всероссийской Коллекции Промышленных Микроорганизмов под номерами В - 7505,
Y- 2284. На них получены две международные патентные заявки по системе РСТ и
оформляются два патента Российской Федерации. В полевых опытах установлено, что
степень деструкции ПХБ микроорганизмами в почве in situ составила для
Alealigenus latus ТХД-13 от 52 % до 78 %, для Hansenula californica AT от 60 %
до 90 %.
Токсикологические испытания бактерий Alcaligenes latus ТХД-13 и дрожжей
Hansenula californica AT показана их безопасность для теплокровных животных по
показателям вирулентности, токсичности, токсигенности и диссеминации во
внутренних органах белых мышей.
Эти микроорганизмы пригодны для использования при биоремедиации почв in
situ.
Интродукция штаммов бактерий Alcaligenes latus ТХД-13 и дрожжей Hansenula
californica AT в почву не оказывает существенного влияния на численность
почвенной микрофлоры. В течение трех месяцев их численность неуклонно снижается
с 106 до 104 КОЕ/г почвы для Alealigenus latus ТХД-13 и для Hansenula
californica AT с 105 до 103 КОЕ/г почвы, достигая минимального уровня к концу 3
месяца.
Оптимальная концентрация суспензии микроорганизмов,вносимых в почву,
загрязненную полихлорированными бифенилами, роставляет: для Alcaligenus latus
ТХД-13 - 107 кл./мл, для Hansenula californica AT - 106 кл./мл. Норма расхода
микробной суспензии составила 1 л/м2 почвы. При температуре воздуха 20-30°С и
влажности почвы 60-80% достигается максимальная степень деструкции ПХБ в почве.
Оценена интегральная токсичность почвы, до и после проведения полевого
эксперимента методом биотестирования и показано снижение интегральной
токсичности почвы в процессе биоремедиации. Для почв, обработанных Alcaligenus
latus ТХД-13, интегральная токсичность снизилась в течение трех месяцев со 100
до 69 %, для Hansenula californica AT со 100 до70%. Токсикологическая оценка
рекультивированной почвы, проведенная на белых крысах, показала отсутствие
выраженных патологических изменений в органах и крови лабораторных животных.
Галотолерантные бактерии-деструкторы полициклических ароматических
углеводородов
Из почв и донных отложений района солеразработок выделены чистые культуры
и сообщества микроорганизмов, способные использовать нафталин и фенантрен в
качестве единственного источника углерода и энергии. Среди десяти подробно
охарактеризованных штаммов-деструкторов нафталина, отнесенных к родам
Rhodococcus, Arthrobacter (вид A. globiformis и A. nicotianae), Bacillus и
Pseudomonas, шесть штаммов способны к росту на фенантрене, три штамма - на
бифениле и два штамма - на феноле.
Выделенные штаммы-деструкторы полициклических ароматических углеводородов
являются галотолерантными микроорганизмами. Показана способность штамма
Pseudomonas putida SN11 к росту на нафталине при концентрации NaCl до 1 М и
штамма Arthrobacter globiformis SF27 - к росту на фенантрене при концентрации
NaCl до 0.7 М.
Установлено, что разложение нафталина штаммом Pseudomonas putida SN11
происходит через салицилат и катехол, а фенантрена - через 1-гидрокси-2-нафтоат
и салицилат. Штамм Arthrobacter globiformis SF27 осуществляет деструкцию
нафталина через салицилат, с последующим его расщеплением через гентизат или
катехол; утилизация фенантрена происходит через 2-карбоксибензальдегид и
орто-фталат.
У исследованных бактерий обнаружены плазмиды с молекулярными массами от
85 тпн до 120 тпн. Плазмиды из штаммов рода Pseudomonas являются конъюгативными
и содержат гены деградации нафталина, салицилата. У штамма Arthrobacter
globiformis SF27 гены, участвующие в деструкции фенантрена и нафталина, также
локализованы на плазмиде.
Установлено, что трансконъюгантные штаммы, полученные при переносе
плазмиды из галотолерантного штамма Pseudomonas putida SN11 в штамм 116
P.putida BS394 (cys~ nah~ sal'), приобретают способность к росту на нафталине
при концентрации NaCl до 0.7 М.
Изолировано сообщество микроорганизмов, способное к росту на нафталине
при концентрациях хлорида натрия до 2.5 М. Установлено, что данное сообщество
состоит как минимум из трех галотолерантных грамположительных
бактерий-деструкторов ПАУ и галофильного грамотрицательного штамма, не способного
к утилизации полициклических ароматических углеводородов.
Микроорганизмы-деструкторы
химических загрязнений в условиях смешанного загрязнения осадков и почв
Отходы, формирующиеся в процессах добычи нефти, её переработки,
нефтехимии и производства взрывчатых веществ, представляют угрозу в связи со
специфическим загрязнением окружающей среды. Ряд компонентов нефтешламов,
отходов военных предприятий отнесен агентствами по защите окружающей среды к
высокотоксичным и потенциально мутагенным веществам. С точки зрения общих
представлений о судьбе неприродных соединений представитель нитроарилов
2,4,6-тринитротолуол (ТНТ) следует отнести к ксенобиотикам, наиболее устойчивым
и трудно вовлекаемым в природные биогеохимические циклы. Биотрансформация ТНТ
путем восстановления нитрогрупп реализуется большей частью организмов
различного систематического положения (метаболиты этого пути обнаруживаются у
беспозвоночных, микроорганизмов, в организме человека, в растениях, поэтому
данный путь является основным. Альтернативный путь биотрансформации ТНТ связан
с восстановлением ароматического кольца путем присоединения гидрид - иона с
образованием гидридного комплекса Мейзенхеймера (КМ). В результате реализации
альтернативного пути трансформации ТНТ образуется метаболит (КМ), менее
токсичный, чем исходное вещество (ТНТ). Данный путь позволяет избежать
повышения острой летальной токсичности на первом этапе трансформации ТНТ.
Комбинированное загрязнение нефтешламами и 2,4,6-тринитротолуолом вело к
снижению численности большей части грамположительных бактерий, микромицетов,
дрожжей и повышению количества бактериальных спор и грамотрицательных в
загрязнённой почве. Культивирование выделенных из нефтешламов микроорганизмов в
присутствии ТНТ изменяло первоначальную популяционную структуру от
доминирования грамположительных бактерий к доминированию грамотрицательных.
В данной работе была создана коллекция микроорганизмов, выделенных из
твёрдых отходов нефтехимического производства при селективном воздействии ТНТ.
Наряду с устойчивостью и метаболической активностью по отношению к ТНТ и
полициклическим ароматическим углеводородам, все выделенные штаммы обладали
резистентностью к осмотическому и токсическому стрессам, вызванным солями
тяжелых металлов. Как и в случае с органическими ксенобиотиками, наиболее
толерантными к данным стрессам оказались грамотрицательные бактерии. Такие
комплексные загрязнители окружающей среды как нефтяные углеводороды и
взрывчатые вещества не редки. В связи с этим выделенный из торфяных болот
(Лангепас, Западная Сибирь, Россия) штамм Candida sp. AN-L13 заслуживает
особого внимания. Помимо его способности осуществлять начальную конверсию
ароматического кольца ТНТ с образованием комплекса Мейзенхеймера и отщеплять
нитриты из исходного ксенобиотика, он также способен утилизировать сырую нефть
и ряд индивидуальных алифатических и ароматических углеводородов.
Этот штамм, также как и другие микроорганизмы со схожими метаболическими
способностями, интересен не только для научного исследования, но он также
обладает большим потенциалом для биоремедиации территорий с комплексными
загрязнениями.
Заключение
Актуальность проблем, рассматриваемых в ксенобиологии все возрастает. Это
обусловлено тем, что ежегодно на Земле синтезируются десятки тысяч новых
соединений. Ряд из них вовлекаются в круговорот веществ в природе. Чем шире
масштабы производства химических соединений, тем больше влияние они оказывают
на биологические процессы в почве, водоемах и на суше, тем сильнее проявляются
побочные и отдаленные последствия их действия на живые системы.
Воздействие ксенобиотиков на живой мир, и на человека в частности
происходит, в самых различных комбинациях этих соединений не только друг с
другом, но и с фактором окружающей среды. Поэтому многие из ксенобиотиков,
вошедших в сегодняшнюю практику могут являться носителями опасного
биологического действия.
Поэтому небходимо создавать вещества или выводить микроорганизмы, которые
бы способствовали деградации ксенобиотиков не причиняя отрицательных действий
всему живому миру. Одними из них являются микроорганизмы-деструкторы, способные
очистки окружающей среды от различных загрязнений.
Список использованных источников
1. Кузнецов
А.Е., Градова Н.Б. «Научные основы экобиотехнологии» Москва «Мир» 2006
2. Юрин
В.М. «Основы ксенобиологии» Минск БГУ 2001
. Куценко
С. А. «Основы токсикологии» Санкт-Петербург, 2002